Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Наглядно о ненаглядном» конкурса «Био/Мол/Текст»-2020/2021.
Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.
Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — : крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Профилактика фурункулеза
Способы предотвращения заболевания включают:
- поддержание чистоты кожи путем регулярного мытья;
- немедленной дезинфекции всех кожных ран, порезов и ссадин, даже самых маленьких;
- накладывания стерильной повязки на любые порезы, чтобы предотвратить заражение.
Соблюдение здоровой, сбалансированной диеты и регулярные физические упражнения улучшат общее состояние здоровья и иммунную систему, снизив риск развития не только фурункулеза, но и всех болезней в целом.
Своевременное обращение к врачу поможет сохранить Ваше здоровье. Не откладывайте лечение, звоните прямо сейчас. Мы работаем круглосуточно.
тел. (круглосуточно)
Немного о VR
В видео есть часть, где представлена VR-работа. Чтобы лучше понять, что где находится — прочитайте, пожалуйста, описание ниже:
- Для удобства рассмотрения внутренних процессов, происходящих в бактериальной клетке, клеточная стенка и цитоплазматическая мембрана сделаны прозрачными.
- В цикле репродукции вируса рассматривается один вид бактериофага. Это стафилококковый бактериофаг 80α (альфа).
- Процессы репликации, трансляции и транскрипции упрощены, и для лучшего ви́дения этих процессов они немного разнесены в пространстве.
Причины фурункулеза
Бактерии стафилококка, вызывающие инфекцию, обитают на коже, концентрируясь в частях тела, где присутствуют складки (фурункулез на лице, в частности фурункулез носа и фурункулез губы – самые распространенные места проявления болезни). Обычно иммунная система держит их под контролем, однако при ослабленном иммунитете они попадают в кожу через волосяной фолликул, порез или царапину на коже. Спровоцировать фурункулез может обычная травма кожных покровов или их расчесывание. Фурункулы часто являются результатом несоблюдения элементарных норм личной гигиены. Когда кожа заражается, иммунная система реагирует, посылая лейкоциты в пораженный участок, чтобы уничтожить бактерии. Гной – это скопление мертвых бактерий, мертвых лейкоцитов и мертвой кожи.
Следующие условия повышают риск развития фурункулеза кожи:
- Диабет: высокий уровень сахара или глюкозы в крови может снизить способность иммунной системы реагировать на инфекцию.
- Лекарства: некоторые медикаменты ослабляют иммунную систему.
- ВИЧ и другие заболевания, поражающие иммунную систему.
- Кожные заболевания: псориаз, экзема и угри.
- Избыточная масса тела также увеличивает риск.
Сам по себе при контакте фурункулез не заразен, однако при ослабленном иммунитете иногда инфекция может распространяться, когда люди используют одно пространство или материалы, например, одежду и гидромассажные ванны для ног.
Золотистый стафилококк
Стафилококки — грамположительные и не спорообразующие кокки, которые образуют пары, короткие цепочки или гроздья. Род Staphylococcus содержит много видов, которые отделяются друг от друга на основе продукции фермента коагулазы [1].
Золотистый стафилококк (Staphylococcus aureus) — коагулазоположительный вид, является одним из самых вирулентных видов.
Вирулентность (от лат. virulentus — «ядовитый») степень способности инфекционного агента (штамма микроорганизма или вируса) вызывать заболевание или гибель организма.
Золотистый стафилококк — часто безвредный обитатель эпителия кожи и слизистых оболочек человека, но также связан с серьезными системными и местными инфекциями [2] и является одной из наиболее распространенных причин пищевых инфекций во всем мире. S. aureus производит 15 энтеротоксинов.
Энтеротоксины бактериальные токсины, которые вызывают секрецию жидкости из клеток кишечника.
Борьба с золотистым стафилококком
Борьба с бактериями велась издавна. Люди пробовали лечить раны растениями. И методом проб и ошибок подбирали нужные противомикробные лекарства [3].
Однако настоящая борьба с бактериями началась после открытия Александром Флемингом пенициллина в 1928 году. А уже в 1929 году вышла статья Флеминга в British Journal of Experimental Pathology. Хотя до Флеминга пенициллин «открывали» уже несколько раз, но ученые того времени всего лишь писали доклады, делали заметки, но не публиковали результаты в научных журналах [4]. Открытый гриб убивал стафило- и стрептококков и даже дифтерийную палочку [5].
Уже в 1940 году появились первые сведения об устойчивости бактерий к пенициллину.
Симптомы фурункулеза
Фурункулы представляют собой красные, опухшие и болезненные узелки разного размера. Чем больше они становятся, тем болезненнее ощущение. Окружающая кожа обычно красная и воспаленная. Узелки быстро наполняются гноем и на последней стадии фурункулеза могут лопнуть. Если инфицировано несколько соседних фолликулов, они могут срастаться и образовывать более крупный узел, называемый карбункулом. Карбункул – это совокупность фурункулов.
Лихорадка и увеличение лимфатических узлов при заболевании фурункулезом возникают редко, однако возможны.
Фурункулы и карбункулы обычно поражают бедра, подмышки, ягодицы, лицо и шею. Они возникают в местах, подверженных образованию волос, поту и трению.
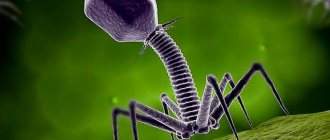
Бактериофаг
В 1919 году, еще до обнаружения пенициллина, Феликс Д’Эрелль открыл совершенно другой метод борьбы с бактериями. Но потом он так и не смог конкурировать с антибиотиками. Речь идет о бактериофаговой терапии.
Бактериофаги (фаги) — это вирусы, которые используют для размножения только прокариотические клетки. Эти вирусы встречаются в природе повсеместно [6]. S. aureus был одним из первых организмов, использованных для демонстрации существования бактериофага [2].
В 1920–1940-е годы проводили множество исследований по клиническому применению бактериофагов, но стабильных результатов получено не было. На Западе от бактериофаговой терапии начали отказываться [7].
Борьба золотистого стафилококка и бактериофага
Сейчас фаговые препараты представляют собой смеси нескольких бактериофагов. Мы остановимся на одном из стафилококковых фагов.
Фаг 80α — умеренный бактериофаг лямбда семейства Siphoviridae с геномом в виде двухцепочечной ДНК. 80α способен к генерализованной трансдукции, а также может выступать в качестве помощника для мобилизации островков патогенности SaPI [2], которые, как было показано, кодируют такие факторы вирулентности, как токсины синдрома токсического шока и коагулаза [1].
Как и у других бактериофагов, капсид 80α собирается в виде пустого предшественника — прокапсида. Горсти фаговой ДНК упаковываются в прокапсиды через портальную вершину в АТФ-зависимом процессе, который требует малых и больших субъединиц фермента терминазы. Упаковка ДНК сопровождается расширением капсида и структурной перестройкой оболочки.
Для бактериофаговой терапии рекомендуется использовать те бактериофаги, которые идут по литическому пути развития (с разрывом клетки).
Бактериофаговые препараты
Сейчас с развитием современных методов генной инженерии и молекулярной биологии бактериофаговая терапия оживает в новых исследованиях. И на данный момент бактериофаговая терапия применяется очень осторожно и строго контролируемо, во избежание повторения истории с антибиотиками.
Однако не везде соблюдаются такие строгие стандарты. В Западной Европе после открытия антибиотиков от использования бактериофагов довольно быстро отказались. В Восточной Европе, несмотря на отсутствие крупных и контролируемых клинических испытаний, они оставались относительно популярным лечением в XX веке [8].
В СССР продолжали изучение бактериофагов. Это привело к тому, что в странах постсоветского пространства накопилась большая их коллекция. Сейчас, когда западные страны только начинают присматриваться к бактериофаговой терапии для лечения золотистого стафилококка и выписывают их заболевшему человеку в редких случаях под строгим наблюдением врача [9], в России бактериофаги в качестве лекарственного препарата используют довольно активно. И могут выписывать такие препараты «с легкой руки» при том, что их эффективность не доказана [10–16]: большинство российских исследований бактериофагов ограничено 30–40 участниками — такие исследования не являются доказательными. К сожалению, такое халатное использование препаратов может привести к увеличению случаев резистентности бактерий.
Очень важно относиться к бактериофагам с особой осторожностью. Иначе в скором времени мы увидим новость «Бактерии резистентны к бактериофаговой терапии».
Возможности использования бактериофагов в лечении инфекционных заболеваний лор-органов у детей
НИКИФОРОВА Г.Н
., д.м.н., проф,
ПШОНКИНА Д.М
.
Кафедра болезней уха, горла и носа ГБОУ ВПО Первый МГМУ им. И.М. Сеченова МЗ РФ, МоскваМенее чем столетняя история применения антибактериальных препаратов в лечении инфекционно-воспалительных заболеваний продемонстрировала широкие возможности адаптации многих штаммов микроорганизмов к токсическому действию данных лекарственных средств. За последние десятилетия значительно выросла резистентность инфекционных агентов к противомикробным препаратам, широко использующимся в оториноларингологии. В детском возрасте частота заболеваний ЛОР-органов выше, чем у взрослых, в то же время вирусные заболевания у детей нередко осложняются развитием бактериальных процессов, что обусловливает поиск новых методов этиотропной терапии. Анализ приведенной литературы показывает обоснованность применения фаготерапии в лечении заболеваний ЛОР-органов у детей, как местно, так и системно, в том числе в сочетании с традиционной антибактериальной терапией. Преимуществом лечебных бактериофагов является их высокая специфичность к определенным микроорганизмам, хорошая совместимость с другими лекарственными средствами, минимальный риск развития нежелательных явлений и отсутствие аллергических реакций.
В детском возрасте частота инфекционно-воспалительных заболеваний верхних отделов дыхательных путей и уха значительно выше, чем у взрослых, что определяется рядом анатомических особенностей, а также несовершенством иммунной системы организма ребёнка. Значительная распространенность заболеваний ЛОР-органов в детском возрасте часто коррелирует с развитием тяжелых и многочисленных осложнений. Подавляющее большинство инфекционных процессов ЛОР-органов у детей имеют вирусную этиологию, в 25–30% острых заболеваний респираторного тракта выявляются вирусно-бактериальные ассоциации [6]. Не секрет, что вирусные инфекции у детей достаточно часто обусловливают развитие бактериальных процессов в ЛОР-органах – риносинуситов, тонзиллофарингитов, отитов и др. Этиологически значимыми патогенами в большинстве вышеуказанных клинических случаев являются
Streptococcus pneumoniae, Haemophilus influenzae, Streptococcus pyogenes Mycoplasma pneumoniae, Chlamydia pneumoniae, Staphylococcus aureus, Arcanobacterium hаemolyticum, Haemophilus influenzae, Moraxella catarrhalis
и некоторые другие микроорганизмы [4, 5, 13]. Заболевания околоносовых пазух являются наиболее частыми осложнениями респираторных вирусных инфекций, однако и тонзиллофарингиты, и средние отиты имеют не меньшее клиническое значение в связи с высоким риском формирования хронических процессов. Средние отиты в детском возрасте развиваются значительно чаще, чем у взрослых пациентов. Например, к 3-летнему возрасту 83% детей переносят хотя бы один эпизод острого среднего отита, а у 46% диагностируется 3 и более случаев этого заболевания [14].
Адекватная этиотропная терапия бактериальных инфекций ЛОР-органов – актуальная проблема современной клинической медицины. Применение антибактериальных препаратов в лечении инфекционно-воспалительных заболеваний на протяжении многих лет привело к развитию адаптации значительного количества штаммов микроорганизмов к токсическому действию лекарственных средств. Процессу устойчивости возбудителей способствуют и предусмотренные природой условия обмена между бактериями различными генетическими элементами. Так же из факторов, способствующих росту резистентности микроорганизмов, следует отметить бесконтрольное применение антибиотиков, самостоятельное сокращение пациентами сроков лечения, использование низких доз лекарственных средств. С восьмидесятых годов двадцатого века отмечается значительный рост резистентности микроорганизмов к многим антибактериальным препаратам, в том числе к макролидам и β-лактамам, традиционно широко использующимся в оториноларингологии. В последнее время отмечается резкий рост числа штаммов бактерий, продуцирующих β-лактамазы, что по данным литературы может быть обусловлено широким использованием в стационарной и амбулаторной практике разных поколений цефалоспоринов [12]. Очень важно учитывать, что применение антибактериальных препаратов в любом случае оказывает повреждающее действие не только на патогенную, но и на нормальную микрофлору организма человека, тем самым повышая риск последующей колонизации патогенной микрофлорой. Учитывая вышеизложенное, актуальность выбора рациональной этиотропной топической терапии бактериальных инфекций в детском возрасте не вызывает сомнений. Хорошие перспективы в этом аспекте имеют бактериофаги.
Бактериофаги были открыты канадским микробиологом Феликсом Д’Эреллем в 1917 году при наблюдении за эффектом лизиса бактерий [11]. До него с подобными явлениями сталкивались и другие исследователи (Н.Ф. Гамалея, 1898; Ф. Туорт, 1915), но именно Ф. Д’Эрелль не только выдвинул предположение о вирусной этиологии гибели бактерий, но и сумел выделить литический фактор. Обнаруженные вирусы получили название бактериофагов и стали применяться в терапии инфекционных заболеваний. Однако с наступлением «эры антибиотиков» фаговая терапия была незаслуженно подзабыта. В настоящее время, когда повсеместно растет антибиотикоустойчивость патогенных микроорганизмов, и эффективность этиотропного лечения неуклонно снижается, интерес клинической медицины к бактериофагам вновь заметно повысился.
Бактериофаги представляют собой наиболее многочисленную, широко распространенную в биосфере и, предположительно, наиболее эволюционно древнюю группу вирусов. Учеными было подсчитано, что за 1 секунду бактериофагами могут быть инфицированы 1024 бактерий [15]. Одной из областей применения бактериофагов является противомикробное лечение, альтернативное антибактериальным препаратам.
Вследствие высокой безопасности и ареактогенности бактериофаги разрешены к применению в педиатрии без возрастных ограничений (в том числе и недоношенным детям) [1, 3, 7]. Использование препаратов бактериофагов стимулирует активизацию факторов специфического и неспецифического иммунитета, поэтому фаготерапия особенно эффективна при лечении хронических воспалительных заболеваний на фоне иммунодепрессивных состояний [8, 16]. В августе 2009г. корпорацией «Nestle Nutrition» (Швейцария) в Бангладеш были инициированы клинические исследования использования бактериофага Escherichia coli в терапии кишечных инфекций детей в возрасте от 6 до 60 месяцев, результаты которого продемонстрировали хорошую переносимость и высокую эффективность данного способа лечения [17]. В другом исследовании у детей с острым гнойным риносинуситом было показано положительное влияние бактериофагов на мукоцилиарный клиренс – важный универсальный механизм защиты слизистой оболочки дыхательных путей. Это позволяет отнести бактериофаги не только к этиологическим, но и к патогенетическим средствам терапии гнойно-воспалительных заболеваний ЛОР-органов [10]. По результатам клинических исследований также были получены данные о положительном влиянии фаготерапии на клинические проявления хронического тонзиллита и высеваемость Staphylococcus aureus с поверхности небных миндалин [9].
В настоящее время российская медицинская промышленность производит различные препараты бактериофагов для борьбы с инфекционными заболеваниями, вызванными значительным спектром патогенных и условно-патогенных бактерий [18].
В большинстве клинических случаев бактериофаги назначают для приема внутрь, но это не единственный способ их применения. Для лечения и профилактики заболеваний ЛОР-органов можно закапывать препарат в полость носа, промывать, полоскать и орошать им миндалины, вводить в слуховой проход турунды с лекарственным раствором. В настоящее время применяются следующие бактериофаги: стафилококковый, стрептококковый, дизентерийный поливалентный, клебсиеллёзный, пиобактериофаг и другие. Пиобактериофаг поливалентный — Секстафаг (ФГУП НПО «Микроген» Минздрава России) способен специфически уничтожать наиболее значимых возбудителей заболеваний ЛОР-органов, в частности стафилококки, стрептококки и другие микроорганизмы. В связи с вышеперечисленными свойствами, показаниями к применению данного препарата являются гнойно-воспалительные заболевания верхних отделов дыхательных путей и уха, а также их осложнения – флегмоны и абсцессы. Согласно инструкции производителя, препарат может применяться местно — в виде полосканий, орошений, аппликаций; для введения в околоносовые пазухи, полость среднего уха, промывания полости абсцесса. Для внутриполостного введения при инфекциях ЛОР-органов рекомендуется использовать от 2,0 до 20,0 мл 1 — 3 раза в день. Длительность лечения пиобактериофагом поливалентным составляет от 5 до 15 дней. Имеются данные о противовоспалительных и иммунорегуляторных свойствах препарата пиобактериофага поливалентного (Секстафаг) [2]. Анализ истории, механизма действия и применения бактериофагов в медицине позволяют с уверенностью сказать, что преимуществом данного способа лечения является способность вирусных агентов поражать как чувствительные, так и полиантибиотикорезистентные микробные клетки. Важной особенностью фаготерапии в сравнении с этиотропной химиотерапией является отсутствие риска распространения в популяции резистентных к терапии патогенных агентов и негативного влияния на нормальную микрофлору. Особенностями бактериофагов, дающими преимущество перед другими способами лечения, также являются их высокая специфичность к определенным микроорганизмам, хорошая совместимость с другими лекарственными средствами, отсутствие аллергических реакций и других нежелательных явлений.
Таким образом, фаготерапия является эффективным и безопасным методом лечения и может быть востребована в терапии воспалительных заболеваний ЛОР-органов бактериальной этиологии, в том числе и в детском возрасте.
ЛИТЕРАТУРА
1. Аникина Т.А., Рязанова С.Х., Сергеева Е.Н. и др. Свежевыделенные штаммы возбудителей – важнейший компонент производства адаптированных лечебно-профилактических бактериофагов // Предприятие по производству бактериальных препаратов “ИмБио”, Вакцинология. – Нижний Новгород, 2006. – С. 3. 2. Арефьева Н.А., Азнабаева Л.Ф., Ворошилова Н.Н., Султанов Н.М. Сравнительное изучение влияния способов лечения на состояние местного иммунитета слизистых оболочек носа больных хроническим гнойным риносинуситом. Фундаментальные исследования 2007; 4. 3. Воротынцева Н.В., Солодовников Ю.П., Милютина Л.Н. и др. Фаготерапия и фагопрофилактика острых кишечных инфекций у детей: методические рекомендации. – М., 1991. – С. 11. 4. Заварзин Б.А., Аникин И.А. Кандибиотик в лечении острых средних и наружных отитов. Рос оторинолар 2011; 2: 5. Лобзин Ю.В. (ред.). Руководство по инфекционым болезням. СПб 2000; 932 6. Нестерова И.В. Проблемы лечения вирусно-бактериальных респираторных инфекций у «часто и длительно болеющих» иммунокомпрометированных детей // Лечащий врач 2009. № 6. С. 26–29 7. Сенцова Т.Б., Сергеева Т.В., Яцык С.П. и др. Алгоритм диагностики и лечения инфекции мочевой системы у детей: методич. рекомендации (№ 41). – М., 2003. – 21 с. 8. Султанов Н.М. Антибактериальная активность и клиническая эффективность препарата пиобактериофага поливалентного очищенного при лечении хронического гнойного риносинусита: дис. канд. мед.наук – Уфа : Башкирский гос. мед. ун-т, 2007. – 113 с. 9. Худоногова З.П., Евстропов А.Н., Васильева Н.Г., Рымша М.А.,Подволоцкая И.В., Шоларь М.В. Эффективность использования стафилококкового бактериофага в топической терапии хронического тонзиллита. Рос. оторинолар. 2011; 6: 55: 176—179. 10. Янборисова Э.Р., Янборисов Т.М. Влияние пиобактериофага на мукоцилиарный клиренс при местном применении у детей с острым синуситом // Российская ринология, 1997. № 2. С. 55. 11. Félix d’Hérelles (1917). «Sur un microbe invisible antagoniste des bacilles dysentériques» 12. Paterson DL, Bonomo RA. Extended-spectrum beta-lactamases: a clinical update. Clin Microbiol Reviews 2005;18:7–86. 13. Pichichero M.E. Group A streptococcal tonsillopharyngitis: costeffective diagnosis and treatment. Ann Emerg Med 1995; 25: 3: 390—403. 14. Teele D.W., Klein J.O., Rosner B. Epidemiology of otitis mediaduring the first seven years of life in children in greater Boston: a prospective, cohort study. J Infect Dis 1989; 160: 1: 83—94. 15. Tettelin, H., Masignani, V., Cieslewicz, M. J., Donati, C., Medini, D., Ward, N. L., Angiuoli, S. V., Crabtree, J., Jones, A. L., Durkin, A. S., Deboy, R. T., Davidsen, T. M., Mora, M., Scarselli, M., Margarit, Y. Ros I., Peterson, J. D., Hauser, C. R., Sundaram, J. P., Nelson, W. C., Madupu, R., Brinkac, L. M., Dodson, R. J., Rosovitz, M. J., Sullivan, S. A., Daugherty, S. C., Haft, D. H., Selengut, J., Gwinn, M. L., Zhou, L., Zafar, N., Khouri, H., Radune, D., Dimitrov, G., Watkins, K., O’Connor K, J., Smith, S., Utterback, T. R., White, O., Rubens, C. E., Grandi, G., Madoff, L. C., Kasper, D. L., Telford, J. L., Wessels, M. R., Rappuoli, R., Fraser, C. M. Genome Analysis of Multiple Pathogenic Isolates of Streptococcus Agalactiae: Implications for the Microbial «pan-genome» Proc. Natl. Acad. Sci. U.S.A. 2005 Sep 27; 102(39): 13950-5. 16. Weber-Dabrowska, Zimecki M., Kruzel M. et al. Alternative therapies in antibiotic-resistant infection // Advances in Medical Sciences. – 2006. – Vol. 51. – P. 242–244. 17. A service of the U.S. National Institutes of Health [Электронный ресурс]. – URL: https://www.clinicaltrials.gov/ct2/show/ NCT00663091?term=bacteriophage&rank=2. 18. Каталог продукции ФГУП «НПО «Микроген»: [Электронный ресурс] //URL: https://www.microgen.ru/catalog.
Источник:
Медицинский совет, № 6, 2015