Индол-3-карбинол и эстрогены
Индол-3-карбинол не влияет на количество эстрогенов, к коим относится эстрадиол. Индол-3-карбинол влияет на метаболизм эстрогенов. Что это значит. После того как эстрогены выполнили свою работу в организме, они должны покинуть его. Происходит это в результате их метаболизма, т.е. превращения в другие субстанции – в водорастворимые метаболиты эстрогенов. Эти метаболиты могут быть “хорошими” и “плохими”. Хорошие метаболиты поддерживают нормальное функционирование тканей, противостоят возникновению раковых клеток. А вот плохие метаболиты вызывают разрастание тканей, т.е. образование опухолей и перерождение этих опухолей в злокачественные. Так вот индол-3-карбинол уменьшает количество плохих метаболитов эстрогенов и увеличивает количество хороших, т.е. просто смещает соотношение метаболитов в пользу хороших.
Now Foods, Индол 3-карбинол, 200 мг, 60 растительных капсул
iherb.com
1 116 руб.
Купить сейчас
Индол-3-карбинол для мужчин
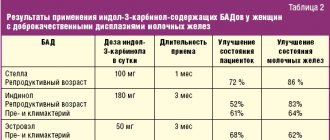
Все это актуально не только для женщин. Эстрогены ведь присутствуют и в мужском организме. Это во-первых. А во-вторых, индол-3-карбинол положительно влияет и на метаболизм мужских гормонов андрогенов. Тестостерон может превращаться в очень активный дигидротестостерон, избыток которого влечет гипертрофию и гиперплазию простаты, развитие аденомы простаты и вероятность развития рака простаты. Индол-3-карбинол снижает частоту преобразований тестостерона в дигидротестостерон. Кроме того, тестостерон может превращаться в эстроген. Эстрогены для мужчины очень важны – они, как ни удивительно, отвечают за мужское либидо, в том числе, и за здоровье в целом. Но избыток эстрогенов у мужчины – это ожирение по женскому типу, депрессии, нарушение половой функции, снижение либидо. Особенно это актуально для мужчин с лишним весом, т.к. в жировая ткань активно синтезирует эстрогены из тестостерона (путем, так называемой, ароматизации) и накапливает их. Так вот, индол-3-карбинол предотвращает нежелательное превращение тестостерона в эстрогены. Самое важное следствие всего этого – здоровье простаты мужчины. А, кстати сказать, аденома простаты (ее разрастание) уже к 40-50 годам наблюдается у каждого четвертого мужчины, и дальше цифры только растут.
Вот, например, комплекс для мужчин с индол-3-карбинолом с экстрактом зеленого чая для поддержки нормального гормонального обмена:
Natural Factors, AndroSense T-Correct, баланс тестостерона и эстрогена, 60 вегетарианских капсул
iherb.com
1 249 руб.
Купить сейчас
Безопасность индол-3-карбинола
Индол-3-карбинол – это соединение, которое было обнаружено в растениях семейства крестоцветных (в частности, в брокколи). На всех препаратах, содержащих индол-3-карбинол, в качестве противопоказаний указывается лишь индивидуальная непереносимость компонентов продукта. Ну, еще беременность и кормление, т.к. не проводились исследования в этой группе.
Особенно эффективен индол-3-карбинол в сочетании с экстрактом зеленого чая:
Now Foods, EGCg, экстракт зеленого чая, 400 мг, 180 растительных капсул
iherb.com
1 202 руб.
Купить сейчас
Это сочетание активно используют гинекологи, назначая Индинол + Эпигаллат. Это, собственно, и есть индол-3-карбинол+зеленый чай. И лецитин
здесь хорош – его фосфолипиды участвуют во всех гормональных процессах. И
магний
, как участник всех гормональных процессов.
За все вышеупомянутые уникальные свойства я и включила индол-3-карбинол в свою схему приема бадов
. Продолжительность курсов в схеме есть.
Вот. Я очень долго и ответственно писала этот пост. Его очень давно ждали. Я написала также отзыв на индол-3-карбинол от Now Foods на iHerb.
UPD: Про то, как индол-3-карбинол снял диагноз рак почки читаем здесь
.
Вирус папилломы человека (ВПЧ) является инфекционным агентом, который обусловливает широкий спектр эпителиальных пролиферативных повреждений аногенитальной области, приводит к появлению остроконечных кондилом, дисплазии вульвы, влагалища и шейки матки. ВПЧ-инфекция — одна из наиболее распространенных и значимых инфекций, передаваемых преимущественно половым путем (ИППП); им инфицирована большая часть сексуально-активного населения планеты. Описаны более 100 типов ВПЧ, около 40 из них принимают участие в инфицировании аногенитальной области [6-9].
Эпидемиологические и вирусологические исследования подтверждают, что около 95% всех опухолей плоскоклеточного рака шейки матки содержат ДНК-вирусы папилломы человека. У пациенток с цервикальной интраэпителиальной дисплазией риск развития рака шейки матки в 20 раз выше, чем в популяции. Максимум заражения ВПЧ-инфекцией приходится на самый активный в сексуальном отношении возраст — 18-25 лет и снижается после 30 лет, когда существенно возрастает частота дисплазий и рака шейки матки, пик которого наблюдается после 45 лет [9]. Сложный цикл репликации вируса, существование инфекции в эписомальной, интегрированной формах обусловливают отсутствие в настоящее время методов патогенетической терапии ВПЧ-инфекции [10].
ВПЧ может приводить к латентной, субклинической и клинической формам инфекции [5]. Наиболее часто патология шейки матки, обусловленная ВПЧ, представляет собой субклиническую и бессимптомную формы инфекции. У женщин это касается ВПЧ-поражения шейки матки, у мужчин — наружных половых органов и аногенитальной области. Субклиническая папилломавирусная инфекция (ПВИ) шейки матки — это интраэпителиальное поражение, связанное с внедрением вируса в незрелые делящиеся клетки базального слоя эпителиального пласта шейки матки [1, 2, 5], что приводит к морфологической перестройке эпителиоцита в ответ на эписомальную репликацию вируса. Субклиническая инфекция шейки матки характеризуется изменениями, выявленными при кольпоскопии, цитологическом и гистологическом исследованиях, обнаружением ДНК ВПЧ. Клиническая инфекция — процесс, видимый невооруженным глазом. Озлокачествление патологического процесса шейки матки чаще всего происходит на фоне иммуносупрессии [8], при которой ВПЧ-инфекция отличается не только более тяжелым течением, более крупными размерами высыпаний с наличием инвазии, но и резистентностью к терапии и высокой частотой рецидивов [10].
Основное направление в лечении субклинических, клинических форм ПВИ шейки матки, цервикальных интраэпителиальных неоплазий (CIN) — это использование комбинированной терапии. Комплексный подход к лечению заключается в хирургическом удалении измененной поверхности эпителиального пласта шейки матки с последующим применением консервативного лечения, направленного на оставшиеся инфицированные вирусом клетки. Наиболее часто в качестве терапевтического компонента используются препараты интерферона, противовирусные препараты, эндогенные цитокины, иммуномодуляторы. Однако ввиду того, что клинически не пораженные ткани могут содержать вирусную ДНК, разрушение элементов не приводит к полной элиминации вируса [6, 7].
Иммунный ответ микроорганизма играет важную роль в предотвращении клинической манифестации ВПЧ-инфекции. ВПЧ вызывает как гуморальный, так и клеточный типы иммунного ответа. Клеточный иммунитет играет основную роль, как в персистенции, так и в сложном регрессе поражений. Это подтверждается данными о более высокой частоте ВПЧ-ассоциированных заболеваний при трансплантации внутренних органов и у ВИЧ-инфицированных [8].
Доказано, что в условиях иммуносупрессии чаще реализуется онкогенный потенциал ВПЧ, связанный с их способностью к выработке онкобелков Е6 и Е7, которые формируют комплексы со специфическими проапоптотическими белками р53 и Rb, которые обычно выполняют в клетке противоопухолевую функцию. В связанном с онкобелками состоянии они не способны выполнять эти функции, что вызывает снижение внутриклеточной противоопухолевой защиты. В настоящее время установлены эстрогенная зависимость индукции онкогена Е7 ВПЧ и связанный с ее устранением способ профилактики и лечения опухолей, обусловленных ВПЧ [1-3].
Препарат, содержащий индол-3-карбинол, обладает выраженной активностью по отношению к ВПЧ-ассоциированным заболеваниям. Активное действующее вещество препарата — высокоочищенный индол-3-карбинол (I3C) — фитопрепарат, полученный из растений семейства крестоцветных. Механизмы фармакологического действия индол-3-карбинола характеризуются широким спектром: антипролиферативная и антиэстрогенная активность; блокада неоангиогенеза, опосредованная через ингибирование циклооксигеназы-2; индукция апоптоза и ингибирование синтеза онкобелка Е в эпителиальных клетках, инфицированных ВПЧ, что приводит к повышению восприимчивости клеток к препаратам интерферона или его индукторов [4].
Указанное фармакологическое действие препарата послужило поводом для его использования в составе комплексной терапии субклинических форм ПВИ и CIN.
Цель данного исследования — оценка эффективности комплексной терапии субклинических форм ПВИ и ВПЧ-ассоциированных заболеваний шейки матки (CIN) у пациенток репродуктивного возраста, основанной на применении метода широкополосной радиоволновой хирургии, иммуномодулирующего препарата, содержащего рекомбинантный α2-интерферон, комплексный иммуноглобулиновый препарат и индол-3-карбинол.
Материал и методы
Исследование проводилось на базе Дорожной клинической больницы Красноярска в период с 2007 по 2009 г. В исследование были включены 65 пациенток репродуктивного возраста (от 18 до 45 лет) с субклиническими формами ПВИ и ВПЧ-ассоциированными заболеваниями шейки матки (CIN), обусловленными высокоонкогенными типами ВПЧ.
С учетом характера проводимого лечения все пациентки были разделены на две группы:
— 1-я группа (основная) включала 38 пациенток с субклиническими формами ПВИ и ВПЧ-ассоциированными заболеваниями шейки матки (CIN), которым проводилось комплексное лечение: применение деструктивного метода, рекомбинантного α2-интерферона и комплексного иммуноглобулинового препарата (КИП), а также препарата, содержащего индол-3-карбинол. Рекомбинантный α2-интерферон и КИП назначали в свечах в дозе 1 млн ЕД в 2 приема интравагинально до момента деструкции и через 2 нед после деструктивного лечения шейки матки в течение 10 дней. Препарат, содержащий активный индол-3-карбинол в дозе 100 мг в капсуле, назначали per os
в суточной дозе 400 мг по 2 капсулы 2 раза в день в течение 12 нед с первого дня после проведения деструкции;
— 2-я группа (группа сравнения) была представлена 27 пациентками. В ней применяли аналогичные методы деструктивного лечения патологически измененного эпителия шейки матки, назначали α2-интерферон и КИП в дозе 1 млн ЕД в 2 приема интравагинально до момента деструкции и через 2 нед после деструктивного лечения шейки матки в течение 10 дней. Пациенткам этой группы индол-3-карбинол не назначали.
В качестве деструктивного метода лечения у пациенток обеих групп использовали аппарат ФОТЕК-Е80М, генерирующий радиоволны специальных форм (широкополосные волны). Режим «Смесь» — радиоволновую вапоризацию проводили на 5-7-й день менструального цикла с захватом 2-3 мм зоны здоровой ткани по границе, определяемой ШИК-пробой. При выявлении деформации шейки матки в сочетании с множественными наботовыми кистами, гипертрофией шейки матки, эндоцервикальными поражениями и CIN II-III степени, деформацией цервикального канала проводилась конизация шейки матки электродом-парусом в режиме МОНО-КОАГ при мощности 70-90 Вт. После иссечения выполнялась радиоволновая пунктурная коагуляция шейки матки по окружности иссеченного участка в 3-4 точках. При этом электрод-игла вводилась на глубину 3-4 мм в край зоны эксцизии и в режиме МОНО-КОАГ при мощности 40-60 Вт проводилась коагуляция.
Всем пациенткам проводилось обследование, включающее расширенную кольпоскопию, цитологический и морфологический методы (биопсия шейки матки с диагностическим выскабливанием цервикального канала) и определение ДНК ВПЧ высокоонкогенного риска методом полимеразной цепной реакции (ПЦР). Все обследования проводились дважды — до лечения и через 3 мес после его окончания.
Оценка эффективности проводимого лечения осуществлялась по следующим параметрам: отсутствию или наличию атипической кольпоскопической картины или наличию другой патологии шейки матки; уменьшению площади распространения процесса; изменениям при цитологическом исследовании, определению ДНК ВПЧ.
Оценку полученных результатов и комплексный системный анализ имеющихся данных выполняли с использованием методов описательной статистики. Сравнение количественных значений в выборках проводилось с использованием непараметрического критерия Манна-Уитни. Для характеристики различий качественных признаков использовались критерий χ2 Пирсона с поправкой Йетса.
Результаты и обсуждение
У всех обследованных нами пациенток, по данным кольпоскопии, выявлена атипическая кольпоскопическая картина (согласно Международной терминологии кольпоскопических терминов, Рим, 2003). Наиболее часто встречаемыми изменениями были пунктации, ацетобелый эпителий, мозаика, йоднегативные зоны (табл. 1).
В результате ПЦР-обследования пациенток с субклиническими формами ПВИ шейки матки в большинстве случаев был выявлен ВПЧ 16-го типа, реже 18-го типа.
По данным цитологического исследования (классификация Бетесда, 2003), в 1-й группе у 31,58±5,4% пациенток цитологическая картина соответствовала LSIL (Low-grade squamous intraepithelial lesions), т.е. плоскоклеточному интраэпителиальному поражению (ПИП) низкой степени, дисплазии легкой степени, у 21,05±4,5% — HSIL (High-grade squamous intraepithelial lesions), т.е. ПИП высокой степени, умеренная дисплазия, у 21,05±3,6% — норме, у 26,32±3,7% — доброкачественным клеточным изменениям. Во 2-й группе в 11,11±4,4% случаев результаты цитологического исследования соответствовали LSIL, в 22,22±6,4% — HSIL, в 25,93±4,7% — норме, в 40,74±5,3% — доброкачественным клеточным изменениям.
Результаты гистологического исследования биоптатов шейки матки в 1-й группе были следующими: у 15,12±4,9% пациенток отмечалась норма, у 32,25±5,3% определялись незначительные клеточные изменения; CIN определялась в 1-й группе у 52,63±5,4% пациенток: CIN-I — у 31,58±2,4%, CIN-II — у 5,26±3,2%, CIN-III — у 15,79±5,5%.
В группе сравнения результаты гистологического исследования биоптатов шейки матки соответствовали норме у 23,11±4,9% пациенток, в 43,54±5,7% случаев были незначительные клеточные изменения. CIN была выявлена у 33,35±6,5% пациенток: CIN-I — у 11,12±3,7%, CIN-II — у 7,41±4,5%, CIN-III — у 14,81±5,3%.
ВПЧ 16-го типа в 1-й группе выявлен у 68,95±7,9% женщин, 18-го типа — у 7,89±1,7%, во 2-й группе 16-й тип ВПЧ был обнаружен у 57,78±7,6% пациенток, 18-й тип — у 7,41±2,7%.
После деструктивного этапа лечения все пациентки 1-й группы получали индол-3-карбинол. В дальнейшем мы проводили оценку скорости эпителизации раневой поверхности. Через 2 нед после вапоризации или конизации шейки матки мы отмечали появление признаков начальной эпителизации шейки матки у всех пациенток. С этого периода мы определяли сроки дополнения терапии препаратами, содержащими α2-интерферон и КИП. Через 12 нед оценка результатов лечения осуществлялась по данным кольпоскопии, цитологического исследования, вирусологического исследования — обнаружения ДНК ВПЧ методом ПЦР.
Под полным выздоровлением мы понимали отсутствие жалоб у пациенток, получение позитивных результатов по данным расширенной кольпоскопии (шейка матки покрыта многослойным плоским эпителием), а также отсутствие койлоцитов при цитологическом исследовании и ДНК ВПЧ в соскобах из цервикального канала при обследовании методом ПЦР.
Критериями положительной динамики считали отсутствие жалоб у пациенток, подтверждение при контрольном кольпоскопическом исследовании признаков эпидермизации, уменьшение площади поражения; при цитологическом исследовании — наличие единичных койлоцитов; при исследовании соскоба цервикального канала — положительный результат обнаружения ДНК ВПЧ методом ПЦР.
Критериями отсутствия эффекта от лечения были клинико-лабораторные данные, не отличающиеся от исходных до начала лечения.
Анализ полученного эффекта от проведенного лечения, по данным расширенной кольпоскопии, показал, что у 89,4% пациенток 1-й группы отмечалось выздоровление. Это значительно выше, чем во 2-й группе — соответственно у 74,07% пациенток.
По данным ПЦР-исследования после лечения ДНК ВПЧ была обнаружена у 18,4% пациенток в 1-й группе, что статистически достоверно реже, чем во 2-й группе — у 33,3% (р<0,05).
Аналогичные результаты были получены по данным цитологического исследования. Так, у 84,27% пациенток 1-й группы результаты цитологического исследования соответствовали норме, у 15,7% пациенток изменения соответствовали ASCUS (atypical squamous cells of undetermined significance), т.е. клетки плоского эпителия с атипией неопределенного значения. Во 2-й группе достоверно реже, только у 66,6% пациенток цитологические результаты соответствовали норме, у 27,5% пациенток изменения соответствовали ASCUS, у 5,8% пациенток изменения соответствовали LSIL (табл. 2).
По результатам проведенного исследования установлено, что эффективность комплексного лечения папилломавирусных субклинических поражений шейки матки у пациенток 1-й группы, получавших в составе комплексной терапии индол-3-карбинол, составила 85,9%, что достоверно выше, чем у пациенток группы сравнения — 69,1% (которым этот препарат не назначался).
Выводы
Использование комбинированной схемы лечения ВПЧ-ассоциированных форм патологии шейки матки у пациенток репродуктивного возраста с применением современных малотравматичных деструктивных методов лечения, а также препаратов, содержащих индол-3-карбинол, рекомбинантный α2-интерферон и комплекс иммуноглобулинов, позволяет значительно улучшить эффективность лечения этой патологии.
Как принимать индол-3-карбинол
Терапевтическая (лечебная) противоопухолевая доза индол-3-карбинола может достигать 1000 мг в сутки (важно разбивать на несколько приемов). И в таком случае желательно постепенно увеличивать суточную дозу. И еще отмечу, что, согласно клиническим испытаниям, в дозе, многократно превышающей 400 мг/день, индол-3-карбинол не вызывает никаких побочных эффектов. Т.е. 1000 мг в ЛЕЧЕБНЫХ целях можно принимать, при необходимости. Продолжительность курса лечения обычно – 3-6 месяцев.
Также смотрите схему бадов на основе индол-3 карбинола и зеленого чая – ФИБРОЗНО-КИСТОЗНАЯ МАСТОПАТИЯ, МИОМА МАТКИ И ЭНДОМЕТРИОЗ. ЛЕЧЕНИЕ И ПРОФИЛАКТИКА
(это ссылка).
При отсутствии на складе препарата от Now Foods, его можно заменить на этот препарат:
Advance Physician Formulas, Индол-3-карбинол, 200 мг, 60 вегетарианских капсул
iherb.com
978 руб.
Купить сейчас
Принимать так же, как Now Foods – 1-3 капсулы в день.
Еще одна замена для женщин, с индол-3-карбинолом:
Публикации в СМИ
И.С. СИДОРОВА, заведующая кафедрой, член-корреспондент РАМН А.Л. УНАНЯН, доцент кафедры, доктор медицинских наук Н.В. КАРАСЕВА, аспирант кафедры Кафедра акушерства и гинекологии ФППОВ ММА им. И. М. Сеченова
Миома матки и аденомиоз относятся к наиболее частым гинекологическим заболеваниям после воспалительных процессов. Миому матки при профилактических осмотрах впервые выявляют у 1—5% обследуемых, среди гинекологических больных — до 30— 35%. Эндометриоз встречается у женщин любого возраста независимо от социального положения и этноса. По данным некоторых ученых, частота генитального эндометриоза колеблется от 12 до 50%. Частота совместной встречаемости миомы матки и аденомиоза достаточно велика и колеблется от 35 до 80%.
Актуальной задачей гинекологии является органосохраняющее лечение больных миомой матки и аденомиозом. Существующая в настоящее время терапия гормональными препаратами миомы матки и аденомиоза имеет ряд существенных недостатков. После прекращения гормонального лечения у большинства пациенток происходит рецидив клинической симптоматики. Заслуживает также внимания выраженность побочных эффектов и большое число противопоказаний к гормональной терапии.
В результате многочисленных исследований гормонального статуса, рецепторов гормонов при миоме матки получены неоднозначные результаты, свидетельствующие о гетерогенности миомы. В настоящее время доказана роль других, раннее неизвестных факторов в генезе сочетания миомы матки и аденомиоза, а именно: нарушения процессов апоптоза, пролиферации, неоангиогенеза, стромообразования в развитии указанных заболеваний. В литературе описаны вещества, обладающие антипролиферативным, антиангиогенным и проапоптотическим действием, в частности индол-3-карбинол и эпигаллокатехин-3-галлат. Индол-З-карбинол обладает мощной противоопухолевой активностью, патогенетически воздействуя на основные звенья развития гиперпластических процессов в организме. Эпигаллокате-хин-3-галлат — один из представителей катехинов, обладает сильнейшей антиоксидантной активностью, сопоставимой с сетокоферолом, а также противовоспалительным, антипролиферативным и антиангиогенным действием.
Воздействие этих препаратов изучено на различных патологических моделях в исследованиях ученых разных стран. Однако пока недостаточно научных исследований по изучению воздействия данных препаратов при сочетании миомы матки и аденомиоза. В связи с этим было проведено клиническое исследование эффективности применения препаратов, содержащих индол-3-карбинол и эпигаллокатехин-3-галлат, у больных с сочетанием миомы матки и аденомиоза.
В исследование были включены 92 пациентки 35—49 лет (средний возраст 42±7 лет), у которых отсутствовали показания к оперативному лечению, и им была назначена терапия гормональными препаратами. Пациентки были разделены на 2 группы. В первую вошли 47 человек, которым были назначены агонисты гонадотропин-рилизинг-гормона (ГнРГ): бусерелин-депо по 3,75 мг/мес внутримышечно или трипторелин по 3,75 мг/мес внутримышечно в течение 6 месяцев. Во вторую группу вошли 45 человек, которые получали терапию агонистами ГнРГ и препараты, содержащие индол-3-карбинол по 400 мг/сут (препарат Индинол по 2 капсулы 2 раза в день во время еды) и эпигаллокатехин-3-галлат по 200 мг/сут (препарат Эпигаллат по 2 капсулы 2 раза в день во время еды) в течение 6 месяцев. Пациенток беспокоила общая слабость, повышенная утомляемость (19,6%). Преобладающим симптомом были обильные и длительные менструации (72,8%), болезненные менструации (41,3%), перименструальные кровяные выделения (38%), боли внизу живота (13%), ациклические кровотечения (9,8%), диспареуния (16,3%), дизурические симптомы (12%). Из 61 (66,3%) пациентки репродуктивного возраста с сочетанием миомы матки и аденомиоза имело место первичное (2,2%) или вторичное (3,3%) бесплодие. Длительность сочетанного заболевания матки колебалась от нескольких месяцев до 14 лет (в среднем 7,6±1,5лет). На фоне проводимой терапии агонистами ГнРГ наблюдалось заметное уменьшение объема матки у всех пациенток первой группы. Максимальное уменьшение матки составило 42—45% от исходного объема к окончанию 6-месячного курса лечения. Однако после окончания курса лечения отмечался рост матки, и через 6 месяцев после окончания лечения объем матки достиг прежних размеров. Такая же тенденция наблюдалась при изучении объема доминантного узла и оценке толщины стенки матки с аденомиозом.
При применении агонистов ГнРГ наблюдались побочные эффекты: «приливы» жара к голове, шее, телу отмечены у большинства пациенток и не зависели от используемого препарата, встречались у 75—80% пациентов. Также пациенты отмечали головные боли (24%), раздражительность (18%), потливость (17%), нарушение сна (11%), сухость слизистых и дискомфорт во время половой жизни (10%), снижение либидо (10%), отеки ног, лица (5%). Осложнений и тяжелых побочных эффектов, что могли бы привести к отмене препарата, не наблюдалось. Несколько иную клиническую картину мы наблюдали у женщин второй группы. В данной группе пациенток наблюдалось также значительное постепенное уменьшение объема матки. В случае с простой миомой через 3 месяца уменьшение объема матки произошло на 32%, через 6 месяцев — на 57%. В случае с пролиферирующей миомой через 3 месяца уменьшение объема матки диагностировано на 43,5%, через 6 месяцев — на 59,5%, что совпало с динамикой уменьшения объема матки у пациенток первой фуппы. Но после отмены препаратов рост матки не был столь значительным, как у пациенток первой группы. Такая же тенденция отмечалась при оценке динамики доминантного узла миомы и толщины стенки матки с аденомиозом. Надо отметить, что побочные эффекты во второй группе пациенток были связаны с применением агонистов ГнРГ. Ни у одной пациентки не было зарегистрировано побочных эффектов, связанных с приемом препаратов Индинол или Эпигаллат.
Выводы
В связи с проведенным исследованием можно сделать вывод, что применение агонистов ГнРГ в качестве самостоятельного метода у пациенток с сохраненной менструальной функцией является недостаточно эффективным. А добавление к лечению препаратов, содержащих индол-3-кар-бинол (Индинол) и эпигаллокатехин-3-галлат (Эпигаллат), которые воздействуют на молекулярные механизмы возникновения миомы матки и аденомиоза — апоптоз, пролиферацию, неоан-гиогенез, показало хорошую клиническую эффективность в лечении сочетания миомы матки и аденомиза.
Таким образом, определились новые пути фармакологической коррекции миомы матки и аденомиоза. Использование препаратов Индинол и Эпигаллат, влияющих на основные патогенетические механизмы развития миомы и аденомиоза, открывает новое направление в терапии указанных заболеваний — целенаправленно воздействующая терапия. Такая терапия должна стать приоритетной у практических врачей при лечении миомы матки и аденомиоза.