Диаглинид, 30 шт., 2 мг, таблетки
Необходимо принимать во внимание возможное взаимодействие репаглинида с препаратами, влияющими на метаболизм глюкозы.
Метаболизм, и, таким образом, клиренс репаглинида, могут изменяться под воздействием препаратов, которые оказывают влияние, подавляя или активизируя ферменты из группы цитохрома Р-450. Особую осторожность следует соблюдать при одновременном назначении с репаглинидом ингибиторов CYP2C8 и CYP3A4. В исследованиях показано, что одновременное назначение деферазирокса, являющегося слабым ингибитором CYP2C8 и CYP3A4, и репаглинида приводит к увеличению системного воздействия репаглинида; при этом происходит небольшое, но значимое снижение концентрации глюкозы в крови. При одновременном назначении деферазирокса и репаглинида необходимо рассмотреть уменьшение дозы репаглинида и осуществлять тщательный контроль концентрации глюкозы в крови.
При одновременном применении клопидогрела, ингибитора CYP2C8, и репаглинида наблюдалось увеличение системного воздействия репаглинида и небольшое снижение концентрации глюкозы в крови. Если репаглинид и клопидогрел применяются одновременно, следует осуществлять тщательный контроль концентрации глюкозы и клиническое наблюдение.
Ингибиторы анионтранспортирующего белка ОАТР1В1 (например, циклоспорин) также могут повышать концентрацию репаглинида в плазме.
Следующие лекарственные средства могут усиливать и/или пролонгировать гипогликемическое действие репаглинида:
Гемфиброзил, триметоприм, рифампицин, кларитромицин, кетоконазол, итраконазол, циклоспорин, другие гипогликемические препараты, ингибиторы моноаминооксидазы, неселективные бета-адреноблокаторы, ингибиторы ангиотензинпревращающего фермента, салицилаты, нестероидные противовоспалительные препараты (НПВП), октреотид, этанол и анаболические стероиды.
Бета-адреноблокаторы могут маскировать симптомы гипогликемии.
Одновременное назначение циметидина, нифедипина или симвастатина (являющихся субстратами CYP3A4) с репаглинидом не оказывает значимого влияния на фармакокинетические параметры репаглинида.
Репаглинид клинически значимо не влияет на фармакокинетические свойства дигоксина, теофиллина или варфарина при применении у здоровых добровольцев. Таким образом, нет необходимости в коррекции дозы этих препаратов при совместном применении с репаглинидом.
Следующие лекарственные средства могут ослаблять гипогликемическое действие репаглинида:
Пероральные контрацептивы, рифампицин, барбитураты, карбамазепин, тиазиды, глюкокортикостероиды, даназол, гормоны щитовидной железы и симпатомиметики.
Совместное применение пероральных контрацептивов (этинилэстрадиол/левоноргестрел)
не приводит к клинически значимому изменению общей биодоступности репаглинида, хотя максимальная концентрация репаглинида достигается раньше. Репаглинид клинически значимо не влияет на биодоступность левоноргестрела, однако не может быть исключено его влияние на биодоступность этинилэстрадиола.
В связи с этим, в период назначения или отмены вышеуказанных препаратов, пациенты, уже получающие репаглинид, должны находиться под тщательным наблюдением для своевременного выявления нарушения гликемического контроля.
Диаглинид® (Diaglinid®)
Необходимо принимать во внимание возможное взаимодействие репаглинида с препаратами, влияющими на метаболизм глюкозы.
Метаболизм и, таким образом, клиренс репаглинида могут изменяться под воздействием препаратов, которые оказывают влияние, подавляя или активизируя ферменты из группы цитохрома Р450.
Особую осторожность следует соблюдать при одновременном назначении с репаглинидом ингибиторов CYP2C8 и CYP3A4. В исследованиях показано, что одновременное назначение деферазирокса, являющегося слабым ингибитором CYP2C8 и CYP3A4, и репаглинида приводит к увеличению системного воздействия репаглинида; при этом происходит небольшое, но значимое снижение концентрации глюкозы в крови. При одновременном назначении деферазирокса и репаглинида необходимо рассмотреть уменьшение дозы репаглинида и осуществлять тщательный контроль концентрации глюкозы в крови.
При одновременном применении клопидогрела, ингибитора CYP2C8, и репаглинида наблюдалось увеличение системного воздействия репаглинида и небольшое снижение концентрации глюкозы в крови. Если репаглинид и клопидогрел применяются одновременно, следует осуществлять тщательный контроль концентрации глюкозы и клиническое наблюдение.
Ингибиторы анионтранспортирующего белка ОАТР1В1 (например, циклоспорин) также могут повышать концентрацию репаглинида в плазме.
Следующие лекарственные средства могут усиливать и/или пролонгировать гипогликемическое действие репаглинида
:
Гемфиброзил, триметоприм, рифампицин, кларитромицин, кетоконазол, итраконазол, циклоспорин, другие гипогликемические препараты, ингибиторы моноаминооксидазы, неселективные бета-адреноблокаторы, ингибиторы ангиотензинпревращающего фермента, салицилаты, нестероидные противовоспалительные препараты (НПВП), октреотид, этанол и анаболические стероиды.
Бета-адреноблокаторы могут маскировать симптомы гипогликемии.
Одновременное назначение циметидина, нифедипина или симвастатина (являющихся субстратами CYP3A4) с репаглинидом не оказывает значимого влияния на фармакокинетические параметры репаглинида.
Репаглинид клинически значимо не влияет на фармакокинетические свойства дигоксина, теофиллина или варфарина при применении у здоровых добровольцев. Таким образом, нет необходимости в коррекции дозы этих препаратов при совместном применении с репаглинидом.
Следующие лекарственные средства могут ослаблять гипогликемическое действие репаглинида:
Пероральные контрацептивы, рифампицин, барбитураты, карбамазепин, тиазиды, глюкокортикостероиды, даназол, гормоны щитовидной железы и симпатомиметики.
Совместное применение пероральных контрацептивов (этинилэстрадиол/левоноргестрел) не приводит к клинически значимому изменению общей биодоступности репаглинида, хотя максимальная концентрация репаглинида достигается раньше.
Репаглинид клинически значимо не влияет на биодоступность левоноргестрела, однако не может быть исключено его влияние на биодоступность этинилэстрадиола.
В связи с этим в период назначения или отмены вышеуказанных препаратов пациенты, уже получающие репаглинид, должны находиться под тщательным наблюдением для своевременного выявления нарушения гликемического контроля.
Диаглинид® (Diaglinide)
Репаглинид показан при неудовлетворительном контроле гликемии и сохранении симптомов сахарного диабета на фоне диетотерапии и физических упражнений.
Поскольку репаглинид является препаратом, стимулирующим секрецию инсулина, он может вызывать гипогликемию. При комбинированной терапии риск гипогликемии повышается.
Большие хирургические вмешательства и травмы, обширные ожоги, инфекционные заболевания с лихорадочным синдромом могут потребовать отмены пероральных гипогликемических лекарственных средств и назначения инсулина.
Необходимо регулярно контролировать концентрацию глюкозы в крови натощак и после приема пищи.
Следует предупредить пациента о повышенном риске возникновения гипогликемии в случаях приема алкоголя, НПВП, а также при голодании. Необходима коррекция дозы при физическом и эмоциональном перенапряжении, изменении режима питания.
У пациентов с истощением, а также пациентов, получающих неполноценное питание, необходима осторожность при выборе начальной и поддерживающей дозы, и ее титрации, во избежание гипогликемии.
Подбор дозы у пациентов с диабетом 2 типа в сочетании с тяжелым нарушением функции почек следует проводить с осторожностью.
Назначение обычных доз репаглинида у пациентов с нарушением функции печени может приводить к более высокой концентрации репаглинида и его метаболитов, чем у пациентов с нормальной функцией печени. В связи с этим, назначение репаглинида противопоказано пациентам с тяжелым нарушением функции печени, а у пациентов с нарушениями функции печени легкой и средней степени репаглинид следует применять с осторожностью. Также следует увеличивать интервалы между проведением коррекции дозы, чтобы более точно оценить ответ на терапию.
Влияние на способность к вождению автотранспорта и управлению механизмами
Способность пациентов к концентрации внимания и скорость реакции могут нарушаться во время гипогликемии и гипергликемии, что может представлять опасность в тех ситуациях, когда эта способность особенно необходима (например, при управлении транспортными средствами или работе с машинами и механизмами). Пациентам необходимо рекомендовать предпринимать меры для предупреждения развития гипогликемии и гипергликемии при управлении транспортными средствами и работе с механизмами. Это особенно важно для пациентов с отсутствием или снижением выраженности симптомов-предвестников развивающейся гипогликемии или страдающих частыми эпизодами гипогликемии. В этих случаях следует рассмотреть целесообразность выполнения подобных работ.
Репаглинид: возможности клинического применения у пациентов с сахарным диабетом 2 типа
В статье описаны механизмы патогенетического действия препаратов группы меглитинидов на примере натеглинида и репаглинида. Показано, что наибольший терапевтический результат от применения этих секретагогов инсулина достигается на ранних стадиях диабета, когда масса и секреторный потенциал бета-клеток частично сохранены. На основании данных международных клинических исследований доказано: репаглинид обладает высокой сахароснижающей эффективностью, а также сопоставимым с препаратами сульфонилмочевины (ПСМ) профилем безопасности в отношении гипогликемий и более высоким по сравнению с ПСМ, глинидами и препаратами инсулина профилем безопасности в отношении влияния на массу тела. Репаглинид (Диаглинид производства ОАО «АКРИХИН») может быть рекомендован в качестве монотерапии или в комбинации с метформином, базальной инсулинотерапией на всех стадиях СД 2 типа.
Рис. 1. Секреция инсулина и ее влияние на метаболизм
Таблица 1. Цели лечения СД 2 типа (EASD/ADA, 2009 г.; ADA, 2012 г.; ВНОК, 2009 г.; ESC, 2011 г.)
Рис. 2. Средние уровни инсулина в плазме (± SEM) после приема 120 мг натеглинида, 0,5 и 2 мг репаглинида и плацебо за 10 минут до еды 80 70 60 50 40 30  *† 20 натеглинид 120 мг Репаглинид 2 мг Репаглинид 0,5 мг Плацебо *† * *‡ * * 
Рис. 3. Средние концентрации инсулина в плазме (± SEM) через определенные временные интервалы после приема 120 мг натеглинида, 0,5 и 2 мг репаглинида и плацебо за 10 минут до еды
Рис. 4. Средняя концентрация глюкозы в плазме (± SEM) после приема 120 мг натеглинида, 0,5 и 2 мг репаглинида и плацебо за 10 минут до еды
Рис. 5. Средняя концентрация глюкозы в плазме (± SEM) через определенные временные интервалы после приема 120 мг натеглинида, 0,5 и 2 мг репаглинида и плацебо за 10 минут до еды
Сахарный диабет (СД) 2 типа является одной из важнейших проблем современного здравоохранения. Распространенность этого заболевания по всему миру ежегодно увеличивается в геометрической прогрессии. Актуальность лечения СД 2 типа определяется высокими показателями заболеваемости, инвалидизации и смертности в результате микро- и макрососудистых осложнений диабета.
Согласно определению Американской диабетической ассоциации (2012), СД 2 типа представляет собой группу метаболических нарушений, характеризующихся прогрессирующей гипергликемией, которая является результатом нарушения секреции инсулина на уровне бета-клеток поджелудочной железы, выраженной инсулинорезистентностью или сочетанием обоих этих факторов. Для СД 2 типа характерно сочетание с ожирением, артериальной гипертонией, дислипидемией, что является мощным предиктором сердечно-сосудистых заболеваний и метаболического синдрома.
Несмотря на то что наиболее ранним и значимым патогенетическим фактором СД считается инсулинорезистентность, следует отметить, что гипергликемия может развиться только при условии наличия патологии на уровне островкового аппарата поджелудочной железы. Именно морфологический и/или функциональный дефект ее бета-клеток определяет выраженность и прогрессию гипергликемии, а следовательно, и возможности коррекции этого тяжелого заболевания.
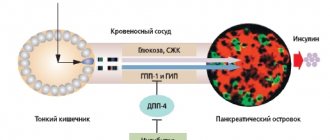
Известно, что поджелудочная железа взрослого человека секретирует около 35–50 ЕД инсулина в сутки (0,6–1,2 ЕД/кг веса в сутки), необходимых для поддержания нормального углеводного метаболизма. Различают базальную и стимулированную секрецию инсулина. Базальная секреция инсулина происходит приблизительно со скоростью 1 ЕД/ч (24 ЕД в сутки) и обеспечивает снижение продукции глюкозы печенью, нормальный диапазон гликемии натощак и поддержание физиологических уровней свободных жирных кислот (СЖК). Стимулированная (пищевая) секреция инсулина составляет не менее 50–60% от суточной продукции и обеспечивает регуляцию концентрации глюкозы крови после приема пищи. Продукция стимулированного инсулина в значительной степени зависит от количества съеденных углеводов и в норме характеризуется двумя фазами – ранней (первой, острой) и отсроченной (второй). Наибольшее значение имеет ранний пик секреции инсулина. Именно этот процесс обеспечивает угнетение секреции глюкагона и продукции глюкозы печенью, повышение периферической чувствительности тканей-мишеней к действию инсулина и подавление липолиза (рис. 1).
При СД 2 типа наблюдаются многочисленные комплексные нарушения секреции инсулина на уровне бета-клеток поджелудочной железы, что ухудшает утилизацию глюкозы и ее использование как приоритетного энергетического субстрата. По данным проспективного исследования UKPDS (United Kingdom Prospective Diabetes Study), уже на момент манифестации СД 2 типа секреция инсулина может быть снижена в среднем на 50%, а в последующем функция бета-клеток снижается примерно на 4–6% в год в зависимости от степени компенсации [1]. Наряду с истинным снижением числа функционирующих бета-клеток в силу их ускоренного апоптоза чрезвычайно значимым фактором уменьшения секреции инсулина является потеря чувствительности этих клеток к глюкозе, а также нарушение пульсового характера секреции.
Механизмы, ответственные за снижение инсулинсекреторной функции бета-клеток, не изучены, однако доказан прогрессирующий характер этого нарушения независимо от вида гипогликемизирующего воздействия (диетотерапия, прием пероральных сахароснижающих препаратов (ПСП), инсулинотерапия).
В современной эндокринологии среди основных причин нарушения секреторной активности бета-клеток выделяют как генетические, так и внешнесредовые факторы, а также метаболические нарушения (патогенетическая липотоксичность, глюкозотоксичность, амилоидоз).
Функциональная неполноценность бета-клеток островкового аппарата поджелудочной железы является независимым мощным фактором развития и последующей прогрессии СД 2 типа. Именно поэтому медикаментозные технологии, направленные на восстановление ее секреторных функций, являются приоритетным направлением в лечении заболевания. Главная цель терапии СД 2 типа – достижение уровня глюкозы плазмы крови, максимально приближенного к нормальному, при условии отсутствия риска развития гипогликемий.
Современный подход к лечению СД 2 типа предполагает индивидуализацию целей и методов терапии заболевания в зависимости от возраста пациента, наличия у него сопутствующей сердечно-сосудистой патологии, степени тяжести диабетических осложнений, ожидаемой продолжительности жизни больного. Не менее важное значение имеет снижение уровня НbА1с (гликированного гемоглобина) до определенного целевого значения [2]. Следует отметить, что уровень НbА1с 7% и выше должен стать сигналом к коррекции/интенсификации терапии для уменьшения микро- и макрососудистых осложнений, улучшения отдаленного прогноза СД.
При лечении СД 2 типа необходимо учитывать следующее:
- риск развития осложнений СД зависит от скорости компенсации и уровня достигнутой гликемии и не зависит от метода лечения;
- интенсивный контроль гликемии по сравнению с традиционным лечением может увеличивать частоту гипогликемий, при этом не влияет на уровень общей и сердечно-сосудистой смертности на фоне СД, но в то же время способствует уменьшению риска микрососудистых осложнений;
- НbA1c является основным интегральным показателем гликемического контроля;
- для максимального снижения риска микрососудистых и нейропатических осложнений у большинства пациентов следует стремиться к достижению уровня НbA1c в диапазоне 6,5–7%;
- у пациентов со склонностью к гипогликемиям (особенно тяжелым), небольшой ожидаемой продолжительностью жизни, выраженными макрососудистыми осложнениями или тяжелой сопутствующей патологией допускается целевой уровень НbA1c 7–8%;
- у больных со стабильным контролем СД и достигнутыми целевыми показателями гликемии целесообразно проводить оценку уровня НbA1c не реже 1 раза в 6 месяцев, а при изменении лечения или недостигнутом целевом показателе гликемии – 1 раз в 3 месяца;
- постпрандиальную гликемию следует рассматривать в качестве самостоятельного (наряду с уровнем НbA1c) важнейшего показателя целевого гликемического контроля, определяющего развитие диабетической ретинопатии, атеросклероза, риск инфаркта миокарда и смерти.
Кроме нормализации углеводного обмена, важными компонентами лечения СД являются снижение артериального давления (АД) до уровня менее 130/80 мм рт. ст. и нормализация уровня липидов крови (табл. 1).
Лечение СД 2 типа включает следующие обязательные компоненты:
- изменение образа жизни больного (диета, физические нагрузки, отказ от вредных привычек –
- курение, употребление алкоголя);
- контроль всех изменяемых факторов риска;
- прием антигипергликемических препаратов с момента дебюта заболевания;
- своевременная комбинированная терапия ПСП, инсулинотерапия.
- Успех лечения СД во многом зависит от комплаентности пациента, степени его мотивации, информированности об особенностях своего заболевания. У большинства пациентов предпочтительно применение пероральных сахароснижающих препаратов по сравнению с инъекционными формами лекарственных средств. В связи с этим особого внимания заслуживают препараты фармакологической группы меглитинидов (репаглинид), которые оказывают влияние на показатели гликемии натощак, постпрандиальной гликемии и НbА1с. Эта группа ПСП используется в мире достаточно широко, но все же существенно реже, чем препараты класса сульфонилмочевины (ПСМ).
«Новые» секретагоги – меглитиниды – преимущественно оказывают стимулирующее влияние на бета-клеточную секрецию инсулина. Репаглинид – препарат группы меглитинидов с более быстрым началом и меньшей продолжительностью действия, чем ПСМ, представляет собой производное карбамоил-метил-бензоевой кислоты. Он стимулирует секрецию инсулина, связываясь с собственным специфичным участком с молекулярной массой 36 кДа, являющимся частью АТФ-зависимого калиевого канала, что обусловливает его специфические фармакологические свойства. Фармакологическое действие репаглинида начинается через 5–10 минут после его приема, что позволяет больному принимать препарат непосредственно перед едой. Пик концентрации репаглинида в плазме достигается через 40 минут – 1 час, что позволяет регулировать уровень постпрандиальной гликемии. Репаглинид in vitro (в отличие от ПСМ) не стимулирует секрецию инсулина бета-клетками при отсутствии в среде глюкозы, но при концентрации глюкозы более 5 ммоль/л оказывается в несколько раз активнее, чем ПСМ. Препарат быстро инактивируется (период полувыведения 40 минут – 1 час), что приближает уровень секреции инсулина после приема пищи к физиологическому профилю, не вызывая стойкой гиперинсулинемии.
Еще одним важным свойством репаглинида является отсутствие прямого влияния на экзоцитоз и подавления биосинтеза инсулина в бета-клетках [3]. Инсулинсекреторная активность меглитинидов определяет мощность гипогликемизирующего эффекта, возможность добиться целевой компенсации СД за короткий период времени, обеспечивая при этом безопасность препаратов. Стимулированный уровень инсулина возвращается к исходному через 3 часа после приема препарата, что снижает вероятность гипогликемических эпизодов. На фоне применения репаглинида не было зарегистрировано ни одного случая гипогликемической комы. Щадящая стимуляция секреции инсулина важна и с точки зрения замедления истощения секреторной активности бета-клеток и быстрой прогрессии СД, а также развития кардиоваскулярной патологии.
Для оценки особенностей инсулинсекреторной активности различных препаратов группы меглитинидов проводились исследования, которые показали, что прием препаратов группы меглитинидов приводил к достоверному увеличению концентрации инсулина в плазме после еды по сравнению с плацебо. В течение 30-минутного интервала после приема пищи (10–40 минут после приема препарата) натеглинид в дозе 120 мг приводил к наиболее быстрому увеличению концентрации инсулина по сравнению с 2 и 0,5 мг репаглинида и плацебо (рис. 2), со средней скоростью 2,3, 1,3, 1,15 и 0,8 мкЕД/мл/мин соответственно. Концентрация инсулина в плазме крови на 10-й и 15-й минутах после приема натеглинида была существенно выше (p 2 мг (105,4 ± 19,6 мкЕД/мл) и 0,5 мг (78,7 ± 17,1 мкЕД/мл) репаглинида. По достижении пиковых значений концентрация инсулина быстро снижалась при приеме натеглинида и через 2 часа была идентична таковой при приеме плацебо. Через 1 час после приема 2 мг репаглинида средняя концентрация инсулина в плазме была значительно выше, чем при приеме натеглинида в любой временной точке (p
Быстрое начало действия натеглинида привело к более высокому среднему содержанию инсулина в плазме в интервале 0–0,5 часов и 0–0,75 часов после приема препарата, по сравнению с 0,5 мг (p 6 мкЕД/мл) (p
Стимулирующее влияние меглитинидов на секрецию инсулина в ответ на нагрузку/потребление углеводов чрезвычайно важно, поскольку препараты этой группы снижают постпрандиальные уровни гликемии, улучшая состояние метаболического контроля. Уровень глюкозы крови после приема пищи обратно пропорционален периферической утилизации глюкозы тканями-мишенями и является важнейшим компонентом гликемической триады, ответственной за развитие отдаленных осложнений СД 2 типа. Такое серьезное внимание, уделяемое постпрандиальным уровням глюкозы, обусловлено тем, что в состоянии после приема пищи человек находится большую часть жизни. Патофизиологические последствия постпрандиальной гликемии определяют риск развития микро- и макрососудистых диабетических нарушений и прогрессирования атеросклероза. Острая постпрандиальная гликемия вызывает активацию свертывающей системы крови, функции тромбоцитов, повышает активность ренин-ангиотензин-альдостероновой системы. В условиях персистирующей гипергликемии формируются количественные и качественные изменения липидного профиля атерогенного характера, увеличивается выработка протеинкиназы С, активируются сосудосуживающие факторы, снижается биологическая активность NO, запускается процесс клеточного оксидативного стресса, происходит активация NF-κВ-рецепторов и, как следствие, развитие эндотелиальной дисфункции и атерогенеза.
Результаты исследований показали, что средний уровень глюкозы плазмы быстро возрастал после завтрака и достигал пика через 45 минут после приема каждого из исследуемых препаратов группы меглитинидов (рис. 4). Пиковые концентрации глюкозы были ниже после приема натеглинида по сравнению с репаглинидом в обеих дозах и плацебо (p
Среднее содержание глюкозы в интервале 0–0,75 часа было меньше после приема натеглинида по сравнению с остальными препаратами (p В интервале 2–8 часов после приема натеглинида средний уровень гликемии был идентичен таковому при приеме плацебо, в то время как на фоне приема репаглинида в обеих дозировках наблюдался пролонгированный гипогликемизирующий эффект по сравнению с плацебо (p
Достоверное снижение постпрандиальной гликемии доказывает важнейшую роль ранней фазы секреции инсулина, улучшающейся на фоне приема меглитинидов. Оба препарата позволяли эффективно уменьшать уровень гликемии в течение двух часов после приема, вызывая высокую по амплитуде секрецию инсулина. Однако на фоне репаглинида восстановление исходных показателей гликемии происходило медленнее. Относительно медленное начало и большая продолжительность действия репаглинида закономерно приводили к более выраженной динамике постпрандиальной гликемии и гиперинсулинемии. Начальные фармакокинетические профили натеглинида и репаглинида не отличаются, оба препарата имеют короткий период полужизни в кровотоке (1–1,5 часа). В отличие от достоверно более короткого периода полужизни репаглинида в плазме, длительная стимуляция секреции инсулина после его приема указывает на более продолжительный фармакодинамический эффект за счет пролонгированного рецепторного ответа [4].
Инактивация репаглинида происходит в печени, более 90% его выводится с желчью, что позволяет применять препарат у больных не только на поздних стадиях диабетического поражения почек, но и при сопутствующей почечной патологии иного генеза.
Репаглинид следует принимать в дозе 0,5–4 мг перед основными приемами пищи 2–4 раза в сутки. Удобная дозировка и режим приема препарата позволяют больному соблюдать режим и кратность питания. В случае пропуска приема пищи (например, обеда) прием препарата также пропускается. Такой режим приема препарата создает большое преимущество как для молодых пациентов, ведущих активный образ жизни, так и для лиц пожилого возраста, поскольку не снижается качество жизни и не возрастает риск гипогликемий. Максимальная доза репаглинида может составлять 16 мг в сутки, однако в современных рекомендациях подчеркивается необходимость своевременного перехода на комбинированную терапию и необоснованность применения максимальных доз любого ПСП. Репаглинид в качестве монотерапии может рекомендоваться пациентам с СД 2 типа как альтернатива метформину в случае его непереносимости или наличия противопоказаний. На ранних стадиях диабета, когда масса и секреторный потенциал бета-клеток частично сохранены, применение репаглинида у больных СД 2 типа может обеспечить хороший терапевтический результат. Следует особо подчеркнуть возможности прандиальной регуляции на фоне использования репаглинида, что позволяет предположить его эффективность в комбинированной терапии. Репаглинид можно сочетать с метформином или базальной инсулинотерапией и рекомендовать на всех этапах интенсификации сахароснижающей терапии.
В России доступен оригинальный препарат репаглинида – НовоНорм производства , а с 2011 г. – еще и зарегистрированный под названием Диаглинид препарат производства российской . Исследования биоэквивалентности отечественного препарата доказали высокую эффективность и безопасность Диаглинида, максимально близкую к оригинальному препарату. Значения фармакокинетических параметров репаглинида, полученные при сравнительном изучении тестируемого и оригинального препаратов, согласовывались с данными литературных источников и достоверно не различались между собой. Максимальная концентрация репаглинида в плазме крови здоровых добровольцев достигалась при приеме Диаглинида в среднем через 0,95 ± 0,69 ч, а НовоНорма – через 1,35 ± 1,02 ч и составила 32,5 ± 20,2 нг/мл и 31,1 ± 11,7 нг/мл соответственно. Средние значения площади под фармакокинетической кривой AUC0-t при приеме тестируемого и референсного препаратов также имели близкие значения: 46,4 ± 24,4 нг/ч/мл и 46,1 ± 16,6 нг/ч/мл соответственно. Степень относительной биологической доступности репаглинида при приеме таблеток Диаглинид по отношению к НовоНорму составила в среднем 103,4 ± 43,2% (ДИ (доверительный интервал) 87,1–101,9%). Нежелательные явления при однократном приеме таблеток Диаглинида и НовоНорма были схожими и классифицированы как проявления основного фармакодинамического эффекта [5].
Несмотря на то что в российских, европейских и американских алгоритмах лечения СД 2 типа меглитиниды отнесены к препаратам резерва, по мнению международных экспертов, репаглинид должен рассматриваться как подходящая или даже предпочтительная терапия в особых ситуациях или у отдельных групп пациентов. Результаты многочисленных рандомизированных плацебоконтролируемых исследований и отчеты по безопасности доказывают:
- высокую сахароснижающую эффективность репаглинида, подтвержденную достоверной положительной динамикой базальной, постпрандиальной гликемии и уровня НbА1с на разных стадиях СД как в монотерапии, так и в комбинации с препаратами других фармакологических групп;
- репаглинид обладает аналогичной ПСМ, метформину или глитазонам эффективностью при применении как в монотерапии, так и в составе любой комбинации. Ряд исследований продемонстрировал превосходство репаглинида над этими препаратами в отношении влияния на постпрандиальную гликемию;
- на фоне терапии репаглинидом развивается сопоставимое или меньшее количество эпизодов гипогликемий по сравнению с ПСМ, репаглинид обладает более высоким профилем безопасности в отношении увеличения массы тела, чем ПСМ, глитазоны или инсулины;
- репаглинид не изучался в контексте влияния на общую смертность, сердечно-сосудистую заболеваемость и смертность от кардиоваскулярных причин, однако доказано его положительное влияние на толщину интима-медиа сосудистой стенки, маркеры хронического неспецифического воспаления, липидные параметры, тромботическую агрегацию, эндотелиальную дисфункцию, оксидативный стресс, уровень адипонектина;
Репаглинид может рассматриваться как альтернатива метформину в монотерапии и в комбинации с ним в следующих случаях:
- если требуется гибкая титрация дозы (у пациентов пожилого возраста, в период религиозных постов и т.п.);
- при склонности больного к перееданию или при необходимости коррекции преимущественно постпрандиальной гликемии;
- при сопутствующей патологии почек диабетического и иного генеза.
Таким образом, репаглинид может применяться для управления СД 2 типа на разных стадиях заболевания, в любых возрастных группах, при отсутствии или наличии диабетических осложнений.