Хронический болевой синдром продолжает оставаться одной из важных медико-социальных проблем современного общества, поскольку значимо влияет на функциональную активность и трудоспособность пациентов, существенно дезадаптирует и снижает качество жизни от 15% до 40% людей в экономически развитых странах [1] и связан с увеличением смертности и повышенной заболеваемостью [2–6]. Неврологические заболевания являются одной из ведущих причин возникновения и хронизации боли.
Невропатическая боль (НБ) — один из распространенных вариантов хронического болевого синдрома [7], наблюдается вследствие поражения или заболевания центральной или периферической соматосенсорной нервной системы на любом уровне и встречается в популяции в 7–10% случаев [8]. НБ отличается характерным клиническим паттерном и многообразием сенсорных проявлений и симптомов, большей интенсивностью и длительностью болевого синдрома, хроническим и чаще рецидивирующим течением и сопровождается разнообразными коморбидными патологическими состояниями, что в итоге формирует сложную для диагностики полиморфную картину болевого синдрома. Вместе с тем анализ предъявляемых жалоб, история повреждения или заболевания соматосенсорной нервной системы, данные осмотра пациента, а также результаты дополнительных методов обследования, объективно подтверждающих поражение соматосенсорной системы, способное привести к возникновению НБ, позволяют выявить данный вариант болевого синдрома.
Основные принципы клинической диагностики НБ [с измен. 9, 10]:
Внимательно выслушать, как
пациент описывает боль — характерные словесные характеристики: «жжение», «горение», «прострелы», «удары током», «покалывание», «онемение», «жгучие» и т. д.
При неврологическом осмотре обратить внимание, есть ли
у пациента характерные нарушения чувствительности — сочетание «позитивных» (симптомов раздражения — гипестезии, анестезии, гипалгезии, аналгезии) и «негативных» (симптомов выпадения — спонтанной боли, дизестезии, парестезии, аллодинии, гипералгезии) сенсорных феноменов.
При анализе болевого синдрома соотнести,
совпадает ли зона предъявляемой боли с выявленными нарушениями чувствительности; локализация описанного болевого синдрома соответствует определенной нейроанатомической зоне — зоне иннервации соответствующей нервной структуры.
Пациент с хроническим болевым синдромом всегда представляет для врачей непростую клиническую задачу, что в том числе связано с наличием разнообразной коморбидной патологии, в частности тревожных и депрессивных нарушений, негативно влияющих на эффективность проводимого лечения и значимо снижающих комплаентность этой категории больных. Особенно трудными и «неудобными» в этой связи пациентами являются больные с хронической НБ, поскольку данный вариант болевого синдрома поздно диагностируется, хуже поддается терапии, отличается рецидивирующим течением и лишь немногим пациентам удается полностью купировать боль. В подавляющем большинстве случаев у пациентов с хронической НБ наблюдаются коморбидные состояния и заболевания, весомо утяжеляющие и без того мучительное существование этих больных [10].
Наиболее эффективным и стратегически оправданным при ведении пациентов с хронической НБ является комплексный и мультидисциплинарный подход, подразумевающий фармакологическую терапию препаратами с доказанной эффективностью, немедикаментозные методы лечения и терапию коморбидных расстройств, особенно тревожных, депрессивных проявлений и нарушения сна. Лишь при недостаточной эффективности указанных направлений терапии применяют малоинвазивные и хирургические методы лечения. Следует отметить, что фармакотерапия хронической НБ должна проводиться длительно и непрерывно, с учетом нозологии, коморбидности и выбора наиболее безопасного лекарственного средства. Начинать терапию следует с минимальных доз препарата с плавной титрацией до терапевтически эффективных, проводить анализ переносимости и параллельный мониторинг побочных или нежелательных явлений [11]. Среди препаратов первой линии терапии рассматриваются лекарственные средства из группы антиконвульсантов (габапентин и прегабалин), селективных ингибиторов обратного захвата серотонина и норадреналина (СИОЗСН) (дулоксетин и венлафаксин) и трициклических антидепрессантов (амитриптилин, нортриптилин и имипрамин) [10].
При выборе лекарственного средства важно учитывать патогенетические механизмы формирования и поддержания хронического болевого синдрома, среди которых несомненную и важную роль играют нарушенное взаимодействие ноцицептивной и антиноцицептивной систем и феномен дезингибиции, наблюдающийся при недостаточной функциональной активности нисходящих антиноцицептивных влияний. И чем дольше существует и более выражен этот патологический процесс, тем более мучительный характер рецидивирующей боли может наблюдаться у пациента [12]. Основными медиаторами антиноцицептивной системы являются биогенные амины: эндорфины, серотонин, норадреналин и дофамин, поэтому лекарственные средства, которые активизируют и нормализуют их обмен, усиливают таким образом функциональную активность антиноцицептивной системы, что приводит к снижению интенсивности и частоты возникновения боли. Это наркотические анальгетики, трициклические антидепрессанты, селективные ингибиторы обратного захвата серотонина (СИОЗС) и СИОЗСН, причем именно антидепрессанты из группы СИОЗСН оказались эффективными и наиболее перспективными для терапии пациентов с хроническим болевым синдромом. Следует заметить, что из существующих на российском рынке препаратов из этой группы дулоксетин обладает большим сродством к рецепторам норадреналина, что предполагает большую эффективность этого лекарственного средства в терапии хронической боли [13]. Проведенные исследования [14–16] убедительно продемонстрировали выраженное влияние дулоксетина на серотонинергические и норадренергические системы, что повышает функциональную активность нисходящей системы подавления боли и оказывает обезболивающее действие независимо от его антидепрессивного эффекта. Именно поэтому изначально рассматриваемый в качестве антидепрессанта [17] дулоксетин достаточно быстро начал использоваться в терапии хронического болевого синдрома при широком спектре различных заболеваний. Многочисленные клинические исследования показали выраженный терапевтический эффект дулоксетина при лечении пациентов с остеоартритом [18–20], болью в нижней части спины [19, 21–23], болевой формой диабетической нейропатии [19, 24–28], фибромиалгией [19, 24], а также другими заболеваниями и патологическими состояниями, сопровождающимися хронической болью [29–32].
Болевая форма диабетической невропатии
При болевой форме диабетической невропатии применяется целый ряд фармакологических средств для лечения хронической НБ, сравнение эффективности которых в одном из последних метаанализов [24] рандомизированных контролируемых исследований (РКИ) продемонстрировало высокий результат дулоксетина. Клиническая эффективность дулоксетина убедительно показана в большом количестве исследований пациентов с хроническим болевым синдромом, обусловленным диабетической невропатией [19, 24–28, 30]. В частности, Кохрановский обзор 8 исследований применения у 2728 пациентов дулоксетина в суточной дозе 60 мг продемонстрировал его эффект даже при крат-косрочной терапии в течение 12 нед. в виде уменьшения выраженности боли на 50% и более (ОР 1,73, 95% ДИ 1,44–2,08) [24]. При этом побочные явления достоверно не отличались от таковых в группе плацебо, не наблюдалось серьезных нежелательных реакций [24]. В другом многоцентровом 6-месячном сравнительном проспективном исследовании эффективности дулоксетина, габапентина и прегабалина более высокая эффективность при купировании болевого синдрома, согласно краткому опроснику оценки боли BPI (англ. Brief Pain Inventory), была обнаружена у дулоксетина, как и достоверное уменьшение при его приеме выраженности тревоги и депрессии, согласно Госпитальной шкале тревоги и депрессии HADS (англ. Hospital Anxiety and Depression Scale) [25].
Следует заметить, что анальгетический эффект дулоксетина развивается гораздо раньше, чем антидепрессивный, что продемонстрировано в мультицентровом двойном слепом плацебо-контролируемом исследовании 348 пациентов с болевой формой диабетической нейропатии при сахарном диабете обоих типов, кроме того, препарат не оказывал влияния на контроль сахарного диабета и хорошо переносился [26]. Полученные результаты доказывают значимое влияние дулоксетина на основные патогенетические механизмы формирования хронической боли — процессы дезингибиции, нормализуя таким образом нисходящий контроль боли, а не уменьшение выраженности болевого синдрома посредством лечения только депрессивных нарушений, практически облигатно наблюдающихся у больных с длительным болевым синдромом. Об указанных особенностях дулоксетина следует сообщать пациентам до начала терапии, что позволит улучшить приверженность данной терапии и дальнейшие взаимоотношения врача и пациента. Немаловажно отметить, что у большинства пациентов с сахарным диабетом наблюдаются сердечно-сосудистые нарушения, поэтому применение дулоксетина более безопасно и предпочтительно, в частности, по сравнению с амитриптилином [26, 33].
Особые указания по применению препарата Дулоксетин
Пациенты с высоким риском суицида в период лечения должны находиться под строгим наблюдением, поскольку до наступления выраженной ремиссии не исключена возможность суицидальных попыток. Применение дулоксетина у пациентов младше 18 лет не изучалось, поэтому его не следует назначать лицам этой возрастной группы. Как и в случае применения других лекарственных средств, действующих на ЦНС, у пациентов с маниакальным синдромом, судорожными припадками в анамнезе дулоксетин необходимо использовать с соблюдением осторожности. Были сообщения о появлении мидриаза в связи с приемом дулоксетина, поэтому применять дулоксетин у пациентов с повышенным внутриглазным давлением или при опасности развития острой узкоугольной глаукомы следует с осторожностью. Сообщалось о повышении концентрации дулоксетина в плазме крови у пациентов с тяжелой почечной недостаточностью (клиренс креатинина ≤30 мл/мин) или выраженной печеночной недостаточностью. Таким пациентам рекомендуется назначать дулоксетин в более низкой начальной дозе. У некоторых пациентов прием дулоксетина приводит к повышению АД. У пациентов с АГ (артериальная гипертензия) и/или другими заболеваниями сердечно-сосудистой системы рекомендуется проводить мониторинг АД. При клинических исследованиях отмечалось повышение активности печеночных ферментов в крови. У большинства пациентов, получавших дулоксетин, это повышение было преходящим и исчезало после прекращения лечения дулоксетином. Значительное повышение активности ферментов печени (больше чем в 10 раз выше нормы) или поражение печени с холестазом, или значительное повышение активности ферментов в сочетании с поражением печени возникало редко, в некоторых случаях было связано со злоупотреблением алкоголя. Дулоксетин не оказывал мутагенного действия в опытах in vitro и in vivo. Адекватные и контролируемые исследования действия дулоксетина у беременных не проводились, поэтому его применение в период беременности не рекомендуется. Дулоксетин выделяется с грудным молоком. Приблизительная суточная доза у грудного ребенка составляет 0,14% дозы для кормящей женщины (мг/кг). Безопасность применения дулоксетина у грудного ребенка не установлена, поэтому кормление грудью во время приема дулоксетина не рекомендуется. В период лечения дулоксетином пациенты должны воздерживаться от потенциально опасных видов деятельности, которые требуют повышенного внимания и быстроты психомоторных реакций.
Хронический болевой синдром в нижней части спины
Боль в нижней части спины продолжает оставаться одной из наиболее актуальных проблем современного человека и частой причиной обращения к врачу. Среди пациентов с хронической болью в нижней части спины (ХБНС) признаки невропатической боли наблюдаются в среднем в 37% случаев [21], однако наблюдаемая в клинической практике низкая диагностика НБ предполагает гораздо больший процент ее наличия.
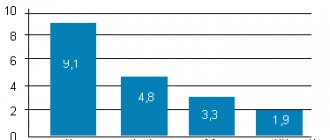
Анализ данных 4 многоцентровых двойных слепых рандомизированных плацебо-контролируемых исследований применения дулоксетина для лечения ХБНС у 1295 пациентов в суточной дозе 60 мг на протяжении 12–14 нед. показал наибольшую эффективность данного препарата в виде большего количества пациентов, у которых наблюдалось снижение боли на 30% и более на момент завершения лечения относительно исходного уровня (59,7% по сравнению с 47,8% в группе плацебо, р<0,001), а также большего снижения степени выраженности боли — на 50% и более (48,6% в сравнении с группой плацебо 35,1%; р<0,001) [21]. Следует отметить, что у этих больных определялись минимальные депрессивные нарушения (низкие баллы по шкале оценки депрессии Бека). Важно заметить, что предикторами наибольшей эффективности дулоксетина, по мнению исследователей, были ранний ответ на терапию — в первые 2 нед. от ее начала (улучшение не менее чем на 15%, согласно опроснику BPI), применение в суточной дозе 60 мг и наличие боли в нескольких областях [21]. Любопытно, что другие исследователи, помимо раннего ответа при приеме дулоксетина в суточной дозе 60 мг, отмечали в качестве предиктора его дальнейшего клинического эффекта у пациентов с ХБНС возникновение побочных реакций на начальном этапе терапии [22].
Другой анализ данных 3 двойных слепых плацебо-контролируемых исследований клинического применения дулоксетина у пациентов с ХБНС обнаружил, что значительно превосходящий плацебо анальгетический эффект дулоксетина в суточной дозе 60 мг на 91% связан с его прямым анальгетическим действием и лишь на 9% — с антидепрессивным, т. е. непрямым эффектом [23]. Полученные результаты доказывают важную роль дулоксетина в терапии хронической боли (в том числе НБ), применение которого направлено на восстановление функциональной активности нисходящих норадренергической и серотонинергической антиноцицептивных систем, что приводит к уменьшению выраженности боли, а также тревожных, депрессивных расстройств и нарушения сна. Напротив, системный анализ исследований эффективности лекарственных средств в терапии пациентов с ХБНС [34] не обнаружил разницы в анальгетическом эффекте между трициклическими антидепрессантами или препаратами из группы СИОЗС по сравнению с плацебо. В клинической практике лечение пациентов с хронической скелетно-мышечной болью, в том числе с ХБНС, начинается с суточной дозы 30 мг, через 7–10 дней прием составляет 60 мг, ряд исследователей при необходимости увеличивают суточную дозу до 120 мг [23].
В метаанализе 9 РКИ [20] эффективности и безопасности дулоксетина в терапии пациентов с ХБНС было продемонстрировано не только его влияние на выраженность боли, но и существенное улучшение функциональной составляющей, повседневной активности, эмоционального фона и качества жизни, причем не было выявлено статистически значимой разницы в серьезных нежелательных явлениях дулоксетина по сравнению с группой плацебо.
Все эти многочисленные исследования позволили включить дулоксетин в алгоритм лечения ХБНС в рекомендациях Американской коллегии врачей [35].
Применение препарата Дулоксетин
При депрессии и диабетической нейропатии назначают внутрь в дозе 60 мг 1 раз в сутки ежедневно, независимо от приема пищи. Некоторым пациентам может быть рекомендовано назначение в более высокой дозе (до максимальной —120 мг/сут в 2 приема). Возможность назначения в дозах, превышающих 120 мг/сут не изучалась. Начальное дозирование для пациентов в конечной стадии почечной недостаточности (клиренс креатинина ≤30 мл/мин) составляет 30 мг 1 раз в сутки ежедневно. Пациентам с циррозом печени назначают в более низкой начальной дозе или с большими интервалами между приемами. Какой-либо коррекции дозы дулоксетина у пациентов пожилого или преклонного возраста не требуется. У пациентов младше 18 лет действие дулоксетина не изучалось.
Хронический болевой синдром при остеоартрите
Остеоартрит (ОА) является самым частым заболеванием суставов, его ведущее проявление — хроническая боль, клинический анализ которой нередко демонстрирует характерные сенсорные проявления НБ [20]. Наиболее часто наблюдается ОА коленных суставов.
Результаты двойного слепого плацебо-контролируемого исследования [36] применения дулоксетина у пациентов с хронической болью при ОА коленного сустава показали значимое по сравнению с плацебо уменьшение выраженности боли и улучшение показателей качества жизни вне зависимости от того, какие именно нестероидные противовоспалительные препараты (НПВП) применялись ранее. По мнению исследователей, дулоксетин может рассматриваться как альтернатива применению НПВП при ОА коленного сустава, если их использование не показано в связи с имеющимися кардиоваскулярными или другими рисками [37]. Эффективность дулоксетина в купировании боли и улучшении функционирования при ОА также подтверждает системный обзор 4 рандомизированных исследований [20]. В метаанализе 3 РКИ [18] с участием 1011 пациентов было продемонстрировано статистически значимое влияние дулоксетина на уровень и частоту возникновения боли при ОА, улучшение функциональной активности, а также отсутствие значимых нежелательных или побочных явлений по сравнению с плацебо через 10–13 нед. терапии.
В другом рандомизированном двойном слепом плацебо-контролируемом исследовании [38] пациентов с ОА коленных суставов показано достоверное уменьшение боли, скованности, функциональной недостаточности и улучшение качества жизни на фоне приема дулоксетина на протяжении 14 нед. В рекомендациях Международного общества по изучению остеоартрита OARSI (англ. Osteoarthritis Research Society International) 2022 г. [39] дулоксетин рассматривается в качестве терапии ОА коленного сустава у пациентов с распространенным хроническим болевым синдромом и депрессивными нарушениями.
Побочные эффекты препарата Дулоксетин
В процессе клинических испытаний отмечались такие побочные явления, как запор, тошнота, сухость во рту, головокружение, повышенная утомляемость, бессонница и головная боль (≥10%). Реже (с частотой ≤10%, но ≥1%) — тахикардия, диспепсия, рвота, снижение аппетита, сонливость, тремор, заторможенность, потливость, ощущение жара, зевание. Со стороны репродуктивной системы отмечались нарушения эякуляции и эрекции (с частотой ≤10%, но ≥1%), снижение либидо и аноргазмия. Редко (≤1%, но ≥0,1%) — гастроэнтерит, стоматит, повышение АД, увеличение массы тела, мышечное напряжение, нарушения вкуса и зрения, ажитация, задержка мочи. Лечение дулоксетином в плацебо-контролируемых клинических испытаниях было связано с незначительным по сравнению с плацебо повышением показателей АлАТ, AсАТ и КФК. В клинических испытаниях дулоксетина для лечения диабетической нейропатии средняя продолжительность заболевания сахарным диабетом составляла приблизительно 11 лет, среднее значение исходной концентрации глюкозы в сыворотке крови натощак — до 163 мг/ дл, средняя начальная концентрация гликозилированного гемоглобина — 7,80%. В этих исследованиях отмечено незначительное повышение начальной концентрации глюкозы в крови натощак через 12 нед у пациентов, принимавших дулоксетин, по сравнению с плацебо, при обычном режиме на протяжении 52 нед. Не отмечено изменений показателя гликозилированного гемоглобина, массы тела пациентов, концентрации липидов (ХС, ЛПНП, ЛПВП, ТГ) или каких-либо побочных эффектов, связанных с сахарным диабетом. По данным постмаркетинговых исследований отмечены такие побочные эффекты: со стороны органа зрения: очень редко (≤0,01%) — глаукома; со стороны гепатобилиарной системы: очень редко (≤0,01%) — гепатит, желтуха; со стороны иммунной системы: очень редко (≤0,01%) — анафилактические реакции; со стороны лабораторных показателей: очень редко (≤0,01%) — повышение активности АлАТ, АсАТ, ЩФ, уровня билирубина в крови; со стороны метаболизма: очень редко (≤0,01%) — гипонатриемия; со стороны кожи: редко (0,01–0,1%) — сыпь; очень редко (≤0,01%) — ангионевротический отек, синдром Стивенса — Джонсона, крапивница; со стороны сердечно-сосудистой системы: очень редко (≤0,01%) — ортостатическая гипотензия и синкопе (особенно в начале лечения).
Передозировка препарата Дулоксетин, симптомы и лечение
Клинические данные по передозировке дулоксетина ограничены. Отмечались случаи передозировки препарата (до 1400 мг), в том числе в комбинации с другими лекарственными средствами, однако они не приводили к летальному исходу. В экспериментах на животных основные проявления токсичности при передозировке отмечались со стороны ЦНС и ЖКТ. Они включали такие симптомы, как тремор, клонические судороги, атаксия, рвота и анорексия. Специфический антидот не известен. Непосредственно после передозировки показано промывание желудка и назначение активированного угля. Следует обеспечить проходимость дыхательных путей. Рекомендуется проводить мониторинг основных показателей жизнедеятельности, в первую очередь сердечной деятельности, при необходимости — симптоматическую и поддерживающую терапию. Дулоксетин имеет большой объем распределения, в связи с чем форсированный диурез, гемоперфузия и обменная перфузия при передозировке малоэффективны.
Список аптек, где можно купить Дулоксетин:
- Москва
- Санкт-Петербург
Взаимодействия препарата Дулоксетин
Дулоксетин не следует назначать одновременно с ингибиторами МАО или в пределах по крайней мере 14 дней после прекращения лечения ингибиторами МАО. С учетом периода полувыведения дулоксетина ингибиторы МАО не следует также назначать по крайней мере на протяжении 5 дней после прекращения лечения дулоксетином. В клинических исследованиях при одновременном назначении теофиллина, субстрата CYP 1A2 с дулоксетином в дозе 60 мг 2 раза в сутки ежедневно не отмечено существенных изменений их фармакокинетики. Эти результаты свидетельствуют о том, что дулоксетин вряд ли будет оказывать клинически значимое действие на метаболизм субстратов CYP 1A2. Поскольку CYP 1A2 принимает участие в метаболизме дулоксетина, одновременное применение дулоксетина с активными ингибиторами CYP 1A2 может приводить к повышению концентрации дулоксетина в плазме крови. Флувоксамин (в дозе 100 мг 1 раз в сутки), будучи активным ингибитором CYP 1A2, снижает клиренс дулоксетина из плазмы крови приблизительно на 77%. В связи с этим при назначении дулоксетина с ингибиторами CYP 1A2 (некоторые хинолоновые антибактериальные средства) целесообразно назначать дулоксетин в более низкой дозе. Дулоксетин является умеренным ингибитором CYP 2D6. При назначении дулоксетина в дозе 60 мг 2 раза в сутки с однократной дозой дезипрамина, который является субстратом CYP 2D6, AUC дезипрамина увеличивается в 3 раза. Одновременное назначение дулоксетина (в дозе 40 мг 2 раза в сутки) увеличивает стационарную AUC тольтеродина (2 мг 2 раза в сутки) на 71%, но не влияет на фармакокинетику 5-гидроксильного метаболита. В связи с этим при назначении дулоксетина с ингибиторами CYP 2D6, которые имеют узкий терапевтический индекс, необходимо соблюдать осторожность. Поскольку CYP 2D6 участвует в метаболизме дулоксетина, одновременное применение дулоксетина с активными ингибиторами CYP 2D6 способно приводить к повышению концентрации дулоксетина в крови. Пароксетин (в дозе 20 мг 1 раз в сутки) снижает клиренс дулоксетина из плазмы крови приблизительно на 37%. В связи с этим при назначении дулоксетина с ингибиторами CYP 2D6 необходимо соблюдать осторожность. При назначении дулоксетина в комбинации с другими лекарственными средствами, влияющими на ЦНС, особенно с подобным механизмом действия, следует соблюдать осторожность. Дулоксетин связывается с белками плазмы крови (90%), поэтому назначение дулоксетина пациенту, принимающему другие лекарственные средства, в значительной степени связывающиеся с белками плазмы крови, может приводить к повышению свободной концентрации любого из этих лекарственных средств.