Последнее десятилетие может рассматриваться как начало инкретиновой эры в терапии сахарного диабета 2 типа (СД2). Фармакологическая реализация инкретинового эффекта позволила стремительно и достаточно широко использовать инкретины в мировой клинической диабетологической практике. Важной отличительной особенностью данного инновационного класса сахароснижающих препаратов является одновременное позитивное воздействие на два патогенетических звена СД2. Инкретины не только способствуют увеличению постпрандиальной глюкозозависимой секреции инсулина β-клетками поджелудочной железы, но и обусловливают снижение синтеза α-клетками контринсулярного гормона глюкагона и, следовательно, интенсивности процесса печеночного глюконеогенеза.
Основными инкретинами энтероинсулярной оси являются глюкагоноподобный пептид-1 (ГПП-1) и глюкозозависимый инсулинотропный полипептид (ГИП). Ингибирование дипептидилпептидазы-4 (ДПП-4), осуществляемое ингибиторами ДПП-4 (глиптинами), позволило пролонгировать время полураспада нативного ГПП-1 с нескольких минут до нескольких часов (рис. 1). Необходимо отметить, что терапевтический потенциал глиптинов определяется физиологической концентрацией ГПП-1.
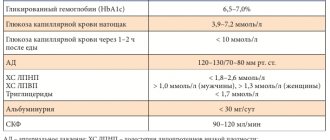
Персонифицированная медицина предполагает индивидуализацию назначения терапии в зависимости от длительности СД2, качества гликемического контроля, риска развития гипогликемий, осложнений СД и имеющихся коморбидных заболеваний, возраста (ожидаемой продолжительности жизни), анамнестических особенностей [2].
Каким требованиям должны отвечать современные сахароснижающие препараты?
• Несомненно и прежде всего – это высокий сахароснижающий потенциал, сохраняющийся на протяжении длительного периода использования. • Снижение уровня гликемии на основе максимально физиологичного воздействия, не вызывающего истощения функциональной активности β-клеток поджелудочной железы. • Снижение вариабельности гликемии и устранение пиков постпрандиальной гипергликемии. • Низкая частота развития гипогликемических эпизодов. • Высокая степень безопасности. • Отсутствие снижения качества жизни пациента. • Приверженность пациента к терапии, удобная фармакологическая форма, возможность производства фиксированных комбинаций, минимизация числа пропущенных приемов. • Положительные негликемические эффекты. • Отсутствие набора массы тела.
Согласно принятым в большинстве стран мира консенсусам и стандартам по ведению пациентов с СД2, препаратом первого выбора в терапии СД2 остается метформин. Установлена его положительная роль в снижении глюконеогенеза, инсулинорезистентности и риска развития онкологических заболеваний. Тем не менее для каждого десятого пациента вследствие развития нежелательных побочных эффектов со стороны желудочно-кишечного тракта прием метформина оказывается неприемлемым. Таким образом, сохраняется проблема выбора препарата второй линии на фоне приема метформина, препарата для стартовой терапии в комбинации с метформином, а также препарата первой линии в случае непереносимости метформина. В соответствии с обновленным консенсусом ADAEASD (American Diabetes Association-European Association for the Study of Diabetes, 2012) ингибиторы ДПП-4 являются одним из перспективных терапевтических подходов к выбору препаратов первой и второй линий терапии [3].
Рассмотрение рынка сахароснижающих препаратов свидетельствует о том, что выбор клиницистов все чаще смещается в сторону назначения пациентам с СД2 ингибиторов ДПП-4. Наибольший опыт, накопленный в ходе проведения клинических испытаний (как преклинических, так и постмаркетинговых), основан на оценке и безопасности ингибитора ДПП-4 ситаглиптина, первого и наиболее изученного представителя класса глиптинов. Препарат Янувия (ситаглиптин, Merck Sharp & Doum, США) был утвержден Управлением по контролю качества пищевых продуктов и лекарственных препаратов (FDA) в 2006 г., Европейским медицинским агентством в 2007 г. Продолжающиеся и уже проведенные рандомизированные клинические исследования (РКИ) с участием ситаглиптина составляют мощную доказательную базу, которая позволяет всесторонне очертить эффективность сахароснижающего действия, негликемические эффект и безопасность его использования. Следует отметить, что ситаглиптин используется в качестве интервенционного или эталонного препарата сравнения. Изучено использование ситаглиптина в виде монотерапии, комбинации с метформином, двойных и тройных комбинаций пероральных сахароснижающих препаратов, комбинации с инсулином. Постмаркетинговые исследования ситаглиптина продолжаются. Следует отметить, что клиническая эффективность комбинации ситаглиптина с препаратом первого выбора метформином послужила предпосылкой к созданию первой фиксированной комбинации ингибитора ДПП-4 и метформина – препарата Янумет (Janumet, Merck Sharp & Doum, США).
Введение
По современным представлениям, сахарный диабет (СД) 2 типа является хроническим прогрессирующим заболеванием, распространенность которого продолжает увеличиваться. Так, по данным Международной федерации диабета (International Diabetes Federation, IDF), в 2017 г. в мире было зафиксировано 425 млн человек в возрасте от 20 до 79 лет, имеющих СД, 5 млн случаев смерти были ассоциированы с осложнениями диабета. По прогнозам IDF, к 2045 г. ожидается рост числа людей с СД до 629 млн человек, у подавляющего большинства из которых будет диагностирован СД 2 типа [1]. По результатам отечественного исследования NATION, реальная численность пациентов с СД в нашей стране составляет не менее 9 млн человек (примерно 6% населения) [2]. Сложная патофизиология СД 2 типа и склонность к прогрессированию требуют многофакторной стратегии в терапии и непрерывного мониторинга ее эффективности.
На сегодняшний день нам известно более 10 патогенетических факторов развития СД 2 типа. Наряду с прогрессирующей дисфункцией β-клеток и резистентностью к инсулину особое значение придается нарушению инкретинового ответа на приемы пищи и увеличению реабсорбции глюкозы в почечных канальцах. Одним из инновационных классов препаратов, воздействующих на инкретиновые механизмы регуляции углеводного обмена, являются ингибиторы дипептидилпептидазы-4 (иДПП-4) (или глиптины). Препараты блокируют инактивацию инкретиновых гормонов, в частности глюкагоноподобного пептида-1 (ГПП-1) и глюкозозависимого инсулинотропного полипептида (ГИП), в результате чего достигается усиление глюкозозависимой секреции инсулина и уменьшение постпрандиального выброса глюкагона (рис. 1).
Рекомендации
- ^ абc
ГРЧ38: Ансамбль выпуск 89: ENSG00000197635 — Ансамбль, Май 2017 - ^ абc
GRCm38: выпуск ансамбля 89: ENSMUSG00000035000 — Ансамбль, Май 2017 - «Справочник человека по PubMed:». Национальный центр биотехнологической информации, Национальная медицинская библиотека США
. - «Ссылка на Mouse PubMed:». Национальный центр биотехнологической информации, Национальная медицинская библиотека США
. - Камеока Дж., Танака Т., Нодзима Й., Шлоссман С.Ф., Моримото С. (июль 1993 г.). «Прямая ассоциация аденозиндезаминазы с антигеном активации Т-клеток, CD26». Наука
.
261
(5120): 466–9. Bibcode:1993Наука … 261..466K. Дои:10.1126 / science.8101391. PMID 8101391. - Хопсу-Хаву В.К., Гленнер Г.Г. (1966). «Новая дипептид-нафтиламидаза, гидролизующая глицил-пролил-бета-нафтиламид». Histochemie. Гистохимия. Histochimie
.
7
(3): 197–201. Дои:10.1007 / bf00577838. PMID 5959122. S2CID 9674831. - Ванхуф Дж., Гуссенс Ф., Де Мистер I, Хендрикс Д., Шарпе С. (июнь 1995 г.). «Мотивы пролина в пептидах и их биологический процессинг». Журнал FASEB
.
9
(9): 736–44. Дои:10.1096 / fasebj.9.9.7601338. PMID 7601338. S2CID 37551773. - ^ аб
Mentlein R (ноябрь 1999 г.). «Дипептидил-пептидаза IV (CD26) — роль в инактивации регуляторных пептидов».
Регуляторные пептиды
.
85
(1): 9–24. Дои:10.1016 / S0167-0115 (99) 00089-0. PMID 10588446. S2CID 22354304. - Чен X (2006). «Биохимические свойства рекомбинантных пролилдипептидаз DPP-IV и DPP8». Дипептидиламинопептидазы
. Успехи экспериментальной медицины и биологии.
575
. С. 27–32. Дои:10.1007/0-387-32824-6_3. ISBN 978-0-387-29058-4 . PMID 16700505. - Барнетт А. (ноябрь 2006 г.). «Ингибиторы DPP-4 и их потенциальная роль в лечении диабета 2 типа». Международный журнал клинической практики
.
60
(11): 1454–70. Дои:10.1111 / j.1742-1241.2006.01178.x. PMID 17073841. S2CID 2645092. - Pro B, Dang NH (октябрь 2004 г.). «CD26 / дипептидилпептидаза IV и ее роль в развитии рака». Гистология и гистопатология
.
19
(4): 1345–51. Дои:10.14670 / HH-19.1345. PMID 15375776. - Мазур К., Шварц Ф., Entschladen F, Ниггеманн Б., Заенкер К.С. (декабрь 2006 г.). «Ингибиторы DPPIV расширяют опосредованное GLP-2 опухолевое действие на раковые клетки кишечника». Регуляторные пептиды
.
137
(3): 147–55. Дои:10.1016 / j.regpep.2006.07.003. PMID 16908079. S2CID 2857735. - Уэсли УФ, МакГроарти М., Хомоюни А. (февраль 2005 г.). «Дипептидилпептидаза ингибирует злокачественный фенотип клеток рака простаты, блокируя путь передачи сигнала основного фактора роста фибробластов». Исследования рака
.
65
(4): 1325–34. Дои:10.1158 / 0008-5472.CAN-04-1852. PMID 15735018. - Бусек П., Малик Р., Седо А. (март 2004 г.). «Активность дипептидилпептидазы IV и / или гомологи структуры (DASH) и их субстраты при раке». Международный журнал биохимии и клеточной биологии
.
36
(3): 408–21. Дои:10.1016 / S1357-2725 (03) 00262-0. PMID 14687920. - Кадзи К., Йошиджи Х., Икенака Й., Ногучи Р., Айхара Й., Духара А., Мория К., Каваратани Х., Шираи Й, Йошии Дж., Янасэ К., Китаде М., Намисаки Т., Фукуи Х (март 2014 г.). «Ингибитор дипептидилпептидазы-4 ослабляет фиброз печени посредством подавления активированных звездчатых клеток печени у крыс». Журнал гастроэнтерологии
.
49
(3): 481–91. Дои:10.1007 / s00535-013-0783-4. PMID 23475323. S2CID 2726091. - Мин ХС, Ким Джи, Ли МХ, Сон Х.К., Кан Й.С., Ли МДж, Ли Джи, Ким Х.В., Ча ДжДж, Чанг Й.Й, Хён Й., Хан Джи, Ча Д.Р. «Ингибитор дипептидилпептидазы IV защищает от почечного интерстициального фиброза на мышиной модели обструкции мочеточника». Лабораторные исследования; Журнал технических методов и патологии
.
94
(6): 598–607. Дои:10.1038 / labinvest.2014.50. PMID 24687121. S2CID 23745972. - Гавр, Пенсильвания, Абэ М., Урасаки Ю., Охнума К., Моримото С., Данг Н.Х. (январь 2008 г.). «Роль CD26 / дипептидилпептидазы IV при раке». Границы биологических наук
.
13
(13): 1634–45. Дои:10.2741/2787. PMID 17981655. - Розеншток Дж., Зинман Б. (апрель 2007 г.). «Ингибиторы дипептидилпептидазы-4 и лечение сахарного диабета 2 типа». Текущее мнение в области эндокринологии, диабета и ожирения
.
14
(2): 98–107. Дои:10.1097 / MED.0b013e3280a02f65. PMID 17940427. S2CID 25482131. - Raj VS, Mou H, Smits SL, Dekkers DH, Müller MA, Dijkman R, Muth D, Demmers JA, Zaki A, Fouchier RA, Thiel V, Drosten C, Rottier PJ, Osterhaus AD, Bosch BJ, Haagmans BL (март 2013 г.) ). «Дипептидилпептидаза 4 представляет собой функциональный рецептор для возникающего коронавируса человека — EMC». Природа
. ScienceNews.
495
(7440): 251–4. Bibcode:2013Натура.495..251р. Дои:10.1038 / природа12005. ЧВК 7095326. PMID 23486063. Сложить резюме –
НаукаНовости
.
Инкретиновый эффект
В основе инкретинового эффекта («incretin» — INtestinal seCRETion INsulin, «кишечноопосредованная» секреция инсулина) лежит более мощная стимуляция секреции инсулина в ответ на поступление глюкозы с пищей по сравнению с парентеральным введением глюкозы в эквивалентной дозе, что возможно за счет выработки инкретиновых гормонов (ГПП-1 и ГИП) в эндокринных К- и L-клетках кишечника и их воздействия на β-клетки. Известно, что за счет инкретинового эффекта у здоровых людей вырабатывается до 50–70% от суточной дозы инсулина. После приема пищи концентрация ГПП-1 в крови повышается в 2–3 раза [3]. Кроме глюкозозависимой секреции инсулина биологическими эффектами ГПП-1 являются также стимуляция биосинтеза инсулина, ингибирование секреции глюкагона, замедление опорожнения желудка, наступление чувства насыщения [4]. Сравнение эффекта от инфузионного введения ГПП-1 и ГИП у людей с СД 2 типа продемонстрировало, что начальная ранняя фаза секреции инсулина восстанавливалась на фоне введения ГИП, а поздняя фаза секреции инсулина (с 20 по 120 мин) сохранялась в ответ на введение ГПП-1. Таким образом, стратегия активации инкретинового ответа стала одной из самых актуальных в терапии СД 2 типа [3]. И один из путей такой активации — ингибирование фермента ДПП-4, разрушающего до 50% ГПП-1 в первые 1–2 мин после поступления в кровоток. Появление иДПП-4 сделало возможным сохранение инкретинового ответа и адекватной постпрандиальной регуляции углеводного обмена у пациентов с СД 2 типа.
Аналоги ГПП-1 в лечении сахарного диабета 2 типа
В настоящее время на Российском рынке имеются два препарата аналогов ГПП-1 — это Байетта (экзенатид) и Виктоза (лираглутид). Эти препараты являются синтетическими аналогами человеческого ГПП-1, но только время действия намного дольше. Они оказывают абсолютно все эффекты человеческого гормона, о которых я говорила выше. Это, несомненно, плюс. Также к плюсам можно отнести уменьшение массы тела в среднем на 4 кг за 6-12 мес. и снижение гликированного гемоглобина в среднем на 0,8-1,8 %. Что такое гликированный гемоглобин и для чего нужно его контролировать, вы может узнать, прочитав статью “Гликированный гемоглобин: как сдавать?”.
К минусам можно отнести:
- Только подкожное введение, т. е. нет таблетированных форм.
- Концентрация ГПП-1 может повышаться в 5 раз, что увеличивает риск гипогликемических состояний.
- Повышаются эффекты только ГПП-1, на ГИП препарат не влияет.
- В 30-40 % могут наблюдаться побочные эффекты в виде тошноты, рвоты, но они носят преходящий характер.
Баета выпускается в одноразовых шприц-ручках (по аналогии с инсулиновыми шприц-ручками) в дозе 250 мкг в 1 мг. Ручки бывают объемом 1,2 и 2,4 мл. В одной пачке — одна ручка. Начинают лечение сахарного диабета с введения дозы в 5 мкг 2 раза в сутки на 1 месяц для улучшения переносимости, а затем, если требуется, дозу повышают до 10 мкг 2 раза в сутки. Дальнейшее повышение дозы не усиливает эффект препарата, но повышает количество побочных эффектов.
Инъекцию Баеты делают за час перед завтраком и ужином, его нельзя делать после еды. Если укол пропущен, то следующий делается в назначенное время по графику. Инъекция назначается подкожно в бедро, живот или плечо. Его нельзя вводить внутримышечно или внутривенно.
Хранить препарат нужно в темном холодном месте, т. е. на дверце холодильника, не допускайте замораживания. Шприц-ручку каждый раз после инъекции нужно хранить в холодильнике. Через 30 дней шприц-ручка с Баетой выкидывается, даже если в ней остался препарат, поскольку после этого времени препарат частично разрушается и не оказывает должного эффекта. Нельзя хранить используемый препарат с присоединенной иглой, т. е. после каждого использования иглу нужно отвинчивать и выбрасывать, а перед новой инъекцией одевать новую.
Баета может совмещаться и с другими сахароснижающими препаратами. Если препарат комбинируется с препаратами сульфонилмочевины (манинил, диабетон и пр.), то их дозу нужно снижать во избежание развития гипогликемии. Про гипогликемию есть отдельная статья, так что рекомендую переходить по ссылке и изучать, если вы еще не сделали этого. Если Баета используется совместно с метформином, то дозы метформина не изменяются, т. к. гипогликемия в этом случае маловероятна.
Виктоза выпускается также в шприц-ручках в дозе 6 мг в 1 мл. Объем шприц-ручки составляет 3 мл. Продается по 1, 2 или 3 шприц-ручки в упаковке. Хранение и использование шприц-ручки аналогично Баете. Лечение сахарного диабета Виктозой проводится 1 раз в сутки в одно и то же время, которое может выбрать сам пациент, независимо от приема пищи. Препарат вводится подкожно в бедро, живот или плечо. Также нельзя его использовать для внутримышечного и внутривенного введения.
Начальная доза Виктозы составляет 0,6 мг в сутки. Через 1 неделю уже можно постепенно увеличить дозу до 1,2 мг. Максимальная доза составляет 1,8 мг, которую можно начинать вводить через 1 неделю после повышения дозы до 1,2 мг. Выше этой дозы препарат вводить не рекомендуется. По аналогии с Баетой, Виктозу можно использовать с другими сахароснижающими препаратами.
А теперь о самом важном — о цене и доступности обоих препаратов. Эта группа препаратов не внесена ни в федеральный, ни в региональный список льготных лекарств для лечения пациентов с сахарным диабетом. Поэтому данные препараты придется покупать за собственные деньги. Скажу честно, что эти препараты не из дешевых. Цена зависит от дозы вводимого лекарства и от упаковки. Например, Баета объемом 1,2 мг содержит 60 доз препарата. Этого количества хватит на 1 мес. при условии, что назначенная суточная доза — 5 мкг. В этом случае вам препарат обойдется в среднем в 4 600 рублей в месяц. Если это Виктоза, то при минимальной суточной дозе в 6 мг препарат будет обходиться 3 400 рублей в месяц.
Дипептидилпептидаза 4 типа
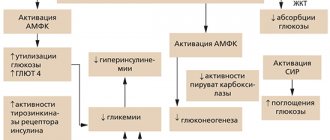
ДПП-4 впервые была выделена в качестве гликопротеина мембраны Т-лимфоцитов CD-26, играющего роль связывающего белка или лиганда для молекул. На сегодняшний день известно, что ДПП-4 является интегральным белком, который не только способен экспрессироваться во всех клетках организма, но и циркулирует в кровотоке в свободной форме как фермент с каталитической активностью [5]. Помимо инкретиновых гормонов физиологическими субстратами для ДПП-4 являются различные цитокины, факторы роста и нейропептиды, которые обладают регуляторным влиянием на работу всех органов и систем организма, включая и нейроэндокринную систему. ДПП-4 в большом количестве представлена в клетках эндотелия сосудов, что делает доступными для нее все пептидные молекулы, циркулирующие через кишечник, печень, легкие и почки [3, 6]. Поэтому предполагают, что ДПП-4 может дополнительно влиять на метаболический контроль через свое протеолитическое действие на другие регуляторные пептиды и даже оказывать влияние на чувствительность к инсулину, потенциально опосредованную его неферментативными взаимодействиями с другими мембранными белками. На сегодняшний день ДПП-4 рассматривается и как локальный медиатор воспаления и инсулинорезистентности в жировой и печеночной ткани, и как участник паракринной системы, включающей местную выработку ГПП-1 в островках поджелудочной железы. Было показано, что ожирение связано с повышенными уровнями растворимой ДПП-4, экспрессирующейся в избыточном количестве в гепатоцитах и адипоцитах. Повышение ДПП-4 в кровотоке приводит, в свою очередь, к резистентности адипоцитов к инсулину, что предположительно обусловлено кавеолином-1 (Cav-1), вырабатываемым на мембране самих адипоцитов и в макрофагах жировой ткани [5] (рис. 2).
Интерес к ферменту ДПП-4 еще больше усилился после открытия и утверждения высокоселективных иДПП-4 — агентов, которые избирательно инактивируют ДПП-4 и усиливают преимущественно инкретиновый эффект для лечения СД 2 типа [7].
Ингибиторы ДПП-4
Ситаглиптин стал первым агентом, который был одобрен для лечения СД 2 типа еще в 2006 г. На сегодняшний день в клиническую практику вошли уже более 10 препаратов группы иДПП-4 по всему миру. В России до недавнего времени были зарегистрированы 6 лекарственных наименований: ситаглиптин, вилдаглиптин, саксаглиптин, линаглиптин, алоглиптин, гозоглиптин. В 2022 г. появился новый препарат — эвоглиптин. Все препараты имеют таблетированную форму и назначаются с частотой 1–2 р/сут. Ингибиторы ДПП-4 демонстрируют торможение активности фермента уже через 5 мин после приема [3].
По отечественным и зарубежным данным, иДПП-4 пока остаются препаратами резервного/второго выбора при выборе первоначальной монотерапии СД 2 типа [2, 8]. Чаще всего назначаются в сочетании с модификацией образа жизни и в комбинации с другими классами (метформином, препаратами сульфонилмочевины (ПСМ), тиазолидиндионами, ингибиторами натрий-глюкозного котранспортера 2 типа и/или базальным инсулином). Но в случае наличия непереносимости или противопоказаний к приему метформина (например, хроническая болезнь почек) иДПП-4 могут быть отличным вариантом как в монотерапии, так и в комбинациях с препаратами других классов.
Гипогликемическая эффективность иДПП-4 выражается в снижении уровня гликированного гемоглобина (HbA1c) на 0,5–1%, что уступает ПСМ, которые снижают HbA1c на 1–2%. Кроме того, иДПП-4 менее доступны по цене. И на первый взгляд может показаться, что ПСМ «мощнее» иДПП-4 и экономически выгоднее. Действительно, во всех странах мира ПСМ занимают одну из лидирующих позиций по частоте назначения. Но оправдано ли это? Ведь 15-летний опыт использования препаратов из группы иДПП-4 подтверждает их эталонную безопасность и удовлетворительную сахароснижающую способность. Имеются данные о выраженных различиях иДПП-4 по сравнению с ПСМ в отношении развития сердечно-сосудистых событий, микрососудистых осложнений и ожидаемого долгосрочного прогноза. По данным Шведского национального регистра, на фоне терапии иДПП-4 отмечается снижение частоты сердечно-сосудистых событий и тяжелых гипогликемий [9]. Согласно многочисленным исследованиям иДПП-4, в отличие от ПСМ, имеют нейтральное влияние на массу тела и риск гипогликемии (что объясняется глюкозозависимой стимуляцией секреции инсулина), за исключением случаев, когда есть сопутствующее лечение инсулином [10]. При этом несколько клинических испытаний показали снижение уровня HbA1c без повышения риска гипогликемии при добавлении иДПП-4 к базальной инсулинотерапии [11].
По данным метаанализа K. Chen et al. с включением результатов долгосрочных клинических испытаний установлено, что влияние иДПП-4 на уровни HbA1c у пациентов с СД 2 типа может ослабевать в течение 2-го года лечения. Однако прямое сравнение «гликемической долговечности» с ПСМ достоверно показало, что в период с 24-й по 104-ю неделю терапии на фоне иДПП-4 наблюдался менее выраженный рост уровня HbA1c — в среднем на 0,16% (p<0,001). Полученные данные позволяют говорить о более долговечном гликемическом ответе на иДПП-4 по сравнению с ПСМ при терапии продолжительностью более 2 лет [12].
Одним из главных преимуществ иДПП-4 является возможность назначения даже пациентам с терминальной почечной недостаточностью, в т. ч. на диализе [2, 3]. Ключевое место иДПП-4 заняли в стратегии терапии СД 2 типа и у пожилых пациентов. Хорошая переносимость, сердечно-сосудистая безопасность, низкий риск гипогликемии (даже в сочетании с базальным инсулином) и возможность назначения при тяжелой почечной недостаточности сделали группу иДПП-4 более предпочтительной для пожилых людей, чем ПСМ [13–16]. Стоит отметить, что иДПП-4 входят в состав комбинированных препаратов, таких как глиптин + метформин, глиптин + пиоглитазон и глиптин + ингибитор натрий глюкозного кoтранспортера 2 типа, что значимо повышает приверженность терапии, особенно пожилых пациентов в условиях полипрагмазии. Европейские ученые отмечают, что в реальной клинической практике продолжает преобладать назначение комбинации инсулина и ПСМ пожилым пациентам, тогда как стратегической целью в лечении этой категории лиц является поддержание целевого уровня глюкозы крови с минимизацией риска гипогликемий и благодаря этому сохранение высокого качества жизни. По их данным, выбор в пользу иДПП-4 за период наблюдения в течение 4 лет не только улучшил гликемический контроль у категории пожилых пациентов, но и позволил достичь данной цели безопасно и с повышением качества жизни (по оценке самих пациентов и их родственников) [17–19].
Таким образом, неоспоримы такие преимущества иДПП-4 перед ПСМ, как отсутствие набора веса, низкий риск гипогликемии, отсутствие необходимости в титровании дозы, допустимость приема пациентами с тяжелой почечной недостаточностью, более длительное сохранение гипогликемического эффекта и преимущественная безопасность при назначении пожилым пациентам.
Из препаратов инкретинового ряда иДПП-4 менее эффективны в снижении HbA1c и нормализации массы тела, чем агонисты рецепторов ГПП-1, но их неоспоримыми преимуществами даже перед агонистами ГПП-1 остаются пероральная форма приема и ценовая доступность.
Препараты, основанные на действии инкретинов и предназначенные для лечения сахарного диабета 2-го типа (СД2), появились в клинической практике в 2005 г. Центральное место среди инкретинов занимает глюкагоноподобный пептид-1 (ГПП-1) — интестинальный гормон, играющий важную роль в поддержании нормального углеводного обмена. К благоприятным эффектам ГПП-1 относится улучшение функции β-клеток, включая глюкозозависимую секрецию инсулина и подавление выработки глюкагона, а также ряд внепанкреатических свойств, таких как замедление опорожнения желудка и подавление аппетита [1].
Однако, находясь в кровеносном русле, ГПП-1 оказывает свои эффекты недолго вследствие быстрого разрушения и выведения из организма. Фермент, который отвечает за деградацию ГПП-1 и потерю его инсулинотропного действия, — сериновая протеаза дипептидилпептидаза-4 (ДПП-4). Понимание роли ДПП-4 в метаболизме ГПП-1 дало основание для создания ингибиторов данного фермента с целью увеличения времени действия эндогенного ГПП-1 [2]. Результаты доклинических исследований, демонстрирующих сохранение концентрации ГПП-1 под влиянием ингибиторов ДПП-4 [3], позже были подтверждены среди пациентов с СД2, у которых прием ингибиторов ДПП-4 снижал уровень гликемии [4].
Представители класса ингибиторов ДПП-4 (глиптинов) прочно укоренились на рынке сахароснижающих препаратов. К ним относятся ситаглиптин, вилдаглиптин, саксаглиптин, алоглиптин (зарегистрирован в Японии), линаглиптин (зарегистрирован в США и Европе). В данной статье представлена сравнительная характеристика трех ингибиторов ДПП-4, зарегистрированных в РФ: ситаглиптин (Янувия), вилдаглиптин (Галвус), саксаглиптин (Онглиза).
Химическая формула
Все ингибиторы ДПП-4 обратимо связываются с активным центром фермента. Ситаглиптин образует с ДПП-4 нековалентную связь, тогда как вилдаглиптин и саксаглиптин связываются с активным центром фермента с помощью ковалентной связи (рис. 1).
Рисунок 1. Химическая структура ингибиторов ДПП-4. Ковалентная связь приводит к формированию стойкого комплекса фермент-ингибитор, характеризующегося низкой скоростью диссоциации, что позволяет ингибитору сохранять активность даже после выведения препарата [5—7]. Это объясняет, почему вилдаглиптин и саксаглиптин оказывают свой эффект в течение более длительного времени, чем можно было предположить на основании периода полувыведения.
Фармакодинамика ингибиторов ДПП-4
В терапевтических дозах все глиптины приводят к длительному снижению активности фермента в течение суток. Степень ингибирования ДПП-4 достигает более 90% через 15 мин после приема препарата и сохраняется на уровне 70—90% в течение последующих 24 ч [8—10], что приводит к значимому увеличению концентрации ГПП-1 (в 1,5—4 раза). Данные получены для ситаглиптина в суточной дозе 100 мг, саксаглиптина 5 мг и вилдаглиптина 100 мг (50 мг 2 раза в сутки).
Как известно, ДПП-4 является членом семейства дипептидилпептидаз, две из которых (ДПП-8 и ДПП-9), по данным некоторых исследований [11, 12], отвечают за Т-клеточную активацию и пролиферацию. При исследованиях in vitro наибольшую селективность в отношении ДПП-4 продемонстрировал ситаглиптин [13, 14], тогда как вилда- и саксаглиптин обладают умеренной селективностью [15, 16]. Высокая селективность ситаглиптина предполагает минимизацию возможных побочных эффектов, однако, учитывая внутриклеточную локализацию ДПП-8 и -9, значимость высокой селективности in vivo остается неясной. Глиптины не являются субстратами, индукторами или ингибиторами ферментов CYР450 за исключением саксаглиптина, активный метаболит которого образуется при помощи фермента цитохром Р3А4/5 [13, 17, 18].
Фармакокинетика ингибиторов ДПП-4
Ингибиторы ДПП-4 существуют в пероральной форме. Максимальная концентрация препаратов достигается менее чем через 4 ч. Ситаглиптин и вилдаглиптин обладают высокой биодоступностью (~85—87%), несколько ниже у саксаглиптина (~67%) [19—21]. Ингибиторы ДПП-4 обратимо и в небольшой степени связываются с белками плазмы (38% для ситаглиптина, 10% для вилдаглиптина, несущественно для саксаглиптина), что обусловливают преимущественно почечный путь их выведения. Основное свое действие ситаглиптин оказывает в неизмененном виде, вилдаглиптин метаболизируется до неактивного метаболита, саксаглиптин до активного [17—19, 22]. В связи с этим назначение саксаглиптина совместно с ингибиторами CYP3А4/5, такими как кетоконазол или кларитромицин, рекомендовано уменьшение дозы саксаглиптина до 2,5 мг в сутки [23]. Выводятся глиптины в основном с мочой, что подразумевает необходимость уменьшения дозы препаратов при снижении СКФ.
Основные параметры метаболизма ингибиторов ДПП-4 представлены в табл. 1.
Использование при почечной и печеночной недостаточности
Учитывая, что выведение ингибиторов ДПП-4 преимущественно происходит через почки, то при развитии почечной недостаточности требуется проведение коррекции дозы этих препаратов. Ингибиторы ДПП-4 разрешены к применению в терапевтической дозе при умеренном снижении СКФ (50—80 мл/мин/1,73 м2), при СКФ ниже 50 мл/мин/1,73 м2 доза препаратов должна быть уменьшена на 50% и более [17, 18, 24].
Большинство исследований показало, что коррекции дозы ситаглиптина и вилдаглиптина при развитии печеночной недостаточности не требуется. Тем не менее требуется осторожность при назначении препаратов данной группы у лиц с повышением печеночных трансаминаз более трех норм и ежеквартальное мониторирование ферментов в течение первого года использования ингибиторов ДПП-4.
Сахарснижающий эффект в монотерапии
Сахарснижающая активность ингибиторов ДПП-4 изучалась в крупных, рандомизированных, плацебо-контролируемых клинических исследованиях, которые продемонстрировали статистически значимое снижение HbA1с на фоне приема глиптинов.
В 12-недельном исследовании, посвященном оценке сахароснижающего эффекта ситаглиптина
, применение препарата в дозе 100 мг 1 раз в день приводило к снижению HbA1с в среднем на 0,6% по сравнению с плацебо (р<0,001) [25, 26]. При этом наблюдаемое различие было тем больше, чем выше был исходный показатель HbA1с: при исходном уровне HbA1с менее 7% снижение его составило –0,4%, у пациентов с начальным HbA1с 7—8,5% показатель снизился на –0,6%; наконец, при HbA1с 8,5—10% снижение его достигало –0,8%.
В 24-недельном исследовании различные дозировки вилдаглиптина
(50 мг 1 раз в cутки/50 мг 2 раза в сутки/100 мг 1 раз в сутки) назначались пациентам, ранее не получавшим терапию [27]. Снижение HbA1с составило 0,7—0,9±0,1% на фоне лечения вилдаглиптином по сравнению с плацебо (р<0,001). Назначение вилдаглиптина пациентам с более высоким значением HbA1с также ассоциировалось с более выраженным снижением данного показателя.
Использование саксаглиптина
среди пациентов, ранее не получавших ПССП, ассоциировалось со снижением HbA1с на 0,7—0,9% в зависимости от дозировки (2,5/5/10//20/40 мг) при этом наибольшая эффективность была получена в дозе 5 мг 1 раз в сутки. В группе плацебо снижение HbA1с составило 0,27% [28].
Сахарснижающий эффект с комбинации с другими ПССП
Добавление 100 мг ситаглиптина
к терапии метформином у пациентов с неудовлетворительным контролем гликемии (HbA1с ≥7% и ≤10%) привело к значимому снижению HbA1с (приблизительно –0,7% по сравнению с плацебо, р<0,001) [29]. Добавление ситаглиптина к глимепириду и/или метформину у пациентов с HbA1с≥7,5 и ≤10,5% привело к снижению HbA1с в среднем на 0,74% по сравнению с плацебо (р<0,001): в подгруппе глимепирид+метформин добавление ситаглиптина привело к снижению HbA1с на 0,89%, в подгруппе, принимавшей только глимепирид, — на 0,57% [30].
Комбинация вилдаглиптина
с метформином у пациентов с неадекватным контролем гликемии достоверно приводила к снижению уровня HbA1с: у пациентов, ранее принимавших метформин, добавление вилдаглиптина в дозе 50 мг в сутки вызывало снижение HbA1с на 0,7%, в дозе 50 мг 2 раза в сутки — на 1,1% [31]. В исследовании, посвященном использованию комбинации вилдаглиптина с глимепиридом, HbA1с снизился с исходных 8,3 до 6,8% через 12 мес после начала терапии [32].
Вилдаглиптин и ситаглиптин разрешены к применению в комбинации с инсулином. В дозе 50 мг 2 раза в сутки добавление вилдаглиптина к исходной терапии инсулином НПХ достоверно снижало HbA1с на 0,5% в общей популяции; среди пациентов старше 65 лет снижение HbA1с достигало –0,7% по сравнению с плацебо (–0,1%) [33]. В исследовании не были зарегистрированы случаи тяжелых гипогликемий.
Сравнительных исследований препаратов из группы ингибиторов ДПП-4 немного, одно из них проводилось в отношении комбинации сита- и саксаглиптина
с метформином среди пациентов с неудовлетворительным контролем гликемии (HbA1с 6,5—10% на фоне приема 1,5—3 г метформина в сутки) [34]: добавление 5 мг саксаглиптина и 100 мг ситаглиптина привело к снижению HbA1с в среднем на 0,5 и 0,6% соответственно.
Прямое сравнение двух наиболее изученных представителей класса ингибиторов ДПП-4 — ситаглиптина и вилдаглиптина было проведено с участием пациентов с СД2 с неудовлетворительным контролем на метформине. Добавление к терапии вилдаглиптина или ситаглиптина в течение 3 мес терапии обеспечило в среднем снижение HbA1с на –0,9% по сравнению с плацебо (R. Marfella R и соавт.) [35]. Кроме того, была продемонстрирована схожесть динамики основных гликемических параметров (HbA1с, глюкозы плазмы натощак и постпрандиально) на фоне лечения обоими препаратами, однако выявило различия в амплитуде колебания гликемии, активности ГПП-1 и степени подавления глюкагона. Вилдаглиптин способствовал более выраженному подъему уровня ГПП-1 между приемами пищи, сильнее подавлял секрецию глюкагона и значительно снижал амплитуду колебания гликемии [36] (рис. 2).
Рисунок 2. Уровень ГПП-1 в плазме на фоне приема вилдаглиптина и ситаглиптина в течение 3 мес. Меньшее влияние ситаглиптина на концентрацию ГПП-1 и глюкагона в промежутках между приемами пищи, вероятно, обусловлено высокой скоростью его диссоциации с активным центром фермента (10 с в отличие от 55 мин для вилдаглиптина). Вместе с этим краткосрочность исследования, небольшая группа включенных в исследование пациентов не позволяют сделать окончательные выводы о том, могут ли данные различия играть существенную роль с точки зрения клинической значимости.
Влияние на функцию β- и α-клеток
В клинических исследованиях всех представленных ингибиторов ДПП-4 отмечено улучшение показателей HOMA-β и соотношения инсулина к проинсулину, которые косвенно отражают функцию β-клеток [37]. Назначение вилдаглиптина пациентам с нарушенной толерантностью к глюкозе (НТГ) также улучшало показатели островковой функции [38]; однако показаний по применению вилдаглиптина у пациентов с НТГ с целью профилактики развития СД2 пока нет.
Помимо влияния на β-клетку, ингибиторы ДПП-4 продемонстрировали способность улучшать чувствительность к глюкозе и α-клеток [37]. У пациентов с СД 2 типа наблюдается дисфункция α-клеток, что приводит к повышенной секреции глюкагона и соответствующему увеличению продукции глюкозы печенью после приема пищи [39]. Увеличение концентрации инкретинов путем назначения ситаглиптина, вилдаглиптина и саксаглиптина приводило к уменьшению резистентности α-клеток к глюкозе и снижению высокой концентрации глюкагона.
Побочные действия
В целом группа ингибиторов ДПП-4 имеет благоприятный профиль переносимости и безопасности по сравнению с другими классами ПССП [40]. В отличие от производных сульфонилмочевины и тиазолидиндионов ингибиторы ДПП-4 не вызывают увеличение массы тела, что приобретает особенную значимость в условиях большого числа пациентов с избыточной массой тела и ожирением. Прием глиптинов не сопровождается развитием отеков. Метформин, агонисты ГПП-1 и ингибиторы α-глюкозидазы вызывают желудочно-кишечные расстройства, тогда как ингибиторы ДПП-4 хорошо переносятся больными. Одним из главных преимуществ нового класса ПССП является отсутствие риска гипогликемий. Это свойство исходит из самого принципа действия инкретинов — глюкозозависимый механизм стимуляции секреции инсулина бета-клетками и подавления секреции глюкагона альфа-клетками. Низкий риск гипогликемий – важная особенность ингибиторов ДПП-4, которая дает преимущество этому классу по сравнению с производными сульфонилмочевины.
Фермент ДПП-4 принимает участие в регуляции некоторых медиаторов воспаления, поэтому теоретически можно ожидать некоторое повышение риска инфекций верхних дыхательных путей, что пока не получило подтверждения в реальной клинической практике. Как уже обсуждалось ранее, на фоне терапии вилдаглиптином возможно повышение печеночных ферментов, поэтому необходим их контроль в течение 1-го года лечения.
С момента внедрения ситаглиптина в практику стали появляться сообщения о случаях острого панкреатита у пациентов, его принимавших. В июле 2011 г. в журнале «Gastroenterology» была опубликована статья, посвященная оценке риска развития панкреатита, а также рака поджелудочной и щитовидной железы у пациентов, получавших инкретинстимулирующую терапию [41]. Авторы анализировали безопасность ингибитора ДПП-4 ситаглиптина и миметика ГПП-1 эксенатида, по данным постмаркетинговых исследований, о нежелательных явлениях, которые были посланы для оценки в FDA (Федеральное агентство по лекарственным и пищевым продуктам США). В качестве группы контроля использовались традиционные ПССП (росиглитазон, натеглинид, репаглинид, глипизид). В результате проведенного анализа авторы заключили, что применение эксенатида и ситаглиптина увеличивает риск развития панкреатита, рака поджелудочной железы; применение эксенатида (но не ситаглиптина) увеличивает риск развития рака щитовидной железы. Спорным остается вопрос о правильности методологии данного исследования, так как база данных FDA по нежелательным явлениям не может применяться для качественных подсчетов и анализа. Также сомнительна правильность выбора препаратов для контрольной группы. Имеющийся на настоящий момент анализ данных 19 контролируемых исследований с участием 10246 пациентов с СД2, получавших ситаглиптин в течение 2 лет, не выявил увеличения риска панкреатита [42]. Требуется дальнейшее изучение потенциальной связи между приемом инкретинстимулирующей терапии у пациентов с СД2 и развитием панкреатита или рака любой локализации.
Комбинированные препараты
Ингибиторы ДПП-4 имеют доказанную активность в отношении контроля гликемии, не вызывают тяжелых побочных эффектов и не истощают резервы поджелудочной железы. Такие свойства нового класса ПССП помогают наиболее эффективно использовать его у пациентов с впервые выявленным СД2. Традиционным препаратом стартовой терапии для пациентов СД2 является метформин. Идея о сочетании двух препаратов с наиболее безопасным профилем действия воплотилась в создании комбинированных форм вилдаглиптина/ситаглиптина с метформином (ГалусМет и ЯнуМет). С учетом фармакодинамики метформина оба препарата назначаются 2 раза в день, что позволяет поддержать стабильное ингибирование ДПП-4 на протяжении всех суток. Сочетание ингибитора ДПП-4 и метформина обеспечивает дополнительный сахарснижающий эффект по сравнению с монотерапией каждым из препаратов и не усиливает побочных эффектов метформина со стороны желудочно-кишечного тракта. Такая комбинация направлена на достижение целевых значений гликированного гемглобина у большего числа пациентов с СД2 и, возможно, способна отсрочить назначение производных сульфонилмочевины и старт инсулинотерапии.
Заключение
Ингибиторы ДПП-4 с момента своего появления в 2005 г. успели занять прочное место в ряду препаратов для лечения СД2. Низкий риск гипогликемий, отсутствие влияния на массу тела и отсутствие побочных эффектов со стороны желудочно-кишечного тракта выгодно отличают этот класс от других ПССП. Различия среди глиптинов касаются их химического строения, способности ингибировать ДПП-4, длительности их действия, метаболизма и элиминации. Вместе с этим данные, имеющиеся на сегодняшний день, свидетельствуют об их идентичности с точки зрения сахарснижающей активности, безопасности и переносимости. Глиптины могут быть назначены пациентам с впервые выявленным СД2, при плохой переносимости или противопоказаниях к назначению бигуанидов, а также в комбинации с другими пероральными сахароснижающими препаратами. Вилдаглиптин и ситаглиптин имеют показания для назначения с препаратами инсулина, что открывает новые возможности комбинированной терапии у пациентов с длительным течением заболевания. Отличительной особенностью их использования является фиксированная дозировка, отсутствие необходимости ее титрования, а также низкий риск гипогликемических эпизодов и отсутствие риска развития тяжелых эпизодов гипогликемии. Исследования по влиянию ингибиторов ДПП-4 на возможность предотвращения утраты функции β-клеток носят обнадеживающий характер. Тем не менее необходимы длительные наблюдения для подтверждения этих данных и значимости их для клинической практики.
Кардиоваскулярная безопасность ингибиторов ДПП-4
Для каждого из представителей глиптинов были получены данные относительно сердечно-сосудистой безопасности: вилдаглиптин — в независимых метаанализах с учетом пациентов с застойной сердечной и умеренной/тяжелой почечной недостаточностью, саксаглиптин — в рандомизированном плацебо-контролируемом исследовании SAVOR-TIMI среди пациентов с подтвержденными атеросклеротическими сердечно-сосудистыми заболеваниями и/или наличием факторов риска, алоглиптин — в исследовании EXAMINE среди пациентов с недавними инфарктом миокарда или госпитализацией по поводу нестабильной стенокардии, ситаглиптин — в исследовании TECOS, линаглиптин — в исследованиях среди пациентов с высоким сердечно-сосудистым риском CARMELINA (плацебо-контролируемое) и CAROLINA (в сравнении с глимепиридом) [20–26]. Только саксаглиптин и алоглиптин продемонстрировали небольшое повышение частоты госпитализации по поводу сердечно-сосудистой недостаточности, вследствие чего при наличии у пациента хронической сердечной недостаточности иДПП-4 должны назначаться с осторожностью.
На сегодняшний день не вызывает сомнений безопасность терапии иДПП-4 в отношении кардиоваскулярных событий, что подтверждается в метаанализе Dan Liu et al. В метаанализ были включены 157 478 пациентов с СД 2 типа, из них более 76 тыс. получали иДПП-4, 81 тыс. человек были включены в контрольную группу. Было показано, что в течение среднего периода наблюдения от 52 до 152 нед. первичная конечная точка (смерть от сердечно-сосудистых заболеваний / нефатальный инфаркт миокарда / нефатальный инсульт) существенно не различалась при лечении пациентов с СД 2 типа, получающих иДПП-4, по сравнению с контрольной группой. Также не различались в обеих группах смертность от всех причин, госпитализация по поводу сердечно-сосудистых осложнений и сердечной недостаточности (рис. 3) [27].
В настоящее время есть основания говорить не только о безопасности иДПП-4, но и об их защитной роли в отношении сердечно-сосудистой системы. Недавно de Oliveira et al. продемонстрировали улучшение эндотелиальной функции на фоне ингибирования ДПП-4 у мышей, подверженных хронической стимуляции β-адренергической симпатической системы. Исследователи показали, что активация β-адренорецепторов может увеличивать активность ДПП-4, что приводило к экспрессии цитокинов в эндотелиальных клетках и сосудистой дисфункции, которая оказалась полностью обратима на фоне введения иДПП-4 [28]. Кроме того, появились довольно противоречивые данные, демонстрирующие влияние иДПП-4 не только на функцию эндотелия, но и на коронарный кровоток и диастолическую функцию левого желудочка. В обзоре N. Kensuke et al. авторы пришли к выводу, что возможное положительное влияние иДПП-4 на сердечно-сосудистую систему можно ожидать у пациентов с исходно высоким уровнем HbA1c, поскольку положительный эффект демонстрировали преимущественно исследования, проведенные у пациентов на фоне декомпенсации углеводного обмена [29].
дальнейшее чтение
- Ансорге С., Бюлинг Ф., Кане Т., Лендекель Ю., Рейнхольд Д., Тэгер М., Вренгер С. (1997). «CD26 / дипептидилпептидаза IV в регуляции роста лимфоцитов». Достижения экспериментальной медицины и биологии
.
421
: 127–40. Дои:10.1007/978-1-4757-9613-1_17. ISBN 978-1-4757-9615-5 . PMID 9330689. - Райнхольд Д., Кене Т., Штейнбрехер А., Вренгер С., Нойберт К., Ансорге С., Броке С. (2003). «Роль ферментативной активности дипептидилпептидазы IV (DP IV) в активации Т-клеток и аутоиммунитета». Биологическая химия
.
383
(7–8): 1133–8. Дои:10.1515 / BC.2002.123. PMID 12437097. S2CID 30027839. - Сато К., Данг Н.Х. (март 2003 г.). «CD26: новая мишень для лечения злокачественных опухолей лимфоидных Т-клеток? (Обзор)». Международный журнал онкологии
.
22
(3): 481–97. Дои:10.3892 / ijo.22.3.481 (неактивно 11.10.2020). PMID 12579300.CS1 maint: DOI неактивен по состоянию на октябрь 2020 г. (связь) - де Мистер I, Ламбейр AM, Proost P, Scharpé S (2003). Субстраты дипептидилпептидазы IV. Обновленная информация о гидролизе пептидов in vitro с помощью DPPIV человека
. Успехи экспериментальной медицины и биологии.
524
. С. 3–17. Дои:10.1007/0-306-47920-6_1. ISBN 0-306-47717-3 . PMID 12675218. - Кох С, Антонсен Д., Сковбьерг Х, Сьёстрём Х (2003). «О роли дипептидилпептидазы IV в переваривании иммунодоминантного эпитопа при целиакии». Дипептидиламинопептидазы в здоровье и болезнях
. Успехи экспериментальной медицины и биологии.
524
. С. 181–7. Дои:10.1007/0-306-47920-6_22. ISBN 0-306-47717-3 . PMID 12675238. - Pro B, Dang NH (октябрь 2004 г.). «CD26 / дипептидилпептидаза IV и ее роль в развитии рака». Гистология и гистопатология
.
19
(4): 1345–51. Дои:10.14670 / HH-19.1345. PMID 15375776.
Возможные побочные эффекты ингибиторов ДПП-4
Один из побочных эффектов, который был ассоциирован с иДПП-4, — развитие острого панкреатита. Однако причинно-следственная связь на сегодняшний день не установлена и нет достоверных данных, подтверждающих повышенный риск развития панкреатита при использовании препаратов инкретинового ряда [30–32]. Все же при подтверждении острого панкреатита терапия иДПП-4 должна быть отменена.
В ответ на предположения о возможном развитии острой почечной недостаточности и инфекций дыхательных путей J.M. Gamble et al. проанализировали Британскую базу данных клинических исследований в период с 2007 по 2016 г. и убедительно продемонстрировали, что начало приема иДПП-4 не было связано с повышенным риском указанных осложнений в сравнении с другими классами препаратов (ПСМ, метформином, тиазолидиндионами и инсулином) [33].
На сегодняшний день активно обсуждаются повышенные риски развития воспалительных заболеваний кишечника на фоне приема иДПП-4, но убедительных данных пока нет [34].
Новый ингибиторДПП-4 эвоглиптин
В реальной клинической практике, в соответствии с данными Регистра СД, наиболее распространенной комбинацией остается терапия метформином и ПСМ. Широкое применение ПСМ объясняется их низкой ценовой категорией. Однако в настоящее время имеется препарат из группы иДПП-4 — эвоглиптин, имеющий оптимальную стоимость, что позволяет рассматривать его как альтернативу ПСМ.
Эвоглиптин — это новейший препарат класса глиптинов, обладающий всеми уникальными фармакокинетическими особенностями иДПП-4. Проведено международное рандомизированное двойное слепое исследование ЭВОКОМБИ, по результатам которого эвоглиптин показал безопасность и эффективность, сравнимые с таковыми ситаглиптина. Данные получены на корейской и российской популяциях пациентов, не достигших целевого уровня гликемии на терапии только метформином в дозе 1000–2000 мг/сут [35]. В исследовании принял участие 281 человек, из которых 142 был назначен эвоглиптин в дозе 5 мг, 139 — ситаглиптин в дозе 100 мг. Через 24 нед. проанализировано абсолютное изменение уровня HbA1c по сравнению с исходными данными. В группе эвоглиптина уровень HbA1c снизился на 0,58±0,70% (р<0,001), а в группе ситаглиптина — на 0,61±0,66% (p<0,001). Различие эффективности между группами — 0,03% (95% доверительный интервал — 0,14; 0,19%). Полученные данные показали не меньшую эффективность эвоглиптина, чем эффективность ситаглиптина. Была сопоставима и частота нежелательных явлений между группами (p>0,05). Ни в одной из групп тяжелой гипогликемии не зарегистрировано. За весь период наблюдения развитие легкой гипогликемии встречалось даже чаще в группе ситаглиптина, чем в группе эвоглиптина, и составило 5,2% и 0,7% соответственно (р=0,365) (рис. 4).
Ретроспективное исследование базы данных клинического испытания ЭВОКОМБИ позволило выделить ряд возможных предикторов эффективности эвоглиптина: это высокий индекс НОМА-В (р=0,0042), низкий метаболический индекс — соотношение концентраций триглицеридов и липопротеидов высокой плотности (р=0,0057), низко-нормальная концентрация фосфора в плазме крови (р=0,014). Метаболический индекс при этом показал себя предиктором, специфическим для российской популяции [36].
В многоцентровом рандомизированном двойном слепом активно контролируемом исследовании EVERGREEN сахароснижающий эффект (включая вариабельность гликемии) и переносимость эвоглиптина были сопоставимы с эффективностью и переносимостью линаглиптина [37]. В исследовании приняли участие 207 пациентов. Через 12 нед. лечения среднее изменение уровня HbA1c в группе эвоглиптина и в группе линаглиптина составило -0,85% и -0,75% соответственно. Изменение средней амплитуды колебаний гликемии составило -24,6 мг/дл в группе эвоглиптина и -16,7 мг/дл в группе линаглиптина. Эти значения были существенно ниже, чем исходные показатели в обеих группах, тем не менее они не сильно различались между собой. В группе эвоглиптина на 24-й неделе уровень HbA1c снизился на -0,94%, достигнув значений <7,0% у 80,2% пациентов. Частота и типы нежелательных явлений были сопоставимы между двумя группами в течение 24 нед. Терапия эвоглиптином улучшила вариабельность гликемии, не вызывая серьезных побочных эффектов у пациентов с СД 2 типа.
Полученные данные демонстрируют, что на сегодняшний день имеется возможность использования препарата из группы иДПП-4, эффективность и безопасность которого не уступает таковым других представителей группы, а ценовая доступность сопоставима с доступностью ПСМ.