Стандартные фармакопейные растворы (жидкости) — это водные растворы (заводского производства) некоторых лекарственных веществ в строго определенной концентрации, указанной в соответствующих статьях ГФ.
К ним относятся растворы твердых, жидких или газообразных веществ:
- раствор калия ацетата,
- жидкость Бурова,
- кислота хлористоводородная,
- раствор аммиака,
- перекись водорода,
- формалин и др.
Эти жидкости легко смешиваются с водой, и их растворы готовят непосредственно во флаконе для отпуска, в который сначала отмеривают воду, а потом рассчитанное количество жидкости. При необходимости раствор процеживают.
Правила выписывания стандартных фармакопейных растворов
Стандартные фармакопейные растворы могут выписываться под двумя названиями: условным и химическим ( см. табл. ниже), от чего зависит расчет их количества.
NB!!!! Если в рецептурной прописи жидкость прописана под условным названием, то при расчетах концентрацию стандартного раствора принимают за единицу (100 %).
NB!!!! Если указано химическое название, то при расчетах исходят из фактического содержания веществ в стандартных растворах, используя следующую формулу:
X = V * (В/А)
где Х — объем стандартной жидкости, мл;
V — объем раствора, который необходимо приготовить, мл;
B — прописанная концентрация раствора, %;
A — фактическая концентрация стандартной жидкости, которая подлежит разведению, %.
| Условное название | Химическое название | Конц-ия, % | Лит-ра |
| Жидкость Бурова | Раствор алюминия ацетата основного | 7,6—9,2 | ГФ IХ |
| Жидкость калия ацетата | Раствор калия ацетата | 33—35 | ГФ VIII |
| Формалин | Раствор формальдегида | 36,5—37,5 | ГФ X |
| Пергидроль | Раствор перекиси водорода концентрированный | 27,5—31,0 | ГФ X |
| Раствор перекиси водорода | 2,7—3,3 | ГФ X | |
| Раствор аммиака | Раствор аммиака | 9,5—10,5 | ГФ IX |
| Кислота уксусная | Кислота уксусная | 3; 29,5—30,5; 98 | ГФ VII |
| Кислота хлористоводород- ная | Кислота хлористоводород- ная | 24,8—25,2 | ГФ X |
| Кислота хлористоводород- ная разведенная | Кислота хлористоводород- ная разведенная | 8,2—8,4 | ГФ X |
Количество воды в обоих случаях рассчитывают по разности между общим объемом приготовляемого раствора и рассчитанным количеством стандартной жидкости.
Для чего назначают препарат
По обозначению Европейской Фармакопеи, перекись водорода называется hydrogen peroxide. На латыни перекись водорода звучит как Hydrogenii peroxydi dilutae – именно по этому названию врач выписывает рецепт.
Следует обратить внимание, что в европейских аптечных сетях приобрести перекись водорода без рецепта врача нельзя, несмотря на высокую безопасность лекарства. Такая практика распространяется на все медицинские препараты – рецепты на них должен выдавать врач.
Препарат назначают для полоскания и промывания при заболеваниях ротовой полости и горла, патологиях гинекологического профиля. Антисептик эффективен для обработки неглубоких ран, против носовых кровотечений.
Раствор формальдегида (формалина)
Применяют как дезинфицирующее и дезодорирующее средство:
- для мытья рук,
- обмывания кожи при повышенной потливости (0,5—1 %-ные растворы),
- для дезинфекции инструментов (0,5 %-ный раствор),
- для спринцеваний 1:2000—1:3000.
Пример №3
Rp.: Solutionis Formalini 5% 100 ml
Da. Signa. Для дезинфекции помещений
Раствор выписан под условным названием.
Расчет: Раствора формальдегида 36,5—37,5%
Х = 5*100/100 = 5 мл
Воды очищенной : 100 – 5 = 95 мл
Технология изготовления: Во флакон для отпуска из оранжевого стекла отмеривают 95 мл воды очищенной и 5 мл стандартного раствора формальдегида. Оформляют к отпуску.
Пример №4
Rp.: Solutionis Formaldegydi 10% 100 ml
Da. Signa. По 1 чайной ложке на стакан воды для обмывания ног
В данном случае прописан раствор формальдегида под химическим названием.
Расчет: Раствора формальдегида 37 %-ного Х =10*100/37 = 27 мл
Воды очищенной :100 – 27 = 73 мл
Раствор жидкости Бурова
Оказывает вяжущее и местное противовоспалительное действие, в больших концентрациях обладает умеренными антисептическими свойствами. Применяют его в разведенном виде (в 10—20 и более раз) для:
- полосканий,
- примочек,
- спринцеваний,
- при воспалительных заболеваниях кожи и слизистых оболочек.
Пример №5
Rp.: Solutionis Liquoris Burovi 10% 100 ml
Da. Signa. Примочка
В данном случае стандартная жидкость выписана под условным названием. Объем раствора равен 100 мл. Во флакон отмеривают 90 мл воды очищенной и 10 мл 8 %-ного раствора основной уксусно-алюминиевой соли, оформляют к отпуску.
Если же прописан раствор алюминия ацетата основного (химическое название), то при расчетах исходят из его фактического содержания в жидкости Бурова, то есть 8%.
Пример №6
Rp.: Solutionis Aluminii subacetatis 0,8% 100 ml
Da. Signa. Примочка
В данном случае расчет производят по формуле:
Х =0,8/8*100= 10 мл 8%-ного раствора алюминия ацетата основного
Объем воды очищенной: 100-10 = 90мл
Раствор калия ацетата
Это раствор калия карбоната или гидрокарбоната в разведенной уксусной кислоте. Применяют как мочегонное средство при отеках, связанных с нарушением кровообращения.
Встречаются варианты прописей:
а) Rp.: Liquoris Kalii acetatis 10 % 200 ml
б) Rp.: Liquoris Kalii acetatis ex 20,0 200 ml
в) Rp.: Solutionis liquoris Kalii acetatis 10 % 200 ml
Лекарственный препарат по всем прописям готовят из раствора калия ацетата, принимая его за единицу (100 %), то есть берут по 20 мл фармакопейной жидкости и по 180 мл воды очищенной.
Пример №7
Rp.: Solutionis Kalii acetatis 10% 200 ml
Da. Signa. По 1 столовой ложке 4 раза в день
В данном случае раствор выписан под химическим названием, поэтому расчет ведут по приведенной выше формуле:
Раствора калия ацетата
Х =10*200/34 = 58, 8 или 59 мл
Воды очищенной 200 – 59 = 141 мл
Раствор кислоты хлористоводородной
Предназначен, в основном, для внутреннего применения в форме капель и микстур при недостаточной кислотности желудочного сока. Учитывая, что ее назначают как взрослым, так и детям, способы прописывания и концентрация кислоты хлористоводородной при этом могут быть различными. Поэтому расчеты, связанные с приготовлением этих растворов, требуют особого внимания.
Во всех случаях, когда прописана кислота хлористоводородная без обозначения концентрации, отпускают разбавленную хлористоводородную кислоту (Асidum hydrochloricum dilutum 8,3 %). Oтпускают столько, сколько прописано в рецепте.
Пример №8
Rp.: Acidi hydrochlorici 4 ml
Aquae purificatae 200 ml
Misce. Da. Signa. По 1 столовой ложке 3 раза в день перед едой
Во флакон для отпуска отмеривают 200 мл воды очищенной, затем 4 мл кислоты хлористоводородной разбавленной 8,3 % и взбалтывают до полного смешения жидкостей.
Оформление растворов кислоты хлористоводородной к отпуску не отличается какими-либо особенностями.
Если прописан раствор хлористоводородной кислоты (с обозначением концентрации) для внутреннего употребления, то для приготовления его используют кислоту хлористоводородную разбавленную (8,3 %), принимая ее при расчетах за единицу (100 %).
Пример №9
Rp.: Solutionis Acidi hydrochlorici 2% 100 ml
Da. Signa. По 1 чайной ложке 3 раза в день перед едой
Расчет: Кислоты хлористоводородной разбавленной 2 мл
Воды очищенной 100 – 2 = 98 мл
Однако, учитывая летучесть хлористого водорода, для повышения точности приготовляемых растворов рекомендуется в работе пользоваться заранее приготовленным разведением этой кислоты (внутриаптечной заготовкой) Solutio Acidi hydrochlorici diluti (1:10), в котором содержится хлористого водорода 0,83%.
Раствор кислоты хлористоводородной разбавленной (1:10) готовится путем разбавления кислоты хлористоводородной (8,3 %) соответствующим количеством воды. Например, для приготовления 1 л раствора необходимо взять 900 мл воды очищенной и добавить 100 мл кислоты хлористоводородной (8,3 %).
Этого раствора берут в 10 раз больше против прописанного количества кислоты в рецепте.
Расчет: Раствора кислоты хлористоводородной разбавленной (1:10) 2•10 = 20 мл
Воды очищенной 100 – 20 = 80 мл
Для приготовления микстуры по вышеуказанному рецепту во флакон для отпуска отмеривают 80 мл воды очищенной и 20 мл раствора кислоты хлористоводородной разбавленной (1:10).
Кислота хлористоводородная (24,8—25,2 %) используется в аптеке как реактив, а также ее применяют для наружных целей при приготовлении жидкости Демьяновича (авторская пропись), в расчетах принимая ее за единицу.
Жидкость Демьяновича состоит из двух растворов, предназначенных для лечения больных чесоткой.
Пример №10
Rp.: Solutionis Natrii thiosulfatis 60% 100 ml
Da. Signa. Наружное (Раствор № 1)
И
Rp.: Solutionis Acidi hydrochlorici 6% 100 ml
Da. Signa. Наружное (Раствор № 2)
Совместное применение двух растворов основано на способности натрия тиосульфата распадаться в кислой среде, выделяя серу и серы диоксид, которые обладают противопаразитарным действием.
Приготовление раствора № 1:
Пропись этого раствора — авторская, поэтому его готовят по массе (60,0 г + 40,0 г) = 100,0 г. Если необходимо приготовить 100 мл раствора в массо-объемной концентрации, следует произвести определенные расчеты. 100,0 г 60 %-ного раствора натрия тиосульфата занимает объем 73,5 мл, поэтому для приготовления 100 мл раствора следует взять натрия тиосульфата 81,63 г: NB!!!!
60,0 — 73,5 мл
х — 100 мл
Х = 81, 63 г
готовят с учетом КУО натрия тиосульфата: 100 — (81,63•0,51) = 58 мл. NB!!!!
Запрещается готовить раствор путем растворения 60,0 г натрия тиосульфата и доведением полученного раствора до объема 100 мл, так как массо-объемная концентрация лекарственного вещества в растворе составит только 46,37%. NB!!!!
Для приготовления раствора № 2 кислоты хлористоводородной 24,8—25,2 % следует взять 6 мл. Тогда кислоты хлористоводородной разбавленной (8,3 %) необходимо взять в 3 раза больше (см. ГФ Х, ст. 18, с. 55), то есть 18 мл, а воды соответственно 82 мл. NB!!!!
Получение Н2О2.
Молекулы Н2О2 всегда получаются в небольших количествах при горении и окислении различных соединений. При горении Н2О2 образуется либо при отрыве атомов водорода от исходных соединений промежуточными гидропероксидными радикалами, например: HO2. + CH4 ® H2O2 + CH3., либо в результате рекомбинации активных свободных радикалов: 2ОН. ® Н2О2, Н. + НО2. ® Н2О2. Например, если кислородно-водородное пламя направить на кусок льда, то растаявшая вода будет содержать в заметных количествах Н2О2, образовавшийся в результате рекомбинации свободных радикалов (в пламени молекулы Н2О2 немедленно распадаются). Аналогичный результат получается и при горении других газов. Образование Н2О2 может происходить и при невысокой температуре в результате различных окислительно-восстановительных процессов.
В промышленности пероксид водорода уже давно не получают способом Тенара – из пероксида бария, а используют более современные методы. Один из них – электролиз растворов серной кислоты. При этом на аноде сульфат-ионы окисляются до надсульфат-ионов: 2SO42– – 2e ® S2O82–. Надсерная кислота затем гидролизуется:
H2S2O8 + 2H2O ® H2O2 + 2H2SO4.
На катоде, как обычно, идет выделение водорода, так что суммарная реакция описывается уравнением 2H2O ® H2O2 + H2. Но основной современный способ (свыше 80% мирового производства) – окисление некоторых органических соединений, например, этилантрагидрохинона, кислородом воздуха в органическом растворителе, при этом из антрагидрохинона образуются Н2О2 и соответствующий антрахинон, который потом снова восстанавливают водородом на катализаторе в антрагидрохинон. Пероксид водорода извлекают из смеси водой и концентрируют перегонкой. Аналогичная реакция протекает и при использовании изопропилового спирта (она идет с промежуточным образованием гидропероксида): (СН3)2СНОН + О2 ® (СН3)2С(ООН)ОН ® (СН3)2СО + Н2О2. При необходимости образовавшийся ацетон также можно восстановить до изопропилового спирта.
Раствор уксусной кислоты.
Исходная уксусная кислота может быть разбавленная (29,5—30,5 %) или концентрированная (98 %).
В медицинской практике применяют 5—8 %-ные растворы уксусной кислоты для наружного применения (обтирания). При приготовлении этих растворов всегда исходят из ее фактического содержания в исходном растворе.
NB!!!!Если в рецепте концентрация кислоты не обозначена, то готовят 30 %-ный раствор кислоты уксусной.
Пример №11
Rp.: Solutionis Acidi acetici 5% 100 ml
Da. Signa. Для обтирания
Для приготовления этого раствора лучше использовать кислоту уксусную разбавленную.
Расчет: Кислоты уксусной разбавленной
Х = 5*100/30= 17 мл
Воды очищенной 100 – 17 = 83 мл
Во флакон для отпуска отмеривают 83 мл воды и добавляют 17 мл разбавленной уксусной кислоты.
Раствор аммиака
Представляет собой 10 %-ный раствор аммиака в воде, который применяют как средство скорой помощи для возбуждения дыхания и выведения больных из обморочного состояния. Иногда применяют внутрь в качестве рвотного средства (по 5—10 капель на 100 мл воды); при укусах насекомых применяют наружно в виде примочек; в хирургической практике — для мытья рук (25 мл на 5 л теплой кипяченой воды).
Если выписан раствор аммиака без указания концентрации, то всегда имеется в виду фармакопейный препарат, содержащий 10 % аммиака (Solutio Ammonii caustici) — нашатырный спирт.
При приготовлении растворов аммиака требуемой по рецепту концентрации в расчетах всегда исходят из фактического содержания аммиака в растворе.
Пример №12
Rp.: Solutionis Ammonii caustici 0,5% 500 ml
Da. Signa. Для мытья рук
Расчет: 10 %-ного раствора аммиака
Х= 0,5*500/10= 25 мл
Воды очищенной : 500 – 25 = 475 мл
Для приготовления раствора по данной прописи во флакон для отпуска отмеривают 475 мл воды очищенной и 25 мл 10%-ного раствора аммиака.
Концентрация аммиака в растворе изменяется, поэтому требуется периодически ее контролировать, а при необходимости — укреплять раствор добавлением более крепкого 25—27%-ного раствора аммиака (ГФ Х, с. 868). При смешивании жидкостей пользуются следующими формулами:
NB!!!! Х = M * (a – c)/(B — c)
NB!!!! Y = M — X
NB!!!!где Х — количество крепкого раствора, которое необходимо взять в работу для укрепления слабого раствора, мл;
М — количество раствора, которое необходимо приготовить, мл;
a — желаемая крепость этого раствора, %;
b — концентрация имеющегося крепкого раствора, %;
c — концентрация имеющегося слабого раствора, %;
Y — количество имеющегося слабого раствора, мл.
Например, необходимо приготовить 10 л 10 %-ного раствора аммиака из имеющегося 5 %-ного раствора путем смешивания его с 25 %-ного раствором аммиака:
Х =10 * (10 – 5)/ (25-5) = 2, 5 л;
Y = 10 − 2, 5 = 7, 5 л.
Таким образом, чтобы получить 10 л 10 %-ного раствора аммиака, необходимо взять 7,5 л 5%-ного раствора и 2,5 л 25%-ного раствора аммиака.
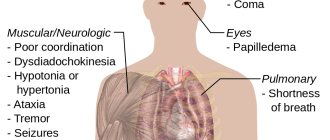
Перекись водорода — польза для организма
Лечение перекисью водорода это новое универсальное профилактическое средство, благодаря которому можно избежать инсультов, инфарктов, устранить атеросклероз и острые сосудистые болезни. После того, как профессор Неумывакин исследовал перекись водорода (H2O2), применяя его на себе и ощутил все его свойства, препарат стали широко использовать.
Сначала перекись водорода применяли только против сердечнососудистых заболеваний, а потом обнаружилось, что с ее помощью также можно лечить аллергию, бронхиты и эмфизему легких. Препарат обладает такими свойствами, при которых уничтожаются раковые клетки, со стенок сосудов удаляются жиры и происходит лечение лейкозов. К препарату нет противопоказаний, нужно лишь правильно рассчитывать дозировку.
Перекись водорода используют при различных инфекциях и заболеваниях, она хорошо защищает от вирусов, бактерий и грибков. Благодаря этому препарату можно стимулировать иммунную систему, а также он является универсальным средством для поддержки жизненно важных процессов и с его помощью организм противостоит против любых заболеваний и инфекций.
Перекись водорода попадая в организм разлагается на воду (H2O) и атомарный кислород(O). И именно он вступает в борьбу за жизнь человека, но только при условии правильного применения. Лечение перекисью водорода особенно эффективно в присутствии витамина С, поэтому во время данного лечения рекомендуется принимать эти витамины в виде драже или употреблять продукты с большим содержанием витамина С.
Важно помнить, что принимать перекись можно только на голодный желудок, соответственно за полчаса до еды или не ранее, чем через 2 часа после еды. Важное примечание: прежде чем начинать лечение перекисью водорода, следует провести очищение своего организма от шлаков: почистить печень, суставы, кровь, почки.
Препараты на основе перекиси водорода можно принимать совместно с различными фитопрепаратами, но нельзя совмещать с лекарствами. Лекарства можно применять только через полчаса после лечения H2O2. При приеме лекарства не стоит переживать из-за легкого жжения в желудке, если оно появилось необходимо снизить дозу препарата до тех пор, пока организм не привыкнет.
Неводные растворы
В медицинской практике широкое применение находят растворы на неводных растворителях (неводные растворы) в качестве:
- примочек,
- полосканий,
- смазываний,
- обмываний,
- интраназальных капель,
- ингаляций.
В зависимости от свойств растворителя различают неводные растворы на летучих, нелетучих и комбинированных растворителях.
К летучим жидкостям, которые применяются в качестве растворителей относятся:
- спирт этиловый,
- хлороформ,
- эфир.
К нелетучим:
- глицерин,
- жирные масла (персиковое, миндальное, подсолнечное),
- масло вазелиновое,
- димексид.
Приготовление растворов на летучих растворителях.
В данном случае необходимо учитывать возможность значительных потерь растворителя и соответствующее увеличение концентрации раствора за счет испарения в процессе приготовления.
Во избежание этих потерь нежелательны такие операции как нагревание, фильтрование или процеживание. Кроме того спирт этиловый, эфир, за исключением хлороформа, огнеопасны, поэтому растворение в данном случае следует производить при соблюдении техники безопасности (вдали от огня).
NB!!!!Спиртовые, эфирные и хлороформные растворы приготовляют непосредственно в отпускных флаконах. Флаконы должны быть чистыми и сухими, так как вода плохо смешивается с органическими растворителями (кроме спирта) и изменяет их растворяющую способность.
NB!!!!При приготовлении спиртовых растворов, в отличие от водных, в сухой флакон для отпуска помещают сначала растворяемое лекарственное вещество (если оно объемное и рыхлое, то используют сухую воронку), а затем растворитель, так как всыпание порошка через смоченное спиртом горлышко флакона затруднительно.
Процеживание этих растворов производят в случае необходимости через маленький комок сухой ваты при помощи воронки, прикрытой стеклом. Процеживание эфирных растворов особенно нежелательно.
В качестве летучего растворителя наиболее часто в аптечной практике используется спирт этиловый.
С п и р т о в ы е р а с т в о р ы.
Спирт этиловый и его водные растворы применяют для растворения многих лекарственных веществ:
- органических кислот,
- оснований алкалоидов,
- эфирных масел,
- йода,
- камфоры,
- резорцина,
- ментола,
- перекиси водорода,
- формалина и других веществ.
Спирт этиловый может применяться и как лекарственное средство, имеющее дезинфицирующее, освежающее и раздражающее свойства, для компрессов и т. д.
NB!!!!Если в рецепте не указана концентрация спирта этилового, то используют 90 %.
NB!!!! Исключение составляет 10 %-ный раствор йода, который готовят с использованием 95 %спирта по прописи ГФ Х ст. 356, а также некоторые растворы, согласно утвержденной нормативно- технической документации
Если крепость этилового спирта указана в процентах, следует понимать объемные проценты.
Пример №13
Rp.: Acidi salicylici 0,3
Spiritus aethylici 30 ml
Misce. Da. Signa. Протирать ступни ног
NB!!!!Рецепт должен быть оформлен штампом лечебного учреждения, личной печатью и подписью врача, печатью лечебного учреждения «Для рецептов».
NB!!!! Для приготовления 1 %-ного раствора кислоты салициловой используют 70 % спирт.
В чистый сухой флакон с хорошо подобранной пробкой помещают 0,3 г кислоты салициловой, отмеривают мерным цилиндром 30 мл 70 % этилового спирта и быстро закрывают пробкой с целью предотвращения улетучивания спирта. Лекарственный препарат оформляют сигнатурой.
Если в аптеке готового 70 % спирта не оказалось, то его готовят из спирта имеющейся концентрации.
Правила разведения спирта
Разбавление спирта этилового водой до нужной концентрации требует проведения соответствующих расчетов. Для этого используют алкоголеметрические таблицы ГФ ХI спирта различной крепости при 20 °С, см. приказ №308 — таблица, показывающая количество (в мл при 20 °С) воды и спирта различной крепости, которые необходимо смешать, чтобы получить 1 л спирта крепостью 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90%.
В аптеки, как правило, поступает спирт с содержанием в нем безводного спирта свыше 96 % (96,1—96,7). Поэтому для приготовления стандартных водно-спиртовых растворов разбавляют имеющийся крепкий спирт, пользуясь таблицей № 5 (ГФ ХI), в которой указывается (в мл при 20 °С) количество воды и спирта различной крепости (95,1—96,5), которые необходимо смешивать, чтобы получить 1 л (при 20°С) спирта крепостью 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95%.
В приказе МЗ № 308 — приведены таблицы в которых указывается соответствие объемов (мл) этилового спирта различной концентрации массе (г) спирта (при 20 °С).
Концентрация исходного спирта дана в объемных процентах для 95, 96, 96,1, 96,2, 96,3, 96,4, 96,5, 96,6, 96,7%.
Для расчетов также используют формулу разбавления:
Х =V*B/A
где Х — количество крепкого спирта, мл;
V — количество этилового спирта требуемой концентрации, мл;
А — концентрация крепкого спирта, мл;
В — требуемая концентрация, %.
Для приготовления 70 % спирта по вышеприведенному рецепту количество 90 % спирта составляет 23,3 мл:
Х =30 * 70/90= 23, 3 мл.
Количество воды, необходимое для приготовления 70 % спирта, нельзя рассчитывать путем вычитания объема 90 % спирта из общего объема раствора, так как необходимо учитывать контракцию — уменьшение в объеме.
Найденное количество 90 % спирта (23,3 мл) отмеривают мерным цилиндром при 20 °С, добавляют примерно 7 мл воды, раствор перемешивают и охлаждают до 20 °С, а затем доводят водой до нужного объема 30 мл.
По таблице № 4 (ГФ ХI) можно рассчитать количество обоих компонентов:
Спирта 90% — 23,34 мл
Воды — 7,2 мл
NB!!!! Поскольку предметно-количественный учет в аптеках ведут по массе, одновременно производят перерасчет объемных единиц в весовые.
Пример №14
Rp.: Acidi salicylici 1,5
Laevomycetini 3,0
Camphorae 1,0
Sp. aethylici 50 ml
Tincturae Calendulae 10 ml
Misce. Da. Signa. Протирать кожу лица
Во флакон для отпуска помещают 3,0 г левомицетина, 1,5 г кислоты салициловой, 1,0 г камфоры, добавляют 50 мл 90% спирта этилового и взбалтывают. После растворения веществ добавляют 10 мл настойки календулы.
Приготовление растворов на нелетучих растворителях.
Растворы лекарственных веществ на нелетучих растворителях готовят по массе, так как значительная вязкость указанных растворителей приводит к большим потерям при отмеривании.
Масса таких растворов складывается из суммы количеств лекарственных веществ и растворителя.
Учитывая, что растворение в вязких растворителях протекает медленно, целесообразно проводить его при нагревании с учетом свойств лекарственных веществ. Однако в этом случае необходимо избегать приготовления насыщенных растворов, так как при охлаждении такого раствора растворимое вещество может выпадать в осадок. Растворы на вязких растворителях готовят непосредственно во флаконах для отпуска, а процеживают лишь в крайних случаях и только сквозь марлю.
Г л и ц е р и н о в ы е р а с т в о р ы
Широко применяются в качестве различных смазываний. В виде глицериновых растворов прописывают:
- кислоту борную,
- натрия тетраборат,
- иод,
- танин,
- ихтиол и другие вещества.
Глицерин обладает значительной вязкостью, поэтому приготовление глицериновых растворов может происходить при подогревании и без подогревания, что полностью зависит от термолабильности входящих лекарственных веществ. При подогревании до 40—50 °С вязкость глицерина снижается и процесс растворения ускоряется.
NB!!!! Натрия тетраборат и кислоту борную лучше растворять в подогретом глицерине, при растворении они образуют глицероборную кислоту, которая придает растворам кислую реакцию.
Для нейтрализации глицероборной кислоты часто наряду с кислотой борной прописывают натрия гидрокарбонат. Прибавлять его следует осторожно небольшими порциями, так как реакция нейтрализации протекает бурно и может происходить разбрызгивание раствора.
Пример №15
Rp.: Acidi borici 1,0
Glycerini 90,0
Misce. Da. Signa. Для смачивания тампонов
В сухой флакон для отпуска с подобранной пробкой помещают кислоту борную, тарируют на технических весах и отвешивают 90,0 г глицерина, подогревают на водяной бане при температуре 50—60 °С до полного растворения кислоты борной. Оформляют к отпуску.
Пример №16
Rp.: Natrii tetraboratis 1,0
Aquae purificatae
Glycerini aa — 5,0
Misce. Da. Signa. Смазывание
Растворимость натрия тетрабората в воде 1:25, в глицерине 1:2,5. Следовательно, во флакон для отпуска помещают 1,0 г натрия тетрабората (через сухую воронку), тарируют его (без воронки) и туда отвешивают глицерин, закрывают пробкой и подогревают на водяной бане путем погружения флакона в теплую воду до полного растворения натрия тетрабората. Затем прибавляют 5 мл воды очищенной.
NB!!!! При приготовлении глицериновых растворов йода подогревание нежелательно.
Пример №17
Rp.: Iodi 1,0
Kalii iodidi 2,0
Aquae purificatae 3 ml
Glycerini 94,0
Misce. Da. Signa. Для тампонов при вульвовагините
В начале готовят концентрированный раствор калия йодида. В отпускной флакон из оранжевого стекла отмеривают воду очищенную и растворяют в ней калия йодид, затем йод. Флакон тарируют на технических аптечных весах, отвешивают глицерин, взбалтывают до получения раствора и оформляют к отпуску.
В случае если в рецепте не прописана вода, ее необходимо взять в минимальном количестве (равном количеству калия йодида).
М а с л я н ы е р а с т в о р ы.
Жирные масла, а также вазелиновое масло — хорошие растворители для многих лекарственных средств, которые довольно широко применяются в виде ушных и интраназальных капель.
С целью ускорения растворения применяют легкое подогревание.
NB!!!! Если в масляном растворе прописано летучее вещество, например ментол, камфора, то для устранения потери растворение производят в предварительно подогретом масле при температуре не выше 40 °С.
Пример №18
Rp.: Mentholi 0,1
Olei Vaselini 10,0
Misce. Da. Signa. Капли в нос
В сухой флакон для отпуска отвешивают 10,0 г масла вазелинового, подогревают на водяной бане не выше 40—50 °С и затем растворяют в нем 0,1 г ментола (пахучее вещество). Процеживают в случае необходимости.
При приготовлении масляных растворов необходимо обратить внимание на приготовление ушных капель с карболовой кислотой.
В ГФ Х имеется два препарата фенола: кристаллический и жидкий. Если в рецепте не указано, какой надо применять, то берут кристаллический. Жидкий фенол используется для приготовления только водных растворов.
Пример №19
Rp.: Acidi carbolici 0,4
Olei Helianthi 20,0
Misce. Da. Signa. Ушные капли
В сухой флакон для отпуска помещают 0,4 г фенола кристаллического, отвешенного на ручных весах на кружке из пергаментной бумаги (стараясь не дотрагиваться руками во избежание ожогов).
Флакон тарируют на технических аптечных весах, куда отвешивают 20,0 г масла подсолнечного, закрывают ранее подобранной пробкой с прокладкой и взбалтывают до полного растворения фенола.
К неводным растворителям относятся также эвтектические сплавы, которые получаются в результате взаиморастворения двух твердых веществ, обладающих высокими криоскопическими константами или низкими температурами плавления, или и тем и другим.
Готовят эвтектические сплавы путем помещения прописанных лекарственных веществ во флакон для отпуска, который хорошо закрывают пробкой и ставят в теплую (40 °С) воду до полного их расплавления.
При приготовлении значительных количеств жидких эвтектических сплавов иногда прибегают к растиранию и перемешиванию в ступке.
Пример №20
Rp.: Camphorae
Chlorali hydrati a—a 1,5
Misce. Da. Signa. Зубные капли
В сухой флакон для отпуска помещают камфору и хлоралгидрат, плотно закрывают пробкой, помещают в теплую (40 °С) воду и выдерживают до полного расплавления — образуется жидкость.
Пример №21
Rp.: Iodi 10,0
Dimexidi ad 100,0
Misce. Da. Signa. Смазывать ногти, стопы ног
В сухой флакон для отпуска помещают 10,0 г йода, тарируют флакон и отвешивают 90,0 г димексида и взбалтывают до растворения (растворимость йода в димексиде 1:1).
Химические свойства
Оба атома кислорода находятся в промежуточной степени окисления −1, что и обусловливает способность пероксидов выступать как в роли окислителей, так и восстановителей. Наиболее характерны для них окислительные свойства:
Na2SO3 + H2O2 → Na2SO4 + H2O Mn(OH)2 + H2O2 → MnO(OH)2 + H2O
При взаимодействии с сильными окислителями пероксид водорода выступает в роли восстановителя, окисляясь до атомарного кислорода:
2AgNO3 + H2O2 → 2Ag + 2O + 2HNO3
Молекула пероксида водорода сильно полярна, что приводит к возникновению водородных связей между молекулами. Связь O—O непрочна, поэтому H2O2 — неустойчивое соединение, легко разлагается. Также этому может поспособствовать присутствие ионов переходных металлов. В разбавленных растворах пероксид водорода тоже неустойчив и самопроизвольно диспропорционирует на H2O и O. Реакция диспропорционирования катализируется ионами переходных металлов, некоторыми белками:
2H2O2 → 2H2O + O2
Однако очень чистый пероксид водорода вполне устойчив.
Пероксид водорода проявляет слабые кислотные свойства (К = 1,4⋅10−12), и поэтому диссоциирует по двум ступеням:
H2O2 ⇄ H+ + HO2− ; HO2− ⇄ H+ + O22−
При действии концентрированного раствора H2O2 на некоторые гидроксиды в ряде случаев можно выделить пероксиды металлов, которые можно рассматривать как соли пероксида водорода (Li2O2, MgO2 и др.):
H2O2 + 2NaOH → Na2O2 + 2H2O H2O2 + Ba(OH)2 → BaO2↓ + 2H2O
Пероксид водорода может проявлять как окислительные, так и восстановительные свойства. Например, при взаимодействии с оксидом серебра он является восстановителем:
H2O2−1 + Ag2O ⟶ 2Ag + O20 + H2O
В реакции с нитритом калия соединение служит окислителем:
KNO2 + H2O2−1 ⟶ KNO3−2 + H2O
Пероксидная группа [—O—O—] входит в состав многих веществ. Такие вещества называют пероксидами, или пероксидными соединениями. К ним относятся пероксиды металлов (Na2O2, BaO2 и др.). Кислоты, содержащие пероксидную группу, называют пероксокислотами, например, пероксомонофосфорная H3PO5, пероксодисерная H2S2O8 и пероксоазотная HNO4 кислоты.