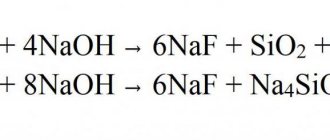Описание элемента
В жидкой форме аммиака молекулы соединены водородной связью. Температура, вязкость и плотность аммиака по сравнению с водой значительно ниже. Процесс кипения начинается от 33 градусов, а процесс горения или плавления — от 77 градусов по Цельсию. Показатели проводимости и диэлектрической проницаемости аммиака низкие. Следовательно, прочность связей в состоянии жидкости низкая.
Аналогично воде, аммиак в жидком состоянии ассоциирован из-за наличия водородной связи. Переход химического состава в состояние жидкости, не имеющей цвета, с плотностью 681 килограмм на метр кубический, быстрый. Проводимость тока в этом состояние практически отсутствует.
Содержание
- 1 Химические свойства
- 2 История
- 3 Происхождение названия
- 4 Жидкий аммиак
- 5 Комплексообразование
- 6 Биологическая роль
- 7 Физиологическое действие
- 8 Применение
- 9 Получение 9.1 Расходные нормы на тонну аммиака
Химические свойства
По свойствам аммиак замечательный растворитель для разнообразных органических и неорганических составов. В твёрдом состоянии представляет собой кристаллы, не имеющие цвета. Может взаимодействовать с кислородом, хлоридом, серной кислотой, а также реагировать на водные и соляные растворы.
Аммиак обладает следующими химическими свойствами:
- Играет роль нуклеофила или комплексообразователя в химических реакциях. При присоединении протона образовывает аммоний: NH3 + H+ → NH4+.
- В жидком растворе происходит слабая щелочная реакция из-за протекающего процесса: NH 3 + H2О → NH4+ +ОН-.
- При воздействии кислот получается соль аммония, что демонстрирует уравнение: NH3 + HNO3 → NH4NO3.
- В соединении с металлами за счет кислотных свойств образует амиды: 2NH3 +2К →2КNH2 +Н2.
Состав амида, имида и нитрида металла образуют за счет реакции с аммиаком в жидком состоянии. Нитрид получают посредством прогревания металла в азотной атмосфере.
Амиды имеют идентичные свойства гидроксидам (за счет неэлектронных ионов ОН, NH2 и молекулы воды). Основание амида сильнее гидроксида, поэтому он подвержен гидролизу, который необратим.
Растворы амидов на основе аммиака проводят ток и подвержены диссоциации: MNH2 → M+ + NH2.
Фенолфталеин в составе раствора приобретает красный оттенок, но после добавления кислот наступает процесс нейтрализации.
Аммиаку в жидком состоянии свойственны ионизирующие функции растворителя, который способен растворить щелочные металлы и щелочноземельные. При этом он приобретает синий цвет. Концентрированный раствор отличается блеском металла. Во время испарения металлы из щелочи получают в целом виде, а щёлочноземельные образуют с аммиаком комплексы со свойствами проводимости металлов.
В результате происходит распадение металлических атомов на ионы, которые положительно заряжены и электроны, сульфатированные в окружении молекул NH 3. Растворы с наличием свободных электронов имеют свойства сильнейших восстановителей.
За счет электронодонорного свойства частицы аммиака могут присутствовать в комплексных соединениях в виде лигандов. Для образования аминокомплексов вводят избыточное количество аммиака в солевой раствор металла.
Химическая реакция вызывает изменение цвета реагентов. Прочными связями комплекса обладают соединения с наличием хрома и кобальта, степень окисления которого +3.
Биологическая роль
Аммиак — вещество, образующееся в организмах живых существ при метаболизме, являющееся в них продуктом азотистого обмена. В физиологии животных для него отведена важная роль, однако он имеет высокую токсичность для организмов и почти не содержится в них в чистом виде. Большая его часть перерабатывается печенью в безвредное вещество – мочевину или как ее еще называют карбамид.
Также он способствует нейтрализации кислот поступающих в организм с пищей, поддерживая кислотно-щелочной баланс крови.
Аммиак – это важный источник азота для растений. Главным образом они поглощают его из почвы, но это очень трудоемкий и неэффективный процесс. Некоторые растения способны накапливать азот, который содержится в атмосфере, с помощью специальных ферментов – нитрогеназов. После чего они перерабатывают азот в полезные им соединения, например, белки и аминокислоты.
Физическое воздействие
По физическим свойствам аммиак относится к веществам, обладающим удушающими характеристиками и действием на нервную систему. При попадании в область дыхательных путей способен токсинами поразить легкие и вызвать отек с поражением разных систем живого организма. По виду действия может быть местного применения и резорбтивного.
Аммиачные пары раздражает слизистую оболочку глаза и кожные покровы. Процесс протекает с сильным неприятным запахом. Вследствие воздействия пара происходит обильное выделение слез и боли в области лица. В результате появляется ожог роговицы глаза. Зрение человека ухудшается или происходит полная его потеря. Следом наступает приступ кашля, изменение цвета кожного покрова с сильным раздражением.
Во время попадания раствора на кожу происходит жжение пораженной поверхности и образование пузырей и изъязвлений. По своим свойствам в сжатом состояние во время процесса испарения поглощает тепло. Попадая на кожу, химический элемент способен вызвать отморожение разной степени. Наличие запаха ощущается при концентрации 37 миллиграмм на метр кубический.
Норма концентрации аммиака на рабочем месте не должна превышать 20 миллиграмм на метр кубический. Работать при более тяжелых условиях без средств индивидуальной защиты запрещено.
Раздражение глаз проявляется при 490 миллиграммах концентрации в воздухе, а зева — 280. Токсичное отравление и лёгочный отек происходит при концентрации состава в 1,5 грамма на метр кубический (если находиться в области облака испарений в течение двух часов).
Агрегатные состояния
Аммиак может находиться в разных агрегатных состояниях:
- Он присутствует в виде бесцветного газа с неприятным резким запахом в нормальных условиях.
- Также он очень хорошо может растворяться в воде, поэтому его можно хранить в виде водного раствора с определенной концентрацией. Он сжижается и становится жидкостью в результате давления и сильного охлаждения.
- Аммиак имеет твердое состояние, в котором он предстает бесцветными кубическими кристаллами.
Применение и использование
Аммиак входит в большое количество веществ в промышленности. Объемы изготовления этого химического элемента достигают 150 миллионов тонн. Чаще всего производят:
- азотные удобрения (аммоний и мочевина);
- вещества на взрывчатой основе;
- азотные кислоты.
Возможно применение аммиака в роли растворителя. В холодильной промышленности встречается в виде холодильного агента (R 717).
В области медицины аммиак или нашатырный спирт (более привычное название — нашатырь) выводит человека из состояния обморока, стимулирует рвотный рефлекс. Для наружного применения используют в качестве обеззараживания укусов насекомых и при обрабатывании рук врачей. При неосторожном использовании возможно получить ожог органов пищеварения, остановку работы легких.
Применение при дерматите, кожных заболеваниях, а также повреждениях кожи в результате травмы категорически запрещено. Местное использование разрешено на здоровой области кожи. При неаккуратном применении и попадании раствора на слизистую часть глазного яблока следует обработать пострадавшую область водой или борной кислотой. Обработку необходимо повторять каждые 10 минут.
Применять вещества на масляной основе и различные мази нельзя. При попадании на область носа следует промыть ее лимонной кислотой или соком из натуральных фруктов. При попадании в область рта рекомендуется обильное употребление воды, фруктового сока.
Отравление аммиаком
Как уже выше упоминалось, аммиак – это крайне токсичное и ядовитое вещество. Его относят к четвертому классу опасности.
Отравление этим газом сопровождается нарушением многих процессов организма:
- Сначала поражается нервная система и снижается усвоение кислорода нервными клетками.
- При проникновении в глотку, затем трахею и бронхи аммиак оседает на слизистых покровах, растворяется, образуя щелочь, которая начинает пагубно действовать на организм, вызывая внутренние ожоги, разрушая ткани и клетки.
- Это вещество также оказывает разрушающее воздействие на жировые компоненты, которые в том или ином виде входят в состав всех органов человека.
- Попадают под влияние сердечно-сосудистая и эндокринная система, нарушается их работа.
После контакта с аммиаком страдает почти весь организм человека, его внутренние ткани и органы, ухудшается процесс жизнедеятельности.
Чаще всего случаи отравления этим газом происходят на химических производствах в результате его утечки, но также можно им отравиться и в домашних условиях, например, если емкость, в которой содержится нашатырный спирт, неплотно закрыта, и его пары накапливаются в помещении.
Отравление может произойти, даже когда при обморочном состоянии человеку подносят к носу тампон, смоченный в нашатыре. Если пострадавшему дать понюхать его более пяти секунд, то высок риск интоксикации, так что с нашатырным спиртом всегда следует обращаться предельно осторожно.
Способы получения
Аммиак производят при водородном и азотном взаимодействии молекул в промышленности. Техника производства называется процессом Габера. Вся реакция протекает с выбросом тепла и уменьшением объема. Таким образом, реакция проводится при пониженной температуре окружающей среды и повышенном давлении. Равновесие смещается вправо. В этих условиях скорость прохождения реакции маленькая, а при повышении показаний температуры скорость начинает увеличиваться. Для безопасного проведения реакции требуется специальное оборудование, поддерживающее повышенное давление.
Для ускорения получения состояния равновесия используют катализаторные материалы — железо с пористым составом и некоторым процентом добавок.
По всем свойствам процесс получения аммиака происходит при температуре в 500 градусов по Цельсию и при наличии высокого давления, достигающего 350 атмосфер. Процент добычи при соблюдении этих факторов составит 30 процентов. В промышленности процесс зациклен. Происходит охлаждение состава и удаление аммиака, а непрореагировавший азот и водород возвращают для повторного синтеза обратно. Этот способ добычи аммиака в промышленности считается самым экономичным.
В условиях лаборатории аммиак добывают за счет действия щелочей. Химический элемент получают путем нагревания аммония с известью. Для сушки аммиака используют известь с натром.
Благодаря физическим и химическим свойствам аммиака его успешно используют в промышленности, производстве, медицине, химии и многих других областях человеческой деятельности.
История
Аммиак был впервые выделен в чистом виде Дж. Пристли в 1774 году, который назвал его «щелочной воздух» (англ. alkaline air). Через одиннадцать лет, в 1785 году К. Бертолле установил точный химический состав аммиака. С того времени в мире начались исследования по получению аммиака из азота и водорода. Аммиак был очень нужен для синтеза соединений азота, поскольку получение их из чилийской селитры ограничивалось постепенным истощением запасов последней. Проблема уменьшения запасов селитры обострилась к концу XIX века. Только в начале XX века удалось изобрести процесс синтеза аммиака, пригодный для промышленности. Это осуществил Ф. Габер, начавший трудиться над этой задачей в 1904 году и к 1909 году создавший небольшой контактный аппарат, в котором использовал повышенное давление (в соответствии с принципом Ле-Шателье) и катализатор из осмия. 2 июля 1909 года Габер устроил испытания аппарата в присутствии К. Боша и А. Митташа, оба — от Баденского анилинового и содового завода (BASF), и получил аммиак. К. Бош к 1911 году создал крупномасштабную версию аппарата для BASF, а затем был построен и 9 сентября 1913 года вступил в строй первый в мире завод по синтезу аммиака, который был расположен в Оппау (ныне район в черте города Людвигсхафен-на-Рейне) и принадлежал BASF. В 1918 году Ф. Габер стал лауреатом Нобелевской премии по химии «за синтез аммиака из составляющих его элементов». В России и СССР первая партия синтетического аммиака была получена в 1928 году на Чернореченском химическом комбинате.
Профилактика при отравлении
Первая помощь в данном случае состоит из нескольких простых действий. Сначала необходимо вынести пострадавшего на свежий воздух, промыть ему лицо и глаза проточной водой. Даже те, кто был не очень хорош в химии, со школы знают: щелочь нейтрализуется кислотой, поэтому ротовую полость и нос нужно обязательно промыть водой с добавлением лимонного сока или уксуса.
Если отравившийся потерял сознание, следует уложить его на бок на случай рвоты, а при остановке пульса и дыхания сделать массаж сердца и искусственное дыхание.
Симптомы отравления
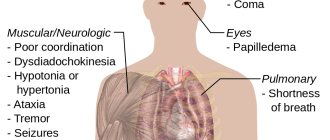
Ниже перечислен ряд признаков отравления аммиаком:
- Сильный кашель, затруднение дыхания.
- Жжение в глазах, слезоточивость, болевая реакция на яркий свет.
- Жжение в полости рта и носоглотке.
- Головокружение, головная боль.
- Боли в животе, рвота.
- Снижение слухового порога.
- При более серьезном отравлении возможны: потеря сознания, судороги, остановка дыхания, острая сердечная недостаточность. Совокупность нарушений может привести пострадавшего в коматозное состояние.
Последствия отравления
После интоксикации аммиаком человека могут ждать очень серьезные необратимые последствия. В первую очередь страдает центральная нервная система, что влечет за собой целый ряд осложнений:
- Мозг перестает полностью выполнять свои функции и начинает давать сбои, из-за этого снижается интеллект, появляются психические заболевания, амнезия, нервные тики.
- Понижается чувствительность некоторых частей тела.
- Нарушается работа вестибулярного аппарата. Из-за этого человек ощущает постоянное головокружение.
- Органы слуха начинают терять свою работоспособность, что приводит к глухоте.
- При поражении глазных покровов снижается зрение и его острота, в худшем случае пострадавшего ждет слепота.
- Наступление летального исхода. Это зависит от того, насколько концентрация газа в воздухе была высокой и сколько паров аммиака попало в организм.
Знать и соблюдать предписанные меры безопасности — значит оградить себя от риска угрозы собственной жизни или худшей участи — инвалидности, потери слуха или зрения.