Лизиноприл при лечении артериальной гипертонии у больных с патологией органов пищеварения
Распространенность артериальной гипертонии (АГ) в России достигает 40% у мужчин и 50% у женщин. У 83,3% больных АГ сочетается с заболеваниями органов пищеварения, в том числе у 30% с патологией печени.
Для коррекции артериального давления (АД) у больных АГ применяются антигипертензивные средства различных фармакологических групп, среди которых наиболее часто назначаемыми препаратами являются ингибиторы ангиотензин-превращающего фермента (АПФ) [7].
За прошедшие 30 лет ингибиторы АПФ были названы «краеугольным камнем лечения сердечно-сосудистых заболеваний» (E. Braunwald, 1991) и «золотым стандартом терапии» (J. Cohn, 1998) [10].
Результаты многочисленных международных исследований показали, что данные препараты являются наиболее эффективными, уменьшающими смертность от сердечно-сосудистых заболеваний, обладающими органопротективными действиями, и потому рекомендованы в качестве антигипертензивных средств первого ряда длительного лечения больных АГ.
В настоящее время наиболее известны десять ингибиторов АПФ: каптоприл, эналаприл, беназеприл, фозиноприл, лизиноприл, моэксиприл, периндоприл, квинаприл, рамиприл и трандолаприл. Для пяти из них (каптоприла, эналаприла, лизиноприла, рамиприла, трандолаприла) в крупных исследованиях было показано, что они снижают смертность [21, 23, 24, 28–32].
В скандинавском исследовании (STOP-2) сравнивалась эффективность ингибиторов АПФ (лизиноприл или эналаприл по 10 мг в сутки) с другими гипотензивными препаратами (блокаторы бета-адренорецепторов, гидрохлортиазид в комбинации с амилоридом или фелодипином) при лечении 6614 больных АГ в течение 54 месяцев [22].
В этом исследовании показано, что ингибиторы АПФ значительно снижали риск возникновения сердечной недостаточности.
Исследование ALLHAT включало 33 357 больных АГ, наблюдавшихся в среднем 4,9 года [1, 17]. Первой группе больных был назначен хлорталидон (до 25 мг в сутки), второй — амлодипин (до 10 мг в сутки), третьей — лизиноприл (до 40 мг в сутки). На фоне терапии лизиноприлом инсульт («конечная точка») развивался реже, чем при применении диуретика.
В исследовании TPOPHY сравнивалась эффективность монотерапии гидрохлортиазидом и лизиноприлом у больных АГ с избыточной массой тела. Монотерапия ингибитором АПФ обеспечила контроль АД у 60%, а диуретиком — у 43% больных. В группе, получавшей лизиноприл, более чем у половины доза 10 мг/сут оказалась достаточной и только у каждого четвертого понадобилось назначить 40 мг в сутки. Для достижения целевого уровня АД на терапии диуретиком почти у каждого второго потребовалось назначение 50 мг/сут гидрохлортиазида, что сопряжено с вероятностью возникновения жизнеопасных аритмий.
В исследовании GISSI-3 у больных, получавших лизиноприл, существенно снижался риск смерти и развития сердечно-сосудистой недостаточности [9].
Терапия ингибиторами АПФ у больных АГ и сахарным диабетом достоверно снижает риск возникновения поражения органов-мишеней. В исследовании EUCLID у 530 больных сахарным диабетом 1-го типа лизиноприл оказывал нефропротективное действие и снижал риск прогрессирования ретинопатии.
Многоцентровое рандомизированное двойное слепое исследование ATLAS показало, что лечение высокими дозами (33,2 мг в сутки) лизиноприла сопровождалось достоверным снижением риска смерти или госпитализаций на 12% [27].
Антигипертензивное действие ингибиторов АПФ связано с:
- ингибированием ренин-альдостерон-ангиотензин-системы в тканях и сосудистой стенке;
- торможением превращения неактивного ангиотензина I в активный вазоконстриктор ангиотензин II и уменьшением секреции альдостерона;
- увеличением активности ренина плазмы;
- аккумуляцией брадикинина вследствие ингибирования кининазы II;
- дилатацией почечных сосудов с повышением натрийуреза;
- усилением синтеза простагландинов PGI2 и PGE2 [18, 20].
Высвобождение PGI2 и PGE2 оказывает сосудорасширяющее, диуретическое и натрийуретическое действие. При лечении ингибиторами АПФ также уменьшается образование других вазоконстрикторных и антинатрийуретических веществ, таких как норадреналин, аргинин-вазопрессин, эндотелин-1 [12].
Гемодинамические эффекты при применении ингибиторов АПФ проявляются:
- уменьшением общего сопротивления сосудов в связи с непрямым вазодилатирующим эффектом, что приводит к снижению АД на 15–25%;
- релаксацией объемных сосудов со снижением давления наполнения левого желудочка;
- повышением минутного объема крови;
- увеличением почечного кровотока в связи с дилатацией эфферентных артериол в клубочках [11].
Классификация ингибиторов АПФ. Несмотря на общий механизм действия, ингибиторы АПФ различаются по химической структуре, наличию в молекуле дополнительных функциональных групп, природе пролекарства, активности и фармакинетическому профилю, что очень важно учитывать при лечении больных с различной патологией органов пищеварения [3].
Наиболее популярна химическая классификация, согласно которой препараты подразделяются на четыре основных класса в зависимости от того, какая химическая группа в их молекуле связывается с ионом цинка в активных центрах ангиотензин-I-превращающего фермента:
- препараты, содержащие сульфгидрильную группу;
- препараты, содержащие карбоксильную группу;
- препараты, содержащие фосфинильную группу;
- препараты, содержащие гидроксамовую группу [15].
Анализ данных литературы показывает, что по продолжительности антигипертензивного эффекта ингибиторы АПФ можно разделить на две группы:
- средней продолжительности — каптоприл;
- пролонгированного действия — эналаприл, лизиноприл, квинаприл, которые в большинстве случаев обеспечивают круглосуточный контроль за уровнем АД при приеме один раз в сутки.
Учитывая данные о физико-химических свойствах и фармакокинетических особенностях, ингибиторы АПФ подразделяются на три класса:
1. Липофильные ингибиторы АПФ (каптоприл), которые сами по себе обладают фармакологической активностью, но в печени подвергаются дальнейшим превращениям с образованием фармакологически активных дисульфидов, которые выводятся путем почечной экскреции.
2. Липофильные пролекарства (фармакологически неактивные) становятся активными диацидными метаболитами после метаболической трансформации в печени (эналаприл — в эналаприлат), которые затем трансформируются в неактивные соединения [13]. У больных с патологией печени оба этих процесса нарушены, а при снижении кровотока в печени отмечается задержка конверсии пролекарства в его активную форму при первом прохождении через нее.
Соответственно при заболеваниях печени, препараты, нуждающиеся в трансформации для приобретения активности, действуют слабее [6, 14].
Пролекарства более липофильны, чем их фармакологически активные метаболиты, что позволяет им обеспечивать быструю и полную абсорбцию при приеме внутрь.
Ингибиторы АПФ этого класса следует разделить на три подгруппы в зависимости от преимущественного пути элиминации их активных диацидных метаболитов:
- подкласс А — препараты с преимущественно почечной элиминацией;
- подкласс В — препараты с двумя основными путями элиминации;
- подкласс С — препараты с преимущественно печеночной элиминацией.
3. Гидрофильные препараты (лизиноприл), которые не подвергаются метаболизму в организме больного. Они циркулируют в крови в несвязанной с белками плазмы форме и подвергаются элиминации через почки в неизмененном виде. Концентрацию их в плазме крови определяют величина дозы, принятой внутрь, а также скорость абсорбции и скорость экскреции через почки [16, 19, 26].
Всего четыре ингибитора АПФ (каптоприл, либензаприл, лизиноприл и церонаприл) непосредственно обладают биологической активностью. Все другие ингибиторы АПФ сами по себе являются неактивными веществами или пролекарствами (pro-drugs), т. е. свое действие проявляют после биотрансформации в печени и образования активных метаболитов [25].
Степень блокирования тканевой ренин-ангиотензивной системы различными ингибиторами АПФ неодинакова. Препараты, которые характеризуются меньшей липофильностью, в меньшей степени вызывают накопление в тканях брадикинина, с которым связывают появление побочного действия — сухого кашля.
Лизиноприл является хорошо изученным ингибитором АПФ, польза которого является доказанной при лечении больных АГ.
Лизиноприл — активное фармакологическое соединение.
Лизиноприл был третьим ингибитором АПФ (после каптоприла и эналаприла) из вошедших в клиническую практику препаратов этой группы.
Лизиноприл оказывает пролонгированный антигипертензивный эффект. Начало антигипертензивного эффекта — через 1–3 ч после приема внутрь, пик действия — через 6 ч, продолжительность действия — 24 ч со стабильным действием через 2–4 недели лечения [4, 5].
Антигипертензивный эффект длится более суток. В случае резкого прекращения терапии лизиноприлом не происходит внезапного повышения АД, а также значительного превышения значений АД до начала лечения.
Лизиноприл вызывает дилатацию артериол и вен, что приводит к снижению АД приблизительно на 15% вследствие снижения общего периферического сопротивления сосудов. Лизиноприл не вызывает рефлекторной тахикардии из-за стимуляции блуждающего нерва и снижения чувствительности барорецепторов каротидного синуса вследствие улучшения податливости и дилатации сонной артерии.
Фармакокинетика
После приема внутрь биодоступность лизиноприла составляет 25–29%. Функциональное состояние печени не влияет на биодоступность. Прием пищи не изменяет абсорбцию препарата из желудочно-кишечного тракта. В организме человека он не подвергается метаболизму и экскретируется с мочой в неизмененном виде. В плазме крови лизиноприл не связывается с белками. Период полувыведения равен 12,6 ч. Препарат подвергается клубочковой фильтрации, секретируется и реабсорбируется в канальцах. Максимальная концентрация достигается через 6 ч после приема разовой дозы, а стационарный уровень концентрации при регулярном приеме — через 2–3 дня.
При АГ начальная доза — 10 мг/сут при одноразовом приеме с последующим возможным постепенным увеличением до 40 мг/сут.
Таким образом, при лечении больных АГ с патологией органов пищеварения врач имеет возможность выбирать препарат из различных классов ингибиторов АПФ в зависимости от их фармакокинетических особенностей.
В нашей работе мы оценивали эффективность ингибитора АПФ (лизиноприл) при терапии больных АГ с различной патологией органов пищеварения.
Цель исследования
Оценить особенности фармакодинамики лизиноприла при различных заболеваниях органов пищеварения у больных АГ.
Материалы и методы исследования
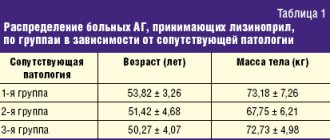
В исследование были включены 60 больных АГ в сочетании со стеатозом (1-я группа), циррозом печени (2-я группа), язвенной болезнью 12-перстной кишки (3-я группа), по 20 человек в каждой группе соответственно.
Титрование дозировок лизиноприла проводилось еженедельно под контролем суточного мониторирования АД (СМАД). На основании жалоб, данных анамнеза и обследования (анализы крови, эзофагогастродуоденоскопия, ультразвуковое исследование органов брюшной полости) установлено наличие патологии со стороны печени и верхних отделов пищеварительного тракта. Больные язвенной болезнью 12-перстной кишки с нормальной функцией печени составляли группу сравнения (табл. 1).
Для оценки эффективности лизиноприла проводилось СМАД с помощью монитора АВРМ-02 осциллометрическим методом измерения АД в свободном двигательном режиме. Регистрацию проводили на «нерабочей» руке при отсутствии асимметрии АД. При асимметрии АД более 5 мм рт. ст. исследование проводилось на руке с более высокими показателями. Измерение АД осуществляли в течение 24 часов каждые 15 минут с 6.00 до 22.00 ч и каждые 30 минут с 22.00 до 6.00 ч.
С целью уточнения суточного профиля АД и оценки гипотензивного эффекта лизиноприла по данным СМАД определяли усредненные показатели АД. В норме в дневные часы АД не должно превышать 140 и 90 мм рт. ст., в ночные часы — 120 и 80 мм рт. ст. В качестве показателя нагрузки давлением оценивали временной индекс (ВИ) — процент времени, в течение которого АД превышает критический уровень за определенные временные периоды (в соответствии с рекомендациями Американского гипертонического общества (American Society of Hypertension) ВИ более 30% свидетельствует о наличии повышенного АД) [3].
Для статистической обработки данных использовалась программа Statistica 5.0. Для каждого показателя вычисляли среднее значение и стандартное отклонение от среднего значения. Статистическую достоверность изменений показателей определяли с помощью критерия Фишера. Статистически достоверными считались различия при р < 0,05.
Результаты и их обсуждение
По данным СМАД у всех обследуемых больных исходно было выявлено стойкое повышение АД, достоверных различий между группами выявлено не было.
Эффективность терапии оценивали через 1, 2, 3 и 4 недели по уровню ВИ СМАД: хорошая — при ВИ менее 30%, неудовлетворительная — ВИ более 30%.
При недостаточной эффективности лизиноприла дозу постепенно увеличивали до 20 мг (табл. 2, 3).
Как видно из табл. 2 и 3, на фоне терапии лизиноприлом в дозе 10 мг/сут отмечено снижение среднесуточных показателей АД, ВИ АД во всех трех группах. При лечении лизиноприлом хороший антигипертензивный эффект был получен у 50% больных с циррозом печени. У 60% больных язвенной болезнью 12-перстной кишки хороший эффект был достигнут при приеме 10 мг/сут, у 30% больных — 20 мг/сут.
Недостаточная эффективность терапии лизиноприлом наблюдалась в 15% случаев у больных с циррозом печени и в 10% — с язвенной болезнью 12-перстной кишки даже при увеличении дозы препарата вдвое.
Заключение
Результаты настоящего исследования свидетельствуют о том, что эффективность монотерапии лизиноприлом не зависела от выраженности изменений печени у больных АГ.
В связи с этим становится особенно актуальным использование антигипертензивных препаратов, не метаболизирующихся в печени, способных обеспечить у больных АГ с патологией желудочно-кишечного тракта адекватный контроль за АД в течение 24 часов [2, 8].
Таким образом, лизиноприл является высокоэффективным антигипертензивным препаратом при лечении больных с различной патологией органов пищеварения.
Литература
- Беленков Ю. Н., Мареев В. Ю., Агеев Ф. Т. Ингибиторы ангиотензин-превращающего фермента в лечении сердечно-сосудистых заболеваний (квинаприл и эндотелиальная дисфункция). М., 2001. 86 с.
- Драпкина О. М., Маевская М. В., Корнеева О. Н., Тутнов Д. А., Ивашкин В. Т. Клиническое исследование эффективности и безопасности даприла (лизиноприла) при патологии печени и сопутствующей артериальной гипертонией // Российские медицинские вести. 2004, № 2, с. 39–42.
- Кобалава Ж. Д. Котовская Ю. В., Хирманов В. Н. Артериальное давление в исследовательской практике. Под ред. В. С. Моисеева, Р. С. Карпова. М.: Реафарм, 2004. 384 с.
- Комиссаренко И. А., Лазебник Л. Б., Михеева О. М. Особенности метаболизма гипотензивных препаратов у больных с патологией органов пищеварения // Кардиоваскулярная терапия и профилактика. Приложение 1. 2009. 8 (6). С. 239.
- Комиссаренко И. А., Михеева О. М., Дроздов В. Н., Петраков А. В., Сильвестрова С. Ю. Применение ингибиторов ангиотензин-превращающего фермента у больных артериальной гипертонией на фоне патологии печени // Consilium medicum. 2007. Т. 9. № 11. С. 72–75.
- Кушаковский М. С. Гипертоническая болезнь. СПб: Сотис, 1995. С. 243–253.
- Лазебник Л. Б., Дроздов В. Н. Заболевания органов пищеварения у пожилых. Анахарсис, 2003. С. 37–39.
- Лазебник Л. Б., Михеева О. М., Комиссаренко И. А., Дроздов В. Н., Петраков А. В., Сильвестрова С. Ю. Особенности лечения больных АГ ингибиторами АПФ при патологии органов пищеварения // Экспериментальная и клиническая гастроэнтерология, 2007. № 4. С. 47–55.
- Мазур Н. А. Эффективность нелипофильных ингибиторов ангиотензин-превращающего фермента в лечении сердечно-сосудистых заболеваний // Российский кардиологический журнал. 2003. № 4 (42). С. 76–79.
- Мареев В. Ю. Применение ИАПФ в лечении сердечно-сосудистых заболеваний в 21 веке. Почему выгодно предпочесть фозиноприл? Болезни сердца. Руководство для врачей. Под ред. Р. Г. Оганова, И. Г. Фоминой. М.: Литтерра, 2006. С. 3–8.
- Метелица В. И. Справочник по клинической фармакологии сердечно-сосудистых лекарственных средств. СПб — М.: Бином. 2-е изд. 2002. 925 с.
- Преображенский Д. В., Сидоренко Б. А. Лечение артериальной гипертензии. М., 1999. С. 126–136.
- Савенков М. П., Иванов С. Н., Боцоева М. А., Михайлусова М. П. Коррекция повышенного артериального давления в утренние часы с помощью ингибиторов АПФ // Гедеон Рихтер в СНГ. 2001. № 4 (8). С. 27–30.
- Савенков М. П., Иванов С. Н., Соломонова Л. А., Савенкова А. М. Утро начинается с рассвета и повышения артериального давления // Русский медицинский журнал. 2006. Т. 14, № 10. С. 734–736.
- Сторожаков Г. И. Ингибиторы АПФ: место в лечении и профилактике сердечно-сосудистых заболеваний // Consilium medicum. Экстра-выпуск. 2002, январь, с. 3–4.
- Тхостова Э. Б. Клиническая эффективность лизиноприла у больных сердечно-сосудистыми заболеваниями // Гедеон Рихтер в СНГ. 2001. № 4 (8). С. 23–25.
- ALLHAT Authors. Major Outcomes in High-Risk Hypertensive Patients Randomized to Angiotensin-Converting Enzyme inhibitor or Calcium channel blocker VS Diuretic. JAMA, December 18, 2002, 288, 23, 2981–2996.
- Campbell D. J., Kladis A., Duncan A. M. Effects of converting enzyme inhibitors on angiotensin and bradykinin peptides // Hypertens. 1994, 23: 439–449.
- Choodoff L. Lisinopril: a new ACE inhibitor for the treatment of hypertension and congestive heart failure // Mt. Sinai. J. Med. 1990. Vol. 57. P. 169–171.
- Furberg C. D., Pitt B. Are all angiotensin-converting enzyme inhibitors interchangeable? // Am Coll Cardiol. 2001, 37, 1456–1460.
- Gruppo Italiano per to Studio della Sopravvivenza nell’Infarto Miocardico (GISSI-3). Effects of lisinopril and transdermal glyceryl trinitrate singly and together on six-week mortality and ventricular function after acute myocardial infarction // Lancet. 1994; 343: 1115–1122.
- Hansson L., Lindholm L. H., Ekbom T. et al. Randomized trial of old аnd new antihypertensive drugs in elderly patients: cardiovascular mortality and morbidity the Swedish Trial in Old Patients with Hypertension-2 Study // Lancet. 1999, 354, 1751–1756.
- ISIS-4 (Fourth International Study of Infarct Survival) Collaborative Group (ISIS-4). A randomized factorial trial assessing early oral captopril, oral mononitrate and intravenous magnesium sulphate in 58 050 patients with suspected acute myocardial infarction // Lancet. 1995; 345:669–685.
- Kober L. et al. for the Trandolapril Cardiac Evaluation (TRACE) Study Group // N Engl J Med. 1995: 333: 1670–1676.
- Lancaster S. G., Todd P. A. Lisinopril: a preliminary review of its pharmacodynamic and pharmacokinеtic propertiсs and therapeutic use in hypertension and congestive heart failure // Drugs. 1988, 35: 646–669.
- Opie H. L. Angiotensin-converting enzyme inhibitors. Wiley-Liss-Authors Publishing. New-York, 1992.
- Packer M., Poole-Wilson P. A., Armstrong P. W. et al. Comparative effects of low and high doses of angiotensin-converting enzyme inhibitor, lisinopril, on morbidity and mortality in chronic heart failure. ATLAS Study Group // Circulation. 1999; 100 (23): 2312–2318.
- Pfeffer M. A. et al. On behalf of the SAVE Investigators. Effect of captopril on mortality and morbidity in patients with left ventricular dysfunction after myocardial infarction: results of the Survival And Ventricular Enlargement trial // N Engl J Med. 1992; 327: 669–677.
- The Acute Infarction Ramipril Efficacy (AIRE) Study Investigators. Effect of ramipril on mortality and morbidity of survivors of acute myocardial infarction with clinical evidence of heart failure // Lancet. 1993; 342: 821–828.
- The CONSENSUS Trial Study Group. Effects of enalapril on mortality in severe congestive heart failure. Results of the Cooperative North Scandinavian Enalapril Survival Study (CONSENSUS) // N Engl J Med/1987; 316: 1429–1435.
- The Heart Outcomes Prevention Evaluation Study Investigators. Effects of an angiotensin- converting enzyme inhibitor, ramipril, on cardiovascular events in high-risk patients // N Engl J Med. 2000; 342: 145–153.
- The SOLVD Investigators. Effect of enalapril on survival in patients with reduced left ventricular ejection fractions and congestive heart future // N Engl J Med. 1991; 325; 293–302.
Л. Б. Лазебник, доктор медицинских наук, профессор О. М. Михеева, доктор медицинских наук, профессор И. А. Комиссаренко, доктор медицинских наук, профессор
ГБОУ ВПО МГМСУ Минздравсоцразвития России, ГУ ЦНИИ гастроэнтерологии Департамента здравоохранения города, Москва
Контактная информация об авторах для переписки
Лизиноприл: универсальный препарат в арсенале врача– кардиолога
Эффективно влиять на сердечно–сосудистый континуум стало возможно с введением в клиническую практику диуретиков и селективных b–адреноблокаторов. Следующий этап – появление ингибиторов ангиотензинпревращающего фермента (иАПФ) и антагонистов кальция (АК), что способствовало дальнейшим успехам в лечении ССЗ. С полным основанием последнюю четверть ХХ века можно назвать «эрой иАПФ». На сегодняшний день пять основных классов антигипертензивных препаратов – тиазидные диуретики, АК, иАПФ, блокаторы ангиотензиновых ре¬цепторов (БАР) и b–блокаторы (БАБ) – подходят для ини¬циации и поддерживающего антигипертензивного ле¬чения в монотерапии или в комбинации [2,3]. При выборе того или иного антигипертензивного препарата необходимо помнить, что он не только должен адекватно снижать АД до целевого уровня, контролировать его в течение суток, улучшая профиль АД, но и отвечать ряду других требований: препарат должен уменьшать реабсорбцию Na+ и воды, не усиливать дисфункцию эндотелия, не активировать симпатическую нервную систему, обладать органопротективными свойствами, быть метаболически нейтральным. Таким требованиям полностью удовлетворяют иАПФ, которых насчитывается сегодня более 30 оригинальных препаратов и их дженериков. Их фармакологическое действие обусловлено влиянием на функциональное состояние ренин–ангиотензин–альдостероновой системы (РААС). Ингибиторы АПФ обладают высокой избирательностью действия: они подавляют превращение ангиотензина I в ангиотензин II, не взаимодействуя напрямую с другими компонентами РААС. Обобщая данные о свойствах и механизме действия иАПФ, можно остановиться на основных протективных эффектах данной группы препаратов: 1. Кардиопротективные эффекты (восстановление баланса между потребностью и обеспечением миокарда О2, снижение пред– и постнагрузки левого желудочка (ЛЖ), уменьшение объемов и массы, замедление ремоделирования ЛЖ, уменьшение симпатической стимуляции, антиаритмический эффект). 2. Вазопротективные эффекты (потенциально прямой антиатерогенный эффект, антипролиферативный и антимиграционный эффект в отношении гладкомышечных клеток, моноцитов, нейтрофилов; улучшение функции эндотелия, антитромбоцитарный эффект, усиление эндогенного фибринолиза, улучшение податливости артерий и их тонуса). Среди множества представителей класса иАПФ особого внимания заслуживает лизиноприл. Лизиноприл (Диротон®, выпускаемый фармацевтической ) – иАПФ с крайне широким спектром действия и оригинальными свойствами, что позволяет применять его в самых различных ситуациях. Кроме того, накоплена большая доказательная база об эффекивности и безопасности лизиноприла по результатам ряда клинических исследований. Лзиноприл (Диротон) – единственный гидрофильный иАПФ, практически не связывается с белками плазмы и не распределяется в жировой ткани. В химической структуре лизиноприла присутствует карбоксильная группа, которая и связывает цинк–содержащий домен АПФ. В отличие от большинства иАПФ лизиноприл не является пролекарством. Всасываясь в ЖКТ, он не подвергается дальнейшим метаболическим превращениям и выводится в неизмененном виде почками. Клиренс лизиноприла коррелирует с клиренсом креатинина, поэтому по мере снижения клиренса креатинина уменьшается и выведение лизиноприла. У больных с почечной недостаточностью выведение препарата замедлено, в связи с чем требуется коррекция дозы. Препарат обладает достаточно вариабельной биодоступностью – от 26 до 60%. Прием пищи не влияет на биодоступность препарата. Его действие начинается через 1 час после приема внутрь, пик эффекта развивается через 4–6 часов, а продолжительность действия достигает 24 часов, что обеспечивает удобный режим назначения – однократно в сутки [4]. Выраженность ингибирующего эффекта лизиноприла на активность АПФ была изучена in vitro на легких кролика. Константа сродства АПФ к лизиноприлу была сопоставима с таковой у эналаприлата и каптоприла, однако диссоциационный период полувыведения препаратов составил соответственно 105, 27 и 9 минут. Эти данные свидетельствуют о бо’льшем сродстве лизиноприла к АПФ [5]. В отличие от большинства других ингибиторов АПФ лизиноприл не содержит сульфгидрильной группы, являющейся причиной ряда побочных эффектов (нейтропении и протеинурии) [6]. Лизиноприл применяют для лечения больных АГ, застойной сердечной недостаточностью, после острого инфаркта миокарда (ОИМ) [7]. Более того, недавно в ряде стран (Великобритания, Испания, Бельгия) он был утвержден для лечения диабетической нефропатии, а в Мексике, Португалии и Новой Зеландии – для лечения больных диабетической ретинопатией [8]. Эффективность лизиноприла в лечении АГ В 2002 г были опубликованы результаты исследования ALLHAT (Antihypertensive and Lipid–Lowering treatment to prevent Heart Attack Trial) [9], в котором оценивалась смертность от ИБС и частота инфарктов миокарда у пожилых пациентов. В исследовании ALLHAT 15255 больных получали хлорталидон в дозе 12,5–25 мг, 9048 больных – амлодипин в дозе 2,5–10 мг и 9054 пациента получали лизиноприл в дозе 10–40 мг в сутки. Если целевого уровня АД достигнуть не удавалось, то на следующей ступени добавляли второй препарат (атенолол – 25–100 мг, резерпин – 0,05–0,2 мг однократно в сутки или клонидин – 0,1–0,3 мг два раза в сутки). При отсутствии эффекта на третьей ступени добавляли гидралазин – 25–100 мг два раза в сутки. По способности предотвращать наступление первичной комбинированной конечной точки (инфарктов миокарда и смертности от сердечно–сосудистых причин) не было показано преимуществ ни одного из этих трех лекарственных препаратов. Анализ общей смертности также не выявил преимуществ какого–либо препарата. Лизиноприл несколько уступал хлорталидону по способности предотвращать инсульты, госпитализации по поводу стенокардии и ухудшения течения сердечной недостаточности. Однако лизиноприл значительно превосходил амлодипин в отношении профилактики декомпенсации сердечной недостаточности у белых, у больных негроидной расы эффективность лизиноприла и амлодипина существенно не отличалась. Сравнение эффективности двух иАПФ – эналаприла и лизиноприла было проведено с использованием для контроля эффективности терапии мониторирования АД. В качестве целевого АД был принят уровень 140/90 мм рт.ст., и доза обоих препаратов титровалась до достижения этого уровня АД. При необходимости добавлялся гидрохлоротиазид. Оба препарата достоверно снижали АД, но более выраженным был эффект лизиноприла. Средние дозы препаратов в конце исследования были в одной группе 18 мг эналаприла и 8 мг гидрохлоротиазида, во второй группе – 17 мг лизиноприла и 6 мг гидрохлоротиазида. При одинаковом режиме назначения (однократно в сутки) лизиноприл обладает большей продолжительностью действия. Безопасность препаратов была сравнимой [10]. В сравнительно небольшом исследовании (65 больных с ДАД 95–115 мм рт.ст.) сравнивалась эффективность и переносимость лизиноприла и b–блокатора небиволола. Лизиноприл назначался в дозе 20 мг один раз в сутки, небиволол – 5 мг один раз в сутки. Оба препарата вызывали достоверное снижение АД и хорошо переносились больными [11]. В Норвежском многоцентровом исследовании была изучена гипотензивная эффективность, переносимость и влияние лизиноприла (средняя доза 18,8 мг), и нифедипина (средняя доза 37,4 мг) на качество жизни у 828 больных с мягкой и умеренной АГ. Лизиноприл был более эффективен в отношении снижения АД, лучше переносился больными. Оба препарата одинаково хорошо влияли на качество жизни больных [12]. В исследовании по сравнению эффективности лизиноприла (20 мг) и БРА телмисартана (80 мг) приняло участие 32 нелеченых ранее больных с АГ. Эффективность препаратов оказалась одинаковой как по данным обычных офисных измерений АД, так и по данным суточного мониторирования АД [13]. Лизиноприл продемонстрировал сравнимую эффективность и с БРА валсартаном. В крупное рандомизированное исследование PREVAIL (Еhe Blood Pressure Reduction and Tolerability of Valsartan in Comparison with Lisinopril study) было включено 1213 пациентов с АГ 1–3 степени (САД 160–220 мм рт.ст. и ДАД 95–110 мм рт.ст.). Больные рандомизировались для приема валсартана в дозе 160 мг или лизиноприла 20 мг в сутки. Через четыре недели при недостаточной эффективности к терапии добавлялся гидрохлоротиазид. Общая продолжительность лечения составила 16 недель. Полностью курс лечения закончили 1100 больных; 51 больной из группы валсартана и 62 больных из группы лизиноприла прекратили лечение из–за побочных эффектов терапии. Снижение АД оказалось идентичным в обеих группах лечения – 31,2/15,9 мм рт.ст. и 31,4/15,9 мм рт.ст. соответственно [14]. Лизиноприл при ожирении В двух больших исследованиях – NHS (некурящие женщины) и Study Seventh–Day Adventist (некурящие, не употребляющие алкоголь мужчины–вегетарианцы) была выявлена прямая корреляционная взаимосвязь между индексом массы тела и сердечно–сосудистой смертностью [15]. По результатам Фрамингемского исследования, каждые 4,5 кг веса способствуют увеличению систолического АД на 4,4 мм рт.ст. у мужчин и на 4,2 мм рт.ст. у женщин. В многоцентровом двойном слепом рандомизированном плацебо–контролируемом исследовании TROPHY было проведено сравнительное изучение эффективности 12–недельной терапии 232 больных с ожирением и АГ лизиноприлом и гидрохлоротиазидом (ГХТ). Данные СМАД показали, что лизиноприл и гидрохлоротиазид эффективно снижали АД на протяжении суток по сравнению с плацебо (р<0,001). Однако снижение ДАД ниже 90 мм рт.ст. отмечено у 60% больных, леченных лизиноприлом и лишь у 43% больных, леченных гидрохлоротиазидом (p<0,05). Важно, что большая часть больных (57%), принимавших лизиноприл, оставались на дозе 10 мг в течение всего периода лечения, в то время как большинству больных, получавших ГХТ (71%), необходимо было увеличение дозы до 25–50 мг в сутки, что сопряжено с крайне неблагоприятными метаболическими эффектами. Оба препарата не оказали существенного влияния на уровень инсулина и липидный профиль, однако уровень глюкозы плазмы через 12 недель различался существенно (p<0,001) в группах лизиноприла (–0.21 ммоль/л) и гидрохлоротиазида (+0,31 ммоль/л) [16]. Необходимо напомнить, что лизиноприл – единственный гидрофильный иАПФ с продолжительностью действия 24–30 ч, не распределяющийся в жировой ткани. Эти свойства позволяют считать его препаратом выбора при лечении тучных пациентов с АГ. Лизиноприл и нефропротекция Нефропротективное действие лизиноприла было продемонстрировано на различных стадиях диабетической нефропатии вне зависимости от наличия АГ. В многоцентровом 2–летнем плацебо–контролируемом исследовании EUCLID (Randomised placebo–controlled trial of lisinopril in normotensive patients with insulin–dependent diabetes and normoalbuminuria or microalbuminuria) было изучено раннее назначение лизиноприла на прогрессирование диабетической нефропатии и ретинопатии у 530 больных СД 2 типа (СД2) без АГ с нормоальбуминурией (85% пациентов) и микроальбуминурией (15%). Уровень микроальбуминурии (МАУ) в группе лизиноприла после окончания наблюдения был на 18,8% ниже, чем в группе плацебо. Максимальный эффект выявлен у больных, уже имевших нефропатию в начале исследования: у пациентов с исходной нормоальбуминурией снижение экскреции альбумина с мочой по сравнению с плацебо составило 12,7% (1,0 мкг/мин.), в то время как у пациентов с исходной МАУ – 49,7% (34,2 мкг/мин.). Таким образом, в ходе исследования EUCLID была доказана способность ингибиторов АПФ замедлять как развитие, так и прогрессирование начальной стадии диабетической нефропатии. При этом наибольшие нефропротективные свойства проявлялись именно на стадии МАУ. В исследовании EUCLID также оценивалось влияние терапии лизиноприлом на развитие и прогрессирование диабетической ретинопатии (ДР) [17]. В группе лизиноприла выявлено снижение риска прогрессирования ДР на 50% (OR=0,5) по сравнению с плацебо, при этом максимальный протективный эффект иАПФ в отношении развития и прогрессирования ДР (OR=0,34) отмечался у пациентов с компенсацией углеводного обмена – при уровне HbA1c менее 7%. В одном из крупнейших исследований с использованием лизиноприла у больных СД 2 типа, в которое были включены 3463 пациента с начальной и выраженной диабетической нефропатией (ДН) и АГ, назначение лизиноприла даже на короткий период (3 месяца) показало не только высокую антигипертензивную эффективность препарата, но и улучшение азотвыделительной функции почек – практически у 50% пациентов с исходно повышенным уровнем креатинина этот показатель стабилизировался. В исследованиях также было отмечено положительное влияние лизиноприла на показатели метаболического контроля (уровень гликированного гемоглобина и липидов крови) и хорошая переносимость терапии – побочные эффекты развивались лишь у 2,2% пациентов [18]. Лизиноприл и кардиопротекция В 2–летнем исследовании ELVERA (Effects of amlodipine and lisinopril on Left Ventricular mass) изучалось влияние лизиноприла и амлодипина на массу миокарда и диастолическую функцию левого желудочка у пожилых больных с АГ, не получавших антигипертензивной терапии. В исследование были включены 166 больных АГ (ДАД 95–115 мм рт.ст. и САД 160–220 мм рт.ст.) в возрасте от 60 до 75 лет: 81 больной получал амлодипин в дозе 2–10 мг в сутки, 85 больных получали лизиноприл в дозе 10–20 мг в сутки. Индекс массы миокарда (ИММ) уменьшился на 25,7 г/м2 в группе амлодипина и на 27 г/м2 в группе лизиноприла. В исследовании SAMPLE [19] приняли участие 206 больных с АГ и ГЛЖ. На фоне терапии лизиноприлом в дозе 20 мг/сут. в сочетании с ГХТ (12,5–25 мг/сут.) и без него наблюдалось адекватное снижение АД и уменьшение ИММ ЛЖ на 15,8%. Доказана также эффективность раннего применения лизиноприла при остром инфаркте миокарда (ОИМ). Результаты исследования GISSI–3 показали, что если лечение лизиноприлом начинается в первые сутки ОИМ при стабильной гемодинамике, то отмечается достоверное снижение общей смертности. Нитраты не улучшили этих показателей. Показатели смертности и комбинированных конечных точек к 6–му месяцу были достоверно ниже (p=0,03) в группе больных, пролеченных лизиноприлом [20]. В исследовании SMILE–2 (Survival of Myocardial Infarction) проводилось прямое сравнение двух иАПФ при ОИМ – зофеноприла в дозе 30–60 мг и лизиноприла в дозе 5–10 мг в сутки. Оба препарата назначались больным, получившим тромболитическую терапию по поводу ОИМ. Терапия иАПФ начиналась не позднее 12 часов после завершения тромболизиса и продолжалась 42 дня. Всего в исследование было включено 1024 больных. Достоверных различий в риске сердечно–сосудистых осложнений в обеих группах лечения не было [20]. Лизиноприл при ХСН В рандомизированном исследовании ATLAS сравнивалась эффективность и переносимость длительной терапии низкими (2,5–5 мг) и высокими (32,5–35 мг) дозами лизиноприла у 3164 больных с ХСН II–IV ФК и фракцией выброса не более 30%. За время наблюдения в группе больных, получавших высокие дозы лизиноприла, наблюдалось снижение смертности от всех причин на 8% и смертности от сердечно–сосудистых причин на 10%. Кроме того, терапия высокими дозами лизиноприла привела к значительному снижению необходимости в госпитализации в связи с декомпенсацией ХСН (на 24%) [22]. Кроме того, в результате исследования ATLAS был установлен крайне благоприятный экономический эффект при применении высоких доз препарата – стоимость лечения была ниже на $2 млрд/год [23]. Одним из самых достойных представителей лизиноприла на Российском рынке, полностью удовлетворяющим соотношению цена–качество, является лизиноприл – Диротон. В г. Волгограде под руководством проф. С.В. Недогоды [24] проводилось 6–месячное открытое рандомизированное исследование по сравнению клинической и фармакоэкономической эффективности препаратов лизиноприла – Диротона (5 мг N 28) и Лизорила (10 мг N 30) у 40 пациентов с АГ. Доказано, что Диротон несколько в большей степени снижал как САД, так и ДАД, чем Лизорил (p>0,05), но при этом коэффициент затраты/эффективность у Диротона был в 1,6 раза лучше, чем у Лизорила. Таким образом, лизиноприл (Диротон) является крайне эффективным и экономичным антигипертензивным препаратом с органопротективными свойствами, с которым удобно работать врачам в самых различных клинических ситуациях. Литература 1. MRFIT research group. Multiple Risk Factor intervention Trial. Risk factor changes and mortality results. JAMA 1982;248:1465–77 2. The Task Force for the management of arterial hypertension of the European Society of Hypertension and of the European Society of Cardiolody. 2007 Guidelines for the management of arterial hypertension. J Hypertens 2007; 25: 1105–1187. 3. ВНОК. Профилактика, диагностика и лечение артериальной гипертензии. Российские рекомендации (второй пересмотр). Кардиоваскулярная терапия и профилактика 2004. Приложение 4. 4. Semple P.F. et al. Onset of action of captopril, enalapril, enalaprilic acid and lisinopril in normal man // Cardiovascular Drugs and Therapy. – 1987– Vol. 1. – P. 45–50. 5. Bull H.G. Inhibition of rabbit lung ACE by lisinopril, enalapril and captopril.// J. of Biological Chem. –1985–Vol.260 – P.2952–2962. 6. Chodoff L. Lisinopril: a new ACE inhibitor for the treatment of hypertension and congestive heart failure // Mt. Sinai. J. Med. – 1990. – Vol. 57. – P. 169–171. 7. Lisinopril. Mosby’s GenRx – The complete reference for generic and brand drugs. 9th edn., Mosby, Inc., St. Louis, Missouri, 1999. 8. AstraZeneca. ‘Zestril’ prescribing information. . Available from: https://www.zestrilinfo.com/info/info.htm. 9. Davis B.R., Culter J.A., Gordon D.J. Antihypertensive and lipid–lowering treatment to prevent heart attack trial. Am. J. Hypertens. – 1996. –Vol.9. –P.342–60. 10. Diamant M, Vincent HH Lisinopril versus enalapril: evaluation of trough:peak ratio by ambulatory blood pressure monitoring. J Hum Hypertens. – 1999/ – Jun;13(6):405–12. 11. Rosei EA, Rizzoni D, Comini S et al. Evaluation of the efficacy and tolerability of nebivolol versus lisinopril in the treatment of essential arterial hypertension: a randomized, multicentre, double–blind study. Blood Press Suppl. – 2003, May;1:30–5 12. Os I, Bratland B, Dahlof B at al. Lisinopril or nifedipine in essential hypertension? A Norwegian multicenter study on efficacy, tolerability and quality of life in 828 patients. J Hypertens. – 1992, Feb;10(2). 13. Stergiou GS, Efstathiou SP, Roussias LG et. Al. Blood pressure– and pulse pressure–lowering effects, trough:peak ratio and smoothness index of telmisartan compared with lisinopril. J Cardiovasc Pharmacol. – 2003, Oct;42(4):491–6. 14. Malacco E, Santonastaso M, Vari NA et al. Comparison of valsartan 160 mg with lisinopril 20 mg, given as monotherapy or in combination with a diuretic, for the treatment of hypertension: the Blood Pressure Reduction and Tolerability of Valsartan in Comparison with Lisinopril (PREVAIL) study. Clin Ther. – 2004. – Jun;26(6):855–65. 15. Lindsted K. Study Seventh–Day Adventist. Int J Obesity, 1991. 16. Reisin E et al. Lisinopril versus HCTZ in obese hypertensive patients: a multicenter placebo–controlled trial. Treatment in obese Patients with Hypertension (TROPHY) Study Group. Hypert 1997: Jul 30:140–145 17. EUCLID Study Group. Effect of lisinopril on progression of retinopathy in normotensive people with type 1 diabetes. Lancet 1998;351:28–31. 18. Parving HH. Effects of ACE inhibitors on renal function in incipient and overt diabetic nephropathy. // J Diabetes Complications. 1996; 10(3): 133–135. 19. Mancia G.,Zanchetti A. et al. Study on monitoring of blood pressure and lisinopril evaluation. Circulation, 1997; 95(6);1464–70. 20. Latini R., Nicolosi G., Maggioni AP. et al. The beneficial effect of lisinopril on left ventricular remodelling after a first myocardial infarction is modulated by age. The GISSI–3 Echo database (abstract) no. 775–11. .1 Am Coll Cardiol 1996; 27(2) Suppl. A: 281 A 21. Ambrossioni E., Borgii С., Magnani В. et al. The effect of the angiotensin–convertmg–enzmie inhibitor zofenopril on mortality and morbidity after anterior myocardial infarction. New Engi J Med. 1995; 332:2:80–85. 22. Packer M., Poole–Wilson P., Armstrong P. et al. Comparative effects of low–dose versus high–dose lisinopril on survival and major events in chronic heart failure: the Assessement of Treatment with Lisinopril And Survival (ATLAS). Europ. Heart J., 1998; 19 (suppl.): 142 (abstract). 23. Packer M et al. Comparative effects of low and high doses of the ACEi lisinopril, on morbidity and mortality in chronic heart failure. Circulation 1999; 100:1–7. 24. Остроумова О.Д., Недогода С.В., Мамаев В.И., Шорикова Е.Г., Фармакоэкономические аспекты эффективности ингибиторов ангиотензипревращающего фермента при артериальной гипертонии и сердечной недостаточности, РМЖ том 11, № 5, стр. 262–267
Лизиноприл Штада таблетки 5 мг 30 шт ➤ инструкция по применению
Внутрь, независимо от приема пищи, 1 раз в сутки утром, предпочтительно в одно и то же время. Доза подбирается индивидуально.
Для обеспечения режима дозирования лекарственного препарата в дозе 2,5 мг рекомендуется использовать таблетки по 2,5 мг или 1/2 таблетки по 5 мг с риской.
При артериальной гипертензии (у пациентов, не получающих другие гипотензивные средства):
начальная доза — 5-10 мг 1 раз в сутки в зависимости от состояния пациента. При отсутствии эффекта дозу повышают каждые 2 недели на 5 мг до средней терапевтической дозы 20-40 мг/сутки (доза свыше 40 мг/сутки обычно не ведет к дальнейшему снижению АД). Обычная поддерживающая доза — 20 мг/сутки. Максимальная суточная доза — 40 мг.
Терапевтический эффект обычно развивается через 2-4 недели от начала лечения, что следует учитывать при увеличении дозы. При недостаточном терапевтическом эффекте возможно применение препарата в комбинации с другими гипотензивными средствами.
Если пациент получает терапию диуретиками, то прием этих препаратов необходимо прекратить за 2-3 дня до начала применения лизиноприла. При невозможности отмены диуретиков начальная доза лизиноприла не должна превышать 5 мг/сутки. В этом случае после приема первой дозы рекомендуется врачебный контроль в течение нескольких часов, с учетом максимального гипотензивного эффекта через 6 часов (может развиться выраженное снижение АД).
При реноваскулярной гипертензии или других состояниях, связанных с повышенной активностью ренин-ангиотензин-альдостероновой системы (РААС) (гиповолемия, диета с ограничением потребления поваренной соли, декомпенсация сердечной деятельности или тяжелая артериальная гипотензия):
начальная доза — 2,5-5 мг в сутки под строгим врачебным контролем (контроль АД, функции почек, содержания калия в сыворотке крови). Поддерживающую дозу, продолжая строгий врачебный контроль, следует определить в зависимости от динамики АД.
При почечной недостаточности
ввиду того, что лизиноприл выводится через почки, начальная доза определяется в зависимости от клиренса креатинина. Далее в соответствии с терапевтическим эффектом и переносимостью следует установить поддерживающую дозу в условиях частого контроля функции почек, содержания калия и натрия в сыворотке крови.
| Клиренс креатинина, мл/мин | Начальная доза, мг/сутки |
| 31-80 | 5-10 |
| 10-30 | 2,5-5 |
| менее 10** | 2,5 |
*включая пациентов, находящихся на гемодиализе
При стойкой артериальной гипертензии показана длительная поддерживающая терапия по 10-15 мг/сутки.
При хронической сердечной недостаточности
начальная доза составляет 2,5 мг 1 раз в сутки с последующим увеличением дозы на 2,5 мг через 1-2 недели до поддерживающей суточной дозы 5-20 мг в зависимости от динамики АД. Максимальная суточная доза — 20 мг.
У пациентов пожилого возраста (старше 65 лет)
часто наблюдается более выраженное и длительное антигипертензивное действие, что связано с уменьшением скорости выведения лизиноприла (рекомендуется начинать лечение с дозы 2,5 мг в сутки).
Острый инфаркт миокарда (в составе комбинированной терапии):
при раннем (в первые 24 часа) лечении пациентов со стабильными показателями гемодинамики (систолическое АД не менее 100 мм рт. ст.) для поддержания этих показателей и профилактики дисфункции левого желудочка и сердечной недостаточности — в первые сутки доза составляет 5 мг, затем 5 мг через 1 сутки, 10 мг через двое суток и затем по 10 мг 1 раз в сутки в качестве поддерживающей терапии. У пациентов с острым инфарктом миокарда препарат следует применять в течение не менее 6 недель.
Пациенты с низким систолическим АД (120 мм рт. ст. или ниже) в начале лечения или в течение первых 3-х суток после острого инфаркта миокарда должны получать препарат в дозе не более 2,5 мг в сутки.
В случае снижения АД (систолическое АД ниже или равно 100 мм рт. ст.), суточную дозу в 5 мг можно при необходимости временно снизить до 2,5 мг. В случае длительного выраженного снижения АД (систолическое АД ниже 90 мм рт. ст. в течение более 1 часа), препарат следует отменить.
При диабетической нефропатии
применяется 10 мг лизиноприла 1 раз в сутки. Дозу при необходимости можно увеличить до 20 мг 1 раз в сутки с целью достижения значений диастолического АД ниже 75 мм рт. ст. в положении «сидя» для пациентов с сахарным диабетом 1 типа и ниже 90 мм рт. ст. в положении «сидя» у пациентов с сахарным диабетом 2 типа.
Гидрохлоротиазид+Лизиноприл-Акрихин таб 12,5мг+20мг N28 (Акрихин)
Гидрохлоротиазид. Нерекомендуемые сочетания лекарственных препаратов. Препараты лития. При одновременном применении гидрохлоротиазида и препаратов лития снижается почечный клиренс лития, что может привести к повышению концентрации лития в плазме крови и увеличению его токсичности. При необходимости одновременного применения гидрохлоротиазида следует тщательно подбирать дозу препаратов лития, регулярно контролировать концентрацию лития в плазме крови и соответствующим образом подбирать дозу препарата. Сочетания лекарственных препаратов, требующие особого внимания. Препараты, способные вызывать полиморфную желудочковую тахикардию типа «пируэт». Следует с особой осторожностью применять гидрохлоротиазид одновременно с таким препаратами, как: антиаритмические лекарственные препараты IA класса (хинидин, гидрохинидин, дизопирамид, прокаинамид); антиаритмические лекарственные препараты III класса (дофетилид, ибутилид, бретилия тозилат), соталол, дронедарон, амиодарон; другие (неантиаритмические) лекарственные средства, такие как: нейролептики: фенотиазины (хлорпромазин, циамемазин, левомепромазин, тиоридазин, трифлуоперазин, флуфеназин), бензамиды (амисульприд, сультоприд, сульприд, тиаприд), бутирофеноны (дроперидол, галоперидол); пимозид, сертиндол; антидепрессанты: трициклические антидепрессанты, селективные ингибиторы обратного захвата серотонина (циталопрам, эсциталопрам); антибактериальные средства: фторхинолоны (левофлоксацин, моксифлоксацин, спарфлоксацин, ципрофлоксацин); макролиды (эритромицин при внутривенном введении, азитромицин, кларитромицин, рокситромицин, спирамицин), ко-тримоксазол; противогрибковые средства: азолы (вориконазол, итраконазол, кетоконазол, флуконазол); противомалярийные средства (хинин, хлорохин, мефлохин, галофантрин, лумефантрин); противопротозойные средства (пентамидин при парентеральном введении); антиангинальные средства (ранолазин, бепридил); противоопухолевые средства (вандетаниб, мышьяка триоксид, оксалиплатин, такролимус); противорвотные средства (домперидон, ондансетрон); средства, влияющие па моторику ЖКТ (цизаприд); антигистаминные средства (астемизол; терфенадин; мизоластин); прочие лекарственные средства (анагрелид, вазопрессин, дифеманила метилсульфат, кетансерин, пробукол, пропофол, севофлуран, терлипрессин, теродилин, цилостазол); в связи с увеличением риска желудочковых аритмий, особенно полиморфной желудочковой тахикардии типа «пируэт» (фактор риска — гипокалиемия). Следует определить содержание калия в плазме крови и, при необходимости, корректировать его до начала комбинированной терапии гидрохлоротиазидом с указанными выше препаратами. Необходим контроль клинического состояния пациента, содержания электролитов плазмы крови и показателей ЭКГ. У пациентов с гипокалиемией необходимо применять препараты, не вызывающие полиморфную желудочковую тахикардию типа «пируэт». Лекарственные средства, способные увеличивать продолжительность интервала QT. Одновременное применение гидрохлоротиазида с лекарственными препаратами, способными увеличивать продолжительность интервала QT, должно основываться на тщательной оценке для каждого пациента соотношения ожидаемой пользы и потенциального риска (возможно увеличение риска развития полиморфной желудочковой тахикардии типа «пируэт»). При применении таких комбинаций необходимо регулярно регистрировать ЭКГ (для выявления удлинения интервала QT), а также контролировать содержания калия в крови. Препараты, способные вызывать гипокалиемию: амфотерицин В (при внутривенном введении), глюко- и минералокортикостероиды (при системном применении), тетракозактид (АКТГ), глицирризиновая кислота (карбеноксолон, препараты, содержащие корень солодки), слабительные средства, стимулирующие моторику кишечника Увеличение риска развития гипокалиемии при одновременном применении с гидрохлоротиазидом (аддитивный эффект). Необходим регулярный контроль содержания калия в плазме крови, при необходимости — его коррекция. На фоне терапии гидрохлоротиазидом рекомендуется применять слабительные средства, не стимулирующие моторику кишечника. Сердечные гликозиды. Гипокалиемия и гипомагниемия, обусловленные действием тиазидных диуретиков, усиливают токсичность сердечных гликозидов. При одновременном применении гидрохлоротиазида и сердечных гликозидов следует регулярно контролировать концентрацию калия в плазме крови, показатели ЭКГ, и, при необходимости, корректировать терапию. Сочетания лекарственных препаратов, требующие внимания. Другие гипотензивные препараты. Потенцирование антигипертензивного действия гидрохлоротиазида (аддитивный эффект). Может появиться необходимость в коррекции дозы одновременно применяемых гипотензивных препаратов. Рекомендуется прекратить прием гидрохлоротиазида за 2-3 дня до начала терапии ингибиторами АПФ для предотвращения развития симптоматической артериальной гипотензии. Если это невозможно, то следует снизить начальную дозу ингибиторов АПФ. Этанол, барбитураты, антипсихотические средства (нейролептики), антидепрессанты, анксиолитики, наркотические анальгетики и средства для общей анестезии Возможно усиление антигипертензивного действия гидрохлоротиазида и потенцирование ортостатической гипотензии (аддитивный эффект). Недеполяризирующие миорелаксанты (например, тубокурарин). Возможно усиление эффекта недеполяризирующих миорелаксантов. Адреномиметики (прессорные амины). Гидрохлоротиазид может снижать эффект адреномиметиков, таких как эпинефрин (адреналин) и норэпинефрин (норадреналин). Нестероидные противовоспалительные препараты (НПВН), включая селективные ингибиторы циклооксигеназы-2 (ЦОГ-2) и высокие дозы ацетилсалициловой кислоты (>3 г/сутки). НПВП могут снижать диуретическое и антигипертензивное действия гидрохлоротиазида. При одновременном применении существует риск развития острой почечной недостаточности вследствие снижения скорости клубочковой фильтрации. Гидрохлоротиазид может усиливать токсическое действие высоких доз салицилатов на центральную нервную систему. Пероральные гипогликемические средства и инсулин. Тиазидные диуретики влияют на толерантность к глюкозе (возможно развитие гипергликемии) и снижают эффективность гипогликемических средств (может потребоваться коррекция дозы гипогликемических средств). Следует с осторожностью совместно применять гидрохлоротиазид и метформин в связи с риском развития лактоацидоза на фоне нарушения функции почек, вызванного гидрохлоротиазидом. Бета-адреноблокаторы, диазоксид. Одновременное применение тиазидных диуретиков (включая гидрохлоротиазид), с бета-адреноблокаторами или диазоксидом может увеличить риск развития гипергликемии. Лекарственные препараты, применяющиеся для лечения подагры (пробенецид, сульфинпиразон, аллопуринол). Может потребоваться коррекция дозы урикозурических лекарственных средств, так как гидрохлоротиазид увеличивает концентрацию мочевой кислоты в сыворотке крови. Тиазидные диуретики могут увеличить частоту развития реакций гиперчувствительности к аллопуринолу. Амантадин. Тиазидные диуретики (включая гидрохлоротиазид) могут снижать клиренс амантадина, приводить к повышению концентрации амантадина в плазме крови и увеличивать риск его нежелательных эффектов. Антихолинергические препараты (холиноблокаторы). Антихолинергические препараты (например, атропин, бипериден) увеличивают биодоступность тиазидных диуретиков за счет снижения моторики желудочно-кишечного тракта и скорости опорожнения желудка. Цитотоксические (противоопухолевые) препараты. Тиазидные диуретики уменьшают почечную экскрецию цитотоксических лекарственных средств (например, циклофосфамида и метотрексата) и потенцируют их миелосупрессивное действие. Метилдопа. Описаны случаи гемолитической анемии при одновременном применении гидрохлоротиазида и метилдопы. Карбамазепин. Риск развития симптоматической гипонатриемии. При одновременном применении гидрохлоротиазида и карбамазепина необходимо наблюдение за состоянием пациента и контроль содержания натрия в плазме крови. Циклоспорин. При одновременном применении тиазидных диуретиков и циклоспорина увеличивается риск развития гиперурикемии и обострения подагры. Пероральные антикоагулянты. Тиазидные диуретики могут уменьшать эффект пероральных антикоагулянтов. Йодсодержащие контрастные вещества. Обезвоживание организма на фоне приема тиазидных диуретиков увеличивает риск развития острой почечной недостаточности, особенно при применении высоких доз йодсодержащих контрастных веществ. Перед применением йодсодержащих контрастных веществ необходимо компенсировать потерю жидкости. Препараты кальция. При одновременном применении возможно повышение содержания кальция в крови и развитие гиперкальциемии вследствие снижения выведения ионов кальция почками. Если необходимо одновременное назначение кальцийсодержащих лекарственных средств, то следует контролировать содержания кальция в плазме крови и корректировать дозу препаратов кальция. Анионные обменные смолы (колестирамин и колестипол). Анионные обменные смолы уменьшают абсорбцию гидрохлоротиазида. Однократные дозы колестирамина и колестипола уменьшают всасывание гидрохлоротиазида в ЖКТ на 85% и 43% соответственно. Лизиноприл. Двойная блокадаренин-ангиотензин-альдостероновой системы (РААС). У пациентов с атеросклеротическим заболеванием, сердечной недостаточностью или сахарным диабетом с поражением органов-мишеней, одновременная терапия ингибитором АПФ и АРА II связана с более высокой частотой развития артериальной гипотензии, обморока, гиперкалиемии и ухудшения функции почек (включая острую почечную недостаточность) по сравнению с применением только одного препарата, влияющего на РААС. Двойная блокада (например, при сочетании ингибитора АПФ с АРА II) должна быть ограничена отдельными случаями с тщательным мониторингом функции почек, содержания калия и регулярным контролем АД. Одновременное применение ингибиторов АПФ с лекарственными средствами, содержащими алискирен, противопоказано у пациентов с сахарным диабетом и/или с умеренной или тяжелой почечной недостаточностью (СКФ менее 60 мл/мин/1,73 м2 площади поверхности тела) и не рекомендуется у других пациентов. Одновременное применение ингибиторов АПФ с АРА II противопоказано у пациентов с диабетической нефропатией и не рекомендуется у других пациентов. Калийсберегающие диуретики, препараты калия, калийсодержащие заменители пищевой соли и другие лекарственные препараты, способные увеличивать содержание калия в сыворотке крови. При одновременном применении лизиноприла с калийсберегающими диуретиками (спиронолактон, триамтерен, амилорид, эплеренон), препаратами калия или калийсодержащими заменителями пищевой поваренной соли и другими лекарственными препаратами, способными увеличивать содержание калия в сыворотке крови (включая антагонисты рецепторов к ангиотензину II, гепарин, такролимус, циклоспорин; препараты, содержащие ко-тримоксазол [триметоприм + сульфаметоксазол]), повышается риск развития гиперкалиемии (особенно у пациентов с нарушениями функции почек). Поэтому данные комбинации назначают с осторожностью, под контролем содержания калия в плазме и функции почек. У пожилых пациентов и пациентов с нарушением функции почек одновременный прием ингибиторов АПФ с сульфаметоксазолом/триметопримом сопровождался тяжелой гиперкалиемией, которая, как считается, была вызвана триметопримом, поэтому лизиноприл следует применять с осторожностью с препаратами, содержащими триметоприм, регулярно контролируя содержание калия в плазме крови. Калийнесберегающие диуретики. При одновременном применении лизиноприла с калийнесберегающими диуретиками гипокалиемия, вызванная их применением, может быть уменьшена. Другие гипотензивные лекарственные средства. При одновременном применении с вазодилататорами, бета-адреноблокаторами, блокаторами «медленных» кальциевых каналов, диуретиками и другими гипотензивными лекарственными средствами усиливается выраженность антигипертензивного действия лизиноприла. Препараты лития. При одновременном применении лизиноприла с препаратами лития выведение лития из организма замедляется (риск усиления кардиотоксического и нейротоксического действия лития). Одновременное применение лизиноприла с препаратами лития не рекомендуется. В случае необходимости применения данной комбинации следует регулярно контролировать концентрацию лития в плазме крови. НПВП, включая селективные ингибиторы ЦОГ-2, и высокие дозы ацетилсалициловой кислоты (> 3 г/сутки). НПВП (в том числе селективные ингибиторы ЦОГ-2) и ацетилсалициловая кислота в дозах более 3 г/сутки, снижают антигипертензивный эффект лизиноприла. У некоторых пациентов с нарушенной функцией почек (например, у пожилых пациентов или пациентов с обезвоживанием, в том числе принимающих диуретики), получающих терапию НПВП (в том числе селективными ингибиторами ЦОГ-2), одновременное применение ингибиторов АПФ или АРА II может вызвать дальнейшее ухудшение функции почек, включая развитие острой почечной недостаточности, и гиперкалиемию. Данные эффекты обычно обратимы. Одновременное применение ингибиторов АПФ и НПВП должно проводиться с осторожностью (особенно у пожилых пациентов и у пациентов с нарушенной функцией почек). Пациенты должны получать адекватное количество жидкости. Рекомендуется тщательно контролировать функцию почек, как в начале, так и в процессе лечения. Не противопоказано применение лизиноприла в комбинации с ацетилсалициловой кислотой в качестве антиагрегантного средства. Гипогликемические лекарственные средства. Одновременный прием лизиноприла и инсулина, а также пероральных гипогликемических средств может приводить к развитию гипогликемии. Наибольший риск развития наблюдается в течение первых недель совместного применения, а также у пациентов с нарушением функции почек. Трициклические антидепрессанты/нейролептики/средства для общей анестезии/наркотические средства. При одновременном применении с трициклическими антидепрессантами, нейролептиками, средствами для общей анестезии, барбитуратами, миорелаксантами наблюдается усиление антигипертензивного действия лизиноприла. Альфа- и бета-адреномиметики. Альфа- и бета-адреномиметики (симпатомиметики), такие как эпинефрин (адреналин), изопротеренол, добутамин, допамин, могут снижать антигипертензивный эффект лизиноприла. Баклофен. Усиливает антигипертензивный эффект ингибиторов АПФ. Следует тщательно контролировать АД и, в случае необходимости, корректировать дозу ангигипертензивных препаратов. Этанол. При одновременном применении этанола усиливает антигипертензивное действие лизиноприл. Эстрогены. Эстрогены ослабляют антигипертензивный эффект лизиноприла вследствие задержки жидкости. Аллопуринол, прокаинамид, цитостатики, иммунодепрессанты, глюкокортикостероиды (ГКС) (при системном применении). Совместное применение ингибиторов АПФ с аллопуринолом, прокаинамидом, цитостатиками увеличивает риск развития нейтропении / агранулоцитоза. Препараты золота. При одновременном применении лизиноприла и препаратов золота внутривенно (натрия ауротиомалат) описан симптомокомплекс, включающий гиперемию лица, тошноту, рвоту и снижение АД. Селективные ингибиторы обратного захвата серотонина. Совместное применение лизиноприла с селективными ингибиторами обратного захвата серотонина может приводить к выраженной гипонатриемии. Ингибиторы mTOR (mammalian Target of Rapamycin — мишень рапамицина в клетках млекопитающих) (например, темсиролимус, сиролимус, эверолимус). У пациентов, принимающих одновременно ингибиторы АПФ и ингибиторы mTOR (темсиролимус, сиролимус, эверолимус), наблюдалось увеличение частоты развития ангионевротического отека. Ингибиторы дипептидилпептидазы N типа (ДПП-IV) (глиптины), например, ситаглиптин, саксаглиптин, вилдаглиптин, линаглиптин. У пациентов, принимавших одновременно ингибиторы АПФ и ингибиторы дипептидилпептидазы IV типа (глиптины), наблюдалось увеличение частоты развития ангионевротического отека. Эстрамустин. Увеличение частоты развития ангионевротического отека при одновременном применении с ингибиторами АПФ. Ингибиторы нейтральной эндопептидазы (НЭП). Сообщалось о повышенном риске развития ангионевротического отека при одновременном применении ингибиторов АПФ и рацекадотрила (ингибитор энкефалиназы). При одновременном применении ингибиторов АПФ с лекарственными препаратами, содержащими сакубитрил (ингибитор неприлизина), возрастает риск развития ангионевротического отека, в связи с чем одновременное применение указанных препаратов противопоказано. Ингибиторы АПФ следует назначать не ранее, чем через 36 ч после отмены препаратов, содержащих сакубитрил. Противопоказано назначение препаратов, содержащих сакубитрил, пациентам, получающим ингибиторы АПФ, а также в течение 36 ч после отмены ингибиторов АПФ. Тканевые активаторы плазминогена. В обсервационных исследованиях выявлена повышенная частота развития ангионевротического отека у пациентов, принимавших ингибиторы АПФ, после применения алтеплазы для тромболитической терапии ишемического инсульта. Фармакокинетические взаимодействия. Антациды и колестирамин снижают всасывание лизиноприла в ЖКТ.
Эффективность и безопасность лизиноприла в клинической практике
Несмотря на успехи, достигнутые в лечении артериальной гипертонии (АГ) в последнее время, это заболевание остается одним из наиболее распространенных и социально значимых во многих странах мира. В настоящее время в России АГ страдает 39% мужчин и 41% женщин, и с возрастом этот показатель увеличивается до 80%. Между тем АГ, являясь весьма серьезным заболеванием, представляет один из факторов риска других заболеваний сердечно-сосудистой системы. Результаты эпидемиологических исследований показали значимую связь между АГ и ишемической болезнью сердца (ИБС), мозговым инсультом, хронической сердечной недостаточностью (ХСН) и хронической почечной недостаточностью (ХПН). Необходимость длительной терапии АГ не вызывает сомнений и направлена на снижение распространенности сердечно-сосудистых заболеваний и ассоциируемой с ними смертности. Однако, несмотря на множество эффективных антигипертензивных препаратов, лечение артериальной гипертензии по ряду причин остается очень сложной проблемой [8]. Опыт клинических исследований очень медленно переносится в реальную практику, несмотря на большую значимость полученных результатов.
В ряде крупных международных исследований, в которых принимали участие больные АГ, показано, что снижение АД приводит к уменьшению частоты сердечно-сосудистых заболеваний и смертности. В ставшем уже «классическим» исследовании НОТ определили так называемые целевые уровни артериального давления, которые позднее были положены в основу европейских и отечественных рекомендаций по лечению АГ (ВНОК, 2007). Согласно этим рекомендациям, у больных с АГ и сахарным диабетом (СД) и/или нарушением функции почек артериальное давление (АД) следует снижать ниже уровня 130/80 мм рт. ст., у всех остальных больных АГ (независимо от возраста, пола, длительности заболевания, исходных цифр АД и др.) — ниже 140/90 мм рт. ст. Такие низкие целевые уровни АД сводят риск развития сердечно-сосудистых осложнений к минимуму, но предъявляют особые требования к эффективности антигипертензивных препаратов.
АГ представляет собой гетерогенный клинический синдром. Существует множество механизмов подъема и поддержания артериального давления: активация нейрогуморальных систем (ренин-ангиотензин-альдостероновой и симпато-адреналовой), гиперволемия, а также дисфункция эндотелия. Доказано, что эндотелий не только является барьером между кровью и тканями, но прежде всего активный орган, дисфункция которого является обязательным компонентом таких сердечно-сосудистых заболеваний, как АГ, атеросклероз, ишемическая болезнь сердца, ХСН. Для того чтобы определить ведущие звенья патогенеза АГ в каждом конкретном случае, требуется использование сложных и дорогостоящих биохимических и инструментальных методов. Поэтому в повседневной клинической практике антигипертензивные препараты для длительной терапии приходится выбирать эмпирическим путем без учета этиопатогенетических механизмов заболевания, но учитывая известные данные об особенностях течения АГ у разных категорий больных. Также при выборе антигипертензивной терапии следует принимать во внимание сопутствующие заболевания. На современном этапе развития медицины определяющим фактором выбора лекарственного средства является эффективность и безопасность по результатам длительных рандомизированных исследований. В настоящее время для лечения АГ используют тиазидные (и тиазидоподобные) диуретики, бета-адреноблокаторы, ингибиторы ангиотензинпревращающего фермента (АПФ), антагонисты кальция, блокаторы АТ1-ангиотензиновых рецепторов, агонисты I1-имидазолиновых рецепторов, агонисты центральных альфа2-адренергических рецепторов.
представлены рекомендации по выбору антигипертензивного препарата в зависимости от различных клинических ситуаций, согласно которым препаратами выбора являются ингибиторы АПФ.
Многочисленные клинические и экспериментальные исследования показали, что ингибиторы АПФ не только эффективно снижают и контролируют уровень АД, но и оказывают благоприятное воздействие на состояние органов-мишеней при АГ — миокард, сосуды, почки (подавляя активность как плазменных, так и тканевых звеньев ренин-ангиотензиновой системы (РАС), ингибиторы АПФ могут предотвращать и даже вызывать обратное развитие изменений, происходящих в органах-мишенях при АГ). Состояние органов-мишеней при АГ имеет важное прогностическое значение и определяет тактику ведения пациентов с АГ. Согласно рекомендациям ВОЗ и Международного общества АГ, должна проводиться стратификация больных АГ по степени риска развития сердечно-сосудистых осложнений [7]. Наличие признаков поражения органов-мишеней определяет принадлежность пациентов к группе высокого риска, частота развития сердечно-сосудистых осложнений в которой составляет 20–30% в течение ближайших 10 лет. Это определяет лидирующее положение ингибиторов АПФ среди всех известных на сегодняшний день групп гипотензивных препаратов [4, 5].
Наиболее ранним эхокардиографическим признаком формирования гипертонического сердца является нарушение диастолической функции миокарда левого желудочка. Под действием ангиотензина II и альдостерона увеличивается синтетическая функция фибробластов, что приводит к накоплению в миокарде волокон коллагена, увеличению его жесткости и снижению податливости стенок сердца. В дальнейшем происходит увеличение массы миокарда левого желудочка. Развитие гипертрофии миокарда у больных АГ имеет неблагоприятное прогностическое значение, так как ассоциируется с увеличением риска развития сердечно-сосудистых осложнений в 2–6 раз [6]. Кроме того, дальнейшее прогрессирование гипетрофических и фиброзных изменений в миокарде может приводить к снижению сократительной способности миокарда и развитию систолической сердечной недостаточности. Получены данные, свидетельствующие о регрессе гипертрофии миокарда левого желудочка на фоне лечения лизиноприлом, а также улучшении функции эндотелия. Механизм регрессии гипертрофии миокарда левого желудочка (ЛЖ) при применении лизиноприла обусловлен как гемодинамическими, так и метаболическими эффектами препарата: ингибированием образования ангиотензина (AII), оказывающим отрицательное действие на давление в ЛЖ и коронарный кровоток, и предупреждением распада брадикинина, который, напротив, повышает давление в ЛЖ, способствует усилению коронарного кровотока и сократимости миокарда. Таким образом, на фоне длительной терапии ингибиторами АПФ, в частности лизиноприлом, наблюдается обратное развитие гипертрофии миокарда и улучшение функционального состояния ЛЖ [2].
АГ является важнейшим фактором риска развития коронарного атеросклероза. Морфологической основой снижения коронарного резерва при АГ являются структурные изменения сосудов микроциркуляторного русла, в которых происходят процессы эутрофического ремоделирования. Отмечается увеличение толщины мышечного слоя артериол: в первую очередь за счет перегруппировки гладкомышечных клеток вокруг просвета сосуда и в меньшей степени вследствие их гипертрофии, в результате чего уменьшается просвет и внешний диаметр сосуда. Кроме того, вследствие увеличения количества фибриллярных структур снижается податливость их стенок [1]. Гиперактивация ренин-ангиотензин-альдостероновой системы (РААС) является непременным условием эндотелиальной дисфункции [11]. По данным иммуногистохимии, основная часть АПФ находится непосредственно на мембране эндотелиальных клеток. По данным V. Dzau, 90% всего объема РААС приходится на органы и ткани (10% — на плазму), среди которых сосудистый эндотелий занимает первое место.
Повышение активности АПФ, расположенного на поверхности эндотелиальных клеток, катализирует распад брадикинина. Уменьшение стимуляции брадикининовых рецепторов эндотелия приводит, в свою очередь, к уменьшению продукции эндотелий-зависимого фактора релаксации — оксида азота. В результате возникающих структурных и функциональных изменений повышается склонность сосудов к вазоконстрикции и нарушается их способность адекватно реагировать на сосудорасширяющие стимулы.
Результаты клинического исследования «Клиническая эффективность применения Диротона (лизиноприла) и эналаприла больными с мягкой и умеренной артериальной гипертензией (АГ), ассоциированной с хроническим вирусным гепатитом» подтверждают положительное влияние ингибиторов АПФ на коронарную микроциркуляцию у больных АГ. Так, у больных АГ с признаками ишемии миокарда и интактными коронарными артериями после длительной, в течение 1 года, терапии ингибитором АПФ эналаприлом наряду с увеличением коронарного резерва отмечено уменьшение ЭКГ-критериев ишемии миокарда по данным нагрузочных тестов. Данный эффект сохранялся и спустя неделю после отмены лизиноприла и, следовательно, не может быть объяснен только гемодинамическими факторами (снижением АД и уменьшением потребности миокарда в кислороде) [9].
АГ является причиной развития 24% случаев терминальной почечной недостаточности. При системной АГ повышается тонус приносящих (афферентных) артериол почечных клубочков, что защищает почечные клубочки от развития внутриклубочковой гипертензии. При срыве механизмов ауторегуляции происходит повышение гидростатического давления в почечных клубочках, развиваются протеинурия и гломерулосклероз [12, 14]. В нескольких клинических исследованиях отмечены преимущества терапии ингибиторами АПФ (лизиноприлом) по сравнению с бета-блокаторами и нифедипином по влиянию на скорость снижения клубочковой фильтрации у больных сахарным диабетом 1-го и 2-го типов [10]. Кроме того, ингибиторы АПФ уменьшают проницаемость стенки клубочковых капилляров, что наряду со снижением гидростатического давления в клубочках почек способствует уменьшению суточной экскреции альбуминов с мочой (на 30–86%). Учитывая наличие отчетливых нефропротективных свойств ингибиторов АПФ, их назначение рекомендуется всем больным с явной или скрытой диабетической нефропатией независимо от типа сахарного диабета и уровня системного АД.
В настоящее время большое внимание уделяют метаболической нейтральности гипотензивных препаратов. Поэтому важным преимуществом лизиноприла является высокая эффективность у больных с метаболическими факторами риска. Наличие тесной взаимосвязи между метаболическими нарушениями и кардиоваскулярными заболеваниями не вызывает сомнения. У больных АГ часто выявляются нарушения углеводного обмена (нарушение толерантности к углеводам, сахарный диабет 2-го типа), липидного профиля (гипертриглицеридемия, снижение холестерина (ХС) липопротеидов высокой плотности (ЛПВП), повышение ХС липопротеидов низкой плотнисти (ЛПНП) и жирового (абдоминальное ожирение) обмена, гиперурикемия, изменения в системе фибринолиза. Данный симптомокомплекс в настоящее время объединяется в кластер факторов риска и входит в понятие «метаболический синдром». В основе метаболического синдрома лежит снижение чувствительности тканей к инсулину — инсулинорезистентность с формированием компенсаторной гиперинсулинемии. Инсулинорезистентность, гиперинсулинемия и гипергликемия рассматриваются как факторы, способствующие патогенезу АГ и атеросклероза. Метаболический синдром в наши дни привлекает пристальное внимание клиницистов различных специальностей. Это обусловлено накоплением данных о действии инсулина на органы-мишени. Существует множество исследований, рассматривающих тонкие механизмы влияния инсулинорезистентности и гиперинсулинемии на уровень АД. Полагают, что нарушения функции эндотелия играют важную роль в патогенезе АГ, связанной с метаболическими нарушениями. На фоне терапии ингибиторами АПФ не происходит неблагоприятных изменений в углеводном, липидном обменах, уровне мочевой кислоты. Известно благоприятное воздействие на инсулинорезистентность, некоторые показатели гемостаза (снижение уровня ингибитора тканевого активатора плазминогена, увеличение тканевого активатора плазминогена). Вазодилататорные эффекты, антипролиферативные, вазопротективные, антисклеротические свойства ингибиторов АПФ можно объяснить эндотелий-зависимыми реакциями, связанными с предотвращением расщепления брадикинина, который является мощным стимулятором высвобождения эндотелий-зависимых расслабляющих факторов, таких как оксид азота, фактор гиперполяризации и простациклин.
В исследовании TROPHY лизиноприл (Диротон) продемонстрировал преимущества в гипотензивной эффективности и безопасности перед гидрохлортиазидом. Кардио- и вазопротективные эффекты препарата были подтверждены на экспериментальных моделях и в клинических группах: регресс ремоделирования левого желудочка (снижение массы миокарда, уменьшение периваскулярного фиброза), антиоксидантные свойства, антитромботическая активность, коррекция эндотелиальной дисфункции.
В открытом исследовании приняли участие 27 пациентов мягкой и умеренной АГ (17 женщин и 10 мужчин) в возрасте от 46 до 75 лет с сочетанием метаболических факторов риска. У 88,9% больных регистрировались различные нарушения липидного спектра (повышение ХС ЛПНП, гипертриглицеридемия, снижение ХС ЛПВП), 74,7% больных имели абдоминальное ожирение, в 25,9% случаев наблюдалась гиперурикемия, у 58,3% больных были диагностированы нарушения углеводного обмена (нарушение толерантности к углеводам, гипергликемия натощак). Длительность лечения составила 12 недель. На первом этапе исследования из-за развития побочных эффектов выбыло 2 человека (7,4%). Монотерапию Диротоном начинали с дозы 10 мг/сут. Если через 4 недели уровень офисного диастолического АД (ДАД) был 90 мм рт. ст. и выше, происходило увеличение дозы Диротона до 20 мг [1]. На фоне терапии отмечался положительный клинический эффект в виде улучшения самочувствия больных, уменьшения слабости, головных болей, сердцебиений. Жалобы на головную боль после окончания терапии сохранились только у 4% пациентов (до лечения 60%). Отмечалось также уменьшение болей в области сердца, эпизодов головокружений, улучшение качества жизни. Улучшение характеристики исходно измененного суточного профиля АД, не нарушая нормального двухфазного ритма, не оказывает воздействия на нормальную вариабельность АД и снижает повышенную вариабельность, обеспечивает адекватный контроль АД в ранние утренние часы, то есть отвечает всем основным требованиям, предъявляемым к антигипертензивному препарату пролонгированного действия. Препарат не оказывал отрицательного влияния на показатели углеводного, липидного и пуринового обмена. На фоне терапии не отмечалось достоверных колебаний показателей утренней и постпрандиальной гликемии, липидного спектра и мочевой кислоты. Полученные данные продемонстрировали безопасность и эффективность монотерапии Диротоном у больных мягкой и умеренной артериальной гипертонией с метаболическими факторами риска.
В рамках программы DESIRE (Diroton Efficiency and Safety Investigation: Russian Estimate) изучалась эффективность и безопасность длительного лечения лизиноприлом у больных артериальной гипертензией в сочетании с патологией бронхолегочной системы. В открытом исследовании приняли участие 31 больной в возрасте от 18 до 59 лет, при этом у 17 больных, составивших основную группу, в течение трех и более лет отмечались обострения хронического бронхита или бронхиальной астмы. Одним из критериев включения была возможность отмены предыдущей антигипертензивной терапии не менее чем за 14 дней до исследования. Диротон назначался в таблетках первоначально в дозе 10 мг однократно утром или вечером. При недостаточном снижении АД при контрольном исследовании на 4-й неделе доза повышалась до 20 мг/сут однократно с сохранением времени приема. Продолжительность лечения составила 12 недель. На фоне терапии Диротоном у больных с брохолегочной патологией отмечено достоверное снижение среднесуточных показателей САД/ДАД (с 150,04 ± 8,29/88,98 ± 4,3 до 130,65 ± 6,13/77,65 ± 3,6 мм рт. ст., р < 0,01), а также усредненных показателей САД и ДАД в течение дня и ночи. Переносимость терапии Диротоном в целом была хорошей. Нежелательные реакции, отмеченные на фоне терапии, не требовали отмены препарата ни в одной из групп. У большинства больных на фоне лечения улучшалось самочувствие: уменьшились головные боли, повысилась толерантность к физическим нагрузкам, улучшилось настроение, что свидетельствует об улучшении качества жизни больных. Сухой кашель был отмечен у 5 (16,1%) больных, ни в одном из случаев отмены препарата не требовалось. В данном исследовании у больных с сопутствующими бронхообструктивными заболеваниями легких (хронический обструктивный бронхит, бронхиальная астма) отчетливая связь между усилением кашля и началом приема Диротона была отмечена только у одной пациентки. Ни у одного из пациентов не отмечено появления одышки, приступов удушья, ухудшения ночного сна. В контрольной группе появление сухого кашля отмечено у 4 пациентов (28%), 3 из них — женщины.
Высокая эффективность и хорошая переносимость особенно важны при наличии сопутствующей патологии бронхолегочной системы, поскольку сочетание АГ с обструктивными заболеваниями легких является достаточно распространенной клинической ситуацией. Такое сочетание существенно повышает у больных артериальной гипертензией степень риска вследствие отрицательного влияния на состояние сердечной мышцы и сосудистой стенки за счет гипоксемии и гипоксии, хронического воспаления, симпатикотонии, вторичной легочной гипертензии и перегрузки правых отделов сердца и создает определенные трудности при подборе адекватной антигипертензивной терапии. Изредка возникающий побочный эффект — сухой кашель не является эквивалентом бронхиальной обструкции.
Нами было проведено исследование, показавшее эффективность применения ингибитора АПФ лизиноприла (Диротона) при АГ и безболевой ишемии миокарда (БИМ) у больных истинной полицитемией (ИП). Проведено лечение 21 пациента АГ при ИП в состоянии клинико-гематологической ремиссии ингибитором АПФ длительного действия лизиноприлом (Диротон) в дозе 10–40 мг один раз утром (средняя доза составила 17,1 ± 2,8 мг/сут). На фоне терапии Диротоном у больных с АГ при истинной полицитемии более 50% пролеченных пациентов отмечали уменьшение головных болей и утомляемости. Особенностью лизиноприла, как гидрофильного соединения, является отсутствие печеночного метаболизма. Это дает возможность его применения у больных с заболеваниями печени, что важно при лечении пациентов с сочетанной патологией, в данном случае АГ с ИП. При изучении показателей суточного мониторирования АД (СМАД) получено достоверное снижение систолического АД (САД) и ДАД (рис.).
Двойное произведение (ДП), как физиологический показатель, используют для косвенного суждения об обменных процессах в сердце, потреблении миокардом кислорода. Оно более отчетливо показывает уровень гемодинамической нагрузки, чем АД или ЧСС отдельно. Среднее значение ДП за сутки лечения составило 115,0 ± 2,0, на фоне 97,4 ± 2,4 мм рт. ст. × уд/мин, в утренний период (с 4 до 10 ч) среднее значение ДП до терапии 111,7 ± 3,3 и на фоне 91,7 ± 4,7 мм рт. ст. × уд/мин (p < 0,0001 в обоих случаях). На фоне терапии увеличилось число больных с типом суточного профиля АД «dipper» и «non dipper». Не осталось ни одного пациента с типом суточного профиля АД «night picker». Исходный нормальный двухфазный суточный ритм АД не был изменен приемом лизиноприла, что свидетельствует в пользу физиологического действия препарата. Целевой уровень АД ниже 135/85 мм рт. ст. был достигнут у 65% больных. На фоне терапии лизиноприлом снизились среднесуточные показатели САД на 12,2%, ДАД — на 9,5%, ПД на 25%, ДП на 15,4% (p < 0,0001) [3].
По результатам суточного ЭКГ мониторирования при ИП с сопутствующей АГ эпизоды БИМ были зарегистрированы у 25% пациентов, из которых 5% без диагностированной ИБС. На фоне терапии лизиноприлом БИМ выявлена у 10% больных с ранее диагностированной ИБС, достоверно уменьшилась частота эпизодов. На фоне лечения наблюдалась положительная тенденция динамики показателей реологических свойств крови. Выявлено уменьшение степени агрегации эритроцитов, спонтанной агрегации тромбоцитов, вязкости крови. Лизиноприл позитивно влияет на активность симпато-адреналовой системы, о чем свидетельствует снижение на фоне лечения до верхней границы нормы (на 46%) показателя адренореактивности.
Таким образом, клинические исследования доказали высокую эффективность и безопасность применения ингибитора АПФ лизиноприла (Диротона) для лечения больных артериальной гипертонией, у больных с метаболическими факторами риска, так как препарат не оказывает отрицательного влияния на углеводный, липидный и пуриновый обмен, повышает качество жизни, улучшает самочувствие больных; доказана высокая эффективность и хорошая переносимость препарата при наличии сопутствующей патологии бронхолегочной системы; способствует нормализации симпато-адреналовой системы; кроме того, лизиноприл является эффективным средством лечения артериальной гипертонии, способным контролировать уровень АД у больных АГ с истинной полицитемией при приеме раз в день утром, позитивно влияет на основные характеристики исходно нарушенного суточного ритма артериального давления, снижает количество эпизодов безболевой ишемии миокарда, положительно влияет на реологические свойства крови.
По вопросам литературы обращайтесь в редакцию.