Спиолто респимат р-р д/ингаляций доз 2.5 мкг+2.5 мкг/доза 4мл
Владелец регистрационного удостоверения
BOEHRINGER INGELHEIM INTERNATIONAL (Германия)
Лекарственная форма
Лекарственный препарат — Спиолто® Респимат® (Spiolto® Respimat®)
Описание
Раствор для ингаляций дозированный
прозрачный, бесцветный или почти бесцветный.
1 доза
олодатерол 2.5 мкг что соответствует содержанию олодатерола гидрохлорид 2.736 мкг, тиотропий бромид 2.5 мкг что соответствует содержанию тиотропия бромида моногидрат 3.124 мкг,
Вспомогательные вещества
: бензалкония хлорида раствор — 2.2 мкг (соответственно бензалкония хлорида — 1.1 мкг), динатрия эдетат — 1.1 мкг, хлористоводородная кислота 1М — до pH 2.9, вода очищенная — до 11.05 мг.
60 доз ингаляционных (30 терапевтических доз) — картриджи (1) вместимостью 4.5 мл, помещенные в алюминиевый цилиндр, в комплекте с ингалятором Респимат® — пачки картонные.
Показания
- длительная поддерживающая терапия у пациентов с ХОБЛ, хроническим бронхитом, эмфиземой легких;
- для уменьшения обструкции дыхательных путей и сопутствующей одышки;
- для уменьшения частоты обострений; улучшения переносимости физических нагрузок и качества жизни.
Противопоказания к применению
- повышенная чувствительность к олодатеролу, тиотропию бромиду или к любому компоненту препарата;
- повышенная чувствительность к атропину или его производным, в т.ч. к ипратропию и окситропию;
- не рекомендуется к применению у детей до 18 лет (ввиду отсутствия данных по эффективности и безопасности).
С осторожностью
следует применять препарат у пациентов с закрытоугольной глаукомой, гиперплазией предстательной железы и обструкцией шейки мочевого пузыря; у пациентов с сердечно-сосудистыми заболеваниями, в т.ч. коронарной недостаточностью, нарушениями сердечного ритма, удлинением интервала QT, гипертрофической обструктивной кардиомиопатией, артериальной гипертензией, тиреотоксикозом, судорогами; у пациентов в анамнезе которых отмечались такие заболевания как инфаркт миокарда или госпитализация по поводу сердечной недостаточности (в течение предшествующего года), жизнеугрожающая аритмия, пароксизмальная тахикардия с ЧСС >100 уд./мин; у пациентов с необычными реакциями на симпатомиметические амины.
Фармакологическое действие
Комбинированный бронхолитический препарат. Олодатерол — бета2-адреномиметик длительного действия и тиотропия бромид — м-холиноблокатор обеспечивают взаимодополняющую бронходилатацию, в результате различного механизма действия активных веществ и различной локализации целевых рецепторов в легких.
Олодатерол
обладает высоким сродством и селективностью к β2-адренорецепторам. Активация β2-адренорецепторов в дыхательных путях приводит к стимуляции внутриклеточной аденилатциклазы, которая участвует в синтезе циклического 3.5-аденозинмонофосфата (цАМФ). Повышение уровня цАМФ вызывает бронходилатацию, расслабляя гладкомышечные клетки дыхательных путей. Олодатерол является селективным агонистом β2-адренорецепторов длительного действия с быстрым началом действия и длительным (не менее 24 ч) сохранением эффекта. β2-адренорецепторы присутствуют не только в гладкомышечных клетках, но и во многих других клетках, в т.ч. в эпителиальных и эндотелиальных клетках легких и сердца. Точная функция β2-рецепторов в сердце до конца не изучена, но их присутствие указывает на возможность влияний на сердце даже высокоселективных бета2-адренергических агонистов.
Тиотропия бромид
— м-холиноблокатор длительного действия. Препарат обладает одинаковым сродством к M1-М5 подтипам мускариновых рецепторов. Результатом ингибирования М3-холинорецепторов в дыхательных путях является расслабление гладкой мускулатуры. Бронходилатирующий эффект зависит от дозы и сохраняется в течение не менее 24 ч. Значительная продолжительность действия связана, вероятно, с очень медленной диссоциацией препарата от М3-холинорецепторов: период полудиссоциации существенно более длительный, чем у ипратропия бромида. При ингаляционном способе введения тиотропия бромид, как N-четвертичное производное аммония, оказывает местный избирательный эффект (на бронхи), при этом в терапевтических дозах не вызывая системных м-холиноблокирующих побочных эффектов. Диссоциация от М2-холинорецепторов происходит быстрее, чем от М3-холинорецепторов, что свидетельствует о преобладании селективности в отношении М3 подтипа холинорецепторов над М2-холинорецепторами. Высокое сродство к рецепторам и медленная диссоциация препарата из связи с рецепторами обусловливают выраженный и продолжительный бронходилатирующий эффект у пациентов с ХОБЛ.
Бронходилатация, развивающаяся после ингаляции тиотропия бромида, обусловлена, в первую очередь, местным (на дыхательные пути), а не системным действием.
В ходе клинических исследований установлено, что препарат Спиолто® Респимат®, применявшийся 1 раз/сут, утром, приводил к быстрому (в течение 5 мин после первой дозы) улучшению функции легких. Эффект препарата Спиолто® Респимат® превосходил эффект тиотропия бромида в дозе 5 мкг и олодатерола в дозе 5 мкг, применявшихся в качестве монотерапии (ОФВ1 при приеме Спиолто® Респимат® на 0.137 л: при приеме тиотропия бромида на 0.058 л; при приеме олодатерола — на 0.125 л).
При применении препарата Спиолто® Респимат® по сравнению с применением тиотропия бромида и олодатерола в качестве монотерапии достигался более значительный бронходилатирующий эффект, а также увеличивалась пиковая объемная скорость выдоха в утренние и вечерние часы.
Применение препарата Спиолто® Респимат® приводило к снижению риска обострений ХОБЛ по сравнению с плацебо.
Препарат Спиолто® Респимат® значительно улучшал емкость вдоха по сравнению с тиотропия бромидом, олодатеролом или плацебо, применявшимися в виде монотерапии.
Спиолто® Респимат® по сравнению с плацебо значительно улучшал время переносимости физической нагрузки.
Лекарственное взаимодействие
Хотя специальных исследований лекарственного взаимодействия не проводилось, тиотропия бромид применяли совместно с другими препаратами, для лечения ХОБЛ, включая метилксантины, стероиды для приема внутрь и ингаляционного применения, при этом клинических признаков лекарственного взаимодействия не отмечалось.
Длительное совместное применение тиотропия бромида с другими м-холиноблокирующими препаратами не изучалось. Поэтому долгосрочное совместное применение препарата Спиолто® Респимат® с другими м-холиноблокирующими препаратами не рекомендуется.
Одновременное применение других адренергических препаратов может усиливать нежелательные эффекты препарата Спиолто® Респимат®.
Одновременное применение ксантиновых производных, стероидов или диуретиков (не относящихся к группе калийсберегающих) может усиливать гипокалиемический эффект адреномиметиков.
Бета-адреноблокаторы могут ослаблять эффект олодатерола или противодействовать этому эффекту. В этом случае предпочтительно применение бета1-адреноблокаторов, хотя и их следует применять с осторожностью.
Ингибиторы МАО, трициклические антидепрессанты или другие препараты, способные удлинять интервал QTc, могут усиливать действие препарата Спиолто® Респимат® на сердечно-сосудистую систему.
Совместное применение олодатерола с кетоконазолом приводило к увеличению системного воздействия олодатерола в 1.7 раза. Однако это не влияло на безопасность. Изменения дозы не требуется.
Режим дозирования
Рекомендуемая терапевтическая доза составляет 2 ингаляции спрея из ингалятора Респимат® (5 мкг/терапевтическая доза тиотропия бромида и 5 мкг/терапевтическая доза олодатерола) 1 раз/сут, в одно и то же время суток.
У пациентов пожилого возраста
можно использовать препарат Спиолто® Респимат® в рекомендуемой дозе.
У пациентов с печеночной недостаточностью легкой и средней степени тяжести
можно использовать Спиолто® Респимат® в рекомендуемой дозе. Данных о применении олодатерола у
пациентов с печеночной недостаточностью тяжелой степени
не имеется.
У пациентов с нарушениями функции почек
можно использовать препарат Спиолто® Респимат® в рекомендуемой дозе.
Пациенты с почечной недостаточностью средней и тяжелой степени
, применяющие препарат Спиолто® Респимат®, должны находиться под тщательным наблюдением врача.
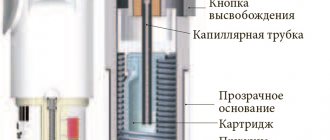
Правила применения ингалятора Спиолто® Респимат®
Перед началом использования препарата следует изучить правила применения ингалятора Спиолто® Респимат®.
Ингалятор предназначен для использования 1 раз/сут. Каждый раз при его применении следует делать 2 ингаляции.
img_spiolto_respimat_1.tif|png
Как хранить ингалятор Спиолто® Респимат®
Хранить Спиолто® Респимат® в недоступном для детей месте.
Не замораживать Спиолто® Респимат®.
Если ингалятор Спиолто® Респимат® не использовался более 7 дней, следует направить его перед применением вниз и нажать один раз на кнопку подачи дозы.
Если ингалятор Спиолто® Респимат® не использовался более 21 дня, следует повторить шаги 4-6 из раздела «Подготовка к первому использованию» до появления облачка аэрозоля. Затем повторить шаги 4-6 еще три раза.
Не использовать ингалятор Спиолто® Респимат® после окончания срока годности.
Не трогать прокалывающий элемент внутри прозрачной гильзы.
Уход за ингалятором Спиолто® Респимат®
Мундштук, включая металлическую часть внутри мундштука, следует очищать влажной тряпочкой или тканью, как минимум, 1 раз в неделю.
Любое незначительное изменение цвета мундштука не влияет на работу ингалятора Спиолто® Респимат®.
Определение момента, когда нужно начать пользоваться новым ингалятором
img_spiolto_respimat_2.tif|png
Ингалятор Спиолто® Респимат® содержит 60 ингаляционных доз (т.е. 30 терапевтических доз) при условии применения в соответствии с режимом дозирования (2 ингаляционные дозы 1 раз/сут).
Индикатор доз показывает, сколько примерно доз еще осталось. Когда индикатор покажет на красную область шкалы, это означает, что лекарства осталось примерно на 7 дней (14 ингаляционных доз).
Когда индикатор доз ингалятора достигнет конца красной области шкалы, ингалятор Спиолто® Респимат® автоматически заблокируется — больше не может быть получено ни одной ингаляционной дозы (поворот прозрачной гильзы будет невозможен).
Через 3 месяца после первого использования ингалятор Спиолто® Респимат® следует выбросить, даже если он полностью не использован.
Подготовка к перовому использованию
1. Снять прозрачную гильзу
img_spiolto_respimat_3.tif|png
- Держать колпачок закрытым.
- Нажать стопорную кнопку и сильно потянуть при этом другой рукой за прозрачную гильзу.
2. Вставить картридж
img_spiolto_respimat_4.tif|png
- Вставить картридж узким концом в ингалятор.
- Поставить ингалятор дном картриджа на твердую поверхность и сильно нажать на него, пока картридж не встанет на место со щелчком.
3. Установить на место прозрачную гильзу
img_spiolto_respimat_5.tif|png
- Установить прозрачную гильзу на место до щелчка.
4. Повернуть
img_spiolto_respimat_6.tif|png
- Держать колпачок закрытым.
- Повернуть прозрачную гильзу в направлении, указанном стрелками на этикетке, пока не раздастся щелчок (пол-оборота).
5. Открыть
img_spiolto_respimat_7.tif|png
- Открыть колпачок до упора.
6. Нажать
img_spiolto_respimat_8.tif|png
- Направить ингалятор вниз.
- Нажать кнопку подачи дозы.
- Закрыть колпачок.
- Повторить шаги 4-6
до появления облачка аэрозоля. - После появления облачка аэрозоля
повторить шаги 4-6 еще 3 раза.
Ежедневное применение
Повернуть
img_spiriva_respimat_9.tif|png
- Держать колпачок закрытым.
- Повернуть
прозрачную гильзу в направлении, указанном стрелками на этикетке, до щелчка (пол-оборота).
Открыть
img_spiolto_respimat_10.tif|png
- Открыть колпачок до упора.
Нажать
img_spiolto_respimat_11.tif|png
Сделать медленный полный выдох.
Обхватить мундштук губами, не перекрывая воздухозаборники.
Делая медленный, глубокий вдох через рот, нажать
кнопку подачи дозы и продолжать делать вдох.
Задержать дыхание примерно на 10 сек или так долго, как возможно.
Для получения второй ингаляционной дозы повторить операции: Повернуть, Открыть, Нажать.
Ответы на часто задаваемые вопросы
1. Сложно установить картридж на необходимую глубину
Вы случайно повернули прозрачную гильзу до установки картриджа?
Откройте колпачок, нажмите на кнопку подачи дозы, затем вставьте картридж.
Вы вставляете картридж широким концом?
Вставьте картридж узким концом в ингалятор.
2. Невозможно нажать на кнопку подачи дозы
Повернули ли Вы прозрачную гильзу?
Если нет, поверните прозрачную гильзу одним непрерывным движением до щелчка (пол-оборота).
Индикатор доз ингалятора Спиолто® Респимат® указывает на ноль?
Ингалятор Спиолто® Респимат® блокируется после выпуска 60 ингаляционных доз (30 терапевтических доз). Подготовьте и используйте новый ингалятор Спиолто® Респимат®.
3. Невозможно повернуть прозрачную гильзу
Вы уже повернули прозрачную гильзу?
Если прозрачная гильза уже повернута, следуйте по шагам «Открыть» и «Нажать» в разделе «Ежедневное применение» для получения ингаляционной дозы.
Индикатор доз ингалятора Спиолто® Респимат® указывает на ноль?
Ингалятор Спиолто® Респимат® блокируется после выпуска 60 ингаляционных доз (30 терапевтических доз). Подготовьте и используйте новый ингалятор Спиолто® Респимат®.
4. Индикатор доз ингалятора Спиолто® Респимат® достигает нуля слишком быстро
Использовали ли Вы Спиолто® Респимат® в соответствии с Режимом дозирования (две
ингаляционные дозы 1 раз/сут)?
Препарата Спиолто® Респимат® хватает на 30 дней при использовании двух ингаляций 1 раз/сут.
Поворачивали ли Вы прозрачную гильзу до установки картриджа?
Индикатор доз считает каждый поворот прозрачной гильзы вне зависимости от того, установлен картридж или нет.
Выпускали ли Вы ингаляционные дозы в воздух для проверки работы Спиолто® Респимат®
. После подготовки ингалятора к использованию не требуется ежедневной проверки ингаляции.
Вы установили картридж в использованный ингалятор Спиолто® Респимат®?
Всегда устанавливайте новый картридж в новый
ингалятор Спиолто® Респимат®.
5. Ингалятор Спиолто® Респимат® выпускает ингаляционные дозы автоматически
Был ли открыт колпачок, когда Вы поворачивали прозрачную гильзу?
Закройте колпачок, затем поверните прозрачную гильзу.
Нажимали ли Вы кнопку подачи дозы во время поворота прозрачной гильзы?
Закройте колпачок так, чтобы кнопка подачи дозы была закрыта, затем поверните прозрачную гильзу.
Останавливались ли Вы во время поворота прозрачной гильзы, до звука щелчка?
Поверните прозрачную гильзу одним
непрерывным
движением до щелчка (пол-оборота).
6. Ингалятор Спиолто® Респимат® не выпускает ингаляционную дозу
Установили ли Вы картридж?
Если нет, установите картридж.
Вы повторили шаги «Повернуть», «Открыть», «Нажать» менее трех раз после установки картриджа?
Повторите шаги «Повернуть», «Открыть», «Нажать» три раза после установки картриджа, как описано в разделе «Подготовка к первому использованию», шаги 4-6.
Индикатор доз ингалятора Спиолто® Респимат® указывает на ноль?
Если индикатор доз указывает на ноль, значит ингалятор пуст и заблокирован.
Не снимайте прозрачную гильзу и не вынимайте картридж после подготовки ингалятора к использованию. Всегда устанавливайте новый картридж в новый
ингалятор Спиолто® Респимат®.
Передозировка
Симптомы:
передозировка олодатерола может привести к выраженным эффектам, типичным для бета2-адреномиметиков, например, к ишемии миокарда, повышению или снижению АД, тахикардии, аритмиям, ощущению сердцебиения, головокружению, нервозности, бессоннице, беспокойству, головной боли, тремору, сухости во рту, спазму мышц, тошноте, усталости, недомоганию, гипокалиемии, гипергликемии и метаболическому ацидозу.
При применении высоких доз тиотропия бромида возможны проявления м-холиноблокирующего действия. После 14-дневного ингаляционного применения тиотропия бромида в дозах, достигавших 40 мкг, у здоровых лиц не наблюдалось значимых неблагоприятных явлений, кроме чувства сухости слизистых оболочек носа и ротоглотки, частота которых зависела от величины дозы (10-40 мкг/сут). Исключение составляло отчетливое снижение саливации, начиная с 7 дня применения препарата.
Лечение:
прием препарата Спиолто® Респимат® следует прекратить. Показано поддерживающее и симптоматическое лечение. В тяжелых случаях необходима госпитализация. Может рекомендоваться применение бета1-адреноблокаторов, но только при соблюдении особой осторожности, т.к. использование этих препаратов может вызвать бронхоспазм.
Побочное действие
Побочные реакции были выявлены на основании данных, полученных при проведении клинических исследований препарата Спиолто® Респимат®.
Определений категорий частоты побочных реакций: очень часто (≥1/10), часто (≥1/100, <1/10), нечасто (от ≥1/1000, <1/100), редко (≥1/10 000, <1/1000), очень редко (<1/10 000), частота неизвестна* (частота не может быть оценена на основании имеющихся данных).
Инфекционные и паразитарные заболевания:
редко — назофарингит.
Со стороны обмена веществ:
частота неизвестна — дегидратация.
Со стороны нервной системы:
нечасто — головокружение, бессонница.
Со стороны органа зрения:
редко — нечеткое зрение; частота неизвестна — повышение внутриглазного давления, глаукома.
Со стороны сердечно-сосудистой системы:
нечасто — мерцательная аритмия, ощущение сердцебиения, тахикардия, повышение АД; редко — наджелудочковая тахикардия.
Со стороны дыхательной системы:
нечасто — кашель, дисфония; редко — ларингит, фарингит, носовое кровотечение; частота неизвестна — бронхоспазм, синусит.
Со стороны пищеварительной системы:
часто — сухость во рту (обычно незначительная); нечасто — запор; редко — кандидоз полости рта, гингивит; частота неизвестна — кишечная непроходимость, включая паралитическую кишечную непроходимость, гастроэзофагеальный рефлюкс, дисфагия, глоссит, стоматит.
Со стороны кожи и подкожных тканей:
частота неизвестна — кожные инфекции и язвы на коже, сухость кожи.
Аллергические реакции:
редко — гиперчувствительность (включая реакции немедленного типа) ангионевротический отек, крапивница, зуд; частота неизвестна — сыпь.
Со стороны костно-мышечной системы:
редко — артралгия, боль в спине**; частота неизвестна — отечность в области суставов.
Со стороны почек и мочевыделительной системы:
редко — дизурия, задержка мочи (чаще у мужчин с наличием предрасполагающих факторов), инфекция мочевыводящих путей.
* Данные побочные реакции не были выявлены в ходе клинических исследований препарата. С вероятностью 95% частота этих побочных реакций не превышает категорию «нечасто».
**Нежелательный эффект, относящейся к препарату Спиолто® Респимат®, а не к его компонентам.
Многие из перечисленных нежелательных эффектов относятся к антихолинергическим свойствам тиотропия бромида или к бета-адреномиметическим свойствам олодатерола. Поэтому следует принимать во внимание возможность возникновения нежелательных эффектов, характерных для всего класса бета-адреномиметиков, таких как: аритмия, ишемия миокарда, стенокардия, артериальная гипотензия, тремор, головная боль, нервозность, тошнота, мышечные спазмы, усталость, недомогание, гипокалиемия, гипергликемия и метаболический ацидоз.
Особые указания
Препарат Спиолто® Респимат® не следует использовать при бронхиальной астме. Эффективность и безопасность препарата Спиолто® Респимат® при бронхиальной астме не изучались.
Острый бронхоспазм
Препарат Спиолто® Респимат® не показан для лечения острых эпизодов бронхоспазма, т.е. в качестве средства скорой помощи.
Гиперчувствительность
После применения препарата Спиолто® Респимат® возможно развитие реакций гиперчувствительности немедленного типа.
Парадоксальный бронхоспазм
Применение препарата Спиолто® Респимат®, как и других ингаляционных лекарственных средств, может привести к парадоксальному бронхоспазму, иногда угрожающему жизни. В случае развития парадоксального бронхоспазма применение препарата Спиолто® Респимат® должно быть немедленно прекращено и назначена альтернативная терапия.
Пациенты с нарушениями функции почек
Т.к. тиотропия бромид выводится преимущественно почками, пациенты с почечной недостаточностью средней и тяжелой степени тяжести (КК <50 мл/мин), применяющие препарат Спиолто® Респимат®, должны находиться под тщательным наблюдением врача.
Нарушения со стороны органа зрения
Пациенты должны быть ознакомлены о правильном применении препарата Спиолто® Респимат®. Не следует допускать попадания раствора или аэрозоля в глаза. Боль или дискомфорт в глазах, нечеткое зрение, зрительные ореолы вокруг источников света в сочетании с покраснением глаз, вызванным отеком конъюнктивы и роговицы могут быть симптомами острой закрытоугольной глаукомы. При развитии любой комбинации этих симптомов следует немедленно обратиться к специалисту. Глазные капли, обладающие миотическим действием, не считаются эффективным лечением.
Сердечно-сосудистые эффекты
Олодатерол, как и другие бета2-адреномиметики, может оказывать клинически существенное влияние на сердечно-сосудистую систему у некоторых пациентов (учащение пульса, повышение АД и/или появление соответствующих симптомов). В случае возникновения таких симптомов может потребоваться прекращение лечения. Кроме того, сообщалось, что бета2-адреномиметики приводили к таким изменениям ЭКГ, как уплощение зубца Т и депрессия сегмента ST, хотя клиническое значение этих изменений неизвестно.
Гипокалиемия
Бета2-адреномиметики у некоторых пациентов могут приводить к развитию гипокалиемии, создающей предпосылки для возникновения нежелательных влиянии на сердечно-сосудистую систему. Снижение концентрации калия в сыворотке крови обычно кратковременно и не требует его восполнения. У пациентов с тяжелой ХОБЛ гипокалиемия может усиливаться из-за гипоксии и сопутствующего лечения и увеличивать риск развития аритмий.
Гипергликемия
Ингаляционное применение больших доз бета2-адреномиметиков может привести к увеличению концентрации глюкозы в плазме крови.
Спиолто® Респимат® не следует применять в комбинации с каким-либо другим лекарственным препаратом, содержащим бета2-адреномиметики длительного действия.
Пациентов, часто применяющих ингаляционные бета2-адреномиметики короткого действия (например, 4 раза/сут), необходимо проинструктировать о том, что эти препараты используются только для облегчения острых симптомов бронхоспазма.
Спиолто® Респимат® предназначен для поддерживающего лечения больных ХОБЛ. В связи с тем обстоятельством, что в общей популяции ХОБЛ существенно преобладают больные в возрасте старше 40 лет, при назначении препарата пациентам моложе 40 лет требуется спирометрическое подтверждение диагноза ХОБЛ.
Влияние препарата на способность управлять транспортными средствами и механизмами
Исследования по изучению влияния на способность управлять транспортными средствами и механизмами не проводились. Следует соблюдать осторожность при выполнении данных видов деятельности, т.к. возможно развитие головокружения или нечеткости зрения.
Условия хранения
Препарат следует хранить в недоступном для детей месте при температуре не выше 25°С. Не замораживать.
Срок годности
Срок годности — 3 года. Использовать в течение 3 мес после первой ингаляции.
Применение при беременности и кормлении грудью
Ограничения при беременности — Противопоказано. Ограничения при кормлении грудью — Противопоказано.
Клинических данных о влиянии олодатерола/тиотропия бромида на беременность нет. В доклинических исследованиях при использовании высоких доз олодатерола, в несколько раз превышавших терапевтические дозы, установлены влияния типичные для бета2-адреномиметиков. Следует учитывать ингибирующее влияние олодатерола на сократительную способность матки. Препарат Спиолто® Респимат® не следует применять у беременных женщин, если только потенциальная польза для матери не превышает потенциальный риск для плода.
Клинических данных о применении олодатерола/тиотропия бромида у женщин, кормящих грудью, нет. Препарат Спиолто® Респимат® не следует применять у кормящих грудью женщин, если только потенциальная польза для матери не превышает потенциальный риск для ребенка. На период применения препарата необходимо прекратить грудное вскармливание.
Применение при нарушениях функции почек
Ограничения при нарушениях функции почек — Без ограничений.
Пациентам с нарушениями функции почек можно использовать препарат Спиолто Респимат в рекомендуемой дозе.
Пациенты с почечной недостаточностью средней и тяжелой степени тяжести, применяющие препарат Спиолто Респимат, должны находиться под тщательным наблюдением врача.
Применение при нарушениях функции печени
Ограничения при нарушениях функции печени — Без ограничений.
Пациентам с печеночной недостаточностью легкой и средней степени тяжести можно использовать Спиолто Респимат в рекомендуемой дозе.
Данных о применении олодатерола у пациентов с печеночной недостаточностью тяжелой степени тяжести не имеется.
Применение у пожилых пациентов
Ограничения для пожилых пациентов — Без ограничений.
У пожилых пациентов можно использовать препарат Спиолто Респимат в рекомендуемой дозе.
Применение у детей
Ограничения для детей — Противопоказано.
Противопоказано применение препарата детям и подросткам в возрасте до 18 лет (ввиду отсутствия данных по эффективности и безопасности).
Условия реализации
Препарат отпускается по рецепту.
Контакты для обращений
БЕРИНГЕР ИНГЕЛЬХАЙМ ИНТЕРНЕШНЛ ГмбХ (Германия)
ООО «Берингер Ингельхайм»
125171 Москва Ленинградское шоссе 16А, стр. 3 Тел. Факс
Спирива Респимат – новое направление в лечении ХОБЛ
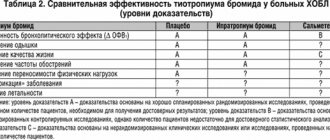
Роль тиотропия бромида в терапии ХОБЛ Тиотропия бромид относится к группе М–холинолитиков. Препарат отличается сверхдлительным (более 24 ч) бронхолитическим эффектом, благодаря которому тиотропий может назначаться 1 р./сут. На сегодняшний день тиотропия бромид является наиболее активным препаратом в ряду холинолитиков: по своей холинолитической активности тиотропиум в 12 раз превосходит атропин и на 20–30% более активен, чем ипратропиум и аклидиниум бромид [1]. Все М–холинолитики являются неселективными препаратами, т.е. они блокируют М–холинорецепторы всех подтипов. При этом блокада М1– и М3–рецепторов способствует расширению бронхов и обеспечивает лечебный эффект препаратов, а блокада M2–рецепторов является нежелательной, т.к. этот подвид холинорецепторов отвечает за торможение сигнала в синапсах. Тиотропия бромид отличает очень кратковременная блокада М2–рецепторов (Т½ связи с M2–рецепторами у тиотропия всего 3,6 ч), в то время как блокада M1 и M3–рецепторов продолжается больше 1 сут. [1]. У больных ХОБЛ основные патологические изменения происходят на уровне мелких периферических дыхательных путей, которые в большей степени повреждаются под воздействием табачного дыма и нейтрофильного воспаления. Причем эти изменения носят необратимый характер. Но наряду с этим больных ХОБЛ отличает повышенный тонус парасимпатической системы, что приводит к сужению крупных бронхов (общее сопротивление дыхательных путей определяется главным образом центральными бронхами, так как их суммарный просвет – около 2 см2 – значительно меньше общего просвета периферических бронхов) и повышению общего сопротивления дыхательных путей [2]. Воздействуя на холинорецепторы центральных бронхов, тиотропиум бромид устраняет влияние парасимпатической нервной системы, крупные бронхи расширяются, а общее сопротивление дыхательных путей – снижается. В итоге уменьшается остаточная емкость легких и увеличивается дыхательный объем. Как следствие, у больных уменьшается одышка, им легче выполнять физические нагрузки [3]. После ингаляции тиотропия бромида величина объема форсированного выдоха за первую секунду (ОФВ1) увеличивается на 150–180 мл (по сравнению с плацебо) или на 103 мл по сравнению с группой контроля, получавшей терапию β2–агонистами и ингаляционными ГКС [4]. Еще в большей степени тиотропиум бромид устраняет так называемую «воздушную ловушку», т.е. уменьшает объем воздуха, который остается в легких больного после максимального выдоха [5]. В результате препарат увеличивает дыхательный объем, уменьшает выраженность одышки, повышает переносимость физической нагрузки [6] и снижает связанную с нагрузкой концентрацию катехоламинов в крови [7]. Положительное влияние тиотропия не ограничивается функцией внешнего дыхания – он значимо (на 38–44%) уменьшает число обострений ХОБЛ [8,9] и на 12–16% – летальность от любых причин у больных ХОБЛ [4,10]. Важно подчеркнуть, что положительное действие тиотропия сохраняется длительное время (в настоящее время наиболее продолжительное исследование этого препарата продолжалось 4 года [4]), в то время как эффекты других бронхолитиков (β2–агонисты длительного действия, например, салметерол) могут заметно уменьшаться при постоянном приеме [11] из–за снижения числа и чувствительности β–адренорецепторов [12]. У больных ХОБЛ тиотропий может назначаться в виде монотерапии, что позволяет существенно (на 27%) снизить риск тяжелых обострений ХОБЛ по сравнению с монотерапией салметеролом (β2–агонист длительного действия) [13]. Результаты метаанализа исследований, в которых применение тиотропия сравнивались с терапией β2–агонистами длительного действия, показали, что тиотропий и β2–агонисты обеспечивают примерно одинаковый прирост величины ОФВ1, но при этом у больных, получавших тиотропий, риск обострений оказался на 14% ниже, а частота нежелательных явлений – на 12% меньше, чем при назначении β2–агонистов (в анализ были включены сравнительные исследования тиотропия с салметеролом, формотеролом и индакатеролом) [14]. При тяжелом течении ХОБЛ, когда требуется комбинация нескольких препаратов, тиотропий можно эффективно сочетать с препаратами других фармацевтических групп. В частности, тиотропий выступает как синергист β2–агонистов длительного действия [15], т.к. на фоне его приема увеличивается чувствительность β–адренорецепторов [16]. В ходе клинических исследований была доказана эффективность комбинации тиотропия с рофлумиластом [17] и комбинированными препаратами, в состав которых входят β2–агонисты и ингаляционные ГКС (будесонид/формотерол) [18]. Респимат® – ингалятор нового поколения Тиотропия бромид в виде нового ингаляционного устройства Респимат® (рис. 1) появился в продаже в нашей стране в 2012 году. Этот прибор объединяет в себе лучшие качества дозированного аэрозольного ингалятора (ДАИ): простоту, компактность, возможность быстро выполнить ингаляцию и положительные свойства небулайзера: ингалятор медленно (около 1,5 с) выделяет аэрозоль. Таким образом, в процессе ингаляции у больных не возникает проблем с координацией дыхания. Частицы аэрозоля, генерируемые обычными ДАИ, имеют высокую начальную скорость – от 2 до 8 м/с [19]. Двигаясь с такой скоростью, частицы по инерции сталкиваются с задней стенкой глотки. В результате большая часть дозы (от 50 до 80%) осаждается в ротоглотке, проглатывается со слюной и абсорбируется в ЖКТ, вызывая нежелательные системные эффекты. Во время ингаляции Респимат выделяет аэрозоль со скоростью около 1 м/с, которая в несколько раз меньше, чем скорость аэрозоля, создаваемого ДАИ. Двигаясь медленно, частицы аэрозоля избегают столкновения с задней стенкой глотки и языком, что снижает депозицию препарата в полости рта. Как следствие, существенно увеличивается количество действующего вещества, доставленное в дыхательные пути. Важно отметить, что Респимат генерирует аэрозоль в течение 1,5 с, в то время как из ДАИ препарат выделяется в среднем всего за 0,2 с [19]. При ингаляции через ДАИ больные вынуждены координировать свой вдох так, чтобы активация ингалятора и начало вдоха идеально совпадали по времени: если пациент начинает вдыхать до активации ингалятора или, наоборот, выполняет вдох с опозданием, то количество препарата, доставленное в дыхательные пути, может уменьшиться в несколько раз [20]. Целому ряду больных трудно добиться хорошей координации между вдохом и активацией ингалятора, например, 18% больных активируют свой ДАИ во второй половине вдоха, а 5% – уже после завершения вдоха [21]. Респимат, обеспечивая выделение препарата на протяжении 1,5 с, существенно снижает последствия ошибок, связанных с недостаточной координацией вдоха больным. В результате Респимат способен в несколько раз по сравнению с ДАИ увеличить депозицию препарата в нижних дыхательных путях (рис. 2). Для другого типа устройств доставки – порошковых ингаляторов также существуют особенности применения, зачастую лимитирующие их эффективность. Так, больные, использующие порошковые ингаляторы, должны вдыхать порошок достаточно быстро. В частности, минимальная скорость вдоха через Турбухалер, Мультидиск и ХандиХалер должна составлять 30 л/мин. [22]. Большинство больных ХОБЛ способны вдыхать препарат с такой скоростью [23]. Но если больной использует ингалятор капсульного типа, продолжительность вдоха должна составлять не менее 3 с: если вдох продолжается меньшее время, то порошок не успевает полностью покинуть капсулу. Сделать долгий вдох с высокой скоростью для больных ХОБЛ в целом проблематично, тем более что некоторые ингаляторы (Аэролайзер) требуют вдоха со скоростью более 60 л/мин. (объем вдоха продолжительностью 3 с со скоростью 60 л/мин. составляет 3 л). В результате при использовании порошковых ингаляторов часть дозы остается в капсуле, и больной должен каждый раз проверять капсулу и при необходимости совершать ингаляцию повторно. При использовании порошковых ингаляторов от больного требуется более быстрый и продолжительный вдох, в то время как при применении Респимата нет никаких особых требований к дыхательному маневру, который осуществляет больной. Таким образом, Респимат значительно удобнее в использовании для больных ХОБЛ по сравнению с ДАИ и порошковыми ингаляторами. Еще одним важным преимуществом нового ингалятора является то, что 55% дозы тиотропия бромида в Респимате выделяется в виде частиц оптимального аэродинамического диаметра, что гарантирует высокую степень легочной депозиции (табл. 1). Таким образом, Респимат на сегодняшний день – одно из наиболее совершенных средств доставки препаратов в дыхательные пути. Кроме того, Респимат является универсальным средством доставки. В перспективе в виде Респимата будут выпускаться не только тиотропий, но и бронхолитики короткого действия, а также новый β2–агонист сверхдлительного (24 ч) действия – олодатерол. Благодаря высокой степени легочной депозиции суточная доза тиотропия в Респимате составляет всего 5 мкг (2 ингаляции по 2,5 мкг), но при этом Спирива Респимат обеспечивает лечебный эффект, сопоставимый с назначением 18 мкг препарата через ХандиХалер [28]. Респимат с точки зрения пациента Респимат прост в использовании. В исследовании 97,7% опрошенных пациентов заявили, что использовать Респимат «очень просто» или «просто» (рис. 3) [29]. На вопрос: «Как быстро Вы почувствовали уверенность при использовании Респимата?» большинство (76,6%) больных ответили, что почувствовали уверенность после первого или второго опыта использования этого ингалятора (рис. 4). Среди больных, применявших для лечения ХОБЛ как Респимат, так и ДАИ, 74% отдали предпочтение Респимату, 19% – ДАИ и 9% затруднились дать ответ [29]. Больные ХОБЛ, для которых предназначен Респимат, представляют серьезную проблему для врачей в плане обучения технике ингаляций из–за пожилого возраста и психологических проблем, связанных с воздействием заболевания на психические процессы (депрессия, негативное отношение к терапии). В частности, исследование, проведенное Brand P. с соавт. [30], показало, что дополнительное обучение технике ингаляции с помощью ДАИ практически не способно улучшить степень доставки препарата в дыхательные пути. Однако если больные применяют Респимат, то количество препарата, доставленного в легкие, в среднем существенно выше по сравнению с ДАИ, причем контроль со стороны врача и дополнительное обучение способны еще более повысить уровень легочной депозиции препарата (рис. 5). Безопасность Безопасность тиотропия бромида (ХандиХалер) была изучена и доказана в ходе 30 международных сравнительных исследований с участием более 30 тыс. пациентов. В частности, было показано, что тиотропия бромид хорошо переносится больными и не оказывает нежелательного воздействия на сердечно–сосудистую систему [31], а также не влияет на уродинамику у больных с доброкачественной гипертрофией предстательной железы [32]. Спирива Респимат (в отличие от ХандиХалера): • содержит в качестве суточной дозы в 3,6 раза меньше действующего вещества; • меньше задерживается в полости рта и, как следствие, меньшее количество тиотпропия может быть проглочено больным со слюной и впоследствии абсорбироваться в ЖКТ; • концентрация препарата в крови после ингаляции через Респимат достаточно мала и существенно не отличается от концентрации, которая создается после ингаляции через ХандиХалер [33–35]. Таким образом, Спирива Респимат должен обеспечивать по крайней мере такую же высокую степень безопасности для больных, как и Спирива ХандиХалер. Действительно, по общему числу нежелательных явлений Спирива Респимат не отличается от плацебо [36] – за исключением жалоб на сухость во рту, которые в 2 раза чаще отмечались в группе тиотропия и закономерно объясняются холинолитическим действием препарата. Однако обобщенный анализ 2 исследований тиотропия, проведенных Bateman E. с соавт. [37], показал, что число летальных исходов по любой причине, включая пациентов, не закончивших исследование, в группах, получавших тиотропий Респимат, было больше, чем в группе плацебо: 2,4% (тиотропий 5 мкг), 2,7% (тиотропий 10 мкг) и 1,6% (плацебо). При этом важно отметить, что разница в частоте летальных исходов по любой причине между группами терапии и плацебо не была статистически достоверна. К тому же увеличение риска летального исхода было зафиксировано далеко не во всех исследованиях Респимата и может быть связано с ошибками в организации исследований (в частности, включение в исследование больных, о которых было известно, что они страдают нарушениями сердечного ритма [38]). Предполагаемое повышение риска летальных исходов, о которых сообщили Bateman E. и Singh S., не повлияло на позицию регуляторных инстанций, отвечающих за безопасность лекарственных средств более чем в 55 странах, – в том числе в странах Западной Европы и в России. Заявка на регистрацию SpirivaRespimat в США подана на рассмотрение FDA. Однако чтобы окончательно подтвердить безопасность Спиривы Респимат, было начато специальное исследование TIOSPIR с участием более 17 тыс. больных ХОБЛ. В этом исследовании больные были рандомизированы для приема Спиривы Респимат (5 мкг/сут.) и Спиривы ХандиХалер (18 мкг/сут.). Основным выводом TIOSPIR должно стать заключение о безопасности применения тиотропия, доставляемого через Респимат. Также в ходе исследования будет получена дополнительная информация об эффективности Спиривы Респимат в лечении ХОБЛ. Завершение исследования ожидается в 2013 г., однако уже в настоящее время можно предполагать, что никаких неожиданных результатов в ходе исследования получено не будет. Независимый комитет по контролю безопасности клинических испытаний в ходе последнего совещания в январе 2013 г. рекомендовал дальнейшее проведение исследования TIOSPIR согласно протоколу без внесения каких–либо изменений [39]. Все сказанное делает маловероятным наличие взаимосвязи между применением Спиривы Респимат и летальными исходами. В этом плане можно вспомнить исследование INSPIRE [40], в котором терапия Спиривой ХандиХалер сравнивалась с терапией салметеролом/флутиказоном. Сравниваемые группы больных в этом исследовании не отличались как по числу обострений ХОБЛ, так и по показателям спирометрии. Кроме того, в группе салметерола/флутиказона случаи пневмонии отмечались в 2 раза чаще, чем в группе Спиривы. Но при этом число летальных исходов оказалось выше в группе Спиривы. Подобный результат оказался абсолютно неожиданным, т.к. существенно более крупное и более продолжительное исследование UPLIFT доказало способность тиотропия снижать летальность у больных ХОБЛ [4], в то время как достоверные данные о снижении летальности при терапии салметеролом/флутиказоном (аэрозоль) так и не были получены [41]. Анализ методологии исследования, проведенный крупнейшим специалистом в области респираторных исследований Samy Suissa [42], убедительно показал, что различия в смертности были обусловлены методологическими погрешностями в проведении исследования INSPIRE (отсутствие полной информации о выбывших из исследования больных, притом что исследование не завершили согласно протоколу более 1/3 пациентов). Респимат: техническое устройство В ингаляторе действующее вещество помещено в металлический картридж, рассчитанный на 60 доз. Препарат в картридже надежно защищен от воздействия внешней среды. Перед первым использованием картридж вставляется в ингалятор, далее для подготовки к работе надо 3 раза подряд после появления аэрозольного облачка активировать ингалятор вхолостую. Респимат не содержит пропеллентов, т.е. жидких веществ, активное испарение которых создает в ДАИ давление, выталкивающее аэрозоль наружу. Отсутствие в Респимате пропеллента позволяет избежать ситуации, при которой пропеллент, поступая вместе с препаратом в дыхательные пути, быстро испаряется на слизистой бронхов, создавая эффект охлаждения, что может спровоцировать бронхоспазм у чувствительных больных [43]. Подача аэрозоля в Респимате осуществляется механически. Поворачивая до щелчка прозрачную гильзу, больной сжимает пружину, а при активации ингалятора пружина проталкивает очередную дозу препарата через так называемый юни–блок, в котором создается аэрозоль. Главная деталь ингалятора – юни–блок состоит из 2 функциональных частей: фильтра и сопла с 2 отверстиями. Пройдя через фильтр, раствор препарата покидает юни–блок через 2 отверстия диаметром 8 мкм, давление и соударение 2 потоков жидкости под определенным углом формирует аэрозоль, состоящий на 55% из частиц оптимального (от 1 до 5 мкм) диаметра. Выводы Респимат обладает целым рядом особенностей, выделяющих это устройство в ряду других ингаляторов. В частности, низкая скорость и продолжительное выделение аэрозоля создают оптимальные условия для доставки препарата в дыхательные пути, а 55% от дозы представлено частицами оптимального размера. Ингалятор обеспечивает минимальную степень депозиции в ротоглотке и содержит меньшее количество препарата по сравнению со Спиривой ХандиХалером. Эти свойства должны сделать терапию тиотропием еще более безопасной. Респимат отличает простая техника ингаляций. В результате больные с первых дней уверенно обращаются с ингалятором. Положительные свойства Респимата позволяют оптимизировать терапию тиотропием и, в конечном итоге, улучшить качество оказания медицинской помощи больным ХОБЛ.
Литература 1. Disse B et al. Life Sci 1993, 52: 537-44. 2. Gross NJ, Co E, Skorodin MS. Chest. 1989 Nov;96(5):984-7. 3. Buels KS, Fryer AD. Handb Exp Pharmacol. 2012;(208):317-41. 4. Tashkin DP et al. UPLIFT Study Investigators. N Engl J Med 2008;359:1543-54 5. Celli B, ZuWallack R, Wang S, Kesten S. Chest. 2003 Nov;124(5):1743-8. 6. O’Donnell DE et al. Eur Respir J. 2004 Jun;23(6):832-40. 7. Yoshimura K et al. Int J Chron Obstruct Pulmon Dis. 2012;7:109-17 8. Casaburi R et al. Eur Respir J 2002; 19:217-224 9. Vincken W et al. Eur Respir J 2002; 19:209-216 10. Celli В et al. CHEST 2010; 137(1): 20-30 11. Donohue JF et al. Chest. 2002 Jul;122(1):47-55 12. Vasudevan NT et al. Cell Cycle. 2011 Nov 1;10(21):3684-91 13. Vogelmeier C et al. N Engl J Med 2011;364:1093-103 14. Chong J, Karner C, Poole P. Cochrane Database Syst Rev. 2012 Sep 12;9:CD009157. 15. Van Noord JA, et al. Eur Respir J. 2005;26:214-222 16. Johnson M. Proc Am Thorac Soc. 2005;2(4):320-5 17. Fabbri LM et al. Lancet. 2009;374(9691):695-703 18. Aaron CD et al. Ann Intern Med. 2007;146:545-555. 19. Hochrainer D, Hцlz H, Kreher C, et al. J Aerosol Med, 2005; 18; 273–82. 20. Newman SP et al. Thorax 1991;46;712-716 21. Мelani AS et al. Respir Med 2011; 105: 930-938. 22. Laube BL et al. Eur Respir J 2011; 37: 1308-1331 23. Malmberg LP et al. Intern J of COPD 2010:5 257–26 24. De Backer W et al. J Aerosol Med and Pulmmon Drug Delivery 2010; Vol. 23 #3: 137–148 25. Rosenborg J et al. Eur Respir J 1999; 14:62s. 26. Criée CP et al. J Aerosol Med. 2006 Winter;19(4):466-72. 27. Ziegler, J., Wachtel H. (2001), Drug delivery to the Lungs XII, 54-57 28. van Noord et al. Respir Med 2009; 103: 22-29 29. Barczok M et al. Presented at VIII Deutsches Aerosol Therapie Seminar, Marburg, Germany. November 2003. 30. Brand P et al. International Journal of COPD 2008:3(4) 763–770 31. Rodrigo GJ et al. Pulmonary Pharmacology & Therapeutics 2012 ;25 : 40-47 32. Miyazaki et al. Pulmonary Pharmacology & Therapeutics 2008; 21: 879–883 33. van Noord J et al. Respir Med 2009;103:22–9. 34. Ichinose M et al. Respir Med 2010;104:228–36. 35. Tiotropium Respimat Pharmacokinetic Study in COPD https://www.clinicaltrials.gov/ ct2/show/NCT01222533? 36. Bateman E, et al. Respir Med 2010; 104: 1460-72 37. Bateman E et al. Int J Chron Obstruct Pulmon Dis. 2010 Aug 9;5:197-208. 38. Singh S et al. BMJ. 2011 Jun 14;342:d3215 39. Metzdorf N. Thorax Online First, published on February 12, 2013 as 10.1136/thoraxjnl-2013-203228 40. Wedzicha JA et al. Am J Respir Crit Care Med Vol 177. pp 19–26, 2008 41. Calverley PM et al. N Engl J Med 2007;356:775–789. 42. Suissa S. Am J Respir Crit Care Med. 2008 Nov 15;178(10):1090-1 43. Berger W. Curr Drug Deliv. 2009 Jan;6(1):38-49