Алтеплаза (Alteplasum)
Рекомендуется регулярный контроль за переносимостью лечения, особенно у пациентов, одновременно получающих ингибиторы АПФ. Терапия требует тщательного наблюдения за зонами возможного кровотечения (включая места введения катетера, артериальных и венозных пункций, разрезов и инъекций). Следует избегать использования жестких катетеров, внутримышечных инъекций и необоснованных манипуляций во время лечения
При остром коронарном синдроме целесообразно проведение тромболизиса. Он способствует снижению смертности и экономически выгоден. Не обнаружено различий в выживаемости после применения тканевого активатора плазминогена, стрептокиназы и анизолированного плазминоген-стрептокиназного комплекса; обсуждается продолжительность и схема тромболитической терапии. Дополнительное лечение антикоагулянтами и антиагрегантами, вероятно, повышает эффективность тромболитической терапии.
Чем раньше проведен тромболизис, тем он эффективнее. Именно поэтому тромболизис нужно ввести в повседневную практику лечебных учреждений. Следует принимать во внимание риск необходимости реанимационных мероприятий, связанных с проведением тромболизиса.
В амбулаторной практике препаратом выбора считают урокиназу (болюсное введение тенектеплазы или ретеплазы), в стационарных условиях — стрептокиназу (кроме случаев, когда пациенты получали ее ранее). Новые средства (альтеплаза) более дорогостоящи и поэтому не могут быть препаратами первой линии. Примерная стоимость курса лечения одного больного при использовании ингибитора тканевого активатора тромбопластина составляет 2900 долларов, с применением стрептокиназы — 400 долларов, анизолированного плазминоген-стрептокиназного комплекса — 1900 долларов, урокиназы — 775 долларов.
Руководители и администраторы здравоохранения, кардиологи стационаров должны содействовать проведению тромболизиса врачами общей практики.
Мониторинг коагулограммы (АЧТВ, фибриноген, продукты деградации фибрина, тромбин, тромбиновое время), гематокрита, концентрации гемоглобина, количества тромбоцитов, электрокардиограммы (при тромбозе коронарной артерии); при тромбозе сосудов головного мозга — контроль психического и неврологического статуса (до начала лечения и периодически во время приема препарата). Для оценки лечения в динамике используют один или несколько критериев; артериальное давление, пульс и частоту дыхания определяют регулярно.
Риск развития геморрагических осложнений возрастает при применении доз препарата, превышающих 100 мг.
Следует соотносить потенциальный риск и пользу применения альтеплазы после недавно перенесенных незначительных травм (биопсия, пункция сосудов, внутримышечные инъекции, массаж сердца) и при других состояниях, сопровождающиеся риском развития кровотечений, при беременности, в течение первых 10 сут послеродового периода (повышенный риск кровотечений), во время кормления грудью, в пожилом возрасте и у детей.
Гепарин натрия перед проведением тромболитической терапии отменяют; следующее введение возможно после тромболизиса и возвращения показателей тромбинового времени и/или АЧТВ к двукратным значениям контроля и ниже (обычно через 2-4 ч).
Не вызывает сомнений актуальность проблемы выбора наиболее эффективной программы тромболитической терапии (ТЛТ), поскольку именно тромболитические препараты составляют основу медикаментозной терапии острого инфаркта миокарда (ИМ) в первые часы после начала ангинозного приступа.
В настоящее время ИМ является основной причиной смерти больных в экономически развитых странах. Только в 1990 г., по данным ВОЗ, из 10 912 больных умерли от ишемической болезни сердца (ИБС) 2 695 (25 %), причем от инфаркта миокарда погибли 1 001 человек, что составило 9,2 % [1].
По сводным данным 9 крупномасштабных рандомизированных исследований, включавших больных с подозрением на ИМ, начатая в первый час заболевания ТЛТ снижала 35-дневную смертность в среднем на 27 %, а терапия, начатая через 7–12 часов, – только на 13 %. При начале ТЛТ через 13–24 часа после начала ИМ она практически не влияла на смертность (FTT Collaborative Group 1994 г.). По расчетам Weaver W. (1995 г.), ТЛТ, начатая в 1 час после возникновения ангинозного приступа, примерно в 40 % случаев останавливает развитие ИМ, т. е. формирование необратимых изменений структуры и функций левого желудочка [2]. Однако большая часть больных ИМ по различным причинам не получает ТЛТ. Даже в США частота проведения тромболизиса составляет лишь 25–35 % [3].
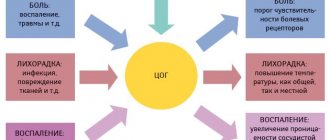
По современным представлениям первопричиной ишемического повреждения сердечной мышцы при ИМ является более или менее быстрое уменьшение доставки кислорода к миокарду вследствие полной или частичной окклюзии крупной коронарной артерии. В большинстве случаев окклюзия так называемой инфарктсвязанной коронарной артерии обусловлена образованием пристеночного тромба в месте атеросклеротической бляшки, в фиброзной капсуле которой возникли трещины и разрывы. Растворение внутрисосудистых тромбов происходит под действием плазмина. Этот трипсиноподобный фермент катализирует лизис фибрина с образованием растворимых продуктов, что приводит к восстановлению кровотока. Плазмин – основное звено фибринолитической системы – образуется в результате активации его предшественника – плазминогена – под действием активаторов.
Аналогично системе свертывания, различают два пути активации плазминогена – внутренний и внешний. Ведущий внутренний механизм запускается теми же факторами, которые инициируют свертывание крови, а именно фактором XIIa, который, взаимодействуя с прекалликреином и высокомолекулярным кининогеном плазмы, активирует плазминоген [4]. Этот путь фибринолиза – базисный, обеспечивающий активацию плазминовой системы не вслед за свертыванием крови, а одновременно с ним. Он работает по “замкнутому циклу”, так как образующиеся первые порции калликреина и плазмина подвергают протеолизу фактор XII, отщепляя фрагменты, под влиянием которых нарастает трансформация прекалликреина в калликреин.
Заслуживает внимания то обстоятельство, что если в свертывании крови компоненты калликреин-кининовой системы выполняют вспомогательную функцию, то в гуморальном механизме фибринолиза это один из ведущих механизмов. Активация по внешнему пути осуществляется за счет тканевого активатора плазминогена (tРА), который синтезируется в клетках эндотелия, выстилающего сосуды. Секреция tРА из клеток эндотелия осуществляется постоянно и усиливается под влиянием разных стимулов: тромбина, ряда гормонов и лекарственных препаратов (адреналин, вазопрессин и его аналоги, никотиновая кислота), стресса, шока, тканевой гипоксии, хирургической травмы. Плазминоген и tРА обладают выраженным сродством к фибрину. При появлении фибрина плазминоген и его активатор связываются с ним с образованием тройного комплекса (фибрин-плазминоген-tРА), все составляющие которого расположены таким образом, что происходит эффективная активация плазминогена. В результате плазмин образуется прямо на поверхности фибрина; последний далее подвергается протеолитической деградации.
Вторым природным активатором плазминогена является активатор урокиназного типа, синтезируемый почечным эпителием, который в отличие от тканевого активатора не имеет сродства к фибрину. Активация плазминогена при этом происходит на специфических рецепторах поверхности клеток эндотелия и ряда форменных элементов крови, непосредственно участвующих в образовании тромба. В норме уровень урокиназы в плазме в несколько раз выше уровня tРА; имеются сообщения о важной роли урокиназного активатора в заживлении поврежденного эндотелия [5].
Образующийся под действием активаторов плазминогена плазмин – активный короткоживущий фермент (время полужизни в кровотоке – 0,1 с.); он приводит к протеолизу не только фибрина, но и фибриногена, факторов свертывания V, VIII и других белков плазмы.
Контролируют действие плазмина несколько ингибиторов, основным из которых является быстродействующий a2-антиплазмин, синтезируемый в печени. Он образует неактивный комплекс со свободным плазмином, попавшим в циркуляцию. Плазмин, образованный на фибрине или на поверхности клеток, защищен от действия a2-антиплазмина. Из других ингибиторов фибринолиза, обладающих значительно более слабым действием, заслуживает упоминания a2-макроглобулин и ингибитор С1-эстеразы. Последний ингибирует фактор XIIа, калликреин и отчасти плазмин, т. е. специфически блокирует внутренний фибринолиз.
Вторым механизмом ограничения фибринолиза является ингибиция активаторов плазминогена. Наиболее физиологически значимым считается ингибитор активатора плазминогена эндотелиального типа (РАI-1). Он инактивирует как тканевой, как и урокиназный типы активаторов, синтезируется в клетках эндотелия, тромбоцитах и моноцитах. Его секреция усиливается под влиянием тканевого активатора плазмингена, тромбина, цитокинов – медиаторов воспаления, бактериальных эндотоксинов. Помимо ферментной фибринолитической системы в организме существует система неферментативного фибринолиза, который осуществляется комплексными соединениями гепарина с гормонами и компонентами свертывающей системы (особенно активен комплекс гепарин-антитромбин III – адреналин). Неферментативный фибринолиз особенно важен для поддержания жидкого состояния крови и предупреждения тромбообразования при стрессовых ситуациях, поскольку он трансформирует адреналин из фактора риска в компонент противосвертывающей системы. Неферментативный фибринолиз не ингибируется антиплазминами, в связи с чем он функционирует в физиологических условиях, уравновешивая субклинические сдвиги в системе гемостаза.
Фармакологическое растворение сгустков крови может быть выполнено с помощью внутривенной или внутриартериальной инфузии активаторов плазминогена [6], среди которых в настоящее время выделяют 5 поколений. Они существенно различаются между собой по составу и происхождению, однако их активирующее действие обусловлено протеолизом одной и той же пептидной связи плазминогена. При одинаковом для всех активаторов плазминогена каталитическом принципе действия разные их виды значительно различаются по сорбционной способности, определяющей распознавание и связывание активатора с зоной тромботического поражения.
К 1 и 2 поколению относят природные активаторы плазминогена. Урокиназа и стрептокиназа – представители I поколения – не имеют заметного сродства к фибрину и приводят к интенсивной системной активации плазминогена, в отличие от tРА и проурокиназы (II поколение), обладающих выраженным сродством к фибрину и активирующих плазминоген только на поверхности сгустка.
С развитием технологии рекомбинантных ДНК и совершенствованием методов химического синтеза биомакромолекул было получено большое число новых производных, отличающихся от природных форм активаторов плазминогена и причисленных к 3 поколению. Модифицированная урокиназа-фибриноген обладает более выраженным тромболитическим эффектом, чем урокиназа, характеризуется пролонгированным пребыванием в кровотоке и слабым влиянием на системную активацию фибринолиза. Ретеплаза, ланотеплаза и Е6010 – мутантные формы tРА – имеют пролонгированное действие в кровотоке и повышенное тромболитическое действие при меньшем истощении гемостатических белков крови. Саруплаза – мутантная форма проурокиназы с повышенной каталитической активностью.
Химерные формы активаторов плазминогена получены методом генной инженерии. Принцип конструирования таких производных состоит в соединении каталитической части активаторов плазминогена, обеспечивающей образование плазмина, с распознающими зону тромбоза фрагментами молекул других белков, способствующими связыванию и накоплению такого агента в зоне тромбоза. Первый тип химерных молекул состоит из фрагментов моноклональных антител против фибрина и проурокиназы низкой молекулярной массы. Активация урокиназного активатора осуществляется в этой биомолекуле тромбином, что делает такую химерную форму специфичной к свежим тромбам.
Производные 2 типа химерных активаторов представляют собой фрагменты моноклональных антител против фибрина, связанные с тканевым активатором плазминогена. На модели тромбоза у обезьян этот химерный белок вызывал более эффективный тромболизис по сравнению с тканевым активатором плазминогена и проурокиназой.
Химерные производные 3 типа состоят из частей tРА и каталитической части урокиназы. Эта форма осуществляет эффективный тромболизис в меньших дозах, чем природные активаторы.
В химерных производных 4 типа используют в качестве распознающей части Р-селектин и аннексин V. Р-селектин – белок, синтезируемый эндотелием и тромбоцитами, обеспечивает адгезию тромбоцитов, ускоряя тромбообразование. Аннексин V нацеливает активатор плазминогена на тромб благодаря его способности прочно связываться с мембранами активированных тромбоцитов. В качестве каталитической части используют фрагменты tРА и проурокиназы. Эти химеры практически не ингибируются РАI-1.
Появление большого количества химерных форм ставит вопрос о реальности их применения. Сдерживающим фактором в этом направлении может быть высокая стоимость их производства и необходимость тщательной иммунологической оценки химер как принципиально новых биологических молекул.
Активаторы плазминогена 4 поколения получены с помощью комбинации приемов биологического и химического синтеза. Тромболитические композиции, относимые к 5 поколению, предполагают комбинированное введение разных активаторов плазминогена с комплементарным механизмом действия и фармакокинетически различным профилем, что достоверно способствует достижению эффективного тромболизиса in vitro. Например, применение tРА как триггера тромболизиса и ковалентного конъюгата урокиназа-фибриноген как средства, поддерживающего тромболитическое действие, которым он обладает благодаря пролонгированному пребыванию в кровотоке, обеспечивает на модели венозного тромбоза у собак быстрый и значимый тромболитический эффект при умеренном истощении содержания гемостатических белков крови [7]. Названная композиция состоит из невысоких доз указанных компонентов, которые в 4–20 раз меньше применяемых для монотерапии. Такое уменьшение доз может существенно снизить стоимость ТЛТ, лимитирующую ее широкое использование.
Как известно, tPA синтезируется эндотелиальными клетками кровеносных сосудов. Он также обнаружен в различных тканях, включая матку, яичники, легкие, простату, мышечную ткань, селезенку, печень. Впервые в изолированном и очищенном состоянии он был получен в начале 1980-х гг. Сегодня наиболее широко применяется tРА, синтезированный ДНК-рекомбинантным методом (rtPA). Такой препарат на 99 % очищен и представляет собой одно- и двухцепочечные белковые молекулы, причем при наличии двух цепей они связаны между собой дисульфидными связями, а одноцепочечные соединения образуются из последних путем частичного ферментативного расщепления. В литературе как отечественной, так и зарубежной препарат, полученный ДНК-рекомбинантным методом и представляющий собой одноцепочечный тканевой активатор плазминогена, наиболее часто обозначается как “алтеплаза” и t-PA. В настоящее время в России имеется алтеплаза под патентованным названием Актилизе (actilyse).
Все тромболитические препараты, как белковые соединения с коротким периодом полувыведения, вводят внутривенно или реже – внутрикоронарно. При в/в введении алтеплаза относительно неактивна в крови, быстро распределяется с T1/2 в a-фазе, равным 4–5 минутам, т. е. через 20 минут в плазме сохраняется менее 10 % первоначального количества препарата. T1/2 в b-фазе оставшегося в депо количества – 40 минут. Алтеплаза активируется при связывании с фибрином и индуцирует превращение плазминогена в плазмин, который и расщепляет фибриновый сгусток. Действие препарата специфично в отношении тромба, так как в обычных условиях (т. е. без образования тромба) циркулирующий плазмин активируется медленно и почти полностью нейтрализуется циркулирующими в крови антиплазминами.
Метаболизируется алтеплаза главным образом в печени (Cl плазмы – 380–570 мл/мин) путем гидролиза, а затем 80 % препарата экскретируется с мочой в виде метаболитов [10, 11]. Соответственно клиренс препарата ухудшается при нарушении функции печени, но не изменяется при почечной недостаточности.
Доказано, что основными факторами, определяющими конечный размер ИМ, являются время до реперфузии миокарда и, в меньшей степени, развитость коллатерального кровотока.
В экспериментальных исследованиях установлено, что в период 40–60 минут после перевязки крупной коронарной артерии у собак повреждается большая часть кардиомиоцитов в субэндокардиальном слое участка миокарда, который располагается в бассейне окклюзированной артерии. При более продолжительной ишемии необратимые изменения захватывают всю толщу стенки левого желудочка, достигая в течение 3–6 часов ее субэпикардиального слоя. В первые 4 часа после окклюзии коронарной артерии в зоне максимальной ишемии некротизируется около 60 % всей массы миокарда, а некроз остальных 40 % наступает в течение последующих 20 часов (Reimer K. и соавт., 1977–79) Это определяет лечебную тактику, цель которой – достижение ранней и стойкой реперфузии окклюзированного сосуда, результатом чего будут сохранение миокарда, уменьшение распространения ИМ и снижение электрической нестабильности миокарда. Восстановление проходимости поврежденного сосуда способствует улучшению остаточной функции левого желудочка, уменьшению осложнений, снижению риска связанных с ИМ заболеваемости и смертности, а также удлинению продолжительности жизни больного после перенесенного ИМ.
Реперфузия может ограничить распространение ИМ несколькими путями. Она уменьшает величину, до которой расширяется зона ИМ и периинфарктная зона. Даже если не уменьшается размер ИМ, сохранение слоя эпикарда может способствовать меньшему растяжению пораженной зоны. Путь заживления инфарцированного миокарда может быть столь же важным, как и первоначальное уменьшение размера ИМ. Поздняя реперфузия ишемизированного участка миокарда также вызывает уменьшение некроза мышечных пучков и сохранение сократительной функции миокарда. Наконец, реперфузия может уменьшить риск электрической нестабильности. Ранняя смерть при ИМ наступает внезапно в результате фибрилляции желудочков. Больные, у которых произошла реперфузия, по данным электрофизиологического исследования, в меньшей степени страдают желудочковыми аритмиями и у них реже наблюдается нарушение поздней реполяризации на ЭКГ [12].
Таким образом, не вызывает сомнения, что основным критерием эффективности ТЛТ является оценка состояния перфузии в пораженной коронарной артерии, которая осуществляется с помощью ангиографии, выполняемой обычно через 60 или 90 минут либо в течение периода до 72 часов после начала инфузии того или другого тромболитического средства.
В настоящее время оценка проходимости коронарной артерии проводится согласно критериям, предложенным в 1985 г. исследовательской группой TIMI (Thrombolysis in Myocardial Infarction), и определяется по степеням (от 0 до 3). Согласно этой классификации, степень проходимости коронарной артерии 0–1 говорит об отсутствии реперфузии коронарной артерии, т. е. о неэффективности тромболитического средства. При достижении степени 2–3 можно говорить о восстановлении проходимости пораженной артерии, а при степени 3 – о полном восстановлении кровотока в пораженной артерии под действием тромболитического средства.
В контролируемом исследовании TIMI 1 (1988) у небольшой группы пациентов (232 чел.) проводилось сравнительное исследование эффективности в/в введения алтеплазы в дозе 80 мг в течение 3 часов и стрептокиназы в период до 7 часов от начала ИМ. В результате, по данным ангиографии, через 90 минут от начала лечения удалось добиться проходимости пораженной артерии (реперфузии) у 62 % пациентов, получавших алтеплазу, по сравнению с 31 % в группе стрептокиназы (p
В ряде других исследований были получены сходные результаты. При введении алтеплазы (n = 85) проходимость инфарктсвязанной артерии была ангиографически подтверждена на 90 минуте от начала введения препарата у 71 % пациентов с острым ИМ, а на 120 минуте – у 85 % [15].
Учитывая полученные результаты, было высказано предположение о целесообразности дальнейшего изучения эффективности алтеплазы, а также предложена новая схема внутривенного введения этого препарата.
В исследовании TIMI-2 (1989) 3262 пациентам алтеплаза вводилась вначале в дозе 150 мг в течение 6 часов, а затем в дозе 100 мг в течение следующих 6 часов. Удалось добиться восстановления кровотока в инфарктсвязанной коронарной артерии у 84,7 % пациентов; однако в этом исследовании была отмечена высокая частота угрожающих жизни кровотечений (1,6 %) из-за применения на начальном этапе лечения больших доз препарата (150 мг) по сравнению с 80 мг в течение 3 часов в TIMI-1 [13, 24].
Neuhaus K. и соавт. (1989) предложили схему “ускоренного” введения алтеплазы: 100 мг в течение 90 минут, причем первые 15 мг вводят в виде болюса, а затем начинают инфузию (50 мг за 30 минут, 35 мг – за остальные 60 минут). Схема ускоренного введения алтеплазы была успешно апробирована в одном из самых крупных исследований по изучению эффективности тромболитической терапии при ИМ (GUSTO-1).
Целью исследований GISSI-2 (1990) и ISIS-3 (1992) было сравнение эффективности алтеплазы и стрептокиназы (GISSI-2) и алтеплазы и анистреплазы со стрептокиназой (ISIS-3). При лечении разными тромболитическими препаратами имела место практически одинаковая летальность. При применении стрептокиназы частота возникновения инсультов по сравнению с таковой при использовании анистреплазы и алтеплазы была намного ниже [16, 17].
В этой связи в 1993 г. было организовано широкомасштабное исследование GUSTO-1, целью которого являлось сравнение эффективности использования алтеплазы по новой ускоренной схеме введения и стрептокиназы, включая и различные варианты сочетания этих препаратов как друг с другом, так и с одновременным в/в или п/к введением гепарина, а также с приемом аспирина.
Результаты исследований (табл. и ) наглядно продемонстрировали значительное повышение частоты реканализации инфарктсвязанной артерии при ускоренном введении алтеплазы в сравнении со стрептокиназой в наиболее значимом временном интервале – 90 минут (81,3 и 59 % соответственно). Также было отмечено, что к 180 минуте от начала введения этих препаратов их эффективность становится практически идентичной (76,3 и 72,4 % соответственно). Тем не менее было выявлено значительное снижение смертности среди пациентов, получавших алтеплазу (совокупно на 14 %), при незначительном увеличении в этой группе риска развития внутричерепного кровоизлияния (0,7 против 0,6 % при введении стрептокиназы) [18–20].
В других контролируемых исследованиях в/в введение алтеплазы оказывало у больных ИМ такой же эффект, как и внутрикоронарное введение стрептокиназы. У больных ИМ в случаях раннего (в течение 2,5 часов от начала заболевания) применения алтеплазы функция левого желудочка улучшалась к 21 дню [21]. При введении алтеплазы в течение первых пяти часов от начала заболевания было отмечено повышение выживаемости больных к 30 дню заболевания и увеличение фракции выброса левого желудочка на 10–22 день после развития ИМ [22]. При этом реже возникали такие осложнения, как кардиогенный шок, фибрилляция желудочков и перикардиты. Препарат по сравнению со стрептокиназой относительно редко вызывал гипотонию. Реокклюзия пораженного сосуда у больных ИМ после в/в введения алтеплазы отмечалась менее чем в 10 % случаев (Verstraete M. и соавт.,1987) [23, 24].
С 1994 по 1996 г. в 1474 больницах США лечение алтеплазой получили 71 253 госпитализированных больных острым ИМ. Из их числа терапию в сроки до 2 часов от начала заболевания проводили у 39 % пациентов, с 2,1 до 4 часов – у 36 %, с 4,1 до 6 часов – у 12 % и позднее – у 13 %. Внутрибольничная летальность и частота развития стойких желудочковых аритмий прогрессивно возрастали по мере задержки начала лечения алтеплазой; наименьший риск летального исхода отмечался при самом раннем применении препарата (до 2 часов от начала заболевания). Не было отмечено связи между временем применения алтеплазы и риском развития в течение госпитализации таких осложнений, как повторный ИМ, ишемия миокарда, кардиогенный шок, эпизоды больших кровотечений, инсульт и внутричерепные кровоизлияния [24]. Данные о повышении внутрибольничной летальности у больных острым ИМ при их более позднем поступлении в больницу и задержке начала применения алтеплазы подтвердили результаты, полученные ранее в исследовании GUSTO-1.
Согласно ангиографическим данным, у 886 больных острым ИМ (исследование TIMI 10B, 1999) в/в введение больших (от 0,52 до 1,24 мг/кг) и средних (от 0,4 до 0,51 мг/кг) доз алтеплазы в ускоренном режиме дозирования оказывало лучший эффект в отношении исходов заболевания, чем лечение малыми дозами препарата (от 0,2 до 0,39 мг/кг) [26–28].
Современная схема применения алтеплазы (Актилизе) при остром ИМ выглядит следующим образом:
- режим 90-минутного (ускоренного) введения показан пациентам со сроком заболевания, не превышающим 6 часов, и последовательно включает: 15 мг в виде в/в болюса, 50 мг в виде в/в инфузии в первые 30 минут, 35 мг в виде в/в инфузии в следующие 60 минут (общая доза 100 мг);
- режим 3-часового введения показан больным с 6–12-часовым сроком заболевания и последовательно включает: 10 мг в виде в/в болюса, 50 мг в виде в/в инфузии за первый час, затем по 10 мг за каждые 30 минут до общей дозы 100 мг.
Максимально допустимая доза Актилизе составляет 100 мг.
Вспомогательную терапию аспирином и гепарином при остром ИМ рекомендуется назначать как можно раньше перед введением Актилизе.
Противопоказаниями к применению Актилизе, также как и других тромболитиков, являются геморрагические синдромы, манифестирующее или недавнее массивное внутреннее кровотечение, кровоизлияние в мозг. Препарат также не следует применять в течение 2 месяцев после операции на головном или спинном мозге, при тяжелой неконтролируемой артериальной гипертензии, бактериальном эндокардите, остром панкреатите.
Вследствие фибринолитических свойств Актилизе может возникать кровотечение, обычно ограниченное местом инъекции. В таких случаях нет необходимости прерывать лечение. Однако при угрозе возникновения опасного для жизни кровотечения ТЛТ следует прервать. Благодаря короткому периоду полувыведения Актилизе и минимальному влиянию препарата на свертывающую систему крови, восполнение факторов свертывания обычно не требуется [29, 30].
Фармакоэкономические аспекты применения алтеплазы. Не секрет, что основной причиной гораздо более широкого применения в нашей стране стрептокиназы, нежели алтеплазы, является более высокая стоимость последней. Действительно, при подсчете прямые экономические затраты при использовании схемы ТЛТ, включающей алтеплазу, будут заведомо выше, чем при применении схемы со стрептокиназой. Однако полный анализ эффективности лекарственной терапии с использованием фармакоэкономических методов, включающих учет косвенных затрат, показал явные экономические преимущества применения алтеплазы перед стрептокиназой.
Фармакоэкономический анализ, проведенный по результатам исследования GUSTO-1, показал следующее. За год наблюдений затраты на одного пациента из группы получавших алтеплазу в среднем оказались на 2845 долл. США выше, чем при использовании стрептокиназы. Однако показатель смертности за первый год в группе пациентов, лечившихся алтеплазой, был на 1,1 % (на 11 на 1000) ниже, чем в группе больных, получавших стрептокиназу. Использование этих данных при дальнейших расчетах показало, что применение алтеплазы позволило сэкономить 32 678 долл. на каждый сохраненный год жизни пациента [31].
Cходные данные, отражающие экономические преимущества применения алтеплазы в качестве тромболитического средства, были получены в ряде других зарубежных исследований, проводившихся с использованием различных методов фармакоэкономического анализа [32–34].
К сожалению, особенностью всех этих исследований является невозможность прямого приложения зарубежных данных к условиям отечественного здравоохранения, так как структура прямых и косвенных затрат в России существенно отличается от таковой в других странах [35]. В этой связи не вызывает сомнений необходимость дальнейшей разработки методологических основ стандартизации результатов фармакоэкономических исследований в условиях России. В свете вышеизложенного весьма актуальным представляется проведение фармакоэкономического исследования алтеплазы в российских условиях, результаты которого могут стать дополнительным и весьма веским аргументом в пользу более широкого, нежели сегодня, использования этого препарата.
В какой дозе применять Алтеплазу при остром ишемическом инсульте?
Предполагают, что тромболитическая терапия с применением ниже, чем стандартной дозы внутривенной алтеплазы может быть эффективной приснижении риска внутримозговых кровотечений.
Материалы и методы
В исследование ENCHANTED были рандомизированы 3310 пациентов(средний возраст 67 лет, 63% жители Азии) с острым ишемическим инсультом. Онибыли разделены на 2 группы: в первой применяли алтеплазу в низкой дозе 0.6мг/кг, во второй – в стандартной дозе 0.9 мг/кг в течение первых 4,5 ч после появления симптомов.
Первичной целью исследования являлась оценка того, что низкая доза алтеплазы не уступает стандартной дозе по частоте смерти и инвалидизации на 90 день (сумма баллов по шкале Рэнкина от 2 до 6 баллов (0 –отсутствие симптомов, 6 — смерть).
Вторичными целями исследования было определить насколько реже на фоне применения низкой дозы алтеплазы возникают внутримозговые кровотечения, а также оценить отвечает ли низкая доза препарата критерию noninferiorityпо модифицированной шкале Рэнкина.
Результаты
Первичной конечной точки исследования достигли 855 пациентов из 1607 (53.2%) из группы низкой дозы алтеплазы и 817 из 1599 (51.1%) на фоне стандартной дозы препарата (OR, 1.09; 95% CI, 0.95-1.25; верхняя граница превысила порог noninferiority в 1.14).
При этом низкая доза алтеплазы отвечала критерию noninferiorityпри анализе суммы балов по модифицированной шкале Рэнкина (OR, 1.00; 95% CI,0.89-1.13; Р=0.04 для порога noninferiority).
Серьезные внутримозговые кровотечения имели место у 1%больных, получавших низкую дозу тромболитика, и у 2,1% пациентов на фоневведения стандартной дозы алтеплазы (P=0.01); фатальные события в течение 7 дней произошли у 0.5% и 1.5%, соответственно (P=0.01). Смертность на 90 день исследования достоверно не различалась между двумя группами (8.5% и 10.3%, соответственно; P=0.07).
Заключение
Согласно результатам исследования, низкая доза алтеплазы недостигла порога non inferiority по показателям смертности и и нвалидизации на 90день.
На фоне низкой дозы алтеплазы было зафиксировано значительно меньше симптомных внутримозговых кровотечений.
Источник:
Craig S. Anderson, Thompson Robinson, Richard I.Lindley, Hisatomi Arima, Pablo M. Lavados, Tsong-Hai Lee, Joseph P. Broderick,et al. Low-Dose versus Standard-Dose Intravenous Alteplase in Acute IschemicStroke. N Engl J Med 2016; 374:2313-2323.