Несмотря на большое количество исследований, посвященных вопросам лечения полипозного риносинусита (ПРС), одним из самых сложных и спорных вопросов этой проблемы остается поиск наиболее эффективных методов устранения назальной обструкции, позволяющих максимально длительно сохранить адекватность носового дыхания, вследствие нарушения которого в организме человека развивается как органная, так и тканевая гипоксия.
Опыт показывает, что хирургическое лечение полипоза является симптоматическим, стандартно устраняя «конечный» результат патологического процесса — нарушение носового дыхания, не прерывает развитие полипоза, а следовательно практически не влияет на продолжительность ремиссии. Число послеоперационных рецидивов остается высоким и нередко достигает 40—50% с частотой рецидивирования 2—3 и более раз в год [1—3].
Медикаментозное лечение ПРС в отличие от хирургического носит патогенетический характер, так как при этом имеет место возможность воздействовать на различные звенья развития заболевания [4—7].
Исследованиями последних десятилетий установлено, что при формировании полипозного процесса немаловажную роль играют аллергия и воспаление, при которых происходят синтез и высвобождение целого ряда медиаторов, включая лейкотриены, характерные для поздней (хронической) фазы аллергического воспаления. Лейкотриены опосредуют свое действие через рецепторы на поверхности клеток респираторного эпителия и являются идеальной мишенью для терапевтической блокады аллергической реакции со стороны как верхних, так и нижних дыхательных путей. Именно это звено патогенеза полипоза остается малоизученным и почти недоступным для медикаментозного воздействия [8, 9].
Современная концепция «единых дыхательных путей», согласно которой ПРС рассматривается как одна из составляющих системной патологии дыхательного тракта, послужила основанием для использования при ПРС антилейкотриеновых препаратов, созданных и рекомендованных для лечения и профилактики бронхиальной астмы, аллергического ринита и астматической триады [10—13].
Сведения литературы о терапевтической значимости блокатора лейкотриеновых рецепторов при назальной обструкции у больных ПРС немногочисленны, базируются на небольшом числе наблюдений и весьма противоречивы. Оценка же эффективности антагониста лейкотриеновых рецепторов, как правило, не лишена субъективизма.
Цель — клинико-лабораторное и морфологическое обоснование возможности и эффективности персонифицированной фармакологической коррекции назальной обструкции у больных с ПРС.
Пациенты и методы
В соответствии с поставленной целью на основании эндоскопических, клинико-лабораторных и морфологических показателей изучена эффективность фармакологического контроля назальной обструкции с помощью блокатора лейкотриеновых рецепторов у 87 больных с ПРС, в возрасте от 22 до 76 лет, основной жалобой которых было нарушение носового дыхания.
Из исследования были исключены пациенты с хроническими гнойно-полипозными формами синусита как риногенного, так и одонтогенного происхождения.
Возраст 53% больных не превышал 50 лет. Женщин было несколько больше — 54%, мужчин — 46%.
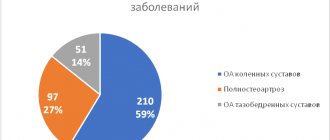
У 65,5% пациентов был диагностирован первичный полипоз, у 34,5% — рецидивирующий, с частотой рецидивирования 3 и более раз в год.
Среди исследуемых 25,3% страдали бронхиальной астмой и получали лечение в соответствии с федеральными клиническими рекомендациями по диагностике и лечению данной патологии без применения превентивной терапии антагонистами лейкотриеновых рецепторов. Остальным был поставлен диагноз: аллергический ринит.
Неоднократно были оперированы по поводу ПРС 34,5% больных.
Контрольную группу составили 20 практически здоровых людей в возрасте 21—26 лет без нарушения носового дыхания и признаков аллергии.
Для объективной оценки и систематизации риноскопических данных была использована классификация И.Б. Солдатова и соавт. [14], в которой распространенность полипозного процесса имеет 4 стадии. Согласно этой классификации, у подавляющего большинства больных (70,1%) объем полипозной ткани в полости носа соответствовал III—IV стадии.
Характеризуя распространенность полипоза в околоносовых пазухах по классификации С.З. Пискунова и Г.З. Пискунова [15], в которой авторы также выделяют 4 стадии, мы установили, что у 75,8% больных распространенность полипоза в околоносовых пазухах по данным компьютерной томографии (КТ) соответствовала I—II стадии, т. е. не коррелировала с данными эндоскопии и существенно не влияла на носовое дыхание.
Объективная оценка назальной обструкции и процессов, происходящих в организме больных с ПРС, осуществлялась на основании данных передней активной риноманометрии, кислотно-щелочного состояния крови и динамики концентрации в сыворотке крови лейкотриена С4 (LTС4). LTС4 вызывает отек дыхательных путей, слизеобразование и не влияет непосредственно на бронхоконстрикцию, а принимает участие в воспалении, сосудистой проницаемости и развитии тканевого фиброза, что составляет морфологическую основу полипоза.
Именно эти свойства данного медиатора определили выбор LTС4 в качестве маркера аллергического воспаления и эффективности антогониста лейкотриеновых рецепторов при лечении назальной обструкции у больных ПРС.
Объективная оценка динамики носового дыхания производилась с помощью серийного прессотахоспирографа ПТС-14П-01 отечественного производства.
Нормативные значения суммарного потока вдыхаемого воздуха по данным контрольной группы составили 700 мл/с, суммарного сопротивления — 0,14 Па/см3/с.
Для характеристики уровня гипоксии исследовали парциальное давление кислорода (рО2) и углекислого газа (рСО2) в крови на автоматическом анализаторе газов, электролитов и параметров КО-оксометрии картриджного типа PapidLab 1200.
Нормативное значение напряжения СО2 крови по данным контрольной группы составило 38,5 ммоль/л, нормативное значение напряжения О2 — 39 ммоль/л.
Для объективной оценки динамики аллергического воспаления у больных ПРС определяли концентрацию LTС4 в сыворотке крови ИФА-методом в биологических жидкостях, кат. № 406410, версия Д 406410−09/17−07.
Для анализа данных применяли статистический пакет Statistica 10 . Использовались методы описательной статистики для определения средних значений, моды, стандартного отклонения, асимметрии, эксцесса и коэффициента вариации.
Для оценки значимости различий между средними выборочными значениями с учетом объема выборок и характера их распределения были использованы непараметрические методы: критерии Вилкоксона—Манна—Уитни, Крускала—Уоллиса и критерий χ2 Пирсона как методы, наиболее адекватные с математической точки зрения [16].
В качестве критериальной статистики использовалась верхняя область 5% распределений Вилкоксона, Крускала—Уоллиса и χ2 как более жесткая по сравнению с t
-распределением для обеспечения большей точности оценок.
Несмотря на обилие научных работ, посвященных роли лейкотриенов в развитии многих заболеваний (бронхиальная астма, аллергический ринит, атопический дерматит, неспецифический язвенный колит и др.), в доступной нам литературе мы не встретили сообщений о количественных показателях концентрации лейкотриенов в сыворотке крови ни в норме, ни при патологии. Отсутствие таких данных свидетельствует о том, что эти заболевания, по мнению Л.А. Горячкиной и соавт. [17], не являются статическими состояниями. В связи с этим для определения «точки сравнения» в нашем исследовании использовано среднее значение концентрации лейкотриена С4 у 20 практически здоровых людей без признаков аллергии и нарушения носового дыхания (контрольная группа).
Аспириновая бронхиальная астма и антагонисты лейкотриенов
Бронхиальная астма
(БА) — хроническое воспалительное заболевание дыхательных путей , в котором принимают участие многие клетки: тучные, эозинофилы, Т-лимфоциты. У предрасположенных лиц это воспаление приводит к повторяющимся эпизодам хрипов, одышки, тяжести в грудной клетке и кашлю, особенно ночью и/или ранним утром. Эти симптомы обычно сопровождаются распространенной, но вариабельной обструкцией бронхиального дерева, которая частично или полностью обратима спонтанно или под влиянием лечения.
Термин “аспириновая астма
” (
АА
) используется для обозначения клинико-патогенетического варианта, когда одним из бронхоконстрикторных факторов у больного являются
нестероидные противовоспалительные препараты (НПВП)
, в том числе и ацетилсалициловая кислота. Аспириновая астма, как правило, складывается из триады симптомов: полипозный риносинусит, приступы удушья и непереносимость НПВП. Нередко аспириновая астма сочетается с атопической, однако она может наблюдаться и как изолированная форма заболевания.
Эпидемиология
Нет убедительных данных о наследственной предрасположенности к АА. Однако исследования в этой области проводятся, т.к. имеются данные о нескольких семьях с сочетанием БА и непереносимости аспирина. АА возникает в возрасте от 30 до 50 лет, чаще болеют женщины. Частота встречаемости среди всех больных БА – 9-22%, по последним данным – до 40%.
История вопроса
Аспирин внедрен в клиническую практику в 1899 году как анальгетик и жаропонижающий препарат, и уже в 1903 году Franke (Германия) описал у себя аллергическую реакцию в виде ларингоспазма и шока на прием аспирина. В 1905 году Barnett сообщил о 2 случаях затрудненного дыхания на прием аспирина. В 1919 году Francis выявил зависимость между полипозным ринитом и гиперчувствительностью к аспирину. В 1922 году Widal впервые установил зависимость между непереносимостью аспирина, полипозным ринитом и бронхиальной астмой. В 1968 году Samter и Beers снова описали этот симптомокомплекс, который назвали “аспириновой триадой”. С этого времени узнали много нового об эпидемиологии, клинических проявлениях и патофизиологии непереносимости аспирина и других НПВП у больных БА. Ключевым является вопрос: почему только у части больных БА наблюдается непереносимость НПВП? Открытие цистенил-лейкотриенов и их участие в патогенезе бронхиальной астмы во многом объясняет патогенез аспириновой триады.
Клиническая картина
Аспириновая БА часто характеризуется тяжелым упорным течением. Больные с АА довольно часто попадают в реанимационные отделения, по данным ряда авторов, чаще, чем больные другими клинико-патогенетическими вариантами бронхиальной астмы. Особо следует отметить течение риносинусита у больных АА. Наиболее часто АА дебютирует с длительного ринита, который у 20-25% больных постепенно переходит в полипозную риносинусопатию. Проявления аспириновой риносинусопатии:
ринорея, заложенность носа, отсутствие восприятия запахов, боли в проекции придаточных пазух носа, головные боли. Около половины больных полипозным риносинуситом со временем начинают реагировать удушьем на прием НПВП. Нередко первые приступы удушья у данной категории больных возникают после хирургических вмешательств, например, полипэктомий, радикальных операций на придаточных пазухах носа и т.д. В отдельных случаях полипозом поражаются и другие слизистые – желудка, мочеполовой системы. Иногда первому приступу удушья предшествуют годы непрерывно рецидивирующего хронического ринита, при котором не удается обнаружить экзоаллергены. Как правило, назальные симптомы протекают тяжело и плохо поддаются терапии. Обычно используются топические, а иногда и системные глюкокортикостероиды. Но терапия ими часто бывает недостаточно эффективной, и больным регулярно проводится хирургическое лечение.
Больные АА не переносят аспирин и другие НПВП. Эта непереносимость проявляется в виде покраснения лица, приступов удушья, кашля, ринита и конъюнктивита, уртикарных высыпаний, отека Квинке, подъема температуры, диареи, боли в животе, сопровождающейся тошнотой и рвотой. Наиболее тяжелыми проявлениями реакции на аспирин и другие НПВП является астматический статус, остановка дыхания, потеря сознания и шок. Следует отметить, что переносимость различных НПВП различна, что зависит от антициклооксигеназной активности препарата и его дозы, а также от чувствительности больного. К препаратам с высокой циклооксигеназной активностью относятся салицилаты (ацетилсалициловая кислота – аспирин, салициловая кислота), полициклические кислоты (индометацин, толметин), ненасыщенные жирные кислоты (диклофенак, ибупрофен, кетопрофен, тиапрофеновая кислота), эноловые кислоты (пироксикам).
Особый интерес представляет широко применяемый в клинической практике болеутоляющий и жаропонижающий препарат парацетамол
. Еще в 1919 году Francis отметил, что фенацетин не вызывает побочных реакций у лиц с непереносимостью аспирина. По механизму действия фенацетин сходен с парацетамолом, однако в настоящее время фенацетин применяют в клинической практике крайне редко в связи с выраженными побочными эффектами. Парацетамол — анальгетик и антипиретик, обладающий жаропонижающим, аналгезирующим и слабым противовоспалительным действием. Парацетамол хорошо переносится и не вызывает бронхоспастических реакций. Однако, начиная терапию парацетамолом у больных АА, следует назначать не более 500 мг и наблюдать за больным в течение 2-3 часов, так как у 5% больных этот препарат может вызвать приступ удушья.
Патогенез
Клетки, участвующие в воспалении в дыхательных путях, вырабатывают различные медиаторы, которые оказывают непосредственное воздействие на гладкие мышцы бронхов, сосуды и секретирующие слизь клетки, а также посылают сигналы другим клеткам, тем самым привлекая и активируя их. Среди различных медиаторов, вызывающих сокращение гладких мышц бронхов, наиболее важное значение имеют цистеиновые лейкотриены
. Эти вещества могут также вызывать отек и гиперреактивность бронхов, изменять секрецию слизи.
Так называемая медленнореагирующая субстанция анафилаксии (МРС-А) была открыта Felberg и Kellaway в 1938 году, когда эти исследователи ввели яд кобры в легкие морских свинок и показали, что при этом наблюдается спазм бронхов, не связанный с действием гистамина, который возникал медленнее и продолжался более длительно. Хотя еще в 1960-х годах Brockehurst и др. сделали вывод о том, что вещество МРС-А является исключительно важным медиатором аллергии, Samuelsson и его коллегам, установившим структуру МРС-А, пришлось дожидаться появления более качественных аналитических методов для ее расшифровки. После того как выяснилось, что на самом деле МРС-А является лейкотриенами, были предприняты значительные исследовательские усилия для понимания биологических свойств лейкотриенов и разработки лекарственных препаратов, являющихся их антагонистами или ингибиторами синтеза.
Биохимия лейкотриенов
Лейкотриены (ЛТ) синтезируются из арахидоновой кислоты, которая высвобождается при иммунологической или неиммунологической стимуляции различных клеток, участвующих в воспалении. Арахидоновая кислота может подвергаться дальнейшим метаболическим превращениям как с помощью циклооксигеназной системы с образованием простагландинов и тромбоксанов, так и с помощью системы ферментов 5-липоксигеназы с образованием лейкотриенов (рис. 1). Для функционирования 5-липоксигеназы требуется связанный с мембраной белок, называемый 5-липоксигеназ-активирующим белком. Он, по-видимому, является контактным белком для арахидоновой кислоты. Как только 5-липоксигеназа превратит арахидоновую кислоту в лейкотриены, она разрушается и инактивируется. Естественным промежуточным продуктом в ходе функционирования ферментной системы 5-липоксигеназы является лейкотриен А4 (ЛТА4) — нестабильный эпоксид, который затем, соединяясь с водой, может превращаться неэнзиматическим путем в дигидроксикислый лейкотриен В4 (ЛТВ4) или, соединяясь с глутатионом, — в цистеиновый лейкотриен С4 (ЛТС4). ЛТС4 далее с помощью g-глютамилтрансферазы превращается в ЛТD4 и затем с помощью дипептидаз – в ЛТЕ4, который подвергается дальнейшему метаболизму. У человека небольшая, но постоянная часть ЛТЕ4 экскретируется в неизмененном виде с мочой, благодаря чему возможно контролировать выработку лейкотриенов при БА и других заболеваниях.
Разные клетки синтезируют ЛТВ4 и цистеиновые лейкотриены в различных соотношениях. Синтезировать ЛТС4 способны эозинофилы, базофилы, тучные клетки и альвеолярные макрофаги. Нейтрофилы синтезируют преимущественно ЛТВ4.
Биологические свойства лейкотриенов
Рецепторы для ЛТВ4 и для цистеиновых лейкотриенов различны. Главные действия ЛТВ4, по видимому, состоят в привлечении и активации клеток, участвующих в воспалении, в первую очередь нейтрофилов и эозинофилов. ЛТВ4, как считается, играет важную роль в развитии гнойного воспаления, ревматоидного артрита и других воспалительных заболеваний. Однако его роль в патогенезе бронхиальной астмы вызывает сомнения и остается неясной. Показано, что при БА антагонисты рецепторов к ЛТВ4 не оказывают влияния на раннюю и отсроченную фазы реакции на провокацию антигеном.
Подчеркивая роль цистенил-лейкотриенов в патогенезе АА, следует отметить повышенное содержание лейкотриенов Е4 (приблизительно в 3–6 раз) в моче и С4 в назальном секрете в сравнении с другими вариантами бронхиальной астмы. Провокация аспирином резко повышает количество лейкотриенов Е4 и С4 в моче, назальном секрете и бронхиальном лаваже.
Большой интерес представляет также тромбоцитарная теория
развития АА. Было обнаружено, что тромбоциты больных АА в отличие от тромбоцитов здоровых лиц активируются
in vitro
под действием НПВП, что проявляется дегрануляцией клеток с выбросом цитотоксических и провоспалительных медиаторов. Другие же клетки периферической крови не активируются под действием НПВП
in vitro
. Как известно, вызванная НПВП блокада циклооксигеназы приводит к угнетению продукции простагландина Н2. Авторы тромбоцитарной теории предполагают, что снижение уровня данного простагландина играет важную роль в активации тромбоцитов у больных АА.
В подавляющем большинстве работ не было выявлено участия реагинового механизма в развитии аспиринового удушья. Имеются лишь единичные сообщения об обнаружении специфических иммуноглобулинов Е к дериватам аспирина.
Диагностика
Важное значение в постановке диагноза аспириновой бронхиальной астмы имеют данные анамнеза
о реакции больного на прием обезболивающих или жаропонижающих препаратов. У части пациентов могут быть четкие указания на развитие приступа удушья после применения НПВП. Отсутствие у ряда больных АА указаний на непереносимость НПВП, как правило, обусловлено следующими причинами: относительно низкой степенью гиперчувствительности к препаратам с антициклооксигеназным действием; одновременным приемом медикаментов нейтрализующих бронхоконстрикторное действие НПВП (например, антигистаминных, теофиллинов, симпатомиметиков), замедленной реакцией больного на НПВП; редким приемом НПВП. Приступы удушья у больных АА, не принимающих НПВП, могут быть связаны с употреблением в пищу природных салицилатов, а также консервированных с помощью салицилатов продуктов. Следует отметить, что значительная часть больных не осведомлена о том, что различные НПВП входят в состав таких часто используемых комбинированных препаратов, как цитрамон, пенталгин, седалгин, баралгин и др.
Важно задать больному БА вопрос об эффективности применения теофедрина для купирования приступа удушья. Больные с АА обычно указывают на неэффективность теофедрина, либо отмечают его двухстадийное действие: вначале бронхоспазм несколько уменьшается, а затем вновь нарастает из-за присутствия в теофедрине амидопирина и фенацетина.
Интенсивность реакции на НПВП зависит от степени чувствительности больного к препарату, также она тесно коррелирует с антициклооксигеназной активностью данного препарата. Наибольшей среди НПВП активностью по отношению к циклооксигеназе обладает индометацин. Чем сильнее антициклооксигеназное действие НПВП, тем интенсивнее проявляются симптомы непереносимости данной группы препаратов. Интенсивность реакции также коррелирует с дозой принятого медикамента. Важную роль играет и способ применения НПВП. При ингаляционном, внутривенном или внутримышечном пути введения интенсивность реакции обычно максимальная.
Таким образом, в постановке диагноза аспириновой бронхиальной астмы большая роль отводится сбору анамнеза и клиническим проявлениям болезни.
Для подтверждения диагноза аспириновой астмы в настоящее время могут применяться провокационные тесты
in vivo
или же тесты
in vitro
. При выполнении провокационного теста
in vivo
используют или прием аспирина внутрь, или ингаляцию в нарастающих концентрациях водорастворимого аспирина — лизин-аспирина (аспизола) с последующим мониторированием показателей бронхиальной проходимости. В связи с возможностью развития приступа удушья данный тест может проводиться только специалистом. Необходимо наличие оснащения и обученного персонала, готового оказать экстренную помощь при развитии бронхоспазма. Показанием для провокационного теста с аспирином является необходимость уточнения клинико-патогенетического варианта астмы. К провокационному тесту допускаются больные, у которых показатели ОФВ1 не менее 65-70% от должных величин. Помимо низких показателей ФВД, противопоказанием к провокационным тестам является также необходимость частого приема симпатомиметиков, деменция, беременность и выраженная кровоточивость. Антигистаминные препараты снижают чувствительность больного к аспирину, поэтому их отменяют не менее чем за 48 часов до начала теста. Симпатомиметики и препараты теофиллина отменяют в зависимости от их фармакокинетических свойств, например, сальметерол следует отменить не менее чем за 24 часа до начала теста.
В настоящее время разрабатывается лабораторная диагностика аспириновой бронхиальной астмы, связанная с определением лейкотриенов Е4 в моче и С4 в назальном лаваже. Следует отметить, что при проведении провокационных тестов с лизин-аспирином в группе больных АА резко повышается содержание лейкотриена Е4 в моче и С4 в назальном лаваже. По-видимому, в ближайшее время будут рекомендованы определенные стандарты в диагностике данного варианта БА.
Лечение
В настоящее время в лечении БА, в том числе и аспириновой, основная роль отводится длительному приему противоастматических противовоспалительных лекарств. Для подбора адекватной противовоспалительной терапии важно определиться в тяжести течения бронхиальной астмы. Ни один тест не позволит нам точно классифицировать степень тяжести БА. Однако совокупная оценка симптомов и показателей функции внешнего дыхания дает характеристику тяжести болезни. Было показано, что оценка течения БА, основанная на клинических проявлениях болезни, связана с показателями степени воспаления дыхательных путей.
Как уровень обструкции, так и степень ее обратимости позволяет подразделить астму по степени тяжести на интермиттирующую, легкую персистирующую (хронического течения), средней тяжести (умеренную) и тяжелую. При лечении астмы в настоящее время применяют ступенчатый подход, при котором интенсивность терапии увеличивается по мере увеличения степени тяжести астмы. Наиболее часто используемыми препаратами вне обострения бронхиальной астмы являются ингаляционные кортикостероиды, доза которых зависит от степени тяжести астмы, недокромил и кромогликат натрия, теофиллины длительного действия и пролонгированные симпатомиметики.
Обычно больным АА требуются высокие поддерживающие дозы ингаляционных кортикостероидов, необходимо также длительное лечение назальных симптомов топическими стероидами. Часто приходится прибегать и к назначению системных стероидов. Поэтому разрабатываются различные патогенетические подходы к терапии АА.
Одним из патогенетических методов лечения аспириновой астмы является проведение десенситизации аспирином
. Метод основан на феномене развития толератности больного АА к повторному воздействию НПВП в период 24–72 часов после удушья, вызванного приемом НПВП. Stevenson показал, что десенситизация аспирином способна контролировать симптомы риносинусита и бронхиальной астмы. Десенситизацию аспирином проводят также больным при необходимости назначать НПВП по поводу других заболеваний (ИБС, ревматические болезни и др.). Десенситизацию проводят по различным схемам, которые подбирают индивидуально. Десенситизация проводится только в стационаре врачом, владеющим данной методикой. Начинают с дозы 5-10 мг и достигают дозы 650 мг и выше. Поддерживающие дозы – 325–650 мг в сутки. Противопоказанием к проведению десенситизации аспирином является обострение бронхиальной астмы, кровоточивость, язвенная болезнь желудка и двенадцатиперстной кишки, тяжелые заболевания печени и почек, беременность. Исследования последних лет показали, что механизм десенситизации связан с формированием нечувствительности рецепторов воздухоносных путей к эффектам лейкотриенов.
В настоящее время появился новый класс противовоспалительных противоастматических препаратов – антагонисты лейкотриеновых рецепторов
. Результаты исследований указывают на то, что эти препараты быстро устраняют базальный тонус дыхательных путей, создаваемый лейкотриенами вследствие хронической активации 5-липоксигеназной ферментной системы. Одним из представителей этой группы является высокоселективный и высокоактивный препарат
зафирлукаст
(аколат). Зафирлукаст при назначении внутрь приводит к значительному увеличению ОФВ1 у пациентов с нарушенной функцией легких, ранее применявших эффективные противоастматические средства, в том числе ингаляционные кортикостероиды.
Особенно широкое применение антагонисты лейкотриенов получили при аспириновой бронхиальной астме, так как в патогенезе этой формы БА имеет место усиленная активация 5-липоксигеназной системы и повышенная чувствительность рецепторов к лейкотриенам. Антагонисты лейкотриенов у таких пациентов улучшают функцию дыхательных путей и блокируют эффект ингаляционно вводящегося лизин-аспирина. Таким образом, антагонисты лейкотриенов оказались особенно эффективными у данной группы пациентов, лечение которых нередко вызывает трудности.
В проведенных исследованиях подключение зафирлукаста
к терапии аспириновой БА вызывает возрастание ОФВ1, показателей пиковой скорости выдоха в утренние и вечерние часы, уменьшение ночных приступов удушья в сравнении с плацебо. Зафирлукаст эффективен как при монотерапии, так и в сочетании с другими препаратами, используемыми в качестве поддерживающего лечения при хроническом течении БА. Исследования также показали хороший эффект антагонистов лейкотриенов в комбинации с ингаляционными и пероральными стероидами. Зафирлукаст способствует сохранению стабильного клинического состояния и оказывает аддитивный клинический эффект, позволяя уменьшить объем стероидной терапии. Таким образом, в настоящее время мы можем сказать, что появился класс препаратов, который влияет на патогенетическое звено аспириновой бронхиальной астмы и оказывает выраженный клинический эффект.
Следует еще раз отметить, что при необходимости назначения препаратов с целью снижения температуры или обезболивания следует назначать парацетамол в начальной дозе 0,5 г в сутки. Проводя терапию парацетамолом у больных АА, следует контролировать состояние больного (желательно с помощью пикфлоуметра) в течение 2–3 часов, так как у 5% больных этот препарат может вызвать приступ удушья. При хорошей переносимости дозу при необходимости можно увеличить.
Литература
1. Бронхиальная астма. Глобальная стратегия. Приложение к журналу Пульмонология. М., 1996; 196.
2. А.Г. Чучалин. Бронхиальная астма. М., 1997.
3. J. Bousquet et al. Eosinophilic inflammation in asthma // N Engl J Med. 1990; 323: 1033-9.
4. British Thoracic Society. Guidelines on the management of asthma // Thorax .1993; 48 (2): 1-24.
5. P. Burney. Current questions in the epidemiology of asthma, in: Holgate ST, et al (eds), Asthma: Physiology, Immunology and Treatment. London, Academic Press, 1993; 3-25.
6. J.M. Drazen, K.F. Austen. Leukotrienes and airway responses // Am Rev Respir Dis. 1987; 136: 985-98.
7. S. Holgate, S-E.Dahlen. SRS-A to Leukotrienes, 1997.
8. Speer F. Aspirin allergy : a clinical study // Soutbern Med Journal.1975 ; 68 : 314-8.
9. Stevenson D.D. Desensitization of aspirin-sensitive astmathics : a therapeutic alternative? // J Asthma. 1983; 20 (1): 31-8.
Зафирлукаст –
Аколат (торговое название)
(AstraZeneca)
| Приложения к статье |
| Аспириновая астма обычно включает триаду симптомов: полипозный риносинусит, приступы удушья и непереносимость НПВП |
| Рис. 1. Схема образования лейкотриенов. |
| Антагонисты лейкотриенов особенно эффективны при аспириновой бронхиальной астме |
Результаты и обсуждение
Проведенные клинико-лабораторные исследования показали, что усиление назальной обструкции у больных с ПРС нарастало пропорционально росту концентрации в сыворотке крови LTС4, средние нормативные показатели которого, по нашим исследованиям, составили 0,256 нмоль/мг.
Полученные результаты свидетельствовали о выраженности аллергического воспаления и были подтверждены гистологическим исследованием полипозной ткани, взятой при биопсии или удаленной при операции.
Морфологически определялась картина васкулита, резко выраженного полнокровия, краевого стояния лейкоцитов, лейкодиапедеза. В отечном основном веществе в большом количестве были видны рассеянные эозинофилы.
Ввиду отсутствия до настоящего времени рекомендаций о длительности и дозировке применения монтелукаста натрия нами была определена схема лечения назальной обструкции у больных ПРС с непрерывным использованием минимальных доз (4—5 мг) препарата, рекомендованных для лечения аллергического ринита и бронхиальной астмы у детей в течение 18 мес [10, 18—20].
Терапевтический эффект блокатора лейкотриеновых рецепторов оценивался через 14 дней, 1 мес, 6 мес и 1 год по сравнению с исходными данными.
Установлено, что при использовании данного препарата у больных с ПРС наблюдалось уменьшение объема полипозной ткани, что существенно отразилось на состоянии носового дыхания и нашло свое отражение в показателях передней активной риноманометрии, кислотно-щелочного равновесия и концентрации в сыворотке крови LTС4.
Наиболее выраженный терапевтический эффект лечения наблюдался у больных с полипозом III—IV стадии (табл. 1, 2). Снижение концентрации LTС4 более интенсивно происходило в течение 1-го месяца.
Таблица 1. Эффективность консервативного лечения назальной обструкции у больных с полипозом III стадии (n=43) Примечание. Здесь и в табл. 2: * — статистически значимые различия для p<0,05 по сравнению с состоянием до лечения. Таблица 2. Эффективность консервативного лечения назальной обструкции у больных с полипозом IV стадии (n=18)
Через 2 нед у больных с III стадией полипоза концентрация LTС4 снизилась на 15,4±0,033%, через 1 мес от начала лечения — на 18,7±0,039%, достигнув значений II стадии полипоза. Через 6 мес концентрация лейкотриенов снизилась на 21,1±0,043%, а через 1 год — на 24,4±0,049% от первоначального значения.
Так же, как у больных с меньшей степенью распространенности полипоза, у больных с IV стадией снижение концентрации лейкотриена С4 наиболее интенсивно происходило в течение 1-го месяца лечения.
Через 2 нед концентрация LTС4 у больных с IV стадией снизилась на 30,9%, через 1 мес от начала лечения — на 43%, достигнув значений II стадии полипоза. Через 6 мес концентрация лейкотриенов снизилась на 45,5%, а через 1 год — на 46,9% от первоначального значения.
Медленное снижение показателей кислотно-щелочного состояния при полипозе IV стадии свидетельствовало о глубине тканевой гипоксии.
В процессе лечения на фоне снижения концентрации LTС4 произошло качественное изменение состава взятой для исследования группы: если до лечения большинство (70,1%) больных составляли пациенты с III—IV стадией полипоза полости носа, то через 1 мес большинство (81,6%) больных имели I—II стадию полипоза.
Использование для лечения назальной обструкции полипозного генеза блокатора лейкотриеновых рецепторов позволило у 73,8% больных с III—IV стадией полипоза восстановить адекватность носового дыхания, не прибегая к хирургическому вмешательству, и добиться стабилизации процесса при динамическом наблюдении от 1,5 до 3 лет.
Эффективность использования блокатора лейкотриеновых рецепторов была подтверждена гистологически.
Установлено, что в результате лечения блокатором лейкотриеновых рецепторов как при первичном, так и рецидивирующем полипозе, в том числе и при наличии бронхиальной астмы, исчез экссудативный компонент аллергического воспаления, о чем свидетельствовало отсутствие отека, полнокровия, значительное уменьшение эозинофильной инфильтрации.
Полученные результаты послужили морфологическим обоснованием возможности и эффективности использования минимальных доз блокатора лейкотриеновых рецепторов для фармакологического контроля назальной обструкции у больных ПРС и легли в основу изобретения «Способ лечения и профилактики назальной обструкции у больных полипозным риносинуситом» (патент № 2499597 от 27.11.13).
Ввиду малой эффективности проводимого консервативного лечения в течение 2 мес 26 из 87 (29,9%) больным с ПРС была выполнена эндоназальная эндоскопическая полисинусотомия.