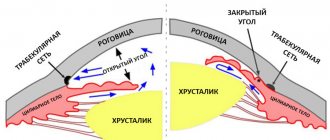
Основными лекарственными препаратами, которые используют при глаукоме, являются глазные капли, снижающие внутриглазное давление.
Глазные капли от глаукомы разделяют по механизму действия:
1.Препараты, которые способствуют оттоку глазной жидкости.
2.Препараты, которые снижают продуцирование водянистой влаги.
Фармакологические свойства
Раствор Дорзопт Плюс — противоглаукомный комбинированный препарат. Каждый его компонент снижает внутриглазное давление, уменьшая секрецию водянистой влаги внутри глаза.
Дорзоламид — ингибитор карбоангидразы. Его действие снижает выработку внутриглазной жидкости и замедляет образование гидрокарбоната, что в последующем ослабляет перенос натрия и воды. Он не способен вызывать спазм аккомодации, миоз или гемералопию.
Тимолол — блокатор неселективный β-адренорецепторов. Предупреждает влияние на β-адренорецепторы катехоламинов. При местном применении, как раствор глазных капель снижает внутриглазное давление так как уменьшает образование водянистой влаги и незначительно увеличивает ее отток.
Способствуют оттоку глазной жидкости следующие препараты:
- парасимпатомиметики (холиномиметики);
- симпатомиметики (α- и β-адреномиметики);
- простагландины F-2α.
Холиномиметики:
- Пилокарпин – препарат растительного происхождения;
- Карбохол – препарат синтетического происхождения.
Эти препараты сужают зрачок, и по этой причине радужная оболочка оттягивается от радужно-роговичного угла. Вследствие этого обеспечивается свободное стекание жидкости к глазной дренажной системе и происходит снижение внутриглазного давления.
Недостатком этих средств является кратковременность гипотензивного эффекта (не более 6 часов).
У препаратов существуют побочные эффекты. После инстилляции капель с пилокарпином в течение 6 часов наблюдается миоз (сужение зрачка), что сопряжено с сужением поля зрения и снижением четкости очертаний предметов вследствие спазма аккомодации. При длительном применении препарата возможно проявление дерматита и аллергического конъюнктивита. Кроме того, в случае использования препаратов с содержанием пилокарпина молодыми людьми с глаукомой и сопутствующей миопией есть риск периферических разрывов сетчатой оболочки.
Симпатомиметики
- Эпинефрин (адреналина гидрохлорид) воздействует на вегетативную нервную систему и улучшает циркуляцию глазной жидкости. Вызывает побочные эффекты: общие – повышение АД, тахиаритмию, и местные – гиперемию слизистой оболочки глаза, расширение зрачка (мидриаз), хронические конъюнктивиты аллергической этиологии. Простагландины F-2α
- Ксалатан,
- Траватан.
Эти препараты благотворно влияют на увеосклеральный отток глазной жидкости и обладают довольно длительным действием – 24 часа после закапывания. При терапии открытоугольной глаукомы их гипотензивный эффект является наиболее сильным. Побочными эффектами являются покраснение слизистой оболочки, чувство жжения, отек области желтого пятна (макулы).
Противопоказания
- ХОБЛ и бронхиальная астма (включая указание в анамнезе);
- Синусовая брадикардия;
- Тяжелая сердечная недостаточность и AV-блокада;
- Кардиогенный шок;
- Тяжелые степени почечной недостаточности;
- Дегенерация роговицы;
- Беременность;
- Лактация;
- Возраст до 18-ти лет;
- Индивидуальная гиперчувствительность.
Препарат должен назначаться с осторожностью при печеночной недостаточности, сахарном диабете, в пожилом возрасте.
Побочные действия
- Воспаление, раздражение и шелушение век, иридоциклит, миопия, проходящая при отмене препарата, точечный кератит, конъюнктивит, кератит, синдром сухого глаза, диплопия, птоз.
- Головная боль, астения, парестезии, звон в ушах, депрессия, снижение памяти.
- Ангионевротический отек, бронхоспазм, зуд, крапивница, алопеция, обострение псориаза.
- Носовое кровотечение, сухость во рту, раздражение глотки, сыпь.
- Аритмия, обморок, снижение АД, нарушения ритма, снижение температуры конечностей, отеки, синдром Рейно.
- Бронхоспазм, кашель и боль в груди.
- Диарея, сухость во рту, снижение либидо, болезнь Пейрони.
Особые указания
Применение раствора Дорзопт Плюс требует обеспечения адекватного контроля сердечно-сосудистой системы.
Дорзопт Плюс содержит бензалкония хлорид, консервант способный осаждаться в гидрофильных контактных линзах, оказывая повреждающее воздействие на ткани органа зрения. Поэтому пациентам, применяющим мягкие контактные линзы, стоит удалять их перед внесением капель, а устанавливать обратно после закапывания примерно спустя 20 мин.
При назначении плановой хирургической операцией раствор Дорзопт Плюс отменяют за 48 часов до общей анестезии, из-за усиления действия миорелаксантов, а также средств общего наркоза.
В период лечения существует необходимость воздержаться от вождения транспортных средств и не заниматься деятельностью, связанной с опасными механизмами.
Хранят раствор Дорзопт Плюс при комнатной температуре. Берегут от детей.
Срок хранения – 2 года. Срок годности после вскрытия – месяц.
Исследования комбинации дорзоламида и тимолола с точки зрения прогрессирования глаукомы
В данном обзоре приводятся данные клинических исследований эффективности комбинации дорзоламида и тимолола. Обсуждаются преимущества использования комбинации дорзоламида и тимолола с позиций сохранения зрительных функций. Ключевые слова: ПОУГ, дорзоламид, тимолола малеат, гемодинамика глаза. Abstract
Study of dorzolamide and timolol combination from the view point of glaucoma progression I.A. Loskutov
Center of Microsurgery of NUZ DKB named after Semashko N.A. Moscow Clinical findings concerning efficiency of dorzolamide and timolol combination are reviewed. Advantages of usage of timolol and dorzolamide combination for a stabilization of visual functions are discussed. Key words: POAG, dorzolamide, timolol maleate, eye hemodynamics.
Эффективность лечения глаукомы может быть адекватно оценена только с позиций сохранения зрительных функций. Поскольку дефекты поля зрения, возникая и увеличиваясь, приводят к слепоте, определение прогрессирования нарушений периферического зрения остается одним из самых важных и наиболее сложных аспектов лечения глаукомы. При этом более полное понимание клинических факторов риска, приводящих к ухудшению течения глаукомы, может помочь в разработке новых стратегий, которые позволят улучшить медицинскую помощь при глаукоме [3, 4]. Хорошо известно, что повышенное внутриглазное давление (ВГД) является одним из наиболее значимых факторов риска прогрессирования глаукомы [5]. Тем не менее существует обоснованное мнение, что в прогрессирование глаукомного повреждения вовлечены и другие факторы риска. Так, несмотря на то, что в ходе таких рандомизированных клинических исследований, как AGIS, была установлена важная роль снижения ВГД в предотвращении ухудшения поля зрения, у многих пациентов заболевание продолжает прогрессировать, несмотря на нормализацию офтальмотонуса. Было установлено, что к значимым факторам риска, вызывающим прогрессирование глаукомного повреждения поля зрения, относятся возраст [6, 7], наличие эксфолиаций [8], кровоизлияний на диске зрительного нерва [9], изменений ретробульбарного кровотока [10–13] и низкое перфузионное давление [8]. Среди препаратов, снижающих ВГД, важное место занимают глазные капли на основе ингибиторов карбоангидразы. Наиболее длительные клинические наблюдения проведены в отношении препарата Трусопт® (2% офтальмологический раствор дорзоламида), который был первым появившимся на отечественном рынке ингибитором карбоангидразы для местного применения. Многочисленные клинические исследования показали, что дорзоламид 2% в виде монотерапии или дополнительной терапии к тимололу хорошо переносится и имеет хороший профиль снижения ВГД [14–19]. Очень важно, что при местном применении дорзоламида различными исследовательскими группами было установлено положительное влияние этого препарата на показатели гемодинамики глаза [20–27]. Другой ингибитор карбоангидразы для местного применения – бринзоламид в 1998 г. стал доступен в США, в 1999 г. – во многих европейских странах. Эффективность и безопасность бринзоламида подтверждены в клинических исследованиях. Бринзоламид имеет выраженную активность в отношении снижения ВГД [28–30]. Кроме того, в сравнительно небольшом числе исследований была проведена оценка влияния бринзоламида при местном применении на глазной кровоток у пациентов с глаукомой [31, 32]. Так как изменения микрогемоциркуляции в глазу связаны с прогрессированием глаукомного повреждения [10–13], можно предположить, что увеличение скорости кровотока потенциально способно защитить от глаукомного ухудшения поля зрения. Клинические наблюдения подтверждают это положение [1, 2]. Аналогичная гипотеза была предложена Мартинесом с соавт. в 2008 г. [27]. Сообщалось, что дорзоламид 2% в комбинации с тимололом 0,5% при инстилляциях каждого препарата по 2 р./сут. может предотвратить ухудшение поля зрения в течение 4 лет у пациентов с ПОУГ. Основной целью другой работы этой же группы исследователей было выявление клинически значимых факторов риска, вызывающих прогрессирование потери поля зрения в группе пациентов с ПОУГ. Факторы прогрессирования в начале исследования и в период последующего контрольного наблюдения оценивали отдельно. Вторичная цель заключалась в оценке степени эффективности дорзоламида 2% и бринзоламида 1%, каждый из которых добавляли к тимололу 0,5%, путем сравнения частоты прогрессирования в обеих исследуемых группах [33]. Так, было проведено рандомизированное исследование в параллельных группах. Пациенты получали дорзоламид 2% или бринзоламид 1%, каждый из которых добавляли к тимолола малеату 0,5%. Инстилляции назначались 2 р./сут. в течение 5 лет. Результаты этого проспективного рандомизированного одноцентрового исследования показали, что пониженное диастолическое артериальное давление (ДАД), системное лечение гипертонии, пониженная скорость тока крови в задней короткой цилиарной артерии (ЗКЦА) и глазничной артерии (ГА) в диастолу, повышенное значение индекса резистентности (ИР) в ГА и ЗКЦА являлись статистически значимыми предикторами прогрессирования поражения поля зрения в данной группе пациентов с ПОУГ в течение 5-летнего периода [33]. Эти результаты согласуются с данными ранее опубликованных работ [10, 34]. Так, обнаружено, что в ретробульбарных сосудах глаз с ухудшением состояния поля зрения наблюдается недостаточный уровень кровообращения по сравнению с таковым в сосудах глаз со стабильным состоянием полей зрения [12, 13]. Интересным результатом работы Мартинеса (2010) было установление достоверной связи между приемом гипотензивных препаратов и прогрессированием глаукомного повреждения [33]. В этой связи обращает на себя внимание работа, проведенная Weinstock еще в 1973 г., в которой было установлено, что интенсивное лечение артериальной гипертензии оказывало негативное воздействие на пациентов с глаукомой [35]. В работе Muskens et al. (2007) приведены данные о том, что применение блокаторов кальциевых каналов может быть связано с прогрессированием ПОУГ [36]. Было обнаружено, что низкое ДАД являлось независимым фактором, ответственным за увеличение риска почти на 40% у всех пациентов [33]. К числу факторов, которые были достоверно связаны с прогрессированием повреждения поля зрения в исследовании Мартинеса [33], были отнесены увеличение диастолической скорости кровотока и снижение ИР току крови в ГА и ЗКЦА. Увеличение скорости тока крови в диастолу (от начала исследования до последнего контрольного визита) в ГА было тесно связано с прогрессированием заболевания. Так, увеличение диастолического минимума тока крови на 1 см/с снижало риск прогрессирования приблизительно на 30%. Аналогичные результаты были получены для диастолического тока крови в ЗКЦА. Увеличение диастолического минимума на 1 см/с снижало риск приблизительно на 20%. Кроме того, прогрессирование было тесно связано с величиной снижения ИР току крови как в ГА, так и в ЗКЦА. Риск прогрессирования снижался приблизительно на 20 и 25% соответственно при снижении ИР на 0,01 единицы [33]. При многофакторном анализе результатов среднее ВГД и его колебания в период контрольного наблюдения не были достоверно связаны с прогрессированием глаукомы. Была обнаружена значительно более низкая частота прогрессирования дефектов поля зрения в течение 5 лет при обследовании глаз пациентов, получавших комбинацию дорзоламид/тимолол, по сравнению с пациентами, получавшими инстилляции комбинации бринзоламид/тимолол [33]. Эти результаты можно объяснить тем фактом, что дорзоламид значительно увеличивает гемодинамические параметры в ретробульбарных сосудах. В настоящее время появляется все больше доказательств того, что уменьшение глазного кровотока непосредственно связано с дефектом поля зрения [10–13]. Тот факт, что обе комбинации (дорзоламид/тимолол и бринзоламид/тимолол) оказывали сходное ВГД-снижающее воздействие, хотя их влияние на сосуды было различным, является дополнительным доказательством в поддержку местного вазоактивного действия, в отличие от механизма, связанного с влиянием на ВГД. Механизм, лежащий в основе сосудорасширяющего действия ингибиторов карбоангидразы на ретробульбарные сосуды, точно неизвестен. Показано, что ингибиторы карбоангидразы могут вызывать внеклеточный ацидоз [37]. Стоит отметить, что повышение артериального рСО2 стимул, который приводит к внеклеточному ацидозу, также сильно увеличивает приток крови к сосудистой оболочке глаза [38, 39]. Тем не менее эксперименты на изолированных предварительно суженных артериях сетчатки быка свидетельствуют о том, что сосудорасширяющий эффект дорзоламида не зависит от изменения рН, т. к. индуцированное дорзоламидом расширение сосудов наблюдается и при стабильном рН [40]. Различные сосудистые эффекты дорзоламида и бринзоламида, обнаруженные в этом исследовании, можно объяснить их различной способностью ингибировать изофермент карбоангидразы IV (КА IV). Как известно, существует 15 изоформ фермента КА, но при глаукоме самое большое значение имеют изоферменты КА II и КА IV: КА II участвует в образовании водянистой влаги, КА IV – в сохранении тонуса артериальных сосудов [48]. Дорзоламид и бринзоламид обладают одинаковой аффинностью к рецептору КА II, но афинность дорзоламида к рецептору КА IV в 6,5 раза выше (ингибирующее действие: ИК50 дорзоламида 6,9 нМ [18] по сравнению с ИК50 45,3 нМ [46] бринзоламида). Таким образом, дорзоламид является мощным ингибитором КА IV. В глазу КАIV локализуется в эндотелиальных клетках хориокапилляров [41]. Кроме того, Sender с соавт. обнаружил активность КА IV в капиллярах мышечных волокон [42]. Таким образом, можно предположить, что расширение сосудов, наблюдавшееся в экспериментах in vitro или после системного введения ингибиторов карбоангидразы, является результатом влияния только на гладкомышечные клетки сосудов или на эти клетки совместно с другими клеточными элементами окружающей ткани. Тем не менее этот ответ зависел от типа ингибитора карбоангидразы. Сосудорасширяющее действие дорзоламида было значительно меньше в изолированных артериолах, о чем свидетельствуют снижение максимальной релаксации и увеличение средней эффективной концентрации [43]. Поэтому весьма вероятно, что в периваскулярных тканях сосудорасслабляющее действие этих препаратов зависит от типа карбоангидразы. Эти эффекты могут быть связаны с различными мембрано-связанными изоферментами IV и XIV, расположенными в астроцитах сетчатки и клетках Мюллера [44, 45]. Частота прогрессирования дефекта поля зрения в глазах, получавших комбинацию дорзоламид/тимолол, обнаруженная с использованием методов анализа событий или тенденции, составила 24% (24/99) и 27% (27/99) соответственно, что значительно ниже частоты прогрессирования, которая была зарегистрирована в исследовании EMGT [47]. Однако частота прогрессирования в глазах у пациентов, получавших комбинацию бринзоламид/тимолол, обнаруженная с использованием методов анализа событий или тенденции, составила 47% (55/116) и 53% (61/116) соответственно, что согласуется с величинами частоты прогрессирования, которые были зарегистрированы в исследовании EMGT [47]. Соответственно, комбинация дорзоламид/тимолол стабилизирует поля зрения в 73% случаев по сравнению с 47% при использовании комбинации бринзоламид/тимолол [33]. В заключение отметим, что результаты исследования Мартинеса (2010) позволяют предположить, что пониженные ДАД, САД, КДС и повышенное значение ИР в ГА и ЗКЦА являлись в начале исследования независимыми факторами риска прогрессирования дефекта поля зрения в этой когорте пациентов с ПОУГ. Полученные результаты позволяют предположить, что повышение КДС и снижение ИР в ГА и ЗКЦА было связано с сохранением поля зрения у пациентов с ПОУГ. Таким образом, лечение комбинацией дорзоламид/тимолол снижало относительный риск прогрессирования на 48% по сравнению с лечением комбинацией бринзоламид/тимолол [33]. Для того чтобы установить, может ли улучшенный кровоток в ретробульбарных сосудах предотвратить прогрессирование глаукомного повреждения, необходимы дальнейшие клинические исследования, в частности рандомизированные клинические испытания с участием пациентов с различными видами глаукомы и разной расовой принадлежности.
Литература 1. Лоскутов И.А., Патеюк Л.С. Клиническое использование комбинации дорзоламида и тимолола // Глаукома. 2009. № 4 (приложение). С. 2–7. 2. Лоскутов И.А. Клиническая значимость местного ингибитора карбоангидразы // Глаукома. 2009. № 1. С. 36–40. 3. Nakagami T., Yamazaki Y., Hayamizu F. Prognostic factors for progression of visual field damage in patients with normal-tension glaucoma // Jpn J Ophthalmol. 2006. Vol. 50. P. 38–43. 4. Chauhan B.C., Mikelberg F.S., Balaszi A.G., Le Blanc R.P., Lesk M.R., Trope G.E. for the Canadian Glaucoma Study Group: Canadian Glaucoma Study 2: risk factors for the progression of open-angle glaucoma // Arch Ophthalmol. 2008. Vol. 126. P. 1030–1036. 5. Nouri-Mahdavi K., Hoffman D., Coleman A.L., Liu G., Li G., Gaasterland D., Caprioli J.; Advanced Glaucoma Intervention Study. Predictive factors for glaucomatous visual field progression in the Advanced Glaucoma Intervention Study // Ophthalmology. 2004. Vol. 111. P. 1627–1635. 6. Nouri-Mahdavi K., Hoffman D., Gaasterland D. & Caprioli J. Prediction of visual field progression in glaucoma // Invest Ophthalmol Vis Sci. 2004. Vol. 45. P. 4346–4351. 7. Spry P.G.D., Sparrow J.M., Diamond J.P. & Harris H.S. Risk factors for progressive visual field loss in primary open-angle glaucoma // Eye. 2005. Vol. 19. P. 643–651. 8. Leske M.C., Heijl A., Hyman L., Bengtsson B., Dong L., Yang Z.; EMGT Group. Predictors of longterm progression in the Early Manifest Glaucoma Trial // Ophthalmology. 2007. Vol. 114. P. 1965–1972. 9. Drance S., Anderson D.R., Schulzer M. & the Collaborative Normal-Tension Glaucoma Study Group. Risk factors for progression of visual field abnormalities in normal-tension glaucoma // Am J Ophthalmol. 2001. Vol. 131. P. 699–708. 10. Galassi F., Sodi A., Ucci F., et al. Ocular haemodynamics and glaucoma prognosis: a colour Doppler imaging study // Arch Ophthalmol. 2003. Vol. 121. P. 1711–1715. 11. Satilmis M., Orgul S., Doubler B. & Flammer J. Rate of progression of glaucoma correlates with retrobulbar circulation and intraocular pressure // Am J Ophthalmol. 2003. Vol. 135. P. 664–669. 12. Martinez A., Sanchez M. Predictive value of colour Doppler imaging in a prospective study of visual field progression in primary open-angle glaucoma // Acta Ophthalmol Scand. 2005. Vol. 83. P. 716–723. 13. Zeitz O., Galambos P., Weirmann A. et al. Glaucoma progression is associated with decreased blood flow velocities in the short posterior ciliary artery // Br J Ophthalmol. 2006. Vol. 90. P. 1245–1248. 14. Strahlman E., Tipping R., Vogel R. & the International Dorzolamide Study Group. A double-masked, randomized 1-year study comparing dorzolamide (Trusopt), timolol and betaxolol // Arch Ophthalmol. 1995. Vol. 113. P. 1009–1016. 15. Adamsons I.A., Polis A.B., Ostrov C.S., Boyle J.E. & the Dorzolamide Safety Study Group. Two-year safety study of dorzolamide as monotherapy and with timolol and pilocarpine // J Glaucoma. 1998. Vol. 7. P. 395–401. 16. Boyle J., Ghosh K., Gieser D. & Adamsons I. A randomized trial comparing the dorzolamide–timolol combination given twice daily to monotherapy with timolol and dorzolamide. Dorzolamide–Timolol Study Group. // Ophthalmology. 1998. Vol. 105#10. P. 1945–1951. 17. Clineschmidt C., Williams R., Snyder E. & Adamsons I.A. A randomized trial in patients inadequately controlled with timolol alone comparing the dorzolamide–timolol combination to monotherapy with timolol or dorzolamide. Dorzolamide–Timolol Combination Study Group // Ophthalmology. 1998. Vol. 105 (10). P. 1952–1959. 18. Sugrue M.: Pharmacological and ocular hypotensive properties of topical carbonic anhydrase inhibitors // Prog Retin Eye Res. 2000. Vol. 19. P. 87–112. 19. Ozturk F., Ermis S.S. & Inan U. Comparison of the ocular hypotensive effects of bimatoprost and timolol–dorzolamide combination in patients with elevated intraocular pressure: a 6-month study // Acta Ophthalmol Scand. 2007. Vol. 85. P. 80–83. 20. Martinez A., Gonzalez F., Capeans C., Perez R. & Sanchez-Salorio M. Dorzolamide effect on the ocular blood flow // Invest Ophthalmol. Vis Sci 1999. Vol. 40. P. 1270–1275. 21. Avunduk A.M., Sari A., Akyol N. et al. The 1-month effects of topical betaxolol, dorzolamide and apraclonidine on ocular blood flow velocities in patients with newly diagnosed primary open-angle glaucoma // Ophthalmologica.. 2001. Vol. 215. P. 361–365. 22. Galassi F., Sodi A., Renieri G. et al. Effects of timolol and dorzolamide on retrobulbar haemodynamics in patients with newly diagnosed primary open-angle glaucoma // Ophthalmologica. 2002. Vol. 216. P. 123–128. 23. Januloviciene I., Harris A., Kagemann L., et al. A comparison of the effects of dorzolamide/timolol fixed combination versus letterpress in intraocular pressure and pulsatile ocular blood flow in primary open-angle glaucoma patients // Acta Ophthalmol Scand. 2004. Vol. 82. P. 730–737. 24. Fuchsjager-Mayrl G., Wally B., Rainer G. et al. Effect of dorzolamide and timolol on ocular blood flow in patients with primary open-angle glaucoma and ocular hypertension // Br J Ophthalmol. 2005. Vol. 89. P. 1293–1297. 25. Martinez A., Sanchez M. A comparison of the effects of 0.005 % latanoprost and fixed combination dorzolamide/timolol on retrobulbar haemodynamics in previously untreated glaucoma patients // Curr Med Res Opin. 2006. Vol. 22. P. 67–73. 26. Martinez A., Sanchez M. Retrobulbar haemodynamic effects of the latanoprost/ timolol and the dorzolamide/timolol fixed combinations in newly diagnosed glaucoma patients // Int J Clin Pract. 2007. Vol. 61(5). P. 815–821. 27. Martinez A., Sanchez M. Effects of dorzolamide 2 % added to timolol maleate 0.5 % on intraocular pressure, retrobulbar blood flow, and progression of visual field damage in patients with primary open-angle glaucoma: a single-centre, 4-year, open-label study // Clin Ther. 2008. Vol. 30. P. 1120–1134. 28. Silver L. Clinical efficacy and safety of brinzolamide (Azopt), a new topical carbonic anhydrase inhibitor for primary open-angle glaucoma and ocular hypertension Brinzolamide Primary Therapy Study Group // Am J Ophthalmol. 1998. Vol.126. P. 400–408. 29. March W., Ochsner K. The longterm safety and efficacy of brinzolamide 1.0 % (Azopt) in patients with primary open-angle glaucoma or ocular hypertension. The Brinzolamide Longterm Therapy Study Group // Am J Ophthalmol. 2000. Vol.129. P. 136–143. 30. Shall K. & the Brinzolamide Primary Therapy Study Group. The efficacy and safety of brinzolamide 1 % ophthalmic suspension (Azopt) as a primary therapy in patients with open-angle glaucoma or ocular hypertension // Surv Ophthalmol. 2000. Vol. 44. P. 155–162. 31. Kaup M., Plange N., Niegel M., et al. Effects of brinzolamide on ocular haemodynamics in healthy volunteers // Br J Ophthalmol. 2004. Vol. 88. P. 257–262. 32. Siesky B., Harris A., Cantor L. et al. A comparative study of the effects of brinzolamide and dorzolamide on retinal oxygen saturation and ocular microcirculation in patients with primary open-angle glaucoma // Br J Ophthalmol. 2008. Vol. 92. P. 500–504. 33. Martinez A., Sanchez M. Predictors for visual fields progression and the effect of treatment with dorzolamide 2% or brinzolamide 1% each added to timolol 0.5% in primary open angle glaucoma // Acta ophthalmologica. 2010. Vol. 88. P. 541-552. 34. Drance S., Rojanapongpun P. The ophthalmic artery velocity in open-angle glaucoma. In: DranceS (ed.). Update to Glaucoma, Ocular Blood Flow, and Drug Treatment. New York, NY: Kluger Publications. 1995. P. 55–56. 35. Weinstock F.J. Ophthalmic hazards of hypotensive drugs // JAMA. 1973. Vol. 224. P. 1039-1043. 36. Muskens R., De Voogd S., Wolfs R., et al. Systemic antihypertensive medication and incident open-angle glaucoma // Ophthalmology. 2007. Vol. 114. P. 2221–2226. 37. Friberg L., Kastrup J., Rizzi D., et al. Cerebral blood flow and end-tidal pCO2 during prolonged acetazolamide treatment in humans // Am J Physiol. 1990. Vol. 258. P. 954–959. 38. Riva C., Petrig B. Choroidal blood flow by laser Doppler flowmetry // Opt Eng. 1995. Vol. 34. P. 746–752. 39. Schmetterer L., Lexer F., Graselli U., et al. The effect of different mixtures of O2 and CO2 on ocular fundus pulsations // Exp Eye Res. 1996. Vol. 63. P. 351–355. 40. Josefsson A., Sigurdsson S., et al. Dorzolamide induces vasodilatation in isolated pre-contracted bovine retinal arteries // Exp Eye Res. 2004. Vol. 78. P. 215–221. 41. Hageman G., Zhu X., et al. Localization of carbonic anhydrase IV in a specific capillary bed of the human eye // Proc Natl Acad Sci USA. 1991. Vol. 88. P. 2716–2720. 42. Sender S., Gros G., Waheed A., et al. Immunohistochemical localization of carbonic anhydrase IV in capillaries of rat and human skeletal muscle // J Histochem Cytochem. 1994. Vol. 42. P. 1229–1236. 43. Kehler A., Holmgaard K., Hessellund A., et al. Variable involvement of the perivascular retinal tissue in carbonic anhydrase inhibitor-induced relaxation of porcine retinal arterioles in vitro // Invest Ophthalmol Vis Sci. 2007. Vol. 48. P. 4688–4693. 44. Inoue J., Oka M., Aoyama Y., Kobayashi S., et al. Effects of dorzolamide hydrochloride on ocular tissues // J Ocul Pharmacol Ther. 2004. Vol. 20. P. 1–13. 45. Nagelhus E., Mathiisen T., Bateman A., et al. Carbonic anhydrase XIV is rich in specific membrane domains of retinal pigment epithelium, Muller cells, and astrocytes // Proc Natl Acad Sci USA. 2005. Vol. 102. P. 8030–8035. 46. Stams T., Chen Y., Boriack-Sjodin P.A. et al. Structures of murine carbonic anhydrase IV and human carbonic anhydrase II complexes with brinzolamide: molecular basis of isoenzyme-drug discrimination // Protein Sci. 1998. Vol. 7. P. 556–563. 47. Leske M., Heijl A., Hussein M., et al. Early Manifest Glaucoma Trial Group: Factors for glaucoma progression and the effect of treatment (the Early Manifest Glaucoma Trial) // Arch Ophthalmol. 2003. Vol. 121. P. 48–56. 48. Martinez A. et al. A comparision of the long-term effect of dorzolamide 2% and brinzolamide 1%, each added to timolol 0.5%, on retrobulbar hemodynamics and intraocular pressure in open-angle glaucomapatients // J Ocular Pharmacol Ther. 2009. Vol. 25(3). P. 239–248.