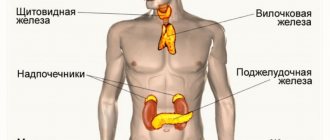
Что такое гормон эстроген? Определение гласит, что эстрогены — группа женских гормонов, в небольшом количестве содержащихся и в мужских организмах. Существует множество разновидностей этих гормонов в организме, основные — эстрадиол, эстриол и эстрон.
На что влияют преобладающие три вида этих гормонов у женщин?
- Эстрадиол — наиболее активный. С помощью инъекций его вводят женщинам при выраженной гормональной недостаточности. Эстрадиол — основа большинства комбинированных оральных контрацептивов.
- Эстрон — стимулирует развитие матки и рост слизистой оболочки в ее полости, а также формирование вторичных половых признаков.
- Эстриол — формируется из первых двух типов. Если его количество в моче беременной женщины увеличено, это указывает, что плацента работает хорошо и плод жизнеспособен.
У женщин в первой половине менструального цикла эти гормоны образуются в фолликуле, а во второй — в желтом теле. В меньшем количестве женские эстрогены вырабатывают надпочечники. После климакса их выработка происходит в коре надпочечников. У мужчин эти гормоны образуются в основном в яичках.
Выработка эстрогенов значительно усиливается во время беременности. В этот период они вырабатываются в плаценте.
Зачем нужны эстрогены?
Если женский организм в достаточном количестве содержит эстроген, «симптомы», которые первыми бросаются в глаза, — это красивая фигура с тонкой талией и округлыми бедрами, а также бархатистая кожа.
Эстрогены у женщин — стероидные гормоны: они влияют на рост и развитие половых органов, подготавливая женщину к материнству. Под их влиянием в организме происходят следующие изменения:
- формируются вторичные половые признаки (в подмышечных впадинах и на лобке появляются волосы, формируется характерная форма таза, увеличиваются молочные железы);
- создается кислая среда во влагалище (на период от полового созревания до менопаузы);
- увеличиваются размеры матки;
- распределяются жировые клетки (на груди, бедрах, ягодицах, коленях), что придает фигуре более женственные очертания.
Если в женском организме в достаточном количестве содержится этот гормон, симптомы проявляются в регулярных месячных.
КРОМЕ ИЗМЕНЕНИЙ В ПИТАНИИ НЕОБХОДИМО ПОЗАБОТИТЬСЯ О СЛЕДУЮЩЕМ
- Сбросить лишний вес — ведь клетки жировой ткани вырабатывают дополнительный эстроген.
- Наладить здоровье желудочно-кишечной системы. Необходимо поддерживать здоровый баланс микробиоты (микрофлоры) в кишечнике, потому что «вредные» бактерии не дают вывести излишки эстрогена из организма, возвращая его в кровь. В то время как «хорошие» помогают избавиться от него. Здесь первое и лучшее средство — массаж и восстановление внутренних органов Чи-ней-цзан.
- Минимизировать контакт с веществами, в составе которых есть синтетические эстрогены: пластмассы (например, посуда), многие средства гигиены, аэрозольные средства от насекомых.
Повышение уровня гормона
У женщин
Одни из самых важных гормонов в организме женщины —эстроген и прогестерон. Оба они вырабатываются в яичниках. Эти гормоны выделяются в разные фазы менструального цикла.
В первый день менструаций гипофиз выделяет фолликулостимулирующий гормон (ФСГ). Под его действием на яичнике начинает развиваться фолликул и выделяются эстрогены. Как только их уровень повышается до определенной отметки, они блокируют выделение ФСГ. Это происходит примерно на 12–15-й день цикла.
В это время гипофиз начинает выделять другой гормон — лютеинизирующий (ЛГ). Когда его уровень повышается, происходит овуляция — фолликул лопается и из него выходит готовая к оплодотворению яйцеклетка. После овуляции снижается уровень эстрогенов и в яичниках начинает вырабатываться прогестерон.
Схематически выработку гормонов на протяжении менструального цикла можно представить так:
фолликулостимулирующий гормон (гипофиз) → эстрогены (яичники) → лютеинизирующий гормон (гипофиз) → прогестерон (яичники)
По этому принципу действуют оральные контрацептивы: они регулируют количество женских гормонов в организме. При этом они снижают уровень ФСГ до такого количества, чтобы не начал вырабатываться лютеинизирующий гормон. Нет лютеинизирующего гормона — нет овуляции.
У мужчин
В норме у мужчин количество эстрадиола должно колебаться в пределах 50–130 пмоль/л. Повышение уровня гормонов у мужчин может свидетельствовать об опухоли в яичках.
Содержание гормонов в организме после менструации
После менструации уровень эстрогена постепенно увеличивается, что помогает расти эндометрию в матке. Постепенно нормализуется общее состояние женщины.
Основные симптомы, характеризующие состояние женщины после менструации:
- нормализация настроения — устанавливается правильный баланс гормонов;
- улучшение состояния кожи — прогестерон вырабатывается не так активно;
- появление энергии и увеличение работоспособности — является следствием увеличения эстрогена.
Интересно! Эстроген считается гормоном женской красоты. Он делает женщину женщиной и стимулирует ее сексуальность.
Отметим, что в этот период женщина выглядит наиболее привлекательно.
Недостаток эстрогенов
Нехватка женских гормонов в детском возрасте — причина медленного развития:
- молочных желез;
- женских половых органов;
- скелета.
Если у подростков после полового созревания недостаток эстрогена, симптомы могут наблюдаться следующие:
- уменьшение молочных желез (после того как грудь выросла, она начинает уменьшаться);
- отсутствие менструаций;
- уменьшение размеров матки.
Если у женщины детородного возраста недостаток эстрогена, симптомы наиболее часто проявляются:
- резкой сменой настроения;
- «холодностью» в постели;
- нерегулярными месячными циклами;
- болями внизу живота во время месячных;
- бессонницей;
- снижением работоспособности;
- ухудшением памяти;
- проблемами с кожей.
При недостатке гормонов на коже могут появиться воспаления, растяжки, снижается эластичность. Как видите, проблемы из-за гормонального дисбаланса в основном «женские»: данные гормоны помогают нам быть более женственными и красивыми.
Что происходит, когда в женском организме слишком мало эстрогена?
Соматические недуги связаны с влиянием эстрогенов на эстрогензависимые ткани. Недостаток гормонов резко меняет их функционирование.
- Низкий уровень эстрогена влияет на кровеносную систему. При снижении его концентрации возникают неблагоприятные изменения липидного профиля. Одновременное возникновение изменений сосудистых стенок и содействие образованию атеросклеротических бляшек повышает риск развития ишемической болезни сердца у женщин в постменопаузе.
- Снижение концентрации эстрадиола также негативно сказывается на состоянии костей. От дефицита эстрогена зависят снижение плотности костной ткани и потеря костной массы.
- Снижение содержания коллагена и гиалуроновой кислоты в коже приводит к ее старению, снижению эластичности. За этот процесс также отвечает дефицит эстрогена.
- К эстрогензависимым тканям относятся ткани мочеполовой системы. Состояние соединительной ткани половой зоны и поддерживающий аппарат репродуктивного органа зависит от концентрации эстрогенов. Когда они отсутствуют, происходит ослабление соединительной ткани и опорной системы матки. Это приводит к склонности к нарушениям статики репродуктивного органа, грыжам и недержанию мочи.
- Влияние дефицита эстрогенов на состояние слизистой оболочки половых путей неоспоримо. У женщин в постменопаузе наблюдается предрасположенность к атрофическим изменениям (атрофический вагинит, атрофия влагалища) и сухости слизистой влагалища. Снижение концентрации эстрогенов вызывает уменьшение количества гликогена в клетках слизистой влагалища.
Это влияет на изменение рН половых путей и возникновение склонности к бактериальным инфекциям. Нельзя отрицать и действие эстрогенов в ходе атрофических изменений кожи вульвы. Недостаток эстрогена может повлиять на возникновение ретроградных поражений кожи.
Как повысить эстроген?
Если вы заметили вышеперечисленные признаки недостатка гормонов, обратитесь к врачу. В зависимости от результатов анализов он подбирает индивидуальный способ повышения гормонов.
Часто врачи прописывают пациентам токоферол (витамин Е). Возможен также прием гормональных препаратов (оральных контрацептивов). Каждая таблетка комбинированных оральных контрацептивов содержитэстроген и прогестерон(в разных соотношениях).
Повысить уровень гормона у женщин можно и при помощи продуктов питания. В них содержатся фитоэстрогены — это нестероидные растительные гормоны, структура которых схожа с человеческими гормонами. Их содержат:
- соя и соевые продукты (молоко, сыр, масло, мука, йогурт);
- другие виды бобовых культур (фасоль, горох, бобы);
- продукты животного происхождения (мясо, рыбий жир, молочные продукты);
- некоторые овощи и фрукты (морковь, красный виноград, баклажаны, томаты, тыква, цветная и брюссельская капуста);
- кофе.
При недостатке этих гормонов в организме старайтесь есть дозированное количество указанных продуктов. Чрезмерные порции могут спровоцировать избыток гормонов.
Низкий уровень эстрогена – лечение
Терапевтические возможности климактерических симптомов основаны на заместительной гормональной терапии (ЗГТ). Существуют специфические показания и противопоказания к применению эстрогенов.
В каждом клиническом случае преимущества и недостатки применения ЗГТ должны рассматриваться индивидуально. Существуют различные способы введения эстрогена — таблетки, пластыри, гели, имплантаты и кремы. Возможно их введение внутривенно, вагинально или перорально.
Чтобы избавиться от сухости во влагалище, можно использовать специальные смазки или вагинальные увлажняющие шарики с гиалуроновой кислотой. Они уменьшают жжение и дискомфорт. Это хороший способ снять боль во время полового акта.
Любое лечение должно назначаться гинекологом после получения результатов анализов.
Избыток эстрогенов
При повышенном количестве этих гормонов в организме могут наблюдаться такие побочные действия:
- тошнота, рвота;
- головная боль и головокружения;
- бессонница;
- раздражительность;
- болезненность молочных желез;
- отеки, в том числе вздутие живота;
- повышенное артериальное давление;
- нерегулярные месячные;
- холодные конечности (руки, ноги);
- увеличение веса;
- усталость;
- угревая сыпь;
- выпадение волос;
- образование тромбов;
- опухоли (матки, груди, эндометрия).
Как избыток, так и нехватка этих гормонов сразу же проявляются внешне и внутренне. В России недостаток женских гормонов встречается редко, а вот их переизбыток — очень часто. Именно поэтому у российских женщин часто диагностируют рак груди, мастопатию, тяжелый предменструальный синдром.
Если у вас появились описанные признаки, сразу же обращайтесь к врачу. Отрегулируйте гормональный фон, пока ситуация не усугубилась.
гормон, эстроген, гормоны
Основные причины увеличения эстрогена в крови
- Увеличение нагрузок на печень. Избыток гормона выводится этим органом, если печень перегружена токсинами, то не сможет вовремя справляться с этой задачей. Накопление негативных форм эстрогена может привести к эндометриозу и раку груди.
- Длительные запоры. Чем дольше время пребывания токсинов в виде негативных форм эстрогена в кишечнике, тем больше у них шансов попасть обратно в кровь и вызвать гормональный сбой.
- Недосыпание или бессонница. При длительных нарушениях сна, повышается уровень стресса, который связан с выбросом кортизола. Кортизол разрушает прогестерон и гормональный дисбаланс прогрессирует.
- Проблемы с избыточным весом. Жировая ткань помогает накапливаться токсинам и вновь попадать в кровь, перегружая печень. Эта нагрузка провоцирует накопление лишнего эстрогена.
- Ксеноэстрогены. Это гормоны, которые не относятся к организму человека, но имитируют действие эстрогена и блокируют работу настоящего гормона. Поступают они из окружающей среды – это синтетические вещества, содержащиеся в продуктах, косметике, бытовых предметах.
Для выявления гормонального дисбаланса необходимо обратиться к гинекологу-эндокринологу. Самолечение никогда не приводит к положительным результатам.
ОНЛАЙН-ЗАПИСЬ в клинику ДИАНА
Вы можете записаться по бесплатному номеру телефона 8-800-707-15-60 или заполнить контактную форму. В этом случае мы свяжемся с вами сами.
Как нормализовать гормональный фон?
Как лечить избыток эстрогенов у женщин? Для того чтобы наладить гормональный фон, убрать высокий уровень эстрогена у женщин, симптомы, придется серьезно заняться своим здоровьем. Врачи рекомендуют хорошо высыпаться, много гулять на свежем воздухе, стараться не нервничать. Хорошей профилактикой гормональных сбоев являются занятия спортом. Кроме того, стоит обратить внимание и на питание. Выработку эстрогена стимулируют соя, сыры, йогурты, бобовые, кофе и капуста.
Записаться на прием к специалисту, который после осмотра и анализов пропишет эффективное лечение можно уже сейчас, перейдя по ссылке https://45плюс.рф/registration/. Квалифицированный специалист подробно проанализирует избыток эстрогена у женщин, лечение, симптомы, пропишет ряд рекомендаций или медикаменты, которые наиболее подойдут именно вам с учетом всех особенностей организма.
Какие функции выполняет эстроген
Исследователи отмечают, что эстроген участвует в работе почти всех тканей в организме человека.
У девочек подростков эстроген участвует в половом созревании. Он несет ответственность за:
- Увеличение молочных желез;
- Рост лобковых волос и в подмышках;
- Начало месячных;
- Регулировку менструального цикла.
У взрослых женщин эстроген отвечает не только за менструальный цикл, но и за здоровье сердца, сосудов и костей, работу мозга и настроение, а также за состояние кожи. Он регулирует уровни плохого и хорошего холестерина, образование тромбов, состояние стенок сосудов.
Механизмы функционирования эстрогеновых рецепторов
В настоящее время выделяют четыре общих механизма реализации рецепторами своей функции (см. рис. 3). Это — прямой (direct), «классический» механизм; связанный с другими факторами транскрипции (TF), негеномный механизм регулирования и особняком выделяют лиганд-независимую активацию эстрогеновых рецепторов [5]. Имеет смысл разобрать каждый подробнее.
Рис. 3. Виды функционирования эстрогеновых рецепторов в клетке [5].
Классический механизм — самая обыкновенная активация рецептора лигандом (гормоном), который вместе с белками-корегуляторами как-то изменяет экспрессию отдельных генов.
Вторая модель несколько сложнее. Здесь рецептор взаимодействует с комплексом других факторов транскрипции, которые модулируют влияние рецептора на экспрессию гена. Это также очень важный регуляторный механизм.
Третий вид функционирования назван «негеномным», так как не затрагивает геном напрямую. Он гораздо менее изучен и реализует себя через определенный каскад реакций (на сегодняшний день неизвестных), следствием чего является изменение клеточной функции в виде открытия/закрытия ионных каналов, изменения концентрации NO в клетке. Эта модель опосредует «быстрые реакции», т. е. ответ на стимул происходит за считанные секунды. Предполагается, что в этом могут участвовать ER, непосредственно связанные с клеточной мембраной, а не свободно плавающие в цитоплазме; также есть гипотезы, что это вообще неэстрогеновые рецепторы (хотя и активируются эстрадиолом).
Предыдущие три механизма функционирования рецептора называют «лиганд-зависимыми», так как рецептор реагирует на гормон. Четвертый — лиганд-независимый способ активации рецептора — не предполагает участия специфического гормона. Любое высокоактивное вещество (например, фактор роста — GF — grows factor) связывается с мембранными рецепторами; это вызывает каскад разнообразных реакций, активацию протеинкиназ, которые, взаимодействуя уже с рецепторами эстрогена, фосфорилируют его; хотя имеются гипотезы, что протеинкиназы взаимодействуют не с ER, а с белками-корегуляторами [5].
Рецептор ER-α
Это — первый из двух обнаруженных типов рецептора к эстрогенам; он преимущественно синтезируется в органах и тканях репродуктивной системы — молочные железы, матка, шейка матки, влагалище и пр. [6].
Как и большинство рецепторов к стероидным гормонам, рецепторы эстрогена осуществляют свою функцию путем активации/деактивации экспрессии различных генов (геномная функция). Однако помимо этого существует и негеномная роль рецептора, которая проявляет себя гораздо быстрее, нежели произойдет реализация наследственной информации (как уже было упомянуто выше). Рецепторы, находясь в цитоплазме, могут связываться с аденилатциклазой, протеинкиназами, запуская определенный каскадный процесс. Именно негеномные функции эстрогеновых рецепторов представляют наибольший интерес для современных исследователей [1].
Например, эстрогеновый рецептор инициирует транскрипцию и в AP-1-сайтах (кодирующих белки AP-1) [7] с помощью комплекса белков-активаторов и репрессоров. AP-1 (activation proteins) представляют собой семейство различных факторов транскрипции, которые играют важную роль в регуляции клеточной цикла, димеризации и общей жизнеспособности клетки [8].
Рецептор ER-β
В 1996 году был выделен новый подтип рецептора к эстрогену, который получил название ER-β [3]. Исследователи изучили строение данного белка и выяснили, что он в целом достаточно гомологичен альфа-рецептору; однако имеются и отличия (см. рис. 4). Если кратко – высококонсервативный ДНК-связывающий домен практически идентичен (96% сходство), лиганд-связывающий – всего 58 % одинаковой структуры; остальные участки молекулы совершенно не совпадают или вовсе отсутствуют, как видно из рисунка 2. Этим же исследованием было продемонстрировано, что ER-β также активируется эстрадиолом, хотя сродство к нему несколько меньше, нежели у ER-α.
В отличие от ERα, данный подтип экспрессируется преимущественно в яичниках, яичках, простате, тимусе, селезенке, легких и гипоталамусе [6].
Рис. 4. Отличия в аминокислотной последовательности рецепторов ER-α и ER-β [3].
Рецептор GPER
В том же 1996 году был обнаружен еще один рецептор, который назвали «G-связанный рецептор» — GPR30 [9]. Во многих источниках этот белок фигурирует именно под таким названием, хотя официально в 2007 году ему присвоили звание самостоятельного G-связанного эстрогенового рецептора — GPER (G-protein coupled estrogen receptor) [10].
GPER – 7-сегментный доменный трансмембранный рецептор, который отвечает за особые реакции, которые названы «быстрыми эффектами» (англ. rapid effects), активируя различные каскадные сигнальные пути. Именно он отвечает за «негеномные» функции эстрогена. GPER связан с плазматической мембраной, а также с ЭПС и комплексом Гольджи, широко распространен в клетках печени, сердца, кишечника, яичников, ЦНС, поджелудочной железы, иммунокомпетентных клетках, адипоцитах и клетках репродуктивной системы [11].
Еще один новый эстрогеновый рецептор?
Не успели ученые опомниться от предыдущих открытий, как в 2002 году была опубликована статья [12], авторы которой уведомили об открытии нового эстрогенового рецептора, который назвали ER-X. Он связан с плазматической мембраной и в большой концентрации определяется в матке и головном мозге. Однако статья видится мне довольно сомнительной: авторы объясняют, почему обнаруженный ими рецептор не является ни альфа-, ни бета-подтипом, но в исследовании совершенно не упоминается GPER (который, как мы помним, тогда назывался GPR30).
На сегодня имеется очень скудный перечень литературы по данному вопросу. ER-X вскользь упоминается в обзоре 2013 года [2]; в это же самое время (в том же месяце – марте) опубликована другая статья, где говорится уже о нескольких новых рецепторах ER-X и ER-x [13], правда, автор вежливо называет их «кандидатами» на роль эстрогеновых рецепторов.
Как бы там ни было, пока что нет единого мнения, отнести ли обнаруженные новые рецепторы к эстрогенам, какую функцию они выполняют, и вообще – действительно ли это «новые» рецепторы, а не методологическая ошибка.
Сердечно-сосудистые заболевания
В этом вопросе женщины репродуктивного возраста имеют огромное преимущество. Активация ERα у мышей связана с более низкой степенью поражения сосудов атеросклерозом; эстроген путем воздействия на ERβ способен предотвратить кардиофиброз. А рецептор GPER способен уменьшить ишемическое поражение и сохранить функцию сердца в норме [2]. К сожалению, все эти преимущества сходят на нет с возрастом или оофорэктомией, а эффективность использования эстроген-заместительной терапии в качестве профилактики и лечения на сегодняшний день не доказана.
Источники:
- B. J. Csheskis, J. G. Greger, S. Nagpal, and L. P. Freedman, “Signaling by Estrogens,” J. Cell. Physiol., vol. 213, pp. 610–617, 2007.
- R. Li and Y. Shen, “Estrogen and brain : Synthesis , function and diseases,” Trends Mol. Med., vol. 19, pp. 197–209, 2013.
- S. Mosselman, J. Polman, and R. Dijkema, “ERβ: Identification and characterization of a novel human estrogen receptor,” FEBS Lett., vol. 392, no. 1, pp. 49–53, 1996.
- A. A. Gupte, H. J. Pownall, and D. J. Hamilton, “Estrogen : An Emerging Regulator of Insulin Action and Mitochondrial Function,” vol. 2015, 2015.
- N. HELDRING et al., “Estrogen Receptors: How Do They Signal and What Are Their Targets,” Physiol Rev, vol. 87, pp. 905–931, 2007.
- J. M. Hall, J. F. Couse, and K. S. Korach, “The Multifaceted Mechanisms of Estradiol and Estrogen Receptor Signaling,” J. Biol. Chem., vol. 276, no. 40, pp. 36869–36872, 2001.
- P. J. Kushner et al., “Estrogen receptor pathways to AP-1,” J. Stetoid Biochem. Biol., vol. 74, pp. 311–317, 2000.
- M. Karin, Z. g Liu, and E. Zandi, “AP-1 function and regulation.,” Curr. Opin. Cell Biol., vol. 9, no. 2, pp. 240–6, 1997.
- C. M. Revankar, D. F. Cimino, L. A. Sklar, J. B. Arterburn, and E. R. Prossnitz, “A transmembrane intracellular estrogen receptor mediates rapid cell signaling,” Science (80-. )., vol. 307, no. 5715, pp. 1625–1630, 2005.
- M. Barton, E. J. Filardo, S. J. Lolait, P. Thomas, M. Maggiolini, and E. R. Prossnitz, “Twenty years of the G protein-coupled estrogen receptor GPER: Historical and personal perspectives,” J. Steroid Biochem. Mol. Biol., vol. 176, pp. 4–15, 2018.
- G. Sharma, F. Mauvais-Jarvis, and E. R. Prossnitz, “Roles of G protein-coupled estrogen receptor GPER in metabolic regulation,” J. Steroid Biochem. Mol. Biol., vol. 176, no. 2016, pp. 31–37, 2018.
- C. D. Toran-Allerand et al., “ER-X: A Novel, Plasma Membrane-Associated, Putative Estrogen Receptor That Is Regulated during Development and after Ischemic Brain Injury,” J. Neurosci., vol. 22, no. 19, pp. 8391–8401, 2002.
- K. Soltysik and P. Czekaj, “Membrane estrogen receptors — is it an alternative way of estrogen action?,” J. Physiol. Pharmacol., vol. 64, no. 2, pp. 129–142, 2013.
- [14] N. J. Kenney, A. Bowman, K. S. Korach, J. C. Barrett, and D. S. Salomon, “Effect of exogenous epidermal-like growth factors on mammary gland development and differentiation in the estrogen receptor-alpha knockout (ERKO) mouse,” Breast Cancer Res. Treat., vol. 79, no. 2, pp. 161–173, 2003.
- P. Cowin, T. M. Rowlands, and S. J. Hatsell, “Cadherins and catenins in breast cancer,” Curr. Opin. Cell Biol., vol. 17, no. 5 SPEC. ISS., pp. 499–508, 2005.
- G. S. Prins, L. Birch, J. F. Couse, I. Choi, B. Katzenellenbogen, and K. S. Korach, “Estrogen Imprinting of the Developing Prostate Gland Is Mediated through Stromal Estrogen Receptor ␣ : Studies with ␣ ERKO and  ERKO Mice 1,” Environ. Prot., pp. 6089–6097, 2001.
- S. Artavanis-Tsakonas, M. D. Rand, and R. J. Lake, “Notch signaling: Cell fate control and signal integration in development,” Science (80-. )., vol. 284, no. 5415, pp. 770–776, 1999.
- H. A. Harris, “Estrogen Receptor-β: Recent Lessons from in vivo Studies,” Mol. Endocrinol., vol. 21, no. 1, pp. 1–13, 2007.
- J. F. Couse and K. S. Korach, “Estrogen receptor NULL mice: What have we learned and where will they lead us?,” Endocr. Rev., vol. 20, no. 3, pp. 358–417, 1999.
- I. Merchenthaler, M. V. Lane, S. Numan, and T. L. Dellovade, “Distribution of Estrogen Receptor α and β in the Mouse Central Nervous System: In Vivo Autoradiographic and Immunocytochemical Analyses,” J. Comp. Neurol., vol. 473, no. 2, pp. 270–291, 2004.
- E. Brailoiu et al., “Distribution and characterization of estrogen receptor G protein-coupled receptor 30 in the rat central nervous system,” J. Endocrinol., vol. 193, no. 2, pp. 311–321, 2007.
- F. Lizcano and G. Guzmán, “Estrogen deficiency and the origin of obesity during menopause,” Biomed Res. Int., vol. 2014, 2014.
- C. A. Stuenkel, “Menopause, hormone therapy and diabetes,” Climacteric, vol. 20, no. 1, pp. 11–21, 2022.
- H. Samavat and M. S. Kurzer, “Estrogen metabolism and breast cancer,” Cancer Lett., vol. 356, no. 2, pp. 231–243, 2015.
- R. J. Santen, W. Yue, and J. P. Wang, “Estrogen metabolites and breast cancer,” Steroids, vol. 99, no. Part A, pp. 61–66, 2015.
- J. Viña and A. Lloret, “Why women have more Alzheimer’s disease than men: Gender and mitochondrial toxicity of amyloid-β peptide,” J. Alzheimer’s Dis., vol. 20, no. SUPPL.2, pp. 527–533, 2010.
- R. Li, P. He, J. Cui, M. Staufenbiel, N. Harada, and Y. Shen, “Brain endogenous estrogen levels determine responses to estrogen replacement therapy via regulation of BACE1 and NEP in female Alzheimer’s transgenic mice,” Mol. Neurobiol., vol. 47, no. 3, pp. 857–867, 2013.
- B. B. Sherwin and J. F. Henry, “Brain aging modulates the neuroprotective effects of estrogen on selective aspects of cognition in women: A critical review,” Front. Neuroendocrinol., vol. 29, no. 1, pp. 88–113, 2008.
- M. Bourque, D. E. Dluzen, and T. Di Paolo, “Signaling pathways mediating the neuroprotective effects of sex steroids and SERMs in Parkinson’s disease,” Front. Neuroendocrinol., vol. 33, no. 2, pp. 169–178, 2012.
Признаки дисбаланса гормонов
Слаженная работа всех гормонов — хитро-сплетенная система, нарушить которую могут стресс, наследственность, заболевания, курение, набор или снижение веса и прием некоторых лекарств.
Наиболее частые симптомы низкого уровня эстрогена:
- Редкие месячные или их прекращение;
- Приливы жара или потливость ночью;
- Проблемы со сном;
- Сухость влагалища;
- Перепады настроения;
- Низкое либидо;
- Сухость кожи.
Как правило, низкий уровень эстрогена наблюдается после наступления менопаузы — периода прекращения месячных и созревания яйцеклеток, который обычно наступает после 45 лет. Так как это состояние связано с повышенным риском болезней сердца и остеопороза, женщинам рекомендуется обсудить с гинекологом начало заместительной гормональной терапии.
Проверенного способа отсрочить начало менопаузы не существует. Отказ от курения, сбалансированный рацион, физическая активность, управление стрессом, помогут чувствовать себя лучше и снизить риск заболеваний, лечение которых может привести к развитию менопаузы до 45 лет.
Кроме менопаузы привести к низкому уровню эстрогенов может голод и низкий индекс массы тела. По этой причине у женщин пропадали месячные в период Второй мировой войны.
Симптомы высокого уровень эстрогена:
- Набор веса;
- Проблемы с менструациями;
- Низкое либидо;
- Усталость;
- Чувство тревоги и депрессии.
Высокий уровень эстрогена может возникнуть после менопаузы у женщин с высоким индексом массы тела, так как в этом случае его будет производить жировая ткань. Это увеличивает риск развития злокачественных опухолей молочных желез.
Как снизить риск рака груди
Ожирение у девочек ускоряет начало полового созревания и менструаций, а дефицит веса может, наоборот, их отсрочить.
У женщин любого возраста повышенный уровень эстрогена может приводить к утолщению эндометрия и связанных с этим заболеваниям — эндометриозу и раку эндометрия.
Во время беременности уровень эстрогена тоже может быть высоким, но в этом нет ничего страшного. Это нормальное состояние, и его уровень вернется в норму после родов.
Дисбаланс эстрогена можно спутать с другими заболеваниями и состояниями. Поэтому при наличии симптомов рекомендуется проконсультироваться со специалистом. Он поможет выяснить, в чем причина проблем, и назначит необходимое лечение.
МЕТАБОЛИЗМ ЭСТРОГЕНОВ У ЖЕНЩИН
(общие представления и клиническая практика)
ЧАСТЬ II
МЕТАБОЛИЗМ ЭСТРОГЕНОВ У ЖЕНЩИН (ОБЩИЕ ПРЕДСТАВЛЕНИЯ И КЛИНИЧЕСКАЯ ПРАКТИКА).
ЧАСТЬ 2. ЛЕЧЕНИЕ ГИПЕРЭСТРОГЕНЕМИИ
Доминирование эстрогенов является достаточно частым нарушением метаболизма женских половых гормонов и проявляется развитием у женщины следующих заболеваний: эндометри-оз, полипы эндометрия, дисплазия шейки матки, фиброзно-кистозная мастопатия, фибромиома матки и т.д. Наличие перечисленных заболеваний у пациентки свидетельствует о нарушении метаболизма эстрогенов, причем степень метаболического дисбаланса находится за пределами компенсаторных возможностей организма. Мириться с этими болезнями нельзя, так как усугубление нарушения метаболизма эстрогенов может привести к развитию злокачественных новообразований матки и молочной железы. По нашему мнению, использовать для лечения этих заболеваний синтетические гормоны нежелательно. Это связано с тем, что метаболизм синтетических гормонов в основном происходит по генотоксическому пути и, кроме того, они могут блокировать ключевые ферменты, которые детоксицируют женские половые гормоны. Так, по данным исследований, метаболиты синтетических гормонов эквилин и эквивелин преобразуются в печени в 4-гидрокси-о-квинон-глютатион конъюгаты. Насыщенное бета-кольцо этих гормонов переключает синтез 2-гидроксиметаболитов женских половых гормонов на 4-гидрокси-путь. [1]. Помимо этого, эндогенный 4-гидроксиэстрон обладает более слабым эффектом в отношении индуцирования повреждений ДНК и апоптоза в клеточных культурах рака молочной железы по сравнению с 4-гидроксиэквиленином [2]. О влиянии метаболитов синтетических гормонов на активность ключевых ферментов детоксикации свидетельствуют следующие данные. Так, 4-гид-роксиэквиленин является необратимым ингибитором СОМТ, которая катализирует метилирование 4-гидроксиэстрадиола [3]. 4-гидрокси-эквиленин, так же как 4,17-гидроксиэквиленин. существенно снижает активность глютатион-S-трансферазы буквально через несколько МИНУТ после введения в организм [4].
1 ПРИЧИНЫ ЗАБОЛЕВАНИЙ
Первостепенная задача врача перед началом лечения заключается в том, чтобы постараться найти причины, которые привели к развитию этих заболеваний.
Вот далеко не полный их перечень: курение, прием гормональных препаратов, хроничесюш стресс, некачественное и несбалансированное питание, воздействие токсических веществ на производстве и в быту (фталаты, пестициды, тяжелые металлы и т.д.), чрезмерные физические нагрузки, недостаточное потребление витаминов, минералов, незаменимых жирных кислот, антиоксидантов, сопутствующие заболевания, в частности, заболевания органов пищеварения, эндокринных органов, ожирение и т.д.
Особое внимание хотелось бы обратить на постоянный или периодический прием фармацевтических средств. Оказывается, ряд лекарств достаточно негативно воздействует на обмен женских половых гормонов. Так. препарат, который широко используется для лечения язвенной болезни и заболеваний, связанных с повышенной кислотностью — омепразол. является мощным стимулятором цитохрома Р-450 1В1, активация которого приводит к ТОМУ, что в организме женщины образуется больше конпе-рогенного метаболита эстрогенов — 4-гидрокси-эстрона. Фенобарбитал и другие барбитфать:. сахароснижающие препараты (троглитаэон, пиоглитазон), противотуберкулезные препараты (рифампицин) сильно активируют работу другого фермента — цитохрома ЗА4, превращающего эстрон в 16-гидроксиэстрон. Последний представляет собой очень активный метаболит женских половых гормонов, повышение концентрации которого связывают с долгосрочным риском рака матки и молочной железы.
2 ЛЕЧЕНИЕ. ОСНОВНЫЕ НАПРАВЛЕНИЯ КОРРЕКЦИИ МЕТАБОЛИЗМА ЭСТРОГЕНОВ
Основным объектом воздействия лечения в случае доминирования эстрогенов является коррекция метаболизма женских половых гормонов. Подобная тактика позволит не только успешно вылечить заболевание, но и устранить возможность повторного рецидива болезни.
1. Стимулирование предпочтительного (2-гидрокси-) пути детоксикации женских половых гормонов
Очень часто у пациенток с гиперэстрогенемией выявляется низкий уровень 2-гидроксиэстрон — «хорошего» метаболита женских половых гормонов, что свидетельствует о сниженной активности этого пути превращения гормонов. Для его стимулирования, прежде всего, необходимо: уменьшить вдвое количество выкуриваемых сигарет (бензопирен — токсин, который образуется в результате курения, разрушается по этому же пути). В рационе необходимо увеличить потребление сырых крестоцветных овощей (капуста, брюссельская капуста, брокколи, кресс-салат, цветная капуста), а также назначить следующие препараты: индол-3-карбинол (I3C), соевые изофлавоны, омега-3 жирные кислоты.
А. Индол-З-карбинол (I3C)
Индол-З-карбинол (I3C) — мощный активатор цитохрома Р450 1А1, который превращает эстрогены в 2-гидроксиметаболиты. Это вещество получают из крестоцветных овощей, и оно очень нестабильно. Поэтому препараты высокого качества всегда имеют капсулированную форму, в которую добавляют антиоксидант для стабилизации, и обычно срок годности их не превышает 1 года с момента производства. Доза I3C должна составлять 300-450 мг в сутки. Длительность лечения не менее 3 месяцев и определяется по данным повторных лабораторных исследований. Восстановление нормальной концентрации 2-гидроксиэстрогенов и соотношения 2-гидрокси- к 16-гидроксиэстрогенам является основанием для прекращения терапии или перевода на поддерживающую дозу.
Благодаря мощной активации цитохрома Р450 1А1 в организме женщины происходит возрастание концентрации 2-гидроксиэстрогенов, наиболее предпочтительных метаболитов в период до менопаузы [5].
Кроме стимулирования 2-гидроксилирования I3C оказывает множество разнообразных воздействий на клетки организма. Так, было установлено, что I3C стимулирует апоптоз предраковых и раковых клеток молочной железы, и этот эффект связан с тем, что I3C блокировал активацию NF-kappa-B, вызванную трансфекцией Akt гена. Благодаря такому эффекту авторы статьи пришли к заключению, что I3C обладает превентивным действием в отношении некоторых форм рака молочной железы [6]. Полученные данные согласуются с результатами других исследований, которые показали, что I3C индуцирует апоптоз клеток рака молочной железы независимо от р53 и Ьах генов [7]. Подобные данные были получены и при исследовании клеток рака предстательной железы. I3C стимулировал апоптоз этих клеток за счет снижения активации NF-kappa-B и ингибировал их рост благодаря торможению GT фазы клеточного цикла [8]. Исследование влияния I3C на клетки шейки матки показало, что он ингибировал антиапоптотический эффект эстрадиола на эпителиальные клетки, подвергшиеся воздействию потенциальных мутагенных субстанций [9].
Исследование влияния I3C на клеточные линии эпителиальных клеток толстой кишки человека показало, что это вещество обладает противораковым действием благодаря СТИМУЛЯЦИИ апоптоза и усилению детоксикационных возможностей клеток в ответ на воздействие потенциальных мутагенных субстанций [10]. Приведенные данные согласуются с результатами исследований, показавших, что I3C уменьшает риск рака и полипов толстой кишки на экспериментальных моделях животных [11].
Противораковое действие I3C связано не только с его влиянием на метаболизм эстрогенов. Так, установлено, что I3C блокирует анги-огенез в ткани опухоли [12]. оказывает влияние на канцерогенез благодаря связыванию свободных радикалов [13]. I3C также повышает активность глютатион-Б-трансферазы и квинонредуктазы. Это приводит к снижению концентрации квинонов и семиквинонов — канцерогенных метаболитов женских половых гормонов [14]. Индукция детоксикационных ферментов второй фазы детоксикации, таких как глютатион-Б-трансфераза, повышает защиту клеток организма от соединений, которые обладают мутагенным действием. Так, было обнаружено, что I3C индуцирует активность, по крайней мере, 11 различных ферментов второй фазы детоксикации [15].
Таким образом, анализируя вышеприведенные научные данные, можно утверждать, что I3C стимулирует 2-гидрокси-путь — предпочтительный путь детоксикации женских половых гормонов, обладает модулирующим действием на рецепторы эстрогенов, стимулирует апоптоз раковых клеток, обладает антиоксидантными свойствами и стимулирует ферменты как первой, так и второй фаз детоксикации в организме.
Б. Соевые изофлавоны
В случае гиперэстрогенемии положительный эффект мы получали от применения соевых изофлавонов. Существует несколько механизмов их терапевтического действия. Прежде всего, соевые изофлавоны стимулируют 2-гидроксилирование эстрогенов и таким образом увеличивают соотношение 2- к 16-гидроксиэстрогенам. Некоторые авторы рассматривают этот эффект соевых изофлавонов в контексте их противоракового действия [16]. Потребление соевых изофлавонов в дозе 65-132 мг в день снижало экскрецию 4-гидроксиэстрона, потенциально канцерогенного метаболита эстрогенов у женщин в период менопаузы [17]. Подобные данные были получены и при исследовании влияния соевых изофлавонов на метаболизм женских половых гормонов в период до менопаузы [18]. Еще одним положительным эффектом соевых изофлавонов является их способность индуцировать синтез белка, связывающего половые гормоны, в сыворотке крови. Повышение его концентрации уменьшает биодоступность эстрадиола для эстроген-чувствительных тканей [19].
Терапевтическая доза соевых изофлавонов должна составлять 90-180 мг в день в течение нескольких месяцев. Прекращение или перевод на поддерживающую дозу 45-90 мг проводится только после достижения нормальных значений уровней эстрогенов и их метаболитов и при условии клинической регрессии заболеваний.
Следует помнить, что соевый белок не может быть хорошим источником изофлавонов, так как они теряются во время промышленной обработки сои.
В. Другие факторы, влияющие на метаболизм эстрогенов
Оказалось, что потребление омега-3 жирных кислот стимулирует 2-гидроксилирование эстрогенов. Однако механизм действия омега-3 жиров остается неизвестным.
Изучение уровня физической активности у женщин показало, что дозированные физические нагрузки повышают соотношение 2- к 16-гидроксиэстрогенам [20].
2. Ингибирование нежелательных (16-гидрокси- и 4-гидрокси-) путей метаболизма женских половых гормонов
Как упоминалось ранее, 16- и 4-гидрокси-пути метаболизма женских половых гормонов менее желательны для женщин в период до менопаузы. Поэтому снижение активности ферментов, которые участвуют в метаболизме эстрогенов по этим путям, является достаточно важной терапевтической задачей.
Снижение активности цитохрома Р450 ЗА4 приведет к снижению образования 16-гидроксиэстрона — метаболита, который в 8 раз активнее эстрадиола и таким образом существенно ослабит его действие на рецепторы к эстрогенам. Наиболее мощным ингибитором активности цитохрома Р450 ЗА4 является нарингенин — флавоноид, содержащийся в грейпфрутах. По данным некоторых исследований, один стакан грейпфрутового сока снижает активность цитохрома Р450 ЗА4 на 30% в течение 12 часов [21]. Другими натуральными ингибиторами активности этого фермента могут быть корень солодки, чеснок и зверобой.
Снижение активности цитохрома Р450 1В1 возможно с помощью изофлавонов, обнаруженных в растении кюдзю (Pueraria lobata). Наиболее активным изофлавоном этого растения является пуэрарин, который обладает способностью ингибировать активность некоторых цитохро-мов Р450. Было установлено, что он ингибирует активность цитохромов ЗА, 2Е1 и 2В1, поэтому может снижать образование 4-гидроксиэстроге-нов. Помимо этого он стимулирует активность цитохрома 1А2, что вызывает увеличение продукции 2-гидроксиэстрогенов [22].
3. Модулирование функции рецепторов женских половых гормонов
А. Соевые изофлавоны
Соевые изофлавоны обладают способностью модулировать рецепторы эстрогенов.
Исследования in vitro и in vivo показали, что эстрогены оказывают слабый эстрогенный эффект, который примерно в 1000 раз слабее эффекта эстрадиола [23]. В другом исследовании было показано, что изофлавоны, связываясь с рецепторами эстрогенов, могут конкурировать с эстрадиолом за рецептор или даже блокировать функцию рецептора [24].
Б. Индол-З-карбинол (I3C)
Было показано, что продукт метаболизма I3C в организме может выступать в качестве лиганда к рецепторам эстрогенов и демонстрировать эффект, похожий на тамоксифен, в отношении эстроген-зависимых тканей [25].
В других исследованиях показано, что 13С является антагонистом ос-эстрогеновых рецепторов. Кроме того, это вещество, с одной стороны, супрессирует эстроген-чувствительные гены pS2 и катепсин-D, а с другой — повышает активность гена BRCA1, который, в свою очередь, блокирует транскрипционную активность альфа-рецептора эстрогенов [26].
В. Нарингенин и ресвератрол
Нарингенин — флавоноид, содержащийся в грейпфрутах, и антиоксидант ресвератрол, имеющийся в красном винограде, влияют на передачу сигналов эстрогенов благодаря прямому и непрямому блокирующему эффекту на а-рецептор эстрогенов [27]. Причем механизм действия этих нутриентов различен [28].
Г. Витамин В6
Пиридоксин (витамин В6) влияет на передачу сигналов стероидных гормонов, в том числе и эстрогенов. Исследования показали, что витамин В6 взаимодействует с гормон-рецептор-ным комплексом и снижает его связывание с ДНК и таким образом нарушает передачу гормонального сигнала к ДНК клетки [29]. Исходя из этого, пациентки с высоким уровнем эстрогенов должны получать достаточно высокие дозы витамина В6 (30-50 мг в сутки).
4. Борьба с оксидативным стрессом
Оксидативный стресштриводит к образованию семиквинонов и квинонов — метаболитов женских половых гормонов, вызывающих необратимые повреждения ДНК клеток. Для борьбы с оксидативным стрессом следует выполнить две задачи. Во-первых, обеспечить необходимыми нутриентами собственную антиоксидантную систему. Так. медь и цинк необходимы для супероксиддисмллазы. селен и ацетилцис-теин — для глютатионпероксидазы. витамин ВЗ — для глютатионредуктазы. железо — для каталазы. Во-вторых, назначить растительные антиоксиданты, такие как катехины зеленого чая, ликопен, куркума, лимонен, витамины С и Е, |3-каротин, способные инактивировать реакционные частицы кислорода.
5. Поддержание ферментов второй фазы детоксикации, которые принимают участие в окончательной инактивации женских половых гормонов
Лечебные мероприятия для поддержания окончательной элиниминации женских половых гормонов должны охватывать 3 основных пути второй фазы детоксикации.
А). Важным условием нормального функционирования процессов метилирования в организме является потребление достаточного количества белка. Это связано с тем, что универсальным донором метиловых группировок в организме является s-аденозин-метионин, который, в свою очередь, образуется из аминокислоты метионина, потребляемой, в основном, с животным белком. Поэтому необходимо провести всестороннюю оценку питания женщины и в случае недостаточного потребления белка ввести в рацион белковую пишу. Для точной оценки потребности в белке лучше использовать специальные компьютерные программы, позволяющие не только правильно оценить качество рациона женщины, но и восстановить обнаруженный дисбаланс. С этими программами можно ознакомиться на сайте www.anti-aging.kiev.ua.
Помимо белка для процессов метилирования необходимы микронутриенты, являющиеся кофакторами ферментативных систем метилирования.’ Поэтому в лечебный план должны входить следующие витамины и минералы:
— фолиевая кислота в дозе 400-1000 мг в сутки;
— витамин В6 в дозе 10-40 мг в сутки;
— витамин В2 в дозе 15-30 мг в сутки;
— витамин В12 в дозе 250-500 мкг в сутки;
— магний в дозе 400-800 мг в сутки.
Однако не у всех пациенток вышеприведенная терапия может оказаться эффективной. Это связано с тем, что примерно у 25% европейцев обнаруживается генетический полиморфизм MTHFR- ключевого фермента процессов метилирования в организме. У этих пациентов восстановить процессы метилирования можно или с помощью метилированной формы фолиевой кислоты (5-метил-тетрагидрофолата), или с помощью соляно-кислого бетаина, выступающего донором метиловых группировок, независимо от 5-метил-тетрагидрофолата. Таким образом, если не известны генетические особенности пациентки, лучше назначать комплекс витаминов группы В, содержащий метилированную форму фолиевой кислоты и соляно-кислый бетаин.
Б). Конъюгирование с глютатионом участвует в инактивации квинонов, генотоксических метаболитов женских половых гормонов. Для нормального протекания этой реакции необходим N-ацетилцистеин — аминокислота, ограничивающая синтез глютатиона. Показано, что назначение этой аминокислоты приводит к существенному возрастанию концентрации восстановленного глютатиона в тканях и ускорению протекания конъюгирующих реакций с глютатионом [30]. Силимарин также стимулирует эндогенный синтез глютатиона [31].
В). Для поддержания активности сульфитации следует назначать молибден и неорганические сульфаты.
Г). Для активации процессов глюкуронизации необходима глюкоза. Поэтому абсолютная недостаточность инсулина или инсулиноре-зистентность, которые сопровождаются снижением концентрации глюкозы внутри инсулин-зависимых клеток, всегда сопровождаются в той или иной степени нарушениями глюкуронизации. Помимо углеводного обмена на активность процессов глюкуронизации активно влияет трийодтиронин — самый активный гормон щитовидной железы. ТЗ стимулирует экспрессию генов УДФ-глюкоронозилтранс-феразы, причем эта активация зависит от обеспеченности организма витамином А [32]. Наряду с ТЗ глюкозонилаты, присутствующие в кресс-салате и других крестоцветных овощах, являются мощными индукторами ключевого фермента глюкуронизации — УДФ-глюкороно-зилтрансферазы [33]. Подобным эффектом обладает и экстракт артишока [34].
6. Предупреждение тонкокишечно-печеночной рециркуляции женских половых гормонов
Для предупреждения всасывания женских половых гормонов в кишечнике, прежде всего, необходимо потреблять достаточное количество клетчатки. Женщины, которые следуют этой рекомендации, имеют в крови более низкий уровень эстрогенов [35]. Наиболее активно сорбирует эстрогены соевая клетчатка и клетчатка семян льна. Большую роль в рециркуляции эстрогенов из кишечника играет (З-глюкурони-даза, фермент бактерий, который отщепляет глюкуроновую кислоту от детоксицированых соединений (эстрогенов). Наиболее сильным ингибитором активности этого фермента является кальция глюкарат — нутриент, присутствующий в некоторых овощах [36]. Кроме этого силимарин и корень солодки также снижают его активность [37].
7. Снижение активности ароматазы
Как упоминалось ранее, ароматаза — это фермент, превращающий андоростендион в эстрон и тестостерон — в эстрадиол. Однако в некоторых случаях (при ожирении, воздействии гербицидов [38], воздействии пестицидов [39, 40], избыточном потреблении алкоголя [42]) активность этого фермента существенно возрастает, что приводит к образованию большого количества эстрогенов. О высокой активности фермента свидетельствует нормальный или с тенденцией к снижению уровень андростен-диона и тестостерона в периферической крови, сопровождающийся высокой концентрацией эстрадиола и эстрона. На сегодня существует достаточно большое количество ингибиторов ароматазы, использующихся для лечения рака молочной железы. Среди этих препаратов можно выделить «Anastrasol», «Arimidex». Кроме того, существует ряд натуральных соединений, которые обладают способностью снижать активность фермента. Среди них можно выделить кризин, апигенин, нарингенин [41]. Однако использовать ингибиторы ароматазы необходимо с осторожностью, так как их назначение может вызвать относительное или абсолютное доминирование андрогенов. Это приведет к появлению акне, особенно непосредственно перед менструацией или в период менструации, образованию кист в яичниках и других симптомов доминирования андрогенов.
3 ЗАКЛЮЧЕНИЕ
Таким образом, в лечении заболеваний, связанных с доминированием эстрогенов, появилась безопасная и высоко эффективная альтернатива гормонотерапии и терапии, направленной на ингибирование секреции гонадотропинов, которая оказывает достаточно стойкий положительный эффект на течение заболевания. Хорошие клинические результаты этого подхода обусловлены воздействием лечения на причины, которые привели к доминированию эстрогенов, пониманием всей сложной цепочки метаболизма эстрогенов, комплексным подходом к коррекции гормональных нарушений и использованием безопасных натуральных соединений, которые оказывают мощное модулирующее действие на процессы превращения эстрогенов.
БИБЛИОГРАФИЯ
- Zhang F, Chen Y, Pis ha E, Shen L, Xiong Y, van Breemen KB, Bolton JL. The major metabolite of equilin, 4-hydroxyequilin, autoxidizes to an o-quinone which isomerizes to the potent cytotoxin 4-hydroxyequiknin-o-quinone. Zhang E, Chem Res Toxicol 1999 12(2):204-213.
- Chen Y, Liu X, Pisha E, Constantinou AI, Hua Y, Shen L, van Breemen RB, Elguindi EC, Blond SY, Zhang F, Bolton JL. A metabolite of equine estrogens, 4-hydroxyequilenin, induces DNA damage and apoptosis in breast cancer cell lines. Chem Res Toxicol (United States) May 2000, 13(5):342-350.
- Yao J, Li Y, Chang M, Wu H, Yang X Goodman JE, Liu X Liu H Mesecar AD, Van Breemen RB, YagerJD, Bolton JL. Catechol estrogen 4-hydroxyequilenin is a substrate and an inhibitor of catechol-O-methyltransferase. Chem Res Toxicol (United States) May 2003;16(5):668-675.
- Yao J, Chang M, Li Y, Pisha E, LiuX, Yao D, Elguindi EC, Blond SY, Bolton JL. Inhibition of cellular enzymes by equine catechol estrogens in human breast cancer cells: specificity for glutathioneS-transferase Pl-1. Chem Res Toxicol (United States) Jul 2002;15(7):935-942.
- Michnovicz JJ, Adlercreutz H, Bradlow HL. Changes in levels of urinary estrogen metabolites after oral indole-3-carbinol treatment in humans. J Natl Cancer Inst, May 21 1997;89(10):718-723.
- Rahman KM, Li Y, Sarhar FH. Inactivation of akt and NF-kappaB play important roles during indole-3-carbinol-induced apoptosis in breast cancer cells. Nutr Cancer 2004;48(l):84-94.
- Ge X Fares FA, Yannai S. Induction of apoptosis in MCF-7 cells by indole-3-carbinol is independent of p53 and bax. Anticancer Res, Jul-Aug 1999; 19(4B):3199-3203.
- Chinni SR, Li Y, Upadhyay S, Koppolu PK, Sarhar FH. Indole-3-carbinol (I3C) induced cell growth inhibition, Gl cell cycle arrest and apoptosis in prostate cancer cells. Oncogene May 24 2001;20(23):2927-2936.
- Chen D, Carter TH, Auborn KJ. Apoptosis in cervical cancer cells: implications for adjunct anti-estrogen therapy for cervical cancer. Anticancer Res Sep-Oct 2004;24(5A):2649-2656.
- Bonnesen C, Eggleston IM, Hayes JD. Dietary indoles and isothiocyanates that are generated from cruciferous vegetables can both stimulate apoptosis and confer protection against DNA damage in human colon cell lines. Cancer Res (United States) Aug 15 2001;61(16):6120-6130.
- Kim DJ Shin DH, Ahn B, KangJS, Nam KT, Park CB, Kim CK, HongJT, Kim YB, Yun YWJangDD, YangKH. Chemoprevention of colon cancer by Korean food plant components. Mutat Res Feb-Mar 2003;523-524:99-107.
- Chang X, Той JC, Hong C, Kim HA, Riby JE, Firestone GL, Bjeldanes LF. 3,3′-Diindolylmethane inhibits angiogenesis and the growth of transplantable human breast carcinoma in athymic mice. Carcinogenesis Apr 2005;26(4):771-778.
- ArnaoMB, Sanchez-Bravo J, Acosta M. Indole-3-carbinol as a scavenger of free radicals. Biochem Mol Biol Int (Australia) Aug 1996;39(6): 1125-1134.
- Staack R,KingstonS] Wallig MA, Jeffery EH. A comparison of the individual and collective effects of four glucosinolate breakdown products from brussels sprouts on induction of detoxification enzymes. Toxicol Appl Pharmacol Mar 1998;149(l):17-23.
- Wallig MA,KingstonS, Staack R, Jefferey EH. Induction of rat pancreatic glutathione S-transferase and quinone reductase activities by a mixture of glucosinolate breakdown derivatives found in Brussels sprouts. Food Chem Toxicol (England) May 1998;36(5):365-373.
- Kishida T, Beppu M, Nashiki К Izumi T, Ebihara К Effect of dietary soy isoflavone aglycones on the urinary 16alpha-to-2-hydroxyestrone ratio in СЗН/HeJ mice. Nutr Cancer (United States) 2000;38(2):209-214.
- Xu X,DuncanAM, Wangen KE, Kurzer MS. Soy consumption alters endogenous estrogen metabolism in postmenopausal women. Cancer Epidemiol Biomarkers Prev Aug 2000;9(8):781-786.
- XuX Duncan AM, Merz BE, Kurzer MS. Effects of soy iwflavones on estrogen and phytoestrogen metabolism in premenopausal women. Effects of soy isoflavones cm estrogen and phytoestrogen metabolism in premenopausal women. Cancer Epidemiol Biomarkers Prev Dec 1998;7(12):1101-1108.
- Adlercreutz H, Hockerstend K, Bannwart, et al. Effect of dietary components, including lignans and phytoestrogens, on enterohepatic circulation and liver metabolism of estrogens and on sex hormone-binding globulin (SHBG). J Steroid Biochem 1987;2 7(4-6):1135-1144.
- Matthews CE, FowkeJH, Dai Q, Leon Bradlow H,Jin F, Shu XO, Gao YT, Longcope C, HebertJR Zheng W. Physical activity, body size, and estrogen metabolism in women. Cancer Causes Control (Netherlands) Jun 2004;15(5):473-481.
- Yee GC, Stanley DL, Pessa LJ, et al. Effect of grapefruit juice on blood cyclosporine concentration. Lancet 1995;345:955-956.
- Guerra MC, Speroni E, Brocolli M, et al. Companion between Chinese medical herb Pueraria lobata crude extract and its main isoflavone puerarin. Antioxidant properties and effects on rat liver CYP-catalysed drug metabolism. Life Set 2000;67:2997-3006.
- Miksicek RJ. Commonly occurring plant flavonoids have estrogenic activity. Mol Pharmacol 1993;44:37-43.
- Pollard JW. Modifiers of estrogen action. Sci Med Jul/Aug 1999:38-47.
- Riby JE, Feng C, Chang YC, Schaldach CM, Firestone GL, Bjeldanes LF. The major cyclic trimeric product of indole-3-carbinol is a strong agonist of the estrogen receptor signaling pathway. Biochemistry (United States) Feb 8 2000;39(5):910-918.
- Meng Qj Yuan F, Goldberg ID, Rosen EM, Aubom K, Fan S. Indole-3-carbinol is a negative regulator of estrogen receptor-alpha signaling in human tumor cells. J Nutr Dec 2000;130(12):292 7-2931.
- Yoon K, Pellaroni L, StonerM, Gaido K, Safe S. Differantial activation of wild-type and variant forms of estrogen receptor a by synthetic and natural estrogenic compounds using a promoter containing three three estrogen-responsive elements. J Steroid Biochem Mol Biol 2001;78:25-32.
- Yoon K, Pellaroni L, Ramamoorthy K, Gaido K, Safe S. Ligand structure-dependant differences in activation of estrogen receptor alfa in human HepG2 liver and U2 osteogenic cancer cell lines. Mol. Cell Endocrinol 2000;162:211-220.
- Bender DA. Novel function of vitamin B6. Proceedings Nutr Soc 1994;53:625-630.
- DeFlora S, Benniceli C, Camoiriano A et al. In vivo effects of N-acetylcysteine on glutatione metabolism and on biotransformation of carcinogen and/or mutagenic compounds. Carcinogenesis. 1985;6:1735-1745.
- Wellington K,Jarvis B. Silymarin: a review of its clinical properties in the management of hepatic disordes. BioDrugs 20()1;15(7): 465-489.
- Haberkorn V, HeydelJM, MounieJ, Artur Y, Gaudonnet H. Influence of vitamin A status on the regulation of uridine (5~~-) diphosphate-glucuronosyltransferase (UGT) 1A1 and UGT1A6 expression by L-triiodthyronine. British J Nutr 2001;85:289-297.
- Kassie F, Robot S, Uhl M et al. Chemoprotective effects of garden cress (Lepidium sativum) and its constituents towards 2-amino-3-methyl-imidazol[4,5-f]quinolin (IQJ-induced genotoxic effects and colonic preneoplastic lesions. Carcinogenesis 2002;23(7):1155-1161.
- KirchhoffR Beckers CH, KirchhoffGM, Trinczek-Gartner H. Petrowicz O, Reimann HJ. Increase in choleresis by means of artichoke extract. Phytomed 1994;1:107-115.
- Goldin BR Adlercreutz H, Gorbach SL. Et al. Estrogen excretion patterns and plasma levels in vegetarian and omnivorous women. New EnglJ Med 1982;307:1542-1547.
- Dwivedi C, Heck Wf, Downie AA, Larroya S, Webb ТЕ. Effect of calcium glucarate on fl-glucoronidase activity and glucarate content of certain vegetables and fruits. Biochem Med Metab Biol 1990;43:83-92.
- KumagaiA, Nishino K, Shimomura A, Kin T, Yamamura. Effect of glycyrrhizin on estrogen action. Endocrinol Japan 1967;14(l):34-38.
- HeckerM, Park JW, Murphy MB, Jones PD, Solomon KR, Van DerKraak G, CanJ A, Smith EE, du Preez L, Kendall RJ, Giesy JP. Effects of atrazine on CYP19 gene expression and aromatase activity in testes and on plasma sex steroid concentrations of male African clawed frogs (Xenopus laevis). ToxicolSci (United States) Aug 2005;86(2):273-280.
- Holloway AC, Stys KA, Foster. DDE-induced changes in aromatase activity in endometrial stromal cells in culture. Endocrine (United States)Jun 2005;27(1):45-50.
- Sanderson JT, Boerma J, Lansbergen GW, van den Berg M, Induction and inhibition of aromatase (CYP19) activity by various classes of pesticides in H295R human adrenocortical carcinoma cells. Toxicol Appl Pharmacol (United States) Jul 1 2002;182(l):44-54.
- Sanderson JT, HordijkJ, Denison MS, Springs teel MF, Nantz MH, van den Berg M. Induction and inhibition of aromatase (CYP19) activity by natural and synthetic flavonoid compounds in H295R human adrenocortical carcinoma cells. ToxicolSci (United Stales) Nov 2004;82(l):70-79.
- Etique N, Chardard D, Chesnel A, Merlin JE, Flament S, Grillier-Vuissoz I. Ethanol stimulates proliferation, ERalpha and aromatase expression in MCF-7 human breast cancer cells. Int J Mol Med (Greece) Jan 2004;13(l):149-55.
Болезнь Паркинсона
Еще одно распространенное нейродегенеративное заболевание; в отличие от болезни Альцгеймера, в этом случае женщины имеют более низкий риск. При этом заболевании страдает в большей степени стриатум и черное вещество – структуры, где экспрессируются все три типа эстрогеновых рецепторов; наиболее выражено влияние ERα, который обеспечивает протекцию дофаминергических нейронов [2].
Имеются данные, что эстрадиол, воздействуя на все три типа рецепторов мозга, способен оказать существенное нейропротекторное действие у особей обоих полов; разрабатываются стратегии, способные применить эти данные в терапии болезни Паркинсона, однако все они еще нуждаются в подтверждении [29].