Актуальность
Кардиологические операции с использованием кардиопульмонального шунта насчитывают более 1 миллиона ежегодно в США и странах Европы. Учитывая, что такие операции часто выполняются пожилым пациентам с коморбидной патологией, нельзя забывать о повышении риска осложнений и летальных исходов.
Левосимендан является инотропным препаратом, который повышает чувствительность к кальцию сократительных белков, связываясь с тропонином С миокарда. Его эффективность в лечении и профилактике синдрома малого сердечного выброса, возникающего после кардиохирургических операций, была продемонстрирована в небольших исследованиях.
Актуальность использования препарата в гуманной медицине и ветеринарии
Синдром острой сердечной недостаточности (ОСН) определяется как постепенное или быстрое обострение клинических признаков и симптомов сердечной недостаточности (СН), требующий срочного терапевтического вмешательста. Это патологическое состояние довольно распространенно у пожилых людей (ишемическая болезнь сердца, кардиомиопатии), собак (кардиомиопатии, приобретенные пороки сердца) и кошек (кардиомиопатии). Частота госпитализаций относительно острой сердечной недостаточности продолжает увеличиваться с каждым годом и это касается как гуманной, так и ветеринарной медицины.
Синдром сердечной недостаточности является гетерогенным, охватывает весь спектр пациентов, у которых симптомы могут быть представлены преимущественно в виде застойной ОСН или, в более поздних стадиях заболевания, — низким сердечным выбросом.
За последнее десятилетие отмечается повышенный интерес ученых к синдрому ОСН, поскольку необходимо раннее терапевтическое вмешательство для стабилизации пациента и улучшения симптоматики.
При этом необходимо:
- восстановить оксигенацию и перфузию внутренних органов
- избежать или ограничить повреждение сердца, почек и других органов
- инициировать долгосрочные методы лечения, которые помогут улучшить выживаемость и качество жизни
К сожалению, отсутствие достаточных знаний о причинах ОСН, не позволяет разработать высокоэффективные методы специфического лечения и улучшить выживаемость таких пациентов. Острая сердечная недостаточность продолжает оставаться прогностически неблагоприятной патологией. Это относитмя для синдрома ОСН с низким сердечным выбросом, где низкое систолическое кровяное давление в момент первичного приема является независимым предиктором кардиальной смерти.
Сердечная недостаточность у пациентов с нормальным или низким систолическим артериальным давлением, как правило, характеризуется более низкой фракцией выброса миокарда левого желудочка и частыми признаками нарушения перфузии внутренних органов, чем у лиц с артериальной гипертензией. У таких пациентов часто выявляют гипонатриемию, сниженную периферическую температуру тела, почечную недостаточность и симптомы коллапса. Данному контингенту больных людей и мелких домашних животных (в частности собак и кошек) требуются инотропы из-за отсутствия альтернативного терапевтического варианта. Данные пациенты с острой сердечной недостаточностью имеют самый высокий показатель смертности в стационаре. Обычные инотропы или инодилататоры, такие как бета-адренергические агонисты и ингибиторы фосфодиэстеразы (ФДЭ) коррегируют давление наполнения и повышают сердечный выброс, улучшают гемодинамику и симптоматику сердечной недостаточности. Однако, показатели выживаемости таких пациентов остаются низкими. Инотропы и инодилататоры оказывают положительное инотропное действие в первую очередь за счет увеличения циклического аденозинмонофосфата (цАМФ) и внутриклеточной концентрации кальция в кардиомиоцитах, но при тяжелой сердечной недостаточности их использование может быть ограничено увеличением частоты сердечных сокращений, аритмиями, а также уменьшения эффекта их применения из-за феномена бета-адренергической десенсибилизации (длительный прием соответствующих лекарственных препаратов нивелирует их терапевтический эффект).
Существуют перспективные научные разработки относительно лечения людей и мелких домашних животных с острой сердечной недостаточностью. К таким методам фармакотерапии относят применение левосимендана
, наиболее изученным сенситизатором кальция, используемый в ряде стран для лечения острой декомпенсации СН, который имеет как инотропный, так и сосудорасширяющий эффект. Левосимендан отличается от классических инодилататоров его способностью улучшить сократительную эффективность миокарда без существенного увеличения потребности его в кислороде, положительного влияния его на коронарный кровоток и отсутствие у него отрицательного луситропного эффекта (скорость релаксации миокарда). Несколько исследований показали значительное преимущество в улучшение фракции выброса и клинических результатов использования левосимендана у пациентов с острой сердечной недостаточностью.
Методы
В 3 фазу мультицентрового рандомизированного плацебо-контролируемого исследования LEVO-CTS были включены пациенты с фракцией выброса левого желудочка 35% или менее, которым была выполнена кардиологическая операция с использованием кардиопульльмонального шунта.
Пациенты были рандомизированы в группу внутривенного введения левосимендана в дозе 0,2 мкг/кг/мин в течение 1 часа до операции, затем в дозе 0,1 мкг/кг/мин в течение 23 часов после оперативного вмешательства или плацебо.
В качестве первичных конечных точек исследования были выбраны: композитная точка, включающая в себя смерть на протяжении 30 дней, почечно-заместительная терапия на протяжении 30 дней, периоперационный инфаркт миокарда (до 5 дня после операции) и использование устройства вспомогательного кровообращения (до 5 дня), и двукомпонентная композитная точка (смерть в течение 30 дней и применение устройства вспомогательного кровообращения на протяжении пяти дней).
Введение
Сердечная недостаточность (СН) – широко распространенное заболевание. И хотя в ее лечении достигнуты большие успехи, позволившие улучшить качество жизни и увеличить выживаемость больных, частота осложнений и смертность при СН остаются одними из самых высоких среди сердечно-сосудистых заболеваний. Под декомпенсированной СН подразумевают как острую дисфункцию сердца, вызванную инфарктом миокарда, операцией на сердце с использованием искусственного кровообращения, тромбоэмболией легочной артерии, суправентрикулярными аритмиями, гипертоническим кризом, пороками сердца, так и хроническую, в основе которой лежит естественное прогрессирование болезни сердца и неадекватное лечение хронической СН (ХСН). Любая декомпенсация СН может осложниться кардиогенным отеком легких, кардиогенным шоком и значительным снижением сердечного выброса.
Особенности лечения острой СН (ОСН) зависят от ее причины и клинических проявлений. Стандартная терапия включает введение мочегонных средств, наркотических анальгетиков, вазодилятаторов и препаратов, повышающих сократимость миокарда.
В последнее время в терапии ХСН предпочтение отдают ингибиторам АПФ, b-адреноблокаторам и антагонистам альдостерона. При ОСН особый интерес вызывает возможность оптимизации лечения с помощью инотропных средств.
При тяжелой СН, особенно со значительным снижением фракции выброса, возможно введение агонистов b-адренорецепторов, которые приводят к увеличению содержания цАМФ и кальция внутри клетки за счет стимуляции этих рецепторных структур. Однако изопротеренол и норадреналин усиливают тахикардию, потребность миокарда в кислороде и периферическую вазоконстрикцию, что недопустимо у больных с острым инфарктом миокарда. Наиболее часто в практике используют допамин и добутамин, поскольку нежелательные эффекты, связанные с вазоконстрикцией, наблюдаются только при назначении больших доз этих препаратов. Кроме того, их благоприятный гемодинамический эффект не сопровождается развитием аритмий и увеличением площади инфаркта миокарда. При введении допамина и добутамина в дозе более 15 мкг/кг/мин возможны незначительная тахикардия и увеличение потребности миокарда в кислороде [12].
В случае ОСН, особенно с наджелудочковыми нарушениями ритма, применяют сердечные гликозиды (дигоксин, строфантин, коргликон), которые также оказывают инотропное действие. Однако их широкое использование у больных инфарктом миокарда в ранние сроки нецелесообразно из-за риска развития токсических реакций, нарушений ритма сердца и летального исхода. Более того, при длительном использовании дигоксин не влияет на выживаемость больных СН.
Ингибиторы фосфодиэстеразы угнетают фосфодиэстеразу III и IV, оказывают влияние на миозиновую АТФазу, увеличивают содержание цАМФ и способствуют поступлению кальция в клетку независимо от его исходной концентрации. Препараты этой группы оказывают инотропный и вазодилатирующий эффекты и улучшают диастолическую функцию. Однако милринон и его аналоги также не нашли широкого практического применения из-за аритмогенного действия и увеличения летальных исходов у больных СН.
Поэтому появление в 2000 г. на фармацевтическом рынке нового класса негликозидных кардиотонических средств – сенситизаторов кальция – вызвал неподдельный интерес среди врачей.
Механизм действия левосимендана
Левосимендан – единственный представитель сенситизаторов кальция, который был одобрен для клинического использования и рекомендован более чем в 30 странах для недлительного лечения ОСН и острой декомпенсации ХСН.
Левосимендан является производным пиридазинона динитрила и обладает двойным механизмом действия. Главным из них считают увеличение чувствительности сократительных белков кардиомиоцитов к внутриклеточной концентрации кальция [3, 4].
При активации мышечного волокна и появлении в миоплазме ионов кальция (в присутствии АТФ) тропонин изменяет свою конформацию и отодвигает нить тропомиозина, открывая для миозиновой головки возможность соединения с актином. Соединение головки фосфорилированного миозина с актином приводит к резкому изменению конформации мостика и перемещению нити актина на один шаг с последующим разрывом мостика. Энергию для этого процесса обеспечивает распад макроергической фосфатной связи. После этого, в результате снижения локальной концентрации ионов кальция и отсоединения его от тропонина, тропомиозин снова блокирует актин, а миозин вновь фосфорилируется за счет АТФ. Таким образом, АТФ играет в мышечной работе двоякую роль, обеспечивая энергией как сокращение, так и расслабление мышцы.
Левосимендан в начале систолы избирательно связывается с насыщенным кальцием сердечным тропонином С, что приводит к стабилизации конформации белка, запускающей сокращение миофибрилл. В результате продлевается связь поперечных миозиновых мостиков с актином, увеличивается количество связей за единицу времени и сила сокращения. Действие левосимендана обратимо и не влияет на процесс расслабления миокарда. В диастолу концентрация ионов кальция уменьшается, что способствует разрыву связи левосимендана с сердечным тропонином С.
Кроме этого, левосимендан оказывает сосудорасширяющий и антиишемический эффекты, связанные с открытием АТФзависимых калиевых каналов в гладких мышцах сосудистой стенки, что может быть обусловлено гиперполяризацией кардиомиоцитов под влиянием активации АТФазы калиевых каналов или блокады высвобождения эндотелина-1. Вследствие расширения вен и артерий снижаются преднагрузка и постнагрузка, уменьшается давление в малом круге кровообращения. In vitro левосимендан и его активный метаболит OR-1896 высокоселективно блокируют фосфодиэстеразу III, не влияя на фосфодиэстеразы IV. В этом отношении левосимендан существенно отличается от милринона, угнетающего фосфодиэстеразу III и IV. Следует отметить, что именно с угнетением фосфодиэстеразы IV связывают поступление кальция в клетку вне зависимости от его исходного содержания.
Фармакокинетика
Левосимендан обладает линейной фармакокинетикой. Препарат хорошо всасывается, его биодоступность составляет 85 %. Он быстро распределяется по организму и быстро элиминируется. Период полувыведения составляет около 60 минут, степень связывания с альбуминами крови – 98 % [2].
Левосимендан практически полностью метаболизируется в печени, с мочой и калом выводится лишь незначительное количество неизмененного вещества. Метаболизм в печени происходит за счет конъюгации с глутатионом.
В основном метаболиты неактивны и выводятся с мочой и калом. Только 5 % левосимендана превращается в активный метаболит OR-1896. Последний образуется лишь через 24 ч постоянной инфузии препарата, его концентрация продолжает нарастать в течение последующих четырех суток. Степень связывания метаболита с белками крови составляет 42 %. Период полувыведения может достигать 75–80 ч. OR-1896 выводится в неизмененном виде с мочой и в меньшей степени с калом. СН не влияет на фармакокинетические параметры самого левосимендана и его метаболитов [4].
Ферментные системы цитохрома Р-450 не участвуют в биотрансформации левосимендана и его метаболитов. При нарушении функции печени образование и выведение активных метаболитов существенно не изменяется. При почечной недостаточности элиминация метаболитов незначительно снижается.
Дозозависимое инотропное действие левосимендана подтверждено в экспериментах на животных, у здоровых лиц, у пациентов с нарушенной сократительной способностью миокарда левого желудочка и у больных, перенесших оперативное вмешательство на сердце [20].
Побочные реакции
Наиболее частыми побочными реакциями, возникающими у больных с СН при внутривенной инфузии левосимендана, являются головная боль (до 6 %), артериальная гипотония (до 5,5 %), тошнота и головокружения (менее 2 %). У пациентов, принимавших левосимендан, наблюдались следующие нарушения сердечного ритма: тахикардия – 2,4 %, фибрилляция предсердий – 1,4 %, экстрасистолия – 1,3 %, желудочковая тахикардия – 1 %, трепетание предсердий – 0,9 %. При мета-анализе 792 ЭКГ, полученных при Холтеровском мониторировании у 386 больных в 10 исследованиях, не выявлено достоверных различий между левосименданом и плацебо по частоте возникновения желудочковых аритмий, суправентрикулярных аритмий, атриовентикулярной блокады и брадиаритмий [1].
Установлено, что 83 % всех побочных реакций развивались в процессе введения препарата и 17 % – после окончания лечения. Большинство побочных реакций (98 %) зарегистрированы в первые 3 дня инфузии левосимендана.
В проведенных крупных сравнительных исследованиях при введении лево-симендана в дозах 0,05–0,2 мг/кг/мин в течение суток частота сердечных сокращений повышалась не более чем на 4-6 ударов в минуту, а снижение артериального давления (АД) не превышало 10 мм рт. ст. [2, 3]. Число случаев выраженной тахикардии, артериальной гипотонии, ишемии миокарда и желудочковых аритмий заметного не увеличивалось.
По данным нескольких двойных слепых, контролируемых исследований, в группах пациентов, принимавших левосимендан, было зафиксировано снижение концентрации калия, эритроцитов и гемоглобина крови. Это объясняется гемодилюцией, возникающей на фоне вазодилатации. Данных, свидетельствующих об угнетении костного мозга, кровотечении и гемолизе, не зарегистрировано. До начала введения левосимендана рекомендуется определить уровень калия в крови [13].
По влиянию на уровень глюкозы в крови и эффективность гипогликемических препаратов у больных сахарным диабетом левосимендан не отличается от плацебо.
Нежелательные реакции левосимендана имеют дозозависимый характер, что позволяет не отказываться от начатого лечения при плохой переносимости препарата, а использовать более низкие дозы.
Толерантность левосимендана
Влияние левосимендана на фракцию выброса, ударный объем, частоту сердечных сокращений и давление заклинивания легочной артерии (ДЗЛА) отчетливо проявляется уже на 5 минуте внутривенного введения, а через 30 минут достигает максимума [19].
При внутривенной инфузии препарата в течение 48 ч толерантность к его гемодинамическому действию не зафиксирована, а положительное влияние на ударный объем и ДЗЛА сохранялись в течение двух суток после прекращения инфузии. Феномен отмены после резкого прекращения введение левосимендана на протяжении 24 ч и вплоть до 14 суток не наблюдался [17, 18].
Лекарственные взаимодействия
При одновременном назначении левосимендана с нитратами (изосорбид-
5-мононитрат), антагонистами кальция (фелодипин), b-адреноблокаторами (карведилол) и ингибиторами АПФ (каптоприл) фармакологических взаимодействий не выявлено [14–17]. Все данные об эффективности и безопасности левосимендана при СН получены в клинических исследованиях, в которых пациенты, помимо этого препарата, получали мочегонные средства, ингибиторы АПФ, нитраты и дигоксин. О наличии значимых лекарственных взаимодействий в этих клинических исследованиях не сообщалось.
Основные клинические исследования левосимендана
Исследование RUSSLAN
В это двойное слепое, плацебо-контролируемое исследование, которое проводили в России и Латвии, были включены 504 больных инфарктом миокарда с СН [11–13]. Пациентов с рентгенологически подтвержденной левожелудочковой недостаточностью, которым требовалось применение препаратов с положительным инотропным действием, включали в исследование на 5 сутки после возникновения острого инфаркта миокарда при условии подписания информированного согласия.
Критерии исключения:
- систолическое АД ниже 90 мм рт. ст.;
- инфаркт правого желудочка;
- разрыв миокарда;
- тампонада сердца;
- выраженная недостаточность митрального клапана;
- желудочковая тахикардия;
- фибрилляция предсердий;
- почечная и печеночная недостаточность;
- необходимость инвазивного вмешательства и терапия инотропными препаратами до исследования.
Больные были разделены на 5 групп приблизительно по 100 человек в каждой, которые получали:
- левосимендан в нагрузочной дозе 6 мкг/кг c последующей инфузией 0,1 мкг/кг/мин;
- левосимендан в нагрузочной дозе 12 мкг/кг c последующей инфузией 0,2 мкг/кг/мин;
- левосимендан в нагрузочной дозе 24 мкг/кг c последующей инфузией 0,2 мкг/кг/мин;
- левосимендан в нагрузочной дозе мкг/кг c последующей инфузией 0,1 мкг/кг/мин;
- плацебо.
Длительность введения препарата составляла 6 ч: в первые 10 минут левосимендан вводили в виде болюса, затем – в виде инфузии. Помимо этого, больные получали всю терапию, показанную при остром инфаркте миокарда и СН.
Первичной конечной точкой исследования была частота клинически значимых случаев артериальной гипотонии и ишемии миокарда, вторичными конечными точками – смерть и прогрессирование СН. Пациентов наблюдали в течение 180 дней.
В исследовании были получены следующие результаты. Частота случаев ишемии миокарда и артериальной гипотонии достоверно не различалась между группами, составляя в группе левосимендана 10,8 %, а в группе плацебо – 13,4 %. При увеличении дозы отмечался дозозависимый рост частоты этих явлений.
Прогрессирование СН и смертность в течение 24 ч наблюдались в группе плацебо чаще, чем в группе левосимендана. Общий риск смерти и прогрессирования СН после 6-часовой инфузии составлял 2 % в группе левосимендана и 5,9 % в группе плацебо, а через сутки – 4 и 8,8 % соответственно. Связи между применяемой дозой препарата и смертностью не выявлено. Серьезные нежелательные реакции были зарегистрированы у 52 пациентов – у 14,7 % в группе плацебо против 9,2 % в группе левосимендана.
Результаты исследования подтвердили безопасность применения левосимендана для лечения СН у больных с острым инфарктом миокарда. Введение препарата приводило к уменьшению слабости, одышки и потребности в других лекарственных средствах, необходимых для терапии СН. При лечении левосименданом снижался риск смерти и прогрессирующей СН.
В группе плацебо летальность через 14 дней составила 19,6 %, а через 180 дней – 31,4 %, тогда как в группе лево-симендана — 11,7 % (p = 0,031) и 22,6 % (p = 0,054) соответственно. Риск общей смертности в течение 14 дней у пациентов, получавших левосимендан, снизился на 44%. Эффект сохранялся в течение 6 месяцев наблюдения – снижение риска общей смертности на 33%.
Таким образом, внутривенная инфузия левосимендана в дозах 0,1–0,2 мкг/кг/мин в течение 6 ч достаточно хорошо переносится и эффективна при лечении больных с острым инфарктом миокарда, осложнившимся левожелудочковой недостаточностью. В указанных дозах левосимендан не повышал частоту развития клинически значимой гипотонии и ишемии миокарда. На фоне его применения в указанных дозах достоверно снижалась смертность, причем эффект, достигнутый в первые 2 недели после начала лечения, сохранялся на протяжении 6 месяцев.
Исследование LIDO
Это двойное слепое, сравнительное исследование было проведено в 11 странах Западной Европы [9, 10]. В него были включены 203 пациента, госпитализированных по поводу СН с низким сердечным выбросом (фракция выброса менее 35 %, сердечный индекс менее 2,5 л/мин/м2, СЗЛА – более 15 мм рт. ст.), нуждающихся в инвазивном мониторировании параметров центральной гемодинамики и внутривенном введении инотропного препарата.
В исследование не включали лиц моложе 21 года, пациентов со стенозом сердечного клапана, рестриктивной или гипертрофической кардиомиопатией, устойчивой желудочковой тахикардией или фибрилляцией желудочков, систолическим АД ниже 85 мм рт. ст., частотой сердечных сокращений более 120 ударов в минуту, почечной и печеночной недостаточностью, а также принимавших агонисты b-адренорецепторов или ингибиторы фосфодиэстеразы.
Исследование имело оригинальный дизайн. Больные были разделены на 2 группы: первая из них получала левосимендан (в нагрузочной дозе 24 мкг/кг, вводимой за 10 минут, с последующей инфузией в дозе 0,1 мкг/кг/мин) и плацебо добутамина; второй группе назначали добутамин в начальной дозе 5 мкг/кг/мин и плацебо левосимендана. Препараты вводили в течение 24 ч, при недостаточном эффекте через 2 ч после начала инфузии скорость введения удваивали. В случае возникновения нежелательных реакций инфузия прерывалась на 30 минут с последующим возобновлением введения препарата в уменьшенной в 2 раза дозе.
Первичной конечной точкой являлось улучшение параметров гемодинамики в течение 24 ч. Вторичными конечными точками были: изменения параметров гемодинамики после 24 ч, число дней в стационаре без парентерального введения лекарств в первый месяц, время до наступления смерти или декомпенсации СН, смертность за 31 сутки после рандомизации, смертность за 180 суток.
В исследовании LIDO было установлено, что 24-часовая инфузия левосимендана приводила к достоверному, по сравнению с добутамином, улучшению параметров гемодинамики у больных с острой декомпенсацией ХСН (28 % против 15 %; р = 0,022). Общая смертность у пациентов, получавших левосимендан в течение 31 дня, была достоверно ниже, чем в группе плацебо – 8 против 17 %
(р = 0,049), что соответствует снижению риска на 57 %. Данный эффект сохранялся при продлении наблюдения до 180 суток – 26 против 38 % (р = 0,029), снижение риска общей смертности на 43 %.
Было показано, что левосимендан реже, чем добутамин, вызывал нежелательные реакции, такие как нарушения ритма (3,9 против 13 %; р = 0,023), ишемию миокарда, боли в грудной клетке (0 случаев против 7; р = 0,013). Сочетанное применение с b-адреноблокаторами не ослабляло гемодинамическое действие левосимендана.
Исследование CASINO
В это рандомизированное, двойное слепое, плацебо-контролируемое исследование планировалось включить 600 пациентов с декомпенсированной ХСН IV функционального класса по NYHA и фракцией выброса левого желудочка менее 35 % [7, 8]. Госпитализированных больных в течение 48 ч рандомизировали в 3 группы, которые получали:
- левосимендан в нагрузочной дозе 16 мкг/кг, вводимой за 10 минут, с последующей инфузией 0,2 мкг/кг/мин на протяжении 24 ч;
- добутамин;
- плацебо.
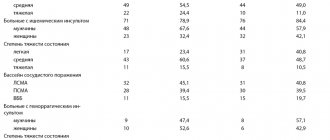
Первичной конечной точкой являлась смертность на протяжении 1, 6 и 12 месяцев. После включения 299 больных исследование было досрочно прекращено из-за очевидного преимущества левосимендана. Результаты исследования представлены в табл.
Смертность за 1 месяц в группе левосимендана составила 6,1 %, в группе добутамина – 12,8 % и в группе плацебо – 8,2 %; через 6 месяцев – 15,3, 39,6 и 24,7 % соответственно. Таким образом, в исследовании CASINO были получены данные, свидетельствующие о положительном влиянии краткосрочных инфузий левосимендана на смертность при острой декомпенсации ХСН.
Исследование REVIVE I
В двойном слепом, плацебо-контролируемом исследовании, включавшем 100 пациентов, изучали эффективность 24-часового парентерального введения левосимендана у больных с острой декомпенсацией ХСН [6]. Госпитализированных пациентов с фракцией выброса левого желудочка менее 30 % и одышкой в покое, сохраняющейся после парентерального введения мочегонных препаратов, рандомизировали в две группы. Первая группа получала левосимендан в нагрузочной дозе 6–12 мкг/кг, вводимой за 10 минут, с последующей инфузией 0,1 мкг/кг/мин в течение 50 минут (в дальнейшем, в случае хорошей переносимости, дозу увеличивали вдвое); второй группе назначали плацебо.
Основной целью исследования была оценка клинического состояния больных в первые 5 суток на фоне инфузии левосимендана и после нее.
По результатам исследования клиническое улучшение в группе левосимендана наступало раньше (через 6 ч от начала инфузии, сохранялось в течение 5 суток) и достоверно чаще, чем в группе плацебо. Данное исследование было предварительным по отношению к начавшемуся в настоящее время исследованию REVIVE II, так как полученные в нем результаты были использованы для доработки протокола.
Исследование SURVIVE
Это крупное рандомизированное, двойное слепое исследование проходит в настоящее время в Европе, России и Израиле. К апрелю 2004 г. в него уже были включены 722 больных. В целом в исследование планируется включить 1300 пациентов. У госпитализированных больных с ОСН, фракцией выброса менее 30 %, одышкой в покое, ДЗЛА более 18 мм рт. ст. и необходимостью парентерального введения инотропных препаратов будут оценены общая смертность за 31 и 180 суток, число дней вне стационара за 180 суток, клиническое состояние и безопасность терапии.
Другие исследования
В ряде исследований рассматривают вопрос об антиишемическом действии левосимендана. Препарат вводили через катетер, установленный в коронарной артерии, непосредственно в область с нарушенной сократимостью миокарда, однако значимых изменений гемодинамики обнаружено не было. Этот эксперимент подтверждает мнение, согласно которому при воздействии левосимендана на “оглушенный” миокард увеличивается чувствительность миофибрилл к кальцию.
В небольшом рандомизированном исследовании больным с острым инфарктом миокарда после успешной ангиопластики вводили в течение 10 минут левосимендан в дозе 24 мкг/кг. На фоне введения препарата уменьшалось число гипокинетических сегментов, увеличивалась общая сократимость миокарда без повышения его потребности кислороде [4].
В эксперименте накладывали лигатуру на коронарную артерию и проводили инфузию левосимендана. При этом уменьшались размеры инфаркта миокарда [5]. Однако специально антиишемическое действие левосимендана в клинических исследованиях не изучали.
В плацебо-контролируемом исследовании у 151 пациента без декомпенсации ХСН на фоне введения левосимендана происходило достоверное, дозозависимое повышение уровня норадреналина в крови, что объясняется увеличением симпатической активности в ответ на выраженную вазодилятацию. При этом уровень адреналина заметно не изменялся. При применении малых доз препарата наблюдалась тенденция к снижению содержания предсердного натрийуретического пептида и уровня ренина крови.
В нескольких исследованиях левосимендан вводили в послеоперационном периоде больным, перенесшим хирургическое вмешательство на сердце с использованием искусственного кровообращения. Полученные данные свидетельствовали о достоверном увеличении ударного объема и снижении периферического сопротивления. Пациенты хорошо переносили препарат; он не влиял на оксигенацию артериальной крови, не оказывал аритмогенного действия.
В настоящее время применение левосимендана при инфаркте миокарда разрешено в ряде стран Европы, включая Россию. Учитывая благоприятное влияние этого препарата на параметры гемодинамики, клинические симптомы и смертность при ОСН и острой декомпенсации ХСН, доказанную в исследованиях безопасность и хорошую переносимость препарата, рассматривается вопрос о расширении показаний к его применению.
Результаты
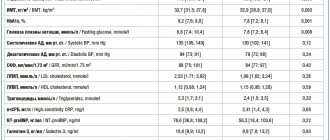
Из 882 пациентов, прошедших рандомизацию, 849 были включены в анализ intention-to-treat.
- Четырехкомпонентная конечная точка была достигнута у 105 из 428 больных (24.5%) из группы левосимендана у 103 из 421 пациента (24.5%) из контрольной группы (отношение шансов, 1.00; 99% CI, 0.66-1.54; P=0.98).
- Двукомпонентная первичная конечная точка была достигнута у 56 больных (13.1%) из основной группы, по сравнению с 48 (11.4%), получавших плацебо (скорректированное отношение шансов, 1.18; 96% CI, 0.76-1.82; P=0.45).
- Частота нежелательных лекарственных явлений достоверно не различалась между группами.
Фармакология и механизм действия левосимендана (симдакса)
Химическое название препарата — [(R) — [[4- (1,4,5,6-тетрагидро-4-метил-6-оксо-3-пиридазинил) фенил] гидразон] пропандинитрила]. Симдакс представляет собой левовращающий изомер рацемического симендана, производного пиридазинонового-динитрила. Симендан представляет собой рацемическое соединение из 2 энантиомеров: декстросимендана и левозимендана.
Левосимендан
принадлежит к так называемой группе «кальциевых сенсибилизаторов» («сенситизаторы ионов кальция»), которые включают в себя несколько других веществ, которые обладают способностью увеличивать чувствительность миофиламентов по отношению к ионам кальция, что приводит к увеличению сократимости миокарда без увеличения концентрации внутриклеточного цАМФ или внутриклеточной концентрации кальция, что, возможно, связано с некоторыми фосфодиэстеразоингибирующими эффектами. Данная концепция терапии, как представляется на современном этапе развития гуманной и ветеринарной кардиологии, связана с наименьшим количеством побочных эффектов, снижением проаритмогенного потенциала, а также благоприятно влияет на потребление кислорода миокардом по сравнению с традиционными инотропами или инодилататорами.
Левосимендан осуществляет кальций-зависимое связывание с N-концевым доменом сердечного тропонина C, который обладает более высоким сродством при высоких концентрациях кальция и с более низкой аффинностью при низкой концентарции кальция. Благодаря стабилизации комплекса кальций-сердечный тропонин С, левосимендан ингибирует эффект тропонина I и увеличивает скорость ассоциации кросс-моста комплекса актин-миозин. Этот положительный инотропный эффект достигается без увеличения внутриклеточной концентрации кальция или значительного увеличения потребности миокарда в кислороде.
Благотворное терапевтическое влияние левосимендана на симптоматику острой сердечной недостаточности также связано с его сосудорасширяющим эффектом на системное артериальное, коронарное, легочное, почечное, кишечное, церебральное кровообращение. Также симдакс улучшает системное венозное кровообращение, в частности в портальной вене. Сосудорасширяющий эффект левосимендана опосредуется аденозинтрифосфатом, воздействуя на калиевые и кальциевые каналы мышечных клеток стенки сосудов. Гиперполяризация мембраны, индуцированная открытием калиевых каналов блокирует вход кальция и активизирует обмен натрия-кальция, что приводит к снижению концентрации внутриклеточного кальция и вызывает расширение сосудов.
Клинические исследования эффективности применения левосимендана
Острая сердечная недостаточность
Несколько клинических испытаний показали положительный эффект левозимендана на краткосрочные гемодинамические и клинические признаки у больных пациентов с ОСН. Сердечный выброс от применения препарата (24-часовая инфузия пациентам с III-IV ФК СН) увеличивается в среднем на 40%, а давление заклинивания легочных капилляров снижается на 30%. Инфузия левосимендана, по сравнению с добутамином, характеризовалась более высокими показателями терапевтической эффективности. Интересный факт, что применение бета-блокаторов усиливает гемодинамические эффекты левосимендана, однако уменьшает гемодинамические эффекты добутамина. Левосимендан достоверно снижает смертность
у пациентов с острой сердечной недостаточностью, по сравнению с использованием в качестве инотропа добутамина.
Важно отметить, что инодилататорные эффекты левосимендана сохраняются при одновременном применении бета-блокаторов. Левозимендан значительно улучшает клиническую симатоматику у людей, собак и кошек с острой сердечной недостаточностью.
У пациентов с декомпенсированной СН, ожидающих трансплантацию сердца, левосимендан улучшает функцию почек в течение 3-х месяцев использования фармакологического препарата.
Левосимендан улучшает коронарное кровообращение, уменьшает потребление кислорода миокардом, улучшает перфузию ишемимизированного миокарда. Данный эффект был доказан у клинически здоровых животных и людей, но позже данные свойства препарата были подтверждены и у пациентов, больных застойной сердечной недостаточностью, а также у людей, больных острым инфарктом миокарда с дисфункцией левого желудочка.
У пациентов, перенесших плановое аортокоронарное шунтирование (АКШ), левозимендан увеличивает сердечный выброс
и ударный объем сердца и уменьшает системное сосудистое сопротивление без увеличения потребления кислорода миокардом или особого повышения использования миокардом питательных субстратов.
Диастолическая сердечная недостаточность
При доклинических исследованиях у животных и человека, левозимендан улучшает диастолическую функцию миокарда левого желудочка, а его инотропный эффект связан с увеличением скорости релаксации и уменьшения времени релаксации миокарда левого желудочка, тем самым улучшая сердечную диастолическую функцию.
У тяжелых пациентов с сердечной недостаточностью с ограниченным наполнением левого желудочка левозимендан улучшал как систолическую и диастолическую функции наполнения левого желудочка, повышал ударный объем и сердечный выброс при одновременном уменьшении давления заклинивания в легочных капиллярах.
Левосимендан в лечении перипартальной кардиомиопатии
Использование новых препаратов у пациентов с редкими заболеваниями, всегда связано с определенными трудностями. Имеются немногочисленные клинические наблюдения относительно применения левозимендана у пациентов с перипартальной кардиомиопатией. Острая сердечная недостаточность является опасным для жизни патологическим состоянием, которое в очень редких случаях развивается во время или после родов. В указанных клинических отчетах, показана высокая эффективность левозимендана в отношении улучшения работы сердца, что было связано как с улучшением симптоматики ОСН, так положительной дианамикой гемодинамических и эхокардиографических показателей, характеризующих систолическую и диастолическую функуцию левого желудочка. Симдакс
вызывал устойчивое увеличение сердечного выброса, ударного объема левого желудочка и соответственно ускоряло восстановление пациентов с перипартальной кардиомиопатией.
Правосторонняя сердечная недостаточность и кардиогенный шок
Левосимендан
также используется для восстановления нарушенной функции левого желудочка у пациентов после кардиологических оперативных вмешательств и у пациентов, у которых развился кардиогенный шок после трансплантации сердца. У больных с острым респираторным дистресс-синдромом, легочной гипертензией и правожелудочковой сердечной дисфункцией эффективность левомисендана оказалась не высокой. При септическом шоке применение левозимендана оказалось вполне оправданным, у больных пациентов на фоне использования препарата происходило снижение среднего давления в легочной артерии, индекса сосудистого сопротивления в легочных сосудах и конечно-систолического объема правого желудочка, увеличение сердечного выброса, фракции выброса правого желудочка и сатурации смешанной венозной крови кислородом.