Написать отзыв
Отзывов: 0
Производители: Pliva-Lachema (Чешская Республика)
Действующие вещества
- Паклитаксел
Класс заболеваний
- Злокачественное новообразование пищевода
- Злокачественное новообразование желудка
- Злокачественное новообразование бронхов и легких
- Саркома Капоши
- Злокачественное новообразование молочной железы
- Злокачественное новообразование шейки матки
- ЗНО треугольника мочевого пузыря
- ЗНО головы, лица, шеи
- Лейкоз неуточненного клеточного типа
Клинико-фармакологическая группа
- Не указано. См. инструкцию
Фармакологическое действия
- Противоопухолевое
Фармакологическая группа
- Противоопухолевые средства растительного происхождения
Концентрат для приготовления раствора для внутривенного введения Паклитаксел (Paclitaxel)
Инструкция по медицинскому применению препарата
Описание фармакологического действия
Оказывает цитотоксическое антимитотическое действие. Активирует сборку микротрубочек из тубулиновых димеров и стабилизирует их, предохраняя от деполимеризации. Вследствие этого ингибирует динамическую реорганизацию микротубулярной сети в интерфазе и в период митоза. Индуцирует аномальное расположение микротрубочек в виде пучков на протяжении всего клеточного цикла и множественных звездчатых сгущений (астеров) в течение митоза.
Показания к применению
Рак яичников, рак молочной железы, немелкоклеточный рак легкого, плоскоклеточный рак головы и шеи, переходноклеточный рак мочевого пузыря, рак пищевода, лейкоз, саркома Капоши у больных СПИДом.
Форма выпуска
Концентрат для приготовления раствора для инфузий 6 мг/мл; флакон (флакончик) 16.7 мл пачка картонная 1; Концентрат для приготовления раствора для инфузий 6 мг/мл; флакон (флакончик) 5 мл пачка картонная 1; Концентрат для приготовления раствора для инфузий 6 мг/мл; флакон (флакончик) 5 мл пачка картонная 10;
Фармакодинамика
Оказывает цитотоксическое антимитотическое действие. Активирует сборку микротрубочек из тубулиновых димеров и стабилизирует их, предохраняя от деполимеризации. Вследствие этого ингибирует динамическую реорганизацию микротубулярной сети в интерфазе и в период митоза. Индуцирует аномальное расположение микротрубочек в виде пучков на протяжении всего клеточного цикла и множественных звездчатых сгущений (астеров) в течение митоза.
Фармакокинетика
Фармакокинетические параметры паклитаксела определялись после инфузий препарата в дозах 135 и 175 мг/м2 на протяжении 3 и 24 ч при проведении рандомизированных исследований Фазы 3 у больных раком яичников. При в/в введении в течение 3 ч в дозе 135 мг/м2 Cmax составляло 2170 нг/мл, AUC — 7952 нг/ч/мл; при введении той же дозы в течение 24 ч — 195 нг/мл и 6300 нг/ч/мл соответственно. Cmax и AUC — дозозависимы. При 3-часовой инфузии увеличение дозы на 30% (от 135 до 175 мг/м2) приводит к повышению Cmax и AUC на 68 и 89% соответственно, при 24-часовой инфузии Cmax повышается на 87%, AUC — на 26%. В исследованиях in vitro показано, что при концентрациях паклитаксела 0,1–50 мкг/мл 89–98% вещества связывается с белками сыворотки. После в/в введения паклитаксела динамика снижения плазменной концентрации носит двухфазный характер: начальное быстрое снижение отражает распределение в ткани и его значительное выведение. Более поздняя фаза частично обусловлена относительно медленным высвобождением паклитаксела из тканей. При в/в введении время полураспределения из крови в ткани — в среднем 30 мин. Кажущийся объем распределения в равновесном состоянии при 24-часовой инфузии составляет 227–688 л/м2. Легко проникает и адсорбируется тканями, преимущественно накапливается в печени, селезенке, поджелудочной железе, желудке, кишечнике, сердце, мышцах. Метаболизм паклитаксела у человека до конца не изучен. После в/в инфузии (1–24 ч) средние значения кумулятивной экскреции неизмененного вещества с мочой составляют 1,3–12,6% дозы (15–275 мг/м2), что указывает на экстенсивный внепочечный клиренс. Показано, что метаболизм паклитаксела у животных осуществляется в печени. Вероятно основным механизмом метаболизма паклитаксела в организме человека является биотрансформация в печени и выведение с желчью. Основные метаболиты — продукты гидроксилирования. Влияние нарушения функции почек или печени на метаболизм после 3-часовой инфузии не исследовалось. Фармакокинетические параметры, полученные у одного больного, свидетельствуют о том, что диализ не оказывает влияния на скорость выведения препарата из организма. Т1/2 и суммарный клиренс вариабельны (зависят от дозы и продолжительности в/в введения): при дозах 135–175 мг/м2 и продолжительности инфузии 3 или 24 ч средние значения Т1/2 находятся в диапазоне 13,1–52,7 ч, клиренс — 12,2–23,8 л/ч/м2. При повторных инфузиях не кумулирует.
Использование во время беременности
Противопоказано при беременности (возможно эмбрио- и фетотоксическое действие). Категория действия на плод по FDA — D. На время лечения следует прекратить грудное вскармливание (неизвестно, проникает ли паклитаксел в грудное молоко).
Противопоказания к применению
Гиперчувствительность (в т.ч. к полиоксиэтилированному касторовому маслу), выраженная нейтропения — менее 1,5·109/л (исходная или развившаяся в процессе лечения), у больных с саркомой Капоши — нейтропения менее 1,0·109/л (исходная или развившаяся в процессе лечения).
Побочные действия
По объединенным данным 10 исследований, включавших 812 пациентов (493 — рак яичников, 319 — рак молочной железы), с использованием различных доз и при разной продолжительности введения паклитаксела наблюдались следующие побочные эффекты. Гематологические: нейтропения менее 2·109/л (90%), нейтропения менее 0,5·109/л (52%), лейкопения менее 4·109/л (90%), лейкопения менее 1·109/л (17%), тромбоцитопения менее 100·109/л (20%), тромбоцитопения менее 50·109/л (7%), анемия – уровень гемоглобина менее 110 г/л (78%), анемия – уровень гемоглобина менее 80 г/л (16%). Подавление функции костного мозга (главным образом нейтропения) является основным токсическим эффектом, ограничивающим дозу паклитаксела. Нейтропения зависит в меньшей степени от дозы препарата и в большей — от продолжительности введения (более выражена при 24-часовой инфузии). Наиболее низкий уровень нейтрофилов обычно отмечается на 8–11 день лечения, нормализация наступает на 22 день. Повышение температуры отмечалось у 12% пациентов, инфекционные осложнения — у 30% больных. Летальный исход зарегистрирован у 1% больных с диагнозами сепсис, пневмония и перитонит. Наиболее распространенными инфекциями, сопутствующими нейтропении, являются инфекции мочевыводящих и верхних дыхательных путей. При развитии тромбоцитопении наименьший уровень тромбоцитов обычно отмечается на 8–9 день лечения. Кровотечения (14% случаев) были локальными, частота их возникновения не была связана с дозой и временем введения. Частота и тяжесть анемии не зависели от дозы и режима введения паклитаксела. Переливание эритроцитарной массы потребовалось 25% больных, переливание тромбоцитарной массы — 2% пациентов. У больных саркомой Капоши, развившейся на фоне СПИДа, угнетение костно-мозгового кроветворения, инфекции и фебрильная нейтропения могут возникать более часто и иметь более тяжелое течение. Реакции повышенной чувствительности. Частота и тяжесть реакций гиперчувствительности не зависели от дозы или режима введения паклитаксела. У всех пациентов при проведении клинических исследований перед введением паклитаксела проводилась адекватная премедикация. Реакции повышенной чувствительности наблюдались у 41% больных и в основном проявлялись в виде приливов крови к лицу (28%), сыпи (12%), артериальной гипотензии (4%), одышки (2%), тахикардии (2%) и артериальной гипертензии (1%). Тяжелые реакции повышенной чувствительности, которые требовали терапевтического вмешательства (одышка, требующая применения бронхорасширяющих средств, артериальная гипотензия, требующая терапевтического вмешательства, ангионевротический отек, генерализованная крапивница) отмечались в 2% случаев. Вероятно, эти реакции являются гистамин-опосредованными. В случае тяжелых реакций гиперчувствительности вливание препарата следует немедленно прекратить и начать симптоматическое лечение, причем вводить препарат повторно не следует. Сердечно-сосудистые. Артериальная гипотензия (12%, n=532) или гипертензия и брадикардия (3%, n=537) были отмечены во время введения препарата. В 1% случаев наблюдались тяжелые побочные эффекты, которые включали обморок, нарушения ритма сердца (асимптоматическая желудочковая тахикардия, бигеминия и полная AV блокада и обморок), гипертензию и венозный тромбоз. У одного пациента с синкопе при 24-часовой инфузии паклитаксела в дозе 175 мг/м2 развилась прогрессирующая гипотензия с летальным исходом. В ходе клинических испытаний также наблюдались отклонения на ЭКГ (23%). В большинстве случаев не было какой-либо четкой связи между применением паклитаксела и изменениями на ЭКГ, изменения не были клинически значимыми или имели минимальное клиническое значение. У 14% пациентов с нормальными параметрами ЭКГ до включения в исследование отмечены отклонения на ЭКГ, возникшие на фоне лечения. Неврологические. Частота и выраженность неврологических проявлений были дозозависимыми, но на них не влияла продолжительность инфузии. Периферическая нейропатия, главным образом проявляющаяся в форме парестезии, наблюдалась у 60% больных, в тяжелой форме — у 3% больных, в 1% случаев послужила причиной отмены препарата. Частота периферической нейропатии увеличивалась при нарастании суммарной дозы паклитаксела. Симптомы обычно появляются после многократного применения и ослабевают или проходят в течение нескольких месяцев после прекращения лечения. Предшествующая нейропатия вследствие ранее проводившегося лечения не является противопоказанием для терапии паклитакселом. Другие серьезные неврологические нарушения, наблюдавшиеся после введения паклитаксела (менее 1% случаев): судорожные припадки типа grand mal, атаксия, энцефалопатия. Есть сообщения о нейропатии на уровне вегетативной нервной системы, которая приводила к паралитической непроходимости кишечника. Артралгия/миалгия отмечались у 60% больных и имели тяжелый характер у 8% больных. Обычно симптомы носили транзиторный характер, появлялись через 2–3 дня после введения паклитаксела и проходили в течение нескольких дней. Гепатотоксичность. Повышение уровня АСТ, щелочной фосфатазы и билирубина в сыворотке крови наблюдалось у 19% (n=591), 22% (n=575) и 7% (n=765) больных соответственно. Описаны случаи некроза печени и энцефалопатии печеночного происхождения с летальным исходом. Гастроинтестинальные. Тошнота/рвота, диарея и мукозит отмечались у 52, 38 и 31% больных соответственно и носили легкий или умеренный характер. Мукозит чаще отмечался при 24-часовой инфузии, нежели при 3-часовой. Кроме того, наблюдались явления непроходимости или перфорации кишечника, нейтропенического энтероколита (тифлита), тромбоз брыжеечной артерии (включая ишемический колит). Реакции в месте в/в инъекции (13%): местный отек, болевые ощущения, эритема, индурация. Эти реакции чаще наблюдаются после 24-часовой инфузии, чем после 3-часовой. В настоящее время какие-либо специфические формы лечения реакций, связанных с экстравазацией препарата, неизвестны. Есть сообщения о развитии флебита и целлюлита при введении паклитаксела. Другие токсические проявления. Обратимая алопеция наблюдалась у 87% больных. Полное выпадение волос отмечается почти у всех больных между 14–21 днем терапии. Встречалось нарушение пигментации или обесцвечивание ногтевого ложа (2%). Наблюдались также транзиторные кожные изменения в связи с повышенной чувствительностью к паклитакселу. Об отеке сообщалось у 21% больных, в т.ч. у 1% — в выраженной форме, но эти случаи не были причиной отмены препарата. В большинстве случаев отек был фокальным и обусловленным заболеванием. Имеются сообщения о рецидиве кожных реакций, связанных с облучением.
Способ применения и дозы
В/в, в виде 3-часовой или 24-часовой инфузии (непосредственно перед введением препарат разбавляют до концентрации 0,3–1,2 мг/мл соответствующими растворами). Режим дозирования устанавливают индивидуально, в зависимости от показаний, проводимой ранее химиотерапии (или ее отсутствия), состояния кроветворной системы, схемы химиотерапии.
Передозировка
Симптомы: миелосупрессия, периферическая нейротоксичность, мукозит. Лечение: симптоматическое. Специфический антидот неизвестен.
Взаимодействия с другими препаратами
По данным клинических исследований, при введении паклитаксела после инфузии цисплатина наблюдалась более выраженная миелосупрессия и снижение клиренса паклитаксела примерно на 33% по сравнению с обратной последовательностью введения (паклитаксел перед цисплатином). В исследованиях in vitro кетоконазол ингибирует биотрансформацию паклитаксела. Циметидин, ранитидин, дексаметазон, дифенгидрамин не влияют на связывание паклитаксела с белками плазмы крови. Ингибиторы микросомального окисления (в т.ч. кетоконазол, циметидин, хинидин, циклоспорин) подавляют метаболизм паклитаксела.
Меры предосторожности при приеме
Лечение должно осуществляться врачом, имеющим опыт проведения химиотерапии, и при наличии условий, необходимых для купирования осложнений. Обязателен постоянный контроль периферической крови, АД, ЧСС и других параметров жизненно важных функций (особенно при первичной инфузии или в течение первого часа введения). При использовании паклитаксела в комбинации с цисплатином сначала следует вводить паклитаксел, а затем цисплатин. Во избежание развития тяжелых реакций гиперчувствительности (и для улучшения переносимости) перед инфузией всем пациентам следует проводить премедикацию с использованием глюкокортикоидов, антигистаминных препаратов и блокаторов гистаминовых H2-рецепторов; примерная схема: дексаметазон (или аналог) — 20 мг внутрь или в/м за 6–12 ч до введения паклитаксела, дифенгидрамин (или аналог) — 50 мг в/в и циметидин — 300 мг (или ранитидин — 50 мг) в/в за 30–60 мин до введения. При возникновении тяжелых аллергических реакций во время инфузии введение немедленно прекращают и проводят симптоматическую терапию. При развитии нейтропении больным не следует вновь назначать препарат до восстановления содержания нейтрофилов до уровня не менее 1,5·109/л и не менее 1·109/л при саркоме Капоши (см. «Противопоказания»). При развитии вследствие инфузии паклитаксела тяжелых нейропатических периферических нарушений или выраженной нейтропении (менее 0,5·109/л), в т.ч. длящейся 7 дней и более или сопровождающейся инфекционными осложнениями, при необходимости повторных курсов рекомендуется снижение дозы на 20%. При появлении в ходе лечения паклитакселом значительных нарушений сердечной проводимости необходимо назначить соответствующее лечение, а при последующем введении препарата следует проводить непрерывный мониторинг функций сердца. В период лечения показано воздерживаться от занятий потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций. Во время лечения рекомендуется использовать адекватные методы предупреждения беременности.
Особые указания при приеме
При работе с паклитакселом, как и при работе с другими противоопухолевыми препаратами, необходимо соблюдать осторожность. Приготовлением растворов должен заниматься обученный персонал в специально предназначенной для этого зоне с соблюдением защитных мер (перчатки, маски и пр.). В случае контакта препарата с кожей или слизистыми оболочками необходимо тщательно промыть водой слизистые оболочки, а кожу — водой с мылом. При приготовлении, хранении и введении паклитаксела следует пользоваться оборудованием, которое не содержит деталей из ПВХ.
Условия хранения
Список Б.: В защищенном от света месте, при температуре не выше 25 °C.
Срок годности
24 мес.
Принадлежность к ATX-классификации:
L Противоопухолевые препараты и иммуномодуляторы
L01 Противоопухолевые препараты
L01C Алкалоиды растительного происхождения
L01CD Таксоиды
L01CD01 Paclitaxel
Паклитаксел и его новые возможности при лечении больных раком яичников
В
ысокая частота диссеминированных форм рака яичников (РЯ) при неуклонном росте заболеваемости определяет актуальность проблемы лекарственного лечения этой патологии. Высокая летальность больных РЯ обусловлена не только редкостью выявления болезни на ранних стадиях, но и недостаточным применением наиболее эффективных комбинированных и комплексных методов лечения. По последним статистическим данным,
в России только 70% больных РЯ получают необходимое комбинированное либо комплексное лечение
, включающее не только хирургический метод лечения, но и современную противоопухолевую лекарственную и лучевую терапию. Роль химиотерапии при лечении РЯ уже хорошо изучена и имеет свои стандарты, что во многом объясняется высокой химиочувствительностью этой опухоли. Повышение эффективности лечения больных РЯ связано с поисками новых противоопухолевых препаратов. С середины 90–х годов это были препараты нового поколения – таксаны.
За 10 лет применения паклитаксела в области клинической химиотерапии опухолевых заболеваний уже разработаны основные показания и схемы при лечении больных раком молочной железы, легкого, яичников, слизистой полости рта, рото– и носоглотки, гортани. Столь широкий спектр противоопухолевой активности позволяет искать новые возможности применения паклитаксела при платинорезистентных формах рака яичников, а также исследовать его эффективность при новых локализациях и редких гистологических вариантах злокачественных опухолей. В результате создания новых и совершенствования «старых» режимов химиотерапии происходит постепенное повышение эффективности лечения и улучшение отдаленных результатов. Так, на рисунке 1 представлены данные ретроспективного анализа лечения диссеминированных больных РЯ в ГУ РОНЦ им. Н.Н. Блохина РАМН с 1979 по 2000 год. При анализе эффективности комбинированного лечения в зависимости от применяемых схем химиотерапии мы можем проследить эволюцию лечения первичных больных распространенным РЯ за последние 20 лет. Однако мы должны подчеркнуть, что трактовка результатов проведенной химиотерапии несколько затруднена, поскольку больные лечились в разное время и получали разнообразные схемы. Так, при применении безплатиновых комбинаций лечение было эффективным в 54%, а число полных регрессий составило 25%. В 80–х годах появились препараты платины, которые сохраняют прочные позиции в комбинированной химиотерапии РЯ до настоящего времени. Их применение позволило достичь общей эффективности 64%, а число полных регрессий уже составило 35%. В 90–х годах в мировую клиническую практику были внедрены принципиально новые препараты для лекарственной терапии РЯ, такие как паклитаксел и доцетаксел. Введение таксанов повысило эффективность лечения до 79%, а число полных регрессий увеличилось до 46%.
Рис. 1. Эффективность комбинированного лечения больных раком яичников
Цель этой статьи состоит в обобщении уже накопленного опыта применения паклитаксела, а также определения перспектив исследовательских программ в комбинированной химиотерапии РЯ.
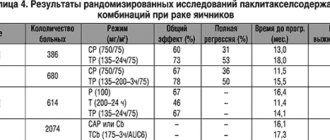
Паклитаксел – первый препарат из группы таксанов, продемонстрировавший высокую активность (16–50%) при лечении злокачественных опухолей яичников, резистентных к препаратам платины [1,2]. Его широкое применение в США у больных РЯ началось с декабря 1992 г., а уже в апреле 1998 г. в комбинации с карбоплатином он был одобрен FDA (Специализированной административной комиссией по разрешению новых лекарств для лрименения в клинической практике) для первой линии химиотерапии РЯ и прочно вошел в стандарты лечения. Все это время продолжалось изучение паклитаксела в различных комбинациях и дозировках, отрабатывались оптимальные режимы лечения для больных РЯ. Результаты наиболее крупных исследований представлены в таблице 1.
На основании данных рандомизированных исследований, паклитаксел с цисплатином или карбоплатином активно внедрялся в повседневную клиническую практику. Однако данные протокола ICON–3, проведенного в 1995–98 гг., показали, что схема САР и один карбоплатин в качестве 1–й линии не уступают по отдаленным результатам паклитакселу с карбоплатином, а при учете побочных эффектов даже предпочтительнее для больных РЯ с I–IIIа стадиями. Преимущество схем с паклитакселом проявилось только для пациенток с неблагоприятным прогнозом, то есть с остаточной опухолью более 1 см [11].
Результаты проведенных протоколов не отвечают на многие вопросы, волнующие клиницистов, поэтому проводятся новые исследования, преследующие конкретные узкие цели, например: GOG 157
и
GOG 175
должны показать роль паклитаксела при ранних стадиях РЯ (I–II ст.) у больных с высоким риском развития рецидива заболевания; протоколы
SWOG
,
GOG 178
и протокол итальянской группы должны продемонстрировать роль консолидирующей терапии паклитакселом в стандартном и еженедельном режимах при достижении полной ремиссии у больных с диссеминированным РЯ; исследование
EORTC–GCG
покажет эффективность нового режима паклитаксела с топотеканом, а также определит роль и место циторедуктивной операции при лечении паклитакселом и цисплатином.
Помимо расширения знаний при проведении III фазы клинических испытаний, в эксперименте был обнаружен терапевтический синергизм паклитаксела с гемцитабином, топотеканом, фторурацилом, цисплатином, циклофосфамидом, этопозидом, винкристином [12]. Указанное обстоятельство и высокая активность паклитаксела в режиме монохимиотерапии у больных РЯ послужили основанием для изучения новых схем лечения. Данные исследования, представленные в таблице 2, не были рандомизированными. Это, скорее, попытка оптимизировать лечение больных РЯ с неблагоприятными факторами прогноза.
Результаты применения паклитаксела в комбинации с цисплатином или карбоплатином, а также и с другими препаратами у нелеченных больных превосходят эффективность стандартной комбинации цисплатина и циклофосфамида. Проводилось изучение более агрессивных режимов паклитаксела в сравнении с режимом: паклитаксел 175 мг/м2 и карбоплатин AUC6. Так, проведение двух курсов карбоплатина AUC9, а затем 6 курсов паклитаксела 135 мг/м2/24–часовой в/в инфузией и цисплатина 100 мг/м2 внутрибрюшинно – продемонстрировало преимущество только по длительности сохранения эффекта . Германо–франко–австрийское исследование сравнивает комбинации: паклитаксела 175 мг/м2 с карбоплатином AUC6 – 117 больных и карбоплатин AUC6 + паклитаксел 175 мг/м2 + эпирубицин (перед паклитакселом) 60 мг/м2 – 111 больных. При оценке эффективности лечения достоверных различий не получено (ПР–42 и 48%, ЧР–30 и 38% – соответственно), токсичность была более высокой при лечении трехкомпонентной схемой [21].
Получены результаты лечения 35 больных распространенным раком яичников паклитакселом в 1–й день в дозе 200 мг/м2/3–часовая инфузия, цисплатином во 2–й день 70 мг/м2 и в 1,2,3 дни ифосфамидом 1,5 г/м2 . Эффективность этой комбинации – 86% (ПР–59%), медиана времени до прогрессирования составила 23 месяца [19].
Очень интересными и перспективными, на наш взгляд, являются режимы, сочетающие паклитаксел с гемцитабином. Так, схема: паклитаксел 175 мг/м2 в 1–й день, карбоплатин AUC 5 в 1–й день и гемцитабин 800 мг/м2 в 1 и 8 день, по предварительным данным, эффективна у 100% первичных больных РЯ с III–IV стадиями болезни [14]. Эта комбинация успешно изучается и при лечении больных с рецидивами рака яичников [20]. Новая комбинация топотекана по 0,75 – 1 мг/м2 1–3 дни, паклитаксела 175 мг/м2/3–х часовая инфузия в 3–й день, и карбоплатина AUC 5 в 3–й день продемонстрировала эффективность у 88,2% (ПР–23,5%) больных (оценивалось 17 пациенток). Основная лимитирующая токсичность этой схемы – гематологическая [17,18 ].
С учетом высокой эффективности паклитаксела при РЯ его необходимо включать в схемы первой линии химиотерапии, особенно при наличии нескольких прогностических неблагоприятных факторов у больной.
При прогрессировании или стабилизации болезни на стандартном лечении (СР) или при раннем рецидиве заболевания схемы химиотерапии 2–й линии обязательно должны включать паклитаксел
. В РОНЦ им. Н.Н. Блохина РАМН продолжает изучаться схема 2–линии лекарственной терапии при РЯ: паклитаксел (абитаксел) 120–135 мг/м2/3–часовая инфузия в 1–й день, карбоплатин AUC 5 в 1–й день и альтретамин
per os
160 мг/м2/сутки 2–15 дни. Лимитирующая токсичность данной схемы – гематологическая (тромбоцитопения, лейкопения, анемия), поэтому на первый курс лечения больная получает паклитаксел 120 мг/м2, а при хорошей переносимости дозировка может быть увеличена до 135 мг/м2. Предварительные результаты применения данной комбинации показали ее перспективность и хорошую переносимость, а объективный клинический эффект составил 70,4%. Комбинация хорошо переносится пожилыми больными.
Таким образом, все кооперированные исследования продемонстрировали высокую эффективность паклитаксел–платиносодержащих режимов
, а также трехкомпонентных схем при проведении 2 линии лечения. Применение данных комбинаций может быть ограничено появлением миело– и нейротоксичности.
В ГУ РОНЦ им. Н.Н. Блохина РАМН, ГУН НИИ Онкологии им. проф. Н.Н. Петрова МЗ РФ и Свердловском областном онкологическом диспансере МНПЦ «Онкология» проводится клиническое исследование паклитаксела, выпускаемого компанией Dr.Reddy’s Laboratories Ltd. Митотакс
®
, производства фармакологической компании Dr.Reddy’s. По строению он идентичен паклитакселу (Paclitaxel), противоопухолевому средству, и обладает аналогичной активностью. Препарат выпускается в удобной расфасовке: во флаконах 30 мг/5 мл, 100 мг/16,7 мл и 250 мг/41,7 мл. Состав: активное вещество: паклитаксел, 1 мл концентрата содержит 6 мг активного вещества. Вспомогательные вещества: полиоксил 35, касторовое масло, спирт абсолютный. При предварительном анализе опыта применения Митотакса у больных РЯ спектр противоопухолевой активности и токсичности полностью аналогичен паклитакселу, что позволяет рекомендовать препарат для широкого применения в клинической практике [21].Литература:
1. Ten Bokkel Huinink W, Gore W., et al., J.Clin. Oncol. 1997; 15: 2183–2193.
2. Canetta R. The development of new citotoxic drugs for ovarian cancer: review of literature and methodological aspects. Forum 1994:4:702–720.
3. Stuart G., Bertelsen K., Mangioni C., et al. Updated analysis shows a highly significant improved overall survival (OS) for cisplatin–paclitaxel as first line treatment of advanced OC: mature results of the EORTC–GCCG, NOCOVA, NC 1C CTG and Scottish Intergroup Trial. Proc. Am. Soc. Clin. Oncol (ASCO) 1998: 17:361a (abs.1394)
4. McGuire W.P., Hoskins W.J., Brady M.P. et al. Cyclophosphamide and cisplatin compared with paclitaxel and cisplatin in patients with stage III and IV ovarian cancer. N.Engl. Med., 1996,334:1–6.
5. Muggia F., Brady M., Sutton G., et. al. Phase III trial of cisplatin or paclitaxel vr their combination in suboptimal stage III and IV epithelial OC. Ginecologic Oncology Group study 132., Proc. ASCO, 1997 16:352a.
6. Ozols R.F., Bundy B., Fowler J., et al. Randomized phase III study of cisplatin vs carboplatin in optimal stage III OC: a GOG study. Proc. ASCO, 1999, 18: 356a
7. Ozols R.F. Ovarian Cancer (Current Status and Future Directions). In: Progress in Anti–cancer Chemotherapy. Ed. By D. Khayat and C.N. Hortobagye. Springer – Verlag. France, 2000, p.p. 135–144.
8. Neijt J.P., Hansen M., et al. Randomised phase III study in previously untreated epithelial OC FIGO stage IIb, IIc, III, IV comparing paclitaxel–cisplatin and paclitaxel–carboplatin. Proc. ASCO 1997: 16–352a (abs. 1259)
9. du Bois A., Richter B., et al. CisplatinPaclitaxel vs CarboplatinPaclitaxel as 1–ts–line treatment in OC. Proc. ASCO, 1998, 17,(abs. 1395).
10. Colombo N., et.al. Randomized trial of paclitaxel and carboplatin vs a control arm of carboplatin or CAP : the tial International collaborative Ovarian Neoplasm Study (ICON3). Proc. ASCO 2000;19:379a (abs.1500).
11. Colombo N., et.al. ICON3., Lancet 2002.
12. Verweij J., Clavel M., Chevalier B. Paclitaxel (Taxol) and docetaxel (Taxotere): not simply two of a kind. Ann Oncol. 1994, 5:495–505.
13. Kaern J., Trope C., et al. A stady of weekly taxol in patients with recurrent platinum resistant OC. 25–TH ESMO Congress. 13–17 Oct. 2000. vol.11,suppl.4, p.85 abs. 379p.
14. Hansen S.W., Anderson H., Boman K. Et al. Gemcitabine, Carboplatin and Paclitaxel as first–line treatment of ovarian cancer FIGO Stages IIB–IV. Proc. ASCO, 1999,v.18,a.1379.
15. Papadimitriou C., Colombo N., Ieda N., et. al. The addition of ifosfamide or epirubicin to paclitaxel/cisplatin regimen in epithelial OC: randomized phase II study. Proc. ASCO, 1999, abs.1396
16. Engelholn S., Hovarth G., et. al., Reverse–schedule oral topotecan, paclitaxel and carboplatin in primary advansed OC: A phase I dose–randing study. 25 ESMO Congress 13–17 oct.,2000– Ann. Onc. V.11., suppl.4., p.81., abs.361o.
17. Herben V.M., Panday V.R., et.al. Phase I and pharmacologic study of the combination of paclitaxel, cisplatin and topotecan administered intravenously every 21 days as first–line therapy in patients with advanced OC. J. Clin. Oncol. 1999,17 (3), p.747–755.
18. Bolis G., Scarfone G., Sciatta C., et al. A phasse II stady of Topotecan, Carboplatin and Paclitaxel as front line treatment in suboptimal advanced epitelial ovarian cancer (AEOC). Proc. ASCO 2000,abs.1543.
19. Papadimitriou Ch., Gergoulias V., et.al., First–line treatment of advansed, suboptimally debulked, epithelial OC with the combination of ifosfamide, paclitaxel and cisplatin: long–term results of a phase II stady. 25 ESMO Congress 13–17 oct.,2000– Ann. Onc. V.11., suppl.4., p.83., abs.371p.
20. Geertsen p., Hansen M., StrOyer J., et al. Combination chemotherapy with relapsed ovarian carcinoma. Proc. ASCO 1999, abs.1395.
21. Frickhofen N., Bunjes d., Berdel W. Et al. Two years of the German multicenter phase II trial of high–dose chemotherapy with stem cell support in advanced ovarian cancer. 25th ESMO Congress. –Annals of Onc., vol.11, suppl.4,Oct.2000,p.82,abs.363o.
22. Емельянов Д.Е., Фрейчко Н.В. Опыт применения препарата Митотакс в Свердловском областном онкологическом диспансере МНПЦ «Онкология»., Здравоохранение Урала 2002г № 8(14), стр.33–34.
Похожие по действию препараты:
- Методжект (Metoject) Раствор для инъекций
- Вартек (Wartec) Крем для наружного применения
- Летрозол (Letrozole) Таблетки пероральные
- Медроксипрогестерона ацетат (Medroxyprogesterone acetate) Субстанция-порошок
- Имуран (Imuran) Таблетки пероральные
- Золадекс (Zoladex) Капсула
- Паклитаксел (Paclitaxel) Субстанция-порошок
- Ломустин (Lomustine) Таблетки пероральные
- Вотриент (Votrient) Таблетки пероральные
- Циклофосфан (Cyclophosphan) Субстанция-порошок
** Справочник лекарств предназначен исключительно для ознакомительных целей. Для получения более полной информации просим Вас обращаться к аннотации производителя. Не занимайтесь самолечением; перед началом применения препарата Паклитаксел Вы должны обратиться к врачу. EUROLAB не несет ответственности за последствия, вызванные использованием размещенной на портале информации. Любая информация на сайте не заменяет консультации врача и не может служить гарантией положительного эффекта лекарственного средства.
Вас интересует препарат Паклитаксел? Вы хотите узнать более детальную информацию или же Вам необходим осмотр врача? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору – клиника Eurolab всегда к Вашим услугам! Лучшие врачи осмотрят Вас, проконсультируют, окажут необходимую помощь и поставят диагноз. Вы также можете вызвать врача на дом. Клиника Eurolab открыта для Вас круглосуточно.
** Внимание! Информация, представленная в данном справочнике лекарств, предназначена для медицинских специалистов и не должна являться основанием для самолечения. Описание препарата Паклитаксел приведено для ознакомления и не предназначено для назначения лечения без участия врача. Пациентам необходима консультация специалиста!
Если Вас интересуют еще какие-нибудь лекарственные средства и медикаменты, их описания и инструкции по применению, информация о составе и форме выпуска, показания к применению и побочные эффекты, способы применения, цены и отзывы о лекарственных препаратах или же у Вас есть какие-либо другие вопросы и предложения – напишите нам, мы обязательно постараемся Вам помочь.