- Виды и причины плацентарной недостаточности
- Диагностика плацентарной недостаточности
- Лечение плацентарной недостаточности
Большинство женщин знают, что плацента связывает маму и малыша во время беременности и при помощи нее к малышу поступают питательные вещества и кислород.
Бывают ли такие ситуации, когда плацента перестает правильно и полноценно выполнять свою функцию? Можно ли как то предотвратить это?
Фетоплацентарная недостаточность: определение
При зачатии вместе с плодом одновременно формируется и развивается плацента или детское место, так называют в народе. Это уникальный временный орган, появляется он только при беременности, а когда ребёнок рождается, то и плацента выходит следом. Она выполняет важнейшие функции:
- фильтрует токсины, вредные вещества и не допускает им проникнуть к малышу;
- обеспечивает плод питанием и кислородом и выводит углекислый газ;
- производит синтез гормонов, отвечающих за течение беременности;
- отвечает за безопасность плода.
Иногда происходит так, что плацента перестаёт выполнять какую-то функцию или полностью отключается, то есть стареет раньше положенного срока, нарушается питательный обмен, кровоток – это называется фетоплацентарная недостаточность.
Какую функцию выполняет плацента
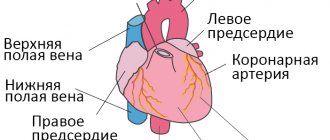
Итак, плацента – это важный орган, который образуется только во время беременности. Образуется плацента из хориона — зародышевых оболочек плода. В самом начале беременности ворсины хориона – выросты оболочки — равномерно покрывают всю поверхность плодного яйца, начиная со второго месяца беременности с одной стороны плодного яйца ворсины начинают удлиняться, увеличиваться в размерах и формируют плаценту.
Внутри ворсин течет кровь малыша, а снаружи они омываются кровью матери. Между кровотоком мамы и малыша расположен всего один слой клеток, который и играет роль барьера между организмом матери и ребенка. Благодаря этой мембране кровь матери и плода не смешивается.
Однако в последние годы стало известно, что клетки крови плода все-таки проникают через плацентарный барьер в кровоток матери и благодаря этому стало возможным проведение генетических анализов и определение хромосомных аномалий, резуса фактора и пола плода по крови беременной женщины (неинвазивный пренатальный тест).
В плаценте происходит постоянный обмен веществ между мамой и ребенком. Из материнской крови к плоду поступает кислород и питательные вещества, от плода обратно к матери углекислый газ и продукты обмена, подлежащие выведению из организма.
Плацентарный барьер выполняет иммунологическую функцию, поскольку пропускает некоторые защитные антитела – клетки крови, обеспечивающие борьбу с инфекционными агентами, кроме того он является непроницаемым для некоторых вредных веществ, вирусов и бактерий. К сожалению, плацентарный барьер легко преодолевают наркотические вещества, алкоголь, никотин, компоненты многих лекарств и некоторые вирусы.
Важной функцией плаценты является выработка гормонов и биологически активных веществ. В первую очередь это гормоны, важные для успешного вынашивания беременности, например хорионический гонадотропин, плацентарный лактоген, эстрогены и др.
К сожалению, не всегда все складывается вполне благополучно. В силу самых различных причин на разных сроках беременности могут происходить отклонения в развитии и функционировании плаценты. Изменения эти никогда не проходят бесследно для мамы и малыша, а зачастую имеют грозные последствия.
Если плацента перестает выполнять свои функции в полной мере, развивается так называемая плацентарная недостаточность. По сути, она заключается в ухудшении кровообращения в системе мать-плацента-плод.
Причины
На развитие ФПН влияют многочисленные факторы:
- болезни щитовидной железы, гипоталамуса (сахарный диабет, астма, проблемы с сердцем и другие);
- железодефицитная анемия провоцирует развитие ФПН при беременности. Организм в это время нуждается в удвоенном количестве железа, зачастую возникает его недостаток, что ведёт к дисфункции кровотока, свёртываемости и это может нарушить кровообращение в плаценте;
- инфекционные болезни и инфекции. На ранних сроках могут привести к выкидышу, а во втором и третьем триместре к патологии детского места;
- аномальное строение матки, хирургические операции и болезни женских органов (миома, эндометриоз и другие);
- многоплодная беременность;
- поздний гестоз;
- резус-конфликт;
- предлежание плаценты;
- плохое питание женщины;
- злоупотребление алкоголем, сигаретами, наркотиками и лекарственными препаратами.
Список причин обширный и поэтому, чтобы контролировать ситуацию и развитие беременности нужно своевременно посещать врача и проходить все рекомендуемые обследования.
Уже несколько лет активно применяется пренатальный скрининг, это комплекс процедур (УЗИ, биохимический анализ крови, осмотр пациентки), который позволяет выявить патологии на ранних сроках.
Лечение плацентарной недостаточности
Специфических способов лечения плацентарной недостаточности в настоящее время не существует, поскольку нет лекарственных препаратов, которые избирательно улучшают маточно-плацентарный кровоток. Именно поэтому все меры борьбы с плацентарной недостаточностью направлены на профилактику. Если пациентка относится к группе высокого риска по развитию плацентарной недостаточности, с раннего срока беременности ей назначают лекарственные препараты, эффективность которых хорошо доказана и которые предупреждают раннее развитие выраженных нарушений функции плаценты.
Если во время проведения дополнительных методов оценки состояния плода выявляются начальные нарушения поступления кислорода к малышу, проводится медикаментозное лечение, направленное на увеличение притока крови и кислорода через плаценту и обязательные контрольные обследования на фоне проводимой терапии. Если изменения серьезные и малыш испытывает выраженный дефицит кислорода и питательных веществ, состояние его страдает, то в таких случаях проводится экстренное родоразрешение.
Классификация ФПН
ФПН по срокам образования:
- Первичная – развивается до 16 гестационной недели, главная причинам- проблемы в имплантации, плацентации.
- Вторичная – происходит после 16 недели из-за внешних неблагоприятных факторов.
ФПН по стадии развития:
- Острая форма – развивается быстро и в любой момент течения беременности, даже возможно образование патологии при родах. Орган перестаёт предавать кислород, в результате развивается гипоксия и угроза летального исхода для ребёнка. Чаще это происходит из-за тромбоза, отслойка, инфаркта плаценты.
- Хроническая форма – развивается в основном из-за проблем в кровообращении матка-плацента. Формируется патология во втором триместре и активно проявляется в последние недели вынашивания.
Наиболее распространяя является хроническая фетоплацентарная недостаточность, её подразделяют на несколько форм:
- компенсированная – не опасна для жизни ребёнка и купируется защитным механизмом организма. Врач же при таком диагнозе более тщательно ведёт беременность и при необходимости прописывает терапию;
- декомпенсированная – представляет угрозу для развития плода, легко обходит защиту и требует лечения. Может стать причиной гипоксии, задержки развития и вызвать патологии сердца, сосудов;
- субкомпенсированная – данная форма не поддаётся защитным механизмам и вызывает осложнения у плода (патологии и болезни), срывает нормальное течение беременности;
- критическая – наиболее опасная. Функционирование плаценты практически полностью нарушено и гибель плода неизбежна.
ФПН степени:
- 1 – выделяют 1а – патология из-за нарушения кровотока в матке-плацента и 1б – нарушен в форме плод-плацента;
- 2 – дисфункция кровотока обоих формах: матка-плацента и плод-плацента;
- 3 – критическая степень. Нарушен кровоток в форме плод-плацента, а матка-плацента может либо функционировать, либо работать , но не в полную меру.
От вида, формы и степени патологии зависит терапия, жизнь ребёнка и его развитие.
Виды и причины плацентарной недостаточности
Врачи различают острую и хроническую плацентарную недостаточность:
Острая плацентарная недостаточность
Это состояние, требующее экстренного вмешательства врачей. Она характеризуется стремительным ухудшением плацентарного кровотока. Острая плацентарная недостаточность возникает в основном в результате отслойки плаценты или гибели отдельных участков ткани плаценты например при образовании тромбов в сосудах. Причиной отслойки может послужить травма живота, антифосфолипидный синдром.
Фосфолипиды – это сложные жиры, которые входят в состав оболочек всех клеток организма. В ряде случаев иммунная система организма вырабатывает большое количество антител к некоторым собственным фосфолипидам и белкам, связывающим эти липиды. Они называются антифосфолипидные антитела и при взаимодействии с клетками организма вызывают повреждение клеток и активацию свертывающей системы крови, что приводит к тромбообразованию.
Антифосфолипидный синдром является самой частой причиной тромботических осложнений при беременности, в том числе причиной отслойки плаценты и острой плацентаной недостаточности. Вызвать отслойку плаценты может также тяжелое течение гестоза – грозного осложнения второй половины беременности, проявляющееся отеками, повышением давления и появлением белка в моче.
Острая плацентарная недостаточность развивается при отслойке более 2/3 поверхности плаценты.
В случае развития острой плацентарной недостаточности необходимо максимально быстро провести операцию кесарева сечения для сохранения жизни малыша и мамы.
Хроническая плацентарная недостаточность
Значительно чаще у беременных женщин встречается хроническая плацентарная недостаточность. В этом случае происходит нарушение формирования и созревания плаценты, уменьшается маточно-плацентарный и плодово-плацентарный кровотоки, ограничивается газообмен и обмен веществ в плаценте, снижается синтез плацентарных гормонов. Все эти изменения определяют недостаточное поступление кислорода и питательных веществ малышу, вызывают задержку роста и развития плода.
Причинами плацентарной недостаточности чаще всего являются перенесенные аборты, особенно хирургический аборт при первой беременности, курение, при этом количество и крепость выкуриваемых сигарет значения не имеют, поскольку на формировании неполноценных сосудов плаценты негативное действие оказывает табачный дым, а не никотин.
В группу риска по развитию плацентарной недостаточности входят также женщины с хроническими заболеваниями, такими как артериальная гипертензия, железодефицитная анемия, пиелонефрит, сахарный диабет, заболевания щитовидной железы. В последние годы наблюдается значительный рост плацентарной недостаточности, вызванной бактериями, вирусами, грибами. Причиной этого может быть как острая инфекция, перенесенная будущей мамой во время беременности, так и активация хронического инфекционного процесса в организме беременной женщины.
Немаловажное значение в формировании хронической плацентарной недостаточности играет патология матки: эндометриоз, пороки развития матки (седловидная, двурогая). Фактором риска врачи считают также миому матки. Безусловно, целый ряд лекарственных средств оказывает неблагоприятное влияние на формирование плаценты и развитие плода. В настоящее время определен список препаратов, не разрешенных к применению во время беременности.
Также большое значение в развитии плацентарной недостаточности имеет тромбофилия – повышенная склонность организма к образованию сгустков крови — тромбов в сосудах.
В некоторых случаях плацентарная недостаточность может быть обусловлена наличием хромосомных нарушений у плода, в частности при синдромах Дауна (наличие дополнительной 21 хромосомы у плода) или синдроме Эдвардса (дополнительная 18 хромосома у плода) уже в ранние сроки беременности диагностируется нарушение функции плаценты.
Следует отметить, что среди осложнений беременности, наиболее часто приводящих к развитию хронической плацентарной недостаточности, существенным фактором является преэклампсия (или поздний гестоз) – это осложнения второй половины беременности, проявляющееся отеками, повышением давления и появлением белка в моче. Независимо от факторов, способствующих развитию плацентарной недостаточности, в основе ее лежат нарушения кровообращения в маточно-плацентарном комплексе, приводящие к нарушению всех функций плаценты. Следовательно, симптомы хронической плацентарной недостаточности будут обусловлены недостатком поступления кислорода и питательных веществ к плоду.
Это прежде всего, задержка внутриутробного развития плода – отставание размеров плода и замедление темпов его роста. Часто имеют место изменение двигательной активности плода. Сначала может быть некоторое усиление движений, а затем уменьшение. Нарушение защитной функции плаценты приводит к внутриутробному инфицированию плода под действием проникающих через плаценту патогенных (болезнетворных) микроорганизмов. Плод, развитие которого происходит в условиях плацентарной недостаточности, в значительно большей степени подвержен риску травматизации в родах, у них отмечается нарушение адаптации к внеутробной жизни, повышенная заболеваемость в первый год жизни.
По времени возникновения врачи разделяют плацентарную недостаточность на раннюю и позднюю.
Ранняя (или первичная) плацентарная недостаточность
Развивается до 16 недель беременности. Она возникает уже на этапе формирования плаценты и связана с заболеваниями беременной женщины, имеющимися до беременности, к примеру с патологией матки, хронической артериальной гипертензией, эндокринологическими заболеваниями. При этом происходит формированием неполноценных сосудов в плаценте.
Поздняя (или вторичная) плацентарная недостаточность
Возникает после 16 недель беременности и чаще всего связана с заболеваниями, возникшими уже во время беременности. Чаще всего это железодефицитная анемия (то есть снижение концентрации гемоглобина и железа в крови), гестационный сахарный диабет (то есть нарушение усвоения организмом глюкозы, возникшее на фоне беременности), перенесенные вирусные и бактериальные инфекции.
Важным является подразделение плацентарной недостаточности на компенсированную и декомпенсированные формы.
Компенсированная плацентарная недостаточность
Развивается, к примеру, при угрозе прерывания беременности и нетяжелых формах позднего гестоза, в случае, если эти осложнения успешно поддаются медикаментозной коррекции.
Декомпенсированная плацентарная недостаточность
Вызывает развитие задержки развития плода, хронической внутриутробной гипоксии, вплоть до гибели плода.
Симптомы
Одинаковых и точных признаков ФПН нет. Все зависит от формы патологии. Естественно, что при острой недостаточности симптомы невозможно не заметить: изменяется самочувствие женщины, кровотечение открывается, а ребёнок резко затихает и прекращает шевелиться.
Хроническая форма протекает спокойно, лишь возможны небольшие кровяные выделения периодически, а размеры живота не соответствуют норме по сроку беременности.
Именно поэтому, женщина должна посещать все назначенные УЗИ и скрининги. Именно с помощью данных процедур врач может оценить функциональность и состояние плаценты.
Фетоплацентарная недостаточность и перинатальные осложнения у беременных с железодефицитной анемией
Согласно современным данным дефицит железа в конце гестационного процесса развивается у всех без исключения беременных либо в скрытой, либо в явной форме. Это связано с тем, что беременность сопровождается дополнительной потерей железа: 320–500 мг железа расходуется на прирост гемоглобина и возросший клеточный метаболизм, 100 мг – на построение плаценты, 50 мг – на увеличение размеров матки, 400–500 мг – на потребности плода. В результате с учетом запасного фонда плод обеспечивается железом в достаточном количестве, но при этом у беременных нередко развиваются железодефицитные состояния различной степени тяжести [9,14]. Отрицательное воздействие ЖДА на течение беременности объясняют тем, что развивающаяся гипоксия может вызвать стресс в организме матери и плода, стимулируя синтез кортикотропин–рилизинг–гормона (КРГ). Повышенные концентрации КРГ – главный фактор риска преждевременных родов, гестоза и преждевременного излития околоплодных вод. КРГ усиливает выброс кортизола плодом, что может ингибировать рост плода. Результатом этих осложнений ЖДА может быть оксидативный стресс эритроцитов и фетоплацентарного комплекса [7,11,17]. При длительном течении анемии нарушается функция плаценты, происходит изменение ее трофической, метаболической, гормонпродуцирующей и газообменной функций, развивается плацентарная недостаточность. Часто (у 40–50%) присоединяется гестоз; преждевременные роды наступают у 11–42%; слабость родовой деятельности отмечается у 10–15% рожениц; гипотонические кровотечения в родах – у 10%; послеродовой период осложняется гнойно–септическими заболеваниями у 12% и гипогалактией у 38% родильниц [7,9,10,13]. Фетоплацентарная недостаточность (ФПН) при ЖДА обусловлена резким снижением уровня железа в плаценте, изменением активности дыхательных ферментов и металлопротеиназ [12]. А.П. Милованов считает, что одним из существенных механизмов в развитии гипоксической, циркуляторной, тканевой и гемической гипоксии в плаценте является патология спиральных артерий матки [6]. По мнению Г.М. Савельевой и соавт. (1986 г.), в основе ФПН любой этиологии лежат нарушения плацентарного кровообращения, включая микроциркуляцию, и обменных процессов, которые тесно связаны между собой и нередко взаимообусловлены. Они сопровождаются изменениями кровотока не только в плаценте, но также в организме матери и плода. В полной мере это относится и к ФПН, развивающейся при беременности, отягощенной ЖДА [19]. Основными критериями ЖДА являются низкий цветовой показатель, гипохромия эритроцитов, снижение содержания сывороточного железа, повышение общей железосвязывающей способности сыворотки крови и клинические признаки гипосидероза. Важнейшим показателем анемий является уровень гемоглобина, при котором следует диагностировать анемию. Эта величина неоднократно менялась в сторону повышения минимального показателя: 100, 110 г/л (ВОЗ, 1971). Легкая (I) степень анемии характеризуется снижением уровня гемоглобина до 110–90 г/л; средняя (II) степень – от 89 до 70 г/л; тяжелая (III) – 70 и менее г/л [2, 4]. Лечение ЖДА предполагает, помимо устранения основной причины этого патологического состояния, применение препаратов железа. Идеальный противоанемический препарат должен содержать оптимальное количество железа, оказывать минимальные побочные эффекты, иметь простую схему применения, наилучшее соотношение эффективность/цена. Однако многие железосодержащие препараты обладают рядом недостатков, создающих проблемы при их использовании: неприятные органолептические свойства, низкая биодоступность, способность раздражать слизистую оболочку желудочно–кишечного тракта, что часто обусловливает диспептические явления. С этой точки зрения обоснован интерес к проблеме поиска новых методов лечения ЖДА, способных влиять не только на состояние беременной, но и предупреждать неблагоприятные осложнения у плода, связанные с нарушением функционирования ФПК [1,7,13,14]. Лечение ЖДА у беременных должно быть комплексным. В первую очередь необходимо уделить внимание диете. Однако основной вид терапии ЖДА у беременных – это препараты железа [1,9,18]. Большой клинический интерес представляет Сорбифер Дурулес с высоким содержанием Fe2+ (100 мг) и аскорбиновой кислоты (60 мг), которая создает более благоприятные условия для всасывания железа в кишечнике и обеспечивает его более высокую биодоступность. Целью исследования явилась оценка эффективности применения железосодержащих препаратов в профилактике ФПН и перинатальных осложнений у беременных с анемией. Материалы и методы исследования Под нашим наблюдением находились 115 беременных женщин с ЖДА во II и III триместрах гестации. Беременные были разделены на две группы. В 1–ю группу вошли 75 беременных, у которых анемия была диагностирована во II триместре беременности; 2–ю группу (группа сравнения) составили 40 пациенток, которые поступили в институт перед родоразрешением в 35–40 нед гестации. Всем беременным проводилась терапия ЖДА железосодержащим препаратом Сорбифером Дурулесом в непрерывном режиме со II триместра (1 таблетка в сутки), а у беременных 2–й группы этот препарат был применен в 36–38 нед (по 1 таблетке 2 раза в сутки). Возраст пациенток находился в пределах от 22 до 37 лет. У 37 (49,6%) пациенток 1–й группы и у 21 (52,5%) 2–й группы предстояли первые роды, у 38 (50,4%) и 19 (47,5%) – повторные. Из особенностей акушер-ско–гинекологического анамнеза у беременных обеих групп следует отметить нарушение менструального цикла у 17 (22%) и 16 (40%) соответственно, самопроизвольные выкидыши – у 18 (24%) и 10 (25%). Перинатальные потери имели в анамнезе 5 (7%) пациенток 1–й группы и 6 (15%) пациенток 2–й группы. У 88,6% беременных обеих групп имелись различные экстрагенитальные заболевания: патология сердеч-но–сосудистой системы у 12 (16%) беременных в 1–й группе, у 6 (15%) – во 2–й; хронический тонзиллит – у 12 (16%) и у 7 (17,5%) пациенток соответственно; хронические бронхолегочные заболевания – у 5 (6,6%) и 3 (7,5%); сахарный диабет 1 типа – у 8 (11%) и 9 (22,5%); патология щитовидной железы – у 5 (6,6%) и 4 (10,0%) соответственно. Перечисленные соматические заболевания и осложнения акушерско–гинекологического анамнеза создавали неблагоприятный фон для развития беременности, вызывая отклонения в течении гестации. Лабораторная диагностика анемии основывалась на определении содержания гемоглобина, количества эритроцитов, сывороточного железа и цветового показателя крови. Исследование маточно–плацентарно–плодового кровотока проводилось на ультразвуковом приборе Voluson–730, оснащенном специализированным датчиком (RAB 4–8p), путем использования цветового допплеровского картирования и импульсной допплерометрии артерии пуповины, грудного отдела аорты плода, средней мозговой артерии плода и сосудов плаценты. Качественный анализ кривых скоростей кровотока включал определение систоло–диастолического отношения (С/Д) в перечисленных сосудах (нормативные показатели С/Д в аорте до 5,6, в артерии пуповины до 2,8, в спиральных артериях 1,60 – 1,80, средней мозговой артерии 3,5–5,0) [10,11,15]. Увеличение мозгового кровотока служит проявлением компенсаторной централизации плодового кровообращения при внутриутробной гипоксии в условиях сниженной плацентарной перфузии. По данным D. Arduini и соавт. [16], допплерометрические исследования свидетельствуют о том, что у плодов с задержкой внутриутробного роста (ЗВУР) и анемией имеется значительное снижение пульсационного индекса в средней мозговой артерии. Исследователи находят, что пульсационные показатели средней мозговой артерии являются наилучшим тестом при выявлении этой патологии. При гипоксии плода сопротивление кровотоку в общей сонной артерии и средней мозговой артерии уменьшается, а сопротивление в аорте и пупочной артерии увеличивается (чувствительность метода 89%, специфичность 94%). При визуальной оценке результатов 3D–исследования выбранной зоны плаценты обращали внимание на характер распределения сосудистого компонента, организацию сосудов в исследуемой области. При компьютерной обработке плацентограмм рассчитывали следующие параметры: VI – индекс васкуляризации, FI – индекс кровотока. Нормативные показатели маточно–плацентарного кровотока, разработанные в отделении перинатальной диагностики МОНИИАГ: центральная зона – VI 4,0–8,1; FI 42,0–45,0; парацентральная – VI 3,8–7,6; FI 40,5–43,7; периферическая – VI 2,8–5,9; FI 37,5–42,1 [12]. Для верификации ультразвуковых признаков ФПН проведено изучение морфологического состояния плацент после родов. Результаты исследования и обсуждение Различные клинические проявления анемии (бледность кожных покровов и видимых слизистых оболочек, тахикардия, слабость, снижение работоспособности, головокружение, парестезии нижних конечностей) имелись у 12 (16,0 %) пациенток 1–й группы и у 20 (50%) – 2–й группы. Течение данной беременности было отягощено ранним токсикозом у 36 (48%) и 27 (67,5%) пациенток 1–й и 2–й групп соответственно, угрозой прерывания беременности в I триместре – у 18 (24,0%) и 26 (65,0%). II триместр беременности был осложнен угрозой прерывания у 8 (10,6%) женщин 1–й группы и у 18 (45,0%) – 2–й группы, водянкой беременных – у 5 (6,6%) и 11 (27,5%) соответственно. В III триместре основными осложнениями гестации были гестоз легкой и средней степеней тяжести – у 6 (8,0%) и 9 (22,5%) беременных 1–й и 2–й групп наблюдения, угроза преждевременных родов – у 5 (6,6%) и 8 (20%), причем у 3 беременных 1–й группы и у 7 – 2–й, несмотря на проводимую терапию, произошли преждевременные роды в 35–36 нед беременности. Диффузное утолщение плаценты было диагностировано у 4 (5,3%) беременных 1–й группы и 5 (12,5%) – 2–й, ФПН – у 16 (21,3%) и 23 (57,5%), ЗВУР – у 15 (20,6 %) пациенток 1–й группы и у 26 (65,0%) группы сравнения, маловодие – у 12 (16,0%) и 7 (17,5%), многоводие – у 4 (5,3%) и 5 (12,5%) соответственно. Обращает на себя внимание, что наиболее тяжелые гестационные осложнения – ФПН и ЗВУР наблюдались у пациенток с анемией II и III степени (табл. 1). У этих же женщин отмечены и наиболее серьезные экстрагенитальные заболевания (сахарный диабет, артериальная гипертензия, бронхолегочные заболевания). Роды у пациенток группы сравнения достоверно чаще осложнялись несвоевременным излитием вод, аномалиями родовой деятельности; последовый и ранний послеродовой периоды – кровотечениями. Течение послеродового периода значительно чаще было патологическим. Представленные данные свидетельствуют о достоверно более частых осложнениях течения беременности, родов и послеродового периода у пациенток 2–й группы (p<0,05). Значительно реже гестационные осложнения наблюдались у пациенток с анемией легкой степени. В частности, у них не отмечено признаков внутриутробного страдания плода. Это свидетельствует о том, что частота и тяжесть гестационных осложнений коррелируют со степенью тяжести анемии. Всем беременным проведена комплексная терапия гестационных осложнений, в том числе профилактика или лечение ФПН (антиагрегантная, антиоксидантная терапия, гепатопротекторы). Показатели красной крови у беременных с ЖДА до и на фоне лечения представлены на рисунке 1. Прирост среднего уровня гемоглобина в 1–й группе после лечения по отношению к исходному составил 23,2 г/л, сывороточного железа – 11,6 мкмоль/л, тогда как во 2–й группе значительной положительной динамики в показателях красной крови не отмечено и прирост уровня гемоглобина составил 5 г/л, а уровень сывороточного железа оставался практически на исходном уровне. Показатели объемного маточно–плацентарного кровотока у беременных обеих групп представлены в таблице 2. Наши исследования свидетельствовали о снижении васкуляризации плаценты (гиповаскуляризация) у пациенток 2–й группы, но в 1–й группе несколько сниженные показатели регистрировались в периферических зонах, тогда как во 2–й группе они были низкими во всех зонах, что обусловливалось сосудистым спазмом и начинающимися реологическими нарушениями в межворсинчатом пространстве. У пациенток как 1–й, так и 2–й группы нарушения плацентарного кровообращения коррелировали с изменениями материнской и плодовой гемодинамики, что выражалось в достоверном повышении резистентности в спиральных артериях, в сосудах пуповины и аорте, а показатели С/Д в спиральных артериях приближались к линейному виду (табл. 3). Во 2–й группе отмечена тенденция к большему повышению С/Д. При этом С/Д в средней мозговой артерии плода было повышено только у беременных 2–й группы. Лишь у одной пациентки 2–й группы с анемией тяжелой степени (Hb 68 г/л) при повышенной резистентности кровотоку в артерии пуповины и аорте плода в средней мозговой артерии отмечено ее снижение. Ребенок родился с анемией тяжелой степени (Hb 112 г/л). При включении в терапию препаратов, направленных на улучшение функции ФПК, а также железосодержащего препарата, отмечена положительная динамика в показателях объемного кровотока у пациенток обеих групп по сравнению с исходными данными, однако у беременных 2–й группы они оставались несколько ниже, чем у пациенток 1–й группы и нормативных (табл. 4). Показатели С/Д при допплерометрии сосудов матери и плода на фоне лечения в 1–й группе приближались к нормативным. Во 2–й группе С/Д в артерии пуповины и аорте плода имело тенденцию к нормализации, тогда как в спиральных артериях и средней мозговой артерии плода сохранялась повышенная резистентность, что, по–видимому, связано с включением в эту группу беременных с анемией средней и тяжелой степени тяжести и недостаточным эффектом кратковременной терапии. При исследовании гормональной функции плаценты у беременных с анемией было обнаружено, что только у 38% женщин 1–й группы и 25% 2–й она была нормальной. У 22,0% и 25,0% беременных соответственно она была напряженной, а у 12% и 20% пациенток 1–й и 2–й групп отмечено истощение гормональной функции плаценты (табл. 5). Известно, что очень сложно достичь компенсации ФПН при истощении функции ФПК. Как показали наши исследования, положительный эффект от проводимой терапии у большинства пациенток с истощением функции ФПК ассоциирован с ранним началом лечения анемии и ФПН у пациенток 1–й группы. В 1–й группе через естественные родовые пути были родоразрешены 63 (84%) беременные, плановое кесарево сечение произведено 10 (13,3%) пациенткам. Показаниями к плановому кесареву сечению явились предлежание плаценты – в одном случае, тяжелое течение сахарного диабета – в 3 наблюдениях, абсолютная неготовность организма к родам и пожилой возраст – у 4 пациенток; по одному случаю составил рубец на матке после кесарева сечения и после миомэктомии. Экстрен-ное кесарево сечение произведено 2 (3,0%) беременным по поводу гестоза тяжелой степени и прогрессирующей ФПН в сроке 31–32 нед. СЗРП I степени наблюдался у 13,3% и II степени – у 6,7% новорожденных. В данной группе было 2 детей, родившихся в состоянии асфиксии. У 12 (16%) новорожденных оценка состояния по шкале Апгар на 1–й минуте составила 7 баллов, на 5–й минуте у всех детей – 8 и 9 баллов. Средняя масса тела у новорожденных матерей 1–й группы достигала 3215,0 г (2650,0–3390,0 г). Показатели мозгового кровотока находились в пределах нормативных значений (С/Д=3,3–3,4; ИР=0,70–0,71). Таким образом, рождение более 75% здоровых новорожденных у беременных с ЖДА, диагностированной во II триместре гестации, является, безусловно, следствием адекватно проведенной и патогенетически обоснованной терапии. Все новорожденные 1–й группы в удовлетворительном состоянии выписаны домой, но 18 (24,0%) из них не на 4–5–е, а на 6–8–е сутки после рождения. Через естественные родовые пути были родоразрешены 15 (37%) беременных 2–й группы, абдоминальным путем в плановом порядке – 18 (45%). В данной группе показаниями к плановому кесареву сечению явились декомпенсация ФПН у 8 беременных, рубец на матке после кесарева сечения в одном наблюдении, острая гипоксия плода – у 4, в одном случае – тяжелый гестоз, в 4 случаях – пожилой возраст первородящей в сочетании с патологией сердечно–сосудистой системы и ФПН. В экстренном порядке абдоминально родоразрешены 7 (17,5%) пациенток по поводу прогрессирующей ФПН. СЗРП I степени наблюдался у 10 (25%) и II степени – у 9 (22,5%) новорожденных. В состоянии асфиксии (с оценкой по шкале Апгар 5–6 баллов на 1–й минуте) родились 7 (17,5%) новорожденных. У 15 (37,5%) детей на 1–й минуте оценка по шкале Апгар составила 7 баллов, на 5–й минуте у этих новорожденных оценка по шкале Апгар была 8 баллов. Средняя масса тела новорожденных у матерей 1–й группы достигала 2800,0 г (2600,0– 3060,0 г). Показатели мозгового кровотока также находились в пределах нормативных значений (С/Д=3,3–3,4; ИР = 0,70–0,71; ПИ=1,3–1,4). Лишь у одного ребенка, родившегося с анемией тяжелой степени, мозговой кровоток был снижен. У 27 (67,5%) новорожденных период ранней неонатальной адаптации протекал удовлетворительно, эти дети были своевременно выписаны домой. Все новорожденные, родившиеся у матерей с ЖДА средней и тяжелой степени, имели гипотрофию, их масса и длина тела соответствовала 3–10–му перцентильному уровню; 6 (15%) новорожденных переведены на второй этап лечения и 7 (17,5%) переведены в отделение реанимации. При анализе причин, осложнивших период ранней адаптации детей, выявлено, что высокий процент осложнений наблюдался во 2–й группе (33%). В 1–й группе число новорожденных с осложнениями было несколько меньше, хотя данный показатель также достаточно высок (24%). Наиболее часто в обеих группах отмечались синдром дыхательных расстройств и инфекционные осложнения, судорожный синдром. Характерной особенностью группы новорожденных матерей с ЖДА была задержка заживления пупочной раны, что свидетельствует о снижении регенеративных процессов, обусловленных наличием у матерей ЖДА средней степени тяжести. Имеются единичные сообщения о влиянии ЖДА на морфологические особенности строения плаценты [5]. По данным автора, имеются характерные морфологические изменения в плаценте в зависимости от времени выявления, степени анемии и проводимой терапии. По нашим наблюдениям, при изучении плацент женщин с ЖДА характерной морфофункциональной особенностью являются диссоциированный тип созревания котиледонов, наличие псевдоинфарктов, афункциональных зон, фокальных некрозов ворсин, склероза стромы ворсин и их тромбоз. Увеличение склерозированных ворсин находится в прямой зависимости от степени тяжести анемии. При анемии легкой и средней степени тяжести сохранность синтициотрофобласта составляет 80–70%, тогда как при анемии тяжелой степени сохранность не превышает 60%. У пациенток 1–й и 2–й групп достоверно разнятся морфологические характеристики плацент: у беременных, которые получали антианемическую терапию со II триместра беременности, наблюдались большая масса и размеры плаценты, полнокровие ворсин, сохранность синцитиотрофобласта, компенсаторные изменения митохондрий, что направлено на улучшение обмена в плаценте и сохранение ее способности к синтезу. При исследовании плацент у женщин 2–й группы выявлено, что для них характерно увеличение склерозированных и фибриноидно–измененных ворсин и их патологическое сближение, облитерация сосудов, скопление эритроцитов в межворсинчатом пространстве, микроинфаркты. Выводы 1. Развитие анемии во время беременности отрицательно влияет на течение гестационного процесса и является серьезным фактором торможения постнатальной адаптации. 2. Своевременное и адекватное лечение, профилактическое применение антианемических препаратов с ранних сроков гестации – залог благополучного завершения беременности как для матери, так и для новорожденного.
Статья опубликована в журнале «Российский вестник акушера–гинеколога» 2009, № 5: 72–77
Литература 1. Белошевский Е.А. Железодефицит у взрослых, детей и беременных. Воронеж 2000; 121. 2. Воробьев П.А. Анемический синдром в клинической практике. М 2001; 168. 3. Грищенко О.В., Лахно И.В., Пак С.А. и др. Современный подход к лечению фетоплацентарной недостаточности. Репродуктивное здоровье женщины 2003; 1: 13: 18–22. 4. Дворецкий Л.И. Алгоритмы диагностики и лечения железодефицитной анемии. РМЖ 2002; 2: 6: 22–27. 5. Жиляева О.Д. Клинико–анатомические особенности системы мать–плацента–плод при течении беременности на фоне железодефицитной анемии: Автореф. дис…. канд. мед. наук. М 2005; 24. 6. Милованов А.П. Патология системы мать–плацента– плод. Руководство для врачей. М: Медицина 1999: 351–368. 7. Мурашко Л.Е. Плацентарная недостаточность: Актуальные вопросы патологии родов, плода и новорожденного: Пособие для врачей. М 2003; 38–45. 9. Серов В.Н., Прилепская В.Н., Жаров Е.В. и др. Железодефицитные состояния в различные периоды жизни женщины: Информационное пособие для акушеров и гинекологов. М 2002; 15. 10. Стрижаков А.Н., Баев О.Р., Тимохина Т.Ф. Фетоплацентарная недостаточность: патогенез, диагностика, лечение. Вопр гин акуш и перинатол 2003; 2: 2: 53–63. 11. Титченко Л.И., Краснопольский В.И., Туманова В.А. и др. Роль 3–D допплеровского исследования плаценты в комплексной оценке фетоплацентарной системы у беременных высокого риска перинатальной патологии. Акуш и гин 2003; 5: 16–20. 12. Шехтман М.М. Руководство по экстрагенитальной патологии у беременных. М 1999; 815. 13. Шакутина М.К. Современные взгляды на патогенез анемии при беременности: Автореф. дис…. канд. мед. наук. Н Новгород 1995; 21. 14. Alen L.H. Biological mechanisms that might underlie iron’s effects on fetal growth and preterm birth. J Nutr 2001; 131: 28–2:581–589. 15. Aranyosi J., Zatick J., Jakab A.Jr. et al. Practical aspects of Doppler sonography in obstetrics. Orv Hetil 2003; 144: 34: 1683–1686. 16. Arduini D., Capponi M., Rizzo G. Sonographic automated volume count (SonoAVC) in volume measurement of fetal fluid–filled structures: comparison with virtual organ computeraided anaLysis (VOCAL). Ultrasound Obstet Gynec 2008; 32: 1: 111–112. 17. Casparis D., Del Carlo P., Branconi F. et al. Effectivness and tolerability of oral liquid ferrous gluconate in iron–deficient anemia in pregnancy and in the immediate post–partum period: comparison with other liquid or solid formulations containing bivalent or tnvalent iron. Minerva Ginecol 1996; 48:11: 511–518. 18. Hercberg S., Preziosi P., Galan P. Iron deficiency in Europe. Public Health Nutr 2001; 4: 2: (B): 537–545. 19. Ponka P. Cellular iron metabolism. Kidney Int 1999; 55: Suppl. 69: 2–11.
Диагностика
Чтобы поставить точный диагноз ФПН проводится комплексное обследование, включающее следующие этапы:
- врач изучает анамнез пациентки, собирает все данные и жалобы;
- внешний осмотр и замер живота, веса, чтобы определить как растёт плод;
- анализ мазка;
- УЗИ плода;
- КГТ и фонокардиография;
- допплерография – изучение кровотока.
Существует группа риска, куда входят некоторые категории женщин, имеющих большую вероятность развития ФНП при беременности:
- возраст от 35;
- работа на тяжёлом производстве;
- плохое и скудное питание;
- многоплодная беременность;
- в анамнезе аборты, хирургические операции, болезни женских органов;
- имеющие хронические болезни;
- злоупотребляющие вредными привычками.
Такие пациентки требует повышенного внимания.
Суть допплерометрии фетоплацентарного кровотока
Во время беременности в женском организме формируется новая структура, внутри которой осуществляются взаимоотношения «будущая мама — плацента — малыш». Система её кровотока также является отдельной. Любые её нарушения способны оказать негативное воздействие на плод.
Для диагностики подобных нарушений применяют допплерометрию фетоплацентарного кровотока. Она позволяет провести оценку движения крови по сосудам внутри этой системы кровотока, благодаря чему врач получает возможность выявить любые нарушение, несущие в себе угрозу здоровью и жизни матери и ребёнка.
Допплерометрия (сокращённо — «ДПМ») является методикой ультразвукового обследования, которая позволяет определить показатели движения крови в исследуемом сосуде. Она основана на эффекте Допплера, который обуславливает сдвиг частот при отражении акустических УЗ-волн от объектов, пребывающих в движении. В данном случае этими объектами являются кровяные клетки, которые движутся по сосудам, формируя ток крови.
При проведении процедуры у беременных женщин оценивают кровоток матки и артерий пуповины.
Терапия
Универсальной схемы лечения нет. Это связано с тем, что патология имеет много форм и видов, может развиться из-за самых разных факторов. Поэтому врачи в большинстве случаев направляют будущую мать в стационар, чтобы понаблюдать за интенсивностью ФПН и предпринять корректные меры.
Самостоятельно назначать лечение ни в коем случае нельзя! При первых же признаках недомогания, уменьшения количества шевелений, кровянистых выделений нужно сразу же обращаться к врачу.
Особенности проведения ДПМ маточно-плацентарного кровотока
Схема проведения УЗ-исследования и допплерометрии для пациентки не имеет различий. Процедура проводится трансабдоминально, а беременная при этом пребывает в положении лёжа на спине или на боку. Диагност наносит на исследуемую область медицинский гель, благодаря которому достигается лучшая визуализация. Он исключает наличие воздуха между датчиком УЗ-сканера и поверхностью кожи и обеспечивает их плотный контакт.
Иногда исследование проводят трансвагинально. Его назначают в случае, если нужно получить детальное изображение. В процессе используются датчики, мощности которых хватает на то, чтобы обеспечить визуализацию сосудов, расположенных на расстоянии не более 10-ти см. Датчик вводят непосредственно во влагалище и таким образом проводят сканирование.
Осложнения
Фетоплацентарная недостаточность может не оказать пагубного воздействия на ребёнка, если протекает в определённой форме. При же острой степени и в тяжёлых случаях может спровоцировать развитие серьёзных болезней:
- внутриутробная задержка развития;
- гипоксия;
- патологии сердца, сосудов, нервной системы;
- летальный исход.
Каждый случай гинеколог рассматривает индивидуально, а возможные осложнения зависит от множества факторов.
Диагностика плацентарной недостаточности
Лечить уже развившуюся плацентарную недостаточность практически невозможно, поэтому врачи активно стремятся выявлять беременных женщин, угрожаемых в отношении формирования нарушений функции плаценты. Если плацентарная недостаточность выявляется в 3 триместре беременности, эффективного лечения, к сожалению, не существует. Поэтому очень активно в настоящее время применяются все способы выявления в ранние сроки беременности тех женщин, в формировании плаценты которых произошли нарушения.
В первую очередь, при постановке на учет по беременности выявляют максимально значимые факторы риска – курение, перенесенные аборты, отягощенную наследственность (низкий вес при рождении, склонность к тромбозам), наличие хронических заболеваний сердца, сосудов, сахарного диабета.
Профилактические мероприятия против развития плацентарной недостаточности особенно актуальны и необходимы до 16-17 недель беременности, когда происходит формирование структур плаценты.
Значимую помощь в оценке риска развития плацентарной недостаточности оказывает пренатальный скрининг, который проводится в 11-14 недель беременности. Он проводится для выявления синдромов Дауна, Эдвардса и др. хромосомных болезней у плода. В настоящее время самым актуальным является проведение комплексного ранний скрининг беременной на прогнозирование риска развития плацентарной недостаточности, преэклампсии и внутриутробной задержки развития плода. Поскольку данный вид диагностики относится к самым современным и передовым, к сожалению, он пока не включен в перечень услуг, предоставляемых в женской консультации в рамках ОМС, но доступен всем желающим в центрах пренатальной диагностики.
Определение белков, вырабатываемых плацентой
В первую очередь проводят определение белка РАРР-А, он является также маркером хромосомных аномалий плода. Снижение концентрации РАРР-А в крови в 11-14 недель беременности встречается у беременных женщин, имеющих высокий риск плацентарной недостаточности и задержки развития плода.
Второй гормон плаценты, который помогает в оценке рисков плацентарной недостаточности – PIGF (плацентарный фактор роста). Его концентрация в крови снижается задолго до первых проявлений плацентарной недостаточности. Его определение применяют не настолько широко, как PAPP-A, но тем не менее многие лаборатории уже включили данный белок в пренатальный скрининг 1 триместра. Крайне важное значение при проведении скрининга 1 триместра имеет измерение кровотоков в сосудах матки. Однозначно доказано, что сужение сосудов матки, определяемое при исследовании, свидетельствует о неполноценности формирования плаценты, которое будет ухудшаться с увеличением срока беременности и приведет к снижению питания малыша и снабжения его кислородов, то есть к развитию плацентарной недостаточности и задержки развития плода. При нормальных размерах маточных сосудов в 11-14 недель беременности риск тяжелой плацентарной недостаточности ничтожно мал.
Следующее обязательное скрининговое ультразвуковое исследование проводится в 20-21 неделю беременности. При этом обязательно проводят измерения плода, чтобы оценить, нет ли отставания в росте. Ведь при кислородном голодании замедляются темпы роста плода и размеры его начинают отставать от нормы для каждого срока беременности. Кроме того врач обязательно оценивает состояние и зрелость плаценты. Во время УЗИ проводится также допплерометрия сосудов матки для выявления ранних изменений, предшествующих клиническим проявлениям плацентарной недостаточности.
У пациенток, относящихся к группе высокого риска кроме УЗИ и допплерометрии проводят также суточное мониторирование колебаний артериального давления, определение количества белка в анализе мочи, собранном за сутки, оценивают показатели системы свертывания крови.
Третье УЗИ проводится всем будущим мамам в 30–34 недели беременности. Врач измеряет окружность головы и живота крохи, длину костей его ручек и ножек, и вычисляет предполагаемый вес плода. Эти измерения позволяют доктору убедиться в том, что малыш развивается нормально. Также имеет значение строение плаценты, наличие в ней признаков старения, вследствие чего она обычно перестает полноценно снабжать малыша кровью, а, значит, ему перестает хватать кислорода и питательных веществ и развитие ребенка нарушается. Во время УЗИ оценивается количество и вид околоплодных вод, которые также могут изменяться при внутриутробном страдании плода.
Допплерометрия
Допплерометрия сосудов плаценты и пуповины (метод исследования скоростей кровотоков в этих сосудах) так же позволяет оценить самочувствие малыша. Доктор исследует кровоток в артериях матки, пуповины, сердца и мозга ребенка. Это исследование позволяет определить, хорошо ли работает плацента, нет ли признаков нехватки кислорода у малыша, или развития гестоза у мамы. При снижении скорости кровотока в каком-либо сосуде можно говорить о нарушениях питания плода различной степени тяжести.
Вовремя проведенное обследование позволяет выявить начальные стадии дефицита кровоснабжения. В таких случаях лечение сможет предотвратить грозные осложнения, такие как гипоксия и внутриутробная задержка развития малыша. Допперометрию проводят в 20–21 неделю и в 30-32 недели беременности, при наличии изменений, контроль осуществляют минимум каждые две недели.
Кардиотокография
Это важный метод оценки состояния плода. Проводится КТГ при сроке беременности 33 недели и более, поскольку только на этом этапе внутриутробного развития малыша устанавливается полноценная регуляция деятельности сердечно-сосудистой системы плода центрами спинного и головного мозга. Запись сердцебиений плода проводят в течение 20–40 минут, а при необходимости исследование может быть продлено до 1,5 часов.
Аппарат регистрирует и записывает частоту сердцебиений малыша. Врач акушер-гинеколог оценивает кривую записи сердцебиений, эпизоды урежения и резкого учащения частоты сердечных сокращений плода и на основании этих данных делает заключение о том, насколько комфортно малыш чувствует себя в животе у мамы. К примеру, при снижении концентрации кислорода в крови плода, уменьшается и его поступление к клеткам нервной системы, что в свою очередь отражается на частоте сердечных сокращений. При нормальном течении беременности КТГ проводят после 33 недели 1 раз в 10–14 дней, иногда чаще. В некоторых клиниках в настоящее время предлагается услуга постоянного КТГ-мониторирования, что приобретает актуальность при наличии признаков плацентарной недостаточности. Беременной женщине выдается мониторчик, который регистрирует изменения сердечной деятельности малыша и эти данные по интернету передаются лечащему врачу.
Профилактика
Способы профилактики универсальны и доступны всем:
- здоровый образ жизни;
- качественное и насыщенное витаминами питание;
- хороший сон;
- физическая активность, при отсутствии противопоказаний;
- необходимо следить за состоянием репродуктивной системы постоянно, избегать абортов и заболеваний по возможности;
- отсутствие стрессов и неврозов;
- своевременно посещать врача во время беременности и все медицинские процедуры.
Конечно, полностью предугадать развитие каких-то патологий невозможно. Но здоровый образ жизни, контроль за собственным самочувствием и планирование беременности – это все повышает шансы благополучно выносить малыша.
Нередко у абсолютно здоровых женщин возникают проблемы при гестации, это может быть наследственное или же какие-то болезни обострились из-за увеличившейся нагрузки, поэтому важно регулярно наблюдаться у врача и замечать даже небольшие изменения в самочувствии, активности ребёнка. Внимательность поможет выявить патологию ФПН своевременно.
Как возникает ФПН?
Фетоплацентарной недостаточностью называют патологию беременности, при которой нарушается плацентарный кровоток. Наличие ФПН можно заподозрить по изменению частоты и силы шевелений малыша. Резкое учащение или урежение движений плода, а тем более их исчезновение часто свидетельствует о неблагополучном состоянии малыша, гипоксии и плацентарной недостаточности.
Последствия этой патологии незамедлительны и очень опасны для плода, ведь именно посредством плацентарного кровотока малышу доставляются питательные вещества и кислород. При снижении скорости, уровня кровотока на любом участке системы мать — плацента — плод малыш начинает испытывать недостаток в веществах, необходимых для нормального роста и развития. При длительно существующей или быстро развивающейся ФПН под угрозу ставится не только развитие, но и сама жизнь малыша.
Какие причины могут привести к нарушению работы столь важного для мамы и малыша органа? Чаще всего ФПН развивается на фоне острых и хронических заболеваний матери, патологии беременности или заболеваний самой плаценты. Вот наиболее распространенные факторы риска развития ФПН.
- Экстрагенитальные (не связанные с гинекологией) заболевания матери. Сюда относится сердечно-сосудистая недостаточность, артериальная гипертензия (повышение артериального давления), патологии почек (острый и хронический пиелонефрит, гломерулонефрит, мочекаменная болезнь, почечная недостаточность), эндокринные заболевания (сахарный диабет, патология надпочечников, щитовидной железы, гипофиза) и др. Все перечисленные заболевания влияют на скорость и уровень кровотока в организме матери, что, в свою очередь, вызывает снижение плацентарного кровотока.
- Заболевания половой сферы беременной — эндометрит (воспаление слизистой стенки матки), воспаление придатков, заболевания, передающиеся половым путем (уреаплазмоз, микоплазмоз, хламидиоз, герпес, цитомегаловирус и др.). Инфекционные агенты и их токсины, проникающие через плацентарный барьер, задерживаются тканью плаценты. В местах внедрения возбудителей образуются очажки воспаления, в которых нарушается нормальное для плаценты кровообращение.
- Патологии беременности. Наиболее распространенной причиной развития плацентарной недостаточности в этой группе является гестоз. Одним из проявлений этой патологии является стойкое повышение артериального давления в кровеносных сосудах, что, безусловно, очень быстро сказывается на уровне плацентарного кровотока. Другой причиной является нарушение гемостаза (соотношения факторов свертывающей и противосвертывающей системы крови, обеспечивающего необходимую вязкость и скорость продвижения по сосудам), нередко выявляющееся во втором и третьем триместре. Реже плацентарная недостаточность развивается на фоне длительной выраженной анемии беременных — заболевания, характеризующегося снижением уровня гемоглобина в крови.
- Патологии плаценты. Как и любой другой человеческий орган, сама плацента тоже может заболеть. Такое заболевание называется плацентит и выражается в значительном отеке плаценты и нарушении плацентарного кровотока. Причиной развития плацентита в основном являются вирусы, способные проникать сквозь плацентарный барьер. Иногда очаги воспаления ограничиваются отдельными участками плаценты; в этом случае в исходе заболевания на месте воспаления образуются петрификаты — очажки обызвествления. Большое количество петрификатов также затрудняет плацентарный кровоток.
- Аномалии развития плаценты. Сюда относится гипотрофия («тощая» плацента), добавочные дольки плаценты, частичная отслойка и неправильное прикрепление плаценты.