СПИРИВА РЕСПИМАТ раствор для ингаляций 2,5мкг/доза 4мл 60 доз
Тиотропия бромид — м-холиноблокатор длительного действия. Препарат обладает одинаковым сродством к M 1 -М 5 подтипам мускариновых рецепторов. Результатом ингибирования М 3 -рецепторов в дыхательных путях является расслабление гладкой мускулатуры. Бронходилатирующий эффект зависит от дозы и сохраняется не менее 24 ч. Значительная продолжительность действия связана, вероятно, с очень медленной диссоциацией препарата от М 3 -рецепторов; период полудиссоциации существенно более длительный, чем у ипратропия бромида. При ингаляционном способе введения тиотропия бромид, как N-четвертичное производное аммония, оказывает местный избирательный эффект (на бронхи), при этом в терапевтических дозах не вызывает системных м-холиноблокирующих побочных эффектов. Диссоциация от М 2 -рецепторов происходит быстрее, чем от М 3 -рецепторов, что свидетельствует о преобладании селективности в отношении М 3 подтипа рецепторов над М 2 -рецепторами. Высокое сродство к рецепторам и медленная диссоциация препарата из связи с рецепторами обусловливают выраженный и продолжительный бронходилатирующий эффект у пациентов с хронической обструктивной болезнью легких (ХОБЛ). Бронходилатация, развивающаяся после ингаляции тиотропия бромида, обусловлена, в первую очередь, местным (на дыхательные пути), а не системным действием. В клинических исследованиях было показано, что применение препарата Спирива Респимат 1 раз/сут приводит к значительному улучшению (по сравнению с плацебо) функции легких (объем форсированного выдоха за 1 секунду ОФВ1 и форсированная жизненная емкость легких ФЖЕЛ) в течение 30 минут после использования первой дозы. Улучшение функции легких сохраняется в течение 24 ч при равновесной концентрации. Фармакодинамическое равновесие достигалось в течение одной недели. Спирива Респимат значительно улучшал утреннюю и вечернюю пиковую объемную скорость выдоха (ПОСВ), измеренную больными. Применение препарата Спирива Респимат приводило к уменьшению (по сравнению с плацебо) использования бронходилататора в качестве средства скорой помощи. Бронходилатирующий эффект препарата сохраняется на протяжении 48 недель применения препарата; признаков привыкания не отмечается. Анализ комбинированных данных двух рандомизированных, плацебо-контролируемых, перекрестных клинических исследований показал, что бронходилатирующий эффект препарата Спирива Респимат (5 мкг) после 4-недельного периода лечения был в количественном отношении выше, чем эффект препарата Спирива (18 мкг). В долгосрочных (12-месячных) исследованиях было установлено, что Спирива Респимат значительно уменьшает одышку; улучшает качество жизни; снижает психосоциальное воздействие ХОБЛ и увеличивает активность. Препарат Спирива Респимат достоверно улучшал общее состояние здоровья (общий балл) по сравнению с плацебо к концу двух 12-месячных исследований, это различие сохранялось на протяжении всего периода лечения; препарат Спирива Респимат значительно уменьшал число обострений ХОБЛ, и увеличивал период до момента первого обострения по сравнению с плацебо. Доказано, что Спирива Респимат уменьшает риск обострения ХОБЛ и значительно снижает количество случаев госпитализации. При ретроспективном анализе отдельных клинических исследований было замечено статистически недостоверное увеличение, по сравнению с плацебо, количества случаев смерти у пациентов с нарушениями ритма сердца. Однако эти данные статистически не подтверждены и могут быть связаны с заболеванием сердца. Фармакокинетика Тиотропия бромид — четвертичное производное аммония, умеренно растворимое в воде. Тиотропия бромид выпускается в виде раствора для ингаляций, который применяется с помощью ингалятора Респимат. Приблизительно 40% от величины ингаляционной дозы осаждается в легких, остальное количество поступает в ЖКТ. Некоторые фармакокинетические данные, описанные ниже, были получены при использовании доз, превышающих рекомендуемые для лечения. Всасывание После ингаляции раствора молодыми здоровыми добровольцами установлено, что в системную циркуляцию поступает около 33% от величины ингаляционной дозы. Прием пищи не влияет на всасывание тиотропия бромида, в связи с тем, что он плохо всасывается из ЖКТ. Абсолютная биодоступность при приеме внутрь составляет 2-3%. C max в плазме наблюдается через 5 мин после ингаляции. Распределение Связывание препарата с белками плазмы составляет 72%; V d — 32 л/кг. На стадии динамического равновесия пиковая концентрация тиотропия бромида в плазме у пациентов с ХОБЛ составляет 10,5-11,7 пг/мл через 10 мин после применения препарата в дозе 5 мкг с помощью ингалятора Респимат. На стадии динамического равновесия наименьшая концентрация в плазме составила 1,49-1,68 пг/мл. Исследования показали, что тиотропия бромид не проникает через ГЭБ. Метаболизм Степень биотрансформации незначительна. Это подтверждается тем, что после в/в введения препарата молодым здоровым добровольцам в моче обнаруживается 74% субстанции тиотропия бромида в неизмененном виде. Тиотропия бромид является эфиром, который расщепляется на этанол-N-метилскопин, и дитиенилгликолиевую кислоту; эти соединения не связываются с мускариновыми рецепторами. В исследованиях in vitro показано, что некоторая часть препарата (
Спирива® Респимат® (Spiriva® Respimat®)
Тиотропия бромид — четвертичное производное аммония, умеренно растворимое в воде. Тиотропия бромид выпускается в виде раствора для ингаляций, который применяется с помощью ингалятора РЕСПИМАТ.
Приблизительно 40 % от величины ингаляционной дозы осаждается в легких, остальное количество поступает в желудочно- кишечный тракт. Некоторые фармакокинетические данные, описанные ниже, были получены при использовании доз, превышающих рекомендуемые для лечения.
Всасывание
После ингаляции раствора молодыми здоровыми добровольцами установлено, что в системную циркуляцию поступает около 33 % от величины ингаляционной дозы. Прием питтти не влияет на всасывание тиотропия бромида, в связи с тем. что он плохо всасывается из желудочно-кишечного тракта.
Абсолютная биодоступность при приеме внутрь составляет 2 — 3 %. Максимальная концентрация в плазме наблюдается через 5-7 минут после ингаляции. На стадии динамического равновесия пиковая концентрация тиотропия в плазме крови у пациентов с ХОБЛ составляет 10,5 пг/мл и быстро снижается. Это указывает на мультикомпартментный тип распределения препарата. На стадии динамического равновесия базальная концентрация тиотропия в плазме крови составляет 1,6 пг/мл. На стадии динамического равновесия пиковая концентрация тиотропия в плазме крови у пациентов с бронхиальной астмой составляла 5,15 пг/мл и достигалась через 5 мин. Распределение
Связывание препарата с белками плазмы составляет 72%; объем распределения 32 л/кг. Исследования показали, что тиотропия бромид не проникает через
гематоэнцефалический барьер. Биотрансформация
Степень биотрансформации незначительна. Это подтверждается тем, что после внутривенного введения препарата молодым здоровым добровольцам в моче обнаруживается 74 % субстанции тиотропия бромида в неизмененном виде. Тиотропия бромид является эфиром, который расщепляется на этанол-М-метилскопин. и дитиенилгликолиевую кислоту; эти соединения не связываются с мускариновыми рецепторами.
В исследованиях in vitro
показано, что некоторая часть препарата (< 20 % от дозы после внутривенного введения) метаболизируется путем окисления цитохромом Р450 с последующей конъюгацией с глютатионом и образованием различных метаболитов. Данный механизм может тормозиться ингибиторами изоферментов CYP450 2D6 и ЗА4, хинидин, кетоконазол и гестоден. Таким образом, CYP450 2D6 и ЗА4 участвуют в метаболизме Тиотропия бромид даже в сверхтерапевтических концентрациях не ингибирует цитохромом Р450 1А1, 1А2, 2В6, 2С9, 2С19, 2D6, 2Е1 или ЗА в микросомах печени человека.
Выведение
Терминальный период полувыведения тиотропия бромида после ингаляции составляет от 27 до 45 часов у пациентов с ХОБЛ. У пациентов с астмой эффективный период полувыведения после ингаляции составляет 34 ч.
Общий клиренс после внутривенного введения препарата молодым здоровым добровольцам составлял 880 мл/мин. Тиотропия бромид после внутривенного введения в основном выводится почками в неизмененном виде (74 %). После ингаляции раствора у пациентов с ХОБЛ почечная экскреция составляет 18,6% (0,93 мкг), оставшаяся неабсорбировавшаяся часть выводится через кишечник. В стадии фармакокинетического равновесия у пациентов с астмой 11,9% (0,595 мкг) дозы выводится в неизменном виде с мочой через 24 часа после приема препарата. Почечный клиренс тиотропия бромида превышает клиренс креатинина, что свидетельствует о его канальцевой секреции. После длительного ингаляционного приема препарата один раз в день пациентами с ХОБЛ фармакокинетические равновесие достигается на 7 день; при этом в дальнейшем не наблюдается аккумуляции.
Тиотропия бромид имеет линейную фармакокинетику в терапевтических пределах после внутривенного применения, ингаляции сухого порошка и ингаляции раствора. Фармакокинетика у пациентов пожилого возраста
В пожилом возрасте отмечается снижение почечного клиренса тиотропия
(347 мл/мин у пациентов с ХОБЛ в возрасте до 65 лет и 275 мл/мин у пациентов с ХОБЛ и астмой старше 65 лет), Установлено, что у пациентов с бронхиальной астмой воздействие тиотропия бромида не зависит от возраста пациентов.
Пациенты с нарушениями функции почек
После ингаляционного применения тиотропия один раз в день в период устойчивого состояния фармакокинетики у пациентов с ХОБЛ и небольшими нарушениями функции почек (клиренс креатинина 50-80 мл/мин) отмечалось небольшое увеличение величин AUC0-6,ss на 1,8-30% и Cmax,Ss по сравнению с пациентами с нормальной функцией почек(клиренс креатинина >80 мл/мин). У пациентов с ХОБЛ и умеренными или значительными нарушениями функции почек (клиренс креатинина <50 мл/мин) внутривенное применение тиотропия бромида приводило к двукратному увеличению общего воздействия (площадь под кривой «концентрация/время» AUC0-44 увеличивалась на 82% а величина Сmax увеличилась на 52 %) по сравнению с пациентами с ХОБЛ и нормальной функцией почек. Аналогичное повышение концентрации в плазме отмечалось и после ингаляции сухого порошка.
У пациентов с бронхиальной астмой и небольшими нарушениями функции почек (клиренс креатинина 50-80 мл/мин) ингаляционное применение тиотропия бромида не приводило к значительному увеличению воздействия в сравнении с пациентами с нормальной функцией почек.
Пациенты с нарушениями функции печени
Предполагается, что печеночная недостаточность не оказывает значительного влияния на фармакокинетику тиотропия бромида, так как тиотропия бромид преимущественно выводится почками и с помощью неферментативного расщепления эфирной связи с образованием производных, которые не обладают фармакологической активностью.
Эффективность и безопасность препарата Спирива Респимат при ХОБЛ и бронхиальной астме
Новый ингалятор Спирива Респимат характеризуется простой ингаляционной техникой, обеспечивает хорошую координацию «больной – ингалятор» и высоко оценивается пациентами. Длительная поддерживающая терапия препаратом Спирива Респимат у пациентов с хронической обструктивной болезнью легких значительно улучшает функцию легких, уменьшает одышку, улучшает качество жизни и снижает риск обострений, в том числе приводящих к госпитализации. У больных с плохо контролируемой бронхиальной астмой, несмотря на терапию ингаляционными глюкокортикостероидами и бета-2-агонистами длительного действия, добавление к терапии Спиривы Респимат позволяет значительно уменьшить выраженность бронхиальной обструкции и снизить риск развития тяжелых обострений астмы.
Рис. 1. Респимат: внешний вид и схема устройства
Рис. 2. Схема устройства униблока в ингаляторе Респимат
Рис. 3. Длительность существования аэрозольного облака при использовании Респимата и ДАИ [27]
Рис. 4. Депозиция ингаляционных препаратов при использовании Респимата и ДПИ [28, 30]
Рис. 5. Сравнение разных доз тиотропия при использовании Респимата и ХандиХалера [32]
Рис. 6. Изменения ОФВ1 после ингаляции тиотропием в виде Спиривы Респимат (5 мкг) и Спиривы ХандиХалер (18 мкг) [33]
Таблица 1. Сравнение тиотропия Респимат и плацебо: первичные конечные точки [39]
Рис. 7. Физическая активность пациентов с ХОБЛ при приеме Спиривы Респимат [41]
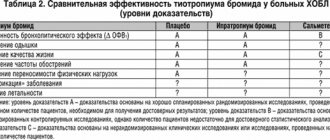
Таблица 2. Наиболее распространенные нежелательные явления при использовании Спиривы Респимат [40]
Таблица 3. Нежелательные явления на фоне терапии Спиривой Респимат [40]
Рис. 8. Средние концентрации тиотропия в плазме при его назначении через ХандиХалер (18 мкг) или Респимат (1,25, 2,5 или 5 мкг) в течение 4 недель у пациентов с ХОБЛ [50]
Рис. 9. Летальность от любых причин у пациентов с ХОБЛ во время терапии препаратами тиотропия [51]
Таблица 4. Летальность от всех причин при терапии препаратами тиотропия [51]
Рис. 10. Время до развития первого обострения при терапии пациентов с ХОБЛ препаратами тиотропия [51]
Рис. 11. Изменение ОФВ1 при добавлении тиотропия к терапии ИГКС/ДДБА (А – исследование 1; В – исследование 2) [53]
Рис. 12. Снижение числа тяжелых обострений астмы при добавлении к терапии ИГКС/ДДБА тиотропия [53]
Рис. 13. Влияние тренировки на легочную депозицию при использовании Респимата и ДАИ [56]
Рис. 14. Предпочтение пациента при использовании Респимата и других ингаляторов [59, 60]
Значение тиотропия бромида для терапии ХОБЛ
Хроническая обструктивная болезнь легких (ХОБЛ) – заболевание, характеризующееся ограничением воздушного потока с развитием не полностью обратимой бронхиальной обструкции. Ограничение воздушного потока прогрессирует и связано с усиленным патологическим воспалительным ответом дыхательных путей на повреждающие частицы или газы [1, 2]. По данным ряда недавно проведенных исследований, распространенность ХОБЛ в мире у пациентов старше 40 лет составляет 10,1% (11,8% у мужчин и 8,5% у женщин) [3]. По данным Всемирной организации здравоохранения, ХОБЛ занимает 4-е место в мире среди ведущих причин смерти: ежегодно от ХОБЛ умирает около 2,75 млн человек, что составляет 4,8% в структуре смертности [1]. Экономические расходы на больного ХОБЛ в 3 раза выше, чем на больного бронхиальной астмой. Наибольший экономический ущерб приносит лечение обострений ХОБЛ [1].
Медикаментозная терапия при ХОБЛ используется для предупреждения и контроля симптомов заболевания, повышения качества жизни больных, уменьшения частоты и тяжести обострений и снижения летального исхода [1, 2]. Препаратами первой линии терапии большинства пациентов c ХОБЛ признаны длительно действующие бронходилататоры [1], среди которых наиболее изученным и наиболее часто используемым является действующий антихолинергический препарат (АХП) тиотропия бромид [4, 5].
К достоинствам тиотропия бромида относятся его селективность по отношению к М1- и М3-рецепторам и длительное действие. Препарат обеспечивает бронходилатацию и протекцию против холинергических бронхоконстрикторных стимулов в течение 24 часов, что позволяет назначать его 1 раз в сутки [4–6]. Такие свойства препарата значительно упрощают режим дозирования и улучшают приверженность больных терапии.
Прирост функциональных легочных показателей у больных ХОБЛ на фоне терапии тиотропия бромидом во всех исследованиях превышал таковой у пациентов, получавших препараты сравнения (ипратропий, салметерол и др.), и данное улучшение поддерживалось на протяжении всего периода исследования без развития тахифилаксии [7–10]. Тиотропия бромид оказался первым препаратом, положительное влияние которого на легочную гиперинфляцию было подтверждено в рандомизированных контролируемых исследованиях (РКИ) [11, 12]. Положительная динамика легочных функциональных параметров на фоне терапии тиотропия бромидом сопровождалась улучшением клинической картины, переносимости физических нагрузок, качества жизни больных, снижением кратности приема короткодействующих бронходилататоров. У больных, принимавших тиотропия бромид, было меньше обострений ХОБЛ, значительно увеличивалось время до первого обострения, снижалось число госпитализаций [6].
В глобальном четырехлетнем исследовании UPLIFT (Understanding Potential Long-term impacts on Function with Tiotropium) впервые были получены доказательства уменьшения летальности больных ХОБЛ на фоне длительного приема тиотропия бромида – было достигнуто достоверное снижение относительного риска смерти на 13% (p 1), то есть замедляет прогрессирование ХОБЛ [14–16]. Прием тиотропия бромида позволил достоверно снизить число эпизодов дыхательной недостаточности (ОР 0,69; 95% ДИ 0,52–0,92).
Подавляющее большинство исследований тиотропия бромида было выполнено с устройством доставки в виде дозированного порошкового ингалятора (ДПИ) ХандиХалер (суточная доза – 1 ингаляция по 18 мкг). Совсем недавно в России был зарегистрирован новый препарат – Спирива Респимат, кардинальным отличием которого от Спиривы ХандиХалер является устройство доставки препарата – ингалятор Респимат. Как известно, залогом успешной ингаляционной терапии служат не только свойства лекарственного средства, но и выбор оптимальной системы его доставки. Идеальное устройство доставки должно обеспечивать хорошую депозицию препарата в легких, быть надежным, достаточно простым в использовании, доступным для применения в любом возрасте и при тяжелых стадиях заболевания. С этой точки зрения новый ингалятор Респимат действительно представляет собой шаг вперед в области ингаляционной терапии [17].
Основные характеристики ингалятора Респимат
В основе ингалятора Респимат (Respimat soft mist inhaler) лежит форсированное прохождение лекарственного раствора через серию каналов, которые сходятся к двум выпускным отверстиям – соплам (рис. 1 и 2), создающим две жидкостные струи, при столкновении которых и образуется лекарственный аэрозоль [18, 19].
Для активации устройства основание поворачивают на 180 градусов до щелчка, что приводит к сжатию пружины и продвижению капиллярной трубки с односторонним клапаном картриджа с раствором. Таким образом жидкость нагнетается в дозирующую камеру (рис. 1). При нажатии на кнопку пружина высвобождается и проталкивает капиллярную трубку к так называемому униблоку (рис. 1 и 2), закрывая односторонний клапан и поворачивая капиллярную трубку к пистону, тем самым начиная продвигать раствор через униблок. Далее лекарственный раствор продавливается через микроканалы, которые сходятся к двум зеркальным выпускным отверстиям. При выходе из них жидкостные струи сталкиваются под определенным углом, в результате чего образуется лекарственный аэрозоль.
Ингалятор Респимат имеет компактный дизайн и снабжен цифровым счетчиком доз (рис. 1). Стрелка счетчика подходит к красной зоне, когда препарата в ингаляторе остается приблизительно на неделю [18]. После активации заданного числа доз (в препарате Спирива Респимат 60 доз) механизм блокируется и дальнейшее использование ингалятора становится невозможным.
Оптимальный аэродинамический диаметр аэрозольных частиц находится в диапазоне от 1 до 5 мкм. Частицы диаметром 5 мкм оседают в верхних ДП (ротоглотке). Приблизительно около 75% аэрозольных частиц, продуцируемых Респиматом, имеют средний аэродинамический диаметр ≤ 5,8 мкм и ≤ 5% – средний аэродинамический диаметр ≤ 1 мкм [19, 20].
На эффективность доставки лекарственных аэрозолей в нижние ДП существенное влияние оказывает депозиция препарата в ингаляционном устройстве и на задней стенке ротоглотки, что происходит благодаря баллистическим эффектам аэрозоля и турбулентной дисперсии [21–25]. Координация между активацией устройства и ингаляцией аэрозоля зависит от скорости аэрозольного облака и времени его существования. Улучшить доставку аэрозольного препарата в нижние ДП можно за счет создания более длительно существующего аэрозольного облака [26]. D. Hochrainer и соавт. измерили скорость струи аэрозоля на расстоянии 10 см от выхода 3 различных ингаляторов – дозированного аэрозольного ингалятора (ДАИ) с фреоновым наполнителем, ДАИ с гидрофторалканом и Респимата. Оказалось, что скорость струи аэрозоля составляет 5,6, 2,4 и 0,8 м/с соответственно [27]. В этом же исследовании с помощью видеорегистрации было показано, что длительность существования аэрозольного облака при использовании данных ингаляторов составляет 0,15, 0,21 и 1,45 с соответственно (рис. 3) [27]. Таким образом, ингалятор Респимат создает медленное скоростное облако аэрозоля, которое существует в 7–10 раз дольше, чем облако, создаваемое ДАИ. Невысокая скорость аэрозольных частиц, выходящих из Респимата, способствует улучшению захвата частиц во время ингаляционного маневра пациента, их повышенной доставке в нижние ДП, а также снижению ротоглоточной депозиции.
Сцинтиграфические исследования продемонстрировали более высокую легочную и меньшую ротоглоточную депозицию препаратов при использовании Респимата по сравнению с дозированными порошковыми ингаляторами (ДПИ) и ДАИ со спейсером и без него [28–32]. В исследовании со здоровыми добровольцами S.P. Newman и соавт. показали, что легочная депозиция флунизолида или фенотерола при использовании Респимата составляет 39,2–44,6%, в то время как ротоглоточная депозиция только 26,2–39,9% (рис. 4) [29, 30]. В этих же исследованиях легочная депозиция лекарственных препаратов при их ингаляции с помощью ДАИ без спейсера составила 11,0–15,3%, а при использовании ДАИ со спейсером – 9,9–28% (рис. 4) [29, 30]. В другом исследовании сравнивали депозицию будесонида, ингалируемого с помощью Респимата и Турбухалера: легочная депозиция препарата составила 51,6 и 28,5% соответственно, а ротоглоточная – 19,3 и 49,3% соответственно [31].
Дозы тиотропия бромида при использовании Спиривы Респимат
Поскольку ингаляционное устройство Респимат наиболее эффективно по сравнению со всеми известными портативными устройствами доставки (ДАИ и ДПИ), логично было бы предположить, что при использовании Респимата потребуется уменьшение традиционных доз препаратов, используемых с другими ингаляторами. Действительно, сегодня рекомендуемая доза тиотропия бромида при использовании Респимата – 5 мкг (при использовании Спиривы ХандиХалер – 18 мкг). Новая доза была определена в ходе нескольких исследований «доза – ответ». В многоцентровом РКИ с участием 202 пациентов с ХОБЛ в параллельных группах в течение 3 недель сравнивали 5 доз тиотропия бромида, ингалируемого через Респимат (1,25, 2,5, 5, 10 и 20 мкг), 1 традиционную дозу тиотропия бромида, ингалируемого через ХандиХалер (18 мкг), и плацебо [32]. Первичной конечной точкой исследования был показатель предбронходилатационного (trough) ОФВ1 на 21-й день терапии. Эффективность лечения дозами тиотропия бромида 5 и 20 мкг через Респимат и 18 мкг через ХандиХалер достоверно отличалась от таковой в группе плацебо-контроля. При этом по влиянию на параметры функции внешнего дыхания дозы тиотропия, ингалируемого через Респимат, 5 мкг и тиотропия, ингалируемого через ХандиХалер, 18 мкг максимально соответствовали друг другу. Кроме того, по другому индексу – экскреции тиотропия бромида с мочой за 0–2 часа до ингаляции на 21-й день – данные дозы тиотропия, назначенные с помощью различных ингаляторов, были практически эквивалентны (рис. 5).
В рандомизированном двойном слепом перекрестном исследовании, в котором 134 пациента с ХОБЛ (средний возраст 70 лет, средний ОФВ1 43%) в течение 21 дня принимали либо Спириву Респимат в дозе 5 мкг, либо Спириву ХандиХалер в дозе 18 мкг, была показана полная эквивалентность данных доз тиотропия бромида как в отношении процента улучшения функциональных легочных показателей (рис. 6), так и в отношении влияния на плазменные концентрации тиотропия в первые 3 часа после ингаляции [33]. Поэтому при назначении препарата Спирива Респимат рекомендовано использовать дозу 5 мкг в сутки (то есть 2 последовательные ингаляции по 2,5 мкг в сутки).
Клиническая эффективность Спиривы Респимат
К настоящему времени опубликованы результаты пяти РКИ, в ходе которых изучали эффективность Спиривы Респимат в течение не менее 12 недель [34–38]. В совокупности в этих исследованиях участвовали 6522 пациента с ХОБЛ. Из них 3686 получали терапию Спиривой Респимат (2839 пациентов в дозе 5 мкг/сут и 847 – 10 мкг/сут) и 2836 – плацебо. Два исследования продолжались 12 недель [34, 35], три – 1 год [36–38].
Полученные данные еще раз подтвердили высокую эффективность тиотропия бромида [5].
Во всех исследованиях по влиянию на функциональные легочные показатели Спирива Респимат в дозах 5 и 10 мкг существенно превосходил плацебо и был сравним с ипратропием в первые часы после ингаляции. Обе дозы тиотропия бромида в долгосрочных исследованиях приводили к достоверному и клинически значимому улучшению качества жизни, связанного со здоровьем, и снижению одышки по шкале интенсивности одышки (Transition Dyspnee Index – TDI [39] (табл. 1).
Кроме того, терапия Спиривой Респимат приводила к выраженному уменьшению числа всех обострений ХОБЛ на 31%, а тяжелых обострений, приводящих к госпитализации пациентов, – на 27% [40]. Таким образом, Спирива Респимат значительно улучшает функцию легких, уменьшает одышку, улучшает качество жизни и снижает риск обострений, в том числе приводящих к госпитализации.
В открытом наблюдательном исследовании с участием 1230 больных ХОБЛ было показано, что терапия Спиривой Респимат в дозе 5 мкг в течение 6 недель приводит к значительному улучшению физической активности пациентов. Был отмечен значительный прирост баллов по шкале «физическое функционирование» опросника SF-36 (Short Form – 36) на 13,4 балла (р
Безопасность Спиривы Респимат
Как и другие представители группы АХП, тиотропий традиционно рассматривается как один из наиболее безопасных препаратов для терапии ХОБЛ [5]. Благоприятный профиль Спиривы ХандиХалер подтвержден многочисленными исследованиями. Новый препарат Спирива Респимат теоретически может иметь еще большую безопасность, поскольку содержит меньшую дозу тиотропия и характеризуется меньшей депозицией в ротоглотке. Это может привести к снижению его системной биодоступности. При анализе наиболее частых нежелательных явлений, зафиксированных в исследованиях Спиривы Респимат, обращает на себя внимание более частое развитие такого нежелательного явления, как сухость во рту – эффекта, специфичного для всех АХП (табл. 2). Однако это нежелательное явление встречается приблизительно в 2 раза реже при использовании Спиривы Респимат, чем Спиривы ХандиХалер [32, 42], что можно объяснить меньшей депозицией препарата в ротоглотке при ингаляции через Респимат.
В исследовании U. Feifel и соавт. при использовании очень высоких доз Спиривы Респимат (до 32 мкг/сут) были отмечены лишь легкие антихолинергические побочные эффекты (сухость слизистых оболочек) [43]. В этом же исследовании для изучения побочных эффектов со стороны глаз добровольцам проводили закапывание раствора тиотропия в глаза. При этом не отмечалось изменений диаметра зрачка, зрачковых рефлексов, внутриглазного давления или аккомодации, то есть при случайном попадании препарата из ингалятора Респимат в глаза развитие каких-либо нежелательных явлений маловероятно.
R. Hodder и соавт. провели специальный анализ 12-месячных исследований Спиривы Респимат с участием в общей сложности 1990 больных ХОБЛ с целью выявления парадоксальной бронхоконстрикции при использовании этого препарата [44]. В проанализированных исследованиях не было ни одного указания на развитие парадоксального бронхоспазма, 21 (1,1%) больной отмечал необходимость использования быстродействующих бронхолитиков или развитие дыхательного дискомфорта и 6 (0,3%) пациентов – дискомфорт, потребовавший приема быстродействующего бронхолитика. При этом данные нежелательные эффекты наблюдались и в группе плацебо. Таким образом, парадоксальная бронхоконстрикция маловероятна при терапии Спиривой Респимат.
В течение последних 3 лет ведутся бурные дискуссии по поводу сердечно-сосудистой безопасности Спиривы Респимат [45–49]. После проведенного совокупного анализа 2 сходных по дизайну годичных исследований E. Bateman и соавт. отметили, что число летальных исходов от любых причин среди больных, принимавших Спириву Респимат, было несколько выше – 2,4 и 2,7% (при приеме 5 и 10 мкг тиотропия соответственно) – по сравнению с пациентами группы плацебо (1,6%) [39]. Однако данные различия не были статистически значимыми. Существует ли прямая связь между повышенной летальностью, или имеет место простое совпадение (тем более что летальность в данных исследованиях не выше или даже ниже, чем в других исследованиях эффективности лекарственных средств у пациентов с ХОБЛ)? Интересно, что в данных исследованиях причиной смерти стали не только сердечно-сосудистые заболевания, но и злокачественные новообразования (табл. 3). Учитывая продолжительность исследований (1 год), можно смело утверждать об отсутствии биологической вероятности взаимосвязи между применением Спиривы Респимат и развитием опухолей.
Достаточно широкий резонанс вызвали результаты метаанализа S. Singh и соавт., основанного на данных пяти РКИ, в которых изучали эффективность Спиривы Респимат у 6522 пациентов с ХОБЛ [48]. Авторы пришли к заключению, что применение Спиривы Респимат приводит к достоверному повышению риска летальности (ОР 1,52; 95% ДИ 1,06–2,16; р = 0,02). При этом и доза тиотропия 10 мкг (ОР 2,15; 95% ДИ 1,03–4,51; р = 0,04), и доза тиотропия 5 мкг (ОР 1,46; 95% ДИ 1,01–2,10; р = 0,04) ассоциировались с повышенным риском летального исхода. В выводах был приведен показатель «число больных, которых необходимо пролечить» (number needed to treat – NNT) в течение года, чтобы получить 1 летальный исход, – 124 пациента (95% ДИ 52–5682). Объясняя возможную ассоциацию терапии Спиривой Респимат с повышенной летальностью, исследователи предположили, что ингалятор Респимат, обеспечивая лучшую депозицию тиотропия в легких, приводит к его повышенной концентрации в системном кровотоке (то есть повышению системной биодоступности), что в свою очередь увеличивает риск развития аритмических событий. Однако с точки зрения фармакокинетики данное объяснение маловероятно. Сравнение плазменных концентраций тиотропия после ингаляции через Респимат и после ингаляции через ХандиХалер в дозах 5 и 18 мкг соответственно продемонстрировало, что их пиковые концентрации и площади под концентрационными кривыми (AUC) практически идентичны [20, 33].
В исследовании, результаты которого были представлены на конгрессе Европейского респираторного общества (European Respiratory Society – ERS) в 2013 г., сравнивали фармакокинетические свойства тиотропия в дозах 1,25, 2,5 и 5 мкг, ингалируемого с помощью устройства Респимат, и тиотропия в дозе 18 мкг, ингалируемого через ХандиХалер [50]. В данное многоцентровое перекрестное плацебоконтролируемое исследование с двойным слепым дизайном было включено 154 пациента с ХОБЛ. Каждый из пяти этапов терапии занимал 4 недели, первичной конечной точкой исследования стала пиковая концентрация препарата (Cmax,ss) и площадь концентрационной кривой в течение 6 часов после ингаляции препарата (AUC0-6h,ss). Как показало данное исследование, тиотропий быстро абсорбировался со слизистых оболочек. При этом не было отмечено отличий между устройствами и медиана достижения максимальной концентрации tmax,ss составляла 5–7 минут после ингаляции (рис. 8). Фармакокинетический профиль Спиривы Респимат был пропорционален используемым дозам препарата (1,25, 2,5 и 5 мкг). Биодоступность дозы Спиривы Респимат 5 мкг оказалась несколько меньше, чем дозы Спиривы ХандиХалер 18 мкг. Среднее соотношение между данными дозами, ингалируемыми через Респимат и ХандиХалер (Р5/ХХ18), составили 81% (90% ДИ 73–89%) для Cmax,ss и 76% (90% ДИ 70–82%) для AUC0-6h,ss, что указывает на более низкую системную экспозицию к тиотропию при использовании Респимата.
B.J. Lipworth и P.M. Short, комментируя результаты метаанализа, проведенного S. Singh и соавт., отметили, что полученным данным вряд ли можно доверять, поскольку они основаны на исследованиях, в которых летальные исходы не являлись конечными точками, и 95% ДИ имеет просто огромный размах – 52–5682 пациента [49]. С учетом данных, демонстрирующих снижение сердечно-сосудистых событий при терапии Спиривой ХандиХалер, с одной стороны, и их повышение при терапии Спиривой Респимат – с другой, авторы комментария квалифицировали саму возможность развития неблагоприятных эффектов со стороны сердечно-сосудистой системы на фоне применения Спиривы Респимат как отсутствие биологического правдоподобия (англ. a lack of biological plausibility). Тем более что увеличение сердечно-сосудистых событий как следствие приема Спиривы Респимат невозможно объяснить с точки зрения повышенной системной биодоступности препарата.
Более надежные данные о безопасности Спиривы Респимат представлены в недавно опубликованном крупнейшем на данный момент исследовании в области ХОБЛ – рандомизированном двойном слепом исследовании TIOSPIR (The Tiotropium Safety and Performance in Respimat Trial) [51]. Исследование TIOSPIR включало 17 135 пациентов с ХОБЛ (средний возраст 65 лет, средний ОФВ1 48%), которые на протяжении в среднем 2,3 года принимали Спириву Респимат в суточных дозах 2,5 или 5 мкг или Спириву ХандиХалер в дозе 18 мкг. Первичными конечными точками исследования были риск летального исхода и риск развития 1-го обострения ХОБЛ, также изучалась сердечно-сосудистая безопасность препаратов, включая оценку безопасности у пациентов со стабильными заболеваниями сердца (среди них 15,2% больных имели ищемическую болезнь сердца, 6% – постинфарктный кардиосклероз, 10,6% – аритмии).
Исследование показало, что длительная терапия Спиривой Респимат не отличается от терапии Спиривой ХандиХалер по риску летальных исходов (для тиотропия в дозе 5 мкг ОР 0,96; 95% ДИ 0,84–1,09; для тиотропия в дозе 2,5 мкг ОР 1,00; 95% ДИ 0,87–1,14) (рис. 9, табл. 4) и по риску развития 1-го обострения (для тиотропия в дозе 5 мкг ОР 0,98; 95% ДИ 0,93–1,03) (рис. 10). Число летальных исходов и больших сердечно-сосудистых событий было сходным во всех трех группах терапии тиотропием.
Таким образом, результаты глобального исследования TIOSPIR практически завершают многолетнюю дискуссию о возможных сердечно-сосудистых рисках терапии ХОБЛ Спиривой Респимат, ясно продемонстрировав, что новый препарат обладает хорошим профилем безопасности.
Спирива Респимат в ступенчатой терапии неконтролируемой бронхиальной астмы у взрослых
У многих больных бронхиальной астмой (БА) низкие и средние дозы ингаляционных глюкокортикостероидов (ИГКС) не позволяют достичь адекватного контроля над заболеванием. Поэтому требуется дополнительное назначение бета-2-агонистов длительного действия (ДДБА), антагонистов рецепторов лейкотриенов или повышение дозы ИГКС. Эффективность короткодействующих АХП (ипратропия) для базисной терапии БА не доказана, а эффективность тиотропия изучалась лишь в нескольких исследованиях. S.P. Peters и соавт. в двойном слепом перекрестном рандомизированном исследовании TALC (Tiotropium bromide as an Alternative to increased inhaled glucocorticoid in patients inadequately controlled on a Lower dose of inhaled Corticosteroid) провели сравнение дополнительной терапии тиотропием, удвоения дозы ИГКС и дополнительной терапии ДДБА у пациентов с БА, неадекватно контролируемой монотерапией ИГКС [52]. Данная работа продемонстрировала, что у пациентов с неадекватным контролем БА при монотерапии ИГКС добавление тиотропия более эффективно, чем удвоение дозы ИГКС. Улучшение функции легких на фоне лечения тиотропием сопровождалось уменьшением симптомов и увеличением числа дней контролируемой БА.
Недавно были получены новые данные о роли терапии тиотропием у больных с плохо контролируемой БА. В двух сходных по дизайну рандомизированных плацебоконтролируемых исследованиях изучали эффективность дополнительной терапии тиотропием (в дозе 5 мкг в сутки через ингаляционное устройство Респимат) у больных БА, уже получавших ИГКС и ДДБА [53]. В качестве основных критериев эффективности были выбраны функциональные легочные параметры и число обострений. Исследование продолжалось 48 недель. До включения в исследование у всех больных были отмечены симптомы заболевания, ОФВ1 был менее 80% от должных значений и пациенты в предшествующий год имели как минимум одно обострение БА. В исследованиях в общей сложности участвовало 912 пациентов с БА (средний возраст 53 года, средний ОФВ1 62%).
Через 24 недели от начала терапии в обоих исследованиях изменение пикового ОФВ1 от исходного уровня было более выраженным у больных, получавших дополнительную терапию тиотропием, различие по ОФВ1 между группами составило 86 ± 34 мл (р = 0,01) и 154 ± 32 мл (р 1, измеренного до ингаляции бронхолитика (trough ОФВ1), в группах терапии тиотропием составил 88 ± 31 мл (р = 0,01) и 111 ± 30 мл (р 1 было относительно небольшим (
Кроме того, дополнительная терапия тиотропием привела к снижению общего числа тяжелых обострений БА на 21% (ОР 0,79; р = 0,03) и удлинению времени до первого обострения (282 против 226 дней) (рис. 12). Уменьшение риска тяжелых обострений было значимым по данным post hoc анализа, число больных, которых необходимо пролечить (NNT) для того, чтобы предотвратить одно обострение в течение 48 недель, составило 15.
В проведенных исследованиях нежелательные явления и серьезные нежелательные явления одинаково часто встречались в обеих группах сравнения. Сухость во рту, типичный побочный эффект для всего класса АХП, была отмечена менее чем у 2% пациентов и чаще наблюдалась при приеме тиотропия (8 против 3 пациентов).
Эффекты, достигнутые при добавлении тиотропия к стандартной терапии у пациентов с БА, должны быть рассмотрены через призму достижения дополнительных преимуществ на фоне наиболее принятой терапии БА. Так, добавление антагонистов рецепторов лейкотриенов и ксантинов к терапии ИГКС/ДДБА обычно не сопровождается какими-либо значительными положительными эффектами, терапия системными ГКС ассоциирована с тяжелыми побочными эффектами, а терапия омализумабом подходит только для очень ограниченной когорты пациентов (IgE-зависимая астма).
Мнение пациента об ингаляторе Респимат
С точки зрения врача, выбор ингаляционного устройства для терапии определяется множеством факторов, таких как лекарственное вещество, доказанная клиническая эффективность, простота использования ингалятора, экономические аспекты терапии. Кроме того, среди этих факторов важное место занимает отношение пациента к устройству. Достоинством ингаляционного устройства Респимат является простая ингаляционная техника [54]. Приемлемая ингаляционная техника при использовании Респимата достигается у 96–98% пациентов всего лишь после первых пяти ингаляций через устройство [55]. Другое преимущество Респимата – хорошая координация «больной – ингалятор» – обеспечивает высокую доставку препарата в дыхательные пути даже у нетренированного пациента. В исследовании P. Brand и соавт. легочная депозиция препарата при ингаляции через Респимат у больных ХОБЛ составила 37% до обучения ингаляционной технике и 53% – после обучения (рис. 13) [56]. В противоположность этому в том же исследовании лучшие показатели легочной депозиции при ингаляции через безфреоновый ДАИ после тренировки составляли 21% [56].
Среди множества исследований, посвященных оценке различных устройств доставки пациентами, можно найти любые результаты в пользу того или иного ингалятора, однако чаще в данных исследованиях использовались произвольные опросники, которые не учитывали основ психометрического тестирования [57]. Поэтому особое внимание привлекают исследования, в которых использовались более совершенные инструменты, например опросник удовлетворенности и предпочтений пациента (Patient Satisfaction and Preference Questionnaire – PASAPQ) – практичный, валидизированный, надежный и чувствительный инструмент для тестирования отношения пациента к ингаляционную устройству [58]. В исследовании W. Schurmann и соавт., включавшем 224 больных ХОБЛ и БА, с помощью PASAPQ было проведено сравнение предпочтений пациентов при применении ингаляторов Респимат и ДАИ [55]. Исследование продемонстрировало, что подавляющее большинство пациентов (81%) предпочли ингалятор Респимат и хотели бы его применять в дальнейшем [55]. Среднее число баллов для 13 из 15 вопросов по опроснику PASAPQ было значительно выше для оценки Респимата по сравнению с оценкой ДАИ (p
В двух других похожих по дизайну исследованиях, включавших 152 и 150 больных ХОБЛ и БА, при помощи опросника PASAPQ сравнивали предпочтения пациентов при использовании Респимата и ДПИ (Мультидиска и Турбухалера) [59, 60]. Общее предпочтение Респимату отдали 74 и 64% больных, Турбухалеру – 17%, Мультидиску – 34%. В обоих исследованиях общее число баллов по шкале PASAPQ для Респимата было существенно выше, чем для ДПИ (p
И наконец, в небольшом исследовании из реальной практики, посвященном оценке эффектов перевода пациентов с ХОБЛ со Спиривы ХандиХалер на Спириву Респимат, в пользу нового ингалятора высказались 72% больных [42].
Заключение
На основании данных, приведенных в обзоре, можно сделать следующие выводы.
Новый ингалятор Респимат характеризуется простой ингаляционной техникой, обеспечивает хорошую координацию «больной – ингалятор» и высоко оценивается пациентами.
Длительная поддерживающая терапия препаратом Спирива Респимат у пациентов с ХОБЛ значительно улучшает функцию легких, уменьшает одышку, улучшает качество жизни и снижает риск обострений, в том числе приводящих к госпитализации.
У пациентов с ХОБЛ данные по нежелательным явлениям, связанным с терапией Спиривой Респимат, согласуются с известным профилем безопасности Спиривы ХандиХалер.
Препарат Спирива Респимат обладает хорошим профилем безопасности, не отличающимся от препарата Спирива ХандиХалер. Подтверждение тому – результаты глобального исследования TIOSPIR.
У больных с плохо контролируемой БА, несмотря на терапию ИГКС и ДДБА, добавление к терапии Спиривы Респимат позволяет значительно уменьшить выраженность бронхиальной обструкции и снизить риск развития тяжелых обострений астмы.
Спирива порошок для инг капс 18мкг N 30+ингалятор
Активное вещество
тиотропий бромид (tiotropium bromide)
Код АТХ
R03BB04 (Tiotropium bromide)
Форма выпуска, упаковка и состав препарата
Капсулы с порошком для ингаляций
твердые желатиновые, размер №3, светло-зеленовато-голубого цвета, непрозрачные; с символом , напечатанными черными чернилами; содержимое капсул — белый порошок.
| 1 капс. | |
| тиотропия бромида моногидрат | 22.5 мкг, |
| что соответствует содержанию тиотропия | 18 мкг |
[PRING] лактозы моногидрат, 200 М — 5.2025 мг, лактозы моногидрат микронизированный — 0.2750 мг.
Состав капсулы (мг/капсула):
макрогол — 2.4000 мг, индигокармин (Е132) — 0.0120 мг, титана диоксид (Е171) — 1.0240 мг, железа оксид желтый (Е172) — 0.0120 мг, желатин — 44.5160 мг.
10 шт. — блистеры (1) в комплекте с ингалятором ХандиХалер® или без него — пачки картонные. 10 шт. — блистеры (3) в комплекте с ингалятором ХандиХалер® или без него — пачки картонные. 10 шт. — блистеры (6) в комплекте с ингалятором ХандиХалер® или без него — пачки картонные.
Клинико-фармакологическая группа
Бронхолитический препарат — блокатор м-холинорецепторов
Фармако-терапевтическая группа
М-холиноблокатор
Фармакологическое действие
Тиотропия бромид — четвертичное аммониевое соединение, умеренно растворим в воде.
Тиотропия бромид имеет линейную фармакокинетику в терапевтических пределах после в/в введения и ингаляции сухого порошка.
Всасывание
При ингаляционном введении абсолютная биодоступность тиотропия бромида составляет 19.5%, что свидетельствует о высокой биодоступности фракции препарата, достигающей легких. Cmax в плазме крови достигается через 5-7 мин после ингаляции. Тиотропия бромид плохо всасывается из ЖКТ. По этой же причине прием пищи не влияет на абсорбцию тиотропия. При приеме внутрь тиотропия бромида в форме раствора абсолютная биодоступность составила 2-3%.
Распределение
Связывание с белками плазмы — 72%. Vd — 32 л/кг.
В равновесном состоянии Cmax в плазме крови у пациентов с ХОБЛ составляет 12.9 пг/мл и быстро снижается. Это указывает на мультикомпартментный тип распределения препарата. В равновесном состоянии Cmin тиотропия в плазме крови составляет 1.71 пг/мл.
Не проникает через ГЭБ.
Метаболизм
Степень биотрансформации незначительна. Это подтверждается тем,что после в/в введения препарата молодым здоровым добровольцам в моче обнаруживается 74% неизменной субстанции.
Тиотропия бромид расщепляется неферментным путем до алкоголь-N-метилскопина и дитиенилгликолевой кислоты, которые не связываются с мускариновыми рецепторами.
При исследованиях показано, что препарат (<20% от дозы после в/в введения) метаболизируется при участии изоферментов цитохрома P450, путем окисления и последующей конъюгации с глутатионом с образованием различных метаболитов. Нарушение метаболизма может иметь место при использовании ингибиторов CYP2D6 и CYP3А4 (хинидина, кетоконазола и гестодена). Таким образом, изоферменты CYP2D6 и CYP3А4 включаются в метаболизм препарата.
Выведение
T1/2 тиотропия после ингаляции варьирует от 27 до 45 ч. Общий клиренс при в/в введении молодым здоровым добровольцам составляет 880 мл/мин. Тиотропий после в/в введения в основном выводится почками в неизмененном виде (74 %). После ингаляции сухого порошка в равновесном состоянии почечная экскреция составляет 7% в сутки от дозы, оставшаяся невсосавшаяся часть, выводится через кишечник. Почечный клиренс тиотропия превышает клиренс креатинина, что свидетельствует о канальцевой секреции препарата. После длительного приема препарата однократно в сутки пациентами с ХОБЛ, фармакокинетическое равновесие достигается на 7 день, при этом в дальнейшем кумуляции не наблюдается.
Фармакокинетика у особых групп пациентов
У пациентов пожилого возраста наблюдается снижение почечного клиренса тиотропия (365 мл/мин у пациентов с ХОБЛ младше 65 лет, до 271 мл/мин у пациентов с ХОБЛ старше 65 лет). Эти изменения не приводили к соответствующему увеличению значений AUC0-6 или Cmax.
У пациентов с ХОБЛ и легкими нарушениями функции почек (КК 50-80 мл/мин) ингаляционное применение тиотропия 1 раз/сут в равновесном состоянии приводило к повышению значения AUC0-6 на 1.8-30%. Значение Cmax сохранялось таким же, как у пациентов с нормальной функцией почек (КК >80 мл/мин). У пациентов с ХОБЛ и средними или тяжелыми нарушениями функции почек (КК < 50 мл/мин) в/в введение тиотропия приводило к двукратному увеличению концентрации препарата в плазме (значение AUC0-4 ч увеличивалось на 82% а значение Cmax увеличивалось на 52%) по сравнению с пациентами с ХОБЛ и нормальной функцией почек. Аналогичное повышение концентрации тиотропия в плазме отмечалось и после ингаляции сухого порошка.
Предполагается, что печеночная недостаточность не будет оказывать значительного влияния на фармакокинетику тиотропия бромида, т.к. препарат в основном выводится с мочой и образование фармакологически активных метаболитов не связано с участием ферментов.
Показания к применению
- в качестве поддерживающей терапии у пациентов с ХОБЛ, включая хронический бронхит и эмфизему (поддерживающая терапия при сохраняющейся одышке и для предупреждения обострений).
Дозировка
Назначают по 1 капс./сут в одно и то же время в виде ингаляций с помощью ингалятора HandiHaler®.
Препарат не следует глотать. Спириву не следует применять чаще чем 1 раз/сут. Капсулы Спиривы должны применяться только с ингалятором HandiHaler®.
Пациентам пожилого возраста
следует принимать препарат в рекомендуемых дозах.
При нарушениях функции почек
пациенты могут применять препарат Спирива® в рекомендуемых дозах. Однако необходимо тщательное наблюдение за
пациентами с умеренной или тяжелой почечной недостаточностью,
получающими препарат Спирива® (как и в случае с другими препаратами, экскретирующимися в основном почками).
Пациенты с печеночной недостаточностью
могут принимать препарат в рекомендуемых дозах.
Способ применения ингалятора HandiHaler®
Ингалятор HandiHaler® разработан специально для применения Спиривы и не предназначен для приема других препаратов. Пациент может использовать свой HandiHaler® в течение одного года.
Ингалятор включает: пылезащитный колпачок, мундштук, основание, прокалывающую кнопку, центральную камеру.
Использование ингалятора HandiHaler®:
1. Открыть пылезащитный колпачок, нажав на прокалывающую кнопку полностью и затем отпустив.
2. Полностью открыть пылезащитный колпачок, подняв его вверх; затем открыть мундштук, подняв его вверх.
3. Непосредственно перед использованием достать капсулу Спиривы из блистера и положить ее в центральную камеру (не имеет значения, какой стороной капсула помещается в камеру).
4. Плотно закрыть мундштук до момента щелчка, пылезащитный колпачок оставить открытым.
5. Держа HandiHaler® мундштуком вверх, нажать прокалывающую кнопку один раз до конца и затем отпустить; таким образом, образуется отверстие, через которое препарат высвобождается из капсулы во время вдоха.
6. Полностью выдохнуть; никогда не выдыхать в мундштук.
7. Взять HandiHaler® в рот и плотно сжать губы вокруг мундштука; держа голову прямо, следует вдыхать медленно и глубоко, но в то же время с достаточной силой, чтобы услышать или почувствовать вибрацию капсулы; делать вдох до полного заполнения легких; затем задержать дыхание как можно дольше и вынуть HandiHaler® изо рта; продолжать дышать спокойно; повторить процедуры 6 и 7 для полного опустошения капсулы.
8. Далее следует снова открыть мундштук, достать и выбросить использованную капсулу. Закрыть мундштук и пылезащитный колпачок.
Чистка ингалятора HandiHaler®
Чистку HandiHaler® следует проводить 1 раз в месяц. Для этого необходимо открыть мундштук и пылезащитный колпачок, затем открыть основание прибора, подняв прокалывающую кнопку. Тщательно промыть ингалятор в теплой воде до полного удаления порошка. HandiHaler® следует протереть бумажным полотенцем и с открытым мундштуком, основанием и пылезащитным колпачком оставить сохнуть на воздухе в течение 24 ч. После чистки указанным образом прибор готов к последующему использованию. В случае необходимости наружная поверхность мундштука может быть очищена с помощью влажной, но не мокрой ткани.
Вскрытие блистера
Отделить полоску блистера вдоль перфорированной линии. Вскрыть полоску блистера непосредственно перед использованием так, чтобы одна капсула была полностью видна. В капсуле содержится небольшое количество порошка, поэтому она заполнена не полностью.
В случае, если капсула случайно была вскрыта и подверглась воздействию воздуха, использовать ее не следует. Ни в приборе, ни в блистере капсулы не должны подвергаться воздействию высоких температур, воздействию солнечных лучей.
Противопоказания
- I триместр беременности;
- детский и подростковый возраст до 18 лет;
- повышенная чувствительность к атропину или его производным (в т.ч. к ипратропию и окситропию);
- повышенная чувствительность к компонентам препарата.
С осторожностью
следует применять препарат при закрытоугольной глаукоме, гиперплазии предстательной железы, обструкции шейки мочевого пузыря.
Передозировка
Симптомы:
при применении высоких доз возможны проявления антихолинергического действия — сухость во рту, нарушения аккомодации, увеличение ЧСС.
После ингаляции однократной дозы до 282 мкг у здоровых добровольцев не выявлено системных антихолинергических эффектов. После повторного приема однократной суточной дозы 141 мкг у здоровых добровольцев наблюдались билатеральный конъюнктивит в сочетании с сухостью во рту, которые исчезали при продолжении лечения. При исследовании, в котором изучались эффекты тиотропия при многократном применении у пациентов с ХОБЛ, получавших максимально 36 мкг препарата более 4 недель, сухость во рту была единственным побочным эффектом.
Острая интоксикация, связанная со случайным приемом капсул внутрь, маловероятна в связи с низкой биодоступностью препарата.
Побочные эффекты
Со стороны обмена веществ:
дегидратация*.
Со стороны пищеварительной системы:
часто (≥1% и <10%) – сухость во рту обычно легкой степени выраженности; нечасто (≥0.1% и <1%) – стоматиты, запор, гастроэзофагеальный рефлюкс; редко (≥0.01% и <0.1%) – кандидоз ротоглотки, гингивит, глоссит; кишечная непроходимость, включая паралитический илеус, дисфагия.
Со стороны дыхательной системы:
нечасто (≥0.1% и <1%) — дисфония, кашель, фарингиты; редко (≥0.01% и <0.1%) – пародоксальный бронхоспазм, ларингиты, синуситы, носовое кровотечение.
Со стороны сердечно-сосудистой системы:
нечасто (≥0.1% и <1%) — мерцательная аритмия; редко (≥0.01% и <0.1%) – тахикардия (включая суправентрикулярную тахикардию), ощущение сердцебиения.
Со стороны мочевыделительной системы:
нечасто (≥0.1% и <1%) — затрудненное мочеиспускание и задержка мочеиспускания (у мужчин с предрасполагающими факторами), дизурия; редко (≥0.01% и <0.1%) — инфекции мочевыводящих путей.
Аллергические реакции:
нечасто (≥0.1% и <1%) — сыпь; редко (≥0.01% и <0.1%) — крапивница, зуд, реакции повышенной чувствительности, включая реакции немедленного типа, ангионевротический отек*.
Со стороны кожных покровов:
кожные инфекции и язвы на коже, сухость кожи*.
Со стороны костно-мышечной системы:
отечность суставов*.
Со стороны нервной системы:
нечасто (≥0.1% и <1%) — головокружение; редко — (≥0.01% и <0.1%) — бессонница.
Со стороны органа зрения:
нечасто (≥0.1% и <1%) — нечеткое зрение; редко — (≥0.01% и <0.1%) — повышение внутриглазного давления, глаукома.
* в объединенной базе клинических исследований данные побочные реакции не были выявлены; отмечены лишь единичные сообщения о данных побочных реакциях при широком применении препарата, однако связь с м-холиноблокирующим действием препарата Спирива® не доказана; частоту этих редких явлений трудно оценить.
Передозировка
Возможно назначение препарата Спирива® в комбинации с другими препаратами, обычно применяющимися для лечения ХОБЛ: симпатомиметиками, производными метилксантина, пероральными и ингаляционными ГКС. Совместное применение с длительнодействующими бета2-агонистами, ингаляционными ГКС и их комбинациями не влияет на действие тиотропия.
Ограниченная информация о совместном применении с антихолинергическими препаратами получена из двух клинических исследований: разовое назначение 1 дозы ипратропия бромида на фоне постоянного приема препарата Спирива® у пациентов с ХОБЛ (64 человека) и у здоровых добровольцев (20 человек) не приводила к уменьшению побочных реакций, изменению жизненных параметров и ЭКГ. Однако постоянное сочетанное применение антихолинергических препаратов и препарата Спирива® не изучалось и, следовательно, не рекомендуется.
Условия хранения
Препарат следует хранить в недоступном для детей месте при температуре не выше 25°C; не замораживать. Срок годности — 2 года.
После вскрытия блистер следует использовать в течение 9 дней.
Условия отпуска из аптек
Препарат отпускается по рецепту.
RU/SPRES-171477
Особые инструкции
Препарат Спирива® не предназначен для купирования острых приступов бронхоспазма.
После ингаляции порошка Спиривы возможно развитие реакций гиперчувствительности немедленного типа.
Процесс ингаляции Спиривы (как и других ингаляционных препаратов) может вызвать бронхоспазм.
Пациентов с почечной недостаточностью (КК ≤50 мл/мин) при назначении Спиривы следует тщательно наблюдать.
Пациентов следует ознакомить с правилами использования ингалятора. Не следует допускать попадания порошка в глаза. Боль в глазах или дискомфорт, нечеткость зрения, зрительные ореолы в сочетании с покраснением глаз, конъюнктивальным застоем и отеком роговицы могут свидетельствовать об остром приступе закрытоугольной глаукомы. При развитии любой комбинации этих симптомов пациент должен немедленно обратиться к врачу. Применение только препаратов, вызывающих миоз, не является эффективным способом лечения в данном случае.
В одной капсуле содержится 5.5 мг лактозы моногидрата.
Влияние на способность к вождению автотранспорта и управлению механизмами
Исследований по изучению влияния препарата на способность к вождению автотранспорта и управлению механизмами не проводилось. Случаи головокружения и нечеткости зрения при применении препарата могут оказать негативное влияние на вышеупомянутую способность.