Общая характеристика
Поджелудочная железа является единственным источником трипсина, поэтому определение его содержания может быть более важным для суждения о поражении поджелудочной железы, чем других ферментов. Все панкреатические протеазы, особенно трипсин и химотрипсин, очень быстро связываются с сывороточными ингибиторами немедленного и замедленного действия. Наиболее точным методом определения суммарной фракции трипсина и трипсиногена в крови является радиоиммунологический, основанный на принципе конкурентного белковосвязывающего анализа с двойными антителами. К преимуществам радиоиммунного анализа относятся: высокая чувствительность, специфичность, надежность, точность. Уровень трипсинемии зависит от формы и стадии заболевания. При острых атаках панкреатита характерно увеличение содержания трипсина, которое наблюдается чаще, чем повышение активности амилазы и липазы. Прогрессирующее безрецидивное течение хронического панкреатита или длительно текущий панкреатит сопровождаются постепенным снижением уровня сывороточного трипсина. Повышение концентрации трипсина в сыворотке крови детей в первые несколько недель после рождения свидетельствует о наличии муковисцидоза, в связи с чем определение этого показателя считают эффективным методом скрининга. По мере прогрессирования болезни и развития истинной недостаточности поджелудочной железы концентрация трипсина в сыворотке крови снижается.
Микрометод определения актвности трипсина в биологических жидкостях
Алехин С.А. Липатов В.А.
Курский государственный медицинский университет, каф. хирургических болезней № 2, каф. оперативной хирургии и топографической анатомии
www.drli.h1.ru
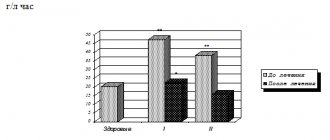
Определение активности трипсина является важным критерием в диагностике острого панкреатита. До настоящего времени основным методом определения активности трипсина был метод Эрлангера в модификации Шатерникова. Недостатками данного метода является его большая стоимость, погрешность связанная с нелинейностью зависимости изменения оптической плотности стандартного раствора р-нитроанилина от его концентрации используемого для построения калибровочного графика, сложность расчетов.
Целью нашей работы являлось устранение вышеизложенных недостатков существующей методики.
Нами разработан микрометод определения активности трипсина в биологических жидкостях.
Метод основан на расщеплении трипсином синтетического бесцветного субстрата — бензоиларгинин-р-нитроанилида — с образованием окрашенного р-нитроанилина, количество которого мы определяем на спектрофотометре BACKMAN-DU65 c микрокюветами при длине волны 410 нм.
Реактивы используемые в нашем методе такие, как и в методике Эрлангера в модификации Шатерника.
Калибровка проводится по описанной методике отличием является построение графика, которое проводится для автоматизации процесса и ведения базы данных в Microsoft Excel.
Поскольку калибровочный график не может иметь четкую линейную зависимость, то для выражения зависимости оптической плотности раствора от концентрации р-нитроанилина необходимо определить уравнение которое описывает данную график. Таким уравнением является уравнение полиномиальной аппроксимации, которое можно также вывести на калибровочный график в Microsoft Excel.
Ход определения:
В опытную и контрольную пробирку вносят по 0,4 мл бензоиларгинин-р-нитроанилида и добавляют по 0,025 мл физиологического раствора. Затем вносят по 0,025 мл плазмы крови, в контрольную пробирку сразу после этого добавляют 0,05мл 0,5н раствора НCl. 0,5 мл содержимого помещают в микрокювету и измеряют значение оптической плотности при длине волны 410 нм и обозначают это значение, как ЕК(410). Поскольку в некоторых случаях в ходе ферментативной реакции происходит помутнение раствора, для введения поправки на мутность следует определить оптическую плотность жидкости также и при длине волны 550 нм. Полученные данные помечают как ЕК(550). Далее опытную пробирку ставят в термостат при температуре 370С на 30 минут. После термостатирования определяют оптическую плотность раствора при длинах волн 410 и 550 нм в опытной пробирке и помечают полученные данные, как ЕОп(410) и ЕОп(550).
Расчет активности трипсина производят в три этапа
1. Расчет разницы оптических плотностей при разных длинах волн, она будет равна:
DЕ = (ЕОп(410) – ЕК(410)) – (ЕОп(550)- ЕК(550))
2. Расчет количества образовавшегося р-нитроанилина по полиномиальному уравнению, которое в общем виде будет выглядеть следующим образом:
y = b + c1*x + c2*x2 +……. +c6*x6 , где b и с константы
Пример полиномиального уравнения для расчета концентрации р-нитроанилина: y = 874,45*x 1 + 84,94*x2
В данном случае константа b равняется 0 и в связи с этим опущена. х — DЕ, а у – количество образовавшегося р-нитроанилина.
В каждой лаборатории должна быть проведена калибровка и расчет полиномиального уравнения для данных этой калибровки.
3. Непосредственно расчет активности трипсина.
Поскольку это микровариант методики определения трипсина, количества реактивов и плазмы крови пропорционально уменьшены по отношению к классической методике, то и коэффициенты перерасчета будут теми же, что и в классической методике.
Количество р-нитроанилина высчитанное с помощью полиномиального уравнения, показывает сколько вещества образовалось в ходе ферментативной реакции в 0,5 мл субстрата в течение 30 минут при добавлении 0,025 плазмы, а высчитываемое количество трипсина в единицах активности показывает сколько вещества образуется в 0,5 мл субстрата при добавлении 0,1 мл плазмы за 1минуту.
Следовательно А – количество трипсина в единицах активности будет равно: А = (у * 4) / 30.
Таким образом расчет активности трипсина по данной методике значительно снижает расход реактивов (в 10 раз по сравнению с методикой Эрлангера в модификации Шатерникова) очевидна экономическая эффективность первой из них. В связи с отсутствием принципиальных отличий между двумя методиками, результаты измерений активности трипсина будут аналогичными (разница между результатами будет находится в области погрешности методики). Немаловажным является и снижение количества забираемой крови на исследование. Так по предложенной нами методике плазмы необходимо всего 0,05 мл. а по классической методике 0,5 мл. Использование автоматических микропипеток позволяет уменьшить погрешность связанную с работой с микроколичествами реактивов и биологических материалов. Еще одним положительным моментом нашей модификации является упрощение расчетов и построения калибровочного графика и их автоматизация.
Использование уравнения полиномиальной аппроксимации позволяет снизить погрешность методики связанную с нелинейностью зависимости изменения оптической плотности раствора р-нитроанилина от его концентрации. В целом методика расчета более проста для понимания, чем классическая, а использование Microsoft Excel позволяет не только полностью автоматизировать расчет, но и вести базу данных.
Алехин С.А., Липатов В.А. Микрометод определения активности трипсина в биологических жидкостях. // Материалы 66-й научной конференции студентов и молодых ученых «Актуальные проблемы медицины и фармации», Курск, 2001, -с. 57 — 59.
Нозологическая классификация (МКБ-10)
- H11.3 Конъюнктивальное кровоизлияние
- H20 Иридоциклит
- H20.9 Иридоциклит неуточненный
- H59 Поражения глаза и его придаточного аппарата после медицинских процедур
- H60.9 Наружный отит неуточненный
- H66.0 Острый гнойный средний отит
- I80 Флебит и тромбофлебит
- J01.9 Острый синусит неуточненный
- J32.0 Хронический верхнечелюстной синусит
- J86 Пиоторакс
- J90 Плевральный выпот, не классифицированный в других рубриках
- K05.4 Пародонтоз
- L89 Декубитальная язва
- M86.9 Остеомиелит неуточненный
- S05.9 Травма неуточненной части глаза и орбиты
- T14.1 Открытая рана неуточненной области тела
- T30 Термические и химические ожоги неуточненной локализации
Ссылки [ править ]
- PDB : 1UTN ; Лейрос Х. К., Брандсдал Б. О., Андерсен О. А., Ос В., Лейрос И., Хелланд Р. и др. (Апрель 2004 г.). «Специфичность трипсина, выясненная расчетами LIE, рентгеновскими структурами и измерениями констант ассоциации» . Белковая наука
.
13
(4): 1056–70. DOI : 10.1110 / ps.03498604 . PMC 2280040 . PMID 15044735 . - Перейти
↑ Rawlings ND, Barrett AJ (1994). «Семейства сериновых пептидаз» .
Методы в энзимологии
.
244
: 19–61. DOI : 10.1016 / 0076-6879 (94) 44004-2 . ISBN 978-0-12-182145-6. PMC 7133253 . PMID 7845208 . - ↑
Немецкий физиолог Вильгельм Кюне (1837-1900) открыл трипсин в 1876 году. См .: Kühne W (1877). «Убер дас трипсин (фермент панкреас)» .
Verhandlungen des Naturhistorisch-medicinischen Vereins zu Heidelberg
. новая серия.
1
(3): 194–198 — через Google Книги. - Энгелькинг LR (2015-01-01). «Глава 7 — Переваривание белков». Учебник ветеринарной физиологической химии
(Третье изд.). Бостон: Academic Press. С. 39–44. DOI : 10.1016 / B978-0-12-391909-0.50007-4 . ISBN 978-0-12-391909-0. - ↑
Kühne W (6 марта 1876 г.). «Ueber das Trypsin (Enzym des Pankreas)» [О трипсине (ферменте поджелудочной железы)]. В Naturhistorisch-medizinischen Verein (ред.).
Verhandlungen des Naturhistorisch-medizinischen Vereins zu Heidelberg
[
Переговоры Медицинской ассоциации естествознания в Гейдельберге
] (на немецком языке). Гейдельберг, Германия: Universitätsbuchhandlung Карла Винтера (опубликовано в 1877 г.). С. 194–8 — через Archive.org. - «Переваривание белков» . Элективный курс (Клиническая биохимия)
. Тернопольский национальный медицинский университет. 14 июля 2015 года . Проверено 11 апреля 2022 года . - Polgár L (октябрь 2005). «Каталитическая триада сериновых пептидаз». Клеточные и молекулярные науки о жизни
.
62
(19–20): 2161–72. DOI : 10.1007 / s00018-005-5160-х . PMID 16003488 . S2CID 3343824 . - Voet D, Voet JG (2011). Биохимия
(4-е изд.). Хобокен, Нью-Джерси: Джон Уайли и сыновья. ISBN 9780470570951. OCLC 690489261 . - «Классификация модифицированного трипсина» (PDF) . www.promega.com. 2007-04-01 . Проверено 8 февраля 2009 .
- Перейти
↑ Rodriguez J, Gupta N, Smith RD, Pevzner PA (январь 2008 г.). «Режет ли трипсин раньше, чем пролин?» (PDF) .
Журнал протеомных исследований
.
7
(1): 300–5. CiteSeerX 10.1.1.163.4052 . DOI : 10.1021 / pr0705035 . PMID 18067249 . - Chelulei Cheison S, J Brand, Лейба E, Kulozik U (март 2011). «Анализ влияния изменений температуры в сочетании с различным щелочным pH на картину гидролиза β-лактоглобулина и трипсина с использованием MALDI-TOF-MS / MS». Журнал сельскохозяйственной и пищевой химии
.
59
(5): 1572–81. DOI : 10.1021 / jf1039876 . PMID 21319805 . - Gudmundsdóttir A, Pálsdóttir HM (2005). «Трипсины атлантической трески: от фундаментальных исследований к практическому применению». Морская биотехнология
.
7
(2): 77–88. DOI : 10.1007 / s10126-004-0061-9 . PMID 15759084 . S2CID 42480996 . - Noone PG, Zhou Z, Silverman LM, Jowell PS Ноулз MR, Cohn JA (декабрь 2001). «Мутации гена муковисцидоза и риск панкреатита: связь с транспортом эпителиальных ионов и мутациями гена ингибитора трипсина». Гастроэнтерология
.
121
(6): 1310–9. DOI : 10,1053 / gast.2001.29673 . PMID 11729110 . - «Трипсин-ЭДТА (0,25%)» . Технологии стволовых клеток . Проверено 23 февраля 2012 .
- «Debrisol» . наркотики.com.
- «Протеаза — База данных ГМО» . ГМО Компас
. Евросоюз. 2010-07-10. Архивировано из оригинала на 2015-02-24 . Проверено 1 января 2012 . - Voet D, Voet JG (1995). Биохимия (2-е изд.). Джон Вили и сыновья. С. 396–400 . ISBN 978-0-471-58651-7.
- Levilliers N, Perón М, Arrio В, Pudles J (октябрь 1970). «О механизме действия протеолитических ингибиторов. IV. Влияние 8 М мочевины на стабильность трипсина в комплексах трипсин-ингибитор». Архивы биохимии и биофизики
.
140
(2): 474–83. DOI : 10.1016 / 0003-9861 (70) 90091-3 . PMID 5528741 .
Механизм [ править ]
Ферментативный механизм аналогичен механизму других сериновых протеаз. Эти ферменты содержат каталитическую триаду, состоящую из гистидина- 57, аспартата- 102 и серина- 195. [7] Эта каталитическая триада ранее называлась системой реле заряда, подразумевая отрыв протонов от серина к гистидину и от гистидина к аспартату, но из-за данных, предоставленных ЯМР, полученная алкоксидная форма серина будет иметь гораздо более сильное влияние на протон, чем имидазольное кольцо гистидина, согласно современным представлениям, вместо этого серин и гистидин имеют фактически равную долю протона, образуя с ними короткие водородные связи с низким барьером . [8] [стр.
] Таким образом,нуклеофильностьсеринавактивном центреповышается, что облегчает его атаку на амидный углерод во время протеолиза. Ферментативная реакция, которую катализирует трипсин,термодинамическивыгодна, но требует значительнойэнергии активации(кинетическинеблагоприятный »). Кроме того, трипсин содержит« оксианионную дыру », образованную атомами водорода амида основной цепи Gly-193 и Ser-195, которые за счет образования водородных связей стабилизируют отрицательный заряд, который накапливается на амидном кислороде после нуклеофильной атаки на планарную поверхность. амид углерода сериновым кислородом заставляет этот углерод принимать тетраэдрическую геометрию. Такая стабилизация этого тетраэдрического промежуточного соединения помогает снизить энергетический барьер его образования и сопровождается понижением свободной энергии переходного состояния. Предпочтительное связывание переходного состояния состояние — ключевая особенность химии ферментов.
Отрицательный остаток аспартата (Asp 189), расположенный в каталитическом кармане (S1) трипсина, отвечает за привлечение и стабилизацию положительно заряженного лизина и / или аргинина и, таким образом, отвечает за специфичность фермента. Это означает , что трипсин преимущественно расщепляет белки на карбоксильной стороне (или « С-концевой стороне») из аминокислоты лизина и аргинина , за исключением , когда либо связан с С-концевой пролин , [9] , хотя данные крупномасштабного масс — спектрометрии показывают , расщепление происходит даже с пролином. [10] Трипсин считается эндопептидазой., т.е. расщепление происходит внутри полипептидной цепи, а не на концевых аминокислотах, расположенных на концах полипептидов .
Способ применения и дозы
В/м. Взрослым — по 5–10 мг 1–2 раза в день; детям — по 2,5 мг 1 раз в день. Для инъекций непосредственно перед применением разводят 5 мг трипсина кристаллического в 1–2 мл 0,9% раствора NaCl или 0,5–2% раствора прокаина. Курс лечения — 6–15 инъекций. Применяют также электрофорез с трипсином: на 1 процедуру 10 мг трипсина (растворить в 15–20 мл дистиллированной воды), вводят с отрицательного полюса.
Ингаляционно: по 5–10 мг в 2–3 мл 0,9% раствора NaCl через ингалятор или через бронхоскоп. После ингаляции полощут рот теплой водой и промывают нос.
Глазные капли: конъюнктивально, 0,2–0,25% раствор, который готовят непосредственно перед применением.
Интраплеврально: 1 раз в сутки, 10–20 мг, растворив в 20–50 мл 0,9% раствора NaCl.
Интраплеврально: по 50–150 мг в 5–30 мл фосфатного буферного раствора, после введения желательно частое изменение положения тела; на 2-й день после инстилляции выпускают, как правило, разжиженный экссудат.
Местно:Трехслойную ткань из диальдегидцеллюлозы, пропитанную раствором трипсина, накладывают на рану (после ее обработки) и закрепляют повязкой, оставляют на ране не более 24 ч. Перед применением полотно смачивают дистиллированной водой или раствором фурацилина. Время полного очищения раны от некротических тканей и гноя — 24–72 ч. При необходимости применяют повторно.
Изоферменты [ править ]
Эти гены человека кодируют белки с ферментативной активностью трипсина:
| Альт. символы | TRY1 |
| Ген NCBI | 5644 |
| HGNC | 9475 |
| OMIM | 276000 |
| RefSeq | NM_002769 |
| UniProt | P07477 |
| Прочие данные | |
| Номер ЕС | 3.4.21.4 |
| Locus | Chr. 7 q32-qter |
| Альт. символы | TRYP2 |
| Ген NCBI | 5645 |
| HGNC | 9483 |
| OMIM | 601564 |
| RefSeq | NM_002770 |
| UniProt | P07478 |
| Прочие данные | |
| Номер ЕС | 3.4.21.4 |
| Locus | Chr. 7 q35 |
| Альт. символы | PRSS4 |
| Ген NCBI | 5646 |
| HGNC | 9486 |
| OMIM | 613578 |
| RefSeq | NM_002771 |
| UniProt | P35030 |
| Прочие данные | |
| Номер ЕС | 3.4.21.4 |
| Locus | Chr. 9 p13 |
Другие изоформы трипсина также могут быть обнаружены в других организмах.