Антиферментные препараты (ингибиторы протеолиза) – это группа лекарственных средств, которые блокируют действие пищеварительных ферментов поджелудочной железы и используются для лечения острого панкреатита.
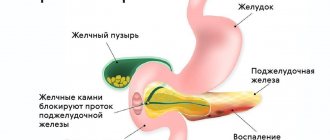
Поджелудочная железа является органом смешанной секреции. Эндокринная ее часть, которая представлена островками Лангерганса, продуцирует прямо в кровь гормоны, влияющие на обмен углеводов – инсулин и глюкагон. Экзокринная же часть поджелудочной железы вырабатывает критично необходимый для нормального пищеварения панкреатический сок, который выделяется через проток в просвет двенадцатиперстной кишки.
Панкреатический сок представляет собой смесь ферментов, способных расщеплять все основные компоненты пищи – белки, жиры и углеводы – до простейших соединений, которые смогут далее всосаться в тонком кишечнике.
Ферменты поджелудочной железы (панкреатические ферменты) обладают чрезвычайно мощной «переваривающей» силой, поэтому поджелудочная железа синтезирует их в исходно неактивной (зимогенной) форме. В нормальных условиях переход панкреатических ферментов в активную форму происходит только в просвете двенадцатиперстной кишки, при взаимодействии с компонентами пищи.
В случае нарушения оттока панкреатического сока, например, при острых заболеваниях поджелудочной железы, ферменты активируются прямо в ткани самой железы. Это, в свою очередь приводит к так называемому аутолизу – «самоперевариванию» поджелудочной железы и ферментативному «расплавлению» окружающих тканей.
Аутолиз поджелудочной железы является острым состоянием, угрожающим жизни человека. При отсутствии адекватных мер помощи существует высокий риск смерти пациента.
К одной из базовых групп лекарственных препаратов, которые применяют для профилактики и лечения аутолиза поджелудочной железы, относят антиферментные препараты – ингибиторы протеолиза.
Показания к применению
Антиферментные препараты применяют при заболеваниях, которые сопровождаются нарушением оттока панкреатического сока из поджелудочной железы: острых панкреатитах, обострениях хронического панкреатита, тяжелых травмах поджелудочной железы, опухолях поджелудочной железы, отеках стенок двенадцатиперстной кишки при длительном активном приеме алкоголя.
Также антиферментные препараты используют для профилактики сильных кровотечений и тяжелой кровопотери в случае операций на сердце, сердечных (коронарных) сосудах, легких и т.д.
Ингибиторы интегразы: механизм действия
Интеграза наряду с обратной транскриптазой и протеазой — один из ключевых участников репликации ВИЧ-1. Она катализирует процессы, приводящие к перемещению ДНК или её фрагментов внутри генома или между геномами. Будучи частью прединтеграционного комплекса, интеграза распознаёт длинные терминальные повторы на концах двойной цепи вновь синтезированной вирусной ДНК, отщепляет по два или по три основания с каждого конца, а также участвует в транспортировке вирусной ДНК в ядро клетки-мишени, где определяет предпочтительный сайт внедрения вирусной ДНК в хромосому и осуществляет её интеграцию в клеточный геном [5].
Ингибиторы интегразы, связываясь с её активным участком и блокируя этап переноса цепей во время интеграции ретровирусной ДНК, предотвращают образование ковалентных связей с ДНК хозяина и включение ВИЧ в геном хозяина [4].
В отличие от обратной транскриптазы и протеазы, интеграза не имеет близких аналогов в эукариотической клетке, поэтому у препаратов, избирательно действующих на неё, побочные эффекты должны быть минимальны [5].
Первым ингибитором протеазы стал ралтегравир, одобренный Администрацией по продуктам питания и лекарственным препаратам США в 2007 году [6]. Сегодня наряду с ралтегравиром используются ещё 4 препарата этого класса: элвитегравир, долутегравир, биктегравир и каботегравир. В разработке находится ещё две молекулы, одна из которых, по всей вероятности, имеет длительность действия до 4 раз больше по сравнению с ралтегравиром и, возможно, будет отнесена к ингибиторам интегразы второго поколения.
Фармакологическое действие
Антиферментные препараты блокируют самый мощный панкреатический фермент – трипсин. Трипсин расщепляет белки (протеины), осуществляя биохимический процесс, который называется протеолиз. Именно поэтому антиферментные препараты еще называют ингибиторами протеолиза. При этом останавливаются процессы самопереваривания в поджелудочной железе и прекращают выделяться в кровь токсины – продукты аутолиза.
Антиферментные препараты дополнительно оказывают кровоостанавливающее действие, блокируя действие других ферментов-протеаз в крови, отвечающих за расщепление белков. В частности, антиферментные препараты ингибируют активность фермента фибринолизина (плазмина), который отвечает за разрушение нитей фибрина, стабилизирующих тромбы, и препятствует тем самым остановке кровотечений.
Кроме того, антиферментные препараты оказывают неспецифическое противовоспалительное действие.
Ингибиторы протеазы: механизм действия
Внедрение в клиническую практику ингибиторов протеазы стало краеугольным камнем лечения ВИЧ. Их добавление в схему терапии к двум нуклеозидным ингибиторам обратной транскриптазы (НИОТ) позволило уменьшить количество пациентов с прогрессирующим течением заболевания (до развития СПИДа или смерти) в два раза. У 90 % пациентов, получавших комбинацию из трёх препаратов, число частиц РНК ВИЧ в крови снизилось с более чем 20 000 на миллилитр до менее чем 500 на миллилитр за 24 недели терапии [1].
Механизм действия ингибиторов протеазы основан на их способности блокировать один из ферментов, служащих важным элементом созревания вируса в жизненном цикле ВИЧ. Геном ВИЧ кодирует длинный полипептид. После удаления оболочки вируса и обратной транскрипции генома РНК образуется полипептид, содержащий все продукты вирусных генов, включая структурные белки и ферменты. Затем протеаза ВИЧ расщепляет его на составляющие вирусные белки. При подавлении активности протеазы этот процесс блокируется, что приводит к нарушению созревания вирусной мРНК, в результате чего образуются вирусные частицы, не способные заражать новые клетки [1].
Первыми ингибиторами протеазы стали пептидомиметические молекулы, схожие с пептидом-предшественником и конкурирующие с ним. Однако, как и большинство пептидомиметических белков, ранние ингибиторы протеазы имели существенный фармакокинетический недостаток: они плохо всасывались и быстро выводились при пероральном приёме. Проблема была решена заменой участка пиридина в структуре ингибиторов протеазы на тиазол, менее богатый электронами. Благодаря этому удалось повысить метаболическую стабильность молекулы и улучшить растворимость вещества в воде, а также увеличить его эффективность в отношении вируса [1, 2].
Первым ингибитором протеазы, одобренным американским Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) стал саквинавир — он получил «зелёный свет» всего через 97 дней после того, как была подана соответствующая заявка. В течение следующих нескольких месяцев было получено разрешение на продажу двух других ингибиторов протеаз — ритонавира и индинавира. Сегодня одобрение регулятора имеют десять препаратов этого класса: ампренавир, атазанавир, лопиновир, ритонавир, типранавир, нелфинавир, индинавир, саквинавир, фосампренавир и дарунавир.
Основы лечения антиферментными препаратами
Учитывая особенности и сложности в подборе индивидуальной дозы антиферментных препаратов конкретному пациенту, а также широкий спектр побочных эффектов и особенностей взаимодействия с другими лекарствами, ингибиторы протеолиза назначает только опытный врач в условиях стационара.
Апротинин может вызвать сильную аллергическую реакцию вплоть до анафилактического шока. Категорически противопоказано назначать препарат пациентам, которым в течение последнего года вводили апротинин.
Общие свойства ингибиторов протеазы
Препараты этой группы снижают концентрацию вирусной РНК, увеличивают количество белых кровяных клеток, отвечающих за реакцию иммунной системы на инфекцию (CD-4 клеток) и, в итоге, улучшают выживаемость при включении в терапию наряду с антиретровирусными препаратами других классов.
В целом ингибиторы протеазы имеют сходные терапевтические эффекты. Их активность в отношении ВИЧ-1 и ВИЧ-2 расценивается как высокая, а устойчивость к ним развивается медленно.
Фармакокинетика
Ингибиторы протеазы интенсивно метаболизируются изоферментами системы цитохрома Р450, в частности, CYP3A4, что открывает возможности для целого ряда межлекарственных взаимодействий. Средства, индуцирующие активность ферментов Р450, например, рифампицин или экстракт зверобоя, ускоряют метаболизм ингибиторов протеазы, уменьшая их концентрацию в плазме и терапевтическую эффективность. И наоборот: препараты-ингибиторы ферментов Р450, такие как кетоконазол или циметидин, повышают уровень ингибиторов протеазы в плазме, что связано с увеличением токсичности последних [2].
На сегодня наиболее мощным ингибитором CYP3A4 является ритонавир. Он специально комбинируется с другими ингибиторами протеазы, являющимися субстратами CYP3A4 для продления их периода полувыведения [4].
Ингибиторы протеазы лучше всасываются при приёме во время или после еды [2, 3].
Показания
Препараты этого класса применяются для лечения ВИЧ-инфекции, профилактики передачи инфекции от матери к ребёнку и постконтактной профилактики заболевания.
Противопоказания
Противопоказано одновременное применение ритонавира с препаратами, выведение которых зависит от активности CYP3A4, во избежание токсичности антиретровирусной терапии.
Побочные эффекты
Неблагоприятные реакции при применении ингибиторов протеазы включают [2, 3, 4]:
- желудочно-кишечные расстройства, в частности, диарею с неустановленным механизмом, которая осложняется тем, что она нередко становится одним из осложнений ВИЧ;
- гиперлипидемию — общий побочный эффект для всех ингибиторов протеазы, реже возникает при приёме атазанавира; по всей видимости, нарушение липидного обмена связано с перераспределением жировой ткани, характерным для ВИЧ, которое обостряется при приёме ингибиторов протеазы;
- гипергликемию, инсулинорезистентность, которые развиваются, вероятно, в результате подавления ингибиторами протеаз переносчика глюкозы, что приводит к подавлению активности поглощения глюкозы клетками; с меньшей вероятностью этот побочный эффект проявляет атазанавир по сравнению с другими ингибиторами протеазы;
- сыпь, чаще всего возникает при приёме ампренавира.
Известен и ряд уникальных побочных эффектов: так, при приёме атазанавира может фиксироваться гипербилирубинемия, которая не считается признаком гепатотоксичности препарата, а на фоне применения индинавира возникает кристаллурия и нефролитиаз, что связано с плохой растворимостью препарата в воде. Поэтому пациентам, получающим индинавир, рекомендуют увеличить потребление жидкости во время лечения.
Особые указания
Использование ритонавира в качестве единственного ингибитора протеазы ограничено из‑за его выраженных пищеварительных побочных эффектов в терапевтических дозировках. Сегодня препарат применяют в низких дозах для повышения активности других ингибиторов протеаз. Одним из самых частых комбинированных препаратов, используемых для лечения ВИЧ, сегодня является лопинавир + ритонавир. Следует обратить внимание на то, что капсулы и растворы ритонавира содержат этиловый спирт, поэтому пациентам, получающим препарат, необходимо избегать приёма препаратов, вызывающих дисульфирамовую реакцию, в частности, дисульфирама и метронидазола [4].
Общие свойства ингибиторов протеаз
Механизмы устойчивости к ингибиторам интегразы отличаются от таковых к другим классам антиретровирусных препаратов. Если в основе резистентности большинства ненуклеозидных ингибиторов обратной транскриптазы и ингибиторов протеазы лежит изменение конфигурации активного центра фермента и следующее за ним блокирование присоединения молекулы лекарства, то в случае с ингибиторами интегразы, по всей вероятности, имеют место другие феномены, причём для разных мутаций они могут отличаться [7]. Считается, что ралтегравир имеет низкий генетический барьер для развития устойчивости, поскольку единичная точечная мутация ВИЧ может приводить к изменению способности интегразы к ингибированию. Возможно, имеет место перекрёстная резистентность между ингибиторами интегразы [4].
Фармакокинетика
Основной путь выведения ралтегравира — через печень, тем не менее коррекция дозы препарата у пациентов с печёночной недостаточностью лёгкой и средней степени тяжести не требуется. Почечное выведение играет незначительную роль в метаболизме ингибиторов протеазы, поэтому при почечной недостаточности дозу не пересматривают.
Ралтегравир не является субстратом для ферментов цитохрома CYP450, не ингибирует и не индуцирует их, с чем связана низкая частота лекарственных взаимодействий.
Показания
Ингибиторы протеазы показаны при ВИЧ-1 инфекции у пациентов, у которых выработалась устойчивость к другим классам антиретровирусных препаратов.
Противопоказания
Не имеют терапевтического значения ввиду высокого профиля безопасности препаратов.
Побочные эффекты
Поскольку антиретровирусные препараты обычно назначаются в комбинированных схемах, возникают сложности с определением неблагоприятных реакций, связанных с конкретным классом или лекарственным средством. В целом ингибиторы протеазы хорошо переносятся. В контролируемых исследованиях побочные эффекты при приёме ралтегравира были сопоставимы с таковыми при приёме плацебо. Ралтегравир считается одним из самых безопасных препаратов для лечения ВИЧ-инфекции благодаря минимальному риску развития нежелательных явлений, причём как у пациентов, ранее не получавших антиретровирусную терапию, так и уже имевших опыт лечения препаратами других классов [4, 8].