Актуальность исследования депрессий позднего возраста в первую очередь обусловлена высокой частотой этой патологии в старших возрастных группах населения. По данным разных авторов [1—3], страдают депрессией от 10 до 25% лиц пожилого возраста, при этом часто депрессия у пожилых людей не распознается врачами, что приводит к затягиванию и хронификации заболевания [1, 3, 4].
Большинство исследователей сходятся во мнении, что показатели распространенности депрессивных расстройств среди лиц старших возрастных групп почти в 2 раза превышают соответствующие оценки для популяции более молодого возраста. Депрессия повышает риск госпитализации пожилых людей, ведет к увеличению продолжительности их пребывания в стационаре при соматических заболеваниях, вызывает ухудшение терапевтического ответа на лекарственные препараты, является одной из наиболее важных причин суицидов и повышает риск развития деменции. По прогнозу экспертов ВОЗ, к 2022 г. депрессия станет ведущим заболеванием по затратам на помощь больным в старших возрастных группах населения. Если принять во внимание, что в позднем возрасте существует повышенный риск возникновения нежелательных побочных явлений и осложнений психофармакотерапии, связанный с возрастными особенностями процессов биотрансформации и элиминации лекарственных препаратов, а также отягощенность пожилых пациентов коморбидными соматическими и неврологическими заболеваниями, требующими постоянного лечения, то это делает понятным, почему терапия депрессий позднего возраста является особенно сложной проблемой современной психиатрии. В связи с этим высокую актуальность приобретает повышение эффективности и безопасности психофармакотерапии при лечении больных пожилого и старческого возраста с депрессивными расстройствами.
В последние годы было установлено, что патогенетические механизмы депрессии связаны не только с нарушениями моноаминергической синаптической передачи и дисфункцией нейроэндокринных систем, но и с нарушениями циркадианной системы, характеризующимися дезорганизацией эндогенных (внутренних) ритмов организма [5]. К настоящему времени одной из концепций патогенеза депрессивных расстройств является хронобиологическая, основывающаяся на том, что депрессивные состояния нередко сопровождаются десинхронизацией биологических ритмов, прежде всего циркадианных (циркадных), соответствующих суточным колебаниям, т. е. 24-часовому периоду.
Нарушения циркадианных ритмов могут изменять целый ряд биологических процессов, таких как цикл сон—бодрствование, высвобождение гормонов, температура тела (уплощение суточных колебаний температуры) и других важных физических функций. Изучение при депрессиях патофизиологических показателей, отражающих нарушения циркадианного ритма сон—бодрствование, показало наличие целого ряда биохимических отклонений. Среди них — снижение ночной концентрации мелатонина в плазме крови, нарушение периодичности колебаний концентраций пролактина, кортизола, тиреостимулирующего гормона и др. [6].
В рамках хронобиологической концепции депрессии большое место отводится нарушениям сна. Раннее выявление и лечение нарушений сна некоторые исследователи рассматривают как способ профилактики рекуррентной депрессии [7], а также предикции рецидива заболевания [8]. Подтверждением этого служат данные эпидемиологических исследований, свидетельствующие о том, что более чем у 80% взрослых, страдающих депрессией, присутствуют нарушения сна [9]. У пожилых людей бессонница является наиболее распространенной жалобой [10], и частота ее возрастает с увеличением возраста [11].
Некоторые авторы [12] нарушения циркадианных ритмов и депрессивные расстройства рассматривают как два взаимосвязанных изменения, характерные для пожилого возраста. Восстановление циркадианных ритмов приводит к нормализации структуры сна: у больных с депрессией увеличивается длительность фазы медленного сна без изменения его общей продолжительности и количества фаз быстрого сна, изменяется выраженность депрессивной симптоматики в течение суток, что приводит к нивелированию аффективного расстройства [13]. В связи с этим новые антидепрессанты, эффективные в отношении инсомнии и не вызывающие сонливости в дневное время, могут представлять собой средство для лечения депрессии позднего возраста. К таким антидепрессантам относится вальдоксан [14]. Первый опыт применения этого препарата в лечении депрессивных расстройств в амбулаторной геронтопсихиатрической практике оказался весьма позитивным [15].
Вальдоксан является агонистом МТ1- и МТ2-мелатониновых и антагонистом 5-НТ2C-серотониновых рецепторов [16]. При этом вальдоксан не обнаруживает значимого сродства к гистаминергическим, бета- и альфа-адренергическим, холинергическим, бензодиазепиновым и дофаминергическим рецепторам, не действует на захват моноаминов. Восстановление синхронизации циркадианных ритмов при приеме вальдоксана осуществляется посредством стимуляции рецепторов мелатонина, гормона, который выполняет основную роль в синхронизации циркадных ритмов организма, в том числе и цикла сон—бодрствование. По данным V. Audinot и соавт. [16], препарат не оказывает отрицательного влияния на память и внимание и не имеет поведенческой токсичности. Использование вальдоксана не оказывает воздействия на артериальное давление и частоту сердечных сокращений, не вызывает синдромов привыкания и отмены (даже при резкой отмене).
Цель настоящего исследования — оценка терапевтической эффективности, переносимости и безопасности вальдоксана при лечении депрессий у пожилых пациентов психиатрического стационара.
Материал и методы
В исследование включали больных в возрасте 60 лет и старше с депрессией разной степени выраженности, лечившихся в геронтопсихиатрической клинике Научного центра психического здоровья.
Больным был назначен вальдоксан в стандартных дозах 25—50 мг в сутки в течение 42 дней. Вальдоксан (вальдоксан) назначался в соответствии с инструкцией 1 раз в сутки в одно и то же время (вечером) в дозе 25 мг (1 таблетка) в первые 2 нед терапии. При необходимости суточная доза увеличивалась до максимальной — 50 мг 1 раз (вечером).
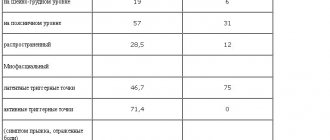
В исследование были включены 20 больных, 6 (30%) мужчин и 14 (70%) женщин в возрасте от 60 до 79 лет (средний — 69,9±6,06 года) (табл. 1).
Таблица 1. Демографическая и клиническая характеристика группы больных, пролеченных вальдоксаном
У всех больных был диагностирован большой депрессивный эпизод (ДЭ) в соответствии с классификацией DSM-IV-TR или МКБ-10, в том числе у 2 больных — однократный ДЭ, у 13 — депрессивная фаза в рамках рекуррентного депрессивного расстройства (РДР) и у 5 — в рамках биполярного аффективного расстройства (БАР). У больных в анамнезе отсутствовали другие психические расстройства и первичные органические заболевания.
По критериям МКБ-10 у 6 (30%) больных депрессия соответствовала легкому ДЭ, у 13 (65%) больных — ДЭ средней тяжести, у 1 (5%) — тяжелому ДЭ (см. табл. 1).
Все пациенты прошли полное клиническое обследование (психопатологическое, психометрическое, терапевтическое и неврологическое).
Для оценки терапевтической эффективности лечения использовали стандартизованные оценочные шкалы: госпитальную шкалу тревоги и депрессии (HADS), шкалу оценки ангедонии Снайта—Гамильтона (SHAPS) и шкалу общего клинического впечатления (CGI). Оценка состояния больных по этим шкалам производилась до начала лечения (0-й день), на 7, 14, 28 и 42-й дни терапии. Для оценки качества жизни больных применялся специальный опросник SF-36. Для оценки когнитивного функционирования использовали краткую шкалу оценки когнитивного статуса (MMSE). Оценка по этим опросникам производилась перед началом и после окончания лечения (на 42-й день терапии).
Эффективность терапии определяли по степени редукции средних по группе больных показателей по шкалам SHAPS, HADS, CGI-S и CGI-I на 7, 14, 28 и 42-й дни лечения по отношению к исходной оценке (в %).
Нежелательные эффекты терапии оценивались с помощью шкалы для оценки побочного действия препаратов UKU перед началом, на 7-й и 42-й дни лечения.
Шкала HADS состоит из 14 пунктов и имеет 2 подшкалы (для оценки уровней тревоги и депрессии). При оценке тяжести тревоги и депрессии учитывался суммарный показатель по каждой подшкале. Сумма баллов от 0 до 7 соответствует норме, 8—10 баллов — субклиническому уровню, 11 баллов и выше — клинически выраженным тревоге и депрессии.
По шкале CGI использовалась градуированная оценка тяжести состояния (подшкала CGI-S), где 1 балл соответствовал тому, что пациент не болен, 2 балла — пограничному состоянию (субклинический уровень), 3 балла — легкой степени, 4 балла — средней степени, 5 баллов — умеренно-тяжелому состоянию, 6 баллов — тяжелому состоянию, 7 баллов — чрезвычайно тяжелому состоянию. Подшкала CGI-I оценивала динамику состояния в процессе терапии по сравнению с его начальным уровнем: 1 балл соответствовал выраженному, 2 балла — умеренному и 3 балла — минимальному улучшению; 4 балла соответствовали отсутствию изменений, 5 баллов — минимальному ухудшению, 6 баллов — ухудшению и 7 баллов — выраженному ухудшению.
Опросник SF-36 используется для оценки качества жизни больных. Он состоит из 36 пунктов, которые сгруппированы в 8 шкал: физическое функционирование, ролевая деятельность, телесная боль, общее здоровье, жизнеспособность, социальное функционирование, эмоциональное состояние и психическое здоровье. Результаты оцениваются в баллах по каждой из 8 шкал, которые составлены таким образом, что более высокая оценка указывает на лучший уровень качества жизни. Количественно оцениваются следующие показатели: 1. Физическое функционирование (PF), отражающее степень, в которой физическое состояние ограничивает выполнение физических нагрузок (самообслуживание, ходьба, подъем по лестнице, переноска тяжестей и т. п.). Низкие показатели по этой шкале свидетельствуют о том, что физическая активность пациента значительно ограничивается состоянием его здоровья. 2. Ролевое функционирование, обусловленное физическим состоянием (RP) — влияние физического состояния на повседневную ролевую деятельность (работа, выполнение повседневных обязанностей). Низкие показатели по этой шкале свидетельствуют о том, что повседневная деятельность значительно ограничена физическим состоянием пациента. 3. Интенсивность боли (BP) и ее влияние на способность заниматься повседневной деятельностью. Низкие показатели по этой шкале свидетельствуют о том, что боль значительно ограничивает активность пациента. 4. Общее состояние здоровья (GH) — оценка больным своего состояния здоровья. 5. Жизненная активность (VT) подразумевает ощущение себя полным сил и энергии или, напротив, обессиленным. Низкие баллы свидетельствуют об утомлении пациента, снижении жизненной активности. 6. Социальное функционирование (SF), определяется степенью, в которой физическое или эмоциональное состояние ограничивает социальную активность больных. Низкие баллы свидетельствуют о значительном ограничении социальных контактов, снижении уровня общения в связи с ухудшением физического и эмоционального состояния. 7. Ролевое функционирование, обусловленное эмоциональным состоянием (RE), предполагает оценку степени, в которой эмоциональное состояние мешает выполнению работы или другой повседневной деятельности (включая бо́льшие затраты времени, уменьшение объема работы, снижение ее качества и т. п.). Низкие показатели по этой шкале интерпретируются как ограничение в выполнении повседневной работы, обусловленное ухудшением эмоционального состояния. 8. Психическое здоровье (MH) характеризует настроение, наличие депрессии, тревоги, общий показатель положительных эмоций. Низкие оценки свидетельствуют о наличии депрессивных, тревожных переживаний, психическом неблагополучии. Все шкалы группируются в два показателя: «физический компонент здоровья» (Physical health — PH) и «психологический компонент здоровья» (Mental Health — MH).
Уровень когнитивной деятельности оценивали по шкале MMSE, в соответствии с которой норме соответствует суммарная оценка 28 баллов и выше, оценка от 25 до 27 баллов указывает на легкое когнитивное расстройство, 24 балла и ниже — на когнитивный дефицит в степени деменции.
В начале терапии тревожный компонент депрессии по HADS составлял в среднем по группе 13,0±4,13 балла, депрессивный компонент — 13,58±3,44 балла, средняя суммарная оценка тревоги и депрессии была 26,05±6,29 балла, а средняя оценка уровня ангедонии (по шкале SHAPS) составляла 8,8±3,12 балла. Уровень когнитивной деятельности большинства больных соответствовал возрастной норме со среднегрупповым показателем по шкале MMSE 26,76±2,30 балла (табл. 2).
Таблица 2. Динамика средних групповых показателей (в баллах) по оценочным шкалам в процессе терапии вальдоксаном
В исследуемой группе установлена высокая отягощенность пациентов сопутствующей хронической соматической патологией. Общее число хронических соматических заболеваний составило в среднем 3,85±1,42 на одного больного. Наиболее часто в изученной когорте больных диагностировались цереброваскулярная (90%) и кардиоваскулярная (50%) патология, а также сахарный диабет (25%).
Статистический анализ результатов проводили с применением программы Statistica 6.0 for Windows с использованием непараметрических методов (парный критерий Вилкоксона). Для описания количественных признаков использовали средние значения и стандартные отклонения. Различия считались достоверными при p
<0,05.
Результаты
Полностью курс терапии вальдоксаном завершили 18 из 20 больных; 2 больных были досрочно исключены из терапевтической программы: в одном случае на 14-й день терапии из-за ухудшения психического состояния пациента (усиление симптомов депрессии с присоединением ипохондрического бреда), в другом случае — также на14-й день терапии в связи с развитием нежелательного явления.
Большинство больных (14 человек — 78%) с 3-й недели терапии получали вальдоксан в дозе 50 мг в сутки, а 4 (22%) больных продолжали лечение в начальной дозе 25 мг в сутки.
Достоверная редукция суммарных показателей тревоги и депрессии по шкале HADS отмечалась уже через 1 нед терапии (см. табл. 2). К этому времени средний суммарный балл по шкале снизился с 26,05 до 22,52 (р
<0,01), средняя степень улучшения составила 13,14%. К 14-му дню терапии средний суммарный балл продолжал снижаться и составил 16,88 (
р
=0,0006), средняя степень улучшения — 34,46%. На 28-й день терапии этот показатель был равен 14,58 балла, средняя степень улучшения — 43,46%. К окончанию терапевтического курса (на 42-й день терапии) средний суммарный балл по шкале HADS снизился до 10,0, а средняя степень улучшения по группе достигла 61,61% (см. табл. 2, рис. 1).
Рис. 1. Динамика среднегрупповых суммарных показателей (в баллах) по шкале HADS в процессе терапии вальдоксаном у пожилых больных с депрессией. Здесь и на рис. 2: различия по сравнению с исходным уровнем: * — p<0,01 (парный критерий Вилкоксона).
Уровень тревожных расстройств, оцениваемый по шкале HADS, в начале терапии был равен 13,0 балла и достоверно снижался на протяжении терапевтического курса вальдоксаном: через 1 нед уровень тревоги был равен 10,17 балла, к 14-му дню терапии — 7,41, к 28-му — 6,70, а к моменту окончания терапии уменьшился до 4,41 балла (см. табл. 2, рис. 1).
Уровень депрессии по шкале HADS перед началом лечения был равен 13,58 балла, он прогрессивно снижался с каждым последующим визитом: к 7-му дню терапии — до 12,23 балла, к 14-му — до 9,41, к 28-му — до 7,88 и к 42-му дню — до 5,58. В целом по группе депрессивный компонент редуцировался на 58,91% по сравнению с исходным уровнем. Как и следовало ожидать, динамика редукции тревожного компонента депрессии несколько опережала редукцию собственно депрессивных расстройств. Эти различия нивелировались к окончанию 1-го месяца терапии (см. табл. 2, рис. 1).
Ангедония считается одним из ведущих проявлений депрессии и нередко рассматривается как ее потенциальный конституциональный маркер. Под ангедонией понимают недовольство неполнотой психических функций, невозможность самовыражения, горечь существования, лишающую больного возможности получать удовольствие и положительные эмоции. Следовательно, эффективное терапевтическое воздействие антидепрессанта на проявления ангедонии можно рассматривать как важную составляющую успешности терапии депрессии. В процессе терапии вальдоксаном положительная динамика в виде редукции ангедонии отмечалась уже на ранних этапах лечения с последующим нарастанием положительного эффекта. По шкале оценки ангедонии SHAPS статистически значимая редукция проявлений ангедонии отмечалась уже через 2 нед лечения. К этому времени ангедония редуцировалась на 31,57% и в дальнейшем продолжала уменьшаться: к 28-му дню — на 52,11% и к окончанию терапии — на 69,29% (см. табл. 2, рис. 2).
Рис. 2. Динамика среднегруппового суммарного показателя ангедонии (в баллах) по шкале SHAPS в процессе терапии вальдоксаном у пожилых больных с депрессией.
После завершения терапии вальдоксаном улучшилось и качество жизни больных. Анализ динамики показателей качества жизни, проводимый с помощью опросника SF-36, показал улучшение всех оцениваемых параметров по сравнению с исходным уровнем. Значимо улучшились показатели как физического, так и психологического компонентов здоровья (табл. 3). В наибольшей степени улучшения касались таких показателей, как жизненная и социальная активность и психическое здоровье (рис. 3).
Таблица 3. Динамика среднегрупповых показателей качества жизни по опроснику SF-36 у больных при терапии вальдоксаном
Рис. 3. Эффективность терапии по показателям качества жизни по опроснику SF-36 больных, леченных вальдоксаном.
Одной из особенностей депрессий в пожилом и старческом возрасте является частое наличие когнитивных расстройств различной степени выраженности. Поэтому выбор препарата, не оказывающего негативного влияния на когнитивное функционирование, представляет одну из важнейших задач гериатрической психофармакотерапии. Изучение влияния вальдоксана на когнитивное функционирование больных, проводимое с использованием теста MMSE, показало не только отсутствие ухудшения, но и некоторое улучшение этого показателя после окончания курсовой терапии. Средний исходный среднегрупповой показатель по шкале MMSE повысился к окончанию лечения c 26,76±3,30 до 28,17±2,0 балла, т. е. улучшился на 5,27% (см. табл. 2). Такой эффект препарата, вероятно, связан с редукцией тревожного компонента и нарушения концентрации внимания, сопряженных с депрессией.
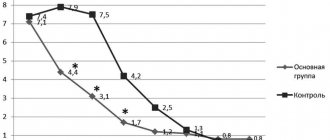
При оценке эффективности терапии вальдоксаном по шкале CGI была отмечена быстрая положительная динамика. Уже к 14-му дню терапии улучшение разной степени выраженности отмечалось у 55% больных, у 35% состояние оставалось без существенной динамики и у 2 (10%) больных состояние ухудшилось (табл. 4). На 28-й день терапии улучшение психического состояния по шкале CGI отмечалось у 88,9% больных, а к окончанию терапии — уже у 94,5% (рис. 4). В целом результаты проведенного анализа переносимости терапии вальдоксаном показали хорошую переносимость терапии. Нежелательные явления, которые имели место у 2 больных, были легкими или умеренными. У 1 больной на 14-й день терапии наблюдалось ухудшение состояния, которое проявлялось утяжелением симптомов депрессии с присоединением бреда ипохондрического содержания, в связи с чем больная была исключена из этой терапевтической программы. Во втором случае ухудшение состояния было связано с развитием нежелательного явления в виде аллергической реакции, что также привело к досрочному прекращению приема препарата.
Таблица 4. Распределение больных с разной степенью изменения состояния по шкале CGI в процессе терапии вальдоксаном по отношению к общему числу больных
Рис. 4. Доля больных с разной степенью изменения показателей шкалы CGI (в % к общему числу больных) в процессе терапии вальдоксаном.
Вальдоксан
Фармакодинамика
Антидепрессант, агонист мелатониновых МТ1- и МТ2-рецепторов и антагонист серотониновых 5-НТ2с-рецепторов.
Агомелатин активен на валидированных моделях депрессии (тест приобретенной беспомощности, тест отчаяния, хронический стресс умеренной выраженности), равно как и на моделях с десинхронизацией циркадных ритмов, а также в экспериментальных ситуациях тревоги и стресса. Показано, что агомелатин не влияет на захват моноаминов и не имеет сродства к α-, β-адренорецепторам, гистаминергическим рецепторам, холинергическим, допаминергическим и бензодиазепиновым рецепторам.
Агомелатин усиливает высвобождение дофамина и норадреналина, в особенности в области префронтальной коры мозга и не влияет на концентрацию внеклеточного серотонина. В экспериментальных исследованиях на животных с десинхронизацией циркадных ритмов было показано, что агомелатин восстанавливает синхронизацию циркадных ритмов посредством стимуляции мелатониновых рецепторов.
Агомелатин способствует восстановлению нормальной структуры сна, снижению температуры тела и выделению мелатонина.
Показана эффективность краткосрочного применения агомелатина (терапия 6-8 недель) в дозах 25-50 мг у пациентов с большими депрессивными эпизодами.
Также показана эффективность применения агомелатина у пациентов с более тяжелыми формами депрессивного расстройства (оценка по шкале Гамильтона ≥25).
Агомелатин был также эффективен при изначально высоких уровнях тревоги, равно как и при сочетании тревожных и депрессивных расстройств.
Подтвержден поддерживающий антидепрессивный эффект агомелатина (при продолжительности исследования 6 мес) в дозе 25-50 мг 1 раз/сут. Результаты исследования подтвердили противорецидивную эффективность агомелатина, которая оценивалась по времени до наступления рецидива заболевания (р=0.0001). Частота развития рецидива в группе пациентов, принимавших агомелатин, составила 22%, в группе плацебо — 47%.
Эффективность агомелатина была продемонстрирована в 6 из 7 клинических исследованиях (преимущество (2 исследования) или сопоставимая эффективность (4 исследования)) в гетерогенных популяциях взрослых пациентов с депрессией по сравнению с селективными ингибиторами обратного захвата серотонина (СИОЗС)/селективными ингибиторами обратного захвата норадреналина (СИОЗСН) (сертралин, эсциталопрам, флуоксетин, венлафаксин или дулоксетин). Антидепрессивный эффект оценивался по шкале Гамильтона (17-пунктовая версия) либо как первичная, либо как вторичная конечная точка.
Агомелатин не оказывает отрицательного воздействия на внимательность и память, у пациентов с депрессией агомелатин в дозе 25 мг увеличивает продолжительность фазы медленного сна без изменения количества и продолжительности фаз быстрого сна. Прием агомелатина в дозе 25 мг также способствует более быстрому наступлению сна со снижением ЧСС и улучшению качества сна (начиная с первой недели лечения); при этом заторможенности в дневное время не отмечается.
На фоне приема агомелатина отмечена тенденция к снижению частоты сексуальной дисфункции (влияние на возбуждение и оргазм).
Прием агомелатина не оказывает влияния на ЧСС и АД, не вызывает сексуальных нарушений, не вызывает синдрома отмены (даже при резком прекращении лечения) и синдрома привыкания.
Эффективность агомелатина в дозе 25-50 мг 1 раз/сут подтверждена у пациентов пожилого возраста (моложе 75 лет) с депрессией в ходе 8-недельного клинического исследования. У пациентов в возрасте 75 лет и старше нет подтвержденных данных о наличии существенного эффекта. Переносимость агомелатина у пациентов пожилого возраста сопоставима с таковой у молодых.
В ходе проведения 3-недельного контролируемого исследования с участием пациентов с большим депрессивным расстройством и недостаточным терапевтическим эффектом от приема пароксетина (СИОЗС) или венлафаксина(СИОЗСН), при переходе с терапии данными антидепрессантами на лечение агомелатином наблюдался синдром отмены. Синдром отмены появлялся как после одномоментного прекращения лечения назначенными ранее СИОЗС/СИОЗСН, так и при их постепенной отмене, что могло быть ошибочно принято за проявление низкой эффективности агомелатина на начальном этапе лечения.
Количество пациентов, у которых через неделю после отмены СИОЗС/СИОЗСН наблюдался хотя бы один симптом, связанный с синдромом отмены, было ниже в группе с длительным снижением дозы (постепенное снижение дозы СИОЗС/СИОЗСН в течение 2 недель), чем в группе с быстрым снижением дозы (постепенное снижение дозы СИОЗС/СИОЗСН в течение 1 недели), и чем при одномоментной отмене: 56.1%, 62.6% и 79.8% пациентов соответственно.
Фармакокинетика
Всасывание
После приема внутрь агомелатин быстро (≥80%) всасывается из ЖКТ. Cmax в плазме достигается через 1-2 ч после приема. Абсолютная биодоступность после приема терапевтической дозы низкая (<5%); межиндивидуальная вариабельность значительная. Биодоступность у женщин выше, чем у мужчин. Биодоступность увеличивается на фоне приема пероральных контрацептивов и снижается на фоне курения.
При назначении препарата в терапевтических дозах Cmax увеличивалась пропорционально дозе. При приеме в более высоких дозах отмечался более выраженный эффект «первого прохождения» через печень. Прием пищи (как обычной, так и с высоким содержанием жиров) не влиял ни на биодоступность, ни на степень всасывания. На фоне приема пищи с высоким содержанием жиров межиндивидуальная вариабельность показателей увеличивалась.
Распределение
Vd в равновесном состоянии составлял порядка 35 л. Связывание с белками плазмы — 95% независимо от концентрации препарата, возраста или наличия почечной недостаточности.
При печеночной недостаточности отмечалось двукратное увеличение свободной фракции препарата.
Метаболизм
После приема внутрь агомелатин подвергается быстрому окислению, в основном за счет CYP1A2 и CYP2C9. Изофермент CYP2C19 также участвует в метаболизме агомелатина, однако его роль менее значима.
Основные метаболиты в виде гидроксилированного и деметилированного агомелатина неактивны, быстро связываются и выводятся почками.
Выведение
T1/2 из плазмы составляет от 1 до 2 ч. Выведение происходит быстро. Метаболический клиренс составляет порядка 1100 мл/мин. Выведение происходит в основном почками (80%) в виде метаболитов. Количество неизмененного препарата в моче незначительно. При неоднократном назначении препарата кинетика не меняется.
Фармакокинетика в особых клинических случаях
У пациентов с почечной недостаточностью тяжелой степени при однократном приеме агомелатина в дозе 25 мг фармакокинетические параметры значимо не изменялись. Из-за ограниченного клинического опыта следует соблюдать осторожность при назначении агомелатина пациентам с умеренной и выраженной почечной недостаточностью.
При назначении агомелатина в дозе 25 мг пациентам со слабо выраженной (класс А по шкале Чайлд-Пью) и умеренной (класс В по шкале Чайлд-Пью) хронической печеночной недостаточностью на фоне цирроза печени было отмечено увеличение его концентрации в плазме в 70 и 140 раз, соответственно, по сравнению с добровольцами, сопоставимыми по полу, возрасту и отношению к курению, но без печеночной недостаточности.
При назначении агомелатина в дозе 25 мг пациентам пожилого возраста (65 лет и старше) было отмечено, что средняя AUC и средняя Cmax были в 4 раза и в 13 раз, соответственно, выше у пациентов в возрасте 75 лет и старше по сравнению с пациентами моложе 75 лет. Общее число пациентов, получавших препарат в дозе 50 мг, было слишком низким, чтобы делать какие-либо выводы. Коррекции дозы в зависимости от возраста не требуется.
Отсутствуют данные о расовых различиях фармакокинетических параметров.