Повидон Йод (Povidon Jod)
Форма выпуска, состав и упаковка
Раствор для наружного применения 10% в виде жидкости темно-коричневого цвета с характерным запахом йода. 100 мл повидон-йод 10 г. Вспомогательные вещества: ноноксинол, глицерол, динатрия гидрофосфат 12-гидрат, лимонная кислота, натрия гидроксид, вода деминерализованная.
Раствор для наружного применения пенообразующий 7.5% в виде жидкости темно-коричневого цвета с характерным запахом йода; при взбалтывании пенится. 100 мл повидон-йод 7.5 г. Вспомогательные вещества: диэтаноламид лауриновой кислоты, аммония нонилфенилэтоксилат сульфоновой кислоты, натрия фосфат 12-гидрат, лимонная кислота, вода деминерализованная.
Раствор для местного применения концентрированный 8.5% 1 мл повидон-йод 85 мг Мазь для наружного применения 10% темно-коричневого цвета, гомогенная, с характерным запахом йода. 100 г повидон-йод 10 г Вспомогательные вещества: макрогол 4000, вода очищенная. Суппозитории вагинальные 1 супп. повидон-йод 200 мг Клинико-фармакологическая группа: Антисептик для наружного и местного применения.
Фармакологическое действие
Антисептический и дезинфицирующий препарат. Высвобождаясь из комплекса с поливинилпирролидоном при контакте с кожей и слизистыми оболочками, йод образует с белками клетки бактерий йодамины, коагулирует их и вызывает гибель микроорганизмов. Оказывает быстрое бактерицидное действие на грамположительные и грамотрицательные бактерии (за исключением Mycobacterium tuberculosis). Активен также в отношении грибов, вирусов, простейших. Обладает более продолжительным действием по сравнению с раствором неорганического йода.
Фармакокинетика
При наружном применении реабсорбция йода с поверхности кожи или слизистой оболочки или ран крайне незначительная.
Показания
Раствор для наружного применения 10%
- лечение и профилактика раневых инфекций в хирургии, травматологии, комбустиологии, стоматологии;
- лечение бактериальных, грибковых и вирусных инфекций кожи, профилактика суперинфекции в дерматологической практике;
- обработка пролежней, трофических язв, диабетической стопы;
- дезинфекция кожи и слизистых оболочек пациентов при подготовке к оперативным вмешательствам, инвазивным исследованиям (в т.ч. пункции, биопсия, инъекции);
- дезинфекция кожи вокруг дренажей, катетеров, зондов;
- дезинфекция полости рта при стоматологических операциях;
- дезинфекция родовых путей, при проведении малых гинекологических операций (в т.ч. искусственное прерывание беременности, введение внутриматочной спирали, коагуляция эрозии и полипа).
Раствор для наружного применения пенообразующий 7.5%
- дезинфицирующие ванны — для полной и частичной обработки пациента перед операциями;
- гигиеническая обработка пациентов;
- гигиеническая обработка рук при контакте с инфицированными пациентами;
- обработка инструмента (не металлического) и предметов ухода за больными.
Раствор для местного применения концентрированный 8.5%
- для полоскания рта и горла.
Мазь для наружного применения 10%
- бактериальные и грибковые инфекции кожи;
- ожоги;
- трофические язвы;
- пролежни;
- инфекционные дерматиты;
- ссадины;
- раны.
Суппозитории вагинальные
- кандидоз;
- трихомониаз;
- неспецифический вагинит.
Режим дозирования
Раствор для наружного применения 10% Для обработки кожи и слизистых оболочек применяют в неразбавленном виде для смазывания, промывания или в виде влажного компресса. Для применения в дренажных системах раствор разбавляют от 10 до 100 раз.
Раствор для наружного применения пенообразующий 7.5% Для дезинфекции рук хирургического персонала 5 мл неразбавленного раствора наносят на предварительно вымытые руки и равномерно распределяют его до локтей, растирая в течение 2.5 мин ладонями или щеткой до образования пены (пену смывают стерильной водой или удаляют стерильной салфеткой); затем обработку повторяют.
Для дезинфекции кожи операционного поля на выбритую и увлажненную водой кожу наносят препарат и втирают для образования пены. 1 мл препарата достаточно для нанесения на поверхность кожи 50-70 см2 путем втирания в течение 5 мин. Пену удаляют с помощью стерильной марлевой салфетки, пропитанной водой, после этого кожу смазывают неразведенным раствором и просушивают.
Раствор для местного применения концентрированный 8.5% Для полоскания рта и горла 1 чайную ложку раствора разводят в 1/4 стакана воды. Полоскание проводят несколько раз/сут. Мазь для наружного применения 10% Мазь наносят тонким слоем на пораженный участок 2-3 раза/сут, можно применять под окклюзионную повязку.
Суппозитории вагинальные
Назначают по 1-2 шт./сут. Длительность лечения — 14 сут или по указанию врача. Перед применением суппозиториев вагинальных необходима санобработка.
Побочное действие
Возможно: аллергические реакции. Местные реакции: в отдельных случаях аллергические реакции на йод — гиперемия, жжение, зуд, отек, боль (требуется отмена препарата). Системные реакции: при применении на большой площади раневой поверхности и слизистых оболочках возможна системная реабсорбция йода, что может вызвать нейтропению, а также изменить результаты тестов функциональной активности щитовидной железы; при длительном применении (более 7-10 дней) возможны явления йодизма (в т.ч. металлический привкус во рту, повышенное слюноотделение, отеки век или гортани).
Противопоказания
- гипертиреоз;
- аденома щитовидной железы;
- сердечная недостаточность;
- хроническая почечная недостаточность;
- герпетиформный дерматит Дюринга;
- одновременное применение радиоактивного йода;
- недоношенные и новорожденные дети;
- детский возраст до 8 лет (мазь для наружного применения);
- беременность;
- лактация;
- повышенная чувствительность к йоду и другим компонентам препарата.
Беременность и лактация
Препарат противопоказан к применению при беременности и в период лактации (грудного вскармливания).
Применение при нарушениях функции почек
Противопоказан при хронической почечной недостаточности.
Особые указания
При развитии побочных эффектов требуется отмена препарата. Присутствие крови и гноя может уменьшить противомикробное действие препарата. Не применять при укусах насекомых, домашних и диких животных. Следует предупредить пациента о необходимости консультации врача при появлении системных реакций. Необходимо следить, чтобы под больным не оставался излишек раствора. В месте применения образуется окрашенная пленка, сохраняющаяся до высвобождения всего количества активного йода, т.е. ее исчезновение означает прекращение действия препарата. Окраска на коже и тканях легко смывается водой. Не нагревать перед употреблением.
Передозировка
Симптомы: местное раздражение, аллергические реакции. Лечение: сокращение частоты применения или полный отказ от применения препарата.
Лекарственное взаимодействие
Повидон йод несовместим с другими дезинфицирующими и антисептическими средствами, особенно содержащими щелочи, ферменты и ртуть. В кислой среде активность препарата понижается.
Условия и сроки хранения
Список Б. Растворы следует хранить в защищенном от света месте, плотно закрытыми, при температуре от 0° до 25°C. Мазь следует хранить в оригинальной упаковке при температуре от 0° до 25°C. Срок годности препарата в форме раствора для наружного применения 10%, мази для наружного применения 10% и суппозиториев вагинальных — 3 года. Срок годности раствора для наружного применения пенообразующего 7.5% и раствора для местного применения концентрированного 8.5% — 2 года.
Повидон-йод раствор для местного и наружного применения 10%, 120мл (Южфарм)
Владелец регистрационного удостоверения
ЮЖФАРМ (Россия)
Лекарственная форма
Лекарственный препарат — Повидон-Йод (Povidone-Iodine)
Описание
Раствор для местного и наружного применения
темно-коричневого цвета, с характерным запахом йода.
100 мл
повидон-йод 10 г
Вспомогательные вещества
: глицерол — 1.275 г, ноноксинол 9 — 0.312 г, натрия гидрофосфата додекагидрат — 0.32 г, лимонной кислоты моногидрат — 0.1 г, натрия гидроксид — 0.117 г, вода очищенная — до 100 мл.
10 мл — флаконы (1) — пачки картонные. 15 мл — флаконы (1) — пачки картонные. 30 мл — флаконы (1) — пачки картонные. 50 мл — флаконы (1) — пачки картонные. 100 мл — флаконы (1) — пачки картонные. 120 мл — флаконы (1) — пачки картонные. 250 мл — флаконы (1) — пачки картонные. 400 мл — флаконы (1) — пачки картонные. 450 мл — флаконы (1) — пачки картонные. 500 мл — флаконы (1) — пачки картонные. 1000 мл — флаконы (1) — пачки картонные. 100 мл — флаконы от 4 до 50 шт. — коробки картонные (для стационаров). 120 мл — флаконы от 4 до 50 шт. — коробки картонные (для стационаров). 250 мл — флаконы от 4 до 50 шт. — коробки картонные (для стационаров). 400 мл — флаконы от 4 до 50 шт. — коробки картонные (для стационаров). 450 мл — флаконы от 4 до 50 шт. — коробки картонные (для стационаров). 500 мл — флаконы от 4 до 50 шт. — коробки картонные (для стационаров). 1000 мл — флаконы от 4 до 50 шт. — коробки картонные (для стационаров).
Показания
Для обработки кожи пациента до и после проведения операций, исследований (биопсия, пункция, взятие крови, инъекции и т.д.), до- и послеоперационной обработки рук хирургов, медицинского персонала, гигиеническая обработка рук при уходе за инфицированными больными, обработка инструмента и предметов ухода за больными.
Для местного применения: инфекции носоглотки, лечение инфицированных поражений кожи (ожоги, раны, язвы, ссадины), профилактика инфицирования раневых поверхностей, лечение неспецифических вагинитов, трихомониаз.
Противопоказания к применению
Гипертиреоз, аденома щитовидной железы, почечная недостаточность, беременность, период лактации (грудное вскармливание), повышенная чувствительность к йоду. Нельзя использовать для обработки кожных покровов у недоношенных и новорожденных детей.
Фармакологическое действие
Антисептическое средство. Представляет собой йод в форме комплекса поливинилпирролидон йода. Концентрация активного йода от 0.1% до 1%. Обладает широким спектром противомикробного действия. Активен в отношении бактерий (в т.ч. микобактерии туберкулеза), грибов, вирусов, простейших. Поливинилпирролидон йод относится к йодофорам, которые связывают йод. При контакте с кожей и слизистыми оболочками йод постепенно и равномерно высвобождается, оказывая бактерицидное действие на микроорганизмы. На месте применения препаратов повидона-йода остается тонкий окрашенный слой, который сохраняется до тех пор, пока не освободится все количество йода, после этого его действие прекращается.
Лекарственное взаимодействие
Фармацевтически несовместим с дезинфицирующими средствами, содержащими ртуть; окислителями, солями щелочей и веществами с кислой реакцией.
Режим дозирования
Индивидуальный, в зависимости от показаний и применяемой лекарственной формы.
Побочное действие
Возможно местное проявление повышенной чувствительности к йоду (зуд, гиперемия), что требует отмены лечения.
Особые указания
Раствор повидона-йода не применять в комплексе с другими антисептическими средствами, энзиматическими мазями. Перед систематическим применением препаратов повидона-йода целесообразно пробное использование. В присутствии крови бактерицидное действие повидона-йода может уменьшиться. Следует избегать попадания препаратов повидона-йода в глаза.
Применение при беременности и кормлении грудью
Ограничения при беременности — Противопоказано. Ограничения при кормлении грудью — Противопоказано.
Противопоказан при беременности, в период лактации.
Применение при нарушениях функции почек
Ограничения при нарушениях функции почек — Противопоказано.
Противопоказан при почечной недостаточности.
Применение у детей
Ограничения для детей — Противопоказано.
Нельзя использовать для обработки кожных покровов у недоношенных и новорожденных детей.
Влияние повидон-йода на эрадикацию высокоонкогенных типов ВПЧ у женщин с поражением шейки матки
Актуальность
За последнее десятилетие достигнуты значительные успехи в понимании роли вируса папилломы человека (ВПЧ) в развитии рака шейки матки (РШМ) и других аногенитальных раков. ВПЧ является основным этиологическим агентом дисплазии шейки матки и карциномы [1]. РШМ — третий по распространенности гинекологический рак в развитых странах. В России число смертей от РШМ увеличилось на 3500 женщин в год. Приблизительно половину пациенток с РШМ составляют женщины репродуктивного возраста (моложе 50 лет) [2]. В последнее время по этой причине ежегодно умирают более 200 женщин в возрасте 20–39 лет. ВПЧ является распространенным вирусом, который передается горизонтально через гетеросексуальный контакт. Примерно 80% всех женщин инфицированы ВПЧ в какой-то момент их жизни, но при этом у порядка 90% папилломавирусная инфекция (ПВИ) спонтанно регрессирует в течение нескольких лет. При отсутствии самостоятельной элиминации может развиваться РШМ. Практически 100% плоскоклеточных интраэпителиальных поражений и РШМ, порядка 43% опухолей вульвы и 70% опухолей влагалища связаны с ПВИ, ежегодно вызывающей 530 тыс. новых случаев РШМ и 21 тыс. случаев рака вульвы и влагалища во всем мире [3]. При отсутствии скрининговой стратегии наблюдается рост заболеваемости РШМ и раком вульвы у молодых женщин [4]. ВПЧ представляет собой двуцепочечный ДНК-вирус, принадлежащий к роду Papilloma
в семействе
Papovaviridae
[5]. Установлено, что ВПЧ — наиболее частая сексуально-трансмиссионная инфекция, являющаяся основной причиной цервикальных плоскоклеточных интраэпителиальных поражений и инвазивного РШМ. Выделяют более 100 типов, инфицирующих эпителий полового тракта. Передача ВПЧ происходит в первую очередь путем контакта кожи с кожей и, вероятно, при нарушении целостности эпидермиса, при этом вирус может инфицировать базальные клетки плоского эпителия [6].
Типы ВПЧ и их роль в развитии онкологических процессов
На сегодняшний день в женском репродуктивном тракте идентифицировано более 100 генотипов ВПЧ. 13 типов ВПЧ (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 и 68) признаны высокоонкогенными (13HR), вызывающими рак. Тем не менее другие типы ВПЧ также могут быть связаны с развитием рака. По данным N. Munoz, два дополнительных типа ВПЧ — 73 и 82 — следует считать канцерогенными. G. Halec et al. на основании систематического обзора продемонстрировали, что 26, 53, 66, 67, 68, 70, 73 и 82 типы ВПЧ могут быть онкогенными [7]. Одна из наиболее важных проблем заключается в том, что диагностика на основе полимеразной цепной реакции (ПЦР), используемая в эпидемиологических исследованиях, имеет ограничения. Во-первых, метод ПЦР обнаруживает не только высокоонкогенные, но и другие типы ВПЧ. Во-вторых, некоторые ПЦР-тесты с использованием консенсусных праймеров показали несогласованные результаты в определении типов ВПЧ, т. к. чувствительность детекции у некоторых типов ВПЧ ниже, чем у других. Типы ВПЧ с низким риском, такие как 6, 11, 40, 42, 43, 44 и 54, связаны с генитальными бородавками и аногенитальными поражениями низкого уровня риска [8]. ВПЧ 16 и 18 типов с высоким риском вместе составляют порядка 70% случаев РШМ, в то время как ВПЧ 6 и 11 типов с низким риском ответственны за 90% генитальных бородавок [9]. Иммунная система играет важную роль в контроле развития рака. Геном ВПЧ кодирует два онкопротеина — Е6 и Е7, способные инактивировать белки р53, и ретинобластомы (pRB) — регуляторы пролиферативной активности клеток. Они необходимы для возникновения и поддержания злокачественного клеточного фенотипа [10]. Адаптивный иммунный ответ защищает от ВПЧ-индуцированных заболеваний [11]. Прогрессирование заболеваний, вызванных ВПЧ, связано с отсутствием сильного ВПЧ-специфического ответа CD4+ и CD8+ Т-клеток. Химиотерапия или лучевая терапия влияет на иммунную регуляторную активность и в сочетании с вакцинацией потенцирует эффективный локальный ВПЧ-специфический Т-клеточный иммунитет в опухолевых моделях мышей. Успешное лечение ВПЧ-индуцированных поражений может быть достигнуто с помощью низкодозированного циклофосфамида, изменяющего местный иммунитет. С учетом важности локального микроокружения в персистенции ВПЧ-индуцированных поражений и опухолей эффективными могут быть методы лечения, способные на местном уровне сместить баланс иммуноэффекторов, таких как ингибиторы циклооксигеназы-2, за счет продукции простагландина Е2 и трансформирующего фактора роста β [12]. В карциноме вульвы выделяют два отдельных канцерогенных пути, один из которых связан с ВПЧ 16 типа. Это четвертый по распространенности инвазивный гинекологический рак, который поражает в основном пожилых женщин и чаще встречается в западных странах [13]. Прогностические факторы течения заболевания включают наличие или отсутствие метастазов в лимфатических узлах, а также размер опухоли и ее рецидивы. Рецидив (гематогенные метастазы) отмечается у 40% пациенток. Прогностическая роль ВПЧ при раке вульвы обсуждается, некоторые исследования показали лучшую выживаемость женщин с ВПЧ-положительными опухолями вульвы, другие — нет [14]. Важным вопросом остается организация скрининговых программ. Такие программы эффективно проводятся в Новой Зеландии. В национальных рекомендациях по программе скрининга РШМ принято всем женщинам в возрасте от 20 до 69 лет, которые когда-либо имели половой акт, назначать цитологический мазок шейки матки в течение 3 лет. Если это первичный скрининговый мазок или с момента предыдущего исследования прошло более 5 лет, рекомендуется второй мазок повторить через год после первого, а затем через 3 года. После введения данной скрининговой программы значительно снизилась заболеваемость РШМ, составляющая в настоящее время 5,4 на 100 тыс. женщин [15]. Помимо этого, в Новой Зеландии было выполнено масштабное исследование по распределению генотипов ВПЧ в образцах шейки матки. Материал был собран у женщин, имеющих высокоонкогенные типы ВПЧ (в 2009–2011 гг.) или страдающих инвазивным РШМ (в 2004–2010 гг.). Наиболее распространенными типами ВПЧ, вызывающими неоплазии шейки матки (цервикальная интраэпителиальная неоплазия — CIN 2 и 3), были типы ВПЧ 16 (51%), 52 (19%), 31 (17%), 33 (13%) и 18 (12%). При этом наблюдалась тенденция к увеличению показателей инфицирования ВПЧ типов 16 и 18 по сравнению с другими генотипами ВПЧ у женщин в возрасте 20–29 лет. Наиболее распространенными генотипами ВПЧ, связанными с инвазивным РШМ, явились ВПЧ 16 (51%), 18 (21%), 31 (4%), 45 (3%) и 52 (3%) [16]. В 2008 г. в Новой Зеландии была внедрена Национальная программа иммунизации женщин четырехвалентной вакциной против ВПЧ (генотипы 6, 11, 16, 18). Позже, в 2013–2016 гг., выполнено исследование, показавшее снижение доли цервикальной интраэпителиальной неоплазии (CIN 2), связанной с HPV 16/18, в когорте молодых новозеландских женщин, что может быть связано с внедрением национальной программы вакцинации против ВПЧ. Это исследование имело важное значение, поскольку это первые документированные данные об изменении генотипа ВПЧ у женщин с поражениями шейки матки после начала программы вакцинации [17]. ВПЧ 16 типа является наиболее распространенным во всем мире генотипом, выявленным у пациенток с инвазивным РШМ, за ним следует ВПЧ 18 типа. Восемь генотипов ВПЧ (16, 18, 31, 33, 35, 45, 52 и 58) приводят к более высоким уровням прогрессирования РШМ [18]. В клинических рекомендациях Японского общества акушерства и гинекологии и Японской ассоциации акушеров и гинекологов представлен алгоритм ведения пациенток с CIN, который включает генотипирование ВПЧ для определения степени риска прогрессирования в CIN 3 [19]. Однако связь между генотипом ВПЧ и прогнозом развития ракового процесса остается спорной. Одни исследования показали, что ВПЧ 18-позитивные опухоли связаны с плохим прогнозом [20]. Другие авторы утверждают, что китайские и британские пациентки с опухолями, ассоциированными с ВПЧ 16 и/или 18 типа, имеют лучшую выживаемость, в то время как в Тайване получены благоприятные результаты для ВПЧ 58- и 31-положительных опухолей [21]. Напротив, иные ученые не обнаружили ассоциаций между генотипом ВПЧ и прогнозом РШМ в популяциях русских и корейцев [22]. Цитологическое исследование шейки матки, выполненное в трех медицинских учреждениях Японии, продемонстрировало, что ВПЧ 18-положительные опухоли были связаны с плохой выживаемостью женщин. Более длительное наблюдение (102 мес.) подтвердило, что ВПЧ 16-положительные опухоли коррелируют с лучшей выживаемостью по сравнению с ВПЧ 18-положительными опухолями. Эти противоречивые результаты могут быть частично обусловлены географическими различиями в распространенности типа ВПЧ [23].
Факторы, повышающие восприимчивость к ВПЧ
Микробы считаются основным триггерным фактором развития злокачественных новообразований. По данным проекта Human Microbiome (HMP) определено, что 20% всех смертельных злокачественных опухолей являются микробиологически индуцированными. Эктоцервикс колонизирован микробами, тогда как эндоцервикс и верхний генитальный тракт считаются практически стерильными у здоровых женщин. Изменения цервико-вагинального микробиома и такие процессы, как бактериальный вагиноз, воспаление шейки матки и повышение вагинального рН, влияют на восприимчивость к цервикальному ВПЧ. Женщины в разных этнических группах отличаются микробиомом влагалища [24]. Большинство цервико-вагинальных инфекций и вагинального дискомфорта обусловлены Gardnerellavaginalis
или
Atopobiumvaginae
[25], а также Candida albicans [26]. Цервикальный эпителий становится уязвимым под влиянием инфекционных микробных агентов для таких инфекций, как ВПЧ [27]. С развитием современных методик секвенирования становится понятным, что микробиом влияет на восприимчивость к раку из-за производства вредных метаболитов и их влияния на клеточную функцию, поскольку дерегулированный метаболизм и воспаление являются признаками рака [28]. Связь специфических микробов (прокариотических и эукариотических) с ВПЧ-инфекциями и цервикальной неоплазией остается одним из значимых вопросов в исследованиях. Известно, что в микробиноме здоровых женщин доминируют
Lactobacilli
. Этот константный вагинальный вид производит молочную кислоту в виде ферментации продуктов, что приводит к снижению вагинального рН до 3,5–4,5, создавая химический барьер для патогенов [29]. Высокий уровень
L. iners
связан с риском развития ВПЧ-ассоциированных цервикальных поражений. Повышение индекса массы тела коррелирует с увеличением численности
L. iners
, что делает ожирение значимым фактором развития CIN [30]. L. iners более приспособлены к изменению pH и разнообразным метаболическим состояниям, чем другие лактобациллы. Высокая обсемененность шейки матки
L. kitasatonis
и
L. crispatus
в сочетании с высокоонкогенными типами ВПЧ повышает риск развития CIN 3. Разнообразие флоры коррелирует с тяжестью CIN. Обнаружение
Sneathia sanguinegens, Anaerococcus tetradius
и
Peptostreptococcus anaerobius
у кавказских, азиатских и чернокожих женщин в микробиоме влагалища часто сочетается с развитием CIN.
P. мicros
— необычный таксон, часто встречающийся в ротовой полости, обнаруженный в слюнном микробиоме и распространенный при наличии цервикальных поражений. Выдвинуто предположение, что P. мicros может проникать в цервико-вагинальный тракт в результате орального секса [31]. Обнаружена прямая связь ВПЧ с доминированием трех грибов родов
Candida
,
Malassezia
и
Sporidiobolaceae. Malassezia
— липофильные, паразитирующие в верхних слоях кожи человека грибы, вызывающие поверхностные грибковые инфекции, такие как атопический дерматит и псориаз.
Malassezia
часто обнаруживается у мужчин на крайней плоти и головке полового члена. Malassezia производят биоактивные индолизины, включая активаторы арильного углеводородного рецептора (AhR). Рецепторы AhR опосредуют многие функции кожи, включая ускорение деления клеток, поэтому было высказано предположение, что Malasseziа могут участвовать в кожном канцерогенезе. Проведенное недавно исследование выявило, что определенная структура микробиома цервико-вагинального тракта коррелирует как с высокоонкогенными типами ПВИ, так и с CIN-тяжестью в популяции женщин репродуктивного возраста. Поэтому поиск особенностей микробиома цервико-генитальной системы может быть важным шагом в понимании биологии цервикальной неоплазии и разработке новых терапевтических схем, нацеленных на микробиоту [32].
Лечение диспластических изменений шейки матки
Поскольку CIN затрагивает в основном женщин репродуктивного возраста, имеется необходимость раннего выявления и улучшения стратегий лечения наиболее клинически значимых CIN. Персистирующая инфекция высокоонкогенными типами ВПЧ является необходимым условием прогрессирования патологии шейки матки. Первичная (вакцинация) и вторичная профилактика (скрининг шейки матки) может оказать решающее влияние на профилактику рака [32]. Поиск препаратов, направленных на лечение диспластических изменений шейки матки, — важное направление гинекологии. Йод — это антисептик, который используется в лечебной практике более 150 лет. Повидон-йод
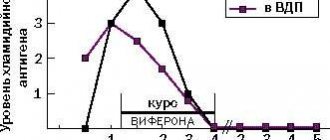
— одно из самых мощных и эффективных йодсодержащих антисептических средств широкого спектра действия. Главное отличие этого препарата в том, что на фоне его приема не возникает резистентности микроорганизмов, он реже, чем антибиотиксодержащие препараты, вызывает аллергическую реакцию. Антисептическое действие повидон-йода связано с сильным окислительным эффектом. Под действием повидон-йода происходит образование пор в мембранах клеток микроорганизмов, что приводит к нарушению целостности клеточной оболочки, повреждению клетки и утрате ею жизнеспособности. Препарат имеет несколько преимуществ перед другими антисептиками. Во-первых, он эффективнее купирует размножение микроорганизмов даже в большом разведении. Во-вторых, у повидон-йода самый широкий противовирусный спектр действия, включающий энтеровирусы, вирусы полиомиелита и герпеса, а также аденовирусы и вирус гриппа. Повидон-йод — устойчивый препарат, его эффективность не изменяется под действием физико-химических условий в очаге воспаления, обусловленных изменением рН, белками, кровью, действием ферментов. В гинекологической практике он чаще всего используется для лечения воспалительных процессов и профилактики развития осложнений после инвазивных вмешательств [33]. Было продемонстрировано, что препарат индуцирует гибель эпителиальных клеток HeLa у крыс. Дополнительные данные, подтверждающие сильное противоопухолевое действие молекулы йода и иодолактонов, были установлены с помощью исследований клеточной культуры. Они выявили значительное снижение клеточного роста при раке молочной железы. Снижение пролиферации под действием молекул йода отмечено и в других злокачественных клеточных линиях человека (нейробластома, глиома, меланома, карциномы легких, толстой кишки и поджелудочной железы) [34]. Сравнительный анализ антипролиферативной/цитотоксической способности I2, йодида калия (KI), комбинированного раствора KI+I2, повидон-йода и I2+ [KI+глицерол] на клетках карциномы человека показал, что повидон-йод может быть потенциальным инструментом для непосредственного вмешательства в рост опухолевых клеток [35]. Рандомизированное исследование, проведенное в США, выявило, что у всех 88 обследуемых пациенток в возрасте 23–67 лет (в среднем 34,8 года) с аномальной цитологией и наличием высокоонкогенного типа ВПЧ после проведения 2 курсов криотерапии шейки матки и локального лечения повидон-йодом через 6 мес. после терапии ВПЧ не был обнаружен [36]. Исследования показали, что применение препарата
Бетадин
® после обработки кондилом раствором для наружного применения с местно-некротизирующим действием повышает эффективность лечения, снижает частоту присоединения бактериальной инфекции и рецидивирования ПВИ слизистой влагалища и шейки матки. В связи с вышеизложенным очевидна целесообразность комплексного лечения патологии шейки матки, включающего повидон-йод [37].
Заключение
Понимание особенностей персистенции ПВИ в эпителии шейки матки и связанного с ней процесса развития заболеваний данной области определяет тактику терапии повреждений шейки матки, ассоциированных с ВПЧ. Методов лечения ВПЧ гениталий много, однако частота рецидивов этого заболевания высока. Поэтому весьма перспективным направлением является разработка комплексной терапии с целью профилактики рецидивирования ВПЧ-ассоциированных заболеваний шейки матки. Применение повидон- йода (например, препарата Бетадин®) в комплексной терапии ПВИ повышает эффективность лечения, снижает частоту бактериальной инфекции, а также частоту рецидивирования ПВИ слизистой влагалища и шейки матки. Сведения об авторах:1Дубровина Светлана Олеговна — д.м.н., профессор, главный научный сотрудник Научно-исследовательского института акушерства и педиатрии; 2Красильникова Лилия Викторовна — к.м.н., акушер-гинеколог;1Ардинцева Оксана Александровна — аспирант;3Варичева Марианна Владимировна — акушер-гинеколог; 4Циркунова Нина Сергеевна — акушер-гинеколог, заведующая гинекологическим отделением;1Африкян Олег Артурович — студент 6 курса;1Афанасова Пелагея Николаевна — студентка 6 курса;5Гаджибекова Наина Балабековна — акушер-гинеколог.1ФГБОУ ВО РостГМУ Минздрава России. 344022, Россия, г. Ростов-на-Дону, пер. Нахичеванский, д. 29.2ООО «ДАВИНЧИ ГРУПП». 344091, Россия, г. Ростов-на-Дону, ул. Толмачева, д. 117.3МБУЗ «Городская больница № 20 г. Ростова-на-Дону». 344091, Россия, г. Ростов-на-Дону, пр. Коммунистический, д. 39.4МБУЗ «Городская больница № 6 г. Ростова-на-Дону». 344025, Россия, г. Ростов-на-Дону, ул. Сарьяна, д. 85/38.5МБУЗ «ГБСМП». 347930, Россия, Ростовская область, г. Таганрог, Большой просп., д. 16.Контактная информация:Ардинцева Оксана Александровна, e-mail:[email protected].Прозрачность финансовойдеятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах и методах.Конфликт интересовотсутствует.Статья поступила26.11.2018. About the authors:1Svetlana O. Dubrovina — MD, PhD, Professor, Principal Researcher of the Scientific Research Institute of Obstetrics and Pediatrics;2Liliya V. Krasilnikova — MD, PhD, obstetrician-gynecologist;1Oxana А. Ardintseva — graduate student;3Marianna V. Varicheva — obstetrician-gynecologist;4Nina S. Tsirkunova — obstetrician-gynecologist, Head of the Department of Gynecology;1Oleg A. Afrikyan — 6th year student;1Pelageya N. Afanasova — 6th year student;5Naina B. Gadzhibekova — obstetrician-gynecologist.1Rostov State Medical University. 29, per. Nakhichevanskiy, Rostov-on-Don, 344022, Russian Federation.2LLC «DAVINCI GROUP». 117, Tolmacheva sr., Rostov-on-Don, 344091, Russian Federation. 3Rostov-on-Don City Hospital No. 20. 39, Kommunisticheskiy pass., Rostov-on-Don, 344091, Russian Federation.4Rostov-on-Don City Hospital No. 6. 85/38, Saryana str., Rostov-on-Don, 344025, Russian Federation.5City Emergency Hospital. 16, Bolshoy prosp., Taganrog, Rostov region, 347930, Russian Federation.Contact information:Oxana А. Ardintseva, e-mail:[email protected].Financial Disclosure:no author has a financial or property interest in any material or method mentioned.Received26.11.2018.





![Таблица 2. Сравнение противовирусного действия некоторых антисептиков [R. Kawana и соавт., 1998]](https://laram-halal.ru/wp-content/uploads/tablica-2-sravnenie-protivovirusnogo-dejstviya-nekotoryh-antiseptikov-r-kawana-i-330x140.jpg)