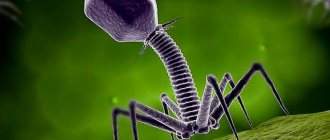
Фармакологическое действие
Средство нормализует работу функций пищеварительной системы. Жидкий Интести-бактериофаг оказывает специфическое антибактериальное воздействие по отношению к ряду штаммов бактерий. В процессе воздействия Интести-бактериофаг лизирует специфически эти бактерии, закрепляясь на их мембранах. Далее он проникает внутрь клетки, после чего размножается, используя энергетический ресурс клетки бактерии. После того, как клетка гибнет, происходит выход зрелых фагочастиц, которые могут заражать другие клетки штаммов.
Препарат строго специфичен по отношению к гомологичным бактериям, поэтому нормальная микрофлора не подавляется и на клетки организма вредного воздействия не оказывается. Интести-бактериофаг стимулирует иммунитет человека, эффективно улучшает состояние при гнойно-септических болезнях, которые сопровождаются иммунодепрессивными состояниями. Перед тем, как начинать лечение, следует определить фагочувствительность возбудителя.
В настоящее время антибиотики широко используются как для лечения, так и для профилактики различных заболеваний. Однако частота и тяжесть течения гнойно-септических инфекций не имеют тенденции к снижению. Одной из причин этого является возрастание этиологической роли микроорганизмов, резистентных к большинству антибиотиков [18, 37]. Применение антибиотиков сопровождается нарушением состава нормальной микрофлоры, аллергизацией и быстрой адаптацией микроорганизмов к окружающей среде.
Согласно последним результатам исследований ВОЗ, большинство известных человечеству микроорганизмов через 10–20 лет приобретет устойчивость к антибиотикам [13], что обусловлено рядом причин:
- постоянное, безосновательное использование антибиотиков при самолечении, а также в тех случаях, когда они не эффективны (при острых респираторных вирусных инфекциях, кашле, гриппе, повышенной температуре и диарее);
- тотальное использование антибиотиков в сельском хозяйстве для предупреждения развития заболеваний, способных передаваться человеку через продукты питания;
- неполный, неадекватный курс лечения антибиотиком [3, 24, 31, 48].
В связи с этим большой проблемой в лечении гнойно-септических инфекций является адекватный подбор антибактериальных препаратов [2, 6, 17, 25, 39, 50]. Хорошие перспективы в качестве антимикробной терапии имеют бактериофаги, широко применявшиеся в “доантибиотическую эру” для лечения кишечных и гнойных инфекций [1, 9, 11, 20, 34, 43].
Со времени первого упоминания о фагах, еще до их официального открытия д Эрелем в 1917 г., прошло уже более 100 лет. В 1896 г. Ханкин, пытаясь объяснить сильное антибактериальное действие вод рек Ганги и Джумны в Индии, впервые описал агент, который проходит через бактериальные фильтры и вызывает лизис микробов, однако разрушается при кипении. Впоследствии д Эрель дал ему имя “бактериофаг” (пожиратель бактерий). Первый известный науке отчет об успешной фаготерапии был сделан в 1921 г. Брийонгом и Майсином, которые использовали стафилококковый бактериофаг для лечения заразных болезней кожи. В 1920-е гг. фаги активно использовались при лечении различных заболеваний [8, 15, 52]. Однако в 1940-е гг. они были потеснены антибиотиками, а на Западе о фагах забыли вовсе [5, 16, 36, 45, 49].
Сегодня в западных странах интерес к фагам проснулся вновь. Побудительным мотивом к этому явилось всевозрастающее число устойчивых к антибиотикам микроорганизмов, особенно стафилококков и синегнойной палочки [10, 14, 29, 46]. Причем бактериофагами интересуются не только специалисты, но даже и политические деятели. Вице-президент США Альберт Гор назвал фаги новым оружием для борьбы с болезнетворными бактериями. В последние годы защищен ряд докторских диссертаций о практическом применении бактериофагов, например в Финляндии – о включении последних в йогурты. Несколько американских фирм начали производить фаги.
Первоначально одним из важных практических применений фагов было их использование для фаготипирования с целью точной идентификации вида микробов [7, 19]. Широко использовались фаги и при терапии ряда заболеваний, причем сообщалось о многочисленных успехах при лечении дизентерии, брюшного тифа, паратифоидной лихорадки, холеры, пиогенных инфекций и инфекций мочевых путей [28, 44, 51]. Фаги наносили на место поражения, давали внутрь либо применяли в виде аэрозолей или клизм. Их также вводили с помощью инъекций – подкожно, внутривенно, внутримышечно, интрадуоденально, внутрибрюшинно и даже в полость легких, сонную артерию и перикард. Описанные результаты были довольно противоречивыми. Часто фаги с точно неопределенным составом и в неизвестных концентрациях давали больным без бактериологического диагноза, не обращая внимания на катамнез, результаты контроля и плацебо. Не было качественного контроля производства, исключение составляли лишь несколько исследовательских центров [4, 19, 22, 40].
В 1931 г. Советом фармации и химии Американской медицинской ассоциации был подготовлен обзор доступной литературы по фаговой терапии. M. Eaton и S. Bayne-Jones [42] рассмотрели 150 работ и опубликовали детальный обзор, в котором их выводы были не в пользу терапии фагами. Они утверждали, что природа фага неживая; возможно, это фермент, поэтому неправильно связывать эффект воздействия фага на культуру бактерий или его терапевтическое действие с особенностями его жизнедеятельности. Это заключение оказало сильное негативное влияние на капиталовложения в исследования по фаготерапии и подорвало интерес западных ученых к возможному использованию фагов в терапевтических целях. Через несколько лет стали широко и эффективно применять антибиотики, что значительно уменьшило интерес к фаговой терапии на Западе. Вновь он возрос лишь в 1980–1990-е гг. в связи с широким распространением антибиотикоустойчивых микроорганизмов и снижением эффективности антибиотикотерпии [41, 47, 51]. Однако в Советском Союзе исследования были продолжены, и отечественные ученые уже в 1930-е гг. пошли самостоятельным путем, разрабатывая нерешенные вопросы, связанные с использованием фагов как в лечебной, так и в противоэпидемической практике [7, 12, 23, 38].
Первые сообщения о результатах лечения и профилактики бактериофагами дизентерии и гнойно-септических инфекций в нашей стране появились в начале 1930-х гг. Было установлено, что лечение дизентерии фагами нужно начинать как можно раньше – до развития интоксикации [3, 9, 18, 30], показана безвредность препарата и его высокая эффективность при правильном применении. При лечении дизентерии у взрослых получали полный эффект при раннем начале лечения и соответствии фага возбудителю дизентерии. У детей недостаточная эффективность объяснялась ранним развитием интоксикации, присоединением гнойных процессов в верхних дыхательных путях (отитов), пневмоний, которые часто завершают дизентерию и вызываются стафило-, стрепто- и пневмококками, а применявшийся дизентерийный фаг не оказывает действия на эти инфекционные агенты. В работах 1960-х гг. была показана эффективность профилактики дизентерии бактериофагами на большой группе детей (30 769 человек) [13, 32, 35], когда заболеваемость дизентерией у детей, получавших лечебные фаги, снизилась в 2,3 раза. В настоящее время также получены результаты, свидетельствующие о высокой эффективности адаптированного сальмонеллезного бактериофага, применение которого позволило справиться без антибиотиков с внутригоспитальной эпидемией сальмонеллеза, продолжавшейся в течение 3 лет и не поддававшейся антибактериальной терапии [26, 38, 44].
Современная классификация бактериофагов включает 13 семейств, подразделенных более чем на 140 родов, которые содержат более 5300 видов фагов [5, 27, 33]. Применение современных электронных микроскопов позволило детально изучить строение фагов. Оказалось, что многие из них устроены сложнее, чем вирусы человека, животных и растений.
Бактериофаги представляют собой бактериальные вирусы, антибактериальный эффект которых обусловлен специфическим лизисом (гибелью) бактерий в очаге воспаления. Действие вирулентного бактериофага происходит поэтапно: вначале он адсорбируется на поверхности гомологичной микробной клетки, затем проникает внутрь с последующим внутриклеточным размножением, используя структурные компоненты клетки и разрушая ее. В результате выходят зрелые фаговые частицы, готовые к заражению новых бактериальных клеток [17, 32, 42, 49].
Большинство фагов содержит кольцевую двунитчатую ДНК и лишь некоторые – РНК или однонитчатую ДНК. Фаги, как и другие вирусы, обладают антигенными свойствами и содержат группоспецифические (определяющие серотип) и типоспецифические антигены. Сыворотки, содержащие антитела к этим антигенам (антифаговые сыворотки), нейтрализуют литическую активность фагов. Взаимодействие бактериофага с клеткой происходит по следующим основным путям, характерным для всех вирусов, – продуктивному (литическому), абортивная вирусная и латентная инфекция (лизогения, вирогения), а также вирус-индуцированная трансформация [2, 15, 34, 46, 50].
По характеру взаимодействия фага с клеткой все бактериофаги делятся на вирулентные (литические), вызывающие продуктивную инфекцию и лизис бактериальной клетки, и умеренные, вызывающие латентную инфекцию и ассоциацию генома вируса с бактериальной хромосомой [11, 37, 45]. Умеренные фаги в отличие от вирулентных не вызывают гибели бактериальных клеток и при взаимодействии с ней переходят в неинфекционную форму фага – профаг (геном фага, ассоциированный с бактериальной хромосомой). Профаг, ставший частью хромосомы клетки, при ее размножении синхронно реплицируется с геномом бактерии, не вызывая ее лизиса, и передается по наследству от клетки к клетке в неограниченном числе поколений. Бактериальные клетки, содержащие в своей хромосоме профаг, называются лизогенными. Профаг в лизогенных бактериях самопроизвольно или под влиянием различных индуцированных агентов может переходить в вегетативный фаг. В результате такого превращения бактериальная клетка лизируется и продуцирует новые фаговые частицы. В ходе лизогенизации бактериальные клетки могут дополнительно приобретать новые признаки, детерминируемые геномом вируса. Такое явление – изменение свойств микроорганизмов под влиянием профага – называется фаговой, или лизогенной, конверсией (проявление вирус-индуцированной трансформации) [6, 19, 26, 33].
Умеренные фаги, неспособные ни при каких условиях переходить из профага в вегетативный фаг (образовывать зрелые фаговые частицы), называются дефектными. Чаще они встречаются в результате нарушений на стадии сборки вирусных частиц. Некоторые умеренные фаги называются трансдуцирующими, поскольку с их помощью реализуется один из механизмов генетической рекомбинации у бактерий – трансдукции. Такие фаги могут использоваться, в частности, в генной инженерии в качестве векторов для получения рекомбинантных ДНК и/или приготовлении рекомбинантных (генно-инженерных) вакцин [8, 14, 29, 46].
Специфичность фагов послужила основанием для их наименования по видовым и родовым названиям чувствительных к ним бактерий. Так, например, фаги, лизирующие стрептококки, называются стрептококковыми, лизирующие холерные вибрионы, – холерными, стафилококки – стафилококковыми. По признаку специфичности выделяют поливалентные бактериофаги, лизирующие культуры одного семейства или рода бактерий, моновалентные (монофаги), лизирующие культуры только одного вида бактерий, а также отличающиеся наиболее высокой специфичностью типовые бактериофаги, способные вызывать лизис только определенных типов (вариантов) бактериальной культуры внутри вида бактерий [16, 28, 39, 50]. Наборы таких типоспецифических фагов используются для дифференцировки бактерий внутри вида – фаготипирования бактерий. С помощью этого метода можно установить источник и пути передачи инфекционного заболевания, т. е. провести его эпидемиологический анализ, поскольку он позволяет сравнивать фаготипы (фаговары) чистых культур бактерий, выделенных в ходе бактериологического исследования от больного и от окружающих его лиц – возможных бактерионосителей [21, 36].
Перспективным направлением в усовершенствовании профилактики и лечения инфекций, в т. ч. гнойно-септических, является использование лечебных бактериофагов, которые могут воздействовать и на устойчивые к антибиотикам штаммы бактерий. Они сами или в комплексе с другими антибактериальными препаратами повышают эффективность этиотропной терапии. Кроме того, препараты бактериофагов не токсичны, не вызывают развития дисбактериозов и других побочных эффектов [1, 20, 28, 46].
Преимущества бактериофагов перед антибиотиками достаточно очевидны [8, 23, 25, 31, 49] и заключаются в следующем:
- бактериофаги способны уничтожать бактерии, устойчивые к антибиотикам, т. к. они действуют лишь на определенные бактерии;
- свободно проникают в ткани организма человека и животного, не нарушая баланса высшего организма;
- не вызывают побочных эффектов;
- не подавляют рост нормофлоры, не ослабляют иммунитет;
- не развивают устойчивость бактерий;
- сочетаются с любыми лекарственными препаратами, оказывают иммуностимулирующее действие.
Многие специалисты включают бактериофаги в комплекс лечебных мероприятий и убеждаются в их высокой эффективности как при местном, так и при пероральном применении. В рану бактериофаги вводили путем распыления, орошения, смачивания салфеток или турунд, которые помещали в рану, а также вливали через дренажные трубки у травматологических, хирургических больных с гнойно-септическими осложнениями после аппендэктомии, при эмпиеме плевры [21, 25–28]. В ряде случаев бактериофаги применяли без антибиотиков [39, 47]. При этом отмечено, что клиническое улучшение и заживление ран происходили в среднем на 3–6 суток быстрее, чем в контрольной группе. Значительно сокращался срок пребывания больных на койке.
Пероральное применение пиобактериофага и дополнительное введение по дренажам [10, 29] позволило санировать мочевые пути у урологических больных в 87,5% случаев и достичь клинико-лабораторного улучшения на 4–5-е сутки. У больных, не получавших бактериофагов, нормализация этих показателей происходила на 2–3 дня позже, а полная санация была достигнута только у 30 % пациентов. Хорошие результаты при использовании бактериофагов для лечения гнойно-септических процессов у урологических больных получены также другими исследователями [30, 35, 38].
Установлено, что, несмотря на способ применения (местное или общее), фаги проникают в кровь и лимфу и попадают в очаг воспаления, оказывая положительное влияние на иммунный статус [4, 12, 24]. Бактериофаги способны быстро проникать в кровь и лимфу и выводиться через почки с мочой. Как показано в ряде исследований, после приема 30 мл бактериофага уже через 2 часа фаговые частицы обнаруживают в моче, а их концентрация в моче достигает максимума через 6–8 часов после приема [44,48].
Под воздействием фага в первую очередь происходит активация фагоцитоза, повышается активность нейтрофилов и их метаболическая активность, что препятствует рецидивированию инфекции и хронизации воспалительного процесса. Отмечено снижение числа лейкоцитов и нейтрофилов, а уровень лимфоцитов повышается преимущественно за счет Т-лимфоцитов [40, 47, 52]. Исследование факторов гуморального иммунитета показало отсутствие достоверных различий в содержании иммуноглобулинов [13, 43]. При лечении острой дизентерии интести-бактериофагом отмечено повышение клеточного иммунитета в большей степени, чем при лечении антибиотиками [16, 17, 41].
Активность лечебно-профилактических бактериофагов в отношении возбудителей гнойно-септических и энтеральных заболеваний достаточно высока – от 72 до 90 %, в т. ч. и в отношении штаммов госпитального происхождения, характеризующихся множественной устойчивостью к антибиотикам [6, 14, 30, 45]. Соответствие препаратов бактериофагов современной этиологической структуре возбудителей достигается за счет их постоянной адаптации к циркулирующим штаммам путем обновления фаговых рас и производственных бактериальных штампов. Эта особенность выгодно отличает фаги от других антимикробных препаратов – антибиотиков, эубиотиков или вакцин, где производственные штаммы (штаммы-продуценты) или синтезированное вещество не подлежат каким-либо модификациям. Такая пластичность препаратов бактериофагов обеспечивает продолжение первичной фагоустойчивости возбудителей [27, 51].
К преимуществам бактериофаговых препаратов относятся узкая специфичность действия, не вызывающая в отличие от антибиотиков угнетения нормальной микрофлоры. Доказано стимулирующее действие стафилококкового бактериофага на бифидобактерии – важнейший компонент микробиоценоза кишечника [11, 34, 38]. Использование бактериофагов для лечения инфекционных заболеваний стимулирует факторы специфического и неспецифического иммунитета, что особенно эффективно при лечении хронических воспалительных заболеваний на фоне иммунодепрессивных состояний, бактерионосительства [5, 18, 24, 31, 50].
Важным условием, обеспечивающим результативность лечения фаговыми препаратами, является определенная фагочувствительность возбудителя. Нагляден продолжительный опыт фаготерапии в НИИ урологии. В результате адаптации в НПО “Биофаг” коммерческих бактериофагов к госпитальным штаммам, циркулирующим в урологической клинике, фагочувствительность штаммов повысилась на 15 % и находилась на уровне даже выше чувствительности к самым современным зарубежным антибиотикам. На фоне длительного использования бактериофагов в стационаре среди госпитальных штаммов не наблюдалось формирования фагоустойчивости, в то время как резистентность к антибиотикам уменьшалась. Клиническая эффективность фаготерапии наблюдалась в 92 % случаев, зачастую превосходя результаты антибиотикотерапии [31].
В России, странах СНГ, Польше, Франции, Испании бактериофаги широко используют в медицине. Накоплен большой опыт применения бактериофагов для лечения кишечных инфекций: показана высокая клиническая эффективность фаготерапии острой и хронической дизентерии, сальмонеллезов, сопровождающихся санацией носителей [22, 29, 36, 46, 50]. Доказана высокая эпидемиологическая эффективность профилактического применения дизентерийного, брюшнотифозного и сальмонеллезного бактериофагов. В контролируемых эпидемиологических исследованиях, проводившихся в дошкольных учреждениях и на промышленных предприятиях, установлено снижение уровня заболеваемости в 3– раз [7, 19, 32, 40, 49]. Использование бактериофагов дало хорошие результаты при лечении заболеваний, вызванных условнопатогенными бактериями, дисбактериозов, гнойных поражений кожи, ЛОР-органов, опорно-двигательного аппарата, мочеполовой системы, систем органов кровообращения и дыхания, в т. ч. у новорожденных и детей первого года жизни [2, 10, 12, 23, 37, 43]. В настоящее время бактериофаги находят все большее применение в гинекологии, урологии, хирургии и других областях медицины [9, 15, 21, 42, 52].
Бактериофаги сначала выпускали в жидком виде. Их применяли местно, перорально, вводили в полости, внутримышечно, подкожно и внутривенно [3, 8, 20, 35]. Затем были разработаны таблетированные формы. В настоящее время с использованием современных технологий созданы новые формы – концентрат, таблетки пиобактериофага, а также стафилококкового и протейного монофагов, линимент и гель. Жидкий концентрат, очищенный от белкового балласта, обладает бoльшей эффективностью по сравнению с жидкими фагами. Таблетированные бактериофаги с кислотоустойчивым покрытием более удобны для больных и экономичны при транспортировке. Использование в линименте ланолина и касторового масла обеспечивает лучшую сохранность бактериофага по сравнению с вазелином [22, 39]. Используют монофаги (стафилококковый, стрептококковый, эшерихиозный, протейный, псевдомонадный, клебсиеллезный) и комбинированные бактериофаги, содержащие фаголизаты от 2 до 8 бактерий. Был разработан бактериофаг Enterobacter и проведено его клиническое испытание [35]. Для лечения заболеваний вирусно-бактериальной этиологии создан комплексный биологический препарат Интерфаг, содержащий интерферон и бактериофаги.
Современные лечебно-профилактические препараты бактериофагов составлены из поликлональных вирулентных бактериофагов широкого диапазона действия, активных и в отношении бактерий, устойчивых к антибиотикам. Их выпускают в жидком виде, в таблетках с кислотоустойчивым покрытием, в виде свечей, мазей, линиментов [7, 11, 33, 48]. Основным разработчиком и производителем лекарственных форм бактериофагов является НПО “Микроген”. На филиалах НПО “Иммунопрепарат” (Уфа), НПО “Биомед” (Пермь), НПО “ИмБио” (Нижний Новгород) освоено свыше 10 различных препаратов на основе бактериофагов.
В настоящее время в России для фаготерапии и фагопрофилактики производятся и используются:
- поливалентный сальмонеллезный бактериофаг;
- моновалентные бактериофаги – брюшнотифозный, дизентерийный, протейный, синегнойный, холерный, стафилококковый, стрептококковый, колифаг (кишечной палочки);
- комбинированные препараты поливалентных бактериофагов –колипротейный, пиобактериофаг (включающий стафилококковые, стрептококковые, клебсиеллезные, эшерихиозные, протейные и синегнойные бактериофаги) и др.
Наиболее часто используются следующие бактериофаги.
- Бактериофаг клебсиелл-пневмонии (Клебсифаг) обладает способностью специфически лизировать бактерии, вызвавшие клебсиелл-пневмонию. Предназначен для лечения гнойно-септических и энтеральных заболеваний, вызванных бактериями клебсиелл-пневмонии: хирургических инфекций, заболеваний урогенитальной сферы, желудочно-кишечного тракта, гнойно-воспалительных заболеваний уха, горла, носа, дыхательных путей и легких, генерализованных септических заболеваний, гнойно-септических заболеваний новорожденных.
- Бактериофаг коли (Колифаг) обладает способностью специфически лизировать энтеропатогенные кишечные палочки (Escherichia coli), наиболее значимые в этиологии гнойно-воспалительных заболеваний. Применяют для лечения и профилактики инфекций кожи и внутренних органов, вызванных кишечной палочкой (гнойно-септических заболеваний, гнойно-осложненных ран, ожогов, абсцессов, флегмон, фурункулов, карбункулов, гидраденитов, бурситов, тендовагинитов, остеомиелитов, маститов, плевритов, холецистита, проктита, цистита, пиелита, пиелонефрита, эндометрита, кольпита, сальпингоофорита, энтерита, энтероколита, токсикоинфекций); для профилактики колиинфекций.
- Бактериофаг колипротейный (Колипротеофаг) обладает способностью специфически лизировать распространенные энтеропатогенные эшерихии и протея (Proteusmirabilisи Proteusvulgaris). Применяют для лечения и профилактики энтероколитов, лечения кольпитов колипротейной этиологии и других заболеваний, вызванных коли и протейными бактериями (цистита, пиелита, пиелонефрита, эндометрита, сальпингоофорита, энтеральной патологии).
- Бактериофаг синегнойный (псевдомонас аэругиноза) обладает способностью специфически лизировать бактерии Pseudomonas aeroginosa. Применяют для лечения и профилактики гнойно-воспалительных заболеваний различных органов, вызванных синегнойной палочкой (заболеваний уха, горла, носа, дыхательных путей и легких, хирургических, урогенитальных, энтеральных инфекций, септических заболеваний, гнойно-воспалительных заболеваний новорожденных), дисбактериозов, а также с профилактической целью для обработки послеоперационных и свежеинфицированных ран, для профилактики внутрибольничных инфекций.
- Бактериофаг стафилококковый (Стафилофаг) обладает способностью лизировать стафилококковые бактерии, выделенные при гнойных инфекциях. Применяют для лечения и профилактики гнойных инфекций кожи, слизистых оболочек, висцеральных органов, заболеваний, вызванных стафилококковыми бактериями (синусита, отита, ангины, фарингита, ларингита, трахеита, бронхита, пневмонии, плеврита, гнойных ран, инфицированных ожогов, абсцесса, флегмоны, фурункула, карбункула, гидраденита, панариция, парапроктита, мастита, бурсита, остеомиелита, уретрита, цистита, пиелонефрита, кольпита, эндометрита, сальпингоофорита, гастроэнтероколита, холецистита, омфалита, сепсиса), а также при дисбактериозе кишечника.
- Бактериофаг стрептококковый (Стрептофаг) обладает способностью лизировать стрептококковые бактерии, выделенные при гнойных инфекциях. Применяют для лечения и профилактики гнойных инфекций кожи, слизистых оболочек, висцеральных органов, заболеваний, вызванных стрептококками (синуситов, отита, ангины, тонзиллита, фарингита, ларингита, трахеита, бронхита, пневмонии, плеврита, нагноения ран, гнойно-осложненных ожогов, абсцесса, флегмоны, фурункула, карбункула, гидраденита, панариция, парапроктита, мастита, бурсита, тендовагинита, остеомиелита уретрита, цистита, пиелита, пиелонефрита, кольпита, эндометрита, сальпингоофорита, гастроэнтероколита, холецистита, омфалита, пиодермии, сепсиса), а также при дисбактериозе кишечника.
- Пиобактериофаг комбинированный (Пиополифаг) способен лизировать стафило-, стрептококки (в т. ч. энтерококки), протея, синегнойную и кишечную палочки. Предназначен для профилактики и лечения гнойно-воспалительных заболеваний уха, горла, носа, пазух носа, дыхательных путей, легких; хирургических инфекций (нагноений, абсцесса, флегмоны, остеомиелита, перитонита), урогенитальных инфекций (уретрита, цистита, пиелонефрита); гинекологических инфекций (кольпита, эндометрита, сальпингоофорита); энтеральных инфекций (гастроэнтероколита, холецистита, дисбактериоза); гнойно-септических заболеваний новорожденных.
- Пиобактериофаг поливалентный (Секстафаг) обладает способностью специфически лизировать стафило-, стрептококки (в т. ч. энтерококки), кишечную палочку, протея, синегнойную палочку и клебсиеллупневмония. Предназначен для профилактики и лечения различных форм гнойно-воспалительных и энтеральных заболеваний: гнойно-воспалительных заболеваний уха, горла, носа, дыхательных путей, легких и плевры; хирургических, урогенитальных и энтеральных инфекций; генерализированных септических заболеваний, в т. ч. Гнойно-септических заболеваний новорожденных и детей грудного возраста.
- Пиобактериофаг комплексный жидкий представляет собой смесь фаголизатов стафило-, стрепто-, энтерококков, кишечной палочки, протея (мирабилис и вульгарис), синегнойную палочку и клебсиелл (пневмония и окситока). Применяют для лечения и профилактики гнойно-воспалительных и кишечных заболеваний: заболеваний уха, горла, носа, дыхательных путей и легких; хирургических, урогенитальных, энтеральных инфекций; генерализованных и септических заболеваний; гнойно-воспалительных заболеваний новорожденных, для обработки послеоперационных и свежеинфицированных ран.
Лечебно-профилактические бактериофаги содержат поликлональные вирулентные бактериофаги широкого диапазона действия, активные в т. ч. и в отношении бактерий, устойчивых к антибиотикам. Фаготерапия может успешно сочетаться с антибиотикотерапией [1, 14, 38, 47, 51].
Идея об использовании бактериофагов при лечении болезней бактериальной этиологии возникла сразу же после их открытия [6, 27, 40, 44, 52]. Она по-прежнему остается одной из наиболее перспективных идей, трансформируясь из открытия в методологию в области современных медицинских нанотехнологий. Отличительной чертой бактериофагов как терапевтических средств является почти полное отсутствие у них побочных эффектов, что позволяет назначать эти препараты пациентам различных возрастных групп без каких-либо ограничений и применять поливалентные бактериофаги до получения результатов бактериологического исследования [9, 17, 26, 48]. Показана возможность использования бактериофагов в комплексном лечении совместно с синбиотиками и пробиотиками, доказано их безопасное применение у лиц любого возраста, в т. ч. детей и беременных женщин [10, 29, 37, 43, 51].
Очевидно, что во многих ситуациях более предпочтительным является применение поливалентных препаратов бактериофагов, таких, например, как Секстафаг. Болезнетворные микроорганизмы, против которых он направлен (стафилококки, стрептококки, патогенные кишечные и синегнойные бактерии, протеи, клебсиеллы), являются возбудителями тяжелых хирургических и кишечных инфекций, литальность при которых может достигать 30–50 %. Их лечение затруднено частой антибиотикорезистентностью, токсическими и аллергическими реакциями, явлениями дисбактериоза. Вместе с тем применение при них пиобактериофагов бывает эффективным в 70–90 % случаев. Важно подчеркнуть, что применение поливалентного пиобактериофага не исключает использования других антибактериальных и противовоспалительных препаратов.
Отсутствие противопоказаний и осложнений при применении препаратов бактериофагов, возможность их использования в сочетании с другими лекарственными средствами, в т. ч. и с антибиотиками, активность в отношении антибиотикорезистентных штаммов и адаптация бактериофагов к современным возбудителям – все это позволяет оценить препараты бактериофагов как высокоэффективное и перспективное средство терапии, в т. ч. и экстренных гнойно-септических и энтеральных инфекций.
Информация об авторе: Чушков Юрий Васильевич – доцент, кандидат медицинских наук, заместитель главного врача клиники акушерства и гинекологии по лечебной работе ГОУ ВПО “Первый МГМУ им. И.М. Сеченова” Минздравсоцразвития РФ. E-mail
Инструкция по применению Интести-бактериофаг (Способ и дозировка)
Инструкция на Интести-бактериофаг предусматривает, что лекарство может применяться перорально и ректально. Перед тем, как применить раствор, нужно встряхнуть емкость и рассмотреть содержимое. Если в нем обнаруживаются частицы, меняется прозрачность или цвет, в таком случае применять препарат нельзя.
Инструкция по применению Интести-бактериофаг предусматривает, что в процессе применения ЛС нужно сначала вымыть руки, обрабатывать антисептиком крышку флакона. Нельзя оставлять его открытым. Необходимое количество раствора должно набираться стерильным шприцом. Какой именно период времени должно длиться лечение, назначает врач в каждом индивидуальном случае.
Если у малышей развиваются побочные эффекты при лечении Интести-бактериофаг, средство можно разводить водой. Если отмечается сильная рвота, препарат вводится человеку ректально.
Детям до 6 месяцев разовая доза равна 5 мл (прием перорально) и 10 мл (прием ректально). Детям 6-12 месяцев показана разовая доза 10-15 мл (прием перорально) и 20 мл (прием ректально). Детям 1-3 лет показана разовая доза 15-20 мл (прием перорально) и 20-30 мл (прием ректально). Дети 3-8 лет должны получать дозу 20-30 мл (пероральный прием) и 30-40 мл (ректальный прием). Пациентам от 8 лет и взрослым следует принимать 30-40 мл перорально и 50-60 мл ректально.
Перорально средство назначается 4 раза в день, его нужно принимать за один час до еды.
Если раствор назначается в целях профилактики, показана одна разовая доза в день. Лечение назначают при первых же симптомах, как правило, оно проводится в течение 7-10 дней.
Бактериофаги в комплексном лечении острого бактериального риносинусита
Острый бактериальный риносинусит (ОБРС) является достаточно распространенным заболеванием с постоянной тенденцией к росту. Так, например, в США за последние годы по поводу ОБРС было зарегистрировано приблизительно 25 млн обращений за медицинской помощью в год [17, 18]. В России данная проблема осложняется еще и тем, что из года в год все большему количеству больных требуется стационарное лечение, причем удельный вес больных, госпитализированных по поводу заболеваний околоносовых пазух, ежегодно увеличивается на 1,5–2%. Так, в структуре оториноларингологических стационаров больные с патологией синусов составляют от 15 до 36%. Чаще встречается верхнечелюстной синусит и этмоидит [1, 5, 9, 12]. Классификация ОБРС основывается на длительности и повторяемости симптомов. Наиболее удачной, по нашему мнению, является классификация, предложенная специальной комиссией Американской академии отоларингологов (American Academy of Otolaryngology Head and Neck Surgery) (табл. 1) [14]. По тяжести течения выделяют: • легкое течение: заложенность носа, слизистые или слизисто-гнойные выделения из носа и/или в ротоглотку, повышение температуры тела до 37,5˚С, головная боль, слабость, гипосмия; на рентгенограмме околоносовых синусов – толщина слизистой оболочки менее 6 мм; • среднетяжелое: заложенность носа, гнойные выделения из носа и/или в ротоглотку, температура тела выше 37,5˚С, боль и болезненность при пальпации в проекции синуса, головная боль, гипосмия, недомогание, могут быть иррадиирущие боли в зубы, уши; на рентгенограмме околоносовых пазух синусов – утолщение слизистой оболочки более 6 мм, полное затемнение или уровень жидкости в одном или двух синусах; • тяжелое: заложенность носа, часто обильные гнойные выделения из носа и/или в ротоглотку (но может быть полное отсутствие), температура тела выше 38˚С, сильная болезненность при пальпации в проекции синуса, головная боль, аносмия, выраженная слабость; на рентгенограмме околоносовых пазух синусов – полное затемнение или уровень жидкости более чем в двух синусах; анализ крови: лейкоцитоз, сдвиг формулы влево, увеличение СОЭ, орбитальные, внутричерепные осложнения или подозрения на них. Серьезным осложнением является тромбоз кавернозного синуса, летальность при котором достигает 30% и не зависит от адекватности антибактериальной терапии [14]. Чаще всего острый риносинусит развивается на фоне ОРВИ. Считается, что при вирусных инфекциях околоносовые пазухи вовлечены в воспалительный процесс в той или иной мере. А вот формирование ОБРС происходит лишь в 1 или 2% случаев. Тем не менее, 1–2% – это достаточно большой процент заболеваемости. Одной из причин роста числа больных острым бактериальным гнойным риносинуситом признаны изменения в характере иммунного ответа слизистых носа и глотки. В частности, синуситы относят к проявлениям инфекционного синдрома, обусловленного иммунной недостаточностью как на местном, так и на системном уровне [2, 5, 9]. По мнению А.С. Лопатина, ОБРС практически всегда вызывается застоем секрета и нарушением вентиляции в околоносовых пазухах. А при нарушении мукоцилиарного транспорта и продленный контакт патогенных бактерий с клетками слизистой оболочки дает возможность формирования бактериального воспаления.
Как правило, наиболее существенную роль в развитии бактериальных инфекций верхних дыхательных путей играют Streptococcus pneumoniae, Haemophilus influenzae, а также Streptococcus pyogenes, Moraxella catarrhalis, Staphylococcus aureus, Pseudomonas aeruginosa, Proteus spp, Esherichia coli и ряд других патогенных и условно-патогенных штаммов бактерий [1, 2, 5, 6, 14]. Основными медикаментозными средствами в лечении ОБРС служат антибактериальные препараты, применение которых направлено на эрадикацию возбудителей. Считается, что оптимальным является применение антибиотиков, к которым наиболее чувствительны микроорганизмы (табл. 2).
Критерием рациональности назначенной антибиотикотерапии является оценка состояния больного через 72 ч (3-е сут) после начала лечения. Положительная динамика состояния пациента предполагает продолжение стартовой антибиотикотерапии. При отсутствии положительной клинической динамики через 72 ч следует сменить антибиотик. В лечении синуситов в большинстве случаев приоритет остается за антибактериальной монотерапией. Назначение двух и более антибиотиков оправданно при тяжелом течении синусита или наличии осложнений [5]. Продолжительность лечения зависит от выбранного препарата и степени тяжести синусита. Курс лечения может составлять от 7 до 14 дней. Важно полностью купировать воспалительный процесс в околоносовых пазухах, поэтому, имея целью полную эрадикацию возбудителя, следует ориентироваться на срок лечения в 7–10 дней. Учитывая значительную роль отека слизистой оболочки полости носа и обструкции соустий естественных отверстий околоносовых пазух в патогенезе ОРС, большое значение придается сосудосуживающим препаратам: ксилометазолину, оксиметазолину, фенилэфрину и др. Топические глюкокортикостероиды сравнительно недавно вошли в арсенал лекарственных средств для лечения острого риносинусита. Цель назначения – уменьшение секреции желез слизистой оболочки, уменьшение тканевого отека и, как следствие, улучшение носового дыхания (мометазона фуроат спрей для носа по100 мкг 2 р./сут) [5, 6].
К сожалению, ввиду бесконтрольного использования лекарственных препаратов, особенно антибактериальных, происходит постоянная эволюция бактериальных клеток, которые приобретают новые свойства, становятся более устойчивыми. За последнее десятилетие значительно выросла резистентность этих бактерий к макролидам и пенициллинам, традиционно широко использующимся в отоларингологии. Кроме того, в последние годы отмечается резкий рост числа бактерий, продуцирующих β-лактамазы расширенного спектра действия, что связано с широким использованием в стационарной и амбулаторной практике цефалоспоринов первого, второго и третьего поколений [10].
Антибиотикорезистентность – достаточно серьезная проблема в лечении синуситов. По данным литературы, особенно большой ее процент отмечается в странах Западной Европы, что затрудняет лечебную тактику синуситов [5]. Распространение антибиотикоустойчивости среди возбудителей заболеваний ЛОР-органов, наряду с токсическими, иммуносупрессивными и аллергическими реакциями на введение антибиотиков, является ведущей причиной снижения эффективности антибактериальной терапии. Однако в последние годы появилось большое количество штаммов микроорганизмов, не чувствительных к антибиотикам, широко используемым в практике [9]. Так, метициллинрезистентность отмечается у 30–40% Staphylococcus aureus. Отмечена тенденция к нарастанию резистентности к пенициллинам, макролидам, а также к аминопенициллинам и антибиотикам цефалоспоринового ряда первого и второго поколений [5, 9].
Помимо устойчивости микроорганизмов к лекарственным препаратам приходится сталкиваться также и с другой актуальной проблемой – аллергической реакцией организма на антибиотик. Вышеперечисленные данные обращают наше внимание на необходимость поиска новых антибактериальных препаратов, которые смогут использоваться для лечения пациентов с риносинуситом. В качестве альтернативы могут применяться высокоэффективные препараты бактериофагов, внимание к которым оправданно усиливается в последнее время [3, 4, 11]. Бактериофа́ги, или фа́ги (от др.-греч. φᾰγω — «пожираю») – вирусы, избирательно поражающие бактериальные клетки. Чаще всего бактериофаги размножаются внутри бактерий и вызывают их лизис. Первооткрывателем бактериофагов был канадский ученый, бактериолог Феликс Д’Эрелль (25.4.1873, Монреаль — 22.2.1949, Париж), однако в 1929 г. Александр Флеминг, наблюдая антагонизм Penicillium notatum и стафилококка в смешанной культуре, открыл пенициллин и предположил возможность его применения в лечебных целях, и фаготерапия была на некоторое время забыта. Однако теперь, когда последствия применения антибиотиков изменили свойства многих бактерий, ученые вновь обратили свое внимание на данную группу препаратов. Публикации, документирующие фаговую терапию, принадлежат группе Stephan Slopek из Института иммунологии и экспериментальной медицины Академии наук Польши (Вроцлав). Эта группа опубликовала серию подробных статей в Аrсhivum Immunologiae et Therapie Ехреrimentalis (cp. Slopek et al., 1983, 1985, 1987), описывающих результаты лечения фагами с 1981 до 1986 г. у 550 больных [8]. Препараты бактериофагов успешно применяются в России более 60 лет (1936 г. – начало применения бактериофагов в СССР).
Каков механизм действия бактериофагов? Процесс взаимодействия вирулентного бактериофага с клеткой складывается из нескольких стадий: адсорбции бактериофага на клетке, проникновения в клетку, биосинтеза компонентов фага и их сборки, выхода бактериофагов из клетки. Продолжительность этого процесса может составлять от нескольких минут до нескольких часов. Затем происходит лизис клетки, и освобождаются новые зрелые бактериофаги. Очень важным свойством бактериофагов является их специфичность. По признаку специфичности выделяют поливалентные бактериофаги, лизирующие культуры одного семейства или рода бактерий, моновалентные (монофаги) – лизирующие культуры только одного вида бактерий, а также отличающиеся наиболее высокой специфичностью – типовые бактериофаги, способные вызывать лизис только определенных типов (вариантов) бактериальной культуры внутри вида бактерий [7, 12, 13].
Препараты бактериофагов используются для лечения гнойно-септических и энтеральных заболеваний, вызванных условно-патогенными бактериями родов Escherichiae, Proteus, Pseudomonas, Enterobacter, Staphylococcus, Streptococcus, Klebsiellae. Именно эти бактерии являются возбудителем тяжелых синуситов на фоне иммунодефицитных состояний, о чем было сказано ранее. Бактериофаги обладают рядом преимуществ: специфичность действия, отсутствие угнетения нормальной микрофлоры и аллергической реакции, стимуляция факторов специфического и неспецифического иммунитета [3, 4, 7, 12, 16]. Применение специфических бактериофагов позволяет оптимальным образом осуществить прицельный лизис патогенной флоры с целью антимикробного эффекта, а также для восстановления нормального микробиоценоза. Бактериофаги не имеют токсичного эффекта и не подавляют нормальную микрофлору. Опосредованно обладают стимулирующим иммунологическим эффектом, влияя на клеточный и гуморальный иммунитет [19]. Различные препараты бактериофагов, применяемые в соответствии с видом возбудителя, высокоэффективны при лечении паратонзиллярных абсцессов, воспалений пазух носа, гнойно-септических заболеваний больных в отделениях реанимации, хирургических инфекций, пиелонефритов, холециститов, гастроэнтероколитов, дисбактериоза кишечника, воспалительных заболеваний и сепсиса новорожденных [3, 7, 11]. Отсутствие побочных патологических реакций на применение препаратов бактериофагов позволяет эффективно использовать их у новорожденных и детей первого года жизни [Ворошилова Н.Н. и др., 2000]. Лечебно-профилактические бактериофаги изготавливаются с соблюдением всех требований к асептике и представляют собой препараты на основе натуральных природных компонентов, содержащихся в воде, почве, поэтому их можно назначать детям и взрослым. По составу бактериофаги делятся на монопрепараты, содержащие вирулентные фаги бактерий одного рода или вида, – стафилококковый, стрептококковый (в т. ч. энтерококковый), протейный, псевдомонас аэругиноза (синегнойный), клебсиелл пневмонии, коли, дизентерийный поливалентный, брюшнотифозный, сальмонеллезный (гр. АВСДЕ), и комбинированные фаги, в составе которых несколько монопрепаратов. К комбинированным относятся: коли-протейный, клебсиелл поливалентный, пиобактериофаги поливалентные (очищенный, комплексный и Секстафаг®) – содержащие бактериофаги стафилококковый, стрептококковый, протейный, псевдомонас аэругиноза (синегнойный), клебсиелл, коли, а также Интести-бактериофаг, содержащий бактериофаги против шигелл, сальмонелл, стафилококков, энтерококков, протея, синегнойной палочки и энтеропатогенной кишечной палочки.
Одним из комбинированных препаратов является Секстафаг® (пиобактериофаг поливалентный жидкий), производимый в России ФГУП «НПО «Микроген» Минздрава России [11]. НПО «Микроген» входит в тройку лидеров российских фармацевтических компаний и является крупнейшим национальным производителем иммунобиологических препаратов: вакцин, сывороток, специфических иммуноглобулинов, питательных сред, аллергенов, пробиотиков. Уникальным направлением научно-производственной деятельности НПО «Микроген» является производство бактериофагов – безопасных антибактериальных препаратов, эффективной альтернативы антибиотикам. Секстафаг® представляет собой смесь стерильных фильтров фаголизатов стафилококков, стрептококков, энтерококков, эшерихий коли, протея, псевдомонас аэругиноза и клебсиелл пневмонии. Форма выпуска – во флаконах и ампулах. Пиобактериофаг Секстафаг® разрешен к применению у новорожденных с 0 мес., а также у беременных, что говорит о безопасности препарата.
Пиобактериофаг поливалентный (Секстафаг®) обладает способностью специфически лизировать соответствующие фагу микроорганизмы. Препарат хорошо себя зарекомендовал при гнойно-воспалительных заболеваниях верхних и нижних дыхательных путей, в т. ч. и при лечении ОБРС. Препарат принимают перорально. Возможно применение совместно с антибактериальными средствами по традиционной схеме антибактериальной терапии, о которых речь шла выше. Секстафаг®, как правило, назначается натощак в жидком виде по 20 мл 2–3 р./сут. Препарат применяется в монотерапии, также возможна комбинированная терапия с антибиотиками. Продолжительность курса составляет, как правило, не более 7–10 дней.
Препарат разрешен к применению у новорожденных с 0 мес. Таким образом, терапия ОБРС, особенно вызванного возбудителями внутрибольничных штаммов, на фоне иммунодефицитных состояний, оправданна препаратами бактериофагов и является перспективным направлением. Может рассматриваться как альтернатива антибиотикотерапии и как вспомогательное лечение при классической терапии антибактериальными препаратами. Появление новых препаратов бактериофагов служит посылом для изучения антибактериальных свойств этих препаратов в отношении основных возбудителей воспалительных заболеваний ЛОР-органов, а также изучения влияния препаратов бактериофагов на иммунный статус пациентов.
Литература 1. Зубков М.Н. Алгоритм терапии острых и хронических инфекций верхних и нижних дыхательных путей // РМЖ. 2009. Т. 17. № 2. С. 123–131. 2. Крюков А.И., Сединкин А.А.., Алексанян Т.А Лечебно-диагностическая тактика при остром синусите // Вестник оториноларингологии. 2002. № 5. С. 51–56. 3. Лазарева Е.Б. Бактериофаги для лечения и профилактики инфекционных заболеваний // Антибиотики и химиотерапия. 2003. Т. 48, № 1. С. 36–40. 4. Лазарева Е.Б., Спиридонова Т Г., Киселевская-Бабина И.В. и др. Эффективность бактериофагов при лечении внутрибольничных инфекций у больных с ожогами // Стерилизация и госпитальные инфекции. 2007. № 2. С. 48–50. 5. Лопатин А.С., Александрова И.А., Гамов В.П., Деточка Я.В. Рациональная фармакотерапия заболеваний уха, горла и носа: Руководство для врачей . М.: Литтерра, 2011. С. 48–64. 6. Лопатин А.С., Трякина Е.Г. Исследование эффективности длительного курса лечения низкими дозами кларитромицина при полипозном риносинусите // Российская ринология. 2007. № 4. С. 38–41. 7. Майская Л. М., Дарбеева О.С., Парфенюк Р.Л. и др. Методика определения фагочувствительности штаммов, выделенных от больных, к препаратам бактериофагов. // Научно-практический журнал «БИО препараты». 2003. № 2. С. 22–23. 8. Ожерельева Н.Г. Краткая медицинская энциклопедия. М.: Изд-во «Советская Энциклопедия», 1989, изд. 2-е. 9. Пальчун В.Т., Лучихин Л.А. Целесообразность и эффективность антибактериальной терапии в ЛОР-практике // Вестник оториноларингологии. 2006. № 3. С. 27–30. 10. Решедько Г.К., Козлов Р.С. Состояние резистентности к антиинфекционным химиопрепаратам в России. Практическое руководство по антиинфекционной химиотерапии / Под ред. Л.С. Страчунского, Ю.Б. Белоусова, С.Н. Козлова. Смоленск, 2007. С. 32–46. 11. Султанов Н.М. Антибактериальная активность и клиническая эффективность препарата пиобактериофага поливалентного очищенного при лечении хронического гнойного риносинусита: Дисс. канд. биол. наук, 2007. C. 94. 12. Guttman B., Raya R., Kutter E. Basic Phage Biology, in Bacteriophages: Biology and Applications / Kutter E. and Sulakvelidze A., ed.. CRP Press, 2005. FL. P. 29–66.Schappert S.M. Ambulatory care visits to physician offices, hospital outpatient departments, and emergency departments: United States, 1996 // Vital Health Stat. 13. 1998. Vol. 134. P. 1–37. 13. Hickner J.M., Bartlett J.G., Besser R.E., Gonzales R. et al. Principles of appropriate antibiotic use for acute rhinosinusitis in adults: background // Ann. Intern. Med. 2001. Vol. 134. P. 498–505. 14. Lanza D.C., Kennedy D.W. Adult rhinosinusitis defined // Otolaryngol. Head Neck. Surg. 1997. Vol. 117 (3 Pt 2 Suppl). P. 1–7. 15. Paterson D.L., Bonomo R.A. Extended-spectrum beta-lactamases: a clinical update // Clin. Microbiol. Rev. 2005. Vol. 18. P. 7–86. 16. Raya R.R., Hébert E.M. Isolation of phage via induction of lysogens. Bacteriophages: Methods and Protocols, Volume 1: Isolation, Characterization, and Interaction / Martha R.J. Clokie, Andrew M. Kropinski eds., 2009. Vol. 501. P. 23–32. 17. Schappert S.M. Ambulatory care visits to physician offices, hospital outpatient departments, and emergency departments: United States, 1996 // Vital. Health Stat. 13. 1998. Vol. 134. P. 1–37. 18. Scheid D.C., Hamm R.M. // Am. Fam. Physician. 2004. Vol. 70. P.1685–1692. 19. Waters V., Ford-Jones E.L., Petric M. et al. Etiology of communityacquired pediatric viral diarrhea: a prospective longitudinal study in hospitals, emergency departments, pediatric practices and child care centers during the winter rotavirus outbreak, 1997 to 1998 // Pediatric Infectious Disease Journal. 2000. № 9. Vol. 19, № 9. P. 843–848.
Аналоги Интести-бактериофаг
Совпадения по коду АТХ 4-го уровня:
Цистамин
Неоваскулген
Подорожника сок
Ацизол
Лейковорин
Лимфомиозот
Тиосульфат натрия
Галиум-Хель
Дикарбамин
Спаскупрель
Метиленовый синий
Нашатырный спирт
Мукоза Композитум
Коэнзим Композитум
Убихинон Композитум
Димефосфон
Унитиол
Налоксон
Оциллококцинум
Дантинорм Бэби
Аналоги препарата – это средства, которые имеют похожее действие на организм. Чтобы подобрать их, необходимо обязательно консультироваться с врачом.
Отзывы об Интести-бактериофаг
Родители оставляют положительные отзывы об Интести-бактериофаг после использования его ректально и перорально. В основном лекарство назначается при дисбактериозе, и с его помощью удается восстановить работу ЖКТ у детей. По словам многих родителей, улучшение состояния подтверждалось соответствующими анализами. Но в некоторых случаях улучшение не наступало, и даже отмечалось некоторое ухудшение состояния здоровья детей. Однако в большинстве случаев лекарство действовало. Чтобы получить результат, врачи рекомендуют обязательно определять чувствительность возбудителей перед лечением.