Фармакологические свойства препарата Аводарт
Фармакодинамика. Дутастерид — ингибитор 5-α-редуктазы, тормозит как тип 1, так и тип 2 изоферментов 5-α-редуктазы, отвечающих за преобразование тестостерона в 5-α-дигидротестостерон. Дигидротестостерон — андроген, в первую очередь отвечающий за гиперплазию ткани предстательной железы. Максимальное снижение дигидротестостерона на фоне приема Аводарта зависит от дозы и наблюдается в первые 1–2 нед. После 1-й и 2–й недели лечения Аводартом в суточной дозе 0,5 мг средняя концентрация дигидротестостерона снижается на 85 и 90% соответственно. У пациентов с доброкачественной гиперплазией предстательной железы, получавших 0,5 мг дутастерида в сутки, среднее снижение уровня дигидротестостерона составляло 94% через 1 год и 93% — через 2 года лечения, средний уровень тестостерона повышался на 19% через 1 и 2 года. Это ожидаемое следствие торможения 5-α-редуктазы, и оно не приводит к проявлению различных известных побочных эффектов. По данным мультицентровых плацебо-контролируемых двойных слепых клинических исследований с участием 4325 мужчин с гиперплазией предстательной железы (30 см3) применение Аводарта в дозе 0,5 мг/сут приводило к предотвращению прогрессирования заболевания как путем снижения риска острой задержки мочи и необходимости в хирургическом вмешательстве, так и статистически достоверным улучшением состояния нижних мочевыводящих путей, увеличением скорости мочеиспускания и уменьшением объема предстательной железы по сравнению с плацебо. Все вышеупомянутые изменения отмечали на протяжении 24 мес. Фармакокинетика. Дутастерид применяют внутрь в форме р-ра в мягких желатиновых капсулах. После приема разовой дозы 0,5 мг максимальная концентрация препарата в плазме крови наблюдается через 1–3 ч. Абсолютная биодоступность составляет 60% и не зависит от приема пищи. Дутастерид после одноразового или многоразового приема имеет большой объем распределения (300–500 л). Связывание с белками плазмы крови — 99,5%. При применении в суточной дозе 60% постоянная равновесная концентрация дутастерида в плазме крови достигается через 1 мес лечения и около 90% — через 3 мес. Постоянная равновесная концентрация дутастерида приблизительно 40 нг/мл в плазме крови достигается после 6 мес приема в суточной дозе 0,5 мг. Аналогично с плазмой крови постоянная равновесная концентрация дутастерида в семенной жидкости достигается через 6 мес. После 52 нед лечения средняя концентрация дутастерида в семенной жидкости составляет 3,4 нг/мл (в пределах 0,4–14 нг/мл). Соотношение распределения дутастерида из плазмы крови в семенную жидкость — около 11,5%. In vitro дутастерид метаболизируется ферментами CYP 3A4 цитохрома Р450 человека до двух моногидроксильных метаболитов. В плазме крови, по данным спектрометрического анализа, выявляют неизмененный дутастерид, 3 основных метаболита (4-гидроксидутастерид, 1,2-дигидродутастерид и 6-гидроксидутастерид) и 2 малых метаболита (6,4 -дигидроксидутастерид и 15-гидроксидутастерид). Дутастерид интенсивно метаболизируется. После приема внутрь дутастерида в дозе 0,5 мг/сут 1–15,4% (в среднем 5,4%) выводится с калом в виде неизмененного дутастерида, остальное — в виде метаболитов. В моче определяют следы неизмененного дутастерида (≤0,1%). Заключительный период полувыведения дутастерида составляет 3–6 нед. Следы дутастерида в плазме крови могут быть выявлены через 4–6 мес после окончания лечения.
Аводарт
Применение при беременности и кормлении грудью
Влияние на фертильность
Влияние дутастерида в суточной дозе 500 мкг на характеристики спермы изучалось у здоровых добровольцев в возрасте 18-52 лет. К 52-й неделе лечения средние значения процентного снижения общего количества сперматозоидов, объема спермы и двигательной активности сперматозоидов составляли 23%, 26% и 18% соответственно по сравнению с исходным уровнем. Концентрация сперматозоидов и их морфологические характеристики не изменялись.
Через 24 недели наблюдения среднее значение процентного изменения общего количества сперматозоидов в группе дутастерида оставалось на 23% ниже по сравнению с исходным уровнем. Среднее значение для всех параметров спермы во всех временных точках оставалось в пределах нормы и не соответствовало заданным критериям для клинически значимого изменения (30%), на 52-й неделе лечения у двух добровольцев в группе дутастерида общее количество сперматозоидов снижалось более чем на 90% по сравнению с исходным уровнем, с частичным восстановлением на 24-й неделе наблюдения.
Таким образом, клиническое значение влияния дутастерида на показатели спермы и на индивидуальную фертильность пациента неизвестно.
Беременность
Дутастерид противопоказан женщинам. Дутастерид не изучался у женщин, т.к. доклинические данные свидетельствуют о том, что подавление уровня ДГТ может вызывать торможение развития наружных половых органов у плода.
Лактация
Нет данных о проникновении дутастерида в грудное молоко.
Применение при нарушениях функции печени
Необходимо с осторожностью применять препарат у пациентов с нарушениями функции печени, т.к. дутастерид подвергается интенсивному метаболизму в печени, а его T1/2 составляет 3-5 нед.
С осторожностью следует назначать препарат при печеночной недостаточности.
Применение при нарушениях функции почек
При нарушениях функции почек снижение дозы препарата не требуется (т.к. при приеме препарата в дозе 500 мкг/сут с мочой выделяется менее 0.1% дозы).
Применение у детей
Аводарт® противопоказан детям.
Применение у пожилых пациентов
Коррекции дозы не требуется.
Особые указания
Дутастерид всасывается через кожу, поэтому женщины и дети должны избегать контакта с поврежденными капсулами. В случае контакта с поврежденными капсулами необходимо сразу промыть соответствующий участок кожи водой с мылом.
Нарушение функции печени
В настоящее время нет данных по применению препарата Аводарт® у пациентов с нарушениями функции печени. Так как дутастерид подвергается интенсивному метаболизму, а его период полувыведения составляет 3-5 недель, необходимо соблюдать осторожность при лечении препаратом Аводарт® пациентов с нарушениями функции печени.
Сердечная недостаточность при комбинированном применении дутастерида и тамсулозина
В двух 4-летних клинических исследованиях частота развития сердечной недостаточности была выше у пациентов, получавших комбинацию дутастерида и альфа1-адреноблокатора, главным образом тамсулозина, чем у пациентов, не получавших комбинированного лечения. В этих двух исследованиях частота развития сердечной недостаточности оставалась низкой (≤ 1%) с некоторой вариабельностью между ними. Но в целом расхождений показателей частоты побочных эффектов со стороны сердечно-сосудистой системы не отмечалось. Причинно-следственной связи между лечением дутастеридом (в качестве монотерапии или в виде комбинации с альфа1-адреноблокатором) и развитием сердечной недостаточности не установлено.
Влияние на выявление простат-специфического антигена (ПСА) и рака предстательной железы (РПЖ)
У пациентов необходимо проводить пальцевое ректальное исследование, а также использовать другие методы исследования предстательной железы, до начала лечения дутастеридом и периодически повторять их в процессе лечения для исключения развития РПЖ.
Определение концентрации ПСА в сыворотке является важным компонентом скрининга, направленного на выявление РПЖ. После 6-месячной терапии дутастеридом средний сывороточный уровень ПСА снижается примерно на 50%. Пациентам, принимающим дутастерид, должен быть определен новый базовый уровень ПСА после 6 месяцев терапии. В дальнейшем рекомендуется регулярно контролировать уровень ПСА.
Применение дутастерида не влияет на диагностическую ценность уровня ПСА как маркера РПЖ. Любое подтвержденное повышение уровня ПСА относительно наименьшего его значения при лечении дутастеридом может свидетельствовать о развитии РПЖ (в частности, рака предстательной железы с высокой степенью дифференцировки по шкале Глисона) или несоблюдении режима терапии дутастеридом и должно подвергаться тщательной оценке, даже если эти уровни ПСА остаются в пределах нормальных значений для данной возрастной категории пациентов, не принимающих ингибиторы 5α-редуктазы.
Уровень общего ПСА возвращается к исходному значению в течение 6 месяцев после отмены дутастерида.
Соотношение содержания свободного ПСА к общему остается постоянным даже на фоне терапии дутастеридом. Если определение процента содержания свободной фракции ПСА дополнительно используется для выявления РПЖ у мужчин, получающих дутастерид, коррекции этой величины не требуется.
Влияние длительного приема дутастерида на развитие рака грудных желез у мужчин
Не обнаружено влияния длительного приема дутастерида на развитие рака грудных желез у мужчин.
РПЖ и опухоли высокой степени градации
В 4-х летнем исследовании (REDUCE) проводилось сравнение применения плацебо и дутастерида у 8231 добровольца в возрасте от 50 лет до 75 лет, с отрицательным результатом биопсии на наличие РПЖ и уровнем ПСА от 2.5 нг/мл до 10 нг/мл при первичном обследовании.
В ходе исследования 6706 пациентам проводилась пункционная биопсия предстательной железы и на основании полученных результатов определялась степень злокачественности РПЖ по шкале Глисона. 1517 пациентам в ходе исследования был поставлен диагноз РПЖ. В большинстве случаев, как в группе дутастерида, так и в группе плацебо, был диагностирован высокодифференцированный РПЖ (сумма баллов по шкале Глисона 5-6). Различия в количестве случаев РПЖ с оценкой 7-10 баллов по шкале Глисона в группе дутастерида и группе плацебо отсутствовали (р = 0.81).
Через 4 года было отмечено больше случаев РПЖ с оценкой 8-10 баллов по шкале Глисона в группе дутастерида (n = 29; 0.9%) по сравнению с группой плацебо (n = 19; 0.6%) (р = 0.15). При оценке данных биопсии за 1-2 года число пациентов с диагнозом РПЖ с оценкой 8-10 баллов по шкале Глисона было сравнимо в группах дутастерида (n = 17; 0.5%) и плацебо (n = 18; 0.5%). При оценке данных биопсии за 3-4 год было диагностировано больше случаев РПЖ с оценкой 8-10 баллов по шкале Глисона в группе дутастерида (n = 12; 0.5%) по сравнению с группой плацебо (n = 1; < 0.1%) (р = 0.0035). Процентное соотношение пациентов с диагнозом РПЖ с оценкой 8-10 баллов по шкале Глисона было стабильным в течение всех временных промежутков (за период 1-2 и 3-4 года) в группе дутастерида (0.5% в каждом периоде), в то время как в группе плацебо процент пациентов с диагнозом РПЖ с оценкой 8-10 баллов был ниже на протяжении 3-4 лет, чем в 1-2 годы (< 0.1% по сравнению с 0.5% соответственно).
В 4-х летнем исследовании (CombAT) пациентов с ДГПЖ, в котором проведение биопсии предстательной железы всем участникам не было определено протоколом, и все диагнозы РПЖ основывались на биопсии по показаниям, РПЖ с оценкой 8-10 баллов по шкале Глисона был диагностирован у 8 пациентов (< 0.5%) при приеме дутастерида, у 11 пациентов (< 0.7%) при приеме тамсулозина и 5 пациентов (< 0.3%) при комбинированной терапии дутастеридом и тамсулозином.
Причинно-следственной связи между приемом дутастерида и развитием РПЖ высокой степени градации не установлено.
Мужчины, принимающие дутастерид, должны регулярно проходить обследования в отношении оценки риска развития РПЖ, включая уровень ПСА.
Влияние на способность к вождению автотранспорта и управлению механизмами
Прием дутастерида не влияет на вождение автомобиля или работу с механизмами.
Показания к примененинию препарата Аводарт
Лечение и предотвращение прогрессирования доброкачественной гиперплазии предстательной железы путем уменьшения размеров предстательной железы, уменьшения выраженности симптомов болезни, улучшения оттока мочи, снижения риска возникновения острой задержки мочи и при необходимости хирургического вмешательства. В комбинации с тамсулозином — лечение и предотвращение прогрессирования доброкачественной гиперплазии предстательной железы путем уменьшения размеров предстательной железы, уменьшения выраженности симптомов болезни и улучшения оттока мочи.
Применение препарата Аводарт
Аводарт можно назначать в качестве монотерапии или в комбинации с блокатором α-рецепторов тамсулозином (0,4 мг). Взрослые мужчины (включая пациентов пожилого возраста) Рекомендуемая доза Аводарта — 1 капсула (0,5 мг) в сутки внутрь. Капсулу глотают целой, не открывают и не разжевывают, поскольку при контакте с содержимым капсулы возможно раздражение слизистой оболочки полости рта и глотки. Аводарт можно принимать независимо от приема пищи. Несмотря на то, что уменьшение выраженности симптомов заболевания могут отмечать спустя непродолжительное время после приема препарата, для объективной оценки эффективности действия препарата лечение следует продолжать не менее 6 мес. Почечная недостаточность Для больных с почечной недостаточностью дозу корректировать не нужно. Печеночная недостаточность Фармококинетика дутастерида у пациентов с печеночной недостаточностью не изучалась.
Инструкция по применению АВОДАРТ™ (AVODART)
Дутастерид – двойной ингибитор 5α-редуктазы. Подавляет активность изоферментов 5α-редуктазы 1 и 2 типа, которые ответственны за превращение тестостерона в 5α-дигидротестостерон (ДГТ). Дигидротестостерон является основным андрогеном, ответственным за гиперплазию железистой ткани предстательной железы.
Аводарт™ в режиме монотерапии
Влияние на концентрацию дигидротестостерона (ДГТ)/тестостерона
Влияние ежедневного приема препарата Аводарт™ на снижение уровня ДГТ, является дозозависимым и отмечается через 1-2 недели (снижение на 85% и 90% соответственно).
У пациентов с доброкачественной гиперплазией предстательной железы (ДГПЖ), получавших дутастерид в дозе 0.5 мг/сут, медиана снижения концентрации ДГТ в сыворотке составила 94% через 1 год терапии и 93% через 2 года терапии, а медиана увеличения концентрации тестостерона в сыворотке составила 19% через 1 и 2 года терапии.
Влияние на объем предстательной железы
Значительное уменьшение объема предстательной железы обнаруживается уже через 1 месяц после начала лечения и продолжается по 24-й месяц (p <0.001). На 12-й месяц лечения применение препарата Аводарт™ привело к среднему сокращению объема предстательной железы на 23.6% (с 54.9 мл на исходном уровне до 42.1 мл), в группе плацебо среднее сокращение объема составило 0.5% (с 54.0 мл до 53.7 мл). Существенное (p <0.001) уменьшение также имело место в переходной зоне предстательной железы уже после одного месяца терапии, оно продолжалось по 24-й месяц; через 12 месяцев среднее сокращение объема переходной зоны предстательной железы в группе терапии препаратом Аводарт™ составило 17.8% (с 26.8 мл на исходном уровне до 21.4 мл), при этом в группе плацебо имело место увеличение объема в среднем на 7.9% (с 26.8 мл до 27.5 мл). Сокращение объема предстательной железы, наблюдавшееся в течение первых 2 лет двойной слепой терапии, сохранилось на протяжении дополнительных 2 лет терапии в ходе расширенных открытых исследований. Уменьшение размеров предстательной железы ведет к облегчению симптомов и к снижению риска острой задержки мочи (ОЗМ) и хирургического вмешательства в связи с ДГПЖ.
Клинические исследования
Применение препарата Аводарт™ в дозе 0.5 мг/сут изучалось в сравнении с плацебо на примере 4325 испытуемых мужского пола с ДГПЖ с симптомами в степени от умеренной до тяжелой, с объемом предстательной железы ≥30 мл и с концентрацией ПСА в пределах 1.5-10 нг/мл в ходе трех двухгодичных многоцентровых международных плацебо-контролируемых двойных слепых первичных исследований эффективности. Данные клинические исследования были продлены до 4 лет за счет дополнительного периода открытой терапии, при этом все пациенты, оставшиеся в исследовании, продолжали получать ту же самую дозу 0.5 мг. По прошествии 4 лет из первоначально рандомизированных пациентов в группе плацебо и в группе дутастерида осталось 37% и 40% испытуемых, соответственно. Большинство (71%) из 2340 испытуемых в дополнительных периодах с открытой терапией получали лечение в течение 2 дополнительных лет.
Наиболее важными параметрами клинической эффективности были:
- индекс симптомов американской урологической ассоциации (AUA-SI), максимальная скорость мочеиспускания (Qmax), частота случаев острой задержки мочи и хирургического вмешательства в связи с ДГПЖ.
Максимальное значение индекса AUA-SI, определяемого с помощью опросника для оценки симптомов, связанных с ДГПЖ, из семи пунктов, составляет 35 баллов. Исходное среднее значение индекса составляло примерно 17 баллов. По прошествии шести месяцев, одного года и двух лет терапии улучшение индекса в группе плацебо составляло 2.5, 2.5 и 2.3 балла соответственно, а в группе препарата Аводарт™ – 3.2, 3.8 и 4.5 балла соответственно. Различия между двумя группами терапии были статистически значимыми. Улучшение индекса AUA-SI, наблюдавшееся в течение первых двух лет двойной слепой терапии, сохранилось на протяжении еще двух лет в ходе расширенных открытых исследований.
Qmax (максимальная скорость мочеиспускания)
Среднее значение Qmax в клинических исследованиях на исходном уровне было около 10 мл/сек (нормальное значение Qmax ≥15 мл/сек). По прошествии одного года и двух лет терапии скорость мочеиспускания увеличилась в группе плацебо на 0.8 и 0.9 мл/сек соответственно, а в группе лекарственного средства Аводарт™ – на 1.7 и 2.0 мл/сек соответственно. Различия между двумя группами терапии на отрезке времени с 1-го по 24-й месяц было статистически значимым. Увеличение максимальной скорости мочеиспускания, наблюдавшееся в течение первых 2 лет двойной слепой терапии, сохранилось на протяжении еще 2 лет в ходе расширенных открытых исследований.
Острая задержка мочи и хирургическое вмешательство
По прошествии двух лет терапии частота случаев ОЗМ в группе плацебо составляла 4.2%, а в группе препарата Аводарт™ – 1.8% (снижение риска на 57%). Данное различие является статистически значимым, оно означает, что лечение 42 (95% ДИ 30-73) пациентов препаратом Аводарт™ на протяжении двух лет предотвращает 1 случай ОЗМ.
После 2 лет терапии частота случаев хирургического вмешательства в связи с ДГПЖ в группе плацебо составляла 4.1%, а в группе препарата Аводарт™ – 2.2% (снижение риска на 48%). Данное различие является статистически значимым, оно означает, что лечение 51 пациента (95% ДИ 33-109) препаратом Аводарт™ на протяжении двух лет, позволяет избежать одного хирургического вмешательства.
Распределение волосяного покрова
В рамках реализации программы клинических исследований Фазы III влияние дутастерида на распределение волосяного покрова официально не изучалось; вместе с тем, применение ингибиторов 5α-редуктазы может снизить потерю волос и способствовать их росту у пациентов с облысением мужского типа (мужская андрогенная алопеция).
Функция щитовидной железы
Влияние на функцию щитовидной железы изучалось в ходе годичного клинического исследования с участием здоровых мужчин. После одного года терапии дутастеридом показатели уровня несвязанного тироксина не изменились, в то же время в сравнении с плацебо уровень тиреостимулирующего гормона (ТСГ) незначительно увеличился (на 0.4 мкМЕ/мл). Вместе с тем, поскольку показатели уровня ТСГ варьировались, причем диапазон медианных значений уровня ТСГ (1.4-1.9 мкМЕ/мл) находился в пределах нормы (0.5-4.0 мкМЕ/мл), а показатели концентрации тироксина были устойчивыми в пределах нормы и схожими при применении плацебо и дутастерида, указанные изменения уровня ТСГ были расценены как клинически не значимые. Результаты всех клинических исследований свидетельствуют об отсутствии отрицательного влияния дутастерида на функцию щитовидной железы.
Новообразования молочной железы
В двухлетних клинических исследованиях, в ходе которых 3374 пациента получали дутастерид, по состоянию на момент перехода участников в 2-летнее расширенное (дополнительное) открытое исследование случаи рака молочной железы были отмечены у 2 пациентов в группе дутастерида и у 1 пациента в группе плацебо. В клинических исследованиях CombAT и REDUCE, проводившихся на протяжении 4 лет, случаи рака молочной железы не были отмечены ни в одной группе терапии, при этом воздействие дутастерида составило 17489 пациенто-лет, а воздействие комбинации тамсулозина и дутастерида – 5027 пациенто-лет. По состоянию на текущий момент не установлено, имеется ли причинно-следственная связь между долгосрочным приемом дутастерида и развитием рака молочной железы у мужчин.
Влияние на мужскую фертильность
Влияние дутастерида в дозе 0.5 мг/сут на свойства спермы изучалось в исследовании с участием здоровых добровольцев в возрасте от 18 до 52 лет (n=27 в группе дустастерида; n=23 в группе плацебо), на протяжении 52 недель терапии и 24 недель последующего наблюдения. Через 52 недели лечения средние показатели процентного уменьшения общего количества сперматозоидов, объема спермы и подвижности сперматозоидов с корректировкой по изменению от исходного уровня в группе плацебо составляли 23%, 26% и 18% соответственно. Изменение концентрации и морфологии сперматозоидов не отмечалось. Через 24 недели последующего наблюдения среднее процентное изменение общего количества сперматозоидов в группе дутастерида оставалось на 23% ниже исходного показателя. При том что средние значения всех параметров во всех отметках времени оставались в пределах нормы и не соответствовали заранее определенным критериям клинически существенного изменения (30%), у двух пациентов в группе дутастерида через 52 недели терапии количество сперматозоидов уменьшилось более чем на 90% от исходного уровня, при этом через 24 недели последующего наблюдения было отмечено частичное восстановление. Возможность снижения мужской фертильности нельзя исключать.
Аводарт™ в комбинации в альфа-адреноблокатором тамсулозином
В ходе многоцентрового международного рандомизированного двойного слепого клинического исследования в параллельных группах (исследование CombAT), в котором участвовали пациенты с симптомами ДГПЖ в степени от умеренной до тяжелой с объемом предстательной железы ≥30 мл и концентрацией ПСА в пределах 1.5-10 нг/мл, изучалось применение следующих препаратов:
- Аводарт™ 0.5 мг/сут (n=1623), тамсулозин 0.4 мг/сут (n=1611) и комбинация Аводарт™ 0.5 мг плюс тамсулозин 0.4 мг (n=1610). Примерно 53% пациентов ранее получали терапию с применением ингибиторов 5α-редуктазы или блокаторов α-адренорецепторов. Первичной конечной точкой в течение первых 2 лет терапии было изменение суммы баллов по международной шкале оценки простатических симптомов (IPSS) (шкала из 8 пунктов, основанная на AUA-SI с дополнительным вопросом по качеству жизни). Вторичные конечные точки, оценивавшиеся после 2 лет лечения, включали такие показатели, как максимальная скорость мочеиспускания (Qmax) и объем предстательной железы. В сравнении с группой препарата Аводарт™ и группой тамсулозина результаты в отношении IPSS, полученные в группе комбинированной терапии, были значимыми, начиная с отметок времени Месяц 3 и Месяц 9 соответственно. Результаты в отношении Qmax в группе комбинированной терапии были значимыми, начиная с отметки времени Месяц 6, в сравнении с группами лекарственного средства Аводарт™ и тамсулозина.
Первичной конечной точкой после 4 лет терапии было время до развития первого случая ОЗМ или хирургического вмешательства в связи с ДГПЖ. После 4 лет терапии снижение риска ОЗМ или хирургического вмешательства в связи с ДГПЖ в группе комбинированной терапии было статистически значимым (снижение риска на 65.8% при значении p <0.001 [95% ДИ 54.7-74.1%]) в сравнении с результатом в группе монотерапии тамсулозином. Показатели частоты случаев ОЗМ и хирургического вмешательства в связи с ДГПЖ за 4 года в группе комбинированной терапии и в группе тамсулозина, составили 4.2% и 11.9% соответственно (p <0.001). По сравнению с группой монотерапии препаратом Аводарт™ в группе комбинированной терапии риск случаев ОЗМ и хирургического вмешательства в связи с ДГПЖ снизился на 19.6% (p=0.18 [95% ДИ 10.9-41.7%]). Показатели частоты случаев ОЗМ и хирургического вмешательства в связи с ДГПЖ за 4 года в группе комбинированной терапии и в группе лекарственного средства Аводарт™, составили 4.2% и 5.2% соответственно.
Вторичные конечные точки, оценивавшиеся после 4 лет терапии, включали время до клинического прогрессирования (комбинированный показатель, включавший следующие составляющие:
- ухудшение, подтвержденное изменением суммы баллов по шкале IPSS на ≥4 балла, случаи ОЗМ, связанные с ДГПЖ, недержание мочи, инфекция мочевыводящих путей (ИМП) и почечная недостаточность);
- изменение суммы баллов по международной шкале оценки простатических симптомов (IPSS), изменение максимальной скорости мочеиспускания и объема предстательной железы. Результаты исследования после 4 лет терапии представлены далее.
| Параметр | Отметка времени | Комбинация | Аводарт™ | Тамсулозин |
| ОЗМ и хирургическое вмешательство в связи с ДГПЖ (%) | Через 48 месяцев | 4.2 | 5.2 | 11.9a |
| Клиническое прогрессирование* (%) | 48 месяцев | 12.6 | 17.8b | 21.5a |
| IPSS (баллы) | [Исходный уровень] 48 месяцев (изменение от исходного уровня) | [16.6] -6.3 | [16.4] -5.3b | [16.4] -3.8a |
| Qmax (мл/сек) | [Исходный уровень] 48 месяцев (изменение от исходного уровня) | [10.9] 2.4 | [10.6] 2.0 | [10.7] 0.7a |
| Объем предстательной железы (мл) | [Исходный уровень] 48 месяцев (изменение от исходного уровня) | [54.7] -27.3 | [54.6] -28.0 | [55.8] +4.6a |
| Объем переходной зоны предстательной железы (мл)# | [Исходный уровень] 48 месяцев (изменение от исходного уровня) | [27.7] -17.9 | [30.3] -26.5 | [30.5] 18.2a |
| Индекс влияния ДГПЖ (BII) (баллы) | [Исходный уровень] 48 месяцев (изменение от исходного уровня) | [5.3] -2.2 | [5.3] -1.8b | [5.3] -1.2a |
| IPSS, вопрос 8 (оценка состояния здоровья в контексте ДГПЖ) (баллы) | [Исходный уровень] 48 месяцев (изменение от исходного уровня) | [3.6] -1.5 | [3.6] -1.3b | [3.6] -1.1a |
Значения показателей на исходном уровне — средние, значения изменений от исходного уровня — откорректированные средние значения.
* Клиническое прогрессирование является комбинированным показателем, включавшим следующие составляющие: ухудшение, подтвержденное изменением суммы баллов по шкале IPSS на ≥4 балла, случаи ОЗМ, связанные с ДГПЖ, недержание мочи, ИМП и почечная недостаточность.
# Оценка проводилась в отдельных исследовательских центрах (13% рандомизированных пациентов).
a Результаты были значимыми в группе комбинированной терапии (p <0.001) в сравнении с группой тамсулозина по прошествии 48 месяцев.
b Результаты были значимыми в группе комбинированной терапии (p <0.001) в сравнении с группой препарата Аводарт™ по прошествии 48 месяцев.
Сердечная недостаточность
В 4-летнем исследовании ДГПЖ с применением препарата Аводарт™ в комбинации с тамсулозином у 4844 пациентов (исследование CombAT) частота случаев, описываемых комбинированным термином «сердечная недостаточность», в группе комбинированной терапии (14/1610, 0.9%) была выше, чем в обеих группах монотерапии:
- Аводарт™ – 4/1623, 0.2%, тамсулозин – 10/1611, 0.6%.
В отдельном клиническом исследовании (исследование REDUCE) c участием 8231 пациента в возрасте от 50 до 75 лет с полученным ранее отрицательным результатом биопсии на рак предстательной железы и с концентрацией ПСА на исходном уровне в пределах 2.5-10.0 нг/мл (у мужчин в возрасте от 50 до 60 лет) и 3-10 нг/мл (у мужчин в возрасте старше 60 лет) частота случаев, описываемых комбинированным термином «сердечная недостаточность», в группе препарата Аводарт™ 0.5 мг 1 раз/сут (30/4105, 0.7%) была выше, чем в группе плацебо (16/4126, 0.4%). Ретроспективный анализ результатов данного исследования свидетельствовал о том, что частота случаев, описываемых комбинированным термином «сердечная недостаточность», у пациентов, получавших одновременно Аводарт™ и блокатор α-адренорецепторов (12/1152, 1.0%), была выше, чем у пациентов, получавших Аводарт™ в режиме монотерапии (18/2953, 0.6%), плацебо и блокатор α-адренорецепторов (1/1399, <0.1%) или только плацебо (15/2727, 0.6%) (см. раздел «Особые указания»).
Рак предстательной железы и рак предстательной железы высокой степени злокачественности
В клиническом исследовании препарата Аводарт™ в сравнении с плацебо (исследование REDUCE) c участием 8231 пациента в возрасте от 50 до 75 лет с полученным ранее отрицательным результатом биопсии на рак предстательной железы и с концентрацией ПСА на исходном уровне в пределах 2.5-10.0 нг/мл (у мужчин в возрасте от 50 до 60 лет) и 3-10 нг/мл (у мужчин в возрасте старше 60 лет) результаты пункционной биопсии (первоначально обязательной по протоколу) для определения суммы баллов по шкале Глисона имелись в отношении 6706 пациентов. Рак предстательной железы в этом исследовании был диагностирован у 1517 пациентов. Большинство случаев выявляемого путем биопсии рака предстательной железы в обеих группах терапии были случаями низкозлокачественных опухолей (сумма баллов по шкале Глисона 5-6, 70%).
Частота случаев рака предстательной железы с суммой баллов по шкале Глисона 8-10 в группе препарата Аводарт™ (n=29, 0.9%) была выше, чем в группе плацебо (n=19, 0.6%) (p=0.15). На протяжении первых двух лет терапии показатели частоты случаев рака с суммой баллов по шкале Глисона 8-10 в группе препарата Аводарт™ (n=17, 0.5%) и в группе плацебо (n=17, 0.5%) были схожие. В течение следующих двух лет (год 3-год 4) частота случаев диагностированного рака предстательной железы с суммой баллов по шкале Глисона 8-10 в группе препарата Аводарт™ (n=12, 0.5%) была выше, чем в группе плацебо (n=1, <0.1%) (p=0.0035). Данные о результатах применения препарата Аводарт™ на протяжении более 4 лет у пациентов с риском развития рака предстательной железы отсутствуют. Процент пациентов с диагностированным раком предстательной железы с суммой баллов по шкале Глисона 8-10 был устойчивым на протяжении всех периодов исследования (годы 1-2, годы 3-4) в группе препарата Аводарт™ (0.5% в каждом периоде); вместе с тем, в группе плацебо процент пациентов с диагностированным раком предстательной железы с суммой баллов по шкале Глисона 8-10 на отрезке времени Год 3-Год 4 был ниже, чем на отрезке времени Год 1-Год 2 (<0.1% и 0.5% соответственно) (см. раздел «Особые указания»). Различия по показателю частоты случаев рака с суммой баллов по шкале Глисона 7-10 (p=0.81) отсутствовали.
В 4-летнем исследовании с участием пациентов с ДГПЖ (исследование CombAT), в котором проведение биопсии не было определено протоколом, а все диагнозы рака предстательной железы основывались на биопсии по показаниям, частота рака с оценкой 8-10 баллов по шкале Глисона была следующей:
- группа препарата Аводарт™ — n=8, 0.5%, группа тамсулозина — n=11, 0.7% и группа комбинированной терапии — n=5, 0.3%.
Связь между применением препарата Аводарт™ и высокозлокачественным раком предстательной железы не представляется очевидной.
Побочные эффекты препарата Аводарт
По данным клинических исследований Монотерапия Аводартом При применении наблюдали следующие побочные реакции по данным клинических исследований с частотой возникновения 1% по сравнению с плацебо
Побочная реакция | Частота возникновения на протяжении 1-го года лечения, % | Частота возникновения на протяжении 2-го года лечения, % | ||
Плацебо (n=2158) | Аводарт (n=2167) | Плацебо (n=1736) | Аводарт (n=1744) | |
| Импотенция | 3 | 6 | 1 | 2 |
| Изменение (снижение) либидо | 2 | 4 | ≤1 | ≤1 |
| Нарушение эякуляции | ≤1 | 2 | ≤1 | ≤1 |
| Гинекомастия* | ≤1 | 1 | ≤1 | 1 |
* включая болезненность и гипертрофию молочных желез.
По данным последующих двухлетних клинических исследований, профиль побочных эффектов препарата не изменился. Комбинированная терапия (Аводарт + тамсулозин) Следующие побочные реакции отмечали по данным клинических исследований с частотой возникновения 1% при сравнении комбинации Аводарта и тамсулозина и монотерапии этими препаратами
Побочная реакция | Частота возникновения на протяжении 1-го года лечения, % | Частота возникновения на протяжении 2-го года лечения, % | ||||
Аводарт+ тамсулозин (n=1610) | Аводарт (n=1623) | Тамсулозин (n=1611) | Аводарт+ тамсулозин (n=1424) | Аводарт (n=1457) | Тамсулозин (n=1468) | |
| Импотенция | 7% | 5% | 3% | 1% | 1% | ≤1% |
| Изменение (снижение) либидо | 5 | 4 | 3 | ≤1 | ≤1 | ≤1 |
| Нарушение эякуляции | 9 | 2 | 3 | ≤1 | ≤1 | ≤1 |
| Гинекомастия * | 2 | 2 | ≤1 | ≤1 | 1 | ≤1 |
| Головокружение | 1 | ≤1 | 1 | ≤1 | ≤1 | ≤1 |
* включая болезненность и гипертрофию молочных желез.
Данные постмаркетинговых исследований. Со стороны иммунной системы: очень редко — аллергические реакции, включая сыпь, зуд, крапивницу, локализованный отек и ангионевротический отек.
Медицинские интернет-конференции
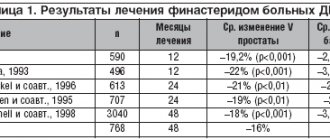
Длительное время ДГПЖ считалась хирургической патологией, и только начиная с 90-х годов, в общепринятые стандарты лечения вошла медикаментозная терапия [1]. Из современных препаратов, применяемых при консервативном лечении больных гиперплазией простаты, только ингибиторы 5-альфа-редуктазы способны предотвращать прогрессирование заболевания [2,3]. Однако до конца не изучен темп снижения клинических проявлений ДГПЖ под влиянием аводарта, а также сопутствующие этому морфологические изменения в ткани простаты.
Цель. Изучение клиникой картины и морфологического субстрата ДГПЖ под влиянием аводарта при коротких сроках лечения.
Материал и методы. Изучен материал, полученный от 51 больного с диагнозом ДГПЖ, которым проводилось лечение аводартом от 1 до 2 месяцев, в клинике урологии Клинической больницы им. С.Р. Миротворцева СГМУ. В зависимости от клинической эффективности применения аводарта пациенты были разделены на 2 группы: первая группа – пациенты отметившие субъективное улучшение – 20 человек (39%); вторая группа – пациенты, не отметившие улучшения – 31 человек (61%). Лечебный эффект оценивали на основании исследования уровня ПСА; ТРУЗИ простаты с определением размеров железы, остаточной мочи (ОМ) до и после консервативного лечения; урофлоуметрического контроля; морфологической верификации при помощи полифокальной биопсии простаты под трансректальным ультразвуковым контролем (по показаниям) и операционного материала полученного до и после консервативного лечения.
Результаты. По данным ТРУЗИ у пациентов первой группы после 1-2 месяцев лечения аводартом средний объем предстательной железы составил 56см3, что на 9см3 (13%) меньше, чем до начала лечения, тогда как во второй группе объем железы в динамике не изменился и по прежнему составлял 65см. Количество ОМ в первой группе снизилось с 84мл до 49мл, то есть на 42%, тогда как во второй всего на 6мл (6%). При контрольной урофлоуметрии и оценке максимальной скорости потока мочи (Qmax) у пациентов первой группы средний показатель Qmax — 10,1 мл/сек, возрос на 1,6 мл/сек (16%), во второй группе – на 0,1 мл/сек (1%). При оценке средней скорости потока мочи (Qср) отмечена схожая тенденция: прирост Qср в первой группе составил 1,1 мл/сек (26%), во второй увеличился на 0,8 мл/сек и составил 19%. При анализе уровня ПСА в данных группах было установлено снижение общего ПСА на 53% и 2% соответственно. Значения плотности ПСА в динамике имели схожую тенденцию, и в первой группе средний уровень составил 0,16нг/мл/см3, во второй – уже 0,2нг/мл/см3, а снижение его по сравнению с показателями до лечения составило 36% и 9% соответственно.
Анализ биопсийного материала 51 пациента в группе до лечения позволил установить, что наиболее часто признаки пролиферации и гиперплазии выявлялись со стороны железистого компонента, что позволило в 48% случаев поставить диагноз простой железистой формы. В 45,6% случаев был диагностирован железисто-фиброзный вариант, и только в 6,4% случаев встречался стромальный вариант ДГПЖ.
Из 51 пациента прошедшего курс лечения аводартом в течение 1-2 месяцев, до лечения диагноз ПИН был поставлен в 29 случаях, причем ПИНВС – у 14 больных и ПИННС – у 15. Через 1-2 месяца после лечения динамика морфологических изменений была разноплановой. В первой группе у 13 пациентов существенной морфологической перестройки не произошло, и у больных сохранялся тот морфологический тип ПИН, который диагностировался и до лечения. В 3 случаях у пациентов с ПИННС был диагностирован ПИНВС и у одного пациента с простой железистой формой появился ПИННС. А у 3-х пациентов отмечен явный лечебный патоморфоз: в 2-х ПИНВС и в 1-ом ПИННС, диагностированные до лечения, после проведенного курса не проявлялись. Стоит отметить, что у данных пациентов также отмечена явные улучшения по результатам лабораторно-инструментального обследования. Во второй группе у 14 пациентов существенной морфологической перестройки не наблюдалось. Однако в 13 случаях отмечена отрицательная динамика: в 5 случаях у пациентов с ПИННС был диагностирован ПИНВС, в 4 ПИН появился у пациентов с простой формой железистой гиперплазии, и особого внимания заслуживали 4 пациента, у которых диагностирован рак простаты, причем в 2-х случаях высокодифференцированная и в 2-х умереннодифференцированая аденокарцинома. И только в 4-х случаях наблюдался положительный лечебный патоморфоз: в 2-х случаях ПИННС и в одном случае ПИНВС, диагностированные до лечения, не проявлялись после, и в одном случае ПИНВС перешел в ПИННС. Обращало на себя внимание уменьшение выраженности воспалительной инфильтрации в первой группе, что может объяснять положительный клинический результат, тогда как во второй она была значительно выражена.
Выводы. Таким образом, сравнительный анализ морфологической картины простаты у пациентов после непродолжительного курса лечения аводартом позволил установить: пациенты имеющие более выраженную положительную клиническую динамику, а также существенные положительные лабораторно-инструментальные изменения являются объективным отражением лечебного патоморфоза ПИН у пациентов с доброкачественной гиперплазией простаты. В связи, с чем данной группе пациентов можно рекомендовать продолжить проведение консервативной терапии на более длительный срок под клинико-лабораторным контролем. Что позволит отдалить оперативное лечение, либо его избежать.
Пациентам не имеющие явной положительной или имеющие отрицательную клинико-лабораторную и инструментальную динамику целесообразно выполнение оперативного лечения, либо выполнение повторной биопсии в ранние сроки в связи с риском развития рака простаты.
Особые указания по применению препарата Аводарт
Дутастерид может абсорбироваться через кожу, поэтому женщины и дети должны избегать контакта с негерметичными капсулами. Если жидкость с капсулы попала на кожу, ее следует немедленно смыть водой с мылом. Влияние печеночной недостаточности на фармакокинетику дутастерида не изучено. Поскольку дутастерид интенсивно метаболизируется и его период полувыведения составляет 3–5 нед, препарат с осторожностью применяют при заболеваниях печени. Влияние на специфический антиген предстательной железы (PSA) и выявление рака предстательной железы. Перед началом курса лечения дутастеридом и периодически во время лечения следует проводить пальцевое ректальное обследование пациента и другие исследования для выявления рака предстательной железы. Концентрация PSA является важным компонентом скринингового метода для выявления рака предстательной железы. Обычно концентрация PSA в плазме крови 4 нг/мл (Hybritech) требует дальнейшего обследования и проведения биопсии простаты. Также следует учитывать, что исходный уровень PSA ≤4 нг/мл у пациентов, получающих дутастерид, не исключает возможности диагностирования у них рака простаты. Лечение Аводартом способно снижать уровень PSA в плазме крови при доброкачественной гиперплазии предстательной железы приблизительно на 50% через 6 мес даже при наличии рака предстательной железы. Хотя могут быть индивидуальные колебания, прогнозируется снижение PSA приблизительно на 50%, поскольку его отмечали во всем диапазоне исходных значений PSA (от 1,5 до 10 нг/мл). Для того чтобы интерпретировать значение PSA у мужчин, которые принимали Аводарт на протяжении 6 мес и более, значение PSA следует удваивать для сравнения с нормальными диапазонами PSA у мужчин, которые не лечились. Такая коррекция сохраняет чувствительность и специфичность PSA-теста и позволяет с помощью этого теста выявлять рак простаты. Любое стойкое повышение уровня PSA во время лечения Аводартом нуждается в тщательном изучении, включая решение о несоответствии лечения Аводартом. Общий уровень сывороточного PSA возвращается к исходному на протяжении 6 мес после прекращения лечения. Соотношение же свободного PSA и общего уровня PSA остается постоянным даже во время лечения Аводартом. Поэтому при использовании для диагностики рака предстательной железы процента свободного PSA у пациента, принимающего Аводарт, удваивать значение свободного PSA не следует. Фертильность Изучение влияния дутастерида в дозе 0,5 мг/сут на характеристики эякулята у 27 здоровых добровольцев на протяжении 52 нед лечения и 24 нед последующего наблюдения выявило снижение общего количества сперматозоидов, объема эякулята и подвижности сперматозоидов на 23; 26 и 18% по сравнению с изменениями в группе принимавших плацебо. Концентрация спермы и ее морфология остались без изменений. Через 24 нед последующего наблюдения средний процент изменений в общем количестве сперматозоидов в группе дутастерида остался на 23% ниже исходного уровня. В то время как средние значения для всех параметров спермы во все периоды оставались в пределах нормы и не отвечали определенным критериям для клинически значимых изменений (30%), у 2 пациентов из группы дутастерида отмечали снижение количества сперматозоидов более чем на 90% по сравнению с исходным уровнем на 52-й неделе лечения и частичным восстановлением их количества через 24 нед последующего наблюдения. Клиническая значимость влияния дутастерида на характеристики спермы для индивидуальной фертильности пациентов не известна. Период беременности и кормления грудью. Дутастерид противопоказан для применения у женщин. Применение дутастерида для лечения женщин не изучали, поскольку по данным доклинического изучения предположено, что снижение уровня циркулирующего дигидротестостерона может приводить к нарушению развития наружных половых органов у плода мужского пола. Дети. Применение противопоказано. Учитывая фармакокинетические и фармакодинамические свойства, дутастерид не влияет на скорость реакции при управлении транспортными средствами или работе с механизмами.
Аводарт, 90 шт., 0.5 мг, капсулы
Дутастерид всасывается через кожу, и поэтому женщины и дети должны избегать контакта с поврежденными капсулами. В случае контакта с поврежденными капсулами необходимо сразу промыть соответствующий участок кожи водой с мылом.
Нарушение функции печени.
В настоящее время нет данных по применению препарата Аводарт® у пациентов с нарушениями функции печени. В связи с тем, что дутастерид подвергается интенсивному метаболизму, а его T1/2 составляет 3–5 нед, необходимо соблюдать осторожность при лечении препаратом Аводарт® пациентов с нарушениями функции печени.
Сердечная недостаточность при комбинированном применении дутастерида и тамсулозина.
В двух 4-летних клинических исследованиях частота развития сердечной недостаточности была выше у пациентов, получавших комбинацию дутастерида и α1-блокатора, главным образом тамсулозина, чем у пациентов, не получавших комбинированного лечения. В этих двух исследованиях частота развития сердечной недостаточности оставалась низкой (≤1%) с некоторой вариабельностью между ними. Но в целом расхождений показателей частоты побочных эффектов со стороны ССС не отмечалось. Причинно-следственной связи между лечением дутастеридом (в качестве монотерапии или в виде комбинации с α1-блокатором) и развитием сердечной недостаточности не установлено.
Влияние на выявление простатспецифического антигена (ПСА) и рака предстательной железы (РПЖ).
У пациентов необходимо проводить пальцевое ректальное исследование, а также использовать другие методы исследования предстательной железы до начала лечения дутастеридом и периодически повторять их в процессе лечения для исключения развития РПЖ.
Определение концентрации ПСА в сыворотке является важным компонентом скрининга, направленного на выявление РПЖ. После 6-месячной терапии дутастеридом средний сывороточный уровень ПСА снижается примерно на 50%. Пациентам, принимающим дутастерид, должен быть определен новый базовый уровень ПСА после 6 мес терапии. В дальнейшем рекомендуется регулярно контролировать уровень ПСА.
Применение дутастерида не влияет на диагностическую ценность уровня ПСА как маркера РПЖ. Любое подтвержденное повышение уровня ПСА относительно наименьшего его значения при лечении дутастеридом может свидетельствовать о развитии РПЖ (в частности РПЖ с высокой степенью дифференцировки по шкале Глисона) или несоблюдении режима терапии дутастеридом и должно подвергаться тщательной оценке, даже если эти уровни ПСА остаются в пределах нормальных значений для данной возрастной категории пациентов, не принимающих ингибиторы 5α-редуктазы.
Уровень общего ПСА возвращается к исходному значению в течение 6 мес после отмены дутастерида.
Соотношение содержания свободного ПСА к общему остается постоянным даже на фоне терапии дутастеридом. Если определение процента содержания свободной фракции ПСА дополнительно используется для выявления РПЖ у мужчин, получающих дутастерид, коррекция этой величины не требуется.
Влияние длительного приема дутастерида на развитие рака грудных желез у мужчин.
Не обнаружено влияние длительного приема дутастерида на развитие рака грудных желез у мужчин.
РПЖ и опухоли высокой степени градации.
В 4-летнем исследовании (
REDUCE
) проводилось сравнение применения плацебо и дутастерида у 8231 добровольца в возрасте от 50 до 75 лет, с отрицательным результатом биопсии на наличие РПЖ и уровнем ПСА от 2,5 до 10 нг/мл при первичном обследовании.
В ходе исследования 6706 пациентам проводилась пункционная биопсия предстательной железы и на основании полученных результатов определялась степень злокачественности РПЖ по шкале Глисона. 1517 пациентам в ходе исследования был поставлен диагноз РПЖ. В большинстве случаев, как в группе дутастерида, так и в группе плацебо, был диагностирован высокодифференцированный РПЖ (сумма баллов по шкале Глисона — 5–6). Различия в количестве случаев РПЖ с оценкой 7–10 баллов по шкале Глисона в группе дутастерида и группе плацебо отсутствовали (р=0,81).
Через 4 года было отмечено больше случаев РПЖ с оценкой 8–10 баллов по шкале Глисона в группе дутастерида (n=29; 0,9%) по сравнению с группой плацебо (n=19; 0,6%; р=0,15). При оценке данных биопсии за 1–2-й год число пациентов с диагнозом РПЖ с оценкой 8–10 баллов по шкале Глисона было сравнимо в группах дутастерида (n=17; 0,5%) и плацебо (n=18; 0,5%). При оценке данных биопсии за 3–4-й год было диагностировано больше случаев РПЖ с оценкой 8–10 баллов по шкале Глисона в группе дутастерида (n=12; 0,5%) по сравнению с группой плацебо (n=1; <0,1%; р=0,0035). Процентное соотношение пациентов с диагнозом РПЖ с оценкой 8–10 баллов по шкале Глисона было стабильным в течение всех временных промежутков (за период 1–2 и 3–4 года) в группе дутастерида (0,5% в каждом периоде), в то время как в группе плацебо процент пациентов с диагнозом РПЖ с оценкой 8–10 баллов был ниже на протяжении 3–4-го года, чем в 1–2-й годы (<0,1% по сравнению с 0,5% соответственно).
В 4-летнем исследовании (CombAT
) пациентов с ДГПЖ, в котором проведение биопсии предстательной железы всем участникам не было определено протоколом и все диагнозы РПЖ основывались на биопсии по показаниям, РПЖ с оценкой 8–10 баллов по шкале Глисона был диагностирован у 8 пациентов (<0,5%) при приеме дутастерида, у 11 пациентов (<0,7%) при приеме тамсулозина и 5 пациентов (<0,3%) при комбинированной терапии дутастеридом и тамсулозином. Причинно-следственной связи между приемом дутастерида и развитием РПЖ высокой степени градации не установлено. Мужчины, принимающие дутастерид, должны регулярно проходить обследования в отношении оценки риска развития РПЖ, включая уровень ПСА.
Влияние на способность управлять транспортными средствами и работать с механизмами.
Прием дутастерида не влияет на вождение автомобиля или работу с механизмами.
Взаимодействия препарата Аводарт
Поскольку дутастерид метаболизируется изоферментом CYP 3A4, концентрация дутастерида в плазме крови может повышаться в присутствии ингибиторов CYP 3A4, а клиренс дутастерида снижается при одновременном применении с ингибиторами CYP 3A4 верапамилом (37%) и дилтиаземом (44%). Вместе с тем клиренс дутастерида не снижается при применении с другим антагонистом кальциевых каналов амлодипином. Снижение клиренса и соответствующее повышение действия дутастерида в присутствии ингибиторов CYP 3A4 не имеет большого клинического значения в связи с широким спектром безопасности препарата. In vitro изоферменты CYP 1A2, CYP 2C9, CYP2 C19 и CYP 2D6 не принимают участия в метаболизме дутастерида у человека, дутастерид не ингибирует ферменты системы цитохрома Р450 у человека, принимающие участие в метаболизме лекарственных средств. В исследованиях in vitro установлено, что дутастерид не вытесняет варфарин, диазепам или фенитоин из связи с белками плазмы крови, так же, как и эти компоненты не замещают дутастерид. Проведено изучение взаимодействия дутастерида с тамсулозином, теразоцином, варфарином, дигоксином и колестирамином. Клинически значимого взаимодействия не выявлено. Хотя специфических исследований по изучению взаимодействия с другими препаратами не проводили, около 90% всех пациентов в клинических исследованиях дутастерида получали другую сопутствующую терапию. Никаких клинически значимых побочных реакций не отмечено при одновременном применении дутастерида с антигиперлипидемическими препаратами, ингибиторами АПФ, блокаторами β-адренорецепторов, блокаторами кальциевых каналов, ГКС, диуретиками, НПВП, ингибиторами фосфодиэстеразы типа V и хинолоновыми антибиотиками. По данным исследования по изучению взаимодействия тамсулозина или теразоцина в комбинации с Аводартом на протяжении 2 нед никаких признаков фармакокинетического или фармакодинамического взаимодействия не выявлено.
Передозировка препарата Аводарт, симптомы и лечение
По данным клинических исследований, у волонтеров разовая доза дутастерида до 40 мг/сут (в 80 раз превышающая терапевтические) на протяжении 7 дней не вызывала нежелательных проявлений с учетом безопасности их применения. В клинических исследованиях применяли дозу дутастерида по 5 мг/сут на протяжении 6 мес без появления дополнительных побочных реакций по сравнению с применением дутастерида в дозе 0,5 мг/сут. Специфического антидота нет, поэтому в случае возможной передозировки проводится симптоматическая терапия.