Химические свойства
Вазопрессин в Википедии описан как антидиуретический гормон гипоталамуса, увеличивающий реабсорбцию жидкости почками, повышая концентрацию мочи и уменьшая ее объем.
Молекула вещества состоит из 9 аминокислот, у человека аминокислотная последовательность выглядит, как Cys-Tyr-Phe-Gln-Asn-Cys-Pro- Arg- Gly, остатки Cys1 и Cys6 соединены дисульфидной связью.
Гормон Вазопрессин синтезируется в организме в крупноклеточных нейронах гипоталамуса. Гормон, синтезированный в теле нейрона, с помощью аксонов перенаправляется к синапсам и накапливается в пресинаптических везикулах, откуда экскретируется в кровь, в момент, когда нейрон возбуждается нервным импульсом.
Чаще всего синтетический гормон выпускают в виде растворов для инъекционного или интраназального введения.
Фармакодинамика и фармакокинетика
Вазопрессин вступает во взаимодействие с V- и Vi-рецепторами, которые расположены на клетках гладкой мускулатуры сосудов, таким образом регулируя вазоконстрикцию. Возникает увеличение проницаемости эпителия собирательной трубки для воды, расположенной в почках и усиление процесса реабсорбции жидкости. Вещество вызывает рост объема циркулирующей в организме крови, гипонатриемию и понижение осмолярности.
Также средство способно повышать тонус гладкой мускулатуры внутренних органов, в частности желудочно-кишечного тракта, взаимодействуя с V1a-рецепторами. Это приводит к повышению сосудистого тонуса и увеличению периферического сопротивления сосудов. Артериальное давление повышается (лекарство сужает артериоллы). Гормон Вазопрессин обладает гемостатическим эффектом, спазмирует мелкие сосуды и капилляры, воздействует на фактор свертываемости крови Виллебранда, стимулирует агрегацию тромбоцитов.
Вещество оказывает влияние и на центральную нервную систему, принимает участие в регуляции агрессии и процессе запоминания. Учеными проводились опыты на мышах — прерийных полевках. В ходе данных исследований, воздействуя на вазопрессиновые рецепторы в мозге животных, мышей удалось сделать моногамными, верными одному партнеру. Таким образом удалось доказать, что вазопрессин (его AVPR1A) отвечает за социальное поведение животных, нахождение партнера и формирование у мужских особей отцовского инстинкта.
Препараты синтетического гормона назначают парентерально. При инъекционном или интраназальном введении вещества период полувыведения составляет около 20 минут. Метаболизм средства протекает в тканях печени и почек, где восстанавливаются дисульфидные связи и происходит дальнейшее расщепление пептидов. Незначительное количество вещества выделяется в неизменном виде с мочой.
Лечение центрального несахарного диабета
Сразу после установления диагноза ЦНД пациентам следует назначать постоянную заместительную терапию препаратами аргинин-вазопрессина – единственный эффективный способ лечения недостаточности продукции АДГ [19, 20]. Учитывая, как правило, хронический характер заболевания, основные требования к лекарственной терапии ЦНД следующие: легкая переносимость, удобство применения, отсутствие ограничения жизнедеятельности пациента, возможность индивидуального подбора дозы препарата и долгосрочная безопасность назначенных препаратов, низкий риск гипонатриемии, обусловленной чрезмерной задержкой жидкости.
Следует помнить, что немаловажную роль в достижении результата фармакотерапии ЦНД играет обучение пациента [3]. Во время терапии препаратами аргинин-вазопрессина пациенту необходимо избегать потребления избытка жидкости, следует ограничивать прием жидкости в объеме, необходимом для удовлетворения жажды. Потребления жидкости по любой другой причине следует избегать, поскольку, в отличие от лиц с нормальной секрецией АДГ, пациент с ЦНД не может быстро увеличивать количество выделяемой мочи в ответ на повышение потребления жидкости, что опасно задержкой жидкости и гипонатриемией. Считается, что диурез за сутки не должен снижаться ниже нормального уровня (15–30 мг/кг/сут) [25]. Также необходимо обучение пациентов распознаванию признаков неадекватной заместительной терапии.
На первых этапах (1912 г.) лечения ЦНД в качестве фармакологических средств пытались применять вытяжку (экстракт) из задней доли гипофиза крупного рогатого скота. Однако эти средства не нашли применения в терапии ЦНД в силу короткого периода полувыведения, недостаточного антидиуретического действия и побочных эффектов за счет влияния на другие органы-мишени для АДГ, в частности, сосудосуживающего действия [19, 26]. Работа по разработке эффективных и безопасных средств для лечения ЦНД, была продолжена и в 1954 г. осуществлен синтез человеческого аргинин-вазопрессина. Однако настоящим прорывом в терапии ЦНД стали пролонгированные синтетические аналоги пептида, синтезированные путем незначительных изменений молекулы нативного АДГ, лишенные указанных выше недостатков и обладающие качественно новыми фармакологическими свойствами [10, 11, 29].
Среди современных препаратов для замещения дефицита АДГ наибольшей антидиуретической активностью обладает 1-дезамино-8-D-аргинин-вазопрессин (десмопрессин). Его химическая структура отличается от молекулы природного АДГ двумя изменениями (дезаминированием 1-цистеина и заменой 8-L-аргинина на D-аргинин), что дает ему ряд терапевтических преимуществ, подтвержденных на практике [19, 32] (рис. 3).
Рис. 3. Структура вазопрессина и десмопрессина.
Основной фармакологический эффект десмопрессина – антидиуретическое действие – реализуется путем взаимодействия со специфическими мембранными V2-рецепторами, локализованными в почечных канальцах и отвечающими за реабсорбцию воды в почках. Способность десмопрессина активировать V2-рецепторы практически вдвое выше, чем у АДГ. В отличие от природного АДГ, благодаря замещению L-аргинина в положении 8 D-аргинином, десмопрессин избирательно активирует V2-рецепторы и не влияет на V1-рецепторы гладкомышечных клеток сосудов и внутренних органов. В силу этого отношение антидиуретической активности к прессорной у десмопрессина составляет примерно 2000:1 против 1:1 у природного пептида. Молекулу десмопрессина отличает устойчивость к разрушению. Дополнительное дезаминирование цистеина в 1-м положении не только повышает отношение антидиуретической активности пептида к прессорной, но и дает возможность гораздо более длительного антидиуретического действия – до 12 ч [19, 32].
Итак, по сравнению с природным вазопрессином антидиуретическое действие десмопрессина выражено в наибольшей степени как по силе, так и по продолжительности фармакологического эффекта, также важно, что препарат практически лишен прессорной активности.
В настоящее время представлены разнообразные лекарственные формы десмопрессина, которые восполняют дефицит АДГ при ЦНД и имеют доказанную эффективность и безопасность (табл. 2). Каждая форма имеет свои преимущества и недостатки, что позволяет на практике выбрать подход, основанный на индивидуальных особенностях клинического профиля пациентов [4, 10, 14, 23].
Таблица 2. Сравнительная характеристика различных лекарственных форм десмопрессина
| Лекарственная форма десмопрессина | Интраназальный спрей | Таблетированная пероральная форма (0,1 и 0,2 мг) | Таблетированная подъязычная форма (60, 120 и 240 мкг) |
| Начало действия | 15–30 мин | 1–2 ч | 15–45 мин |
| Клинически значимая концентрация в крови | 60 мин | 2–4 ч | 60 мин |
| Длительность действия | 8–24 ч | 8–12 ч | 8–12 ч |
| Способ применения | Интраназально | Препарат следует принимать после еды | Сублингвально, для рассасывания; не запивать таблетку жидкостью |
| Начальная доза препарата | 10 мкг 2 раза в сутки | 0,1 мг 1–3 раза в день | 60 мкг 3 раза в день |
| Средняя суточная доза | 10–40 мкг | 0,2–1,2 мг | 120–720 мкг |
Длительное время в качестве заместительной терапии ЦНД десмопрессин применялся интраназально [11]. Однако эта лекарственная форма не всегда обеспечивала стабильную эффективность антидиуретического эффекта на протяжении всех 24 ч. В частности, по данным клинических исследований, продолжительность действия после интраназального применения колеблется для дозы 20 мкг от 8 до 24 час., для дозы 5–10 мкг – от 4 до 18 час. [32]. Кроме того, высокая индивидуальная вариабельность действия этой формы десмопрессина может затруднять подбор дозы и повышает риск развития гипонатриемии [15]. Другим недостатком этой формы десмопрессина является то, что абсорбция может быть нарушена у пациентов с патологией слизистой носа, что, безусловно, ограничивает применение лекарственного средства в случае развития катаральных явлений или хронического ринита [3, 14]. Кроме того, интраназальное введение десмопрессина может вызывать побочные явления со стороны слизистой оболочки носовых путей. Следует помнить о противопоказаниях к интраназальному применению десмопрессина, которые включают аллергический ринит, заложенность носа, отек и рубцовые изменения слизистой носа, инфекции верхних дыхательных путей.
Следующим этапом в развитии фармакотерапии ЦНД стала разработка пероральной формы десмопрессина (Минирин), выпускаемого в таблетках по 0,1 и 0,2 мг. Доза Минирина подбирается индивидуально, составляя от 0,025 до 1 мг/сут при кратности приема 1–3 раза в сутки и не зависит от возраста и массы тела больного [10]. Однако и эта форма десмопрессина не лишена недостатков в связи с особенностями ее применения [13]. В частности, таблетки необходимо запивать водой, что не всегда возможно у некоторых пациентов. Вследствие быстрой деградации желудочно-кишечными дипептидазами, биодоступность этой формы десмопрессина достаточно низкая (0,16%). Поэтому прием с пищей снижает абсорбцию пероральной формы десмопрессина, в связи с чем препарат рекомендуется принимать натощак за 30–40 мин до или через 2 ч после еды, что не всегда удобно пациентам [11].
Развитие современной терапии ЦНД было направлено на оптимизацию уже существующих препаратов, а именно разработку новых способов введения десмопрессина при условии сохранения эффективности и безопасности, что позволяет улучшить качество жизни больных и сделать лечение более комфортным [12, 24]. С учетом в большинстве случаев хронического характера заболевания для получения необходимого терапевтического эффекта значение имеет не только эффективность десмопрессина, но и насколько та или иная форма удобна в применении пациентам.
Новые возможности лечения ЦНД появились с внедрением в клиническую практику десмопрессина в удобной сублингвальной форме – оральный лиофилизат десмопрессина (Минирин Мелт), выпускаемой в дозировках 60 и 120 мкг [1, 13, 16]. Большое количество дозировок препарата позволяет достаточно точно подбирать терапию, учитывая индивидуальные особенности каждого пациента с ЦНД. Сублингвальная форма десмопрессина быстро растворяется во рту; препарат обладает стабильной фармакокинетикой. Максимальная концентрация (Сmax) десмопрессина в плазме крови достигается в течение 0,5–2 ч после приема препарата и прямо пропорциональна величине принятой дозы: после приема 200, 400 и 800 мкг Cmax составляла 14, 30 и 65 пг/мл соответственно.
По данным фармакологических исследований, биодоступность десмопрессина при сублингвальном применении в дозах 200, 400 и 800 мкг составляет около 0,24%, 0,28%, 0,25% соответственно, что на 60% выше, чем в пероральной форме и достаточно, чтобы вызвать продолжительный антидиуретический эффект [12, 24]. Это дает возможность лечения больных ЦНД с использованием меньших доз по сравнению с таблетированной формой десмопрессина, что уменьшает риск развития гипонатриемии. В целом, риск гипонатриемии выше у лиц пожилого возраста, по-видимому, вследствие повышения чувствительности почечных канальцев к АДГ, нарушения осморегуляции, недостаточно выраженного чувства жажды и нарушения способности почек сохранять натрий [31]. Развитию данного осложнения способствует избыточное потребление жидкости.
Результаты клинических исследований свидетельствуют о меньшем риске развития гипонатриемии при применении сублингвальной формы десмопрессина по сравнению с интраназальным введением препарата [5, 14, 16]. Так же, как и таблетированная форма десмопрессина, сублингвальная форма не вызывает атрофии слизистой носа.
Эффективность и безопасность сублингвальной формы Минирина Мелт при ЦНД подтверждена международными и российскими исследованиями, в том числе и сравнительными с другими лекарственными формами десмопрессина, на основании которых были сделаны выводы о возможности применения данного препарата у пациентов с этой патологией гипоталамо-гипофизарной системы. Применение десмопрессина в сублингвальной форме обеспечивает длительный терапевтический эффект препарата: уменьшение объема выделяемой мочи и одновременное повышение осмоляльности мочи и снижение ОПК [12, 13, 15, 23, 24].
Для клинической практики интересны результаты мультицентрового открытого исследования Arima H. и соавт., которое состояло в изучении долгосрочной клинической эффективности и безопасности десмопрессина для сублингвального приема у пациентов с ЦНД [5]. Согласно дизайну исследования, пациентов с ЦНД, которые ранее получали интраназальный спрей десмопрессина, переводили на подъязычную форму десмопрессина; период наблюдения составил 1 год. В исследование было включено 20 пациентов с ЦНД (60% мужчин) в возрасте от 6 до 75 лет (средний возраст – 39,6±19,5 лет). Перевод пациентов с интраназальной формы на сублингвальную осуществляли в вечернее время (пациенты начинали лечение с дозы 60 мкг). Дальнейшая титрация дозы проводилась в зависимости от наступления терапевтического эффекта, для чего контролировали объем и осмоляльность мочи; суточную дозу снижали, если уровень натрия сыворотки крови составлял ≤136 ммоль/л. При отсутствии положительного эффекта доза препарата повышалась с шагом 60 мкг. Средняя суточная доза колебалась в пределах от 60–180 мкг, максимальная же доза в изучаемой группе составила 720 мкг (240 мкг 3 раза в сутки). Результаты исследования продемонстрировали долгосрочную клиническую эффективность и безопасность десмопрессина для сублингвального приема. Авторы считают использование десмопрессина для сублингвального приема удобным, безопасным и эффективным при длительном применении.
Накапливается положительный опыт применения десмопрессина для сублингвального приема у пациентов с ЦНД, развившимся в результате оперативных вмешательств по поводу различных опухолей мозга. Интересны и показательны результаты недавнего сравнительного исследования с участием пациентов с ЦНД после хирургического лечения опухолей мозга (n=51: 25 пациентов с краниофарингиомой, 21 – с герминомой, 3 – с глиомой и 2 – с аденомой гипофиза) [1]. Разовая доза перорального Минирина колебалась от 25 мкг до 200 мкг, суточная – от 25 до 600 мкг, кратность приема составляла от 1 до 4 раз в сутки. Согласно дизайну исследования, пациенты в течение 3 сут регистрировали количество выделенной мочи, время и дозу принимаемого Минирина. Далее пероральный Минирин заменяли на сублингвальный Минирин (из расчета 100 мкг перорального эквивалентно 60 мкг сублингвального). В течение 1 нед пациенты также отмечали в своем дневнике количество выделенной мочи, время приема и количество принимаемого сублингвального Минирина. В исследовании оценивалось предпочтение пациентов в отношении формы препарата, эффективность, безопасность, комплаентность и простота в использовании.
В результате сравнительного анализа было показано, что клиническая эффективность сублингвальной формы Минирина сопоставима с пероральной формой Минирина: суточный диурез при приеме пероральной формы составлял 1,5±0,4 л/сут, а на фоне приема подъязычной – 1,7±0,5 л/сут (p>0,05). Побочных эффектов применения подъязычной формы не отмечено.
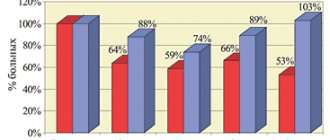
Как известно, наряду с эффективностью веским аргументом в пользу выбора того или иного препарата является удобство применения для пациента. По окончании исследования 60% больных предпочитали сублингвальную форму препарата; больным понравилось отсутствие необходимости запивать таблетку водой и регулировать прием препарата в зависимости от приема пищи. Причем предпочтение сублингвальной формы десмопрессина не коррелировало с возрастом пациентов, диагнозом, длительностью ЦНД.
Клинический опыт применения сублингвальной формы десмопрессина продолжает расти. Согласно национальному регистру больных ЦНД Дании, за период с 2007 по 2011 гг. три четверти пациентов с ЦНД получали сублингвальную форму, ни об одном серьезном побочном эффекте не сообщалось [16].
В клинической практике может возникнуть необходимость замены одной формы десмопрессина на другую, при этом следует воспользоваться следующим ориентировочным пересчетом дозы препарата (табл. 3). В частности, при переводе пациента с пероральной формы на сублингвальную 60 мкг сублингвальной соответствуют 100 мкг пероральной формы.
Таблица 3. Соотношения дозировок между различными формами препарата десмопрессин
| Таблетки подъязычные | Таблетки | Водный назальный спрей |
| 60 мкг | 0,1 мг | 5 мкг |
| 120 мкг | 0,2 мг | 10 мкг |
| 240 мкг | 0,4 мг | 20 мкг |
Минирин Мелт принимают сублингвально (оральный лиофилизат удерживают под языком до растворения без добавления воды). Доза лекарственного средства подбирается индивидуально и зависит от выраженности полиурии у пациента, не следует запивать таблетку жидкостью. Рекомендуемая стартовая доза составляет 60 мкг 3 раза в день, при необходимости ее изменяют в зависимости от наблюдаемого терапевтического эффекта, под контролем количества выпитой и выделенной жидкости. Как демонстрирует клинический опыт, оптимальной поддерживающей дозой является 60–120 мкг 3 раза в день сублингвально; рекомендуемая дневная доза находится в пределах 120–720 мкг [6, 12]. Контроль эффективности лечения ЦНД оценивается по клиническому состоянию пациента, объему и относительной плотности мочи. При появлении жалоб на отеки и выраженную головную боль, а также при изменении электролитов крови необходимо снижение дозы десмопрессина.
Противопоказаниями к назначению десмопрессина являются повышенная чувствительность к десмопрессину или другим компонентам препарата; привычная или психогенная полидипсия (с объемом мочеобразования 40 мл/кг/24 ч); сердечная недостаточность и другие состояния, требующие назначения мочегонных препаратов и детский возраст до 6 лет. Следует воздержаться от назначения препарата при гипонатриемии, нарушении функций почек (клиренс креатинина ниже 50 мл/мин). Не выявлено побочного действия на течение беременности, здоровье беременной, плода и новорожденного при приеме Минирина.
При выборе средства терапии ЦНД необходимо учитывать, что оригинальная сублингвальная форма выпуска десмопрессина (Минирин Мелт) доказала долгосрочную высокую эффективность и безопасность в рамках клинических исследований и в условиях реальной практики. Вместе с тем, в настоящее время в РФ зарегистрировано несколько генерических препаратов десмопрессина (в их числе Натива, Ноурем), в инструкциях по применению которых указываются ссылки на клинические исследования, проведенные с оригинальной сублингвальной формой десмопрессина. Отсутствие объективной информации о терапевтической биоэквивалентности оригинальных и генерических препаратов десмопрессина не позволяет клиницистам с полной уверенностью использовать генерики при ведении больного с дефицитом АДГ. Поэтому очевидна необходимость проведения сравнительных исследований терапевтической биоэквивалентности оригинальных и генерических препаратов десмопрессина.
Побочные действия
Во время лечения средством могут развиться:
- головные боли, головокружение, тошнота;
- боли и воспаление в месте введения препарата;
- абдоминальные спазмы;
- аллергические высыпания на коже, зуд, крапивница.
Также редко при использовании больших дозировок могут возникнуть:
- ишемия, желудочковая аритмия, инфаркт миокарда или кишечника;
- остановка сердца, некроз кожи.
Вазопрессин, инструкция по применению (Способ и дозировка)
Средство назначают внутримышечно, внутривенно или интраназально.
Вазопрессин, инструкция по применению
Для остановки кровотечений синтетический гормон применяют в дозировке: 100 МЕ вещества на 250 мл р-ра 5% глюкозы. Инфузию производят в центральную или периферическую вену с помощью дозатора. 0,3 МЕ в минуту вводят в течение получаса, затем повышают еще на 0,3 МЕ в минуту, каждые 30 минут, пока кровотечение не остановится. Максимальная дозировка составляет 0,9 МЕ в минуту. После остановки кровотечения дозировку следует снизить. Если во время проведения терапии средством развились какие-либо осложнения и нежелательные побочные реакции, то процедуру необходимо прервать.
Чтобы уменьшить риск развития побочных реакций, можно параллельно вводить пациенту нитроглицерин внутривенно (10 мкг в минуту, повышая каждые 15 минут на такое же количество).
При несахарном диабете синтетические аналоги Вазопрессина применяют согласно инструкции и рекомендациям лечащего врача. Чаще всего интраназально.
Центральный несахарный диабет: этиология, патогенез, клиническая картина и диагностика
В большинстве случаев недостаточность синтеза или секреции АДГ – это дефицит нейросекреторных клеток, формирующих нейрогипофиз. Этиологические факторы ЦНД достаточно разнообразны (рис. 2). ЦНД может иметь генетическое происхождение, менее 5% случаев заболевания связано с наследственными формами [7, 33]. Ведущим фактором в возникновении органической формы заболевания, особенно в детском возрасте, является инфекция [4]. Частыми причинами ЦНС выступают супраселлярные и интраселлярные опухоли, травмы черепа. Почти у половины детей и трети взрослых больных развитие ЦНД связано с наличием первичной или метастатической опухоли в гипоталамо-гипофизарной области (например, рак легких, молочной железы). Заболевание может возникать и в результате хирургического или лучевого вмешательство по поводу опухолей в гипоталамо-гипофизарной области; другая частая причина заболевания у взрослых (17% случаев) – травма ЦНС (травма головы, глазницы, переломы костей черепа) [20, 21, 26]. Кроме того, ЦНД может проявляться в остром постхирургическом, посттравматическом периоде, как следствие отека вокруг аксонов, вазопрессинсодержащих нейронов. В зависимости от анатомической локализации повреждения ЦНД может быть транзиторным или постоянным [26, 33]. В частности, в случае локализации патологического процесса над срединным возвышением с вовлечением вазопрессинсинтезируемых клеток супраоптического и паравентрикулярного ядер, функция последних необратимо утрачивается. Если же местоположение патологического процесса ниже указанной структуры, то нарушение водного баланса нередко оказывается транзиторным [19, 21].
Рис. 2. Причины центрального несахарного диабета (ЦНД)
В последние годы показано, что причиной ЦНД может быть аутоиммунный процесс (наличие антител к нейронам гипоталамуса, синтезирующим АДГ, реже – к самому пептиду). Лимфоцитарный инфундибуло-нейрогипофизит может объяснить ЦНД примерно у половины пациентов с идиопатической формой заболевания. Другой причиной идиопатического ЦНД может являться субклиническая нейроинфекция или начальный рост опухолей гипоталамо-гипофизарной области, что требует проведения повторных инструментальных методов исследования [19, 20].
Среди более редких причин ЦНД необходимо отметить системные инфильтративные заболевания (саркоидоз, гистиоцитоз, туберкулез), сосудистую патологию (центральные аневризмы, тромбоз или кровоизлияние, послеродовый некроз гипофиза) и гемобластозы (лейкоз, лимфогранулематоз и др.).
Стоит добавить, что ЦНД может быть генетическим и приобретенным, при этом доля семейных форм заболевания составляет менее 5%. В частности, синдром DIDMOAD, или синдром Вольфрама, при котором дефицит АДГ развивается вследствие аплазии нейросекреторных клеток [4, 26].
Под названием «несахарный диабет» объединяют заболевания с разной этиологией. В противоположность ЦНД причиной нефрогенного несахарного диабета (ННД) может быть нарушение чувствительности почек к АДГ. ННД наблюдается как при врожденной, наследственной неспособности почек (обычно сцеплена с полом, экспрессируется только у мужчин) отвечать на воздействие АДГ, так и при некоторых приобретенных состояниях, сопровождающихся невосприимчивостью почечных канальцев к гормону [19, 20]. Несахарный диабет беременных развивается в одном из 30 000 случаев. Это менее частый тип НД, возникающий в результате разрушения эндогенного вазопрессина аргининаминопептидазой плаценты. Наблюдается эта форма только в период беременности, чаще в середине или в конце периода, и носит название гестационного НД [19].
Клиническая картина у больных с ЦНД складывается из симптоматики, обусловленной дефицитом АДГ. Манифестация заболевания, как правило, возникает при значительном снижении секреторной активности нейрогипофиза (на 80–90%). Основным проявлением является патологически повышенное выделение разведенной мочи (гипотоническая полиурия – превышающая 2 л/м2/сут или 40–50 мл/кг/сут.) Недостаточность АДГ бывает полной или частичной, что определяет выраженность полиурии. Чаще объем мочи увеличивается до 5–6 л, хотя нередко достигает 10–12 л, что требует и днем, и ночью, практически каждый час мочеиспускания [19, 20]. У детей первым симптомом заболевания обычно является ночное недержание мочи, нередко наблюдается и дневное недержание мочи [4]. Гиперосмоляльность плазмы (>300 мосм/л), обусловленная выраженной полиурией, стимулирует неукротимую жажду (полидипсию), не прекращающуюся и ночью. Больные выпивают большие количества жидкости, предпочитая охлажденные напитки. Нередко наблюдается уменьшение пото- и слюноотделения.
Даже в тех случаях, когда полиурия полностью компенсирована обильным питьем, выделение слюны и пищеварительных соков снижается, что приводит к ухудшению аппетита. Из-за систематического употребления больших количеств жидкости могут наблюдаться нарушения со стороны ЖКТ: растяжение и опущение желудка, нередки запоры. Характерны психические и эмоциональные нарушения – головные боли, бессонница, эмоциональная неуравновешенность вплоть до психозов, снижение умственной активности. В связи с полиурией и полидипсией появляется бессонница, чему сопутствуют физическая и психическая астенизация. Без адекватного восполнения выделяемой жидкости при практически не снижающемся большом диурезе дегидратация становится выраженной. Развивается коллапс и понижается фильтрационная способность почек. Быстро падает масса тела пациента, наступает сгущение крови.
В клиническом плане важно помнить, что течение ЦНД может осложниться другими гипоталамо-гипофизарными нарушениями, равно как последние (синдром Шиена, акромегалия и др.) могут включать на определенном этапе их развития проявления недостатка секреции АДГ.
Успех лечения и прогноз у пациентов с ЦНД напрямую зависят от своевременной постановки диагноза, основанной на анализе патогенетических механизмов, правильного выбора диагностических методов и назначения эффективного лечения. В основе выбора тактики лечения должен быть индивидуальный подход к фармакотерапии в каждом конкретном случае [28]. В типичных случаях диагноз ЦНД не представляет трудностей. Его подтверждением служит выявление гипотонической полиурии, т.е. выделение мочи более 2 л/м2, или более 40 мл/кг в сутки у старших детей и взрослых с низкой относительной плотностью (<1005–1010 г/л) или осмоляльностью мочи менее 300 мОсм/кг в наиболее концентрированной порции; осмоляльности плазмы более 290 мОсм/кг [18, 19]. Часто выявляют гипернатриемию.
В клинической практике наиболее успешно используется дифференциально-диагностический тест с сухоядением (при исключении жидкости из пищи и увеличении осмоляльности плазмы удельный вес мочи при ЦНД остается низким), который позволяет дифференцировать ЦНД от первичной полидипсии, когда нет изменений секреции АДГ и чувствительности к нему [3, 6]. Тест с десмопрессином проводится для дифференциальной диагностики ЦНД и НДД [4].
Определенную помощь в диагностике может дать проба Зимницкого. Пробу следует оценивать с учетом возможных экстраренальных потерь. При сохраненной способности почек к осмотическому разведению и концентрированию мочи отмечаются:
- значительные колебания объема мочи в отдельных порциях (50–250 мл);
- максимальная относительная плотность (ОПМ), характеризующая способность почек концентрировать мочу, должна быть не ниже 1025 г/л;
- минимальная ОПМ, отражающая способность почек к осмотическому разведению мочи, у здорового человека должна быть ниже осмотической концентрации (осмоляльности) безбелковой плазмы, равной 1010–1012, и обычно составляет 1003–1006;
- значительные колебания ОПМ: разница между максимальными и минимальными показателями должна составлять не менее 12–16 ед. (например, от 1006 до 1020 или от 1010 до 1026 и т. д.);
- значительные суточные колебания ОПМ связаны с сохраненной способностью почек то концентрировать, то разводить мочу в зависимости от постоянно меняющихся потребностей организма;
- преобладание (примерно двукратное) дневного диуреза над ночным.
С целью выявления и последующего специализированного лечения патологии, являющейся причиной ЦНД, используются и инструментальные методы. Проведение МРТ головного мозга, имеющей ряд преимуществ по сравнению с другими методами визуализации, необходимо для исключения органической природы заболевания, составляющей примерно 40% случаев ЦНД. Отличительная особенность – отсутствие изображения нейрогипофиза или визуализация более тусклого свечения вследствие сниженного синтеза АДГ при центральной форме заболевания [30]. Следует помнить, что манифестация ЦНД, обусловленного патологией гипоталамо-гипофизарной области, нередко может на несколько лет опережать выявление каких-либо образований в ней. В этой связи необходим регулярный МРТ контроль у пациентов с неустановленной причиной заболевания.