Главная | О нас | Доставка | Рекламодателям | Войти | Регистрация
Доставка в воскресенье и праздничные дни не работает!
- Лекарства
- БАДыВитамины
- Категории от А до Я
- Бренды от А до Я
- Продукты от А до Я
- Медтехника
- Красота
- Ребенок
- Уход
- Изделия мед. назначения
- Травы и фито-чаи
- Лечебное питание
- Путешествие
- Изготовление лекарствАкции
Аптека онлайн, это лучшая аптека алматы, доставляющая лекарства в алматы. Интернет аптека или онлайн аптека оказывает следующие виды услуг: доставка лекарств, лекарства на дом. Интернет аптека алматы или аптека алматы онлайн осуществляет доставка лекарств на дом, а так же доставка лекарств на дом алматы.
Моя корзина
Apteka84.kz — интернет-аптека, предлагает своим клиентам лекарственные средства, лечебную и декоративную косметику, биологически активные пищевые добавки, витамины, детское питание, интим товары для взрослых, медицинскую технику и тысячи других медицинских и косметических изделий по низким ценам. Все данные, представленные на сайте Apteka84.kz, имеют исключительно информационный характер и не являются заменой профессиональной медицинской помощи. Apteka84.kz настоятельно рекомендует внимательно читать инструкцию по применению, находящуюся в каждой упаковке лекарственных и других средств. Если в настоящий момент у вас имеются те или иные симптомы заболевания, вам следует обратиться за помощью к врачу. Вы обязательно должны сообщать врачу или фармацевту обо всех лекарственных средствах, которые вы принимаете. Если вы чувствуете, что вам требуется дополнительная помощь, пожалуйста, проконсультируйтесь с Вашим местным фармацевтом или свяжитесь с нашим терапевтом в режиме он-лайн или по телефону.
© 2022 Аптека 84.
Натрия хлорид (Sodium chloride)
При проведении любой инфузии необходимо наблюдать за состоянием пациента, за клиническими и биологическими показателями, особенно важно оценивать электролиты плазмы. В организме детей из-за незрелости функции почек может замедляться экскреция натрия. Поэтому у таких пациентов повторные инфузии следует проводить только после определения концентрации натрия в плазме.
Реакции гиперчувствительности
Имеются данные о развитии на фоне применения препарата реакций гиперчувствительности или инфузионных реакций, в том числе гипотензии, пирексии, тремора, озноба, крапивницы, сыпи и зуда. При появлении реакций гиперчувствительности или инфузионных реакций, инфузию следует немедленно прекратить и принять необходимые терапевтические меры по показаниям.
Риск гиперволемии и (или) перегрузки растворенными веществами и нарушений баланса электролитов
В зависимости от объема и скорости инфузии на фоне внутривенного введения препарата могут развиваться следующие состояния:
-гиперволемия и (или) перегрузка растворенными веществами, приводящие к гипергидратации и, например, к застойным явлениям, в том числе центральному и периферическому отеку;
-клинически значимые нарушения электролитного и кислотно-щелочного баланса.
Применение у пациентов с почечной недостаточностью
У пациентов с почечной недостаточностью препарат следует применять с особой осторожностью или не применять совсем. Применение препарата у таких пациентов может привести к задержке натрия.
Применять только прозрачный раствор, без видимых включений и, если упаковка не повреждена. Вводить непосредственно после подключения к инфузионной системе. Раствор следует вводить с применением стерильного оборудования с соблюдением правил асептики и антисептики. Во избежание попадания воздуха в инфузионную систему ее следует заполнить раствором.
Как и для всех парентеральных растворов, совместимость добавляемых веществ с раствором должна определяться перед растворением.
Не должны применяться с раствором натрия хлорида 0,9% препараты, известные как несовместимые с ним. Определять совместимость добавляемых лекарственных веществ с раствором натрия хлорида 0,9% должен врач, проверив возможное изменение окраски и/или появления осадка, нерастворимых комплексов или кристаллов. Перед добавлением необходимо определить, является ли добавляемое вещество растворимым и стабильным в воде при уровне pH, что и у раствора натрия хлорида 0,9%. При добавлении препарата необходимо определить изотоничность полученного раствора до введения. Перед добавлением в раствор препаратов их необходимо тщательно перемешать с соблюдением правил асептики.
Приготовленный раствор следует ввести сразу после приготовления, не хранить!
Добавление других препаратов или нарушение техники введения может вызвать лихорадку вследствие возможного попадания в организм пирогенов. В случае развития нежелательных реакций, необходимо немедленно прекратить введение раствора.
При значительном обезвоживании, при невозможности внутривенного введения препарат вводят подкожно или ректально.
Хлорид натрия — важнейший химический реактив
Хлорид натрия составляет основу поваренной соли, самой популярной приправы к пище. Кроме этого, натриевая соль соляной кислоты миллионами тонн потребляется промышленностью для различных целей.
Свойства хлорида натрия
NaCl представляет собой кристаллы с кубической ионной решеткой. Кристаллы без цвета и запаха, с четко выраженным соленым вкусом. Хлористый натрий водорастворим, не гигроскопичен. Растворяется в аммиаке, этиловом и метиловом спирте, муравьиной кислоте, глицерине, этиленгликоле. Не растворяется в ацетоне, соляной кислоте, диэтиловом эфире.
Водный раствор хлорида натрия замерзает при температуре ниже нуля. Благодаря этому свойству химреактив довольно долго использовался в качестве антигололедного средства на дорогах и тротуарах (сейчас этот способ считается экологически вредным и применяется все реже). На этом же свойстве основано применение смеси мелко наколотого льда и поваренной соли в качестве эффективного и простого охладителя, способного понизить температуру смеси на пару десятков градусов.
Хлорид натрия в природе и жизни человека
NaCl очень важен для человека: он необходим нам для усвоения питательных веществ в процессе пищеварения; наша кровь в немалой степени состоит из солевого раствора; хлорид натрия входит в число важнейших источников минерального сырья для химической промышленности.
В природе хлористый натрий встречается в морской воде, соленых озерах, в соляных подземных водах, в ископаемом виде (галит, каменная соль). Галит — это минеральная форма NaCl. Иногда галит называют каменной солью, но это неверно. Каменная соль — это осадочная порода, содержащая 90% галита и примеси железа, гипса, магнезита, талька, битумов, соединений калия, кальция, магния, йода, брома, бора. Каждое месторождение каменной соли имеет свой уникальный состав.
Морская соль, получаемая выпариванием морской воды, содержит больше жизненно важных для человека примесей химических элементов, минералов и солей, чем каменная соль. В ней только 77,8% хлористого натрия. Она имеет горьковатый вкус, используется, преимущественно, в медицине и кулинарии.
Применение NaCl
— Химреактив применяется для производства более полутора тысяч веществ и материалов, начиная от металлического натрия и хлора и кончая содой, соляной кислотой, гидроксидом натрия, гербицидами для сельского хозяйства.
— Поваренная соль — готовый продукт, на 97 и более процентов состоящий из NaCl, используется в пищевой промышленности. Чем выше содержание хлорида натрия, тем выше сорт соли. Выпускаются также специализированные сорта с добавками микроэлементов, например, иодированная соль. Пищевая соль применяется как приправа в пищу, в качестве консерванта.
— В промышленной и полупромышленной водоподготовке для регенерации ионообменных смол в натрий-катионитовых фильтрах.
— Растворы хлорида натрия востребованы в медицине для приготовления и разведения лекарственных средств, для восстановления водно-солевого баланса организма, при кровотечениях, в качестве антидота при отравлении нитратом серебра, как антибактериальное средство для обработки ран, для некоторых других целей.
— В зоологии — для добавки в рацион животных.
Магазин «ПраймКемикалсГрупп» предлагает по хорошей цене купить поваренную соль оптом и в розницу. Также у нас широко представлены другие реактивы для лабораторных исследований и промышленности, лабораторная посуда и приборы.
Гидролиз
Гидролиз (греч. hydor — вода и lysis — разрушение) — процесс расщепления молекул сложных химических веществ за счет реакции с молекулами воды.
В химии, как и в жизни, разрушается чаще всего нестойкое и слабое (стойкое и сильное выдерживает удар). Запомните, что гидролиз (вода) разрушает «слабое» — это правило вам очень пригодится.
Любая соль состоит из остатка основания и кислоты. Абсолютно любая:
- NaCl — производное основания NaOH и кислоты HCl
- KNO3 — производное основания KOH и кислоты HNO3
- CuSO4 — производное основания Cu(OH)2 и кислоты H2SO4
- Al3PO4 — производное основания Al(OH)3 и кислоты H3PO4
- Ca(NO2)2 — производное основания Ca(OH)2 и кислоты HNO2
Чтобы успешно решать задания по теме гидролиза и писать реакции, вам следует запомнить, какие основания и кислоты являются слабыми, а какие — сильными.
При изучении гидролиза я рекомендую ученикам сохранить на гаджет схему, которую вы видите ниже. Для того, чтобы приобрести нужный опыт — она незаменима. Пользуйтесь ей как можно чаще, подглядывайте в нее и она незаметно окажется в вашем интеллектуальном составляющем 
По катиону, по аниону или нет гидролиза?
Итак, если в состав соли входит остаток сильного основания и остаток сильной кислоты — гидролиза не происходит. Примеры: NaCl, KBr, CaSO4. Также гидролиза не происходит, если соль нерастворима (вне зависимости от того, чем она образована): AlPO4, FeSO3, CaSO3.
Если в состав соли входит остаток слабого основания и остаток сильной кислоты, то гидролиз идет по катиону. Помните, что гидролиз разрушает слабое, в данном случае — катион. Примеры: AlCl3, MgBr2, Cr2SO4, NH4NO3.
Катион NH4+ и его основание NH4OH , несмотря на растворимость, является слабым, поэтому гидролиз будет идти по катиону в соли NH4Cl. Замечу также, что Ca(OH)2 считается растворимым основанием, поэтому гидролиза соли CaCl2 не происходит.
Если в состав соли входит остаток сильного основания и остаток слабой кислоты, то гидролиз идет по аниону. Примеры: K3PO4, NaNO2, Ca(OCl)2, Ba(CH3COO)2, Li2SiO3.
Если соль образована остатком слабого основания и слабой кислоты, то гидролиз идет и по катиону, и по аниону. Примеры: Mg(NO2)2, Al2S3, Cr2(SO3)3, CH3COONH4.
Самостоятельно определите тип гидролиза для CaI2, Li2SiO3, Ba(NO2)2, CuBr2, Zn(H2PO4)2. Ниже вы найдете решение.
Среда раствора
Среда раствора может быть нейтральной, кислой или щелочной. Определяется типом гидролиза. Некоторые задания могут быть построены так, что, увидев соль, вы должны будете определить ее тип раствора.
Обрадую вас: если вы усвоили тему гидролиза, сделать это проще простого. В случае, когда гидролиз не идет или идет и по катиону, и по аниону среда раствора — нейтральная.
Если гидролиз идет по катиону (разрушается остаток основания) среда — кислая, если гидролиз идет по аниону (разрушается остаток кислоты), то среда раствора будет щелочная. Изучите примеры.
Однако замечу, что в дигидрофосфатах, гидросульфитах и гидросульфатах среда всегда кислая из-за особенностей диссоциации. Примеры: NH4H2PO4, LiHSO4. В гидрофосфатах среда щелочная из-за того, что константа диссоциации по третьей ступени меньше, чем константа гидролиза. Примеры: K2HPO4, Na2HPO4.
Попробуйте определить среду раствора для соединений из самостоятельного задания, которое вы только что решили. Ниже будет располагаться решение.
С целью запутать в заданиях часто бывают даны синонимы. Так «среду раствора» могут заменить водородным показателем pH.
Запомните, что кислая среда характеризуется pH 7.
Например, в соли CaCl2 среда раствора будет нейтральной (pH=7), а в растворе AlCl3 — кислой (pH
Индикаторы (лат. indicator — указатель)
Индикатор — вещество, используемое в химии для определения среды раствора. В зависимости от среды раствора индикатор способен менять его цвет, что наглядно отражает характер среды в определенный момент времени.
Наиболее известные и широко применяемые индикаторы: лакмус, фенолфталеиновый и метиловый оранжевый. В зависимости от среды раствора их окраска меняется, что отражает приведенная ниже таблица.
Для тех, кто обладает хорошей зрительной памятью, будет несложно запомнить эту схему. Но что делать аудиалам и кинестетикам?  От волнения на экзамене такая таблица легко может раствориться и перепутаться в океане мыслей, поэтому своим ученикам я рекомендую запомнить индикаторы по стихам.
От волнения на экзамене такая таблица легко может раствориться и перепутаться в океане мыслей, поэтому своим ученикам я рекомендую запомнить индикаторы по стихам.
Только представьте, как приятно будет прочитать стих на экзамене, и убедиться в его безошибочности. Это придаст уверенности и поднимет настроение 
Лакмус Индикатор лакмус красный Кислоту укажет ясно. Индикатор лакмус синий — Щелочь здесь, не будь разиней! Когда ж нейтральная среда, Он фиолетовый всегда.
Фенолфталеин Фенолфталеиновый В щелочах малиновый Несмотря на это — В кислотах он без цвета.
Метиловый оранжевый От щелочи я желт как в лихорадке Я розовею от кислот, как от стыда И я бросаюсь в воду без оглядки — Здесь я оранжевый практически всегда!
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию
.
1.4.7. Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная.
Для того, чтобы понять, что такое гидролиз солей, вспомним для начала, как диссоциируют кислоты и щелочи.
Общим между всеми кислотами является то, что при их диссоциации обязательно образуются катионы водорода (Н+), при диссоциации же всех щелочей всегда образуются гидроксид-ионы (ОН−).
В связи с этим, если в растворе, по тем или иным причинам, больше ионов Н+ говорят, что раствор имеет кислую реакцию среды, если ОН− — щелочную реакцию среды.
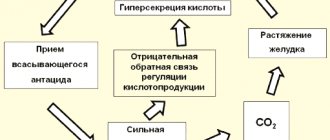
Если с кислотами и щелочами все понятно, то какая же реакция среды будет в растворах солей?
На первый взгляд, она всегда должна быть нейтральной. И правда же, откуда, например, в растворе сульфида натрия взяться избытку катионов водорода или гидроксид-ионов. Сам сульфид натрия при диссоциации не образует ионов ни одного, ни другого типа:
Na2S = 2Na+ + S2-
Тем не менее, если бы перед вами оказались, к примеру, водные растворы сульфида натрия, хлорида натрия, нитрата цинка и электронный pH-метр (цифровой прибор для определения кислотности среды) вы бы обнаружили необычное явление. Прибор показал бы вам, что рН раствора сульфида натрия больше 7, т.е. в нем явный избыток гидроксид-ионов. Среда раствора хлорида натрия оказалась бы нейтральной (pH = 7), а раствора Zn(NO3)2 кислой.
Единственное, что соответствует нашим ожиданиям – это среда раствора хлорида натрия. Она оказалась нейтральной, как и предполагалось.
Но откуда же взялся избыток гидроксид-ионов в растворе сульфида натрия, и катионов-водорода в растворе нитрата цинка?
Попробуем разобраться. Для этого нам нужно усвоить следующие теоретические моменты.
Любую соль можно представить как продукт взаимодействия кислоты и основания. Кислоты и основания делятся на сильные и слабые. Напомним, что сильными называют те кислоты, и основания, степень диссоциации, которых близка к 100%.
примечание: сернистую (H2SO3) и фосфорную (H3PO4) чаще относят к кислотам средней силы, но при рассмотрении заданий по гидролизу нужно относить их к слабым.
Кислотные остатки слабых кислот, способны обратимо взаимодействовать с молекулами воды, отрывая от них катионы водорода H+. Например, сульфид-ион, являясь кислотным остатком слабой сероводородной кислоты, взаимодействует с ней следующим образом:
S2- + H2O ↔ HS− + OH−
HS−+ H2O ↔ H2S + OH−
Как можно видеть, в результате такого взаимодействия образуется избыток гидроксид-ионов, отвечающий за щелочную реакцию среды. То есть кислотные остатки слабых кислот увеличивают щелочность среды. В случае растворов солей содержащих такие кислотные остатки говорят, что для них наблюдается гидролиз по аниону.
Кислотные остатки сильных кислот, в отличие от слабых, с водой не взаимодействуют. То есть они не оказывают влияния на pH водного раствора. Например, хлорид-ион, являясь кислотным остатком сильной соляной кислоты, с водой не реагирует:
То есть, хлорид-ионы, не влияют на pН раствора.
Из катионов металлов, так же с водой способны взаимодействовать только те, которым соответствуют слабые основания. Например, катион Zn2+, которому соответствует слабое основание гидроксид цинка. В водных растворах солей цинка протекают процессы:
Zn2+ + H2O ↔ Zn(OH) + + H+
Zn(OH) + + H2O ↔ Zn(OH)+ + H+
Как можно видеть из уравнений выше, в результате взаимодействия катионов цинка с водой, в растворе накапливаются катионы водорода, повышающие кислотность среды, то есть понижающие pH. Если в состав соли, входят катионы, которым соответствуют слабые основания, в этом случае говорят что соль гидролизуется по катиону.
Катионы металлов, которым соответствуют сильные основания, с водой не взаимодействуют. Например, катиону Na+ соответствует сильное основание – гидроксид натрия. Поэтому ионы натрия с водой не реагируют и никак не влияют на pH раствора.
Таким образом, исходя из вышесказанного соли можно разделить на 4 типа, а именно, образованные:
1) сильным основанием и сильной кислотой,
Такие соли не содержат ни кислотных остатков, ни катионов металлов, взаимодействующих с водой, т.е. способных повлиять на pH водного раствора. Растворы таких солей имеют нейтральную реакцию среды. Про такие соли говорят, что они не подвергаются гидролизу.
Примеры: Ba(NO3)2, KCl, Li2SO4 и т.д.
2) сильным основанием и слабой кислотой
В растворах таких солей, с водой реагируют только кислотные остатки. Среда водных растворов таких солей щелочная, в отношении солей такого типа говорят, что они гидролизуются по аниону
Примеры: NaF, K2CO3, Li2S и т.д.
3) слабым основанием и сильной кислотой
У таких солей с водой реагируют катионы, а кислотные остатки не реагируют – гидролиз соли по катиону, среда кислая.
Примеры: Zn(NO3)2, Fe2(SO4)3, CuSO4 и т.д.
4) слабым основанием и слабой кислотой.
С водой реагируют как катионы, так и анионы кислотных остатков. Гидролиз солей такого рода идет и по катиону, и по аниону. Нередко такие соли подвергаются необратимому гидролизу.
Что же значит то, что они необратимо гидролизуются?
Поскольку в данном случае с водой реагируют и катионы металла (или NH4+) и анионы кислотного остатка, в раcтворе одновременно возникают и ионы H+, и ионы OH− , которые образуют крайне малодиссоциирующее вещество – воду (H2O).
Это, в свою очередь, приводит к тому, что соли образованные кислотными остатками слабых оснований и слабых кислот не могут быть получены обменными реакциями, а только твердофазным синтезом, либо и вовсе не могут быть получены. Например, при смешении раствора нитрата алюминия с раствором сульфида натрия, вместо ожидаемой реакции:
2Al(NO3)3 + 3Na2S = Al2S3 + 6NaNO3 ( − так реакция не протекает!)
Наблюдается следующая реакция:
2Al(NO3)3 + 3Na2S + 6H2O= 2Al(OH)3↓+ 3H2S↑ + 6NaNO3
Тем не менее, сульфид алюминия без проблем может быть получен сплавлением порошка алюминия с серой:
2Al + 3S = Al2S3
При внесении сульфида алюминия в воду, он также как и при попытке его получения в водном растворе, подвергается необратимому гидролизу.
Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑
Раздел: Теория для подготовки к ЕГЭ Автор: С.И. Широкопояс
157 320
Синонимы: хлористый натрий, поваренная соль.
Свойства.
Белые кубические кристаллы или белый кристаллический порошок, без запаха, соленого вкуса, растворим в трех частях воды (растворимость при 20°С — 36,0; при 100°С — 39,1), слабо растворим в глицерине и метаноле. Растворы стерилизуют в автоклаве при температуре 120°С в течение 20 минут.
Форма выпуска. Для лечебных целей используют выпускаемые промышленностью таблетки по 0,9 г или порошок натрия хлорида, из которых готовят на дистиллированной воде стерильные гипертонические растворы в 5, 10 и 20 % концентрации. Выпускается также в форме 0,9 % стерильного раствора в ампулах по 5, 10 мл и флаконах по 100, 200, 250, 400мл.
Хранят в обычных условиях, срок хранения не ограничен.
Действие и применение.
Натрия хлорид — основной источник образования соляной кислоты желудочного сока. При приеме внутрь хорошо всасывается из желудочно-кишечного тракта, при внутривенном введении гипертонических растворов распространяется по кровяному руслу, оказывая избирательное влияние на органы и ткани, центры водного и солевого обменов.
Избытки вещества выводятся в течение 24 часов через почки; процесс выделения натрия хлорида тесно связан с выделением воды и регулируется гормонами гипофиза (антидиуретический гормон) и надпочечников (альдостерон).
В зависимости от концентрации натрия хлорида различают растворы: изотонический (0,9 %), гипертонический (1 % и более) и гипотонический (менее 0,85 %).
Гипертонические растворы натрия хлорида действуют рефлекторно и резорбтивно на организм, возбуждая рецепторы вен, сердца, легких и органов брюшной полости; влияют на водный и минеральный обмен, осмотическое и кислотно-щелочное равновесие, моторную и секреторную функцию желудочно-кишечного тракта, выделительную функцию почек и объем диуреза; проявляют антитоксическое действие; активизируют иммунобиологические реакции организма. На этих свойствах гипертонических растворов натрия хлорида основано их применение в качестве средства патогенетической и заместительной терапии.
Осмотическое и диуретическое действие гипертонических растворов натрия хлорида обусловливают их антитоксический эффект. При этом происходит быстрое возмещение натрия и хлора и активизация натрийсодержащих ферментов, таких, как Na+ и К+ -аденозинтрифосфатаза, участвующих в антитоксических реакциях организма. Стимулируется также сложная система тканевой регуляции водно-солевого обмена, так называемый натрий — калиевый насос, что способствует быстрой регидратации организма. Обезвоживание (дегидратация), наблюдающееся при желудочно-кишечных заболеваниях молодняка раннего возраста, сопровождается значительными потерями воды, натрия и хлора. Это приводит к опасному для жизни сгущению крови, замедлению кровотока, нарушению обмена веществ, гипоксии, гипотермии. Восстановление водного баланса крови и тканей — регидратация — возможно только при быстром возмещении потерянных ионов натрия и хлора, которые выполняют активную роль в водно-солевом обмене. Натрий и хлор проходят активно через мембраны клеток, вода следует за ними пассивно. Дефицит натрия и хлора наиболее быстро восстанавливается путем внутривенного введения гипертонических растворов. Повышение концентрации раствора до 3-5 % в 10-20 раз увеличивает содержание натрия хлорида в межтканевой жидкости.
Гипертонические растворы натрия хлорида при внутривенном введении повышают резервную щелочность крови, что может быть использовано в качестве средства ощелачивающей терапии при ацидозе стельных коров. Регуляция кислотно-щелочного равновесия у стельных коров приводит одновременно к повышению активности иммунобиологических реакций организма (фагоцитоза) и естественной резистентности, новорожденных телят.
Гипертонические растворы натрия хлорида, действуя косвенно через парасимпатические окончания, увеличивают образование ацетилхолина и стимулируют моторную функцию желудочно-кишечного тракта. На этом основано применение растворов в качестве руминаторного средства при атониях преджелудков у жвачных; они нормализуют моторику преджелудков, поэтому их можно назначать при судорожных сокращениях рубца и рвоте, сопровождающих некоторые кормовые отравления.
Гипертонические растворы натрия хлорида рекомендуются при следующих острых и хронических заболеваниях и патологических состояниях животных: атонии преджелудков, тимпании и парезе рубца; отравлении ядовитыми растениями (белой чемерицей, лютиками, хвощами, соланином), отходами пивоваренного производства (бардой, дробиной), некоторыми пестицидами (фосфидом цинка, фосфорорганическими соединениями, препаратами мышьяка, фторидами); лекарственных токсикозах (отравление нитрофуранами); ацидозах у стельных коров; желудочно-кишечных заболеваниях телят раннего возраста (токсической диспепсии, колибактериозе), сопровождающихся диареей и обезвоживанием.
Гипертонические растворы натрия хлорида инъецируют внутривенно: крупным животным и овцам в яремную вену из шприца Жанэ без поршня или градуированной воронки на 150-250 мл (температура раствора 35-36°С).
При заболеваниях преджелудков взрослым жвачным вводят 20 % раствор натрия, хлорида в дозе 0,07-0,1 г сухого вещества на 1 кг живой массы (оптимальная доза -0,08-0,09 г, минимальная — 0,07, максимальная — 0,1 г); молодняку крупного рогатого скота (до 1,5-2 лет) — 10 % раствор в дозе 0,05-0,06 г сухого вещества на 1 кг массы. При острых атониях преджелудков гипертонический раствор натрия хлорида назначают однократно, при хронических — проводят курс лечения, состоящий из трех-четырех внутривенных вливаний раствора с интервалами 48 часов.
Внутривенное введение гипертонических растворов натрия хлорида при травматическом ретикулите может быть использовано для дифференциального диагноза с первичными атониями, так как при этом отмечается только временное (в течение 12-24 часов) усиление сокращений рубца, появление аппетита и жвачки, но затем состояние становится прежним.
В случае отравлений жвачных инъецируют 10-20 % растворы натрия хлорида в тех же дозах, что и при заболеваниях преджелудков; лошадям — 10 % раствор в дозе 0,05 г сухого вещества на 1 кг живой массы. При острых отравлениях раствор вводят двукратно с интервалом 24 часа в зависимости от состояния животного; при хронических — осуществляют курс лечения, состоящий из трех-четырех вливаний с интервалом 48 часов. Во время лечения животным обеспечивают свободный доступ к воде.
В целях нормализации кислотно-щелочного равновесия при ацидозе у стельных коров (снижение кислотной емкости ниже 300 мг %) и профилактики диспепсии новорожденных телят за 1-1,5 месяца до отела проводят четыре-пять внутривенных вливаний 20 % раствора натрия хлорида в дозе 0,09-0,1 г сухого вещества на 1 кг живой массы с интервалами 7-10 дней.
При токсической диспепсии и колибактериозе телят, сопровождающихся обезвоживанием, вводят внутривенно в первый день лечения 5 % раствор натрия хлорида в дозе 0,4 г сухого вещества на 1 кг массы. После внутривенного введения гипертонического раствора телятам выпаивают теплую, слегка подсоленную воду (5-7 г натрия хлорида на 1 л воды) из сосковой поилки в количестве 2-3 л. В первый день лечения молозиво полностью заменяют гипотоническим (0,5-0,7 %) или физиологическим раствором, выпаивая его вволю в часы кормления; на второй день лечения телятам дают разбавленное физраствором (на 2/3,1/2 и 1/3) молозиво и только на третий день больных телят переводят на цельное молозиво. При значительном снижении температуры тела (ниже 37°С) телятам инъецируют 10 % раствор в той же дозировке (0,4 г на 1 кг массы).
Внутривенное вливание 5-10 % растворов натрия хлорида телятам назначают однократно (лучше в первый день болезни); повторное введение раствора допускается не ранее чем через 24 часа.
К нежелательным влияниям 20 % раствора натрия хлорида можно отнести раздражающее действие при его попадании в подкожную клетчатку с образованием ограниченных инфильтратов. При этом сразу после введения раствора обильно смазывают места инъекции настойкой йода.
Гипертонические растворы натрия хлорида противопоказаны при травматическом перикардите у жвачных и отравлении поваренной солью; не допускается подкожное и внутрибрюшинное введение гипертонических растворов.
Повышенной чувствительностью к поваренной соли обладают свиньи, птицы, особенно куры.