Способ применения и дозировка
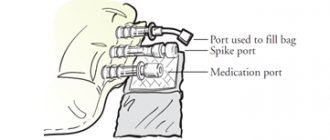
Вводят только в/в (медленно капельно или струйно) или в венозный участок диализной системы. Не предназначен для в/м введения. Недопустимо одномоментное введение полной терапевтической дозы.
Перед введением первой терапевтической дозы необходимо назначить тест-дозу. Если в течение периода наблюдения возникли явления непереносимости, введение следует немедленно прекратить.
Доза рассчитывается индивидуально в соответствии с общим дефицитом железа в организме по специальной формуле.
Противопоказания
Венофер не назначают пациентам с индивидуальной гиперчувствительностью к ингредиентам, входящим в состав раствора, а также другим парентеральным препаратам железа. Венофер не применяют для терапии пациентов с гемохроматозом, гемосидерозом, нарушением выведения железа, а также анемией, которая не связана с дефицитом железа. Запрещено назначение парентерального раствора железа (III) в первом триместре беременности. Рекомендуется соблюдать осторожность, назначая препарата Венофер пациентам, страдающим бронхиальной астмой, поливалентной аллергией, экземой, дефицитом фолиевой кислоты, а также нарушением функции печени. Венофер с осторожностью назначают пациентам, страдающим острыми и хроническими инфекционными заболеваниями, при которых повышены показатели ферритина плазмы крови. Введение препарата Венофер детям допускается только под тщательным контролем врача и в дозе не более 0,15мл парентерального раствора на 1кг массы тела 1 раз в 72 часа.
Побочные действия
Венофер при правильном применении неплохо переносится пациентами. В период терапии препаратом Венофер у пациентов возможно развитие таких нежелательных эффектов:
Со стороны центральной нервной системы: потеря сознания, головокружение, парестезии, головная боль, астения.
Со стороны сердца и сосудов: ощущение сердцебиения, тахикардия, артериальная гипотензия, чувство жара, коллапс, гиперемия лица, отеки.
Со стороны желудочно-кишечного тракта: дискомфорт и боль в эпигастральной области, тошнота, рвота, изменение вкусовых ощущений, диарея.
Аллергические реакции: эритема, кожный зуд, крапивница, гиперпигментация, повышенная потливость, бронхоспазм. Кроме того возможно развитие ангионевротического отека и анафилактического шока (первое введение препарата следует проводить под контролем врача при наличии средств для реанимации).
Другие: одышка, боль в суставах и мышцах, отек суставов, боль в конечностях и грудной клетке, местные реакции при введении (гиперемия, зуд и отек тканей), бледность кожных покровов, гипертермия, озноб.
Фармакологическое действие
Средство для лечения железодефицитных состояний. Многоядерные центры железа (III) гидроксида окружены снаружи множеством нековалентно связанных молекул сахарозы. В результате образуется комплекс, молекулярная масса которого составляет приблизительно 43 кД, вследствие этого его выведение почками в неизмененном виде невозможно. Данный комплекс стабилен и в физиологических условиях не выделяет ионы железа. Железо в этом комплексе связано со структурами, сходными с естественным ферритином.
Фармакокинетика
После однократного в/в введения в дозе, содержащей 100 мг железа, Cmax железа, в среднем 538 мкмоль, достигается спустя 10 мин после инъекции. Vd центральной камеры практически полностью соответствует объему сыворотки — около 3 л. Vd в равновесном состоянии составляет примерно 8 л (что указывает на низкое распределение железа в жидких средах организма). Благодаря низкой стабильности железа сахарата в сравнении с трансферрином, наблюдается конкурентный обмен железа в пользу трансферрина. В результате за 24 ч переносится около 31 мг железа (III). T1/2 — около 6 ч. В первые 4 ч почками выводится менее 5% железа от общего клиренса. Спустя 24 ч уровень железа сыворотки возвращается к первоначальному (до введения) значению, и примерно 75% сахарозы покидает сосудистое русло.
Взаимодействие с другими лекарственными средствами
Запрещено сочетанное применение препарата Венофер с лекарственными препаратами железа для перорального применения. Прием пероральной формы железа рекомендуется не ранее, чем через 5 дней после окончания терапии препаратом Венофер. Раствор для парентерального применения Венофер допускается смешивать только с 0,9% раствором натрия хлорида. Запрещено смешивать препарат в одном шприце с другими лекарственными средствами для парентерального применения. Препарат Венофер совместим с контейнерами из стекла, поливинилхлорида и полиэтилена. Совместимость с другими веществами не изучена.