Клинические проявления неврологических осложнений сахарного диабета (СД) разнообразны и сходны с симптомами других заболеваний, что часто приводит к позднему началу патогенетической терапии. Нормогликемия — главное условие предотвращения диабетической полинейропатии (ДП), достижение ее не всегда возможно, заболевание, как правило, имеет прогредиентное течение. Диагноз Д.П. устанавливается на основании клинического обследования, однако отсутствие симптомов заболевания не исключает ее наличия и требует инструментального обследования [1].
ДП наблюдается у 30—50% больных СД и имеет различные варианты. Ее частота связана с длительностью заболевания, эффективностью контроля гликемии и другими факторами риска. Наиболее распространенной формой ДП является хроническая дистальная симметричная сенсорная или сенсомоторная ДП (ДДСП), которая развивается у трети пациентов с СД. ДДСП сопровождаются нейропатическим болевым синдромом и приводит к снижению качества жизни больных [2].
Лечение пациентов с ДДСП включает уменьшение выраженности болевого синдрома (симптоматическая терапия) и восстановление структуры пораженных нервов (патогенетическая терапия). Лечение должно быть комплексным, включать препараты, воздействующие на разные стороны развития патологического процесса. Нейротропные витамины и метаболические препараты влияют на ряд биохимических процессов, протекающих в нервной ткани [3, 4]. Одним из таких препаратов является кокарнит, в состав которого входят трифосаденин, кокарбоксилаза, цианокобаламин и никотинамид. Каждый из указанных компонентов выполняет определенную функцию в процессах метаболизма. В ряде клинических исследований продемонстрированы эффективность и безопасность кокарнита в лечении пациентов с ДДСП [5].
Цель исследования — изучение влияния кокарнита на функции периферических нервов у пациентов с ДДСП.
Кокарнит (лиоф.д/р-ра в/м 187.125 амп.2мл №3+р-ль)
Страна
Египет
Страна производства может меняться в зависимости от партии товара. Детальную информацию уточняйте у оператора при подтверждении заказа.
Состав
1 ампула содержит: трифосаденина динатрия тригидрат 10 мг, кокарбоксилаза 50 мг, цианокобаламин 0.5 мг, никотинамид 20 мг.
Вспомогательные вещества: глицин — 105.875 мг, метилпарагидроксибензоат — 0.6 мг, пропилпарагидроксибензоат — 0.15 мг. Растворитель: лидокаина гидрохлорид — 10 мг, вода д/и — до 2 мл. Лиофилизат для приготовления раствора для в/м введения в виде лиофилизированной массы розового цвета. Восстановленный раствор — прозрачный, розового цвета.
Фармакологическое действие
Препарат представляет собой рационально подобранный комплекс метаболических веществ и витаминов. Трифосаденин является производным аденозина, стимулирует метаболические процессы. Оказывает вазодилатирующее действие, в т.ч. на коронарные и мозговые артерии. Улучшает метаболизм и энергообеспечение тканей. Обладает гипотензивным и антиаритмическим действием. Под влиянием АТФ происходит снижение АД, расслабление гладкой мускулатуры, улучшается проведение нервных импульсов. Кокарбоксилаза — кофермент, образующийся в организме из поступающего извне тиамина (витамина B1). Входит в состав фермента карбоксилазы, катализирующего карбоксилирование и декарбоксилирование ?-кетокислот. Опосредованно способствует синтезу нуклеиновых кислот, белков и липидов. Снижает в организме концентрацию молочной и пировиноградной кислот, способствует усвоению глюкозы. Улучшает трофику нервной ткани. Цианокобаламин (витамин В12) в организме превращается в метилкобаламин и 5-дезоксиаденозилкобаламин. Метилкобаламин участвует в реакции превращения гомоцистеина в метионин и S-аденозилметионин — ключевые реакции метаболизма пиримидиновых и пуриновых оснований (следовательно, ДНК и РНК). При недостаточности витамина в данной реакции его может замещать метилтетрагидрофолиевая кислота, при этом нарушаются фолиевопотребные реакции метаболизма. 5-дезоксиаденозилкобаламин служит кофактором при изомеризации L-метилмалонил-КоА в сукцинил-КоА — важной реакции метаболизма углеводов и липидов. Дефицит витамина В12 приводит к нарушению пролиферации быстроделящихся клеток кроветворной ткани и эпителия, а также к нарушению образования миелиновой оболочки нейронов. Никотинамид — одна из форм витамина РР, участвует в окислительно-восстановительных процессах в клетке, улучшает углеводный и азотистый обмен, регулирует тканевое дыхание.
Показания к применению
Симптоматическое лечение диабетической полиневропатии.
Способ применения
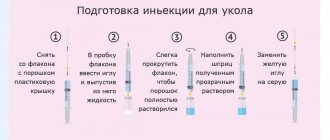
Препарат вводится глубоко в/м (в ягодичную мышцу). В случаях выраженного болевого синдрома лечение целесообразно начинать с в/м введения 2 мл (1 амп.)/сут до снятия острых симптомов. Продолжительность применения — 9 дней. После улучшения симптомов или в случаях умеренно выраженных симптомов полиневропатии назначают по 2 мл (1 амп.) 2-3 раза в неделю в течение 2-3 недель. Рекомендуемый курс лечения 3-9 инъекций в зависимости от тяжести заболевания. Длительность лечения и проведение повторных курсов определяется врачом в зависимости от характера и тяжести заболевания.
Взаимодействие
У пациентов, применяющих гипогликемические средства группы бигуанидов (метформин), из-за нарушения всасывания цианокобаламина из ЖКТ может наблюдаться снижение концентрации цианокобаламина в крови. Лекарственное взаимодействие с другими гипогликемическими средствами не описано. Цианокобаламин не совместим с аскорбиновой кислотой, солями тяжелых металлов, тиамином, тиамина бромидом, пиридоксином, рибофлавином, фолиевой кислотой. Нельзя применять одновременно цианокобаламин с препаратами, повышающими свертываемость крови. Кроме того, следует избегать одновременного применения цианокобаламина с хлорамфениколом. Аминогликозиды, салицилаты, противоэптилептические лекарственные средства, колхицин, препараты калия снижают абсорбцию цианокобаламина. При совместном применении препаратов, содержащих трифосаденин, с дипиридамолом усиливается действие дипиридамола, в частности вазодилатирующее действие. Димиридамол усиливает эффект трифосаденина. Проявляется некоторый антагонизм при совместном применении препарата с производными пурина (кофеин, теофиллин). Нельзя вводить одновременно с сердечными гликозидами в больших дозах, поскольку усиливается риск развития побочных реакций со стороны сердечно-сосудистой системы. При одновременном применении с ксантинола никотинатом снижается эффект препарата. Никотинамид потенцирует действие седативных, транквилизаторов, а также гипотензивных средств.
Побочное действие
Частота проявления нежелательных реакций приведена в соответствии с классификацией ВОЗ: очень часто (более 1/10); часто (менее 1/10, но более 1/100); нечасто (менее 1/100, но более 1/1000); редко (менее 1/1000, но более 1/10 000); очень редко (менее 1/10 000), включая отдельные случаи; частота неизвестна. Со стороны иммунной системы: редко — аллергические реакции (кожная сыпь, затрудненное дыхание, анафилактический шок, отек Квинке). Со стороны нервной системы: очень редко — головокружение, головная боль, возбуждение, спутанность сознания. Со стороны сердечно-сосудистой системы: — очень редко — тахикардия; — в отдельных случаях брадикардия, аритмия; — частота неизвестна — боли в области сердца, покраснение кожи лица и верхней половины туловища с ощущением покалывания и жжения, «приливы». Со стороны ЖКТ: очень редко — рвота, диарея. Со стороны кожи и подкожных тканей: очень редко — повышенное потоотделение, акне, зуд, крапивница. Со стороны костно-мышечной и соединительной ткани: очень редко — судороги. Общие расстройства и нарушения в месте введения: очень редко — может возникнуть раздражение, боль и жжение в месте введения препарата, слабость. Если любые из указанных нежелательных реакций усугубились или появились любые другие нежелательные реакции, не указанные в инструкции, пациенту необходимо сообщить об этом врачу. При развитии выраженных нежелательных реакций препарат отменяют.
Противопоказания
— повышенная чувствительность к любому компоненту препарата или растворителю; — сердечно-сосудистые заболевания (острая сердечная недостаточность, острый инфаркт миокарда, неконтролируемая артериальная гипертензия, артериальная гипотензия, тяжелые формы брадиаритмий, AV-блокада II-III степени, хроническая сердечная недостаточность (III-IV функциональный класс пo NYHA), кардиогенный шок и другие виды шока, синдром пролонгации QT, тромбоэмболии, геморрагический инсульт); — воспалительные заболевания легких, ХОБЛ, бронхиальная астма; — беременность; — период грудного вскармливания; — возраст до 18 лет; — гиперкоагуляция (в т.ч. при острых тромбозах), эритремия, эритроцитоз; — язвенная болезнь желудка или двенадцатиперстной кишки в фазе обострения; — подагра; — гепатит, цирроз печени. С осторожностью следует применять препарат при стенокардии.
Передозировка
Компоненты препарата Кокарнит имеют широкий терапевтический диапазон. Симптомы Трифосаденин. Превышение максимальной суточной дозы (около 600 мг для взрослого человека) может приводить к развитию следующих симптомов: головокружение, снижение АД, кратковременная потеря сознания, аритмия, AV-блокада II и III степени, асистолия, бронхоспазм, желудочковые нарушения, синусовая брадикардия и тахикардия. Кокарбоксилаза. Сообщалось о следующих симптомах после введения дозы, превышающей рекомендованную более чем в 100 раз: головная боль, спазм мышц, мышечная слабость, паралич, аритмия. Цианокобаламин. После парентерального введения высокой дозы наблюдались экзематозные кожные нарушения и доброкачественная форма акне. При применении в высоких дозах возможно развитие гиперкоагуляции, нарушение пуринового обмена. Никотинамид. При применении в больших дозах наблюдались гиперпигментация, желтуха, амблиопия, слабость, обострение язвенной болезни желудка и двенадцатиперстной кишки. При длительном применении отмечалось развитие стеатогепатоза, повышение концентрации мочевой кислоты в крови, нарушение толерантности к глюкозе. Лечение Введение препарата немедленно прекращают, назначают симптоматическую терапию, в т.ч. десенсибилизирующую.
Особые указания
При усугублении симптомов заболевания либо отсутствии эффекта по прошествии 9 дней необходимо проведение коррекции курса лечения. При применении препарата Кокарнит необходим надлежащий подбор дозы гипогликемического лекарственного препарата и адекватный контроль течения сахарного диабета. Цвет приготовленного раствора должен быть розовым. Нельзя применять препарат, если цвет раствора изменился. Раствор необходимо применять сразу после его приготовления. Использование в педиатрии Данные по эффективности и безопасности применения препарата Кокарнит у детей отсутствуют. Влияние на способность к вождению автотранспорта и управлению механизмами При возникновении побочных эффектов со стороны ЦНС (головокружение, спутанность сознания) рекомендуется воздержаться от управления транспортными средствами и другими механизмами.
Условия отпуска в аптеках
По рецепту
Кокарнит
Препарат представляет собой рационально подобранный комплекс метаболических веществ и витаминов.
Трифосаденин является производным аденозина, стимулирует метаболические процессы. Оказывает вазодилатирующее действие, в т.ч. на коронарные и мозговые артерии. Улучшает метаболизм и энергообеспечение тканей. Обладает гипотензивным и антиаритмическим действием. Под влиянием АТФ происходит снижение АД, расслабление гладкой мускулатуры, улучшается проведение нервных импульсов.
Кокарбоксилаза — кофермент, образующийся в организме из поступающего извне тиамина (витамина B1). Входит в состав фермента карбоксилазы, катализирующего карбоксилирование и декарбоксилированиса-кетокислот. Опосредованно способствует синтезу нуклеиновых кислот, белков и липидов. Снижает в организме концентрацию молочной и пировиноградной кислот, способствует усвоению глюкозы. Улучшает трофику нервной ткани.
Цианокобаламин (витамин В12) в организме превращается в метилкобаламин и 5-дезоксиаденозилкобаламин. Метилкобаламин участвует в реакции превращения гомоцистеина в метионин и S-аденозилметионин — ключевые реакции метаболизма пиримидиновых и пуриновых оснований (а, следовательно, ДНК и РНК). При недостаточности витамина в данной реакции его может замещать метилтетрагидрофолиевая кислота, при этом нарушаются фолиевопотребные реакции метаболизма.
5-дезоксиаденозилкобаламин служит кофактором при изомеризации L-метилмалонил-КоА в сукцинил-КоА — важной реакции метаболизма углеводов и липидов. Дефицит витамина В12 приводит к нарушению пролиферации быстроделящихся клеток кроветворной ткани и эпителия, а также к нарушению образования миелиновой оболочки нейронов.
Никотинамид — одна из форм витамина РР, участвует в окислительно-восстановительных процессах в клетке, улучшает углеводный и азотистый обмен, регулирует тканевое дыхание.
Фармакокинетика
Трифосаденин
После парентерального введения проникает в клетки органов, где расщепляется на аденозин и неорганический фосфат с высвобождением энергии. В дальнейшем продукты распада включаются в ресинтез АТФ.
Кокарбоксилаза
Быстро абсорбируется после в/м введения. Проникает в большинство тканей организма. Подвергается метаболическому разложению. Продукты метаболизма выводятся преимущественно почками.
Цианокобаламин
В крови цианокобаламин связывается с транскобаламинами I и II, которые транспортируют его в ткани. Депонируется преимущественно в печени. Связь с белками плазмы 0.9%. Быстро и полно всасывается после в/м и п/к введения. Cmax после в/м введения достигается через 1 ч. Из печени выводится желчью в кишечник и снова всасывается в кровь. T1/2 — 500 дней. Выводится при нормальной функции почек — 7-10% почками, около 50% — кишечником. При сниженной функции почек — 0-7% почками, 70-100% — кишечником. Проникает через плацентарный барьер, в грудное молоко.
Никотинамид
Быстро распределяется во все ткани. Проникает через плацентарный барьер и в грудное молоко. Метаболизируется в печени с образованием никотинамида-N-метилникотинамида. Выводится почками.
T1/2 из плазмы составляет около 1.3 ч, стационарный Vd – около 60 л, общий клиренс – около 0.6 л/мин.
Введение
Сахарный диабет (СД) представляет собой одну из глобальных проблем современного здравоохранения, т.к. вызывает осложнения со стороны нервной и сердечно-сосудистой систем, снижает качество жизни, повышает риск внезапной смерти [1]. В настоящее время, по данным Международной федерации диабета, СД страдают 415 млн взрослых (каждый 11-й житель земного шара). По данным Федерального регистра СД, в 2016 г. в России зарегистрированы 4,3 млн человек, страдавших этим заболеванием [2, 3].
Диабетическая полинейропатия (ДПН), по данным разных авторов, встречается среди 50–80% больных СД 2 типа (СД2) и ассоциируется с выраженным болевым синдромом, что ведет к снижению качества жизни. В исследовании DIAD показано, что сенсорный дефицит и нейропатическая боль являются независимыми факторами риска внезапной смерти от заболеваний сердца или нефатального инфаркта миокарда. В исследовании ACCORD установлено, что наличие нейропатии в анамнезе позволяет прогнозировать повышение смертности среди пациентов [4]. Дистальная симметричная сенсомоторная полинейропатия – самый частый вариант ДПН: до 75% случаев, и, по данным некоторых авторов, развивается уже на этапе преддиабета [5].
Патогенез ДПН в настоящее время рассматривается в рамках взаимодействия между метаболическими и сосудистыми факторами [6]. Известно, что при СД2 жесткий контроль гликемии лишь незначительно снижает риск развития нейропатических осложнений. Согласно данным современных исследований, к факторам, влияющим на развитие ДПН, относят возраст больного, дислипидемию, артериальную гипертензию, курение [7].
В свете современных данных лечение ДПН должно включать воздействие на факторы риска, патогенетическую и симптоматическую терапию, лечение самого СД. Это делает актуальной необходимость комплексного лечения ДПН с включением препаратов, воздействующих на ее патогенез [8].
Одним из новых препаратов, предложенных для комплексного патогенетического и симптоматического лечения ДПН, является Кокарнит, содержащий трифосаденина 10 мг, цианокобаламина 0,5 мг, никотинамида 20 мг и кокарбоксилазы 50 мг.
Цель исследования: оценка эффективности комплексной терапии, включающей препарат Кокарнит, для пациентов с ДПН.
Методы
В исследование были включены 20 пациентов с СД2 (средний возраст – 62,35±7,9 года), в т.ч. 14 женщин (70%) в возрасте 63,2±8,1 и 6 мужчин (30%) в возрасте 60,1±7,9 года. Средняя длительность СД составила 11,9±4,7 года (15%<5 лет, 60% – 5–15 лет, 25%>15 лет).
Критерии включения в исследование: пациенты обоего пола в возрасте от 18 лет, страдавшие ДПН, подписавшие информированное согласие.
Критерии исключения: наличие противопоказаний в соответствии с инструкцией по применению Кокарнита; полинейропатия иного генеза; прием альфа-липоевой кислоты, витаминов группы В и Актовегина в течение месяца до включения в исследование.
Все пациенты проходили комплексное клиническое обследование, включившее общеклинический и биохимический анализы крови, общий анализ мочи, электрокардиографию, рентгенографическое исследование органов грудной клетки. Каждый пациент был консультирован неврологом и эндокринологом в 1-й (визит 1), 9-й (визит 2), 30-й (визит 3) и 90-й (визит 4) дни, каждому больному проведена электронейромиография (ЭМГ) на 1-й, 9-й и 90-й дни.
Исследование функционального состояния периферических нервов методом стимуляционной ЭМГ проведено на 4-м канальном приборе Viking Quest (Nicolet Biomedical, США). Проведена стимуляция двигательных нервов (n. рeroneus, или малоберцовый нерв, – поверхностный и глубокий, n. tibialis, или большеберцовый нерв) c регистрацией амплитуды двигательного М-ответа и скорости распространения возбуждения, дистальной и резидуальной латенции. Для оценки состояния сенсорных нервов (n. рeroneus – поверхностный и глубокий, n. suralis, или икроножный нерв) применяли антидромную стимуляцию с определением амплитуды сенсорного S-ответа и скорости распространения возбуждения. При анализе полученных результатов в качестве величин нормы использовали данные 20 здоровых пациентов [9, 10].
Эффективность применения препарата оценивалась в баллах с помощью шкалы общей оценки симптомов нейропатии – (Total Symptom Score; TSS), шкалы неврологических симптомов (Neurogical Symptoms Score; NSS) и шкалы нейропатического дисфункционального счета (Neuropathy Disability Score; NDS).
Осмотр неврологом включал исследование коленных и ахилловых рефлексов, тактильной, болевой, температурной и вибрационной чувствительности. Вибрационная чувствительность исследовалась с помощью градуированного камертона с частотой вибрации 128 Гц. Качество жизни пациентов оценивалось на первом и четвертом визитах с помощью шкалы оценки качества жизни (The Short Form 36; SF-36).
Каждый из пациентов получал Кокарнит 1 раз в сутки внутримышечно в дозе 2 мл на протяжении 9 суток ежедневно дополнительно к комплексной терапии. Комплексная терапия была представлена сахароснижающими, гипотензивными препаратами, а также антиагрегантами. Сахароснижающие препараты включали инсулины различного спектра действия, таблетированные средства (метформин, сульфанилмочевина, ингибиторы дипептидилпептидазы-4). Гипотензивные препараты были из различных групп (блокаторы кальциевых каналов, ингибиторы АПФ, бета-адреноблокаторы, сартаны, центрального действия, мочегонные). Антиагрегантная терапия в виде ацетилсалициловой кислоты.
В исследование не включались пациенты, получавшие терапию витаминами группы В, препаратами тиоктовой кислоты в течение 6 месяцев до старта исследовательской программы.
Статистическая обработка полученных результатов осуществлена с использованием программного обеспечения Excel Worksheet из пакета Microsoft Office 2013. Вычислены среднее арифметическое, стандартное отклонение и критерий достоверности (t). За достоверные принимались различия на уровне значимости 95% при р<0,05.
Результаты исследования
У всех обследованных нами пациентов, страдавших СД, была выявлена дистальная симметричная сенсомоторная полинейропатия, смешанный вариант (Классификация диабетичской нейропатии; Дедов И.И., 2002) разной степени выраженности, которая в 25% случаев сочеталась с радикулопатией, в 10% – с мононейропатией периферических нервов. Все пациенты испытывали нейропатическую боль разной степени выраженности, что подтверждалось данными шкал TSS, NSS и NDS. На фоне проведенной терапии отмечено достоверное уменьшение болевого синдрома, что отражено в табл. 1.
С помощью опросника SF-36 оценивали качество жизни, физическое, психологическое, социальное и психическое здоровье, интенсивность боли и жизненную активность. Тестирование проведено на 1-м и 4-м визитах. У всех пациентов установлено достоверное улучшение по шкалам, указанным в табл. 2. Наиболее выраженное улучшение наблюдалось по шкалам ролевого (физического) функционирования (табл. 2).
При проведении ЭМГ проявления дистальной сенсорно-моторной полинейропатии различной степени выраженности были выявлены у 100% пациентов. Характер изменений был аксонально-демиелинизирующим, наиболее пораженными оказались сенсорные волокна. Из сенсорных нервов самый пораженный – поверхностный n. рeroneus: зарегистрированы самая низкая скорость проведения импульсов и самая низкая амплитуда потенциала действия (табл. 3, 4). В 20% случаев потенциалы действия на малоберцовых нервах не регистрировались. По сравнению с контрольной группой у всех пациентов были достоверно снижены скоростные показатели и амплитуды в отношении сенсорных и моторных нервов.
При исследовании моторных нервов аксональное поражение выявлено у 72% пациентов. Самые низкие показатели амплитуды М-ответа отмечены при исследовании поверхностного n. рeroneus, что отражено в табл. 5.
Данные о скорости проведения по моторным нервам представлены в табл. 6.
По данным ЭМГ, наиболее чувствительными к лечению оказались сенсорные нервы, в отношении которых в результате терапии отмечено более выраженное повышение показателей скорости проведения импульсов, хотя степени статистической значимости эти изменения не достигли. У 4 (20%) пациентов до лечения не регистрировались потенциалы действия на n. рeroneus, но после проведенной терапии они по малоберцовым нервам до лечения не регистрировались, после лечения они появились у 2 из этих больных.
Показатели функционального состояния n. рeroneus (сенсорных волокон) и n. suralis продемонстрировали наличие достоверной обратной связи между амплитудой потенциалов действия сенсорных нервов и длительностью СД. У пациентов с длительностью СД >20 лет отмечены наиболее низкие амплитуды потенциалов на n. suralis: 1,8±1,2 против 4,9±3,8 мкВ в общей группе.
Также установлена достоверная обратная связь между неконтролируемой гликемией и поражением сенсорных нервов нижних конечностей: 2,1±0,5 (у пациентов с неконтролируемой гликемией) против 4,9±3,8 мкВ в общей группе.
Обсуждение
Анализ полученных нами результатов обследования пациентов с ДПН свидетельствует о достоверном снижении у них скорости проведения и амплитуд импульсов по моторным и сенсорным нервам нижних конечностей по сравнению со здоровыми лицами. Сенсорные нарушения превалировали у наблюдавшихся нами больных над моторными расстройствами, что согласуется с результатами, полученными другими авторами [11].
Нервы были поражены по типу аксономиелинопатии с преобладанием поражения по типу миелинопатии. Наиболее низкие скорости проведения импульсов и самые низкие амплитуды выявлены в поверхностных n. рeroneus. Это указывает на целесообразность его включения в ЭМГ-обследование пациентов с СД2.
В результате применения Кокарнита в составе комплексной терапии удалось улучшить проведение по моторным и сенсорным нервам нижних конечностей, наиболее выраженные улучшения наблюдались в более пораженных сенсорных нервах. Выявлено достоверное повышение амплитуды потенциалов действия на поверхностном n. рeroneus, что указывает на влияние Кокарнита на аксональную функцию. Также было отмечено достоверное улучшение по показателям качества жизни и ощущению нейропатической боли самими пациентами по показателям шкал TSS, NSS и NDS. Все эти данные убедительно свидетельствуют о положительном влиянии Кокарнита на основные симптомы ДПН. Регресс неврологического дефицита в ходе лечения был подтвержден результатами ЭМГ. Полученные в настоящей работе данные совпадают с результатами проведенных ранее исследований.
Заключение
Кокарнит – эффективный препарат для лечения пациентов с диабетической дистальной сенсомоторной полинейропатией. Применение Кокарнита, содержащего витамины группы B, а также трифосаденин и никотинамид, представляется патогенетически обоснованным и эффективным в составе комплексного лечения пациентов с диабетической нейропатией.
Материал и методы
Проведено клинико-нейрофизиологическое обследование 30 пациентов с ДДСП в возрасте от 27 до 65 лет (средний — 55,3±10,8 года) и длительностью СД от 2 до 20 лет (средняя — 8,0±5,8 года). Критерии включения
в исследование: пациенты обоего пола в возрасте от 18 лет, страдающие ДДСП, подписавшие информированное согласие.
Критерии исключения
: противопоказания в соответствии с инструкцией по применению кокарнита; полинейропатия иного генеза; прием альфа-липоевой кислоты, препаратов, содержащих витамины группы В, и актовегина в течение месяца до включения в исследование.
Все пациенты проходили стандартное неврологическое обследование с детальной оценкой болевых проявлений по опроснику боли PainDetect. Основным критерием эффективности исследуемого препарата было изучение выраженности нейропатической боли по опросникам ТSS (англ
.: Total Symptom Score — общая оценка симптомов нейропатии) и NSS (
англ
.: Neurological Symptoms Score — оценка неврологических симптомов). Оценка качестважизни проводилась с помощью русской версии общегомеждународного опросникаEuroQol-5D (
англ
.: EuropeanQualityofLife instrument — Европейский инструмент оценки качества жизни).
С целью изучения состояния периферического нейромоторного аппарата пациентам осуществляли стимуляционную электромиографию (ЭМГ) с анализом проведения по моторным волокнам периферических нервов, по сенсорным волокнам периферических нервов и вызванного кожного симпатического потенциала (ВКСП). Исследование проводилось на 2-канальном электромиографе Keypoint Portable (Дания) с помощью поверхностных отводящих и стимулирующего электродов. Оценивали состояние моторных волокон срединного, локтевого, большеберцового и малоберцового нервов. Анализировали амплитуду моторного ответа (М-ответ) и порог его регистрации, скорость распространения возбуждения (СРВ), дистальную латентность (ДЛ) и состояние поздних ответов. За норму принимались: амплитуда М-ответа локтевого нерва — не менее 6 мВ, срединного и большеберцового нервов — не менее 4 мВ, малоберцового нерва — не менее 3 мВ; СРВ по моторным волокнам периферических нервов верхних конечностей — не ниже 50 м/с, нижних конечностей — не ниже 40 м/с; ДЛ для срединного и локтевого нервов — 3,5 мс, для малоберцового и большеберцового нервов — 4 мс [6, 7].
Проведение по сенсорным волокнам исследовали на срединном, локтевом, икроножном и поверхностном малоберцовом нервах. Определяли СРВ, амплитуду сенсорного ответа (S-ответ). Нормальной считалась амплитуда S-ответа для срединного и локтевого нервов не менее 10 мкВ, для икроножного и поверхностного малоберцового нервов не менее 5 мкВ; СРВ по сенсорным волокнам периферических нервов верхних конечностей не менее 48 м/с, нижних конечностей — не менее 38 м/с [8, 9].
Для изучения состояния вегетативных волокон исследовали амплитуду и латентность ВКСП. За норму ВКСП с ладонной поверхности кисти принимали амплитуду не ниже 330±102 мкВ, латентный период —1,4±0,1 с; с подошвенной поверхности стопы — амплитуда 230,2±81,7 мкВ, латентный период — 2,0±0,2 с [10, 11]. Клинико-нейрофизиологическое обследование проводилось дважды — до введения препарата и через 2 нед после введения последней инъекции. Кокарнит вводили глубоко внутримышечно в ягодичную мышцу по 2 мл ежедневно однократно в течение 9 дней.
Статистическая обработка полученных результатов осуществлялась на ПЭВМ с использованием программного обеспечения Excel Worksheet из пакета Microsoft Office 2013. Использовался метод вариационной статистики с вычислением средней арифметической (М
), стандартного отклонения (
SD
) и критерия достоверности (
t
). За достоверные принимались различия на уровне значимости 95% при
р
<0,05.
Кокарнит раствор для инъекций, по 2 мл в ампулах, 3 шт. + растворитель, 3 шт.
Никотинамид
Антикоагулянты, ацетилсалициловая кислота – усиление риска развития геморрагий. При одновременном применении следует соблюдать осторожность.
Антигипертензивные средства – усиление гипотензивного действия. При одновременном применении следует соблюдать осторожность.
Антибиотики – возможное усиление гиперемии, вызванной никотинамидом.
Ловастатин, правастатин – одновременное применение с никотинамидом не рекомендуется из-за повышенного риска побочных реакций. Сообщалось о случаях рабдомиолиза при одновременном применении никотинамида с ловастатином.
Неомицин, барбитураты, противотуберкулезные средства, сульфаниламиды – уменьшение токсичности последних и предотвращение индуцированного неомицином уменьшения концентрации холестерина и липопротеидов высокой плотности.
Пероральные контрацептивы, изониазид – возможное повышение потребности в никотинамиде (вследствие замедления превращения триптофана в никотиновую кислоту).
Пробенецид – ослабление действия последнего.
Ципрофибрат – одновременное применение с никотинамидом не рекомендуется.
Фибринолитические средства, спазмолитические средства, сердечные гликозиды – усиление последних.
Никотинамид усиливает токсическое влияние алкоголя на печень.
Кокарбоксилаза
Сердечные гликозиды – усиление кардиотонического действия сердечных гликозидов.
Цианокобаламин
Средства, повышающие свертываемость крови – одновременное применение с никотинамидом не рекомендуется.
Пероральные контрацептивы – снижение концентрации цианокобаламина в плазме крови.
Тиамин – усиление риска аллергических реакций, вызванных тиамином.
Хлорамфеникол – снижение гемопоэтического ответа на лекарственное средство.
Антиметаболиты и большинство антибиотиков изменяют результаты микробиологических исследований цианокобаламина.
Динатрия аденозин трифосфат тригидрат
Блокаторы β-адренорецепторов, нитраты – усиление антиангинального действия.
Дипиридамол – усиление действия последнего, в частности его сосудорасширяющего эффекта.
Калийсберегающие диуретики, препараты калия, ингибиторы АПФ – усиление риска гиперкалиемии.
Карбамазепин – усиление эффекта аденозина (в том числе до развития блокады).
Ксантинола никотинат – ослабление эффекта аденозина.
Производные пурина (кофеин и теофиллин) – выявляется некоторый антагонизм с аденозином.
Препараты магния – усиление риска гипермагниемии.
Сердечные гликозиды – усиление риска побочных реакций со стороны сердечно-сосудистой системы. Препарат нельзя вводить в больших дозах одновременно с сердечными гликозидами.
Лидокаина гидрохлорид
Амитриптилин, бупивакаин, дизопирамид, имипрамин, нортриптилин, петидин, хинидин, хлорпромазин – снижение концентрации лидокаина в плазме крови.
Антиаритмические средства (в т.ч. амиодарон, верапамил, хинидин, дизопирамид, аймалин) – усиление кардиодепрессивного эффекта (вследствие удлинения интервала QT) и в очень редких случаях возможно развитие атриовентрикулярной блокады или фибрилляции желудочков. Одновременное применение с амиодароном может привести к развитию судорог.
Антикоагулянты (в т.ч. ардепарин, далтепарин, данапароид, эноксапарин, гепарин, варфарин) – увеличение риска кровотечений.
Ацетазоламид, тиазидные и петлевые диуретики – ослабление эффекта лидокаина (вследствие гипокалиемии).
Барбитураты (фенобарбитал), противосудорожные средства – увеличение метаболизма и снижение концентрации лидокаина в плазме крови, а также усиление кардиодепрессивного эффекта.
Блокаторы β-адренорецепторов – замедление метаболизма и усиление эффектов (в т.ч. токсических) лидокаина, в частности, увеличение риска брадикардии и артериальной гипотензии. При одновременном применении этих средств следует снизить дозу лидокаина.
Вазоконстрикторы (эпинефрин, метоксамин, фенилэфрин) – возможно замедление абсорбции и пролонгация эффекта лидокаина.
Глюкагон, изадрин – увеличение клиренса лидокаина.
Гуанадрель, гуанетидин, мекамиламин, триметафан – при спинальной и эпидуральной анестезии увеличивается риск выраженной артериальной гипотензии и брадикардии.
Средства для наркоза (гексобарбитал, тиопентал натрия внутривенно), этанол – усиление угнетающего воздействия на дыхание.
Средства, предопределяющие блокаду нервно-мышечной передачи – усиление эффекта таких средств (в результате уменьшения проводимости нервных импульсов).
Ингибиторы моноаминооксидазы (фуразолидон, прокарбазин, селегилин) – увеличение риска артериальной гипотензии. В период лечения ингибиторами МАО не следует применять лидокаин парентерально.
Курареподобные средства – углубление миорелаксации (вплоть до паралича дыхательных мышц).
Мексилетин, норепинефрин – усиление токсичности лидокаина (в результате снижения клиренса и печеночного кровотока).
Мидазолам – повышается концентрация лидокаина в плазме крови.
Наркотические анальгетики (морфин) – усиление анальгезирующего эффекта таких средств, однако усиливается и угнетение дыхания.
Новокаин, новокаинамид, прокаинамид – возбуждение центральной нервной системы (ЦНС), бред, галлюцинации.
Полимиксин В – при одновременном применении следует контролировать функцию дыхания.
Прениламин – увеличение риска желудочковой ари.
Пропафенон – увеличение длительности и повышение тяжести побочных эффектов ЦНС.
Рифампицин – снижение концентрации последнего в плазме крови.
Седативные и снотворные средства – усиление угнетающего эффекта на ЦНС.
Сердечные гликозиды – ослабление кардиотонического эффекта сердечных гликозидов. На фоне интоксикации гликозидами наперстянки лидокаин может усугублять тяжесть АВ-блокады.
Циметидин – снижение метаболизма (снижение печеночного клиренса вследствие ингибирования микросомального окисления) и увеличение концентрации лидокаина в плазме крови, а также усиление его токсических эффектов.
Возможность применения препарата Кокарнит при лечении диабетической полинейропатии
Диабетическая полинейропатия – осложнение сахарного диабета, развивающееся, наряду с другими осложнениями (ангиопатия), в результате хронической гипергликемии. Достижение нормогликемии является главным условием профилактики и лечения диабетических осложнений. К сожалению, поддерживать нормальный уровень глюкозы в крови удается у небольшого числа больных, что диктует необходимость поиска лекарственных средств, препятствующих токсическому влиянию глюкозы на ткани. Одним из таких препаратов считается Кокарнит, доказавший свою эффективность в ряде исследований.
Таблица 1. Динамика нейропатической симптоматики по TSS на фоне терапии препаратом Кокарнит, %
Таблица 2. Динамика нейропатической симптоматики по NIS-LL на фоне терапии препаратом Кокарнит, %
Таблица 3. Динамика симптомов астении по МFI-20 на фоне терапии препаратом Кокарнит, балл
Рисунок. Количество пациентов, у которых отмечалось улучшение состояния по GCIC в конце наблюдения
Диабетическая полинейропатия (ДПН) – осложнение сахарного диабета (СД), которое наряду с другими осложнениями (ангиопатия) является следствием хронической гипергликемии. Заболевание обусловливает развитие синдрома диабетической стопы (язва, гангрена, ложный сустав), безболевых форм инфаркта миокарда, поражение желудочно-кишечного тракта и урогенитальные расстройства.
Диабетическая периферическая полинейропатия (ДППН) характеризуется комплексом клинических проявлений, имеет четкие диагностические критерии и служит маркером висцеральной, в частности опасной для жизни кардиальной, диабетической нейропатии [1, 2].
В настоящее время однозначные данные о распространенности ДПН отсутствуют. Считается, что в среднем более 50% пациентов с СД страдают указанным заболеванием. Среди факторов риска развития выделяют длительность СД, продолжительность периодов выраженной гипергликемии, уровень гликированного гемоглобина, наличие сердечно-сосудистой патологии, артериальной гипертензии, употребление алкоголя, курение. Так, распространенность ДППН при длительности СД до пяти лет и более 30 лет возрастает с 14 до 44% соответственно. Риск развития ДПН повышается на 10–15% при увеличении уровня глюкозы натощак на 1 ммоль/л или гликированного гемоглобина на 1%.
На данный момент существуют две взаимодополняющие гипотезы развития ДПН: метаболическая и сосудистая. Однако необходимо помнить, что ключевая роль в патогенезе принадлежит хронической гипергликемии, которая запускает каскад биохимических реакций, приводящих к дегенерации и демиелинизации нервных волокон. Свой вклад в развитие ДПН вносит и гипогликемия. Так, частые эпизоды тяжелой гипогликемии ассоциируются с демиелинизацией нервного волокна и патологией переднего рога серого вещества спинного мозга [3].
Некоторые ученые считают, что на ранних стадиях развития заболевания преобладают метаболические факторы, они также превалируют при диффузном повреждении нервов, на поздних стадиях и при фокальных нейропатиях увеличивается роль сосудистых [4].
В основе метаболической теории патогенеза лежит активация полиолового пути обмена глюкозы, что приводит к накоплению сорбитола. Как следствие, отек тканей как нервной, так и сосудистой стенки, нарушение эндоневрального кровотока и гипоксия нервов. Важно отметить, что в норме только 1–2% глюкозы превращается в сорбитол, в условиях гипергликемии скорость данного процесса увеличивается в семь – десять раз.
Активация полиолового пути влияет также на образование оксида азота (NO) внутри клеток. Известно, что при уменьшении концентрации данного высокоактивного радикала снижается интраневральный кровоток, в результате замедляется скорость проведения возбуждения по нервному волокну. Данный механизм определяет начальные изменения периферической нервной системы в ответ на гипергликемию [4–6].
Еще один патобиохимический путь повреждения – увеличение образования конечных продуктов гликирования. Это приводит к нарушению структуры базальной мембраны капилляров, внутриклеточных белков, в том числе митохондриальных, процессов окисления глюкозы с развитием окислительного стресса [7, 8].
Окислительному стрессу в последние годы отводится особое место в патогенезе ДПН. Повышенная продукция свободных радикалов и сниженная антиоксидантная защита – важная патобиохимическая характеристика СД. Окислительный стресс лежит в основе развития и микрососудистых осложнений, и прогрессирования атеросклероза [7, 9].
Клинически ДППН проявляется снижением чувствительности всех модальностей в дистальных отделах ног, ахилловых и коленных рефлексов, слабостью мышц голени и стопы [3, 10].
Кроме того, очень часто хроническим заболеваниям, в том числе сахарному диабету, сопутствует астеновегетативный синдром (fatigue sindrom). Он характеризуется повышенной утомляемостью, слабостью, раздражительностью, неспособностью концентрировать внимание, снижением удовлетворенности жизнью, работоспособности и обусловливает ухудшение качества жизни пациентов и снижение комплаентности лечению [11].
Особенность симптоматики ДППН затрудняет диагностику, как следствие, упускается время и процессы становятся необратимыми. По данным опроса врачей-хирургов, занимающихся оперативным лечением пациентов с синдромом диабетической стопы, 43–85% перенесших ампутацию конечности могли бы избежать этого, если бы профилактическая терапия была начата своевременно [4].
На сегодняшний день патогенетическая терапия заболевания предполагает прием препаратов, влияющих на окислительный стресс, и витаминов группы В [3, 4, 10].
Целью
настоящего исследования стала оценка влияния препарата Кокарнит (лиофилизат для приготовления раствора для внутримышечного введения) при применении один раз в сутки внутримышечно в дозе 2 мл в течение девяти дней на динамику нейропатической симптоматики у больных диабетической полинейропатией.
Задачи исследования:
- изучение влияния препарата Кокарнит на нейропатическую симптоматику;
- оценка влияния препарата Кокарнит на общее клиническое впечатление об изменении симптомов нейропатии и частоты побочных реакций.
Материал и методы
В исследование включено 34 пациента (14 мужчин и 19 женщин) с сахарным диабетом: СД 1 типа – у 4, СД 2 типа – у 29. Средний возраст участников составил 53,6 ± 2,4 [24,0–74,0] года, длительность диабета – 9,8 ± 0,1 [1,0–31,0] года.
Каждый участник подписал информированное согласие на включение в клиническое исследование и обработку результатов обследования.
Все пациенты получали основную сахароснижающую терапию: инсулин, пероральные сахароснижающие препараты, гипотензивные препараты, препараты для лечения сочетанных заболеваний. К схеме лечения был добавлен Кокарнит.
Прием препаратов, содержащих витамины группы В и альфа-липоевую кислоту, не допускался.
Препарат Кокарнит представляет собой рационально подобранный комплекс метаболических веществ и витаминов: трифосаденина динатрия тригидрат, кокарбоксилаза, цианокобаламин, никотинамид.
Трифосаденина динатрия тригидрат является производным аденозина, стимулирует метаболические процессы. Вещество оказывает вазодилатирующее воздействие, в том числе на коронарные артерии и артерии головного мозга. Улучшает метаболизм и энергообеспечение тканей. Обладает гипотензивным и антиаритмическим действием. Под влиянием аденозинтрифосфата снижается артериальное давление, расслабляется гладкая мускулатура, улучшается проведение нервных импульсов.
Кокарбоксилаза – кофермент, образующийся в организме из поступающего извне тиамина (витамина В1). Входит в состав фермента карбоксилазы, катализирующего карбоксилирование и декарбоксилирование альфа-кетокислот. Опосредованно способствует синтезу нуклеиновых кислот, белков и липидов. Снижает концентрацию молочной и пировиноградной кислот в организме, способствует усвоению глюкозы. Улучшает трофику нервной ткани.
Цианокобаламин (витамин В12) в организме превращается в метилкобаламин и 5-дезоксиаденозилкобаламин. Метилкобаламин участвует в превращении гомоцистеина в метионин и 8-аденозилметионин – ключевой реакции метаболизма пиримидиновых и пуриновых оснований (следовательно, ДНК и РНК). В случае недостатка витамина его может замещать метилтетрагидрофолиевая кислота, при этом нарушаются фолиевопотребные реакции метаболизма. 5-дезоксиаденозилкобаламин служит кофактором при изомеризации L-метилмалонил-КоА в сукцинил-КоА – важной реакции метаболизма углеводов и липидов.
Дефицит витамина В12 приводит к нарушению пролиферации быстроделящихся клеток кроветворной ткани и эпителия, а также образования миелиновой оболочки нейронов.
Никотинамид – одна из форм витамина РР, участвует в окислительно-восстановительных процессах в клетке, улучшает углеводный и азотистый обмен, регулирует тканевое дыхание.
Схема применения препарата Кокарнит предполагала внутримышечное введение 2 мл в течение девяти дней, затем – на 12-й, 15-й и 18-й день. Курс терапии – 12 инъекций.
Основные критерии оценки эффективности исследуемого препарата:
- динамика нейропатической симптоматики по ТSS (Total Symptom Score – общая оценка симптомов нейропатии);
- нейропатической симптоматики по NIS-LL (Neuropathy Impairment Score – Lower Limb – шкала невропатических нарушений нижних конечностей);
- показателей MFI-20 (Multidimensional Fatigue Inventory – субъективная шкала оценки астении).
Второстепенные показатели:
- динамика общего клинического впечатления об изменении симптомов нейропатии по опроснику GCIC (Global Clinical Impression Change);
- частота побочных эффектов терапии.
Продолжительность наблюдения составила 12 недель.
Другие виды лечения, назначаемые в течение исследования, отмечались в индивидуальной регистрационной карте пациентов.
Дизайн исследования предполагал три визита. Первый – включение в исследование (первый день), второй – через три дня после окончания курса инъекций (21-й день), третий – через 42 дня от начала терапии.
Во время всех визитов состояние пациентов оценивалось по TSS, NIS-LL, GCIC и MFI-20. Кроме того, во время первого и второго визитов проводились стандартные общий и биохимический анализы крови, третьего – сделано общее заключение об эффективности лечения: выраженное улучшение, умеренное улучшение, минимальное улучшение, без динамики, небольшое ухудшение, умеренное ухудшение, значительное ухудшение, а также о наличии побочных реакций.
Исходя из полученных результатов рассчитывали среднее арифметическое (M), стандартную ошибку (m), относительную величину (р, %). Для подтверждения достоверности различий между выборками использовали t-критерий Стьюдента.
Вероятность ошибки указывали как р и считали приемлемой при
Статистическая обработка данных проведена с помощью программы Statistica 6.0.
Результаты
Все пациенты, включенные в исследование, имели клинические проявления ДППН. Так, 60,6% пациентов жаловались на умеренно выраженные боль, жжение, парестезии, онемение, 36,3% – выраженные их проявления (по TSS) (табл. 1). Через 21 день на фоне терапии препаратом Кокарнит у 54,1% больных зафиксировано снижение симптоматики ДППН до нормы, у 45,4% – до умеренно выраженной степени. К данному моменту выраженная симптоматика заболевания не отмечалась ни у одного пациента (табл. 1). Положительная динамика наблюдалась и во время третьего визита.
Средние показатели по TSS составили: первый визит – 6,32 ± 0,8 балла (р
Оценка нейропатического дефицита по NIS-LL (мышечная сила, рефлексы, тактильная, температурная, вибрационная, проприоцептивная чувствительность) показала, что исходно доля больных с выраженной нейропатией составляла 21,2%, умеренной – 69,8% (табл. 2). В результате проведенной терапии доля первых сократилась до 9,1%, вторых – до 48,4%. При этом количество пациентов с отсутствием нейропатического дефицита к концу исследования увеличилось с 9,1 до 30,3% (первый и третий визиты соответственно) (табл. 2). Необходимо отметить, что наиболее выраженный эффект лечения наблюдался через 21 день (второй визит). Через 42 дня зафиксировано замедление положительной динамики, однако число пациентов с умеренной нейропатией оставалось высоким.
Средние показатели по NIS-LL: первый визит – 10,1 ± 0,8 балла, второй – 6,8 ± 0,7 балла (р
Динамика проявлений астении определялась по МFI-20. Данный опросник включает 20 вопросов для оценки общей, физической, психической астении, снижения мотивации в обследуемой группе. В таблице 3 представлено изменение физического и психического состояния пациентов на фоне лечения препаратом Кокарнит. Уменьшение симптомов заболевания позволило расширить физические возможности пациентов, улучшить их общее состояние и эмоциональный фон.
По данным GCIC, терапия препаратом Кокарнит способствует улучшению нейропатической симптоматики. Общее заключение об эффективности лечения представлено на рисунке.
В отношении побочных эффектов и осложнений у больных при проведении курса терапии необходимо отметить следующее. Одна пациентка из 35 выбыла из исследования, так как после первой инъекции у нее развилась аллергическая реакция в виде сыпи. У остальных участников каких-либо побочных эффектов не наблюдалось.
Заключение
Проведенное исследование показало, что пациентов с СД необходимо регулярно обследовать на предмет выявления признаков ДППН. Длительная неудовлетворительная компенсация СД обусловливает развитие осложнений.
Для предотвращения более тяжелых поражений нервной системы, развития синдрома диабетической стопы и кардиопатии необходимо проведение профилактических, а также лечебных мероприятий (на стадии клинических проявлений заболевания).
Витамины группы В относятся к нейротропным препаратам и признаются патогенетической терапией ДПН [4, 6].
Результаты исследования также свидетельствуют, что лечение препаратом Кокарнит ассоциируется с выраженным и умеренным улучшением нейропатической симптоматики, общего состояния пациентов.