Холиноблокаторы (холинолитики) – это лекарственные препараты, которые блокируют холинорецепторы разных типов в органах и тканях, препятствуя реализации эффектов естественного биологически активного вещества – медиатора ацетилхолина.
Ацетилхолин – это передатчик импульсов в периферической нервной системе, регулирующий работу многих внутренних органов и систем (в частности, головного мозга, сердца, бронхов, матки, желудочно-кишечного тракта, мочевыводящей системы и т.д.).
Свои эффекты ацетилхолин реализуют путем взаимодействия с особыми структурными компонентами клеток – рецепторами, а именно холинорецепторами. В зависимости от их месторасположения и функций адренорецепторы классифицируют на М- и Н-холинорецепторы.
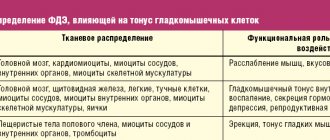
М-холинорецепторы располагаются преимущественно в головном мозге, сердце, бронхах, желудочно-кишечном тракте, радужной оболочке глаза, мочевыводящих путях. Эффекты стимуляции М-холинорецепторов включают в себя сужение зрачка, снижение внутриглазного давления, усиление образования кислоты желудочного сока, повышение секреции пищеварительных желез, усиление моторики желудочно-кишечного тракта и перистальтики, повышение тонуса мочевого пузыря, а также снижение частоты сердечных сокращений.
Н-холинорецепторы локализованы преимущественно в скелетных мышцах, а также в особых структурах – вегетативных ганглиях и каротидных клубочках. При их стимуляции наблюдается сокращение мышц, сужение сосудов (и, как следствие, повышение артериального давления) и возбуждение дыхательного центра в головном мозге.
Существует отдельный класс препаратов, которые способны стимулировать холинорецепторы (холиномиметики, холиностимуляторы), так и группа препаратов, которые могут блокировать холинорецепторы (холиноблокаторы, холинолитики).
В зависимости от типа блокируемых рецепторов холинолитики делят на М-холиноблокаторы, а также Н-холиноблокаторы (которые, в свою очередь, делят на два отдельных класса: ганглиоблокаторы и миорелаксанты). Рассмотрим подробно препараты, блокирующие М-холинорецепторы.
Что такое М-холиноблокаторы?
М-холиноблокаторы представляют собой группу лекарственных средств, которая активно используется в гастроэнтерологии и других областях медицины с целью улучшения состояния пациентов и остановки прогрессирования заболеваний ЖКТ.
Медикаменты помогают расслабить гладкую мускулатуру органов пищеварительного тракта и существенно сокращают период выздоровления при острых нарушениях. Средства применяют довольно часто, комбинируют их с другими препаратами, чтобы обеспечить максимальный терапевтический эффект.
Механизм действия
М-холиноблокаторы (показания к применению не являются единственным поводом для назначения лекарств, поэтому перед лечением проводят предварительное обследование) оказывают действие за счет содержания компонентов, способных оказывать расслабляющее воздействие на мышечные волокна, присутствующие в стенках органов пищеварительного тракта.
За счет этого осуществляется:
- расслабляющий эффект;
- наблюдается подавление функционирования пищеварительных желез;
- снижение выработки соляной кислоты.
На фоне этого отмечается существенное улучшение состояния пациентов, страдающих хроническими тяжелыми заболеваниями желудка, двенадцатиперстной кишки и кишечника.
В результате курсового использования медикаментов в сочетании с другими средствами отмечается сокращение периода выздоровления и постепенное восстановление слизистых оболочек пищеварительного тракта. Благодаря своеобразному защитному слою, который формируется на стенках органов, происходит восстановление тканей.
Нередко при гастрите, язвенной болезни отмечается образование на стенках желудка изъязвлений. Средства помогают ускорить их заживление и предотвратить дальнейшее разрушение тканей и развитие перитонита.
М-холиноблокаторы. Механизм действия
Препараты из группы М-холиноблокаторов дополнительно обладают и другими свойствами:
- Несколько подавляют активность потовых желез, что снижает потоотделение при различных нарушениях.
- Ослабляют тоническое воздействие центральной нервной системы на внутренние органы.
- При приеме в повышенных дозах учащают сердцебиение, при назначении умеренных доз приводят к уменьшению частоты сердечных сокращений.
- Оказывают воздействие на процесс фильтрации крови в почках, снижая суточный диурез.
- Подавляют активность пациента, что особенно важно при психоэмоциональном возбуждении.
- Расширяют бронхи и помогают несколько снизить секрецию мокроты, что облегчает состояние пациентов с хроническими заболеваниями дыхательной системы.
- Снижают токсическое влияние некоторых лекарств на центральную нервную систему.
Благодаря многофункциональности лекарств они могут применяться не только в гастроэнтерологии, но и при лечении патологий глаз, сердца, дыхательной системы.
М-ХОЛИНОБЛОКАТОРЫ (ПРЕПАРАТЫ) ЦЕНТРАЛЬНОГО И ПЕРИФЕРИЧЕСКОГО ДЕЙСТВИЯ.
М-ХОЛИНОМИМЕТИКИ.
Локализация М-холинорецепторов— М-холинорецепторы расположены в постсинаптической мембране клеток эффекторных органов у окончаний постганглионарных холинергических (парасимпатических) волокон. Кроме того, они имеются на нейронах вегетативных ганглиев (локализуются вне синапсов) и в ЦНС (в коре головного мозга, ретикулярной формации). Выделяют м1-холинорецепторы (в вегетативных ганглиях и в ЦНС), м2-холинорецепторы (основной подтип м- холинорецепторов в сердце) и м3-холинорецепторы (в гладких мышцах, большинстве экзокринных желез), м4-холинорецепторы (в сердце, стенке легочных альвеол, ЦНС) и м5-холинорецепторы (в ЦНС, в слюнных железах, радужной оболочке, в мононуклеарных клетках крови).
Препараты их возбуждающие —
Пилокарпина гидрохлорид, Ацеклидин
Механизм действия— прямое стимулирующее влияние на м-холинорецепторы.
Фармакологические эффекты:
1. Глаз: сокращение m.constrictorpupillae, сужение зрачка (миоз), открытие угла передней камеры глаза, улучшение оттока жидкости в Шлеммов канал, сокращение цилиарной мышцы и улучшение оттока внутриглазной жидкости через трабекулярную сеть, увеличение кривизны хрусталика (ближний фокус)
2. Действие на ССС: уменьшение ЧСС, уменьшение атриовентрикулярной проводимости, уменьшение силы сердечных сокращений, периферическая вазодилатация (опосредуется через внесинаптические М-Хр и высвобождение NO)
3. ЖКТ: увеличение тонуса и амплитуды сокращения кишечника
4. Мочевой пузырь: сокращение детрузора, уменьшение емкости мочевого пузыря.
5. Матка: у человека не чувствительна к М-агонистам.
6. Дыхательная система: сокращение мышц бронхиального дерева, повышение секреции бронхиальных желез
7. ЦНС: паркинсоноподобные эффекты.
Показания к применению—
Пилокарпин широко применяется в офтальмологической практике для понижения внутриглазного давления при глаукоме, а также для улучшения трофики глаза при тромбозе центральной вены сетчатки, острой непроходимости артерии сетчатки, при атрофии зрительного нерва, при кровоизлияниях в стекловидное тело.
Ацеклидин средство, предупреждающее и устраняющее атонию мочевого пузыря, особенно при увеличении количества мочи, связанном с нейрогенными расстройствами мочевого пузыря, при атонии мускулатуры желудочно-кишечного тракта, а также при пониженном тонусе и субинволюции матки, для остановки кровотечения в послеродовом периоде. Применяют растворы ацеклидина для сужения зрачка и снижения внутриглазного давления при глаукоме.
Противопоказания к применению отдельных препаратов –
ПИЛОКАРПИН Гиперчувствительность, ирит, циклит, иридоциклит, кератит, состояние после офтальмологических операций и др. заболевания глаз, при которых сужения зрачка нежелательно
АЦЕКЛИДИН при бронхиальной астме, тяжелых заболеваниях сердца, стенокардии, кровотечениях из желудочно-кишечного тракта, эпилепсии, гиперкинезах, при беременности (если препарат не назначают для повышения тонуса мускулатуры матки), а также при воспалительных процессах в брюшной полости до оперативного вмешательства.
Симптомы отравления мускарином— обильное слюноотделение, профузный пот, покраснение лица, тошнота, рвота, боль в животе, понос. Зрачки сужены, зрение неясное из-за спазма аккомодации. При прогрессировании отравления могут наблюдаться: расстройства ритма сердца, значительное снижение артериального давления вплоть до коллапса. Вследствие спазма бронхов и усиленной секреции бронхиальных желез дыхание затруднено, поверхностно, наблюдаются цианоз, судороги. Смерть наступает из-за асфиксии.
Меры помощи— Средством антидотной терапии является атропина сульфат, который вводят под кожу в виде 1 мл 0,1% раствора повторно (с интервалами 10 мин), до 3 раз (при наличии показаний). В тяжелых случаях препарат может быть введен внутривенно медленно. При попадании яда внутрь промывают желудок взвесью активированного угля, 0,1% раствором перманганата калия с последующим введением взвеси активированного угля, солевого слабительного. Назначают высокую клизму. При асфиксии — искусственная вентиляция легких, реанимационные мероприятия В случае расстройства кровообращения под кожу вводят камфору, кордиамин, кофеин-бензоат натрия.
АНТИХОЛИНЭСТЕРАЗНЫЕ СРЕДСТВА.
Классификация препаратов по механизму действия.
I. Препараты обратимого действия — Физостигмина салицилат Прозерин Галантамина гидробромид
II. Препараты необратимого действия Армин
Фармакологические эффекты:
1) ЦНС: низкие дозы – диффузная активация ЭЭГ, психостимуляция, высокие дозы – генерализированные судороги, кома, остановка дыхания.
2) Глаз, ЖКТ, МПС, дыхание: эффекты парасимпатической стимуляции (миоз, лакримация, саливация, кишечные спазмы, рвота, диарея, частое мочеиспускание, бронхоспазм, гиперсекреция)
3) ССС: средние дозы – умеренная брадикардия и уменьшение сердечного выброса, высокие дозы – брадикардия, снижение АД
4) Кожа – усиление потоотделение
5) Скелетные мышцы – фасцикуляция, слабость, деполяризационный блок, паралич.
Показания к применению: миастенический синдром, послеоперационная атония кишечника, атонические запоры, нарушения опорожнения мочевого пузыря после гинекологических операций и родов, устранение эффекта недеполяризующих курареподобных средств, периферический паралич поперечно-полосатой мускулатуры, полиомиелит, энцефалит, слабость родовой деятельности, атрофия зрительного нерва, для сужения зрачка и понижения внутриглазного давления при открытоугольной глаукоме.
Противопоказания к применению: механическая обструкция кишечника или мочевыводящих путей, бронхиальная астма, повышенная чувствительность к антихолинэстеразным средствам, эпилепсия, стенокардия, атеросклероз
Симптомы отравления препаратами группы ФОС
возбуждения М-холинорецепторов (миоз, саливация, потливость, рвота, диарея). Наибольшая угроза — бронхоспазм с отеком легких.
Меры помощи.
Прежде всего следует удалить ФОС с мест введения. Если это кожный покров или слизистые оболочки, их необходимо тщательно промыть 3-5% раствором натрия гидрокарбоната. При попадании веществ в пищеварительный тракт промывают желудок, дают адсорбирующие и слабительные средства, назначают высокие сифонные клизмы. Эти мероприятия проводят многократно, до исчезновения выраженных проявлений интоксикации. Если ФОС поступили в кровь, следует ускорить их выведение с мочой (с помощью форсированного диуреза). Эффективными способами очищения крови от ФОС являются гемосорбция, гемодиализ и перитонеальный диализ. Важный компонент лечения острых отравлений ФОС — применение м-холиноблокаторов (атропин и атропиноподобные средства Кроме того, следует проводить симптоматическую терапию. Необходимо постоянно следить за дыханием больного. Учитывая, что ФОС вызывают гиперсекрецию желез, следует проводить туалет полости рта и удалять секрет из трахеи и бронхов. При необходимости применяют вспомогательное или искусственное дыхание. При психомоторном возбуждении вводят аминазин, диазепам, натрия оксибутират и другие препараты угнетающего типа действия.
М-ХОЛИНОБЛОКАТОРЫ (ПРЕПАРАТЫ) ЦЕНТРАЛЬНОГО И ПЕРИФЕРИЧЕСКОГО ДЕЙСТВИЯ.
Механизм действия: блокада М-Хр. Классический пример – атропин: блокирует мускариновые рецепторы всех типов, снимает тоническое влияние ЦНС на внутренние органы, конкурентная блокада атропином снимается при увеличении концентрации АХ или мускариновых агонистов, предотвращает образование ИФ3в М1- и М3-Хр или уменьшает уровень цАМФ в М2-Хр.
Фармакологические эффекты атропина:
1) Кожа: блокада потоотделения, сухость кожи, возможно гиперпирексия, гиперемия
2) Зрение: циклоплегия (релаксация цилиарной мышцы), мидриаз (релаксация мышцы, суживающей зрачок), затруднение оттока жидкости (повышение внутриглазного давления), уменьшение лакримации (слезотечение)
3) ЖКТ: гипосаливация, снижение тонуса и моторики ЖКТ, вагусной секреции желудка, поджелудочной железы, кишечника, желчи.
4) МПС: задержка мочеиспускания, расслабление мочеточников.
5) Дыхательная система: расширение бронхов, уменьшение секреции бронхиальных желез.
6) Сердечно-сосудистая система: брадикардия в малых дозах (влияние на вагусные центры), тахикардия в высоких дозах (периферические эффекты), повышение сердечного выброса
7) ЦНС: в терапевтических дозах слабый стимулирующий эффект на ЦНС, в токсических – галлюцинации, кома.
Других М-холиноблокаторов в сравнении с ним. Если атропин сильнее влияет на сердце, бронхи, пищеварительный тракт, то скополамин — на глаза и секрецию ряда экскреторных желез. Действует скополамин менее продолжительно, чем атропин.
По влиянию на ЦНС скополамин существенно отличается от атропина. В терапевтических дозах скополамин обычно вызывает успокоение, сонливость и сон. Действует угнетающе на экстрапирамидную систему и передачу возбуждения с пирамидных путей на мотонейроны.
Синтетический препарат метацин плохо проникает через гематоэнцефалический барьер, и поэтому все его эффекты обусловлены в основном периферическим м-холиноблокирующим действием. На ЦНС не влияет. От атропина отличается более выраженным бронхолитическим эффектом. По влиянию на глаз значительно слабее атропина.
Показания к применению: язвенная болезнь желудка и 12-перстной кишки, спастические состояния ЖКТ, желчных путей, мочеточников, синдром раздражения толстой кишки, урологические расстройства: гиперкинезия МП при цистите, гиперсаливация и повышенная секреция бронхиальной слизи при наркозе, рефлекторная брадикардия и аритмия при наркозе, отравление ингибиторами АЦХЭ, мускарином (атропин)
Противопоказания к применению: глаукома,заболевания сердца, непроходимость ЖКТ, неспецифический язвенный колит
Симптомы отравления атропином: наблюдаются симптомы, связанные с подавлением холинергических влияний и воздействием вещества на ЦНС. Отмечается сухость слизистой оболочки полости рта, носоглотки, что сопровождается нарушением глотания, речи. Кожа становится сухой. Температура тела повышается. Зрачки широкие, типична фотофобия2. Характерны двигательное и речевое возбуждение, нарушение памяти и ориентации, бывают галлюцинации. Протекает отравление по типу острого психоза.
Меры помощи: Лечение состоит в удалении невсосавшегося атропина из желудочно-кишечного тракта (промывание желудка, танин, активированный уголь, солевые слабительные), ускорении выведения вещества из организма (форсированный диурез, гемосорбция) и применении физиологических антагонистов (например, антихолинэстеразных средств, хорошо проникающих в ЦНС). При выраженном возбуждении назначают диазепам (сибазон), иногда барбитураты кратковременного действия. В случае чрезмерной тахикардии целесообразно применение β-адреноблокаторов. Снижение температуры тела достигается наружным охлаждением. При необходимости налаживают искусственное дыхание. Вследствие фотофобии таких больных целесообразно помещать в затемненное помещение.
Н-ХОЛИНОМИМЕТИКИ.
Локализация Н-холинорецепторов: нейрональные ганглии АНС, мозговое вещество надпочечников, нейроны ЦНС
Препараты их возбуждающие: Никотин, цитизин, анабазина гидрохлорид
Механизм действия: оказывают двухфазное действие на н-холинорецепторы (стадия возбуждения сменяется угнетающим эффектом). Первая фаза (возбуждение) характеризуется деполяризацией мембран ганглионарных нейронов, вторая (угнетение) обусловлена конкурентным антагонизмом с ацетилхолином.
Фармакологические эффекты:
1) стимуляция автономных ганглиев (симпатических сильнее, чем парасимпатических)
2) сердечно-сосудистая система: тахикардия, периферический и коронарный вазоспазм, гипертензия
3) ЖКТ, мочевыделительная система: угнетение активности
4) хемокаротидная зона: стимуляция дыхания
5) ЦНС: низкие дозы: психостимуляция, высокие дозы – рвота, тремор, судороги, кома.
Показания к применению: облегчение отвыкания от курения, рефлекторная остановка дыхания (при операциях, травмах и т.д.),шоковые и коллаптоидные состояния (прессорный эффект), угнетение дыхания и кровообращения у больных с инфекционными заболеваниями.
Противопоказания к применению: атеросклероз, выраженном повышение артериального давления, эрозивно-язвенные поражения ЖКТ в фазе обострения, кровотечения из крупных сосудов, отек легких, беременность.
Токсикология никотина и продуктов табачного дыма.
При остром отравлении никотином отмечаются гиперсаливация, тошнота, рвота, диарея. Брадикардия сменяется тахикардией. Артериальное давление повышено, одышка переходит в угнетение дыхания. Зрачки сначала сужены, затем расширены. Помощь в основном направлена на поддержание дыхания, так как смерть наступает от паралича центра дыхания. Хроническое отравление никотином, как правило, связано с курением табака. Однако следует учитывать, что табачный дым содержит и другие токсичные вещества. Симптоматика хронического отравления довольно разнообразна. Типичны воспалительные процессы слизистых оболочек дыхательных путей. Наблюдается гиперсаливация. Кислотность желудочного сока может снижаться. Моторика толстой кишки повышается. Среди изменений со стороны кровообращения, помимо повышения артериального давления и учащения ритма сердечных сокращений, могут быть экстрасистолы, пароксизмальная тахикардия. Нередко никотин способствует развитию приступов стенокардии, иногда ослабляет зрение. Серьезные изменения наблюдаются со стороны высшей нервной деятельности. Курение табака наносит большой вред здоровью. Оно способствует развитию ишемической болезни сердца, рака легкого, хронического бронхита, эмфиземы легких и др. Повышаются преждевременная смертность и инвалидизация лиц, злоупотребляющих курением табака.
ГАНГЛИОБЛОКАТОРЫ.
Фармакокинетика
М-холиноблокаторы довольно хорошо усваиваются в организме пациентов. Показания к их применению предполагают исключение возможных противопоказаний, которые могут ухудшить фармакокинетические особенности.
После приема внутрь или парентерального введения средства быстро распространяются по системному кровотоку. В зависимости от активного компонента в составе максимальная концентрация его в крови достигается через разный промежуток времени.
Медикаменты из этой группы почти не накапливаются в организме и тканях, что считается преимуществом, так как снижает риск развития осложнений в результате передозировки.
Действующие компоненты средств перерабатываются преимущественно в печени, после чего выводятся с помощью почек. Период переработки ингредиентов занимает от 1 до 3 дней в зависимости от используемого лекарства. При поражении печени период метаболизма несколько продлевается.
Если больные страдают заболеваниями почек, замедляется выведение продуктов распада активных веществ в организме. При длительном использовании средств отмечается незначительное накапливание их в тканях, что не отражается на состоянии.
У пациентов преклонного возраста фармакокинетические особенности отличаются, что связано с естественным замедлением метаболизма и присутствием хронических заболеваний внутренних органов.
Для чего применяют М-холиноблокаторы в гастроэнтерологии? Показания к применению
Лекарства из группы М-холиноблокаторов чаще всего применяют для терапии патологий органов пищеварительной системы.
Основные показания для назначения медикаментов:
- Язвенная болезнь желудка и двенадцатиперстной кишки в острой и хронической форме. Состояние нередко сопровождается повышением выработки соляной кислоты, а также риском перфорации стенки органа. Средства помогают снизить этот риск, что предотвращает прогрессирование заболевания.
- Гастрит с выраженными симптомами и повышением кислотности желудочного сока. Средство не применяют при анацидной форме воспаления слизистой оболочки желудка, так как оно может усугубить состояние пациента.
- Патологии желчного пузыря и печени, сопровождающиеся печеночной или желчной коликой.
- Эрозивные поражения слизистой оболочки пищевода, которые провоцируют дискомфорт при приеме пищи или жидкости.
- Частая изжога в результате заброса содержимого желудка в пищевод.
- Опухоли поджелудочной железы, которые провоцируют чрезмерную выработку веществ, провоцирующих активное образование соляной кислоты. В результате наблюдается ее отрицательное воздействие на слизистую оболочку желудка.
- Эрозии и язвы на слизистой оболочке желудка, кишечника, возникающие на фоне длительного приема нестероидных противовоспалительных лекарств.
- Обострение хронической формы заболеваний пищеварительного тракта.
Лекарства из этой группы также могут включать в состав комплексного лечения патологий печени, кишечника, поджелудочной железы, желчного пузыря. В каждом случае решение о назначении принимает врач на основании данных обследования.
Показания к применению
Препараты М-холиноблокаторов используют при заболеваниях желудочно-кишечного тракта, связанных со спазмами и избыточной секрецией желез: язвенной болезни желудка и двенадцатиперстной кишки, остром панкретатите, холецистите, желчнокаменной болезни, печеночных и кишечных коликах.
Применяют препараты М-холиноблокаторов также при заболеваниях, связанных со спазмом бронхов – бронхиальной астме, хронической обструктивной болезни легких.
Используют М-холиноблокаторы для расширения зрачка и исследования глазного дна, а также при подборе очков и контактных линз для определения преломляющей способности хрусталика глаза.
Назначают М-холиноблокаторы при гиперактивном мочевом пузыре – частых мочеиспусканиях, недержании мочи, а также при почечных коликах.
Помимо этого, М-холиноблокаторы используют при брадикардии, перед операциями для уменьшения негативных эффектов наркоза, а также при отравлении препаратами холиномиметиков и антихолинэстеразными средствами (в том числе пестицидами).
Платифиллина гидротартрат также применяют при гипертоническом кризе – резком чрезмерном повышении артериального давления.
Противопоказания
М-холиноблокаторы (показания к применению анализируют вместе с противопоказаниями перед началом терапии) не используют в случае непереносимости компонентов в составе какого-либо средства или склонности к подобным проявлениям.
К другим противопоказаниям для терапии относят:
- Тяжелые патологии сердца в острой и хронической форме. При сердечной недостаточности, ишемической болезни сердца, стенокардии не стоит использовать средства из этой группы. В период восстановления после перенесения инфаркта миокарда медикаменты также не применяют, так как присутствует риск развития осложнений и усугубления симптоматики.
- Острые заболевания печени тяжелой формы. Средства могут применяться при отсутствии серьезных нарушений со стороны органа, но при прогрессировании болезни лучше от них отказаться.
- Язвенный колит в острой форме. Несмотря на положительное воздействие средств на слизистую оболочку желудка, они могут отрицательно отразиться на кишечнике.
- Острая непроходимость желудочно-кишечного тракта. При этом средства могут привести к тяжелым осложнениям.
- Глаукома тяжелой формы с выраженными расстройствами со стороны зрительного аппарата.
- Гастрит с пониженной кислотностью желудочного сока, при котором наблюдается нарушение пищеварения.
- Воспалительные патологии толстого кишечника в острой стадии.
- Гиперплазия предстательной железы тяжелой формы, сопровождающаяся выраженными расстройствами со стороны мочевыделительной системы.
- Период беременности и лактации, когда средства могут отрицательно отразиться на состоянии матери и ребенка.
- Острые состояния, связанные с желудочно-кишечными кровотечениями на фоне прободения стенки органов пищеварительного тракта.
- Грыжа пищевода.
Средства с осторожностью назначаются пациентам преклонного возраста, поскольку они часто страдают заболеваниями сердечно-сосудистой системы.
Фармакологическое действие
М-холиноблокаторы оказывают широкий спектр фармакологических эффектов: расширяют зрачок, расслабляют бронхи, повышают частоту и силу сердечных сокращений, понижают образование кислоты желудочного сока, угнетают секрецию желез пищеварительного тракта, снижают моторику желудочно-кишечного тракта и перистальтику, снижают тонус мочевого пузыря и вызывают расслабление гладких мышц мочевыводящих путей.
Платифиллина гидротартрат дополнительно расширяет сосуды, снижает артериальное давление.
Побочные эффекты
М-холиноблокаторы (показания к применению не всегда позволяют начать терапию препаратами из этой группы) могут провоцировать осложнения при неправильном использовании. Нередко осложнения связаны с непереносимостью компонентов, о которой пациент до начала применения не знал. Средства могут привести к головокружению, сильной головной боли и слабости.
Нередко отрицательные реакции затрагивают пищеварительный тракт, сопровождаются тошнотой и приступами рвоты. Состояние усугубляется расстройством пищеварения и частым жидким стулом. Иногда осложнения проявляются в виде стойкого запора, а также болей в области кишечника.
Побочные реакции затрагивают сердечно-сосудистую систему, могут снижать или повышать показатели артериального давления. При применении в умеренных дозах наблюдается брадикардия, при превышении дозировки отмечается патологическая тахикардия.
Повышение внутриглазного давления считается распространенной реакцией при длительном применении средств. Даже при отсутствии патологий зрительного аппарата возможны подобные осложнения. Отрицательные реакции могут затрагивать мочевыделительную систему, что приводит к нарушению оттока мочи и существенному уменьшению суточного диуреза.
Лекарства могут провоцировать и другие тяжелые осложнения:
- Приступы судорог.
- Галлюцинации.
- Эмоциональное возбуждение или постоянная сонливость, сильная слабость.
- Паралич дыхательной системы, сопровождающийся удушьем и другими осложнениями на фоне этого нарушения.
Наиболее тяжелым осложнением считается кома, которая развивается в большинстве случаев на фоне передозировки медикаментами. Аллергическая реакция на лекарства проявляется в стандартной форме, сопровождается сыпью, раздражением и сильным зудом.
При передозировке все отрицательные симптомы усугубляются, состояние существенно ухудшается, появляется угроза жизни пациента. При появлении осложнений стоит немедленно прекратить применение медикаментов и посетить врача, который с помощью других лекарств нормализует состояние.
Меры предосторожности
Средства из группы М-холиноблокаторов не применяются одновременно с некоторыми нестероидными противовоспалительными лекарствами, а также седативными и транквилизаторами.
При употреблении лекарств состояние больного должно контролироваться с помощью специальных исследований. Пациент регулярно посещает врача, что позволяет контролировать терапию и отмечать возможные ухудшения, требующие отмены лекарства.
В случае появления осложнений нельзя продолжать лечение. Больным также не разрешается самостоятельно превышать дозировку и продлевать терапевтический курс.
При применении лекарств в сочетании некоторыми антигистаминными средствами возможно усиление антацидного действия, что стоит учитывать. Нередко М-холиноблокаторы назначают в сочетании с противовоспалительными медикаментами, которые усиливают эффективность.
Не назначают препараты одновременно с другими антацидными на основе аналогичных компонентов, что может привести к осложнениям.
Классификация препаратов М-холиноблокаторов
Препараты группы М-холиноблокаторов классифицируют на:
- препараты системного действия: атропина сульфат, бутилскополамин (скополамина бутилбромид), гиосцин, платифиллина гидротартрат;
- селективные М1-холиноблокаторы, влияющие на образование соляной кислоты в желудке: пирензепин, телензепин;
- препараты, влияющие на тонус бронхов: ипратропия бромид, тиотропия бромид, умеклидиния бромид, аклидиния бромид, гликопиррония бромид;
- препараты, влияющие на тонус мочевого пузыря: толтеродин, оксибутинин, солифенацин, дарифенацин, троспия хлорид;
- препараты, влияющие на величину зрачка: атропина сульфат, тропикамид, циклопентолат.
Список препаратов, режим дозирования
М-холиноблокаторы (показания к применению должны быть изучены пациентами заблаговременно) представлены довольно обширной группой медикаментов. Существует множество средств этой группы, применяемых при различных нарушениях.
Но некоторые из них используются чаще всего:
- Бекарбон – средство на основе экстракта белладонны и натрия гидрокарбоната, которое доступно в таблетированной форме и оказывает выраженное антацидное, спазмолитическое действие на пищеварительный тракт пациента. Дополнительно медикамент снижает секрецию пищеварительных желез, что положительно отражается на состоянии больных. Назначается средство при несварении, гастрите и некоторых других заболеваниях. Схема применения предполагает прием 1 таблетки 3 раза в сутки за 30 мин до еды. Лечение длится до 3 недель в зависимости от выраженности проявлений.
- Бесалол также содержит экстракт белладонны, но обогащен дополнительно компонентом салол или фенилсалицилат, усиливающим эффективность. Таблетки обладают выраженными спазмолитическими и антисептическими свойствами, назначают при различных патологиях со стороны пищеварительного тракта. Принимают таблетки внутрь по 1 штуке 3 раза в сутки. Лечение обычно не длится дольше 3 недель.
- Беллалгин считается более действенным средством, так как содержит не только растительный экстракт, но и метамизол, бензокаин и натрия гидрокарбонат. Лекарство помогает устранить спазмы и боль в области органов пищеварения. Используется короткими курсами с целью улучшения состояния и остановки прогрессирования болезни. Суточная дозировка медикамента для пациентов составляет 3-6 таблеток, разделять ее следует на 3 приема в течение дня. Длительность терапии обычно составляет 5-7 дней.
- Гастроцепин – лекарство на основе пирензепина в качестве основного активного компонента. Оно активно используется в гастроэнтерологии, так как обладает выраженными антацидными свойствами, что позволяет снизить кислотность желудочного сока и уменьшить его отрицательное воздействие на стенки органа. Препарат можно принимать внутрь по 2 таблетки в сутки, его также вводят внутримышечно по 2 мл внутримышечно. Лечение может длиться 2-3 недели.
- Бускопан всегда используется в сочетании с другими средствами с целью достижения спазмолитического эффекта. Препарат помогает расслабить гладкую мускулатуру пищеварительного тракта, что существенно облегчает состояние и помогает справиться с выраженными расстройствами. Таблетки принимают внутрь по 2 штуки в сутки в течение 5-10 дней.
- Атропин считается наиболее важным и сильнодействующим представителем группы М-холиноблокаторов. Он обладает выраженными свойствами, используется при патологиях желудка, желчного пузыря и некоторых других заболеваниях. Средство в форме раствора вводят внутривенно, подкожно или внутримышечно. Они назначаются короткими курсами по 7-10 дней с ежедневным введением 1 мл лекарства. Дозировка и продолжительность применения может изменяться в зависимости от конкретного пациента.
- Метацин отличается большей эффективностью, чем некоторые другие средства, так как обладает выраженными спазмолитическими свойствами и снижает активность пищеварительных желез. Принимают средство по 2-3 таблетки в сутки перед едой. Лечение длится до 14 дней. Нередко применение комбинируют с использованием других медикаментов, которые усиливают действие и сокращают курс терапии.
Подобные средства используются чаще всего, так как обладают выраженными свойствами. Другие лекарства в большинстве случаев не назначаются.
М-холиноблокаторы
- Механизм действия
- Фармакокинетика
- Режим дозирования
- Побочные эффекты
Холиноблокаторы – лекарственные средства, предупреждающие развитие эффектов ацетилхолина в вегетативных ганглиях, в скелетных мышцах и в органах, получающих парасимпатическую иннервацию. М-холиноблокаторы различают по силе и длительности действия: короткого (диагностического) — Тропикамид (Мидриацил) и длительного (лечебного) действия — атропин, циклопентолат (Цикломед), скополамин, гоматропина метилбромид.
Также к данной группе препаратов относится комбинированный препарат Мидримакс.
В зависимости от того, в каких органах и тканях находятся м-холинорецепторы, они могут быть трех видов:
- м1 – рецепторы находятся в нервных клетках (головной мозг, периферические нервные сплетения),
- м2 – рецепторы – в сердце,
- м3 – рецепторы – в гладких мышцах глаза, бронхов, желче- и мочевыводящих путей, кишечника, а также клетках желез: потовых, слюнных, бронхиальных, желудочных.
Наличие нескольких модификаций м-холинорецепторов позволяет избирательно влиять на какую-то одну из них и избежать развития ненужных эффектов. Например, снизить тонус гладких мышц, не изменяя деятельности сердца, или расширить зрачки для осмотра глазного дна, не вызывая расслабления кишечника.
Показания к применению
- Спазмы аккомодации полустойкого и стойкого характера у детей с аномалиями рефракции.
- Комплексная терапия воспалительных заболеваний переднего отдела глаза с целью предотвращения развития задних синехий.
С диагностической целью М-холиноблокаторы используют для:
- расширения зрачка при проведении офтальмоскопии
- достижения циклоплегии с целью исследования рефракции у детей
- предоперационной подготовки больных для витреоретинальной хирургии и хирургии катаракты.
Механизм действия
| Фармакодинамика циклоплегических мидриатиков | ||||
| Препарат | Мидриаз | Циклоплегия | ||
| t до развития max эффекта, мин | длительность, дни | t до развития max эффекта, мин | длительность, дни | |
| Атропин | 30-40 | 7-10 | 60-180 | 6-12 |
| Гоматропина метилбромид | 40-60 | 1-3 | 30-60 | 1-3 |
| Скополамин | 20-30 | 3-7 | 30-60 | 3-7 |
| Циклопентолат | 30-60 | 1 | 25-75 | 0,25-1 |
| Тропикамид | 20-40 | 0,25 | 20-35 | 0,01 |
В результате блокады М-холинорецепторов, расположенных в сфинктере зрачка и цилиарной мышце, происходит пассивное расширение зрачка вследствие увеличения тонуса мышцы, расширяющей зрачок, и расслабления мышцы, его суживающей. Одновременно за счет расслабления цилиарной мышцы возникает парез аккомодации.
Интенсивно пигментированная радужка более устойчива к дилатации, для достижения достаточного мидриатического эффекта бывает необходимо увеличивать концентрацию ЛС или частоту введений. В результате увеличения дозы препарата возможно развитие системных побочных эффектов и симптомов передозировки у этой группы пациентов.
Расширение зрачка может спровоцировать острый приступ глаукомы у пациентов с закрытоугольной и смешанной глаукомой, лиц старше 60 лет и людей с гиперметропией, предрасположенных к закрытоугольной глаукоме в связи с тем, что они имеют неглубокую переднюю камеру.
Блокируя М-холинорецепторы в других органах и тканях, ЛС этой группы уменьшают секрецию слезных, слюнных, бронхиальных, потовых и желудочных желез. Мхолиноблокаторы снижают тонус гладких мышц внутренних органов (бронхов, уретры, мочевого пузыря и ЖКТ). Оказывают умеренное стимулирующее влияние на ЦНС (возбуждение, галлюцинации и т.д.) и отсроченное длительное седативное действие. Понижая тонус блуждающего нерва, приводят к увеличению частоты сердечных сокращений (ЧСС) и повышению проводимости по пучку Гисса. В высоких дозах вызывают вазодилятацию.
Фармакокинетика
Данные о глазной фармакокинетике имеются только для атропина. При местном применении (капельном или субконъюнктивальном) атропин накапливается практически во всех тканях глаза, где он частично гидролизируется под воздействием фермента — атропинэстеразы. При местном применении хорошо адсорбируется в системный кровоток. T1/2 составляет 2 ч. Около 40% метаболизируется в печени. Неизмененный препарат и его метаболиты выводятся с мочой.
Режим дозирования
С лечебной целью применяют 3-4 раза в день. Для достижения циклоплегии требуется 3-4 — кратное закапывание с интервалом 10-15 мин за 1 ч до проведения исследования.
Побочные эффекты
| Клинически значимые взаимодействия М-холиноблокаторов | |
| Лекарственные средства | Результат взаимодействия |
| Нитраты | Возрастание риска повышения ВГД |
| Прокаин (новокаин) | Усиление антихолинергического действии |
| Ингибиторы моноаминоксидазы | Возможно возникновение нарушений ритма сердца (особенно при применении с атропином) |
| Препараты ландыша | При одновременном приёме внутрь с атропином наблюдается взаимное ослабление эффектов |
- Со стороны ССС — тахикардия.
- Со стороны ЦНС— галлюцинации, возбуждение; в больших дозах у маленьких детей и стариков возможен паралич дыхания, психическое и двигательное беспокойство, головокружение, судороги, галлюцинации.
- Со стороны органа зрения — субкапсулярная катаракта, экзофтальм, глаукома, повышение ВГД.
- Со стороны ЖКТ — сухость во рту, запор.
- Со стороны мочевыделительной системы — затруднение мочеиспускания.
- Со стороны органа зрения — преходящее снижение зрения, фотофобия, отек и гиперемия кожи век и конъюнктивы
Для уменьшения побочных эффектов системного характера на несколько минут после инстилляции необходимо пережимать слёзные канальцы у внутреннего угла глаза.
Противопоказания
- Гиперчувствительность.
- ЗУГ или анатомически узкий угол передней камеры глаза.
Особенности применения М-холиноблокаторов при разных патологиях
В зависимости от конкретного заболевания специалист может назначать пациентам средства из группы М-холиноблокаторов по разной схеме. Он также может комбинировать несколько лекарств этой группы для достижения выраженного результата. Препараты также могут использоваться не только при патологиях пищеварительной системы.
| Заболевания | Применение медикаментов |
| Печеночная и желчная колика | При таких патологиях пациенту могут назначить Гастроцепин в дозировке 2 мл в сутки. Вводят средство внутримышечно. Дополнительно врач обычно использует Белларгин, назначает больному по 2 таблетки 2 раза в сутки в течение 5 дней. Обычно этого достаточно для устранения симптоматики и облегчения состояния. |
| Угроза преждевременных родов | При таких расстройствах пациента принимает Метацин по 1 таблетке 2-3 раза в сутки в зависимости от запущенности состояния. Дополнительно ей могут назначать лекарства из других групп. |
| Диспепсические расстройства разного происхождения | При таких нарушениях назначается Гастроцепин в таблетированной форме курсами по 10 дней. Он помогает существенно улучшить состояние. Пациент принимает по 1 таблетке 3 раза в день до еды. |
| Язвенная болезнь, гастрит с повышенной кислотностью желудочного сока | При таких нарушениях Бекарбон сочетают с использованием Метацина. Первый употребляют по 2 таблетки 2 раза в сутки, второй препарат принимают по 1 таблетке 3 раза в сутки. Лечение длится от 2 до 3 недель. |
| Патологии почек, сопровождающиеся формирование конкрементов или песка | Для оказания спазмолитического действия с целью облегчения выведения камней и песка назначается Бесалол. Суточная дозировка составляет 6 таблеток, ее следует разделить на 3 раза в течение дня с равными промежутками времени. Терапию продолжают в течение 7-14 дней. |
| Изжога | При изжоге назначают Гастроцепин или Бекарбон по 2-3 таблетки в сутки перед едой. Обычно терапия симптоматическая, но нередко ее сочетают с другими средствами с целью повышения эффективности. Терапия может длиться от 1 до 3 недель в зависимости от запущенности состояния и наличия сопутствующих осложнений со стороны других органов. |
при различных состояниях дозировка и схема применения лекарств может отличаться, что зависит от индивидуальных особенностей каждого пациента, но важно применять средства по назначению и в точности соблюдать рекомендации. Это позволит существенно снизить риск развития осложнений.
М-холиноблокаторы являются обширной группой медикаментов с выраженными терапевтическими свойствами. Показания к их применению предполагают назначение с целью улучшения состояния пациентов при гастритах, язвенной болезни и некоторых патологиях печени, желчного пузыря.
Многие препараты могут провоцировать тяжелые осложнения, поэтому не стоит использовать их самостоятельно без предварительного обследования.
М-холиноблокаторы в лечении гиперактивного мочевого пузыря
Гиперактивный мочевой пузырь (ГАМП) – тяжелое расстройство мочеиспускания, которым страдают не менее 17% населения старше 40 лет, из них 56% – женщины и 44% – мужчины (16). В то же время существуют различия, обусловленные полом, возрастом, этнической принадлежностью.
Рисунок 1. Распространенность ГАМП в разных возрастных группах (Milsom I., Abrams P., Cardozo L. et al., 2001)
Рисунок 2. Распространенность симптомов ГАМП (SIFO Group Survey)
Таблица 1. Топическая характеристика М-холинорецепторов в организме человека (BJU may 2000; Vol. 85, Supp. 3: 35)
Таблица 2. Сравнение аффинности к M-холинорецепторам (in vitro) толтеродина и оксибутинина
Таблица 3. Сравнительная характеристика селективности различных М-холиноблокаторов (Vesicare SmPC, Astellas, 2005)
Таблица 4. Изменения основных симптомов гиперактивности детрузора на основании 12-недельных исследований фезотеродина (Pfizer labs., 2008)
Как правило, распространенность ГАМП недооценивается, так как подавляющее большинство исследований включает пациентов только с одним из симптомов императивного недержания мочи (14, 16). С возрастом значительно увеличивается число больных с различными расстройствами функции нижних мочевых путей, особенно это относится к ГАМП (рисунок 1) (8, 20).
Некоторые современные данные отображают тот факт, что роль М2-рецепторов может быть более резко выраженной с возрастом. Полагают, что указанные рецепторы могут играть важную роль в возрастзависимом повышении ответа a1-адренорецепторов в тканях мочевого пузыря, а облегчение контрактильного ответа, связанного с a1А-адренорецепторами может быть причиной гиперактивности мочевого пузыря у пожилых людей.
Для клинического проявления гиперактивности детрузора характерны безотлагательные (императивные) позывы на мочеиспускание, поллакиурия, ноктурия и неудержание мочи при позыве (или ургентное недержание мочи) (рисунок 2). Возникая в любой период времени и зачастую в неудобном месте, указанные симптомы приносят значительное беспокойство больным.
Недержание мочи, или даже неудержание мочи, может быть также следствием нестабильности уретры, обусловленной колебаниями максимального уретрального давления более 15 см водн. ст. Неудержание мочи не является обязательным условием для постановки диагноза ГАМП, так как у половины пациентов отмечаются только сенсорные симптомы: частые дневные и ночные мочеиспускания, императивные позывы. Этот вариант симптомокомплекса получил название сухого ГАМП.
Следует иметь в виду, что наличие детрузорной гиперактивности, выявленной при уродинамическом исследовании, не означает, что больной должен страдать недержанием мочи. К примеру, бессимптомная детрузорная гиперактивность регистрируется у 42% здоровых женщин старше 65 лет (20). В случае присоединения императивного недержания мочи принято говорить о влажном, или мокром, ГАМП (14, 20, 22).
С возрастом исследователи отмечают значительное увеличение доли мокрого ГАМП. В возрасте от 65 до 74 лет ургентное недержание мочи отмечают до 20% женщин. По данным шведского исследования, у пожилых людей 75 лет и старше ургентным недержанием мочи страдают 42% женщин и 35% мужчин (Stenzelius K., Mattiasson A., Hallberg I.R., Westergren A.,2004).
С возрастом частота симптомов возрастает до 30% у лиц старше 65 лет и до 40% после 70 лет. В европейских странах почти 22 млн человек страдают этим тяжелым заболеванием, но лишь 27% из них получают лечение, что свидетельствует о недостаточной оценке проблемы как пациентами, так и медицинскими работниками (20).
Распространенность учащенного мочеиспускания и императивных позывов одинакова среди мужчин и женщин, а императивное недержание мочи чаще встречается у женщин старших возрастных групп. Этиология и патогенез императивных расстройств мочеиспускания, обусловленных гиперактивностью мочевого пузыря, до настоящего времени не ясны. Существует несколько теорий развития данного заболевания. Нервная дегенерация является общим признаком развития нестабильного мочевого пузыря. Возможно, детрузорная гиперактивность обусловлена возрастными изменениями не только в мочевых путях, но и в центральной нервной системе (ЦНС). Очевидно, что различные изменения как в периферической нервной системе, так и в ЦНС могут быть причиной гиперактивности детрузора.
Существует мнение, что этиология ГАМП связана с качественными изменениями самой гладкой мускулатуры. В норме в мочевом пузыре гладкомышечные клетки находятся в состоянии спонтанной активности. Во время наполнения, тем не менее, их активность не синхронизирована, потому что каждая из клеток связана лишь с несколькими из своих соседей, и нет особой взаимосвязи между отдельными пучками. Синхронная активация, наблюдаемая во время мочеиспускания, невозможна без густой плотной иннервации, и большое количество гладкомышечных клеток должно быть активировано с помощью нервных импульсов.
Elbadawi A. и соавт. (1997) использовали электронную микроскопию для исследования образцов тканей, полученных в результате биопсии у пожилых пациентов с дисфункцией мочеиспускания, подтвержденной уродинамическим исследованием. Исследователи описали так называемую размыкательную модель, или разобщенный паттерн, выявленный у пациентов с ГАМП. Особенность данной модели состояла в умеренном расширении межклеточных пространств, наличии редких промежуточных связей между клетками, но отличалась избыточным содержанием особых характерных выступающих сочленений и тесным прилеганием клеточных опор. Было высказано предположение, что выступающие сочленения и клеточные границы-опоры осуществляют непосредственное связывание между отдельными гладкомышечными клетками и что они вовлечены в генерацию мышечного сокращения у пациентов с ГАМП. У 5 пациентов, участвующих исходно в этом исследовании со стабильностью детрузора, со временем развилось состояние гиперактивности детрузора. Ультраструктурные исследования новых материалов биопсии показали наличие так называемой размыкательной модели в отличие от предыдущей биопсии, проведенной у тех же пациентов (Elbadawi A., Hailemariam S., Yalla S.V., Resnick N.M., 1997).
У пожилых мужчин развитие симптомов ГАМП часто сопровождается инфравезикальной обструкцией (ИВО) в результате заболеваний простаты. Около 60% мужчин с ИВО отмечают симптомы ГАМП. Точного объяснения взаимосвязи между инфравезикальной обструкцией и ГАМП пока нет. По данным Wein A.J. (2003), ГАМП встречается у 52-80% мужчин с ИВО вследствие гиперплазии простаты, а у 38% мужчин он продолжает иметь место и после хирургического устранения обструкции.
Существующие исследования указывают на ряд неврологических изменений (Steers W.D., De Groat W.C., 1988, Sibley G.N.,1987) и увеличение a-адренергической активности в результате ишемии детрузора (Perlberg S., Caine M., 1982) вследствие его гипертрофии на фоне ИВО. При гипертрофии детрузора, возникшей в результате обструкции, увеличиваются метаболические потребности в сочетании с уменьшением притока крови, что приводит к аноксии и гибели нейронов (Levin R.H. et al., 1999). Более того, имеются данные о том, что плотность холинергических нервных волокон в детрузоре на 60% меньше в группе больных с ДГПЖ и ИВО по сравнению с группой больных того же возраста и отсутствием ИВО. Авторы считают, что значительное снижение плотности нервных волокон в ответ на ИВО вследствие ДГПЖ может привести к нарушению нейромышечного контроля мочевого пузыря.
Большая роль в развитии императивных нарушений мочеиспускания у женщин в климактерии уделяется дефициту эстрогенов и связанным с ним атрофическим изменениям в уротелии, дистрофическим изменениям в мышце мочевого пузыря (2-4). Возможно, это является причиной сенсорных симптомов, сопровождающих сухой ГАМП (поллакиурии, ноктурии, императивного позыва к мочеиспусканию). 70% женщин связывают их появление с наступлением климактерия (16), что рассматривают как один из основных факторов риска развития ГАМП у женщин. По данным Versi E. с соавт. (1995), частота стрессового недержания мочи у женщин снижается с увеличением длительности постменопаузы, и одновременно с увеличением возраста нарастает частота детрузорной гиперактивности. Некоторые исследования показали, что отдельные нейроны в спинном мозге содержат эстрогеновые рецепторы и являются мишенями для эстрогенов. Присутствие эстрогеновых рецепторов в нейронах центральных областей головного мозга повышает возможность того, что эндокринные возрастные изменения могут действовать через супраспинальный контроль мочеиспускания.
Развитие гипоксии детрузора и, как следствие ее, метаболических нарушений в его структуре нарушает его сократительную способность. Это позволяет предположить, что ишемия и гипоксия могут лежать в основе повреждения интрамуральных нейронов и приводить к изменению функции гладкой мускулатуры мочевого пузыря у пациентов с гиперактивностью детрузора. Ишемия приводит к апоптозу гладкомышечных клеток, кроме того, к нарушению нервной проводимости. Нервная ткань более чувствительна к ишемии, чем гладкая мускулатура, и некоторые из этих повреждений практически необратимы. Нервная дегенерация является общим признаком развития нестабильного мочевого пузыря. При гипертрофии детрузора, возникшей в результате обструкции, увеличиваются метаболические потребности в сочетании с уменьшением притока крови, что приводит к аноксии и гибели нейронов (Levin R.H., 1999).
Abrams P. (1985) считает, что гиперактивность детрузора у больных с ДГПЖ является не результатом ИВО, а следствием возрастных изменений в стенке мочевого пузыря. Несмотря на противоречивость данных, следует признать, что как возраст, так и ИВО могут привести к постсинаптической денервации мочевого пузыря. Это обстоятельство еще раз подчеркивает важную роль нервной системы в контроле за накопительной функцией мочевого пузыря.
Роль наследственных факторов изучается, а ряд современных исследований свидетельствует о возможности генетических изменений при наличии ГАМП.
Согласно классической физиологической концепции, функция мочевого пузыря обеспечивается антагонистическим взаимодействием симпатического и парасимпатического отделов нервной системы (14). Симпатический отдел ответственен за расслабление детрузора и сокращение уретрального сфинктера, парасимпатический – за сокращение детрузора и расслабление сфинктера. Активация той или иной системы определяет состояние нижних мочевых путей. Рецепторы в области окончаний симпатических нервов мочевого пузыря и мочеиспускательного канала в зависимости от физиологических эффектов, возникающих при их стимуляции, разделяются на a- и b-адренорецепторы.
Стимуляция a-адренорецепторов приводит к сокращению гладкомышечных волокон указанных отделов мочевых путей и увеличению уретрального сопротивления. Стимуляция b-адренорецепторов вызывает торможение активности детрузора и его физиологическую адаптацию к поступающему объему мочи. Адренергические ингибиторные нейроны в основном отходят от n.
hypogastricus
, в то время как возбуждающие нервы, как полагают, отходят от тазового нерва и относятся к холинергическому типу. Рецепторы системы парасимпатических (холинергических) нервов равномерно расположены в мышечной стенке мочевого пузыря и почти не встречаются в области его основания и уретры. Стимуляция этих рецепторов вызывает сокращение детрузора.
В настоящее время известно пять молекулярных подтипов мускариновых М-холинорецепторов, и ткани могут содержать разное количество разных подтипов (таблица 1).
Например, гладкая мускулатура мочевого пузыря человека содержит смешанные популяции М2 и М3 подтипов. Особого внимания заслуживают М3-рецепторы, посредством которых осуществляется передача импульса на сокращение детрузора, и М2-рецепторов, воздействие на которые препятствует расслаблению его гладкой мускулатуры. Основное количество мускариновых рецепторов в мочевом пузыре приходится на М2 подтип (80%). Известно, что М2-рецепторы составляют 4/5 всех мускариновых рецепторов мочевого пузыря.
Стимуляция М3-рецепторов ацетилхолином приводит к гидролизу фосфоинозитола и в конечном счете к аккумуляции внутриклеточного кальция и сокращению гладкой мускулатуры. Активация М2-рецепторов ведет к ингибированию аденилатциклазы и возвращает симпатически-ассоциированное расслабление гладкой мускулатуры мочевого пузыря. В конечном результате это обусловливает наиболее эффективное полное опорожнение мочевого пузыря.
Некоторые современные данные отображают тот факт, что роль М2 мускариновых рецепторов может быть более резко выраженной с возрастом. Преобладание активности холинорецепторов парасимпатического отдела вегетативной нервной системы характеризует уменьшение физиологической емкости мочевого пузыря в фазу наполнения, быстрое нарастание при этом детрузорного давления, а также повышение внутрипузырного и детрузорного давлений в фазу опорожнения с увеличением максимальной объемной скорости потока мочи и сокращением времени мочеиспускания.
О превалировании активности b-адренергических элементов симпатического звена ориентируются по увеличению физиологической емкости мочевого пузыря и снижению при этом максимальных значений внутрипузырного и детрузорного давлений. Наличие некоординированных сокращений детрузора расценивается как свидетельство повышенной активности мускарино-чувствительных холинергических нейроструктур, равномерно расположенных во всем теле детрузора. Известно, что функция нижних мочевых путей осуществляется благодаря тесному антагонистическому взаимодействию адрено- и холинорецепторов симпатического и парасимпатического отделов вегетативной нервной системы. Поэтому понятно, что при поражении или функциональной недостаточности хотя бы одного вида рецепторов вся эта система гармоничного равновесия непременно нарушается ввиду превалирования действия противоположной группы рецепторов (11).
Согласно современным представлениям в нижнем мочевом тракте обнаружено много рецепторов для различных трансмиттеров, включающих такие, как оксид азота и субстанция Р. Различные ко-трансмиттеры и нейромодуляторы имеют стимулирующий эффект на гладкую мускулатуру мочевого пузыря, такие как АТФ, субстанция Р, GABA, NPY и различные другие. Возможное наличие различных нейротрансмиттеров и модуляторов в нижнем мочевом тракте много дискутировалось в течение последних двадцати лет.
Связь гиперактивности детрузора с повышением активности парасимпатического отдела вегетативной нервной системы доказана и объясняет лечебный эффект применения блокаторов периферических мускариночувствительных холинорецепторов. На их фоне влияние парасимпатического звена ослабевает, а симпатического возрастает, тем самым снижается внутрипузырное давление, снижаются или подавляются некоординированные сокращения детрузора, увеличивается эффективная емкость мочевого пузыря и улучшается адаптационная функция детрузора (5, 6).
Фармакотерапия – один из самых распространенных методов лечения ГАМП. Согласно рекомендациям это метод выбора. Затем следует поведенческая терапия, физиотерапия и остальные виды лечения. Медикаментозный метод вызывает интерес прежде всего благодаря своей доступности, возможности длительного применения и индивидуального подбора дозы и режима лечения. Патогенетическая фармакотерапия должна быть ориентирована на возможные механизмы развития ГАМП – миогенный и нейрогенный. Фармакологическое лечение гиперактивности мочевого пузыря представляет собой сложную проблему. Вопросом симптоматического лечения этого состояния занимались и отечественные, и зарубежные ученые.
Для лечения ГАМП наиболее часто применяют антихолинергические препараты, впервые предложенные Langworthy O. (1936), нарушающие проведение импульсов в парасимпатических ганглиях или препятствующие взаимодействию парасимпатического медиатора ацетилхолина с М-холинорецепторами (Diokno А. Lapides J., 1972). Большинство из этих препаратов вызывают неизбежные нежелательные явления, что обусловливает необходимость поддержания врачом баланса между преимуществами и недостатками препаратов. Антимускариновое действие обычно вызывает сухость во рту, запоры, трудности аккомодации, сонливость. Препараты нельзя назначать пациентам с нарушенным оттоком мочи из мочевого пузыря (обструктивной уропатией), обструкцией кишечника, язвенным колитом, глаукомой или миастенией. В нормальном мочевом пузыре сцепление между пучками мышечных волокон гарантирует, что возникновение диффузной активности не приведет к повышению давления в мочевом пузыре. В нестабильном (гиперактивном) мочевом пузыре эти связи усилены, что приводит к возникновению волны диффузного возбуждения, императивному позыву и неконтролируемым сокращениям детрузора. Эта гипотеза объясняет эффективность антимускариновых препаратов при ургентном недержании мочи. Если часть ганглиев возбуждается непосредственно сенсорными нервами, то подавление этого эффекта должно привести к устранению как императивных позывов, так и нестабильных сокращений.
Один из самых известных антихолинергических препаратов – атропин, который имеет выраженное системное действие. И хотя некоторые пилотные исследования показали достоверную эффективность и безопасность его внутрипузырного применения при гиперрефлексии, самый распространенный метод введения в настоящее время – это электрофорез. Отсутствие селективности действия препарата, вне всякого сомнения, становится негативным фактором, так как определяет низкую эффективность его терапевтических доз в отношении симптомов гиперактивности. Препарат в настоящий момент представляет больше исторический интерес, и его практически не применяют в лечении гиперактивности детрузора.
Fowler С. (1996) предложил препарат антихолинергического действия – оксибутинин. Ранее оксибутинин, обладающий антимускариновым, антиспазматическим и местным анестезирующим действием, назывался «золотым стандартом» в лечении ГАМП, хотя не все из вышеперечисленных свойств наблюдаются при использовании терапевтических доз. Необходим индивидуальный подбор дозы, и пациентов предупреждают, что это займет определенный период времени, в течение которого необходимо посещать врача. Оптимальной считают дозу, которая дает нужный эффект при минимальных побочных эффектах. Дозы для приема внутрь составляют от 2,5 мг однократно до 5 мг 4 раза в сутки. Стандартная стартовая доза для взрослых составляет 5 мг 2-3 раза в сутки. У пожилых рациональная стартовая доза составляет 2,5 мг 2-3 раза в сутки. Дозу необходимо поддерживать в течение 7 суток до корректировки (либо уменьшения, либо увеличения, в зависимости от выраженности клинического эффекта). С целью уменьшения выраженности побочных эффектов дозу оксибутинина снижают. Malone-Lee J. и соавт. (1992) предложили уменьшить дозу до 5 мг в сутки, Moore K. и соавт. (1990) – до 3 мг, а Bemelmans B.L.H. и соавт. (2002) – до 2,5 мг 3 раза в день.
При невозможности перорального применения оксибутинина Brendler C. и соавт. (1989), Maderbacher H., Jilg G. и соавт. (1985), Weese D.и соавт. (1993) предложили метод введения 5 мг оксибутинина непосредственно в мочевой пузырь, растворенного в 30 мл стерильной воды, 2-3 раза в день. Enzelsberger и соавт. (1995) предложили 20 мг оксибутинина, растворенные в 40 мл воды, вводить в мочевой пузырь в течение 10 дней. При двойном слепом рандоминизированном исследовании не было отмечено побочных реакций, и рекомендовано применение внутрипузырного введения оксибутинина при выраженных побочных эффектах при пероральном введении.
Альтернативный метод применения оксибутинина в ректальных свечах предложили Wiskind A.K. и соавт. (1994). Был отмечен хороший терапевтический эффект, однако такие побочные эффекты, как сухость во рту и торможение перистальтики, сохранялись.
Толтеродин – первый препарат, целенаправленно разработанный для лечения пациентов с гиперактивностью мочевого пузыря, проявляющейся учащенными императивными позывами на мочеиспускание, императивным недержанием мочи. Данный препарат разработан с использованием комплексного подхода к достижению селективности в отношении мочевого пузыря. Толтеродин – конкурентный антагонист М-холинергических рецепторов, являющийся смешанным антагонистом М2- и М3-холинорецепторов, локализующихся в мочевом пузыре и слюнных железах, блокирует кальциевые каналы и, таким образом, обладает двойным действием на мочевой пузырь. Препарат отличается селективностью в отношении мочевого пузыря. Безопасность, эффективность и переносимость толтеродина оценивали в четырех рандоминизированных двойных-слепых, параллельных, мультицентровых, 12-недельных исследованиях у больных с гиперактивностью мочевого пузыря (Appell R.A., и соавт., 2001, Drutz H., Appell R.A., 1997, Nilvebrant L. и соавт., 1997). Исследования показали хорошую переносимость препарата, высокую эффективность и выраженную селективность в отношении холинергических мускариновых рецепторов мочевого пузыря по сравнению с рецепторами слюнных желез в отличие от оксибутинина (таблица 2).
Селективность толтеродина обеспечивает возможность длительного применения препарата. Более того, по результатам исследований частота побочных эффектов при длительном (до 2 лет) применении толтеродина не увеличивается, а наоборот снижается. Так, частота возникновения сухости во рту через год применения препарата составляет 36%, а уже ко второму году приема препарата снижается до 19% (16). Частота мочеиспусканий через 12 месяцев использования снизилась на 22% а частота эпизодов ургентного недержания мочи – на 58%.
В зарубежной литературе есть данные о применении толтеродина у детей по 1 мг 2 раза в сутки, что привело к снижению частоты мочеиспусканий, уменьшению эпизодов недержания мочи, серьезные побочные явления отсутствовали. В исследовании M. Munding, H. Wessells (2001) установлено, что толтеродин уменьшает количество эпизодов ургентного недержания. У 73% принимавших препарат детей наблюдалось улучшение или излечение. По данным P. Abrams и соавт. (2001), толтеродин незначительно снижает максимальную скорость потока мочи, не снижает детрузорное давление при максимальной скорости потока мочи и не вызывает клинически значимого увеличения остаточной мочи у мужчин с ГАМП и ИВО вследствие ДГПЖ. Данный эффект толтеродина несомненно очень важен у столь многочисленной категории урологических больных.
Еще одна форма толтеродина – капсулы пролонгированного действия по 4 мг, используемые 1 раз в сутки (за исключением пациентов с выраженными нарушениями функции печени и почек – в этом случае применяют капсулы по 2 мг в сутки).
Еще один M-холиноблокатор, который используют для лечения ГАМП, – троспия хлорид. Это парасимпатолитик с периферическим, атропиноподобным действием, а также ганглионарным миотропным действием, подобным папаверину. Троспия хлорид является конкурентным антагонистом ацетилхолина на рецепторах постсинаптических мембран, блокирует мускариновое действие ацетилхолина и ингибирует ответ, вызванный постганглионарной парасимпатической активацией блуждающего нерва. Имеет высокое сродство к М1- и М3-холинорецепторам. Троспия хлорид снижает тонус гладкой мускулатуры мочевого пузыря, оказывает расслабляющее действие на гладкую мускулатуру детрузора мочевого пузыря как за счет антихолинергического эффекта, так и вследствие прямого миотропного антиспастического влияния.
Троспия хлорид – четвертичное аммониевое соединение с антимускариновым типом действия. Хотя биодоступность троспия хлорида уступает таковой третичных аминов, это не оказывает влияния на его эффективность, а только определяет необходимость его применения в более высоких дозах. Дозу препарата подбирают индивидуально от 30 до 90 мг в сутки, в зависимости от клинической картины и тяжести заболевания. Концентрация троспия хлорида при однократном приеме составляет от 20 до 60 мг, пропорциональна принятой дозе. Троспия хлорид является более гидрофильным относительно третичных соединений оксибутинина и толтеродина, хуже проникает через гематоэнцефалический барьер и реже вызывает побочные эффекты со стороны ЦНС.
При исследовании 75 женщин с недержанием мочи при ГАМП (Fuertes и соавт., 2000) было продемонстрировано не только эффективное воздействие троспия хлорида (суточная доза 40 мг, продолжительность лечения 8 недель) на клинические проявления гиперактивности детрузора и уродинамические показатели, но и улучшение показателей качества жизни пациенток на 35%. При проведении сравнения эффективности троспия хлорида и толтеродина в двойном плацебо-контролируемом исследовании у пациентов с императивными нарушениями мочеиспускания оба препарата показали снижение частоты мочеиспусканий – на 23% и 28% для толтеродина и троспия хлорида соответственно, увеличение объема мочеиспускания – на 39% и 33% соответственно. Число эпизодов недержания мочи снизилось на 67% и 73% для толтеродина и троспия хлорида соответственно. Выраженность побочных эффектов была одинаковой в обеих подгруппах (12). По данным Д.Ю. Пушкаря и соавт. (2004), на фоне приема троспия хлорида в течение 12 недель отмечено снижение числа мочеиспусканий за сутки на 20%, снижение среднего числа эпизодов недержания мочи до 40%, увеличение объема мочеиспускания на 18,8%.
Новым препаратом, с успехом применяемым для лечения ГАМП, является M-холиноблокатор солифенацин (Везикар). Солифенацин – активное вещество препарата Везикар – является специфическим конкурентным ингибитором мускариновых рецепторов (М-холинорецепторов), преимущественно М3 подтипа. При этом солифенацин имеет низкое или не имеет сродства к другим рецепторам и ионным каналам. Максимальный эффект после приема Везикара в дозах 5 или 10 мг может быть выявлен через 4 недели, что было показано в двойных слепых рандомизированных клинических испытаниях у мужчин и женщин с синдромом ГАМП. Клинический эффект от приема Везикара наблюдается уже в течение первой недели лечения, а эффективность сохраняется в течение по крайней мере 12 месяцев. Нет необходимости корректировать дозу Везикара в зависимости от возраста пациента. Площадь под кривой концентрация/время (AUC) сходна у пожилых (65-80 лет) и у здоровых молодых людей (менее 55 лет). Время достижения максимальной концентрации несколько ниже, а период полувыведения увеличивается на 20% у пожилых пациентов. Эти различия не являются клинически значимыми.
Начальная доза Везикара составляет 5 мг 1 раз в сутки, при необходимости доза может быть увеличена до 10 мг 1 раз в сутки. Наиболее частый побочный эффект Везикара – сухость во рту (отмечается у 11% пациентов при суточной дозе 5 мг и у 4%, получавших плацебо). Для солифенацина характерна низкая частота типичных для антимускариновых средств побочных эффектов (например, сухость во рту), что обусловлено более высокой селективностью препарата к тканям мочевого пузыря. Везикар более селективен в отношении мочевого пузыря, чем толтеродин и оксибутинин (таблица 3).
Эффективность препарата в дозах 5 мг 10 мг изучена и доказана во многих клинических исследованиях у больных с синдромом ГАМП: отмечено статистически значимое снижение числа мочеиспусканий (включая ночные), эпизодов ургентности, увеличение среднего объема мочеиспусканий. Эффект проявлялся уже в течение 1-й недели лечения, достигая максимальной величины через 4 недели. Эффективность препарата сохраняется в течение длительного применения (по меньшей мере 12 месяцев).
По данным проведенных исследований, на фоне применения солифенацина в дозе 5 мг и 10 мг в сутки число эпизодов ургентности снижается на 49% и 55% соответственно, число эпизодов ургентного недержания мочи – на 58% и 62% соответственно, частота мочеиспусканий (на 5 мг в сутки) – на 19%, а объем выделенной мочи увеличивается на 21% (VesicareÒ SmPC, Astellas, 2005).
С учетом высокой селективности и хорошей переносимости препарата отмечается его высокая эффективность при длительном (до 60 недель) применении. По результатам исследования, проведенного Haab F. и соавт. (2005), после 60-недельного использования солифенацина в дозировке 5 мг в сутки 62,7% пациентов стали удерживать мочу, у 43,1% снизились эпизоды ургентности, у 41,8% снизилась частота мочеиспусканий, 23,1% больных избавились от ноктурии. 81% больных, участвующих в исследовании, завершили его до конца, и лишь 4,8% выбыли из-за нежелательных побочных явлений.
Из незарегистрированных пока в России М-холиноблокаторов необходимо отметить дарифенацин и фезотеродин. Дарифенацин является антагонистом М3-рецепторов, но характеризуется более избирательным действием по сравнению с другими антихолинергическими препаратами. Пока известно, что в дозе 2,5 мг он не влияет на слюнные железы. При лечении дарифенацином уродинамические параметры улучшаются лишь в случае применения дозы 10 мг в день (24).
Фезотеродин – новый антагонист мускариновых рецепторов, также применяемый в качестве лекарственного препарата для лечения синдрома ГАМП. Эффективность фезотеродина была показана в слепых рандомизированных контролируемых исследованиях в сравнении с плацебо и с толтеродином. Европейское медицинское агенство (European Medicines Agency) в апреле 2007 года одобрило использование фезотеродина в клинической практике. Рекомендуемая стартовая доза фезотеродина составляет 4 мг в сутки однократно (доза может быть увеличена до 8 мг однократно). Бионакопление активного метаболита фезотеродина составляет 52%. После однократно или многократно принятой per
os
дозы фезотеродина от 4 мг до 28 мг плазменные концентрации активного метаболита пропорциональны принятой дозе. Приблизительно после 5 часов достигаются максимальные плазменные уровни препарата. Накопления препарата в крови не происходит даже при многократно принятой дозе фезотеродина. Результаты клинических 12-недельных исследований фезотеродина в отношении основных симптомов ГАМП представлены в таблице 4.
Помимо указанной выше селективности в отношении мочевого пузыря, важным свойством Везикара и других селективных М-холинолитиков является удобство приема – 1 раз в сутки, что наряду с высокой безопасностью существенно повышает приверженность к лечению со стороны пациентов. Появление подобных современных лекарственных средств дает надежду на более эффективное, безопасное и удобное лечение больных ГАМП в будущем. Результаты проведенных исследований демонстрируют более значимые показатели эффективности М-холиноблокаторов в комплексе с a-адреноблокаторами у различных групп пациентов, а также препаратами для заместительной гормонотерапии у женщин в климактерии.
Вероятно, в будущем необходимо отходить от принципов монотерапии симптомов комплекса императивных нарушений мочеиспускания, так как реальный путь повышения эффективности лечения этого сложного заболевания мы видим в проведении комплексной терапии, включающей не только различные виды фармакотерапии, но и физические, психологические и другие методы лечения.