28.06.2017
Заболевания иммунной и эндокринной системы | Поджелудочная железа и надпочечники
Первая ассоциация со словом «надпочечники» — адреналин. Этот знаменитый «мачо» в мире гормонов действительно родом из надпочечников. Но не он один. Помимо него небольшие парные железы снабжают организм еще и рядом других, не менее важных секретов. Чтобы понять, что теряет организм, если надпочечники перестают справляться со своей задачей (а это и есть т.н. надпочечниковая недостаточность или гипокортицизм), познакомимся поближе с ролью их гормонов на сцене театра жизни.
Большая часть надпочечников (порядка восьмидесяти-девяноста процентов) приходится на т.н. кору — «фабрику» по производству кортикостероидов. Именно их недостаток виновен в многообразии клинических проявлений у людей с надпочечниковой недостаточностью.
Глюкокортикоиды. Без них организму никак не обойтись в мире, полном неожиданностей и опасностей — стрессов, аллергенов, возбудителей, заведомо вредных или чрезмерных физико-химических факторов и пр.
Минералкортикоиды. Без их участия невозможен водно-электролитный обмен и поддержание артериального давления в коридоре физиологической нормы для конкретного организма «здесь и сейчас».
Адрогены. Значимые участники обменных процессов и регуляторы половых функций в организме как мужчин, так и женщин. Впрочем, производство гормонов этого класса не удел исключительно надпочечников. Поэтому они не столь значимы в ракурсе нашей темы.
Мозговой слой (оставшиеся десять-двадцать процентов) поставляет организму стресс-гормон номер один адреналин и его собрата — норадреналин. Последний преимущественно занят почетной обязанностью — опосредует передачу нервного импульса. Кроме того, он также участвует в стресс-реакциях, регуляции давления крови и многих других процессах.
Первичная надпочечниковая недостаточность
Ее проявления — следствия недопоступления в организм рассмотренных выше ключевых участников адаптационных и обменных процессов — кортикостероидов. А виной тому разрушение места их образования — коры.
На долю недуга этого типа приходится львиная доля всех случаев гипокортицизма (девяносто пять процентов). По имени впервые описавшего его в середине 19 века английского доктора Томаса Аддисона, называется этот недуг болезнь Аддисона.
Первые симптомы чаще всего появляются в молодом и зрелом возрасте (от двадцати до пятидесяти лет).
Что способно разрушить кору надпочечников?
- Лидирующую позицию занимают аутоиммунные процессы (девяносто восемь процентов случаев).
- На втором месте — туберкулез. Первичные очаги в большинстве случаев локализуются в легких, но с током крови возбудитель достигает надпочечники и постепенно разрушает их ткани.
- На третьем месте — наследственная патология ферментных систем, проявляющаяся в том числе дистрофическими процессами в коре желез — т.н. адренолейкодистрофия.
К разрушению ткани органа также могут привести:
- инфаркт желез;
- метастазы новообразований в ткань желез;
- хирургические вмешательства и др.
Надпочечниковая недостаточность (НН; недостаточность коры надпочечников, гипокортицизм) – клинический синдром, обусловленный недостаточной секрецией гормонов коры надпочечников в результате нарушения функционирования одного или нескольких звеньев гипоталамо-гипофизарно-надпочечниковой системы (ГГНС).
Классификация
Согласно исходной локализации патологического процесса, НН подразделяют на первичную (поражение самой коры надпочечников; 1-НН) и центральные формы: вторичную, являющуюся результатом нарушения секреции адренокортикотропного гормона (АКТГ), и третичную, развивающуюся при дефиците кортикотропин-рилизинг гормона (КРГ). Вторичную и третичную НН объединяют в центральные формы в связи со сложностью их дифференциальной диагностики в клинической практике. Нередко и та, и другая обозначаются как вторичная НН (2-НН).
I. Первичная НН (1-НН)
1. Аутоиммунная деструкция коры надпочечников:
1.1 Изолированная 1-НН аутоиммунного генеза;
1.2 1-НН в рамках аутоиммунных полигландулярных синдромов (АПС).
2. Туберкулезное поражение надпочечников.
3. Адренолейкодистрофия.
4. Метастатическое поражение коры надпочечников.
5. Поражение надпочечников при диссеминированных грибковых инфекциях.
6. ВИЧ-ассоциированный комплекс.
7. Ятрогенная 1-НН (двусторонняя адреналэктомия по поводу болезни Иценко-Кушинга, двустороннее кровоизлияние в надпочечники на фоне терапии антикоагулянтами).
II. Центральные формы НН (гипоталамо-гипофизарные заболевания: пангипопитуитаризм, опухоли гипофиза, оперативные вмешательства на гипофизе и проч.).
1-НН является относительно редким заболеванием – регистрируется от 40–60 до 100–110 новых случаев на 1 млн взрослых в год. Истинная частота центральных форм НН не известна, но ее наиболее частой причиной бывает подавление ГГНС на фоне хронической терапии глюкокортикоидами. В связи с тем, что в клинической практике наиболее часто встречается 1-НН (более 95 %), мы уделим основное внимание рассмотрению различных аспектов этого вида гипокортицизма. Клиническая картина заболевания, связанного с деструкцией надпочечников патологическим процессом, впервые и достаточно полно была описана в 1855 г. английским врачом Томасом Аддисоном (1793–1860). С тех пор 1-НН туберкулезной и аутоиммунной этиологии обозначается как болезнь Аддисона.
Этиология первичного гипокортицизма
Аутоиммунная деструкция коры надпочечников в настоящее время рассматривается в качестве основной причины 1-НН. В работах начала 1990 гг. было показано, что специфическими иммунологическими маркерами аутоиммунной деструкции коры надпочечников являются антитела к ферментам надпочечникового стероидогенеза: 21-гидроксилазе (P450c21), 17a-гидроксилазе (P450c17) и ферменту отщепления боковой цепи (P450scc).
Важным аспектом этиологии 1-НН считаются АПС. Под ними подразумевают первичное поражение аутоиммунным процессом двух и более периферических эндокринных желез, приводящее, как правило, к их недостаточности и зачастую сочетающееся с различными органоспецифическими неэндокринными заболеваниями аутоиммунного генеза. Аутоиммунный полигландулярный синдром 2 типа (АПС-2) – наиболее распространенный, но менее изученный вариант АПС. Его самым частым вариантом является синдром Шмидта, представляющий собой сочетание 1-НН и аутоиммунных тиреопатий (аутоиммуный тиреоидит или болезнь Грейвса). Реже встречается сочетание 1-НН с сахарным диабетом 1 типа (синдром Карпентера).
Аутоиммунный полигландулярный синдром 1 типа (АПС-1; APECED-Autoimmune polyendocrinopathy-candidiasis-ectodermal-dystrophy, MEDAC-Multiple Endocrine Deficiency Autoimmune Candidiasis, кандидо-полиэндокринный синдром) – редкое заболевание с аутосомно-рецессивным типом наследования или еще реже встречающееся спорадически, для которого характерна классическая триада, описанная Уайткером: слизисто-кожный кандидоз, гипопаратиреоз, 1-НН.
Деструкция коркового вещества надпочечников в результате туберкулезного процесса занимает второе место в ряду этиологических факторов 1-НН. Туберкулез надпочечников развивается вследствие гематогенного распространения микобактерий. Обычно в процесс вовлекается как корковое, так и мозговое вещество.
Адренолейкодистрофия (АЛД, болезнь Зимерлинга-Крейтцфельдта, меланодермическая лейкодистрофия) – наиболее распространенное врожденное пероксисомное заболевание с
Х-сцепленным рецессивным типом наследования, которое характеризуется избыточным накоплением предельных длинноцепочечных жирных кислот, в основном в миелине, и проявляется преимущественным поражением белого вещества ЦНС, коры надпочечников и яичек. Выделяется несколько клинических фенотипов АЛД – от тяжелой детской церебральной формы до бессимптомного течения. При адреномиелонейропатии (35 % случаев АЛД), которая, как правило, манифестирует в 3–4 десятилетии жизни, НН на фоне прогрессирующей неврологической симптоматики (спастический парапарез ног, нарушение вибрационной чувствительности, нарушение деятельности сфинктеров) развивается примерно у 2/3 пациентов. В 10–20 % случаев АЛД единственным проявлением заболевания оказывается НН без каких-либо признаков неврологической дисфункции.
Патогенез и клинические проявления надпочечниковой недостаточности
Первичная НН
В основе 1-НН лежит абсолютный дефицит кортикостероидов. Недостаток альдостерона приводит к потере натрия и воды через почки и желудочно-кишечный тракт с развитием дегидратации, гиповолемии, гипотонии, а также прогрессирующей гиперкалиемии. Дефицит кортизола – основного адаптогенного гормона человеческого организма – становится причиной снижения сопротивляемости по отношению к различным эндо- и экзогенным стрессорам, на фоне которых (чаще всего на фоне инфекций) и происходит декомпенсация НН.
Клиническая картина 1-НН была достаточно полно описана Томасом Аддисоном. За последние 150 лет к этому описанию добавились лишь незначительные дополнения.
Заболевание обычно манифестирует в возрасте 20–50 лет. Гиперпигментация кожи и слизистых – наиболее известный и типичный симптом болезни Аддисона. Она патогенетически обусловлена тем, что при 1-НН происходит гиперсекреция не только АКТГ, но и его предшественника – пропиомеланокортина (ПОМК), из которого помимо АКТГ в избытке образуется меланоцитстимулирующий гормон.
Гиперпигментация наиболее заметна на открытых частях тела (лицо, руки, шея), местах трения (кожные складки, места соприкосновения с одеждой) и естественного скопления меланина, а также на слизистых (полость рта, десны, слизистая щек на уровне зубов, места трения зубных протезов).
Похудение – еще один типичный симптом НН, прогрессирующее увеличение массы тела пациента практически исключает этот диагноз. Потеря массы тела, как правило, бывает значительной, достигая 5–20 кг. Общая и мышечная слабость в начале заболевания может быть выражена умеренно (снижение работоспособности) и достигает значительной степени при декомпенсации заболевания (вплоть до адинамии).
Кардинальный симптом 1-НН – артериальная гипотензия. Выраженная систолическая и диастолическая гипертензия в большинстве случаев позволяет исключить диагноз. Диспепсические расстройства той или иной выраженности при 1-НН наблюдаются практически всегда. Чаще – это плохой аппетит и тошнота; периодически возникают разлитые боли в животе; реже – рвота, расстройство стула. Характерный симптом 1-НН, патогенетически связанный с выраженной потерей натрия, – пристрастие к соленой пище.
Ни один из перечисленных симптомов 1-НН, взятый отдельно, не является специфичным для этого заболевания — диагностическое значение имеет только их сочетание.
Особенности клинической картины вторичного гипокортицизма (2-НН)
Важнейшее патогенетическое отличие 2-НН – отсутствие дефицита альдостерона. Дефицит АКТГ приводит в данном случае к недостаточности кортизола и андрогенов, но не затрагивает практически независимую от аденогипофизарных влияний продукцию альдостерона, секреция которого регулируется системой ренин-ангиотензин-натрий-калий. В этой связи симптоматика 2-НН достаточно бедна. Не выражены такие симптомы, как артериальная гипотензия, диспепсические расстройства, пристрастие к соленой пище. Важным отличием 2-НН от 1-НН является отсутствие гиперпигментации кожи и слизистых оболочек. На первый план в клинической картине
2-НН выступают общая слабость, похудение, реже – гипогликемические эпизоды. Облегчает диагностику наличие анамнестических или клинических данных о гипофизарной патологии, операциях на гипофизе, длительном приеме кортикостероидов.
Острый гипокортицизм
Наиболее частой причиной острого гипокортицизма является декомпенсация или острая манифестация хронических форм НН, этиология которой рассмотрена выше. Таким образом, при остром гипокортицизме практически всегда имеет место выраженная симптоматика, характерная для хронической НН. Реже речь идет о геморрагическом инфаркте надпочечников, в основе патогенеза которого лежит ДВС-синдром при септических состояниях (синдром Уотерхауса-Фридериксена) и различных коагулопатиях. В патогенезе острого гипокортицизма основную роль играют циркуляторная недостаточность и дегидратация. Выделяют три основные формы острой НН.
- Сердечно-сосудистая. В данном случае доминируют явления коллапса и острой сердечно-сосудистой недостаточности.
- Гастроинтестинальная. Доминируют диспепсические симптомы: выраженная рвота, понос. Эту форму необходимо дифференцировать с пищевыми токсикоинфекциями.
- Церебральная (менинго-энцефалическая). Пациенты в прострации, нередко в делириозном состоянии; выражена неврологическая симптоматика.
Диагностика НН
Такие исследования, как определение экскреции 17-оксикортикостреоидов (17-ОКС), 11-оксикортикостероидов (11-ОКС) и 17-кетостероидов (17-КС), считаются малоинформативными и не должны использоваться ни для диагностики НН, ни в клинической медицине в целом. Определение уровня кортизола крови имеет ограниченное диагностическое значение, поскольку у многих больных НН он оказывается на нижней границе нормы. Тем не менее выраженное снижение этого показателя – уровень кортизола
“Золотым стандартом” в диагностике 1-НН является проба с 1-24 АКТГ.
В настоящее время на российском фармацевтическом рынке имеется только один препарат 1-24 АКТГ – Синактен депо (тетракозактид), предназначенный для внутримышечного введения и обладающий длительным действием, что затрудняет интерпретацию результатов пробы. В 8–9 часов утра 1-го дня у пациента определяют уровень кортизола крови (в принципе, это исследование не обязательно, поскольку важен не относительный прирост, а пиковый уровень кортизола); в 21–22 часа пациенту внутримышечно вводится Синактен депо (250–1000 мкг препарата). На 2-й день в 8–9 часов утра определяется уровень кортизола плазмы, и если он превышает 500–550 нмоль/л, хроническая 1-НН может быть исключена. Указанная модификация теста должна рассматриваться лишь как практический выход из положения, при котором отсутствует 1-24 АКТГ для внутривенного введения, поскольку приведенный протокол теста не является общепринятым.
Наиболее значим для диагностики 2-НН тест с инсулиновой гипогликемией, при котором инсулин короткого действия вводится внутривенно в дозе 0,1–0,15 Ед/кг. Тест будет иметь диагностическое значение, если у пациента происходит снижение уровня гликемии менее 2,2 ммоль/л и развивается гипогликемическая симптоматика. Если на этом фоне уровень кортизола крови превысит 20 мкг/дл (550 нмоль/л), можно говорить о нормальном функционировании ГГНС и об отсутствии как 2-НН, так и 1-НН. Тест противопоказан пациентам с тяжелой сердечной и иной патологией, аритмиями, эпилепсией.
При лабораторном подтверждении наличия у пациента НН следующим этапом является выяснение ее причин. В клинической практике, установив диагноз 1-НН, необходимо сразу же исключить ее туберкулезную этиологию. В этих целях проводится рентгенография грудной клетки и обследование фтизиатром. При отсутствии данных, свидетельствующих о туберкулезном процессе (а это наиболее частая ситуация), предположительно ставится диагноз идиопатической (аутоиммунной) болезни Аддисона.
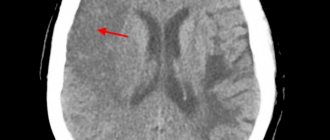
Инструментальным методам, позволяющим визуализировать надпочечники (рентгеновское исследование, компьютерная томография), в этиологической диагностике 1-НН традиционно отводится небольшая роль. Тем не менее ряд авторов сообщают, что в большинстве случаев туберкулеза надпочечников имеется их увеличение по данным КТ и МРТ, а в отдельных, относительно редких случаях могут быть обнаружены кальцинаты.
Лабораторным маркером АЛД является высокий уровень длинноцепочечных жирных кислот. Это исследование особенно показано при сочетании
1-НН с различного рода неврологической симптоматикой, в частности периферической нейропатией. Для установления диагноза АЛД определенное значение имеет электромиография, а также КТ и МРТ головного мозга.
Заместительная терапия НН
Заместительная терапия при остром гипокортицизме
- Не ожидая результатов лабораторных исследований (при возможности – предварительный забор крови для определения уровня кортизола, АКТГ, калия, общего и биохимического анализа крови), следует как можно раньше начинать внутривенное введение 2–3 литров физиологического раствора, возможно в сочетании с 5–10 % раствором глюкозы. За первые сутки вводится не менее 4 литров жидкости. Введение калийсодержащих и гипотонических растворов, а также диуретиков противопоказано.
- Немедленное введение 100 мг гидрокортизона внутривенно, затем – каждые 6 часов на протяжении первых суток. Как альтернатива (на время доставки в клинику) – 4 мг дексаметазона внутривенно (или эквивалентная доза преднизолона – 40 мг), с последующим переходом на терапию гидрокортизоном. Параллельно – симптоматическая терапия – чаще всего антибиотикотерапия вызвавших декомпенсацию заболевания инфекционных процессов.
- При положительной динамике доза гидрокортизона на 2–3 сутки уменьшается до 150–200 мг/сут (при стабильной гемодинамике препарат вводится внутримышечно). Назначать минералокортикоиды (9альфа-фторкортизол) не нужно до тех пор, пока суточная доза гидрокортизона не будет снижена до уровня менее 100 мг/сут.
При умеренной выраженности декомпенсации, а также при впервые выявленном заболевании терапию, как правило, начинают с внутримышечного введения 100–150 мг гидрокортизона в сутки (например, утром 75 мг, в обеденное время – 50 мг, вечером – еще 25 мг). Через несколько дней дозу препарата снижают и переходят на поддерживающую заместительную терапию таблетированными кортикостероидами. Выраженный положительный эффект от терапии кортикостероидами имеет важное диагностическое значение. При наличии НН пациенты уже на 1–3 сутки отмечают заметное улучшение самочувствия.
Заместительная терапия хронического гипокортицизма
Заместительная терапия 1-НН предполагает обязательное комбинированное назначение глюко- и минералокортикоидов. При 2-НН дефицит минералокортикоидов отсутствует и в назначении минаралокортикоидов (9альфа-фторкортизол), за исключением случаев обнаружения у пациента выраженной артериальной гипотензии, необходимости нет.
Заместительная терапия минералокортикоидами. Надпочечники имеют две жизненно важные функции – поддержание водно-солевого баланса и адаптация организма к стрессорным воздействиям внешней среды. При нарушении первой из них, которую обеспечивают минералокортикоиды, организм погибает в результате обезвоживания (потеря натрия и воды) и нарастающей гиперкалиемии. В то же время, дефицит глюкокортикоидов без стрессорных воздействий в принципе может и не сказаться. Тем не менее, типичной ошибкой при проведении заместительной терапии хронической 1-НН является назначение монотерапии глюкортикоидами, в лучшем случае кортизоном, но чаще всего преднизолоном. В этой ситуации, несмотря на возрастающую дозу препарата, состояние больных не нормализуется, а доза препарата продолжает увеличиваться, что приводит в ряде случаев к развитию экзогенного синдрома Кушинга.
Современная заместительная терапия 1-НН минералокортикоидами подразумевает использование только одного препарата – 9альфа-фторкортизола (флудрокортизон, Кортинефф). Кортинефф назначается один раз в сутки в дозе 0,05–0,1 мг (как правило, ежедневно утром). В клинической практике рекомендуется использовать следующие критерии адекватности терапии 9альфа-фторкортизолом:
- нормальные уровни калия и натрия плазмы;
- нормальный или умеренно повышенный уровень активности ренина плазмы;
- нормальное (комфортное) артериальное давление;
- отсутствие отечности, задержки жидкости (признаки передозировки препарата).
Основные преимущества Кортинеффа по сравнению с другими препаратами, обладающими минералокортикоидными эффектами, заключаются в эффективности при пероральном применении, а также в мощном сользадерживающем эффекте, сопоставимом с таковым альдостерона. Период полувыведения Кортинеффа составляет 18–36 часов, что позволяет имитировать практически не имеющую циркадного ритма секрецию альдостерона ежедневным однократным приемом 0,05–0,2 мг препарата. Глюкокортикоидными эффектами Кортинеффа на практике можно пренебречь, поскольку заметными они становятся, если доза препарата превышает 0,5 мг/сут.
После начала терапии Кортинеффом у некоторых пациентов развиваются легкая преходящая отечность и склонность к задержке жидкости. Эти явления не следует воспринимать как основания для отмены препарата. Спустя несколько дней (максимум неделю) они обычно саморазрешаются. Дозу Кортинеффа иногда приходится повышать летом (особенно в условиях жаркого климата) в связи с увеличением потерь натрия и воды с потом.
Следует иметь в виду некоторые особенности заместительной терапии Кортинеффом во время беременности, при которой происходит постепенное и значительное увеличение уровня прогестерона, являющегося, подобно спиронолактону, антагонистом минералокортикоидов. Поэтому во время беременности доза Кортинеффа может значительно возрастать. Подбор дозы должен осуществляться по уровню калия плазмы и артериальному давлению. Описаны случаи, когда в соответствии с перечисленными критериями дозу Кортинеффа приходилось увеличивать до 0,3 и даже до 0,6 мг в день.
Наряду с НН Кортинефф, благодаря мощным минералокортикоидным и сользадерживающим свойствам, используется в лечении идиопатической гипотонической болезни и ортостатической артериальной гипотонии.
Заместительная терапия глюкокортикоидами. В арсенале врача имеется большое число глюкокортикоидных препаратов, которые можно использовать для заместительной терапии НН. Последнюю можно проводить, используя следующие схемы:
- с применением препаратов короткого действия (гидрокортизон – 10–20 мг утром и 5–10 мг после обеда);
- с применением препаратов средней продолжительности действия (преднизолон – 5 мг утром и 2,5 мг после обеда).
Во всем мире для заместительной терапии НН наиболее часто используется таблетированный гидрокортизон. Отрицательным свойством синтетических препаратов является их относительно узкий терапевтический диапазон. Препаратом выбора у детей и подростков считается именно гидрокортизон, поскольку на фоне терапии синтетическими препаратами в ряде исследований была отмечена задержка роста детей с НН. В этой связи при использовании синтетических глюкокортикоидов можно предполагать большую частоту развития синдрома остеопении, чем при терапии гидрокортизоном.
С другой стороны, при терапии гидрокортизоном и кортизона ацетатом определенные сложности создает относительно короткий период их действия. При классическом двухразовом приеме указанных препаратов достаточно типичны жалобы пациентов на слабость в вечерние часы и рано утром до их приема. Можно выделить следующие критерии адекватности глюкокортикоидного компонента заместительной терапии НН:
- минимально выраженные жалобы на слабость и низкую работоспособность;
- отсутствие выраженной гиперпигментации кожи и ее постепенный регресс;
- поддержание нормальной массы тела, отсутствие жалоб на постоянное чувство голода и признаков передозировки (ожирение, кушингоидизация, остеопения, остеопороз).
Надежные объективные (лабораторные) критерии адекватности заместительной терапии НН глюкокортикодиами на сегодняшний день отсутствуют, и подбор терапии базируется практически исключительно на данных клинической картины и опыте врача.
Вторичная надпочечниковая недостаточность
Ее проявления (о чем подробнее поговорим ниже) частично сходны с первичной формой недуга. Но причина иная, и коренится она «наверху» — в гипоталамо-гипофизарной системе. Конкретнее — в недостаточной выработке аденогипофизом «побудительного фактора» для эндокринной активности коры надпочечников. Называется он адренокортикотропный гормон.
Что становится виновником такого состояния?
- Доброкачественные (краниофарингиомы) или злокачественные процессы в гипофизе и/или гипоталамусе.
- Травмы и хирургические вмешательства в гипоталамо-гипофизарной области.
- Некротическое поражение гипофиза после родов (т.н. синдром Шихена).
Причины, вызывающие недостаточность коры надпочечников
Недостаточность коры надпочечников бывает острая и хроническая. Хроническая недостаточность коры надпочечников может быть первичной и вторичной. Первичная недостаточность коры надпочечников (болезнь Аддисона) возникает в результате разрушения ткани самого надпочечника. Первичная недостаточность надпочечников развивается, если сохранено и функционирует менее 10-15% ткани надпочечника. К предрасполагающим факторам первичной надпочечниковой недостаточности относятся: инфекционные заболевания (сифилис, туберкулез, грибковые заболевания надпочечников); амилоидоз надпочечников; ВИЧ-инфекция; идиопатическая атрофия коры надпочечника (аутоиммунный процесс, при этом в организме по неизвестной пока причине нарушается система иммунного контроля, и образуются аутоантитела, разрушающие клетки собственных надпочечников). Вторичная недостаточность коры надпочечника возникает при заболеваниях головного мозга с поражением гипофиза или гипоталамуса (опухоли головного мозга, черепно-мозговые травмы, после операций на головном мозге, после лучевой терапии, при различных интоксикациях), которые в норме контролируют работу надпочечников. Острая надпочечниковая недостаточность, или аддисонический криз — острое коматозное состояние. Острая недостаточность коры надпочечников может развиться:
- на фоне уже имеющейся хронической недостаточности гормонов коры надпочечников;
- при оперативном удалении надпочечников по поводу болезни Иценко-Кушинга (синдром Нельсона);
- при резкой отмене глюкокортикоидов, назначенных с целью лечения.
Причиной острой надпочечниковой недостаточности может стать аутоиммунный тиреоидит (синдром Шмидта). Острая недостаточность коры надпочечников может возникнуть у новорожденного вследствие кровоизлияния в надпочечники во время тяжелых и затяжных родов, вследствие родовой травмы или воздействия различных инфекций. Такое состояние называется синдром Уотерхауза-Фридериксена. У взрослых и пожилых людей кровоизлияние в надпочечники может произойти на фоне травм живота и грудной клетки, при передозировки антикоагулянтов, при оперативных вмешательствах, сепсисе, перитонитах, ожогах. При недостаточности коры надпочечников резко падает содержание в крови их гормонов – глюкокортикоидов и минералокортикоидов. При этом организм теряет способность адаптации к стрессовой ситуации.
Симптомы надпочечниковой недостаточности
Клинические проявления обусловлены острой нехваткой в организме гормонов-регуляторов. Их острота определяется степенью гормональной недостаточности и сохранностью компенсаторных механизмов.
Для первичной формы недуга характерны:
- Потеря массы тела (от умеренной до резко выраженной).
- Астенический синдром — слабость, утомляемость. Особенно заметна мышечная слабость.
- Вялость, подавленность, раздражительность.
- Склонность к депрессии.
- Снижение полового влечения.
- Снижение артериального давления (у гипертоников до нормы, у людей с прежде нормальным давлением до показателей гипотонии).
- Обмороки, провоцируемые стрессовыми ситуациями.
- Расстройства в работе желудочно-кишечного тракта: боли, тошнота, потеря аппетита, расстройство стула и др.
- Страсть к соленому.
- Большое количество отделяемой мочи.
- Выраженная пигментация слизистых оболочек и кожных покровов (начиная с открытых участков с постепенным расширением пораженных территорий).
- Уменьшение количества волос в подмышечных и лобковой областях.
Вторичная надпочечниковая недостаточность отличается более легким течением. Причина в том, что в этом случае нарушается продукция только гюкокортикоидов, а минералкортикоиды образуются в достаточном количестве.
Для нее характерны:
- астения;
- гипогликемия, выражающаяся в преходящем недомогании, наступающем спустя несколько часов после приема пищи.
Хроническая надпочечниковая недостаточность
Оба рассмотренных выше вида нарушений продукции гормонов корой надпочечников относятся к хроническому типу.
Острая надпочечниковая недостаточность
Острая ситуация чаще всего возникает вследствие срыва механизмов, компенсирующих нехватку гормонов при болезни Аддисона. В этом случае говорят о т.н. аддисоновом кризе. В иных случаях к острой недостаточности могут привести:
- острая травма обоих желез;
- удаление пораженного опухолью надпочечника;
- кровоизлияние в ткань обоих желез (во время родов, при молниеносном сепсисе, передозировке гепарина).
Проявления:
- Со стороны сердечно-сосудистой системы (по сути шоковое состояние вплоть до развития коллапса): гипотония; учащенное сердцебиение; бледность лица, синюшность носогубного треугольника; холодные конечности; отсутствие мочеиспускания; обмороки.
- Со стороны пищеварительной системы (напоминает острое пищевое отравление): спазмы; острые боли; тошнота; вздутие живота; понос; сильная рвота.
- Со стороны нервной системы: головная боль; судороги; бредовое состояние; заторможенность вплоть до ступора.
Надпочечниковая недостаточность у детей
У детей диагностируют и первичную, и вторичную формы надпочечниковой недостаточности. Обе они бывают врожденными и приобретенными.
Детский недуг имеет свои особенности. В силу анатомо-физиологической недоразвитости желез у малышей (до третьего года жизни) повышен риск возникновения острой ситуации. Спровоцировать таковую может:
- родовая травма;
- острая инфекция;
- острый психоэмоциональный стресс;
- геморрагический инфаркт желез вследствие травмы, хирургического вмешательства, инфекции;
- передозировка лекарственных средств (например, гепарина);
- резкая отмена гормональной терапии.
В остальном причины и клинические проявления детского недуга аналогичны таковым у взрослых пациентов.
Диагностика и лечение заболеваний надпочечников в ГУТА КЛИНИК
В ГУТА КЛИНИК используются самые современные методы диагностики и лечения заболеваний надпочечников
. Мы специализируемся не только на лечении заболеваний надпочечников, но также на диагностике и лечении других эндокринных патологий – при заболеваниях щитовидной железы, при нарушениях обмена веществ, ожирении, климактерическом синдроме, сахарном диабете.
Проводится лабораторная диагностика
уровня гормонов в крови и моче, специальные тесты и инструментальные исследования (УЗИ, компьютерная томография и др.)
Поскольку заболевания надпочечников
в основном связаны со сниженным или, наоборот, повышенным уровнем гормонов надпочечников, основным методом лечения заболевания надпочечников является гормонокорригирующая терапия с динамическим наблюдением за общим состоянием здоровья пациента.
Гормональная терапия назначается строго по показаниям после проведения тщательной диагностики. Учитываются пол, возраст, характер, степень тяжести, течение и форма заболевания, а также другие факторы.
В некоторых случаях по показаниям назначается адреналэктомия (удаление надпочечников). Хирургическое лечение заболеваний проводится на уровне мировых стандартов, позволяя пациенту сохранить высокое качество жизни.
О функции надпочечников
Надпочечники – это две железы внутренней секреции, расположенные на вершинах почек. Хоть размер этих желез совсем незначительный и общая масса составляет до 12 грамм, в организме они выполняют очень важные функции. От правильной работы надпочечников зависит функционирование всего организма.
Для чего нужны надпочечники
Надпочечники состоят из наружной оболочки (коры) и внутренней части (мозговое вещество). Кора занимает около 90% объема всей железы, и лишь 10% приходится на мозговое вещество. Вырабатываемые корой и мозговым веществом гормоны абсолютно разные.
Кора синтезирует:
- гормоны, ответственные за водно-солевой обмен
- гормоны, ответственные за обмен углеводов
- половые гормоны.
Мозговое вещество вырабатывает:
- адреналин
- норадреналин
- пептиды.
Каждая из функций надпочечников критически важна для человеческого организма, и сбой при синтезе любого гормона может привести к летальному исходу или к инвалидности.
Причины заболевания надпочечников
Патология коркового слоя может быть вызвана нарушением функции головного мозга, оказывающей влияние на активность выработки гормонов в самом надпочечнике. В результате нарушения данного механизма происходит либо усиленная секреция гормонов (возникает их избыток в организме), либо подавленная (дефицит).
Наличие новообразования в надпочечнике может быть причиной постоянной гиперпродукции того гормона, в области выработки которого возникла опухоль.
Врожденная патология, воспалительные заболевания, нарушения кровообращения в надпочечнике становятся пусковым звеном в развитии такого угрожающего жизни состояния, как надпочечниковая недостаточность.