Двууглекислый натрий, натрия гидрокарбонат, натрия бикарбонат, питьевая сода — это названия одного и того же химического соединения, известного каждому человеку как «пищевая сода». Она является хорошим разрыхлителем для теста. Содовым раствором можно снять зубную боль. Но это далеко не весь спектр применения этого «чудо»-вещества. На самом деле, без гидрокарбоната натрия трудно обойтись и в быту, и в кулинарии, и в медицине, и во многих других сферах деятельности.
История создания
Пищевую соду в хлебопечении использовали с древности. Она была найдена археологами при раскопках пещер І-ІІ веков до н.э. Тогда ее добывали из золы морских водорослей или находили в виде минерала. Это химическое соединение активно использовали в древнем Египте.
Впервые химическая формула соединения — NaHCO3— была установлена ученым-французом Анри де Монсо. Благодаря этому открытию, пищевую соду стали получать синтетическим путем, что значительно удешевило ее стоимость и расширило спектр использования. С момента открытия формулы способы ее синтеза постоянно менялись, совершенствовались, становились экономически выгоднее.
Способы получения
Содержание:
- История создания
- Химические свойства
- Полезные свойства
- Возможный вред
- Медицинское применение
- Использование в кулинарии
- Применение в хозяйстве
- Использование в косметологии
- Другие способы использования
- Использование в промышленности
- Как выбрать и хранить
Первый способ промышленного получения карбоната натрия заключался в растворении каменной соли в воде, смешивании раствора с известняком и древесным углем и последующим нагреванием в печи. Однако, как оказалось, на выходе получали не пищевую, а кальцинированную соду. Кроме того, в результате такой деятельности оставалось очень много токсичных отходов (сульфида кальция и хлороводорода), поэтому от него быстро отказались.
Сегодня пищевую соду производят двумя способами — «сухим» и «мокрым», в основе каждого из которых лежит реакция карбонизации (обогащения раствора углекислотой).
Виды соды
С химической точки зрения и области применения различают несколько разновидностей соды: пищевую (питьевую), кальцинированную (бельевую) и каустическую (гидроксид натрия).
СОДА
СОДА – карбонат натрия Na2CO3, бесцветное кристаллическое вещество, очень гигроскопичное, плавящееся при 858° С и хорошо растворимое в воде. При охлаждении насыщенных водных растворов соды ниже 32–35° С из них выделяются кристаллы десятиводного карбоната натрия Na2CO3·10H2O – декагидрата карбоната натрия. Если упаривать водный раствор соды, то при температуре выше 113° С будет кристаллизоваться безводный карбонат натрия Na2CO3. Безводный карбонат натрия в технике и быту называют кальцинированной содой, а десятиводный – кристаллической содой. Есть еще гидрокарбонат натрия NaHCO3, более известный в быту и в медицине как питьевая, или пищевая, сода.
Также по теме:
НАТРИЙ
Сода была известна человеку примерно за полторы-две тысячи лет до нашей эры, а может быть и раньше. Ее добывали из содовых озер и извлекали из немногочисленных месторождений в виде минералов натрона Na2CO3·10H2O, термонатрита Na2CO3·H2O и троны Na2CO3·NaHCO3·2H2O.
Первые сведения о получении соды путем упаривания воды содовых озер относятся к 64 и приведены в сочинении римского врача Диоскорида Педания о лекарственных веществах. И ему, и алхимикам всех стран вплоть до 18 в. сода представлялась неким веществом, которое шипело с выделением какого-то газа при действии на него известных к тому времени кислот – уксусной CH3COOH и серной H2SO4.
Также по теме:
ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ
Теперь известно, что шипение – это результат выделения газообразного диоксида углерода (углекислого газа) CO2 в результате реакций
Na2CO3 + 2 CH3COOH = Na(CH3COO) + CO2 + Н2О,
Также по теме:
ЩЕЛОЧЕЙ ПРОИЗВОДСТВО
Na2CO3 + 2 H2SO4 = 2 NaHSO4 + CO2 + Н2О,
где образуются еще ацетат натрия Na(CH3COO) и гидросульфат натрия NaHSO4.
Во времена Диоскорида Педания о составе соды никто не имел понятия, ведь и диоксид углерода открыл голландский химик Ян ван Гельмонт (назвавший его «лесным газом»). только через шестьсот лет
Искусственную соду научились получать после долгих и мучительных поисков только в 18 в. Но сначала следовало определить состав этого вещества, выделив его в достаточно чистом виде. В 1736 французский химик, врач и ботаник Анри Луи Дюамель де Монсо, пользуясь водой содовых озер и применив метод перекристаллизации, впервые выделил чистую соду. Ему удалось установить, что сода содержит химический элемент «натр». Годом позже Дюамель и немецкий химик Андреас Сигизмунд Маргграф пришли к выводу, что сода Na2CO3 и поташ (карбонат калия K2CO3) – разные вещества, а не одно и то же, как считалось ранее.
Дюамель пытался получить соду, действуя уксусной кислотой CH3COOH на сульфат натрия Na2SO4. С точки зрения современного химика, это совершенно бессмысленно, но Дюамель не знал состава ни того, ни другого из взятых им исходных веществ. Ему было также неизвестно, что сильную кислоту (серную) нельзя вытеснить из солей слабой кислотой (уксусной). Тем не менее, Дюамель сделал интересное наблюдение: при нагревании смеси сульфата натрия с уксусной кислотой начали выделяться пары, которые загорелись от пламени свечи. Это была довольно летучая и горючая уксусная кислота…
История знает немало других, иногда и опасных попыток получить соду. Так, Маргграф с этой целью смешивал нитрат натрия с углем, а потом нагревал смесь. Опыт завершился вспышкой смеси, которая обожгла ему лицо и руки. Маргграф не учел, что достаточно к смеси нитрата натрия (натриевой селитры) и угля добавить серу, как получится один из видов пороха.
Правда, при проведении реакции
4NaNO3 + 5C = 2Na2CO3 + 3CO2 + 2N2
удалось получить немного соды, но какой ценой!
Первый промышленный способ получения соды зародился в России. В 1764 российский химик, швед по происхождению академик Эрик Густав Лаксман сообщил, что соду можно получить спеканием природного сульфата натрия с древесным углем.
При этом протекает реакция:
2Na2SO4 + 3C + 2O2 = 2Na2CO3 + CO2 + 2SO2
Здесь помимо карбоната натрия Na2CO3 образуются два газообразныx вещества – диоксид углерода CO2 и диоксид серы SO2.
Поскольку природный сульфат натрия часто содержит примесь карбоната кальция CaCO3 (известняка), то этой реакции сопутствует вторая:
CaCO3 + C + Na2SO4 = Na2CO3 + 4CO + CaS,
где выделяется газообразный монооксид углерода СО и получается малорастворимый сульфид кальция CaS, который при обработке смеси водой отделяется от карбоната натрия. Последняя стадия процесса – выпаривание раствора, отфильтрованного от осадка, и кристаллизация карбоната натрия.
Лаксман осуществил получение соды по своему способу в 1784 на собственном стекольном заводе в Тальцинске недалеко от Иркутска. К сожалению, дальнейшего развития этот способ не получил и вскоре был забыт. А ведь еще Петр I в 1720, отвечая на вопрос князя Голицына, зачем нужна «зода», писал: «Зодою умягчают шерсть». В 1780 российский академик Гильденштедт о.
«Зодой» или «зудой» называли в России соду. Несмотря на обилие собственного сырья для производства соды ее ввозили в Россию из-за границы вплоть до 1860.
В 1791 французский врач и химик-технолог Никола Леблан, ничего не зная о способе Лаксмана, получил патент на «Способ превращения глауберовой соли в соду» (глауберова соль – декагидрат сульфата натрия Na2SO4·10H2O). Леблан предложил для получения соды сплавлять смесь сульфата натрия, мела (карбоната кальция) и древесного угля. В описании изобретения он указывал: «Над поверхностью плавящейся массы вспыхивает множество огоньков, похожих на огни свечей. Получение соды завершается, когда эти огоньки исчезают».
При сплавлении смеси протекает восстановление сульфата натрия углем:
Na2SO4 + 4C = Na2S + 4CO
Образовавшийся сульфид натрия Na2S взаимодействует с карбонатом кальция CaCO3:
Na2S + CaCO3 = Na2CO3+ CaS
После полного выгорания угля и монооксида углерода CO («огоньки исчезают») расплав охлаждают и обрабатывают водой. В раствор переходит карбонат натрия, а сульфид кальция остается в осадке. Соду можно выделить упариванием раствора.
Свою технологию получения соды Леблан предложил герцогу Филиппу Орлеанскому, личным врачом которого он был. В 1789 герцог подписал с Лебланом соглашение и выделил ему двести тысяч серебряных ливров на строительство завода. Содовый завод в пригороде Парижа Сен-Жени назывался «Франсиада – Сода Леблана» и ежедневно давал 100–120 кг соды. Во время Французской революции в 1793 герцог Орлеанский был казнен, собственность его конфискована, а содовый завод и сам патент Леблана – национализированы. Лишь через семь лет Леблану вернули разоренный завод, восстановить который ему уже не удалось. Последние годы Леблана прошли в нищете, а в 1806 он покончил жизнь самоубийством.
Технологию производства соды по Леблану стали использовать во многих странах Европы. Первый содовый завод такого типа в России был основан промышленником М.Прангом и появился в Барнауле в 1864. Но уже через несколько лет в районе теперешнего города Березники был построен крупный содовый , где выпускалось 20 тысяч тонн соды в год. Этот завод использовал новую технологию производства соды – аммиачный способ, изобретенный бельгийским инженером-химиком Эрнестом Сольве. С этого времени заводы в России и в других странах, использовавшие метод Леблана, не выдержав конкуренции, стали постепенно закрываться: технология Сольве оказалась более экономичной.
Аммиачный способ получения соды был предложен еще в 1838–1840 английскими инженерами-химиками Г.Грей-Дьюаром и Д.Хеммингом. Они пропускали через воду газообразные аммиак NH3 и диоксид углерода CO2, которые при взаимодействии дают раствор гидрокарбоната аммония NH4HCO3:
NH3 + CO2 + H2O = NH4HCO3,
а затем добавляли к этому раствору хлорид натрия NaCl, чтобы выделить малорастворимый на холоде гидрокарбонат натрия NaHCO3:
NH4HCO3 + NaCl = NaHCO3Ї + NH4Cl
Гидрокарбонат натрия отфильтровывали и нагреванием превращали в соду:
2 NaHCO3 = Na2CO3 + CO2 + H2O
Диоксид углерода CO2, необходимый для проведения процесса, получали из карбоната кальция СаСО3 – мела или известняка – при прокаливании:
CaCO3 = CaO + CO2,
а оксид кальция CaO, который при этом получался, после обработки водой давал гидроксид кальция Ca(OH)2:
CaO + H2O = Ca(OH)2,
необходимый для получения аммиака NH3 из хлорида аммония NH4Cl:
2 NH4Cl + Ca(OH)2 = 2 NH3 + CaCl2 + 2 H2O
Таким образом, аммиак все время находился в обращении и не расходовался, отходом производства оставался только хлорид кальция CaCl2.
Эрнест Сольве не внес принципиальных новшеств в химическую основу содового процесса английских инженеров, он только технологически оформил производство, однако, это тоже непросто. В частности, он применил здесь аппараты колонного типа, которые позволили вести процесс непрерывно и достичь высокого выхода продукта.
Преимущества аммиачного метода над способом Леблана состояли в получении более чистой соды, меньшем загрязнении окружающей среды и экономии топлива (поскольку температура здесь ниже). Все вместе это привело к тому, что в 1916–1920-х закрылись почти все заводы, работавшие по методу Леблана.
Первыми в мире заводами, использующими аммиачный способ получения соды, стали бельгийский завод в Куйе, построенный по проекту самого Сольве в 1865, и Камско-Содовый завод Лихачева в России, который начал работать в 1868. Российский завод был создан полковником Иваном Лихачевым в его имении на берегу реки Камы в Казанской губернии. Лихачев добывал аммиак NH3 путем сухой перегонки отходов, которые ему поставляли почти двести кожевенных мастерских со всей округи. Диоксид углерода СО2 получали прокаливанием известняка, найденного поблизости. Завод просуществовал недолго и уже через четыре года был закрыт из-за нерентабельности: сильно подорожали и кожевенные отходы, и поваренная соль NaCl.
Сейчас в мире производится несколько млн тонн соды в год.
Карбонат натрия применяется в стеклоделии (это составная часть шихты – смеси исходных веществ, из которой выплавляется стекло), для получения мыла и других моющих средств, в целлюлозо-бумажной промышленности (для варки целлюлозы). Много соды потребляется в технологическом процессе получения алюминия, именно сода идет на обработку исходного сырья алюминиевой промышленности – бокситов. Карбонатом натрия нейтрализуют кислоты в промышленных стоках, в том числе – при очистке нефтепродуктов, осаждают из растворов солей нерастворимые карбонаты и гидроксиды, которые после прокаливания используются как пигменты:
Гидрокарбонат натрия тоже не остается без применения – он служит источником углекислого газа при выпечке хлеба и кондитерских изделий, газированных напитков, а также в огнетушителях. Кроме того, питьевая сода по-прежнему занимает свое законное место в домашней аптечке как одно из самых простых и дешевых, но очень нужных лекарственных средств.
Людмила Аликберова
Химические свойства
Гидрокарбонат натрия — это слабая кислая соль угольной кислоты. Представляет собой мелкие бесцветные кристаллы, которые при повышении температуры до 50-60°С начинают «отдавать» молекулу углекислого газа, постепенно разлагаясь до карбоната натрия (кальцинированной соды).
Реагирует с кислотами с образованием солей (хлорида, ацетата, сульфата натрия) и угольной кислоты, которая моментально расщепляется до воды и углекислоты. В воде порошок растворяется плохо и легко отделяется фильтрованием.
Как делают соду?
Сегодня пищевую соду производят по методу, который придумал еще в 1861 году бельгийский ученый-химик Эрнест Сольве. Метод Сольве оказался более безопасным для окружающей среды и эффективным, чем все предыдущие способы изготовления соды. Именно Сольве построил в 1883 году первый в России содовый завод на Березовом острове в Пермской губернии, который работает до сих пор! Правда, производят там кальцинированную соду и известковое молоко, которые, несмотря на свои названия, в пищу совсем не годятся, но необходимы для химической промышленности.
Для получения бикарбоната натрия (он же гидрокарбонат натрия, натрий двууглекислый и пищевая сода) нужен известняк, залежи которого находятся вблизи производства в городе Стерлитамак. Известняк обжигают в печах, получают известь и добавляют к ней солевой раствор, а полученную смесь выпаривают с помощью аммиака. Так получается технический бикарбонат натрия, но это еще не пищевая сода – ее нужно очистить. Для этого соду растворяют в воде и щелоках, затем в декарбонизаторе под воздействием пара происходит разложение бикарбоната: очищенный бикарбонат натрия выпадает в осадок, а вредные вещества удаляются. Далее продукт фильтруют, высушивают, измельчают и расфасовывают в пачки.
Сода никогда не остается равнодушной в компании уксуса
Полезные свойства
Польза гидрокарбоната натрия обусловлена его щелочной рН. Именно способность реагировать с кислотами и ощелачивать среду лежит в основе следующих полезных свойств пищевой соды:
- кислотонейтрализующее;
- антисептическое;
- противовоспалительное;
- противозудное;
- подсушивающее;
- противогрибковое;
- разжижающее мокроту;
- смягчающее и отбеливающее кожу.
Такое множество полезных свойств позволяет использовать это соединение в народной и традиционной медицине для лечения многих заболеваний и нормализации самочувствия человека при различных патологических и физиологических состояниях.
Задание 33
Задание 33.1
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Источник — Демонстрационный вариант КИМ ЕГЭ по химии 2019 года
Решение
1) При указанных условиях (H2SO4, 180 ᴼC) происходит внутримолекулярная дегидратация пропанола-1 с образованием пропилена (вещество Х1):
2) Взаимодействие пропилена с HCl приводит к образованию 2-хлорпропана (вещество Х2) (реакция гидрогалогенирования):
3) При взаимодействии 2-хлорпропана с водным раствором NaOH происходит замещение –Cl на гидроксильную группу, образуется изопропанол (вещество Х3):
4) Изопропанол под действием H2SO4 при нагревании (180 ᴼC) подвергается внутримолекулярной дегидратации с образованием пропилена (вещество Х1):
5) При воздействии водного раствора KMnO4 пропилен вступает в реакцию гидроксилирования с образованием пропиленгликоля (вещество Х4):
Задание 33.2
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Источник — Открытый банк заданий ЕГЭ
Решение
1) Щелочной гидролиз 1,1-дибромпропана приведет к образованию альдегида — пропаналя:
2) При взаимодействии с подкисленным раствором дихромата калия пропаналь окисляется в пропановую кислоту:
3) В результате реакции пропановой кислоты с хлором в присуствии красного фосфора образуется 2-хлорпропановая кислота:
4) 2-Хлорпропановая кислота взаимодействует с гидрокарбонатом натрия с образованием соответствующей натриевой соли:
5) Взаимодействие натриевой соли 2-хлорпропановой кислоты с иодэтаном приводит к образованию соответствующего сложного эфира — этилового эфира 2-хлорпропановой кислоты:
Задание 33.3
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Источник — Открытый банк заданий ЕГЭ
Решение
1) Метилциклогексан в присутствии платины при нагревании вступит в реакцию дегидрирования с образованием толуола:
2) В результате реакции с водным раствором перманганата калия толуол окисляется в бензоат калия:
3) Сплавление бензоата калия с гидроксидом калия приведет к образованию бензола:
4) Нитробензол получают нитрованием бензола смесью концентрированных азотной и серной кислот:
5) Нитробензол восстанавливается водородом, выделяющимся при взаимодействии Fe и HCl, до анилина. Последний далее может взаимодействовать с HCl с образованием соответствующей соли — хлорида фениламмония:
Суммарное уравнение реакции:
Задание 33.4
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Источник — Открытый банк заданий ЕГЭ
Решение
1) н-Бутан в присутствии катализатора AlCl3 изомеризуется в изобутан:
2) Взаимодействие изобутана с бромом на свету приведет к образованию 2-бром-2-метилпропана:
3) 2-Бром-2-метилпропан под действием спиртового раствора гидроксида калия дегидрогалогенируется с образованием изобутена (изобутилена):
4) Реакция изобутена с подкисленным серной кислотой раствором перманганата калия приведет к окислению углеводорода с образованием ацетона и углекислого газа:
5) Гидрирование ацетона на никеле приведет к образованию изопропилового спирта (изопропанола):
Задание 33.5
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Источник — Открытый банк заданий ЕГЭ
Решение
1) В результате взаимодействия бензола с хлорметаном в присутствии катализатора AlCl3 протекает реакция алкилирования с образованием толуола:
2) Бромирование толуола в присутствии катализатора FeBr3 приводит к образованию 4-бромтолуола (п-бромтолуола) и 2-бромтолуола (о-бромтолуола):
3) Реакция 4-бромтолуола (п-бромтолуола) с бромметаном и металлическим натрием приводит к образованию п-ксилола (реакция Вюрца-Фиттига):
4) Окисление п-ксилола по действием подкисленного серной кислотой раствора перманганата калия приведет к образованию терефталевой кислоты:
5) Терефталевая кислота с этиловым спиртом в присутствии катализатора H2SO4 вступит в реакцию этерификации с образованием сложного эфира — диэтилового эфира терефталевой кислоты (диэтилтерефталата):
Задание 33.6
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Источник — Открытый банк заданий ЕГЭ
Решение
1) Термическое разложение метана (температура около 1000о С) приводит к образованию ацетилена:
2) Ацетилен присоединяет воду в присутствии катионов двухвалентной ртути с образованием ацетальдегида (реакция Кучерова):
3) Образовавшийся этаналь (ацетальдегид) взаимодействует с аммиачным раствором оксида серебра (I) (реакция серебряного зеркала), в результате окисления альдегида образуется ацетат аммония:
4) Последующее взаимодействие с гидроксидом кальция переводит ацетат аммония в ацетат кальция:
5) Разложение ацетата кальция при нагревании приведет к образованию ацетона:
Задание 33.7
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Источник — Открытый банк заданий ЕГЭ
Решение
1) Каталитическое гидрирование дивинила (бутадиена-1,3) приводит к образованию бутена-2:
2) Реакция бутена-2 с подкисленным серной кислотой раствором перманганата калия приведет к окислению углеводорода с образованием уксусной кислоты:
3) Хлорирование уксусной кислоты в присутствии красного фосфора приведет к образованию хлоруксусной кислоты:
4) Хлоруксусная кислота взаимодействует с избытком аммиака с образованием аминоуксусной кислоты (глицина):
Cl-CH2-C(O)OH + 2NH3 → H2N-CH2-C(O)OH + NH4Cl
5) Последующее взаимодействие аминоуксусной кислоты с гидроксидом магния переводит аминокислоту в соответствующую магниевую соль:
2H2N-CH2-C(O)OH + Mg(OH)2 → [H2N-CH2-C(O)O]2Mg + 2H2O
Задание 33.8
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Источник — Открытый банк заданий ЕГЭ
Решение
1) Тримеризация этина (ацетилена) при нагревании в присутствии активированного угля приводит к образованию бензола:
2) В результате алкилирования бензола хлорметаном в присутствии хлорида алюминия (III) образуется толуол:
3) Хлорирование толуола на свету приведет к образованию бензилхлорида:
4) Бензилхлорид реагирует с водным раствором гидроксида натрия с образованием бензилового спирта:
5) Подкисленный серной кислотой раствор дихромата калия окисляет бензиловый спирт в бензойную кислоту:
Задание 33.9
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Источник — Открытый банк заданий ЕГЭ
Решение
1) В результате реакции с водным раствором перманганата калия толуол окисляется в бензоат калия:
2) Сплавление бензоата калия с гидроксидом калия приведет к образованию бензола:
3) В результате алкилирования бензола пропиленом в присутствии хлорида алюминия (III) и хлороводорода образуется изопропилбензол (кумол):
4) Изопропилбензол хлорируется на свету с получением 2-хлор-2-фенилпропана:
5) 2-Хлор-2-фенилпропан реагирует с водным раствором гидроксида натрия с образованием 2-фенилпропанола-2:
Задание 33.10
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Источник — Открытый банк заданий ЕГЭ
Решение
1) Бензол гидрируется избытком водорода в присутствии платины до циклогексана:
2) Циклогексан бромируется на свету с образованием бромциклогексана:
3) Бромциклогексан под действием спиртового раствора гидроксида калия дегидробромируется с образованием циклогексена:
4) Циклогексен присоединяет воду с образованием циклогексанола:
5) Циклогексанол окиcляется под действием подкисленного серной кислотой раствора дихромата калия в циклогексанон:
Задание 33.11
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Источник — Открытый банк заданий ЕГЭ
Решение
1) Метилпропионат вступает в реакцию гидролиза с образованием пропионовой кислоты и метанола:
2) Метанол взаимодействует с хлороводородом с образованием хлорметана:
3) Хлорметан алкилирует бензол с образованием толуола:
4) В результате нитрования толуола смесью концентрированных азотной и серной кислот получают 4-нитротолуол (п-нитротолуол):
5) 4-Нитротолуол восстанавливается водородом, выделяющимся при взаимодействии Fe и HCl, до 4-метиланилина (п-толуидин). Последний далее взаимодействует с HCl с образованием соответствующей соли:
Суммарное уравнение реакции:
Возможный вред
Пищевую соду следует употреблять внутрь в ограниченных количествах и по строгим показаниям. Кристаллы бикарбоната в большом количестве токсичны для слизистой органов пищеварения и могут вызвать сильное раздражение и ответные аллергические реакции.
Не рекомендуется употреблять растворы на основе гидрокарбоната натрия людям, страдающим эрозивно-язвенными процессами желудка и кишечника, пониженной кислотностью желудка и анацидным гастритом.
При регулярном вдыхании паров углекислого газа или кристаллов гидрокарбоната, например, на производстве соды, может возникать раздражение слизистой органов дыхания.
Частое употребление содового раствора грозит стойкими органическими нарушениями работы пищеварительной системы. Происходит ощелачивание желудочного сока, а также сдвиг в сильно щелочную сторону содержимого кишечника.
Медицинское применение
Гидрокарбонат натрия широко применяют в медицине. При этом соду используют в разных ее областях: дерматологии, гастроэнтерологии, кардиологии, пульмонологии, стоматологии, токсикологии, при ЛОР-патологиях. Помогает двууглекислый натрий от изжоги, тошноты, укачивания.
Это вещество применяют внутрь в виде содового напитка и наружно в сухом виде, в виде пасты или водного раствора для обтираний, примочек, ванночек.
В стоматологии
Полоскание раствором гидрокарбоната натрия ротовой полости снимает местное воспаление, облегчает зубную боль, укрепляет десны, устраняет неприятный запах. Соду можно использовать в качестве заменителя зубной пасты для отбеливания зубов.
В гастроэнтерологии
При тошноте делают крепкий содовый раствор (1 ст.ложка на стакан воды) и медленно выпивают его. При сильной изжоге рекомендуется чайную ложку соды растворить в стакане воды и выпить. Таким образом, на некоторое время состояние больных улучшается. Однако, необходимо отметить, что при частых изжогах следует обратиться к врачу, а не лечиться содой дома. Привычное поступление щелочного раствора вызывает реакцию нейтрализации между соляной кислотой и содой, в результате чего выделяется много углекислого газа, который вызывает вздутие. Образовашаяся углекислота раздражает химиорецепторы желудка, стимулируя тем самым рефлекторное усиление образования желудочного сока.
В кардиологии
Гидрокарбонатные ванны способствуют нормализации артериального давления и сердцебиения, что полезно при перебоях в работе сердца и сосудов. Сода способствует усилению мочеотделения, чем уменьшает общий объем циркулирующей крови. Как результат уменьшается давление кровяного столба на стенки сосудов и немного падает артериальное давление.
Прием раствора гидрокарбоната натрия внутрь при резком повышении кровяного давления является средством первой помощи при гипертоническом кризе в домашних условиях. Если выпить содовый напиток вместе с гипотензивными лекарствами, эффект усилится.
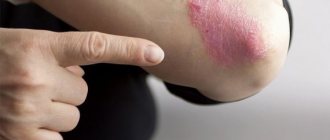
В дерматологии
Мыльно-содовые ванночки и аппликации помогают избавиться от грибкового поражения ногтей, а также от мозолей и натоптышей. Пастой из пищевой соды и воды нужно обрабатывать места ожогов кожи при воздействии на нее кислот, а также участки кожи с солнечными ожогами. Смачивать водой с растворенной в ней содой нужно места укусов комаров и других насекомых на коже. При сильном зуде можно посыпать кожу сухим порошком.
При проблемах с запахом пота, содовым раствором следует обработать подмышки. Бактерии и грибки, которые размножаются в поте, продуцируют кислоты, вызывающие неприятный запах, погибнут. Гидрокарбонат натрия нейтрализует эти кислоты и проявляет умеренный антисептический эффект.
Ванночки для ног на основе гидрокарбоната делают при грибковых заболеваниях ступней и ногтей. Они также помогают смягчить загрубевшую кожу пяток перед педикюром. Горячие ванночки из крепкого раствора пищевой соды помогают при панариции (гнойном воспалении под ногтем).
При ЛОР-патологиях
Гидрокарбонат натрия при попадании в вязкую мокроту, реагирует с кислотами, содержащимися в ней. Образовавшиеся пузырьки углекислого газа и вода разжижают мокроту, увеличивают ее количество и облегчают откашливание.
Для приготовления отхаркивающего средства при трахеитах, ларингитах, бронхитах, а также при сильном кашле чайную ложку пищевой соды разводят в 200 мл теплого молока. Этот эликсир пьют перед сном. Вместо такого напитка можно делать паровые ингаляции с содой. Столовую ложку порошка разводят в литре горячей воды и дышат над ней. Для усиления эффекта в раствор можно добавить несколько капель эфирных масел эвкалипта, сосны или розмарина. Полосканиями горла раствором из соли и соды снимают воспаление гланд при ангине.
Внутривенное введение стерильного водного раствора натрия гидрокарбоната часто применяют в реанимации, инфекционных отделения и токсикологии при отравлениях, интоксикациях. метаболическом ацидозе.
Натрия гидрокарбонат раствор для инфузий 40 мг/мл 200 мл, 28 флаконов
Владелец регистрационного удостоверения
ДАЛЬХИМФАРМ (Россия)
Лекарственная форма
Лекарственный препарат — Натрия гидрокарбонат (Sodium hydrocarbonate)
Описание
Раствор для инфузий
прозрачный, бесцветный.
1 мл
натрия гидрокарбонат 40 мл
Вспомогательные вещества
: вода д/и до 100 мл.
100 мл — бутылки для крови и кровезаменителей (1) — пачки картонные. 100 мл — бутылки для крови и кровезаменителей (35) — ящики картонные. 200 мл — бутылки для крови и кровезаменителей (1) — пачки картонные. 200 мл — бутылки для крови и кровезаменителей (28) — ящики картонные. 400 мл — бутылки для крови и кровезаменителей (1) — пачки картонные. 400 мл — бутылки для крови и кровезаменителей (15) — ящики картонные.
Показания
Метаболический ацидоз (в т.ч. при сахарном диабете, инфекциях, интоксикациях, заболеваниях почек, наркозе, в послеоперационном периоде); в качестве симптоматического средства для купирования изжоги, неприятных ощущений в эпигастрии, связанных с повышенной кислотностью желудочного сока; симптоматическое лечение кашля с вязкой и трудноотделяемой мокротой при различных заболеваниях дыхательных путей; морская и воздушная болезнь.
Для местного применения: воспалительные заболевания полости рта, глаз, верхних дыхательных путей, для разрыхления ушной серы.
Противопоказания к применению
Состояния, сопровождающиеся развитием метаболического алкалоза.
Фармакологическое действие
Антацидное средство, регулирует КЩР. Обладает щелочными свойствами, повышает щелочной резерв крови. При приеме внутрь быстро нейтрализует соляную кислоту желудочного сока и оказывает быстрый, но кратковременный антацидный эффект. Раздражает рецепторы слизистой оболочки желудка, усиливает выделение гастрина с вторичной активацией секреции, может вызывать неприятные ощущения в желудке (вследствие его растяжения) и отрыжку.
Обладает отхаркивающим действием за счет уменьшения вязкости мокроты в связи со сдвигом в щелочную сторону реакции бронхиальной слизи.
Всасываясь, приводит к развитию алкалоза. Ощелачивание мочи предупреждает осаждение мочевой кислоты в мочевыводящих путях.
Облегчает симптомы морской и воздушной болезни.
Лекарственное взаимодействие
При одновременном применении уменьшается выведение амфетамина с мочой вследствие повышения pH мочи под влиянием натрия гидрокарбоната.
При приеме внутрь натрия гидрокарбоната на фоне применения лития карбоната в установленных поддерживающих дозах возможно уменьшение концентрации лития в плазме крови, что обусловлено влиянием ионов натрия.
При одновременном применении с метотрексатом усиливается выведение метотрексата с мочой и уменьшается его токсическое действие на почки вследствие повышения pH мочи под влиянием натрия гидрокарбоната.
При одновременном приеме внутрь уменьшается всасывание тетрациклинов.
Вследствие повышения pH мочи под влиянием натрия гидрокарбоната наблюдается задержка выведения эфедрина из организма и повышается риск развития побочных эффектов (тремор, тревога, нарушения сна, тахикардия).
При в/в капельном введении натрия гидрокарбоната возможно усиление антигипертензивного эффекта резерпина.
Режим дозирования
Применяют внутрь, парентерально, местно наружно. Режим дозирования зависит от показаний и способа введения.
Побочное действие
При длительном применении
возможно развитие алкалоза (иногда некомпенсированного), сопровождающегося потерей аппетита, тошнотой, рвотой, болями в эпигастральной области, беспокойством, головными болями, а в некоторых тяжелых случаях тетаническими судорогами; повышение АД, метеоризм (при приеме внутрь).
Особые указания
Не рекомендуется применять систематически в связи с тем, что при нейтрализации хлористоводородной кислоты желудка натрия гидрокарбонатом происходит выделение углекислоты, которая оказывает возбуждающее действие на рецепторы слизистой оболочки желудка, усиливает выделение гастрина и может вызвать вторичное усиление секреции. Кроме того, при длительном регулярном применении возможно защелачивание мочи и повышение риска образования фосфатных камней.
Интенсивное выведение CO2 может спровоцировать перфорацию стенок ЖКТ.
У пациентов с сопутствующими заболеваниями сердца или почек избыточное употребление натрия вызывает отеки и сердечную недостаточность.
Применение при нарушениях функции почек
Ограничения при нарушениях функции почек — С осторожностью.
У пациентов с сопутствующими заболеваниями почек избыточное употребление натрия вызывает отеки и сердечную недостаточность.
Использование в кулинарии
Многогранно применение гидрокарбоната натрия и в кулинарии. Способность соды при гашении уксусом выделять углекислый газ позволяет использовать ее в качестве разрыхлителя. Гашеная сода придает пышность омлету, тесту. Гасить соду можно уксусом или вносить порошок в сметанное или кефирное тесто. Во втором случае молочная кислота будет играть роль уксуса.
Добавление ее в блюда из бобовых позволяет сократить время их приготовления. Если использовать соду в маринаде для мяса, можно смягчить жесткие мышечные волокна. Ягодные и фруктовые муссы при добавлении в них щепотки соды становятся слаще, а кофе и чай — более прозрачными и ароматными.
Для того чтобы избавиться от нитратов в овощах, их нужно замочить в содовом растворе. Потемневший картофель можно осветлить этим же способом.
Применение в хозяйстве
Незаменимо вещество и в быту. Оно является отличным чистящим средством. Хромированные изделия и столовое серебро для возвращения им блеска натирают сухой содой, промывают мыльной водой, а затем протирают насухо мягкой ветошью.
Порошок гидрокарбоната натрия, нанесенный на увлажненную губку, устраняет царапины и потертости на половых покрытиях из винила. Кафельную плитку, кухонную плиту, мойку и сантехнику можно очистить от загрязнений, обработав густой смесью соды и воды. Эта же смесь помогает избавиться от специфического кошачьего запаха в местах, где были «метки».
Для удаления запахов
Хорошая гигроскопичность двууглекислого натрия является причиной того, что он быстро впитывает ароматы, поэтому его можно использовать для устранения различных запахов. Чтобы избавиться от неприятных запахов в холодильнике, нужно насыпать сухой порошок в стакан и поставить его в дверцу холодильника. Меняя содержимое стакана по мере необходимости (раз в 1-2 месяца), можно навсегда избавиться от специфического «холодильного» запаха.
При устойчивом запахе кислого молока «пахнущие» емкости нужно почистить сухим порошком. Аналогично поступают с посудой, имеющей запах рыбы.
Если засыпать несколько столовых ложек порошка в сливное отверстие, а через несколько минут включить теплую воду, можно устранить неприятный запах из сифона под раковиной.
Питьевая сода поможет справиться также с неприятным запахом от ковра. Для этого ковер посыпают порошком, оставляют на 20-30 минут, а затем тщательно пылесосят. Однако такой способ подходит только для нелиняющих ковров.
С помощью пищевой соды можно также предупредить появление неприятных запахов, например, из стиральной или посудомоечной машины при их длительном простое. Уезжая на длительное время из дома, следует натереть сухим гидрокарбонатом внутреннюю поверхность машинок и оставить их дверцы приоткрытыми, а после возвращения — запустить их в режиме ополаскивания.
Для ухода за одеждой
Во время машинной стирки хорошо будет добавить в стиральный порошок соду. Это поможет избавиться от неприятного запаха в стиральной машинке, улучшит качество стирки и аромат выстиранного белья. Неприятно пахнущую одежду можно выстирать в машинке, обильно посыпав ее содой.
Мокрый купальник не заплесневеет и не будет неприятно пахнуть, если после купания в бассейне или в природном водоеме его сложить в пакет с содой, а дома хорошенько выполоскать и высушить.
Зачем еще нужна сода?
Неужели весь этот сложный процесс производства пищевой соды был придуман лишь для того, чтобы булки были более пышными? Этот продукт может быть очень полезен в быту, при этом он абсолютно безопасен, нетоксичен, пожаро- и взрывобезопасен.
Сода – универсальное моющее и чистящее средство: для посуды, кафеля, раковины, ванной, при этом она не вредит коже рук и полностью смывается водой. С помощью соды можно очистить чайник от накипи (2 ст л соды + 500 мл кипятка, 5 часов) и прочистить сливные трубы (5 ст л соды + 100 мл уксуса, 1 час).
Еще одна особенность соды – она не только очищает, но избавляет от неприятного запаха, поэтому ее можно нанести на ковер или мягкую мебель, оставить на 10-15 минут, а затем пропылесосить.
Сода является мягким абразивом, который очищает и дезинфицирует детские вещи и игрушки, при этом абсолютно безопасен для кожи малышей. Для эффективного удаления пятен и устранения неприятных запахов при стирке можно добавлять соду: в отличие от некоторых стиральных порошков сода гипоаллергенна.
Сода – прекрасное чистящее средство
Использование в косметологии
Сода — отличное косметическое средство. Хороший очищающий и отбеливающий эффект имеет скраб, приготовленный из измельченных овсяных хлопьев и сухого гидрокарбоната натрия. Кожа после такого скраба становится мягкой, а регулярное его применение избавляет от прыщей. Для придания блеска волосам после мытья головы их нужно обработать раствором соды и лимонного сока.
Для похудения
Гидрокарбонат натрия применяют также для похудения. Чтобы потерять до 2 кг за одну процедуру, можно наполнить ванну теплой водой и растворить в ней 0,5 кг морской соли и 0,3 кг обычной питьевой соды. Худеющему нужно погрузиться в такую ванну на 20 минут. При этом температура воды должна быть около 40°С. Содово-солевой раствор расслабляет мышцы, снимает усталость и нервное напряжение, очищает лимфатические сосуды, уменьшает отечность тканей. После ванной обтираться не следует: достаточно надеть теплый халат. Делать такие водные процедуры лучше перед сном.
Использование в промышленности
Питьевую соду в качестве пищевой добавки Е500 использует пищевая промышленность в изготовлении хлебобулочных, мучных, кондитерских, колбасных изделий, газированных напитков, а также для очистки промышленного оборудования.
Химическая промышленность использует гидрокарбонат натрия в производстве красителей, реактивов, средств бытовой химии, пенопластов. Бикарбонатом наполняют порошковые огнетушители.
В легкой промышленности соду применяют в кожевенном производстве, для изготовления искусственной кожи, шелковых и хлопковых тканей.