Пароксетин — антидепрессант из ада?
Начало
Пароксетин, также известный под торговыми названиями Aropax, Paxil, Pexeva, Seroxat, Sereupin и Brisdelle, впервые появился на рынке в в 1992 году. Являясь эффективным при большой депрессии и различных тревожных расстройствах, он быстро занял значительную долю на рынке рецептов антидепрессантов. Однако, к концу 1990-х годов пароксетин стал часто ассоциироваться с серьезными лекарственными взаимодействиями и побочными эффектами. Когда впервые был одобрен паксил (пароксетин), его назвали «крайне необходимым и желанным дополнением к арсеналу антидепрессантов / снотворных».
Механизмы действия пароксетина
Помимо того, что он является ингибитором обратного захвата серотонина, он также обладал легкими и умеренными норадренергическими эффектами за счет ингибирования обратного захвата норадреналина (NRI или NARI) и мог активировать, что часто помогало депрессивным пациентам с летаргией.
Показания к назначению пароксетина
Пароксетин оказался эффективен при лечении генерализованной тревоги, паники, посттравматического стресса, социальной фобии, предменструального дисфорического расстройства и расстройств обсессивно-компульсивного спектра
Побочные эффекты и осложнения от терапии пароксетином
Было зафиксировано влияние пароксетина на мужскую фертильность, врожденные дефекты, гестационную гипертензию, удлинение интервала QT у младенцев, гиперпролактинемию, когнитивные нарушения у пожилых людей, аутизм, сексуальные побочные эффекты, увеличение веса и суицидальность, агрессию и акатизию у детей и подростков. Пароксетин имеет самое высокое известное сродство к транспортеру серотонина (0,13 наномоль) из всех используемых в настоящее время антидепрессантов.
Сексуальные расстройства
Пациенты могут быть готовы терпеть некоторые побочные эффекты, такие как сексуальная дисфункция, на раннем этапе лечения, но, вероятно, они менее готовы терпеть побочные эффекты, которые снижают качество их жизни во время продолжающегося лечения.
Пароксетин способствует заболеванию раком
К началу 1990-х годов исследования на животных показали, что антидепрессанты увеличивают частоту и рост рака груди у мышей. Исследователи предположили, что это увеличение заболеваемости и роста опухоли, возможно, было связано с ингибированием ферментов (например, изофермента CPY450 2D6), которые участвуют в метаболизме канцерогенов и эстрогенов, что приводит к увеличению концентрации и уровня в сыворотке канцерогенов и эстрогенов, которые связаны с раком груди . Еще одной причиной онкогенеза является повышенное ингибирование высвобождения дофамина в лактотрофах гипофиза, приводящее к растормаживанию. продукции пролактина и его повышенному уровню.
Между 2001 и 2006 годами несколько групп исследователей опубликовали исследования «случай-контроль» и обзоры антидепрессантов и исследований рака груди. Некоторые пришли к выводу, что нет связи между употреблением антидепрессантов и раком груди, в то время как другие пришли к выводу, что существует связь и / или что возможная связь между антидепрессантами и риском рака груди не была исключена, и необходимы дополнительные исследования. В исследовании 2006 г. Chien et al. пришли к выводу, что существуют ограниченные доказательства того, что когда-либо использование антидепрессантов связано с общим риском рака груди. Однако они обнаружили, что СИОЗС могут повышать риск опухолей, отрицательных по рецепторам прогестерона (PR-), рецепторам эстрогена и рецепторам отрицательного рецептора прогестерона (ER + / PR-), хотя необходимы дальнейшие исследования для подтверждения этой связи. 33% (20 из 61) исследований сообщили о положительной связи между антидепрессантами и раком. 67% (41/61) исследований сообщили об отсутствии ассоциации или антипролиферативного эффекта. Был сделан вывод, что доклинические и клинические данные неоднозначны с точки зрения демонстрации связи между приемом антидепрессантов и раком груди и яичников.
Пароксетин имеет самую высокую константу ингибирования изофермента P450 2D6 из всех антидепрессантов (Ki = 0,065–4,65 мкмоль). Это высокое сродство объясняет его высокий профиль ингибирующего взаимодействия с субстратами для 2D6. Сильное ингибирование 2D6 пароксетином также означает, что происходит значительное ингибирование метаболизма канцерогенных субстратов 2D6, что подразумевает повышенную вероятность онкогенеза. Так пароксетин был связан с увеличением на 620% риска заболеваемости раком груди у женщин, принимавших его в течение четырехлетнего периода. Канадское эпидемиологическое исследование приема антидепрессантов и рака груди показало, что у пароксетина отношение шансов (OR) для рака груди у женщин, лечившихся от депрессии и / или тревожности в течение четырехлетнего периода, составляло 7,2. Это было в несколько раз выше OR, чем у любого другого антидепрессанта или класса антидепрессантов в этом исследовании, включая трициклические антидепрессанты (TCAs), которые, как было установлено, имели средний OR 2,0.
Через ингибирование 2D6, метаболизм тамоксифена ингибируется, что, увеличивает риск смерти от рака груди в течение пятилетнего периода у женщин, принимающих оба препарата. Пароксетин также является мощным ингибитором 3A4 с множественными взаимодействиями с субстратом 3A4.
Выводы
1) Не используйте пароксетин в качестве терапии первой линии у пациенток, ранее не принимавших антидепрессанты, у которой в семейном анамнезе был рак груди; 2) Если женщина, не страдающая раком груди в анамнезе, хорошо реагирует на пароксетин, продолжайте прием пароксетина; 3) Если женщина имеет сильную семейную историю рака молочной железы (мать, сестры, бабушки или тети) или имеет положительный результат теста на BRCA1 или BRCA2, после консультации с гинекологом прекратите прием пароксетина и назначьте другое средство; 4) Всегда постепенно уменьшайте дозу пароксетина до прекращения приема и / или медленно перекрестно снижайте его при лечении другим препаратом
Клиническая эффективность препарата Рексетин (пароксетин) при расстройствах тревожного спектра
Румянцева Г.М., Степанов А.Л., Левина Т.М., ГНЦ социальной и судебной психиатрии им. В.П. Сербского, г. Москва
Введение
Тревожно-фобические расстройства относятся к наиболее распространенным психическим нарушениям, встречающимся в общемедицинской практике (А.Б. Смулевич, 1999).
Большая распространенность нарушений тревожного спектра среди населения по сравнению с депрессивными расстройствами была выявлена и в больших эпидемиологических исследованиях, проведенных в последние десятилетия прошлого столетия (D. Regier и соавт., 1998).
Тревога и депрессия, по мнению ряда ученых, не являются самостоятельными болезнями, а только стадиями развития единой аффективной патологии, при которой тревога — более адаптивный манифестирующий синдром (H. van Praag, 2000).
В структуре расстройств тревожного спектра нередко существенное место занимают фобические, навязчивые, ипохондрические, компульсивные и другие симптомы, являющиеся частью тревожного синдрома или коморбидными расстройствами.
В процессе изучения контингента обращающихся в частные медицинские центры, специализирующиеся на лечении пограничных психических расстройств, было выявлено, что тревожно-фобические нарушения занимают одно из первых мест среди причин обращения за помощью (F40-F48 МКБ-10).
При этом была отмечена определенная специфика содержания фобических проявлений. Больные испытывают затруднения в изложении/вербализации своих страхов, поскольку содержание их могло быть морально осуждаемым, непонятным для окружающих, расцениваться как признак тяжелой и опасной психической болезни, например страх нанести вред ребенку или другому близкому человеку, страх перед возможной беременностью и родами, страх заражения венерическим заболеванием, страх гомосексуального влечения и/или возможности таких контактов, страх не удержать мочеиспускание или дефекацию в общественном месте и др.
Как правило, больные, долгое время страдая от своих тягостных переживаний, боялись обращаться в медицинские учреждения и скрывали свои страхи от окружающих, нередко прибегали к помощи экстрасенсов, снятию сглаза и порчи или религиозным обрядам. В тех случаях, когда тревога становилась выраженной или присоединялись коморбидные расстройства (соматоформные и депрессивные), искали помощи в частных медицинских центрах, где, по их мнению, лучше соблюдается врачебная тайна, гарантируется анонимность и возможны большее внимание, поддержка и забота со стороны врача.
Такие состояния чаще всего расцениваются в рамках специфических (изолированных) фобий. Однако на момент обращения к специалисту фобия, как правило, сопровождается выраженным аффектом тревоги и нередко коморбидными депрессивными, соматоформными проявлениями, паническим расстройством. Настоящее исследование посвящено клиническому изучению эффективности терапии этих расстройств антидепрессантом из группы селективных ингибиторов обратного захвата серотонина (СИОЗС) Рексетин.
Материалы и методы
Под нашим наблюдением находились 20 больных женщин 25-37 лет, состояние которых можно было оценить в рамках рубрики F40.2 МКБ-10 — изолированные фобии.
Все больные были с высшим или незаконченным высшим образованием; 3 имели два высших образования. Состояли в браке или проживали совместно 18 пациенток; 13 из них имели детей.
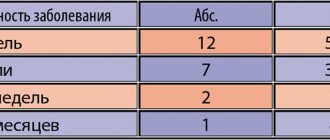
На момент обращения больные жаловались на навязчивые переживания контрастного содержания: у 11 человек это был страх причинить вред ребенку или мужу, что обычно сопровождалось боязнью острых, колющих предметов.
У 7 из этих пациенток к первичной фобии присоединился страх сойти с ума и/или, потеряв контроль над собой, совершить нелепое действие: закричать, ударить, потерять сознание и остаться без помощи, не удержать мочеиспускание.
У 3 больных имел место навязчивый страх сексуального влечения к представительницам своего пола.
У 6 больных это был страх наступления беременности и возможности ее вынашивания в связи с «состоянием своего здоровья» и последствий для «психической полноценности» будущего ребенка.
Возникновение фобических расстройств у всех больных относится к возрасту 20-27 лет.
При клиническом исследовании определено, что половина больных преморбидно была близка к акцентуированным личностям с тревожно-ананкастными чертами характера, склонным к повышенному беспокойству, ответственности, гипернормативности, сомнениям и опасениям, преимущественно ипохондрического содержания. Обычно склонность к навязчивым опасениям в отношении своего здоровья данные пациентки обнаруживали уже в детстве. Как правило, эти особенности заострялись после эмоциональных потрясений (тяжелая болезнь и смерть близкого родственника или сверстника, алкоголизм одного из родителей, ситуации, когда дети становились свидетелями несчастного случая или подвергались угрозе насилия).
Остальные пациентки не имели выраженных акцентуаций характера и отличались активностью, целеустремленностью и были социально успешными.
Страхи у них возникали на фоне длительной психотравмирующей ситуации (дисгармония семейных или партнерских отношений, конфликт на работе) или вскоре после острых стрессовых переживаний (нападение и насилие, смерть первого ребенка, вынужденный аборт, выкидыш, разрыв отношений).
Отягощение болезненных проявлений происходило постепенно либо за счет присоединения навязчивостей другого (ипохондрического) содержания (страх сумасшествия, инсульта/инфаркта, онкологического заболевания), либо за счет усиления тревоги и появления депрессивных синдромов.
Несмотря на сложность клинической картины, на первом месте всегда стоял диагноз специфической фобии, поскольку длительное время болезнь ограничивалась только этими симптомами. Коморбидными были в
9 случаях паническое расстройство (F41.0), в 11 случаях — смешанное тревожно-депрессивное расстройство (F41.2).
Паническое расстройство возникало на высоте навязчивых страхов (например, причинить вред ребенку, потерять сознание на улице, накануне медицинских обследований). В структуре панического расстройства были выраженный страх, телесное напряжение, вегетососудистый и соматический компонент. Частота и выраженность панических атак были незначительными, состояния не требовали экстренной медицинской помощи, больные справлялись с паническими симптомами самостоятельно или с помощью близких. У всех больных нарушался сон, сновидения приобретали тягостный, тревожный, гнетущий характер. Формировалось избегающее поведение: больные переставали посещать места, где имелись острые и колющие предметы, метро, лифты, замкнутые помещения, избегали авиаперелетов.
В случаях развития смешанного тревожно-депрессивного расстройства состояние пациенток характеризовалось усилением генерализованной тревоги. При этом в равной степени были и соматические, и психические компоненты тревоги. Затем присоединялось подавленное настроение с раздражительностью, бессонницей, ангедонией, снижением аппетита, прогрессивной потерей массы тела.
Для обследования больных были применены шкала тревоги и депрессии Гамильтона и шкала фобий Шихана.
Всем больным назначен рексетин (пароксетин) в начальной дозе 20 мг. Увеличение дозы до 40 мг проводили по показаниям через 1 нед. 3 пациенткам и на 4-5-й неделе лечения еще 5 больным. Пациентки на время лечения не меняли свой привычный жизненный график и не утрачивали трудоспособность.
На 1-й неделе лечения все больные получали бензодиазепины (алпразолам, клоназепам) для коррекции острого чувства тревоги, беспокойства и характерной бессонницы. Снижение дозы и отмену бензодиазепинов проводили постепенно к исходу 2-й недели.
Общая длительность лечения составила 5 нед.
Результаты и обсуждение
Наиболее чувствительным к воздействию рексетина оказался симптомокомплекс тревоги.
Так, уже на 1-й неделе лечения некоторые больные стали отмечать снижение телесной напряженности и ощущения внутреннего дрожания, потливости, уменьшилась интенсивность чувства неполноты вдоха, наметилась тенденция к улучшению засыпания.
В течение 2-й недели регрессирование тревоги было более существенным: менее интенсивными и более редкими были наплывы тягостных мыслей-образов основного фобического переживания (страх сойти с ума/потерять контроль, причинить вред и пр.); суточные колебания настроения становились не столь резкими; проявления недовольства, враждебности и раздражения в отношении ближайшего окружения смягчались.
Следует отметить достаточно быстрое наступление терапевтического эффекта. Наиболее выраженное ослабление интенсивности тревожных переживаний и улучшение самочувствия больных наблюдалось в течение первых 4 нед. терапии рексетином. В дальнейшем положительная динамика несколько замедлялась и носила более плавный характер.
Уменьшение интенсивности, тягостности «умственной жвачки» следовало через 2-3 нед. вместе со снижением общей аффективной напряженности (чувственный заряд переживаний). Нормализация самочувствия до исходного, доболезненного наблюдалась начиная с 3-4-й недели лечения.
Депрессивная симптоматика начинала подвергаться обратному развитию наиболее значимо через 3 нед. лечения: сначала пациентки сообщали об уменьшении постоянного ощущения слабости и утомляемости, о прибавке сил и появлении желаний и интереса к жизни. В это время наблюдали эмоциональное оживление и уменьшение двигательной и ментальной заторможенности. Происходила и редукция ангедонических жалоб (неполучение удовольствия от общения, секса, еды, чтения, творческих увлечений, работы; чувство апатии). К этому же времени проявился вегетостабилизирующий эффект препарата.
Больные (4 человека) отметили урежение частоты гастроинтестинального дискомфорта: сенесталгий в области кишечника, отрыжки воздухом, газообразования, утренних поносов и позывов на мочеиспускание перед выходом из дома.
Особо следует подчеркнуть динамику эссенциальных фобических проявлений.
Если первые 2 нед. улучшение в основном происходило за счет редукции симптомокомплекса тревоги, то на 3-й неделе терапии было отмечено уменьшение частоты возникновения фобических переживаний. Больные могли большую часть дня не вспоминать о своих страхах, они появлялись эпизодически в утренние и вечерние часы. Уменьшалась и сила навязчивых страхов, они возникали «на периферии сознания», не поглощая полностью внимания больных. Наиболее интенсивной редукции подвергся страх сумасшествия, который был наиболее тесно связан с тревожным аффектом. Наименьшая динамика была отмечена у фобии беременности. Страх причинить вред близким занимает как бы промежуточное положение в плане терапевтической лабильности.
Почти полной редукции фобий удалось добиться у 5 больных, у которых структура синдрома усложнялась за счет смешанного тревожно-депрессивного расстройства. У 12 пациенток отмечено, что остающиеся фобические переживания не насыщены эмоционально, являются «бледной тенью» тех, которые были до лечения. У 3 больных, несмотря на положительную динамику болезненных симптомов, фобии остались без изменения, лишь уменьшилась их аффективная насыщенность.
К 4-5-й неделе лечения у 5 больных стало наблюдаться «застывание» клинической картины — отсутствие дальнейшей положительной динамики, что потребовало увеличения дозы препарата до 40 мг в сутки.
Наиболее резистентными к терапии оставались личностные особенности больных: неуверенность, обидчивость, переживание собственного несовершенства, высокая личностная тревожность. Данные переживания у большинства больных были многолетними, латентными, связанными со структурой личности, и пациенты адаптировались к ним.
Необходимо отметить, что большинство пролеченных нами пациенток не отмечали эффекта чрезмерной активизации, «взбудораженности», неусидчивости и усиления тревоги в 1-ю неделю лечения, свойственного некоторым СИОЗС (флуоксетин, паксил).
В 1-ю неделю лечения 8 пациенток все же сообщали об усилившихся трудностях засыпания, частых пробуждениях и большей раздражительности, что потребовало назначения транквилизаторов.
У 5 пациенток на протяжении 1-й и 2-й нед. лечения отмечено усиление явления потливости и чувство жара, особенно при волнении и при нахождении в душных помещениях.
Ни в одном случае мы не наблюдали нейролептических симптомов (гипертонус и гиперкинезы лицевой мускулатуры и языка, тремор и др.) и значимых явлений поведенческой токсичности, а также дизурий (учитывая тот факт, что выборка пациентов была женской). Однако 1 пациентке со значительным снижением массы тела (46 кг) и дисменореей потребовалось уменьшение дозы рексетина до 10 мг в сутки в течение 2 нед. в начале лечения.
Заключение
Применение рексетина в дозировках 20-40 мг при изолированных фобиях с коморбидным паническим расстройством (F41.0) и смешанным тревожно-депрессивным расстройством (F41.2) выявило высокую эффективность препарата в отношении купирования симптомов тревоги и депрессии, а также выраженное антифобическое действие пароксетина, которое было показано в более ранних работах (С.Н. Мосолов и соавт.).
Препарат существенно облегчает состояние пациентов, уменьшает интенсивность и частоту возникновения обсессивных и фобических проявлений и улучшает качество жизни пациентов. Отчетливые анксиолитические свойства рексетина при хорошей переносимости позволяют рекомендовать его к использованию в амбулаторной практике для лечения изолированных фобий с коморбидными проявлениями панического расстройства и смешанных тревожно-депрессивных состояний.
Литература 1. Смулевич А.Б., Иванов С.В., Дубницкая Э.Б., Дробижев М.Ю. // Смулевич А.Б. Депрессии в общемедицинской практике. — М.: Берег, 2000. — С. 65-72. 2. Мосолов С.Н., Смулевич А.Б., Нуллер Ю.Л. и др. Применение препарата Паксил (Пароксетин) при лечении панического расстройства (результаты российского мультицентрового исследования). — М., 2003. 3. Praag H.M. van. Nosologomania: a disorder of psychiatry // World J. Biol. Psychiatry. — 2000. — 1. — 151-8. 4. Regier D.A. et al. Prevalence of anxiety disorders and their comorbidity with mood and addictive disorders // Br. J. Psychiatry. — 173 (Suppl. 34). — 24-8.
Симптомы отмены антидепрессантов
Симптомы отмены чаще возникают в течение трех дней после прекращения приема антидепрессантов. Обычно симптомы не сильно выраженные и проходят в течение двух недель.
К симптомам отмены антидепрессанта можно отнести:
- тревожность,
- депрессия и перепады настроения,
- головокружения,
- проблемы с равновесием,
- ощущение удара током,
- головная боль,
- усталость,
- симптомы гриппа (озноб, боли в мышцах),
- потеря координации,
- мышечные подергивания и спазмы,
- тошнота,
- нарушения сна (кошмары, яркие сны, бессонница),
- рвота.
Наличие симптомов отмены антидепрессанта не означает, что вы зависимы от препарата.
Зависимость представляет собой вредные долговременные химические изменения в мозге. Она характеризуются интенсивной тягой, неспособностью контролировать употребление какого-либо вещества и негативными последствиями употребления этого вещества.
В редких случаях отказ от антидепрессанта может вызвать манию. Антидепрессанты, а именно ингибиторы моноаминоксидазы, могут привести к путанице и психотическим симптомам. Если вы думаете бросить прием антидепрессанта, вам нужно обратиться к врачу-психиатру во избежание возникновения нежелательных симптомов или снизить их возникновение к минимуму и обсудить риски и преимущества прекращения лечения.
Во многих случая прекратить прием большинства антидепрессантов – это постепенно снижать дозу антидепрессанта в течение нескольких недель или более под наблюдением врача. Данная методика дает возможность мозгу приспособиться к химическим изменениям и может предотвратить симптомы отмены препарата. Не пытайтесь самостоятельно снижать дозу препарата и отменять его.
В некоторых случаях врач может назначить дополнительные препараты, для того чтобы облегчить симптомы отмены, такие как тошнота, бессонница. Также врач может порекомендовать перейти от антидепрессантов короткого действия к пролонгированному действию, чтобы облегчить симптомы отмены.
Иногда трудно отличить симптомы отмены от симптомов депрессии после прекращения приема антидепрессанта. Если возникли вопросы, записаться на консультацию возможно, позвонив по номеру телефона Юсуповской больницы. Врач-психиатр оказывает помощь пациентам круглосуточно.
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина №04 2004
Н
есмотря на значительные успехи в области терапии депрессивных состояний и огромное разнообразие препаратов, обладающих антидепрессивным действием (в мире насчитывается более 100 их наименований), эта проблема остается одной из наиболее актуальных в современной психофармакотерапии. Появление в арсенале психотропных средств современных препаратов, объединенных понятием «антидепрессанты нового поколения», открывает широкую перспективу дифференцированного подхода к лечению депрессии и ставит перед клиницистами задачу адекватного выбора препарата в зависимости от особенностей клинической картины и тяжести состояния пациента. Первым шагом на пути решения этой задачи является определение спектра клинического действия новых антидепрессантов (Г.Я.Авруцкий и соавт., 1988; С.Н.Мосолов, 1995). Одним из представителей нового поколения антидепрессантов является препарат “Паксил” (пароксетин). Он имеет сложную бициклическую структуру, отличную от структуры других известных тимоаналептиков, и относится к наиболее изученной к настоящему моменту группе современных антидепрессантов – селективных ингибиторов обратного захвата серотонина (СИОЗС). От трициклических антидепрессантов (ТЦА) их отличает практически полное отсутствие побочных эффектов при сопоставимой эффективности. Механизм действия пароксетина основан на его способности избирательно блокировать обратный захват серотонина (5НТ) пресинаптической мембраной, с чем связано повышение свободного содержания этого нейромедиатора в синаптической щели и усиление серотонинергического действия в ЦНС, ответственного за развитие тимоаналептического эффекта. Влияние на мускариновые a- и b-адренорецепторы незначительно, что определяет крайне слабую выраженность холинолитических, кардиоваскулярных и седативного побочных эффектов. В ряду серотонинергических препаратов пароксетин является самым мощным и одним из наиболее специфических блокаторов обратного захвата серотонина (D.R.Thomas и соавт., 1987; I.F.Tulloch и соавт., 1992). Считается, что мощность серотонинергического действия является основным фактором, определяющим выраженность тимоаналептического эффекта, а селективность определяет толерантность. Результаты многочисленных клинических исследований показывают, что пароксетин высокоэффективен при лечении большой депрессии и связанной с ней симптоматики, такой как тревога, идеаторная и психомоторная заторможенность, нарушения сна (J.L.Claghorn и соавт., 1992; A.Kiev, 1992; К.Rickels и соавт., 1992; W.T.Smith и соавт., 1992). В рандомизированных двойных слепых исследованиях, включающих более 2,5 тыс. пациентов с тяжелой депрессией, было установлено, что пароксетин не уступает по своей эффективности имипрамину (G.C.Dunbar и соавт., 1991), амитриптилину (A.L.Laursen и соавт., 1985; H.Kuhs и соавт., 1989; H.Kuhs и соавт., 1990; А.Bignammi и соавт., 1992; P.Stott и соавт., 1993) и кломипрамину (С.Link и соавт., 1992). По результатам всех перечисленных исследований переносимость пароксетина оказывалась лучшей по отношению к препаратам сравнения. Кроме того, по степени влияния на симптоматику тревоги пароксетин не отличался от амитриптилина (P.Stott и соавт., 1993), а в сравнении с имипрамином он оказывал более ранний эффект (G.C.Dunbar и соавт., 1991). Целью настоящей работы было изучение особенностей тимоаналептического действия и переносимости пароксетина. Исследование проводилось в период 1998–1999 гг. в четырех клинических центрах России: Московском НИИ психиатрии МЗ РФ, Научном центре психического здоровья РАМН, Санкт-Петербургском психоневрологическом институте им. В.М.Бехтерева, Челябинской государственной медицинской академии (кафедра психиатрии). Статистический анализ результатов проводился научно-исследовательской организацией «ИннФарм». Исследование было открытым, несравнительным. Длительность исследования составляла 8 нед (1-я неделя – период «wash out» для пациентов, принимавших психотропные препараты к моменту начала исследования, и 7 нед активной терапии). В исследование отбирались больные в возрасте от 18 до 65 лет с диагнозом по МКБ-10 рекуррентное депрессивное расстройство (F32.1), умеренный или тяжелый депрессивный эпизод (F33.1 или F33.2), биполярное аффективное расстройство (F31), эпизод умеренной или тяжелой депрессии (F31.3; F31.4). Минимальная сумма баллов при оценке по 17-балльной шкале Гамильтона (ШГ) составляла не менее 17, а по шкале глобального клинического впечатления (ШГКВ) – не менее 3 баллов. В исследование включались пациенты, давшие письменное информированное согласие на участие в нем. Критериями исключения являлись: период беременности и лактации у женщин или возможность наступления беременности в период исследования; высокий суицидальный риск для амбулаторных больных; любые клинически значимые некомпенсированные заболевания почек, печени, сердечно-сосудистой, дыхательной системы, цереброваскулярные расстройства или другие серьезные прогрессирующие соматические заболевания; органические заболевания ЦНС, закрытоугольная глаукома, гипертрофия простаты, любая клинически значимая патология, обнаруженная во время физикального обследования и/или клинически значимые отклонения от нормы лабораторных показателей, установленные в период скрининга; любой из перечисленных методов лечения в указанные временные интервалы до начала исследования: ингибиторы МАО (включая обратимые) – 2 нед; электросудорожная терапия – 3 мес; депо-формы нейролептиков – 4 нед, гиперчувствительность к пароксетину в анамнезе, одновременное назначение антиаритмических препаратов 1-го типа. Для больных, принимавших какие-либо психотропные препараты до начала исследования, проводился 7-дневный период «оwash out»). В первые 2 нед исследования, включая период «оотмены», второй – на 28-й день терапии), 4 были исключены в связи с нежелательными явлениями (трое – на 7-й день терапии, один – на 21-й день терапии).
Длительность настоящего эпизода депрессии в среднем составила 3,6±2,02 мес. Медикаментозное лечение текущего депрессивного эпизода до начала исследования проводилось 32 (49,2%) пациентам, немедикаментозное – 2 (3,1%). Исходный средний по группе показатель суммарного балла по ШГ составлял 25,5±2,5. По ШГКВ средний по группе показатель тяжести депрессивного расстройства составлял 2,9±0,8 балла.
У большей части пациентов (45–70,3%) степень тяжести заболевания оценивалась как «умеренно выраженные психические нарушения». Пароксетин назначался в однократной суточной дозе 20 мг утром. При недостаточной эффективности доза увеличивалась до 60 мг/сут. Увеличение дозы проводилось постепенно – на 10 мг с интервалом в одну неделю. Средняя по группе суточная доза пароксетина составляла 32,3±2,6 мг. При анализе данных были получены следующие результаты. Общая эффективность терапии к концу исследования по ШГ (процент больных с редукцией суммарного балла не менее чем на 50%), рассчитанная методом LOCF, составила 84,4% (54 из 64 пациентов). При анализе по методу ОС, включающему только случаи, завершившие исследование, эффективность составила 88,1% (52 из 59 пациентов) (рис. 1). При обоих методах обработки данных уже с 7-го дня терапии число респондеров достигало уровня статистической значимости (p<0,001).
По ШГКВ положительный эффект (выраженное и существенное улучшение) наблюдался у 89,9% пациентов (рис. 2). При этом степень тяжести депрессивной симптоматики до начала терапии не играла решающей роли в ее последующей эффективности. Так, из 45 пациентов с первоначальной оценкой «умеренно выраженные психические расстройства», 17 на заключительном визите были признаны здоровыми, у 13 – степень тяжести заболевания оценивалась как «пограничное состояние», у 8 – как «слабо выраженные психические нарушения», у 6 – изменения степени тяжести заболевания не наблюдалось, т.е. сохранялась «умеренная степень тяжести заболевания», у 1 имело место ухудшение состояния с оценкой «сильно выраженные нарушения». Из 13 пациентов с первоначальной оценкой по ШГКВ «сильно выраженные психические нарушения» на заключительном визите 5 были признаны здоровыми, у 7 степень тяжести оценивалась как «пограничное состояние» и у 1 имели место «слабо выраженные психические расстройства». Из 3 пациентов с оценкой состояния «тяжелое психическое расстройство» у 1 на заключительном визите выявлялись «слабо выраженные психические нарушения», у 2 состояние оценивалось как «пограничное».
«Слабо выраженные психические нарушения» выявлялись у 3 больных, из которых на заключительном визите 2 были признаны здоровыми и у 1 состояние оценивалось как «пограничное». Эффект терапии наступал достаточно быстро. Значение суммарного балла ШГ по группе в целом уже на 7-й день лечения уменьшалось на 19,9% (изменения статистически значимы, p<0,001) (рис. 3). В дальнейшем происходило последовательное уменьшение выраженности депрессивной симптоматики. К концу исследования суммарный балл ШГ составлял 7,5±2,6 балла, т.е. в сравнении с исходным уровнем его значение уменьшилось на 18,0±2,9 балла (p<0,001), или на 69,9±5,6% (p<0,001). Темп редукции депрессивной симптоматики по ШГ показан на рис. 1. Уже к 28-му дню процент больных с 50% редукцией суммарного балла по ШГ составлял 54,7. Следует отметить что “прирост” числа пациентов с положительным эффектом терапии наблюдался вплоть до 6-й недели лечения.
Как видно из рис. 1, на 35-й день лечения он был зарегистрирован у 76,6% пациентов, а за последующую неделю число респондеров увеличилось еще на 7,8%, и в дальнейшем этот показатель оставался неизменным до конца исследования. Оценка скорости наступления эффекта по ШГКВ в целом не отличалась от таковой ШГ. Изменение степени тяжести заболевания наблюдалась уже на 3-й день терапии (p<0,001) и превысило 50% уровень на 28-й день (рис. 4). На всем протяжении исследования изменение этого показателя было достаточно равномерным, и уменьшение его значения имело место вплоть до окончания наблюдения (49-й день – на 76%). Это отражает наблюдающуюся клинически плавную поступательную редукцию депрессивной симптоматики в процессе лечения пароксетином.
Число пациентов с положительным эффектом терапии (существенное или выраженное улучшение), как при оценке по ШГ, превысило 50% к 28-му дню лечения и нарастало до 49-го дня (рис. 5). Эти данные подтверждают обоснованность общих для всех СИОЗС рекомендаций о целесообразности оценки эффекта проводимой терапии не ранее 5–6 нед с момента ее начала.
Основные показатели, определяющие спектр психотропного действия антидепрессанта (пониженное настроение, психическая тревога и заторможенность), редуцировались достаточно равномерно (рис. 6), хотя статистическая значимость при редукции заторможенности наблюдалась несколько позже (7-й день терапии) по сравнению с симптомами психической тревоги и сниженного настроения (3-й день терапии). Клинически уже с первой недели лечения у большинства больных отмечалось улучшение самочувствия. В первую очередь уменьшалась выраженность тревоги, появлялась возможность отказаться от приема анксиолитиков, назначенных в период «wash out». Пациенты становились контактнее, активнее в беседе, отмечали, что начинает восстанавливаться утраченный в период депрессии интерес к привычному кругу занятий, увлечений. Анализ результатов исследования показывает, что пароксетин достаточно эффективно устраняет расстройства сна, связанные с депрессией. Клинически это проявляется постепенным увеличением продолжительности, а затем и улучшением качества сна при отсутствии истинно гипнотического эффекта.
По ТТТГ показатели сна улучшаются уже с 3-го дня терапии. К концу 1-й недели статистически значимо изменяется значение показателей «трудности засыпания» и «ранние пробуждения», а к 21-му дню лечения – «бессонница среди ночи» (рис. 7). Пароксетин в целом хорошо переносился больными. Каких-либо клинически значимых изменений лабораторных показателей не наблюдалось. На фоне лечения исследуемым препаратом у 25 из 65 больных (38,5%) было зарегистрировано 65 случаев НЯ, однако связь развития НЯ с приемом пароксетина оценивалась как «вероятная» только в 14 (21,5%) случаях. Оценка интенсивности НЯ показала, что 33/65 (50,8%) случаев НЯ были слабой интенсивности, 28/65 (43,1%) – умеренной и 1/65 (6,2%) – выраженной. В большинстве случаев [40/65 (61,5%) НЯ] никаких мер в отношении исследуемого препарата принято не было, в 18/65 (6,2%) случаях доза препарата была уменьшена, в 4/64 (6,2%) – увеличена и в 3/65 (4,6%) случаях препарат был отменен. В связи с развитием НЯ из исследования были исключены 4 пациента. Из них у одного пациента с отягощенным аллергологическим анамнезом и лекарственной непереносимостью предшествующей терапии флуоксетином наблюдались тошнота, рвота. У второго на 2-й неделе терапии развилась менингеальная симптоматика, и в дальнейшем был поставлен диагноз серозного менингита, в связи с чем больной получал специфическую терапию. У третьего пациента имела место кожная аллергическая реакция, аналогичная наблюдавшейся ранее при приеме амитриптилина. У четвертого пациента причиной отмены терапии была тошнота, развившаяся в 1-ю неделю терапии при приеме 20 мг пароксетина. Все НЯ, имевшие место в период исследования и встречавшиеся с частотой более чем 1 случай, представлены в табл. 1.
Как видно из табл. 1, наибольший удельный вес среди НЯ занимают бессонница, тревога, сонливость, тошнота и тремор. Анализ исходов НЯ показал, что в подавляющем большинстве случаев (80%) НЯ были преходящими. Они развивались в первую неделю терапии при применении дозы 20 мг/сут (табл. 2) и в дальнейшем по мере продолжения терапии редуцировались. При увеличении дозы препарата у большинства больных роста частоты НЯ не происходило.
В целом это может свидетельствовать о том, что либо в первую неделю терапии происходит адаптация к приему пароксетина, либо часть зарегистрированных НЯ (такие как нарушения сна, тревога, соматовегетативные расстройства) были обусловлены неустойчивостью психического состояния пациентов. Таким образом, резюмируя результаты проведенного исследования, можно заключить, что пароксетин обладает отчетливым тимоаналептическим, анксиолитическим и активизирующим эффектом, т.е. является антидепрессантом сбалансированного действия. Особенно важной представляется показанная исследованием возможность его эффективного применения при лечении умеренной и тяжелой депрессии, в том числе и в условиях стационара. Хорошая переносимость препарата, преходящий характер нежелательных явлений, их незначительная выраженность, а также высокая комплаентность являются его важными преимуществами при лечении больных.
В настоящее время для фармакотерапии генерализованного тревожного расстройства (ГТР) используются антидепрессанты [12], которые позволяют достичь ремиссии у 40-50% больных. В ряде исследований [1, 7, 13, 14, 19] предпочтение при выборе антидепрессантов отдается селективным ингибиторам обратного захвата серотонина (СИОЗС) и селективным ингибиторам обратного захвата норадреналина (СИОЗН). Доказано, что антидепрессанты эффективны в отношении как идеаторной, так и соматической тревоги [2, 5, 6, 16-18]. Выявлено, что они оказывают более сильное влияние на идеаторную тревогу в сравнении с транквилизаторами [11, 15].
При ГТР в настоящее время используются практически все из известных СИОЗС [8]. Но особый профиль рецепторного взаимодействия выделяет пароксетин из ряда серотонинергических препаратов [3]. Его эффективность при ГТР доказана в ряде плацебо-контролируемых исследований [18, 19]. При этом было установлено превосходство пароксетина над бензодиазепиновыми транквилизаторами в отношении редукции симптомов идеаторной тревоги. Однако ряд важных аспектов использования пароксетина при ГТР остается малоизученным, особенно с учетом его клинической гетерогенности. Так, Ю.Э. Лесс [4] было выделено 4 клинических типа этого расстройства: аффективный, соматизированный, фобический и тонический. У больных с аффективным типом ГТР в клинической картине на первом плане — собственно аффект тревоги (так называемая свободно плавающая тревога). При соматизированном типе ГТР тревожные переживания сопровождаются выраженной вегетативной гиперактивностью. При фобическом типе ГТР характерна «борьба» с ярко выраженной тревогой, сближающая ее с феноменом навязчивости. При тоническом типе особенно выражено мышечное напряжение, чувство скованности, невозможность расслабиться при минимуме вегетативных расстройств. Клиническая гетерогенность ГТР подтверждается также и тем, что не более чем у половины больных состояние исчерпывается явлениями генерализованной тревоги на протяжении всего заболевания. В остальных же случаях на том или ином этапе заболевания могут появляться другие, коморбидные расстройства, прежде всего аффективного и тревожного спектров (паническое расстройство, обсессивно-фобические расстройства, агорафобия, простая фобия, депрессия, дистимия). Остается неясным, как тип ГТР и перечисленные коморбидные нарушения влияют на эффективность лечения пароксетином.
В настоящее время на отечественном рынке появился препарат из группы пароксетина под торговым названием «адепресс». Этот препарат терапевтически эквивалентен оригинальному пароксетину и выпускается в виде таблеток, содержащих 20 мг активного вещества.
Цель исследования — изучение эффективности адепресса при различных клинических вариантах ГТР с учетом коморбидных состояний.
Материал и методы
Работа проводилась в отделении Новых средств и методов терапии отдела пограничной психиатрии ГНЦ социальной и судебной психиатрии им. В.П. Сербского на базе клинического отделения Московской городской клинический психиатрической больницы №12.
Исследование было открытым натуралистическим.
Критерии включения больных в исследование были следующие: диагноз по МКБ-10 — F41.1 — генерализованное тревожное расстройство; наличие ГТР в качестве основного расстройства, в том числе с коморбидной симптоматикой тревожно-фобического круга (агорафобия, паническое расстройство, социальная фобия, обсессивно-компульсивное расстройство); число баллов по шкале тревоги Гамильтона (НАМ-А) не менее 20 на момент включения в исследование; возраст пациентов в диапазоне от 18 до 60 лет; наличие информированного согласия на участие в исследовании.
Критериями исключения являлись: шизофрения, органическое заболевание ЦНС, наркомания, алкоголизм; число баллов по шкале НАМ-D более 15 на момент включения в исследование; беременность или лактация; клинически выраженные соматические заболевания или отклонения лабораторных показателей.
В исследование были включены 49 госпитализированных и амбулаторных больных (13 мужчин и 36 женщин).
Длительность исследования составляла 42 дня. Начальная доза адепресса составляла 10 мг/сут с последующим гибким режимом дозирования в диапазоне 10-60 мг/сут. Адепресс применялся в виде монотерапии. При выраженной тревоге, а также бессоннице в первые дни лечения допускалось использование небольших доз бензодиазепиновых транквилизаторов (альпрозолам, лоразепам, феназепам).
Состояние больных оценивалось с помощью шкалы тревоги Гамильтона (HAM-A) перед началом терапии и затем в динамике — еженедельно. Редукция симптоматики до 7 баллов и менее оценивалась как уровень ремиссии; 50% редукция суммы баллов — как выраженное улучшение (респондеры); редукция на 25-49% — как незначительное улучшение (парциальные респондеры); редукция симптоматики менее 25% — как отсутствие эффекта (нонреспондеры).
Переносимость исследуемых препаратов оценивалась с помощью шкалы побочных эффектов (UKU).
Плановое обследование включало, кроме того, соматическое состояние пациентов (масса тела, АД, ЧСС, ЭКГ, общий и биохимический анализ крови, общий анализ мочи).
Обследование больных проводилось до лечения (0 день) и затем на 7-, 14-, 21-, 28-, 35-й и 42-й дни терапии.
Выбыли в течение 1-й недели терапии 4 пациента. В 2 случаях поводом для исключения из исследования являлся прием запрещенных препаратов, в одном случае — нарушение режима дозирования, еще в одном — отзыв согласия. Общей причиной прекращения участия в исследовании оказалось усиление тревоги, в одном случае — с бессонницей.
Таким образом, завершили исследование 45 пациентов: 12 (26,7%) мужчин и 33 (73,3%) женщины, средний возраст которых был 36,2±8,2 года. Из них 31 (68,9%) человек работал или учился, не работали — 14 (31,1%); в браке состояли 29 (64,4%), были одинокими или разведенными — 16 (37,6%).
В соответствии с выделенными в предшествующих исследованиях клиническими типами ГТР больные распределились следующим образом: соматизированный тип — 16 больных, аффективный — 8, фобический — 9, тонический тип — 11.
Как следует из многочисленных публикаций [9, 10, 17, 18], изучение противотревожного действия антидепрессантов проводится с анализом их воздействия на когнитивную (психическую) и соматическую (вегетативную) составляющие тревожного состояния. Поскольку в исследуемой выборке были представлены больные с преобладанием соматической (21 больной) и с преобладанием когнитивной тревоги (24), то выборка была разделена на 2 соответствующие группы. Средняя сумма баллов по HAM-A в 1-й группе (с преобладанием соматической тревоги) составляла 27,4 балла, во 2-й (с преобладанием когнитивной тревоги) — 28,3 (р
>0,05), что свидетельствовало об их сопоставимости.
Случаев изолированного ГТР в изученной выборке было 19 (42,2%), тогда как ГТР, протекающего с коморбидными психическими нарушениями, — 26 (57,8%) наблюдений. При этом оказалось, что в 1-й группе (соматической тревоги) чаще встречалось изолированное ГТР (73,7%), а во 2-й группе (когнитивной тревоги) — коморбидное ГТР (61,5%). Из коморбидных нарушений в 1-й группе встречались только панические атаки -10 (41,7%) случаев. Во 2-й группе спектр коморбидных нарушений включал дистимию — 7 (33,3%) случаев, обсессии — 8 (38,1%), панические атаки — 1 (4,8%).
Статистическая обработка результатов производилась при помощи критерия Стьюдента, качественных показателей — по методу χ2, сравнительный анализ динамики количественных показателей — по методу однофакторного дисперсионного анализа, сравнительный анализ порядковых данных — при помощи критерия Манна-Уитни.
Характеристика психических нарушений, в том числе коморбидных, в исследуемой выборке представлена в табл. 1.
Результаты и обсуждение
Положительная динамика в большинстве случаев отмечалась уже к концу 1-й недели терапии, после 2 недель лечения в обеих группах регистрировались достоверные отличия от исходного уровня (рис. 1).
Рисунок 1. Показатели HAM-A в процессе терапии адепрессом в 1-й и 2-й группах больных.Различия по сравнению с фоном p<0,05; * — значимые отличия между двумя группами, установленные в χ2 (р<0,05). Далее показатель по HAM-A в обеих группах продолжал уменьшаться, достигая к концу исследования минимальных значений. При этом более выраженная динамика отмечалась в 1-й группе, а с 3-й недели межгрупповые различия становились достоверными (
р
<0,05).
Общие результаты эффективности терапии приведены в табл. 2.
Частота ремиссий в обеих группах оказалась примерно одинаковой (29,2 и 28,6%), тогда как число респондеров и нонреспондеров существенно различалось. В 1-й группе больных с соматической тревогой к концу исследования было примерно в 2 раза больше респондеров (50% против 28,6%), а в группе больных с когнитивной тревогой -нонреспондеров (42,8% против 20,1%). Большинство случаев положительной реакции на терапию адепрессом в 1-й группе формировалось раньше, чем во 2-й. Как видно на рис. 2, большая часть респондеров выявлялась после 3 нед терапии, а после 4 нед были сформированы почти все ремиссии.
Рисунок 2. Распределение больных (%) в разных группах по терапевтическому ответу в динамике. По оси абсцисс — недели. В группе когнитивной тревоги большая часть респондеров отмечалась также уже спустя 3 нед лечения, но более глубокая редукция симптоматики, достигающая уровня ремиссии,в большинстве случаев возникала только к концу 6-недельного периода терапии. Следует также отметить, что наиболее хорошие результаты в группе пациентов с преобладанием соматической тревоги достигались применением относительно меньшей дозы адепресса. Средняя доза к концу исследования в 1-й группе составила 14,4 мг/сут, во 2-й — 32,8 мг/сут (
р
<0,05).
При сравнительном анализе терапевтического ответа у больных с изолированным и коморбидным ГТР выявились следующие результаты. В 1-й группе при изолированном ГТР у 42,8% больных отмечалась ремиссия, 50% — респондеров и лишь 7,1% больных оказались нонреспондерами. Иные соотношения выявлены в этой группе при коморбидном ГТР: ремиссии — 10%, респондеры — 50%, нонреспондеры — 40% наблюдений. В группе когнитивной тревоги при изолированном ГТР ремиссий было 80%, нонреспондеров — 20%, при коморбидном ГТР ремиссии отмечены у 12,5% больных, респондеры — 37,5%, половина больных коморбидным ГТР в этой группе оказались респондерами. Таким образом, наличие коморбидной симптоматики неблагоприятно сказывалось на результатах терапии в обеих группах больных.
При анализе результатов терапии в зависимости от клинического типа ГТР выявлены следующие различия (табл. 3).
Из табл. 3 видно, что наиболее высокие показатели эффективности адепресса были достигнуты при аффективном типе ГТР, где во всех наблюдениях фиксировалось клиническое улучшение (ремиссия — 37,5%, респондеры — 62,5%). На втором месте оказался фобический тип ГТР (36,4%), однако при этом типе было меньше всего респондеров (18,2%) и наблюдалась самая высокая частота отсутствия эффекта (45,4%). При соматизированном типе ГТР наблюдалось 25% ремиссий, что вместе с 43,7% респондеров в сумме составили более ⅔ больных этого типа с положительным ответом на терапию адепрессом; нонреспондеры составили 31,2% случаев. При тоническом типе ГТР зафиксировано 20% ремиссий, 40% респондеров и столько же нонреспондеров.
Что касается переносимости адепресса, то в ходе проведенного исследования у 27 больных были выявлены те или иные побочные явления; у 18 больных они носили сочетанный характер. Все нежелательные явления можно было условно разделить на 2 группы. К 1-й группе относились так называемые психические нежелательные явления, проявлявшиеся усилением тревоги и взбудораженностью (7 наблюдений). Они регистрировались на 1-й неделе терапии и, по-видимому, были связаны с явлениями «гиперстимуляции», описанными при терапии серотонинергическими антидепрессантами. Данные явления носили хоть и выраженный, но достаточно краткосрочный характер и, как правило, купировались назначением небольших доз транквилизаторов. Ко 2-й группе нежелательных явлений относились соматические побочные эффекты со стороны желудочно-кишечного тракта, представленные тошнотой и диареей (5 наблюдений). Эти явления возникали в первой половине исследования (до 28-го дня), субъективно были умеренно тягостными, но не требовали медикаментозной коррекции и проходили в течение нескольких дней самостоятельно. Сонливость при терапии адепрессом наблюдалась в 12 случаях, возникая на начальном этапе терапии (1-2-я неделя). Выраженность дневной сонливости была незначительной, а с учетом особенностей психического состояния включенных в исследование больных данные нежелательные явления воспринимались как отчасти положительные, позволяющие уменьшить «внутреннее напряжение». Умеренная головная боль (6 наблюдений) возникала в первые дни терапии, гипергидроз (5) — на 14-21-й день, сексуальная дисфункция (6) — на 4-6-й неделе терапии. Данные побочные явления, подробно описанные в литературе, связывают с возбуждением серотониновых рецепторов в центральной и периферической нервной системе, что свойственно всем серотонинергическим препаратам, включая адепресс.
Необходимо отметить также, что нежелательные явления возникали чаще у больных с соматизированным типом ГТР, к которому относились все 4 пациента, выбывшие из исследования, а также 50% всех зарегистрированных исследованных пациентов. В среднем на 1 больного при соматизированном типе возникало 1,4 нежелательных явлений, при аффективном -1,0, тоническом — 0,7, фобическом — 0,4.
Проведенное исследование показало высокую эффективность адепресса у больных ГТР. Установлено, что этот препарат эффективен как при изолированном, так и при ГТР, осложненном коморбидной психической патологией. Однако результаты терапии адепрессом при изолированном ГТР превосходят соответствующие показатели при наличии в структуре ГТР сопутствующей психопатологической симптоматики. Полученные результаты соответствуют данным литературы о том, что коморбидные нарушения при ГТР затрудняют фармакотерапию, требуя увеличения дозы препарата и сроков для достижения терапевтического ответа. Следует отметить, что в случаях положительного ответа на терапию коморбидные генерализованной тревоге дистимия, обсессии, фобии, как правило, редуцируются одновременно с симптоматикой генерализованной тревоги.
Настоящее исследование показало также, что адепресс эффективен при доминировании как соматической, так и когнитивной тревоги, однако при преобладании соматической тревоги в структуре ГТР эффект наступает быстрее — на 3-4-й неделе терапии, при ГТР с преобладанием когнитивной тревоги обратное развитие симптоматики наступает только на 3-6-й неделе терапии.
Адепресс эффективен при лечении больных с любым клиническим типом ГТР, но более чувствительны к терапии адепрессом больные ГТР аффективного и соматовегетативного типа.
Отсутствие выраженных побочных явлений свидетельствует о хорошей переносимости адепресса. Соответствуя стандартам применения современных СИОЗС, переносимость адепресса дифференцируется при различных типах ГТР: частота нежелательных явлений убывает в ряду: соматизированный, аффективный, фобический, тонический тип ГТР.
Таким образом, адепресс не только эффективен при лечении различных клинических вариантов ГТР, но и хорошо переносится, что позволяет рассматривать препарат как средство первого выбора для лечения данного расстройства.
Длительность приема антидепрессантов
По данным многочисленных исследований, длительность приема антидепрессантов составляет минимум 6 месяцев, после того как пациент начинает отмечать улучшение.
Пациенты, прекратившие прием препаратов до 8 месяцев, могут отмечать возобновление симптомов. Пациенты, у которых был один или несколько рецидивов депрессии, длительность приема антидепрессантов составляет около 24 месяцев. А те пациенты, у которых отмечается частый рецидив депрессии, нуждаются в длительном лечении, которое может составить несколько лет.
Для правильного подбора дозы препарата и определения длительности лечения, в Юсуповской больнице работают врачи-психиатры высшей категории, умеющие научную степень. Каждому пациенту уделяется пристальное внимание. Пациенты, обратившиеся за медицинской помощью в клинику, постоянно находятся под наблюдением специалиста на всем протяжении лечения. У врачей-психиатров можно проконсультироваться по поводу реабилитации после лечения, что дает возможность снизить процент возникновения повторных симптомов депрессии.
Самостоятельный и бесконтрольный прием антидепрессантов влечет за собой развитие нежелательных побочных эффектов, что в свою очередь приводит к ранней отмене препарата и не эффективности лечения.
Мнение эксперта
Автор:
Елена Михайловна Бунина
Психиатр, врач высшей категории
Статистические данные свидетельствуют о том, что 5 % населения страдает от симптомов депрессии. В большинстве случаев психиатры принимают решение о назначении антидепрессантов. Препараты входят в перечень комплексной терапии, применяемой при депрессивном расстройстве.
Действие антидепрессантов направлено на восстановление нормального уровня химических веществ, отвечающих за регуляцию грусти и беспокойства. Многочисленными клиническими исследованиями доказано, что препараты данной фармакологической группы не вызывают привыкания. Тем не менее у каждого пятого регистрируются симптомы отмены. Они связаны с резким прекращением приема назначенных лекарств. Заранее предугадать развитие симптомов отмены невозможно.
Психиатры Юсуповской больницы для каждого пациента подбирают индивидуальный план лечения. Он включает в себя комплексную терапию с использованием антидепрессантов, прошедших контроль качества и безопасности. Медикаменты обладают доказанной эффективностью и входят в перечень мировых стандартов терапии депрессии. Врачи не рекомендуют самостоятельно и резко прекращать назначенный курс. Это может усугубить ситуацию и привести к развитию нежелательных симптомов.