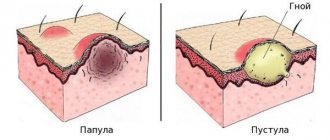
Саркомы – это разнородная группа злокачественных новообразований, которые произрастают из соединительной ткани, чем отличаются от раков, который является злокачественными опухолями, развивающимися из эпителиальных тканей. Саркомы мягких тканей могут происходить из любых внескелетных неэпителиальных тканей, кроме глии и тканей ретикулоэндотелиальной системы. Они чаще всего имеют агрессивное течение и склонны к рецидивированию, даже после проведения радикального лечения.
Саркома мягких тканей – это редкая патология. В России заболеваемость в 2022 году составила 1,75 на 100 000 человек. Чаще всего эти новообразования поражают нижние конечности, на долю данной локализации приходится около 40% случаев. Саркомы внутренних органов встречаются редко и локализуются они в почках, сердце, матке и простате. Отдельно рассматривается саркома груди, при которой средний возраст больных составляет около 50 лет.
- Классификация сарком мягких тканей
- Этиология и патогенез сарком мягких тканей
- Клинические симптомы саркомы мягких тканей
- Диагностика саркомы
- Общие принципы лечения сарком мягких тканей
Как развивается саркома?
Саркома – это рак?
Раком официальная медицина России и некоторых других стран называет злокачественные опухоли, которые развиваются в эпителиальных клетках, содержащихся в коже или слизистых оболочках, и выстилающих внутреннюю поверхность органов. Саркомы же к определенным органам не привязаны, образуются в разных типах тканей, но ведут себя похожим образом – быстро растут, повреждают здоровые клетки и метастазируютМетастаз – это дополнительный очаг рака – новая опухоль в органе, расположенном далеко от основного новообразования., в том числе в легкие, кости и печень.
Заболевание начинается с появления всего лишь одной мутировавшей, или измененной клетки. Она становится такой под воздействием радиации, различных химикатов, заболеваний или наследственных особенностей, и постепенно размножается, создавая свои копии. Со временем их становится все больше, они превращаются в опухоль, и разрушают окружающие ткани. Кроме того, у них есть особое, очень опасное свойство – они умеют перемещаться по телу при помощи кровеносной и лимфатической системЛимфатическая система дополняет сердечно-сосудистую. Циркулирующая в ней лимфа – межклеточная жидкость – омывает все клетки организма и доставляет в них необходимые вещества, забирая из них отходы. В лимфатических узлах, выполняющих роль «фильтров», опасные вещества обезвреживаются и выводятся из организма., закрепляться в других областях организма и создавать дополнительные новообразования.
Типы сарком мягких тканей
Врачам известно более 50 различных типов подобных опухолей, самыми распространенными из которых являются:
- Фибросаркомы
, поражающие соединительную ткань ног, рук или туловища. Чаще всего они встречаются у людей в возрасте от 20 до 60 лет, но могут возникать даже у младенцев. - Ангиосаркомы –
это начинающиеся в кровеносных сосудах гемангиосаркомы, или в лимфатических – лимфангиосаркомы. Они появляются в том числе в тех частях тела, которые подвергались воздействию лучевой терапии, в области грудной клетки и в конечностях с лимфедемой – скоплением в тканях лимфатической жидкостиЛимфа – это межклеточная жидкость, которая омывает все клетки организма и доставляет в них необходимые вещества, забирая отходы. из-за нарушения ее оттока. - Лейомиосаркомы –
возникают в гладких мышцах, часто обнаруживаются в брюшной полости, но могут выявляться и в других частях тела – конечностях или в матке. - Синовиальные
– образуются в тканях, окружающих сустав, как правило, в бедре, колене, щиколотке и плече. - Фибромиксоидные
саркомы низкой степени злокачественности – медленно развивающиеся опухоли, обычно встречающиеся у пациентов молодого и среднего возраста. - Саркома Капоши –
развивается в клетках, выстилающих лимфатические или кровеносные сосуды. - Альвеолярные
– редкий вид онкологии, в основном поражающий молодых пациентов. - Нейрофибросаркомы, злокачественные шванномы и нейрогенные саркомы
– возникают клетках, окружающих нерв. - Липосаркомы –
опухоли жировой ткани, чаще всего образуются у людей в возрасте от 50 до 65 лет. - Светлоклеточные –
обычно развиваются в сухожилиях рук или ног. - Рабдомиосаркомы
– наиболее распространенный тип сарком мягких тканей у детей. - Эпителиоидные
– как правило, повреждают ткани рук, предплечий, стоп или голеней подростков и молодых пациентов. - Стромальные опухоли
желудочно-кишечного тракта – начинаются в пищеварительной системе. - Миксофибросаркомы низкой степени злокачественности – чаще всего обнаруживаются на конечностях пожилых людей.
- Злокачественные мезенхимомы –
имеют признаки фибросаркомы и как минимум двух других типов сарком.
Причины развития саркомы
Точные причины возникновения подобных опухолей врачам не известны – современная медицина знает лишь о факторах, которые увеличивают вероятность этого события.
Радиация
, применяемая для борьбы с различными видами онкологии. Саркомы могут возникать в тех частях тела, которые подвергались воздействию лучевой терапии. В среднем с момента ее проведения до выявления заболевания проходит около 10 лет. Методы лечения совершенствовались на протяжении нескольких десятилетий, и в данный момент о выборе правильных доз известно гораздо больше, чем раньше. Современные знания помогают сократить количество новых диагнозов, но даже сегодня облучение используется только тогда, когда его преимущества перевешивают риски.
Наследственность
. Некоторые нарушения, вызванные изменениями в генах, часто унаследованы от родителей и связаны с повышенной вероятностью развития сарком мягких тканей. К ним относят:
- синдром Гарднера
, приводящий к появлению большого количества полипов – разрастаний ткани кишечника; - нейрофиброматоз
, вызывающий образование множественных опухолей нервов; - синдром Ли-Фраумени
, увеличивающий риск возникновения рака молочной железы, новообразований головного мозга, сарком и лейкемии – изменения клеток костного мозга и крови; - ретинобластома
– опасная для жизни опухоль глаза, развивающаяся в основном у детей; - синдром Вернера
– генетическое заболевание, обладатели которого преждевременно стареют, страдают от катаракты – помутнения хрусталика, закупорки сердечных артерий и других проблем со здоровьем; - туберозный склероз
, приводящий к появлению судорог и множества опухолей в различных тканях и органах, в том числе в мозге, глазах, коже, сердце, почках, печени, легких и желудочно-кишечном тракте; - синдром Горлина
, повышающий вероятность развития многих видов рака кожи, фибросаркомыФибросаркомы поражают соединительную ткань ног, рук или туловища. Чаще всего они встречаются у людей в возрасте от 20 до 60 лет, но могут возникать даже у младенцев. и рабдомиосаркомыРабдомиосаркомы – это наиболее распространенный тип сарком мягких тканей у детей.
Химикаты
, такие как мышьяк и винилхлорид, используемый при производстве пластмасс, увеличивают риски возникновения саркомы печени.
Повреждение лимфатической системы
. Лимфа – это прозрачная жидкость, содержащая клетки иммунной системы, которые переносятся по всему телу через сосуды и лимфатические узлы, выполняющие роль «фильтров», задерживающих и обезвреживающих опасные вещества. При повреждении этих важнейших органов или после их удаления у человека может образоваться лимфедема – скопление лимфы и отеки, а также ее осложнение – лимфангиосаркомаЛимфангиосаркома – это опасная для жизни опухоль, развивающаяся в лимфатических сосудах..
Травмы, образ жизни и вредные привычки, в том числе курение, неправильное питание и нехватка физической нагрузки, вероятность образования саркомы не повышают.
Частота возникновения саркомы Юинга
Среди злокачественных опухолей у детей саркома Юинга составляет 1,8% и является второй по частоте среди злокачественных опухолей костей у детей (10-15%).
Ежегодно в США эта опухоль выявляется у 150 детей и подростков. Чаще заболеванию подвержены лица мужского пола.
Существует некоторая связь между возникновением саркомы Юинга и наличием аномалий костей скелета и мочеполовой системы.
В 30% случаев в момент диагностики уже имеется метастатическое поражение легких и костей.
Признаки и симптомы саркомы мягких тканей
Примерно половина из них возникает в руках или ногах. Большинство людей замечают опухоль, которая постепенно увеличивается в течение недель или месяцев, причем болит она не всегда.
Примерно 4 из 10 сарком развиваются в брюшной полости – животе, что вызывает не только неприятные ощущения, но и закупорку пищеварительного тракта или кровотечения из желудка и кишечника. Кроме того, они могут давить на нервы, кровеносные сосуды и ближайшие органы, и способны разрастаться до весьма крупных размеров.
В редких случаях новообразования появляются в груди, на голове или шее.
К возможным признакам заболевания относят:
- появление новой припухлости или шишки в любой области организма и рост уже имеющихся;
- усиливающаяся боль в животе;
- кровь в стуле или рвоте, поскольку она может быть вызвана повреждением пищеварительного тракта растущей опухолью;
- черный дегтеобразный стул, приобретающий подобный цвет и консистенцию из-за кровотечения в желудке или кишечнике.
Чаще всего вышеперечисленные симптомы вызваны не саркомами, но при их появлении необходимо срочно обращаться к врачу.
Какие бывают симптомы болезни?
Наиболее часто встречающимся симптомом, который появляется из-за саркомы Юинга, являются боли и припухлость в том, месте, где растёт опухоль.
Боли появляются спонтанно. Обычно болеть начинает тогда, когда ребёнок что-то делает с физической нагрузкой. Но часто эти боли ночью полностью не уходят. Чем больше растёт опухоль, то кроме болей у ребёнка становится видна припухлость, либо если припухлость ещё не видна, её уже можно прощупать. Иногда эта зона роста опухоли может быть покрасневшей. А сам участок организма перестаёт нормально работать. Нередко эти симптомы врачи сначала ошибочно воспринимают за болезни роста, воспаление костей или как результат какой-то спортивной травмы.
Но так как саркомы Юинга могут вырастать практически в любой кости и в мягких тканях, то в каждом отдельном случае другие симптомы могут сильно отличаться. Например, если опухоль растёт в области позвоночника или периферических нервов [периферическая нервная система], то у ребёнка в первую очередь могут появиться такие отклонения как потеря двигательной способности (паралич). Если опухоль растёт в тазовых костях, или в районе груди, или же в бедренных костях, то очень долгое время она не даёт каких-то явных симптомов и остаётся незамеченной.
Примерно у трети заболевших детей, у которых появляются такие общие симптомы как повышение температуры, болезненное самочувствие, общая усталость и утомляемость, они начинают худеть, болезнь может находиться уже на поздней стадии. С того момента, когда у ребёнка появились первые симптомы, до того времени, когда ему поставили точный диагноз, может пройти от несколких недель до нескольких месяцев.
Те симптомы у детей и подростков, о которых мы здесь пишем, не обязательно говорят о том, что у ребёнок заболел саркомой Юинга или каким-то другим раком костей. Тем не менее, если у ребёнка или у подростка появляются боли в костях, мы обязательно рекомендуем обратиться к опытному педиатру и выполнить полную диагностику. Чтобы точно быть уверенным в том, что это не онкология.
Диагностика саркомы мягких тканей
Подробная информация о заболевании и общем состоянии здоровья человека позволяет подобрать самое подходящее для каждого конкретного пациента лечение.
Высококлассные специалисты онкологического проводят полную диагностику сарком мягких тканей на самом современном оборудовании – быстро, качественно, без очередей и потерь времени.
Обследование начинается с общего осмотра и опроса о симптомах и семейных заболеваниях, после чего врач назначает ряд исследований.
Первым из них может стать обычная рентгенография
. С ее помощью сразу после постановки диагноза доктора могут увидеть, распространилась ли опухоль на легкие.
– компьютерная томография: рентгеновские лучи создают подробное изображение внутренних органов и тканей. Метод используется для выявления новообразований в груди или брюшной полости, а также для обнаружения повреждений легких, печени и других органов.
МРТ
– магнитно-резонансная томография: радиоволны и сильные магниты часто работают лучше, чем КТ. МРТ позволяет получать данные о размерах саркомы, ее расположении, а иногда даже о типе ткани, из которых она состоит. Кроме того, данное исследование назначается для изучения состояния головного и спинного мозга.
УЗИ
с помощью ультразвуковых волн специалист может отличить уплотнения от обычных кист – заполненных жидкостью мешочков.
ПЭТ
– позитронно-эмиссионная томография: перед выполнением данного исследования пациент получает радиоактивный сахар, который накапливается в опасных новообразованиях. Затем проводится сканирование, которое показывает, являются ли изменения в тканях онкологией.
При подозрении на саркому мягких тканей врач назначает биопсию
, в ходе которой небольшой кусочек опухоли изымается и передается в лабораторию, где его клетки тщательно изучаются.
Основные методы диагностики
В первую очередь необходимо обратиться к терапевту. Врач проводит визуальный осмотр, при необходимости отправляет на дополнительное обследование к онкологу, эндокринологу или другим специалистам. Для точной постановки диагноза показано проведение обследования:
- анализ крови – общий, биохимический;
- анализ мочи – общий;
- рентген пораженных областей и суставов;
- УЗИ пораженных областей, а также лимфоузлов и брюшной полости;
- МРТ;
- сцинтиграфия (специальное исследование костей);
- биопсия – забор биологической ткани непосредственно из места поражения для дальнейшего анализа.
Стадии саркомы мягких тканей
Сразу после обнаружения заболевания врачи пытаются поставить его стадию – понять, насколько сильно оно успело распространиться по организму и повредить ткани. Данная информация позволяет понимать примерные прогнозы пациента и подбирать для него самые подходящие методы лечения.
Стадирование сарком мягких тканей проводится по международной системе TNM
, каждая буква которой имеет свое значение:
- «Т
» описывает размеры основного новообразования; - «N
» – повреждение ближайших лимфатических узлов; - «М
» – наличие метастазов – дополнительных очагов заболевания в других областях организма.
С помощью «G
» указывают:
- Степень отличия опухолевых клеток
от здоровых – от 1 до 3. Единица присваивается максимально похожим на нормальные ткани клеткам, а 3 – сильно измененным; - Количество делящихся клеток
– от 1 до 3. Чем их меньше, тем балл ниже. - Некроз
: оценка от 0 до 2 ставится при определении количества умирающих тканей – чем выше цифра, тем их больше.
Затем подсчитывается общее количество баллов: G1 – от 2 до 3; G2 – от 4 до 5; G3 – от 6 до 8.
Стадии:
1А
: размеры саркомы не превышают 10 сантиметров, остальные ткани здоровы.
1В
: новообразование может быть крупнее 15см, но его клетки очень похожи на нормальные, а другие органы не пострадали.
2
: опухоль не более 5см в диаметре, но ей присвоена степень G2 или G3.
3А
: саркома от 5 до 10см, G2 или G3.
3В
: от 10 до 15 см, G2 или G3, но другие ткани здоровы. Либо, в случае расположения новообразования в области живота, любые размеры основного очага и повреждение ближайших лимфатических узлов.
4
: опухоль любого диаметра и типа G, повредившая не только расположенные рядом лимфоузлы, но и отдаленные ткани, такие как легкие.
Список литературы:
- Kaatsch P, Spix C: German Childhood Cancer Registry — Jahresbericht / Annual Report 2015 (1980-2014). Institut für Medizinische Biometrie, Epidemiologie und Informatik (IMBEI), Universitätsmedizin der Johannes Gutenberg-Universität Mainz 2015 [URI: https://www.kinderkrebsregister.de/ dkkr/ ergebnisse/ jahresbericht/ jahresbericht-2015.html] KAA2015a
- Dirksen U, Jürgens H: Ewing-Sarkome des Kindes- und Jugendalters. S1-Leitlinie der Gesellschaft für Pädiatrische Onkologie und Hämatologie (GPOH) AWMF online 2014 [URI: https://www.awmf.org/ uploads/ tx_szleitlinien/ 025-006l_S1_Ewing_Sarkome_Kinder_Jugendliche_2014-06-abgelaufen.pdf] DIR2014
- Haeusler J, Ranft A, Boelling T, Gosheger G, Braun-Munzinger G, Vieth V, Burdach S, van den Berg H, Jürgens H, Dirksen U: The value of local treatment in patients with primary, disseminated, multifocal Ewing sarcoma (PDMES). Cancer 2010, 116: 443 [PMID: 19924786] HAE2010
- Burkhardt B, Reiter A, Landmann E, Lang P, Lassay L, Dickerhoff R, Lakomek M, Henze G, von Stackelberg A: Poor outcome for children and adolescents with progressive disease or relapse of lymphoblastic lymphoma: a report from the berlin-frankfurt-muenster group. Journal of clinical oncology 2009, 27: 3363 [PMID: 19433688] BUR2009
- Germeshausen M, Skokowa J, Ballmaier M, Zeidler C, Welte K: G-CSF receptor mutations in patients with congenital neutropenia. Current opinion in hematology 2008, 15: 332 [PMID: 18536571] GER2007
- Gerth HU, Juergens KU, Dirksen U, Gerss J, Schober O, Franzius C: Significant benefit of multimodal imaging: PET/CT compared with PET alone in staging and follow-up of patients with Ewing tumors. Journal of nuclear medicine : official publication, Society of Nuclear Medicine 2007, 48: 1932 [PMID: 18006618] GER2007
- Wagner LM, McAllister N, Goldsby RE, Rausen AR, McNall-Knapp RY, McCarville MB, Albritton K: Temozolomide and intravenous irinotecan for treatment of advanced Ewing sarcoma. Pediatric blood & cancer 2007, 48: 132 [PMID: 16317751] WAG2007
- Hunold A, Weddeling N, Paulussen M, Ranft A, Liebscher C, Jürgens H: Topotecan and cyclophosphamide in patients with refractory or relapsed Ewing tumors. Pediatric blood & cancer 2006, 47: 795 [PMID: 16411206] HUN2006
- Bernstein M, Kovar H, Paulussen M, Randall RL, Schuck A, Teot LA, Jürgens H: Ewing’s sarcoma family of tumors: current management. The oncologist 2006, 11: 503 [PMID: 16720851] BER2006
- Juergens C, Weston C, Lewis I, Whelan J, Paulussen M, Oberlin O, Michon J, Zoubek A, Jürgens H, Craft A: Safety assessment of intensive induction with vincristine, ifosfamide, doxorubicin, and etoposide (VIDE) in the treatment of Ewing tumors in the EURO-E. W.I. N.G. 99 clinical trial. Pediatric blood & cancer 2006, 47: 22 [PMID: 16572419] JüR2006
- Hawkins DS, Schuetze SM, Butrynski JE, Rajendran JG, Vernon CB, Conrad EU 3rd, Eary JF: [18F]Fluorodeoxyglucose positron emission tomography predicts outcome for Ewing sarcoma family of tumors. Journal of clinical oncology : official journal of the American Society of Clinical Oncology 2005, 23: 8828 [PMID: 16314643] HAW2005
- Dirksen U, Poremba C, Schuck A: Knochentumoren des Kindes-und Jugendalters. Der Onkologe 2005, 10: 1034 DIR2005
- Niemeyer C, Kontny U: Tumoren der Ewing-Sarkom-Familie, in: Gutjahr P (Hrsg.): Krebs bei Kindern und Jugendlichen. Deutscher Ärzte-Verlag Köln 5. Aufl. 2004, 491 [ISBN: 3769104285] NIE2004
- Schuck A, Ahrens S, Paulussen M, Kuhlen M, Konemann S, Rube C, Winkelmann W, Kotz R, Dunst J, Willich N, Jürgens H: Local therapy in localized Ewing tumors: results of 1058 patients treated in the CESS 81, CESS 86, and EICESS 92 trials. Int J Radiat Oncol Biol Phys 2003, 55: 168 [PMID: 12504050] SCH2003g
- Paulussen M, Frohlich B, Jürgens H: Ewing tumour: Incidence, prognosis and treatment options. Paediatr Drugs 2001, 3: 899 [PMID: 11772151] PAU2001c
Саркома Юинга: краткая информация (336KB) автор: Dipl.-Biol. Maria Yiallouros, PD Dr. med. Gesche Tallen Stand: 14.07.2016
Лечение саркомы мягких тканей
Борьба с онкологией – задача не из легких, и требует участия не одного врача, а целой команды профессионалов своего дела.
В онко проводятся любые виды диагностики и терапии сарком на самом современном оборудовании. Наши специалисты мирового уровня полностью ведут пациента и оказывают ему всю необходимую помощь – быстро, качественно, без очередей и потерь времени.
Каждая ситуация уникальна и требует индивидуального подхода и сочетания различных методик:
Хирургия
, с помощью которой можно полностью излечить некоторые опухоли. Целью операции является удаление всего новообразования и некоторого количества окружающих его здоровых тканей – по крайней мере 1-2 сантиметров, чтобы в организме человека не осталось измененных клеток. В прошлом многим пациентам с саркомами на руках и ногах назначалась ампутация конечностей. Сегодня этот метод применяется редко, и только в некоторых случаях не удается избежать этой травмирующей процедуры. Кроме того, бывают ситуации, когда вместе с онкологией приходится удалять важные нервы, мышцы, кости и кровеносные сосуды.
Даже при распространении заболевания на отдаленные участки тела, такие как легкие или другие органы, с помощью хирургии можно вылечить человека или продлить ему жизнь.
Лучевая терапия
: воздействие на опухоль радиоактивными лучами или частицами – это ключевая часть борьбы с саркомами мягких тканей. В большинстве случаев данная процедура назначается как
адъювантное
лечение, проводимое после хирургического вмешательства. С ее помощью специалисты убивают оставшиеся в организме измененные клетки и предотвращают повторное развитие заболевания. Некоторым пациентам требуется
неоадъювантная
терапия, используемая до операции для уменьшения новообразования и облегчения его удаления. Кроме того, радиация может применяться как паллиатив – для облегчения симптомов запущенной болезни, которую нельзя победить.
Существует несколько видов лучевой терапии:
- классическая внешняя
, при которой воздействие происходит снаружи, через кожу; - интраоперационная
, предполагающая облучение тканей после удаления опухоли, до закрытия раны; - брахитерапия – введение маленьких гранул радиоактивного материала в поврежденные саркомой области;
- и протонная
терапия, использующая вместо рентгеновский лучей потоки протонов – положительно заряженных частиц, точно направленных на измененные клетки.
Химиотерапия
– применение специальных убивающих опухолевые клетки препаратов. Они вводятся в вену или принимаются внутрь как таблетки и достигают всех участков тела. Благодаря этому свойству метод эффективен даже на запущенных этапах заболевания. В зависимости от типа и стадии саркомы, данная процедура может назначаться как основное или вспомогательное лечение – в дополнение к хирургическому вмешательству, и сочетаться с лучевой терапией. Некоторым пациентам требуется особый вид химиотерапии – так называемая
изолированная перфузия конечностей
. При ее проведении специалист отделяет кровообращение пострадавшей руки или ноги от остального организма, после чего вводит действующие вещества.
Таргетная терапия
– препараты, атакующие только определенные компоненты измененных клеток, и наносящие минимум вреда здоровым.
Пазопаниб
(
Вотриент
): блокирует несколько важных для роста и выживания клеток ферментов – белков, которые запускают или ускоряют химические реакции, необходимые для копирования генетической информации. Его можно использовать для лечения запущенных сарком мягких тканей, не отреагировавших на химиотерапию. Он замедляет развитие опухоли и облегчает побочные эффекты у пациентов, чьи новообразования нельзя вылечить хирургически.
Таземетостат (Тазверик
): воздействует на белок, способствующий росту некоторых онкологических клеток. Его используют при эпителиоидных саркомахЭпителиоидные саркомы, как правило, повреждают ткани рук, предплечий, стоп или голеней подростков и молодых людей., которые невозможно удалить с помощью операции.
Костные саркомы у детей
Злокачественные опухоли костей у детей — одна из драматических страниц детской онкологии, что связано в первую очередь с поздней диагностикой и большим процентом больных, поступающих на лечение в запущенных стадиях заболевания. В связи с этим актуальным и своевременным остается вопрос ранней диагностики этих новообразований. Ведь именно ранняя диагностика злокачественной опухоли кости является залогом повышения эффективности лечения. Сложность диагностики связана в первую очередь с недооценкой клинической картины опухолевого процесса из-за крайне редкой заболеваемости, низкого уровня онкологической настороженности, а также незнания или игнорирования методов исследования, позволяющих уточнить злокачественность процесса.
Ранняя своевременная диагностика костных сарком представляет очень большие трудности. Об этом говорит тот факт, что почти 70% больных до обращения к детскому онкологу имели другой диагноз (остеомиелит, миозит, невралгия, туберкулез, различные травматические повреждения) и в связи с этим получали неадекватное лечение.
Костные саркомы составляют до 10% в структуре заболеваемости злокачественных новообразований у детей. Это один из важных и трудных в диагностическом и лечебном плане разделов детской онкологии. При анализе структуры опухолевого поражения скелета на долю доброкачественных процессов приходится 62%, злокачественных — 30%, метастазов — 8%. Наиболее распространенными опухолями являются остеогенная саркома и саркома Юинга.
В отличие от доброкачественных опухолей, которые одинаково часто поражают как мальчиков, так и девочек, злокачественные опухоли в 1,2-2 раза чаще встречаются у мальчиков и возникают в период наиболее интенсивного роста скелета и усиленной пролиферации клеток. В последнее время отмечается увеличение заболеваемости опухолями костей, возможно в связи с акселерацией населения. Так, было замечено, что дети моложе 15 лет, больные костными саркомами, значительно выше ростом по сравнению с пациентами, страдающими другими формами злокачественных опухолей. Эти наблюдения подкрепляют имеющиеся данные о том, что, возможно, удлинение сроков роста скелета или чрезмерная стимуляция обменных процессов имеют значение в происхождении опухолей костей.
Пристальное внимание врачей всего мира привлечено к этой сложной проблеме по различным причинам, и прежде всего потому, что при злокачественных опухолях костей у детей довольно длительное время сохранялась низкая выживаемость, но в последние годы наметились благоприятные перспективы благодаря своевременной комплексной ранней диагностике и интенсификации программ лечения, приводящих к обнадеживающим результатам.
Эффективность лечения этих опухолей зависит от раннего обращения к врачу — чем раньше будет поставлен правильный диагноз, тем быстрее будет проведена специальная терапия и тем выше шанс к полному выздоровлению и качеству жизни ребенка.
Причина появления злокачественных опухолей костей до настоящего времени не известна, однако доказано, что у 40% больных возникновение костной саркомы провоцирует травма.
Остеогенная саркома развивается, главным образом, в длинных трубчатых костях, преимущественно в нижних конечностях, в основном в костях, составляющих коленный сустав. Значительно реже — в плоских, костях таза, малоберцовой, плечевой, ключице, позвоночнике, нижней челюсти. Остеоcаркома формируется к периоду конца полового созревания, то есть в период наиболее интенсивного развития организма — от 12 до 16 лет, предпочтительнее в зонах наиболее активного роста скелета.
Саркома Юинга чаще всего поражает плоские кости (кости малого таза, ребра, лопатку) и диафизы длинных трубчатых костей. Нередко очаги поражения обнаруживаются одновременно в нескольких костях, иногда локализуются и в мягких тканях. Она составляет 10-15% всех первичных злокачественных новообразований костей. В год выявляется 0,6 новых случаев заболевания на 1 млн населения. Эта саркома редко встречается у детей до 5 лет или у взрослых старше 30 лет. Пик заболеваемости наблюдается между 10 и 15 годами жизни.
Костные саркомы характеризуются быстрым ростом и ранним метастазированием. Заболевание у детей протекает более злокачественно, чем у взрослых.
Диагностика злокачественных опухолей костей должна быть комплексной с учетом данных клинико-лабораторных обследований, лучевых методов диагностики и обязательно морфологических методов.
Классические признаки костных опухолей — боль, припухлость (появление прощупываемой опухоли), нарушение функций пораженной конечности.
Первым признаком является боль, которая в отличие от воспалительного процесса не стихает в покое (усиление по ночам, отсутствие облегчения при фиксации конечностей). По мере роста опухоли начинает страдать функция близлежащего сустава и затем развивается прощупываемая опухоль, нередко с патологическим переломом (поздний признак болезни). На 3-4-м месяце от начала заболевания из-за боли сначала ограничивается, а затем прекращается движение в ближайшем суставе.
Клинические проявления остеогенной саркомы во многом определяются локализацией опухоли, ее размерами и степенью распространенности на окружающие ткани.
По клиническому течению можно выделить два вида остеогенной саркомы — стремительное развитие опухоли с нарастанием болевого синдрома, нарушением функции пораженной конечности и быстрым летальным исходом, и медленное развитие опухолевого процесса. Для детей и подростков характерен первый вид клинического течения заболевания. У большинства больных первым симптомом заболевания является боль, которая появляется на фоне полного здоровья и совсем неожиданно. Однако в более чем 50% наблюдений в анамнезе имелось указание на травму именного того участка, в области которого в дальнейшем появлялась опухоль. Боль при остеогенной саркоме обусловлена сдавлением надкостницы и окружающих тканей. Срок с момента травмы до появления заболевания варьирует в довольно широких пределах, но все же основная масса родителей связывает появление первых симптомов заболевания с травмой. Для проявления остеогенной саркомы характерны постоянные и самостоятельные боли в покое, интенсивность которых прогрессирует очень быстро, появляются ночные боли. Наиболее интенсивные боли наблюдаются при поражении костей голени, что определяется анатомическими особенностями этой области (наличие парных костей, меньший объем окружающих мягких тканей). Характер болевых ощущений носит тупой, ноющий характер. В этот период общее состояние ребенка остается удовлетворительным, иногда в вечернее время возникает субфебрильная температура.
Важным клиническим симптомом служит появление опухоли, которая у детей очень быстро проявляется вслед за возникновением боли. В подавляющем большинстве случаев опухоль выявляется в течение месяца от начала появления боли. Как первый признак заболевания безболезненная опухоль встречается значительно реже, чем болевые ощущения. По мере роста опухоли она становится болезненной при пальпации, возникает отечность мягких тканей, кожи, отмечается синюшность кожных покровов вследствие венозного застоя. Кожа становится напряженной и появляется расширенная поверхностная венозная сеть.
Одновременно с появлением и ростом опухоли появляется и нарастает нарушение функции конечности в виде хромоты и сгибательной контрактуры в ближайшем от опухоли суставе. В этот момент состояние ребенка заметно ухудшается, отмечается подъем температуры до 38-39оС, что, по-видимому, связано с распадом ткани опухоли.
Общие симптомы в виде недомогания, постоянной гипертермии, слабости, похудания, нарушения сна наблюдаются, как правило, в поздних стадиях заболевания. Лабораторные показатели: ускорение СОЭ, лейкоцитоз, повышение ЩФ при запущенных стадиях.
О чрезвычайно быстром росте остеогенной саркомы и об очень высокой ее злокачественности свидетельствует тот факт, что у большинства больных срок обращения к врачу от начала клинических проявлений заболевания составил в среднем 3,5 месяца. Из них более чем у 15% детей, впервые поступивших для обследования, были выявлены метастазы в легких.
Остеогенная саркома — чрезвычайно злокачественная опухоль, склонная к быстрому гематогенному метастазированию. Наиболее часто метастазы возникают в легких и до конца первого года от начала заболевания выявляются у подавляющего числа больных. Крайне редко, но возможно метастазирование остеогенной саркомы в регионарные лимфатические узлы и другие кости.
Первым признаком саркомы Юинга бывает тупая, ноющая боль в месте поражения, постоянно нарастающая (в 22% случаев отмечается острое начало болевого синдрома). Одновременно с болью возникает недомогание, повышается температура и нарастает интоксикация. В области растущей опухоли появляются припухлость, гиперемия, расширение подкожных вен и местная гипертермия.
Для саркомы Юинга у детей характерна цикличность течения заболевания, когда клиническая симптоматика вначале уменьшается, затем возобновляется. Как правило, клиническая картина заболевания многими признаками напоминает остеомиелит: боли, лихорадка, нарушение подвижности конечности, местное повышение температуры, припухлость мягких тканей в области поражения, похудание, изменения в анализах крови (анемия, увеличение СОЭ). Это затрудняет своевременную диагностику на ранних этапах заболевания.
Особенно сложна диагностика саркомы Юинга ребер. При первичном обращении к врачу диагноз в 60% случаев был ошибочным, в 40% вообще не был поставлен. При остром начале болезни, сопровождающемся легочными симптомами, диагностировались пневмония и острые респираторные заболевания; при болях иррадиирующего характера — миозиты, гепатиты, невралгии.
Опухоли, появившиеся после травмы, трактовались как ушибы, а без травмы — как липомы, остеомиелиты, проявление рахита.
Более половины больных обратились к врачу в первый месяц от начала заболевания. При обращении к врачу жалобы на опухоль и боль оказались примерно одинаковыми по частоте, так как появление опухоли воспринимается родителями как более грозный признак, чем боль, сопровождающая многие заболевания.
Наиболее типичными признаками опухоли Юинга ребра являются припухлость в области поражения, боль в грудной клетке, сопровождающиеся симптомами респираторных заболеваний и дыхательной недостаточности. Рентгенологически определяемое разрушение ребра смазывается за счет огромного внутригрудного мягкотканного компонента, что приводит, как правило, к ошибочной диагностике и трактуется как воспалительное поражение легочной ткани. Опухоль часто инфильтрирует плевру и осложняет процесс плевритом. Все это затрудняет диагностику деструктивных изменений ребра.
Общее состояние детей на ранних стадиях заболевания не страдает. Но когда опухоль достигает больших размеров, может повышаться температура до субфебрильных цифр, отмечаются похудание, вялость, бледность, понижение аппетита.
При появлении вышеуказанных признаков ребенка нужно в обязательном порядке направить к хирургу, травматологу или детскому онкологу.
К сожалению, заблуждение об обреченности онкологических больных распространено довольно широко. Научно-популярная литература по лечению рака, особенно у детей, практически отсутствует, зато много примитивных и недостоверных брошюр, в которых содержится непроверенная, а чаще вредная информация о якобы лечебном действии различных препаратов. Все это вынуждает родителей больного ребенка использовать «чудодейственные» средства, предлагаемые зачастую людьми, бесконечно далекими от медицины. В результате упускается драгоценное время, необходимое для раннего выявления злокачественной опухоли кости, и больные нередко попадают к детскому онкологу в далеко зашедшей стадии заболевания, когда существенно помочь им уже нельзя.
Таким образом, при первичном обращении больного к врачу общей поликлинической сети большое значение имеет тщательный и правильно собранный анамнез заболевания, также врач поликлиники должен знать, что костные саркомы могут протекать под масками других заболеваний, в том числе и неопухолевых. В связи с этим важны дополнительные методы обследования, которые позволяют выявить признаки опухолевого процесса, уточнить природу новообразования.
Рентгенологическому исследованию принадлежит первостепенная роль в распознавании костных злокачественных сарком.
При первичном обследовании больного ребенка по месту жительства с подозрением на первичную злокачественную опухоль кости (на основании данных тщательно собранного анамнеза и клинических симптомов) необходимо выполнить традиционную рентгенографию области поражения длинной кости или отдела скелета в двух стандартных проекциях. Если определяемые изменения в кости дают право заподозрить костную саркому, то следует не заниматься дифференциальной диагностикой и лечением, а немедленно направить ребенка в специализированное детское онкологическое отделение или центр.
При отсутствии признаков патологического процесса на первичных рентгенограммах и нарастании болевого синдрома или увеличении припухлости необходимо выполнить контрольное рентгенологическое исследование через 2 недели без проведения тепловых процедур или других физиотерапевтических методов лечения. Это является ключевым моментом для прогноза заболевания, так как физиопроцедуры вызывают очень быструю генерализацию опухолевого процесса.
При поступлении больных с предполагаемым злокачественным новообразованием кости в специализированное детское онкологическое отделение необходима комплексная диагностика, включающая в себя клинико-лабораторные, патоморфологические исследования и методы лучевой диагностики (многопроекционная рентгенография, компьютерная и магнитно-резонансная томография, ангиография, ультразвуковое и радиоизотопное исследование). Объем, вид и последовательность диагностических исследований зависят от локализации опухоли.
В комплексной лучевой диагностике рентгенологический метод сохраняет ведущее положение и определяет последовательность и объем уточняющих исследований. Методически правильное проведение квалифицированного рентгенологического исследования обычно позволяет не только установить наличие или отсутствие опухолевого поражения кости, но и достоверно судить о его доброкачественности или злокачественности. Рентгенологическое исследование костей является обязательным при болях неясного характера. Необходимо помнить, что при локализации процесса в костях таза, ребрах, позвоночнике нередко основным симптомом становятся иррадиирующие боли не только в костях и суставах, но и в грудной и брюшной полостях. Это приводит к диагностическим ошибкам, так как рентгенологическому исследованию подвергается не первичный очаг, а болевая зона.
В диагностически трудных случаях, а именно при выраженных болях в костях и нормальной рентгенологической картине, показаны повторные снимки с короткими интервалами (2-3 недели), позволяющие судить о динамике процесса. Рентгенограммы выполняются в двух стандартных взаимно перпендикулярных проекциях с захватом смежных (с предполагаемым участком поражения) отделов кости. Иногда обзорные снимки целесообразно дополнять прицельными снимками, томограммами.
При первичных злокачественных опухолях трубчатых костей осуществляется рентгенография в стандартных прямой и боковой проекциях. При поражении ребер, костей таза, позвонков проводится полипозиционное рентгенологическое исследование в прямой, боковой, правой и левой косой проекциях. Исследование костей свода черепа, как правило, ограничивается рентгенографией в двух стандартных проекциях.
Рентгенологически различают три формы остеогенной саркомы: остеолитическую (выявляется очаг деструкции кости), остеопластическую (отмечается выраженное костеобразование) и смешанную.
Одним из наиболее патогномоничных рентгенологических признаков остеогенной саркомы принято считать наличие остеофитов, возникающих на границе наружного дефекта компактного слоя кости и внекостного компонента опухоли, который имеет вид характерного козырька (треугольник Кодмана).
Другим рентгенологическим симптомом, который свидетельствует о распространении опухоли за пределы кости, являются так называемые спикулы — тонкие игольчатые обызвествления, направленные перпендикулярно длиннику кости. При остеопластическом варианте они бывают различной длины и отходят от коркового слоя надобно языкам пламени.
Распространение опухолевого процесса на окружающие ткани приводит к образованию внекостного компонента, в котором определяются поля оссификации различных размеров. Эти участки, как правило, наблюдаются при остепластическом и смешанном вариантах остеогенной саркомы. В единичных наблюдениях при остеогенной саркоме на некотором удалении от основного массива опухоли можно наблюдать симптом шаровидных уплотнений.
Остеолитический вариант остеогенной саркомы проявляется очагами деструкции различных размеров с нечеткими, неровными контурами. Реактивные изменения надкостницы характеризуются вначале однослойным, а в дальнейшем многослойным периоститом. Опухоль истончает, а затем полностью разрушает кортикальный слой и реактивно измененную надкостницу, выходит за пределы кости, инфильтрирует мышцы, сосуды и нервы. При этом по краям опухоли образуется разрушенный надкостницей характерный периостальный козырек.
При остеопластическом варианте остеогенной саркомы на первый план выступают остеопластические процессы.
При смешанном варианте остеосаркомы имеются рентгенологические признаки как остеолитической, так и остеопластической остеогенной саркомы.
Саркоме Юинга присущи следующие рентгенологические признаки: периостальная реакция слоистый («луковичный») периостоз, мелкоочаговая деструкция, расширение костномозгового канала.
К моменту клинических проявлений в кости определяется мелкоочаговая деструкция. Она характеризуется множеством мелких, нечетко очерченных участков остеолиза по типу ноздреватого рисунка и сочетается с пластинчатой деструкцией, которую отличают значительное разволокнение и разрушение коркового слоя. Реже наблюдается крупноочаговая деструкция, состоящая из нескольких очагов остеолиза, иногда разделенных костными перегородками. Изредка наблюдается незначительное вздутие кости. Внутренний слой коркового вещества волнистый, местами нечеткий, костномозговой канал расширен. На рентгеновском изображении деструктивные и продуктивные изменения в кости выражаются в разволокнении и разрыхлении коркового слоя и в проявлении нарастающих многослойных пластинчатых периостальных наслоений. В результате этих изменений пораженная опухолью кость приобретает характерное продольное слоистое строение, напоминающее собой луковицу, и появляется типичная для саркомы Юинга периостальная реакция — слоистый («луковичный») периостоз, отдельные слои которого являются следствием повторяющихся вспышек опухолевого роста. В плоских костях обычно можно видеть только участки крупноочаговой деструкции без периостальной реакции. Реже определяются радиальные костные спикулы с разнообразной по протяженности опухолью в мягких тканях. В период активного роста опухоли на уровне деструкции появляется мягкотканный компонент, стелющийся вдоль кости и вначале четко очерченный жировой межмышечной прослойкой. Патологические переломы встречаются в 5% случаев.
Обладая высокой чувствительностью, радионуклидный метод исследования костных сарком у детей указывает на область поражения и распространенность процесса, позволяет выявить относительно ранние фазы развития патологического процесса в костной ткани и лимфатической системе. Мы считаем, что скеннирование костей имеет большое значение для установлении уровня резекции кости при планировании сохранной операции, поскольку позволяет выявить зоны изменений, которые могут еще недостаточно четко регистрироваться рентгенологически. Скеннирование костей можно рекомендовать в качестве дополнительного диагностического метода, а также для динамического наблюдения за больным как в процессе, так и после окончания специальной терапии для выявления рецидива или метастазов опухоли. Применение радионуклидного исследования также показано при выраженной болезненности и нормальной рентгенологической картине.
Оценка распространенности опухолевого процесса при первичной диагностике и лечении, состояние внекостного компонента опухоли доступны УЗИ, которое незаменимо в детской онкологии, так как является общедоступным методом обследования. Эхографическая картина внекостного компонента злокачественных опухолей костей характеризуется наличием объемного образования, широко прилежащего к кости, имеющего гетерогенную структуру и зоны пониженной эхоплотности по периферии, а также гиперэхогенные участки вблизи кости.
При отсутствии выраженной динамики на рентгенограммах (как при первичном обращении, так и обязательно спустя 10 дней), но при наличии нарастания клинической симптоматики показано выполнение компьютерной томографии очага поражения. КТ и МРТ помогают установить внутрикостное и внекостное распространение опухоли, выявить вовлечение прилежащих органов и тканей в опухолевый процесс.
Исследования очага поражения необходимо выполнять до и после курсов противоопухолевой терапии, а также после радикального удаления опухоли не менее раза в месяц в течение первых 6 месяцев для выявления рецидива, уточнения состояния культи, эндопротеза.
Даже в типичных случаях клинико-рентгенологический диагноз костных сарком должен быть обязательно подтвержден морфологическим исследованием. Для этого производится трепанобиопсия — удобный и вполне надежный способ получения материала для исследования. Этот метод практически бескровен, малотравматичен, прост и позволяет получить участок ткани опухоли, достаточный как для цитологического, так и гистологического исследования. Оба метода требуют определенного опыта и тщательной подготовки с предварительным изучением рентгенологической картины для того, чтобы проникнуть инструментом в нужном направлении на необходимую глубину.
Наиболее эффективной в диагностическом плане является открытая, или инцизионная, биопсия, которая позволяет получить материал под визуальным контролем. Открытая биопсия должна поводиться в сложных дифференциально-диагностических случаях, при сомнительных диагнозах трепанобиопсии и с учетом объема предполагаемого оперативного вмешательства. Все виды диагностических манипуляций и операций следует проводить после предварительной разметки участка биопсии под контролем рентгеноскопии.
Учитывая возможности различных методов лучевой диагностики, план исследования больных должен строиться по определенной схеме. При первично-костных опухолях костей у детей используются следующие диагностические мероприятия: рентгенография зоны поражения в стандартных прямой, боковой и косых проекциях, УЗИ, РКТ, МРТ, радиоизотопное исследование, пункционная биопсия опухоли, открытая биопсия по показаниям (ангиографию проводят при первичном обследовании и в процессе специального лечения с целью оценки эффекта для решения вопроса об органосохраняющей операции).
Все эти методы, являясь не конкурирующими, а дополняющими друг друга, позволяют в короткие сроки и с наименьшими материальными и временными затратами установить топику и распространенность опухолевого процесса. Точность диагностики при костных саркомах достигает 94,7%.
Таким образом, при проведении полного и адекватного объема диагностических мероприятий у большинства больных возможна постановка правильного диагноза на ранних этапах развития болезни.
Несмотря на трагичность заболевания, в последние годы медицина достигла больших успехов в лечении злокачественных опухолей костей у детей при использовании органосохранного лечения (вместо калечащей операции сохраняется пораженная конечность), которое является приоритетным направлением в детской онкологии.
Вот пример из нашей практики. Больной С. 14 лет, обращение к врачу-травматологу с жалобами на припухлость в области нижней трети левого бедра с сильными, усиливающимися по ночам болями в области левого бедра и коленного сустава. Эти явления возникли после травмы, полученной во время игры в футбол. Была заподозрена злокачественная опухоль левого бедра, ребенок направлен в Научно-исследовательский институт детской онкологии и гематологии Российского онкологического научного центра им. Н.Н.Блохина РАМН, где диагноз был подтвержден. Своевременно проведенное лекарственное лечение позволило сохранить конечность, выполнена органосохраняющая операция с эндопротезированием коленного сустава. Лечение получено в полном объеме, в том числе и реабилитационное. В настоящее время пациент здоров, женат, имеет двоих детей, работает экономистом.
Суммируя все, подчеркнем, что исход болезни не безнадежен. Костная саркома сейчас не приговор — это просто диагноз. И чем раньше он поставлен, тем больше надежды на успех.
При своевременном обращении к врачу у большинства больных можно достигнуть высоких результатов лечения. Следует проявлять повышенную онкологическую настороженность у детей и подростков с обнаруженными воспалительными процессами, доброкачественными опухолями и опухолеподобными поражениями костей. Обязательно проводить динамическое наблюдение, особенно при нерезультативности проведенного лечения. В ходе ежегодной диспансеризации детей и подростков следует формировать группы высокого риска развития саркомы костей для последующего систематического клинико-рентгенологического наблюдения.
Комплексное лечение злокачественных опухолей опорно-двигательного аппарата проводится с использованием современных научных протоколов: интенсивные системные и регионарные курсы полихимиотерапии с современными схемами; оперативные вмешательства в различных объемах, преимущественно органосохраняющего характера; облучение по современным программам; хирургическое лечение метастазов.
Использование предоперационной терапии расширяет возможности выполнения в 80% случаев оперативных вмешательств с сохранением конечности, а это является важным фактором для выполнения как физической, так и социально-психологической реабилитации пациента и улучшения качества жизни. В НИИ детской онкологии и гематологии РОНЦ им. Н.Н.Блохина РАМН впервые в России и странах СНГ профессором Ю.Пашковым и его учениками были выполнены органосохраняющие, сберегательные операции с эндопротезированием у детей со злокачественными опухолям костей. Среди органосохраняющих операций хотелось бы отметить не только сегментарные резекции с замещением образующихся костных дефектов металлическими эндопротезами разных конструкций как отечественного, так и импортного производства, но и проведение хирургических вмешательств с использованием тотального эндопротезирования длинных трубчатых костей.
У детей с прогностически неблагоприятными формами саркомы Юинга и примитивной нейроэктодермальной опухолью проводится лечение по единому научному протоколу, включающему в себя индуктивную интенсивную полихимиотерапию со сбором периферических стволовых клеток, лучевую терапию и оперативное вмешательство с последующей высокодозной химиотерапией с трансплантацией периферических стволовых клеток или костного мозга. Изучаются осложнения и побочные проявления химиотерапии, разрабатываются методы их предупреждения и коррекции. К этой тематике относятся изучение и внедрение в практику противорвотных отечественных и зарубежных лекарств, кардиопротекторов, уропротекторов, стимуляторов гемопоэза.
Лев ДУРНОВ,
академик РАМН.
Надежда ИВАНОВА,
заведующая отделением опухолей опорно-двигательного аппарата,
кандидат медицинских наук.
Наталья КОШЕЧКИНА,
заведующая отделением лучевой диагностики, доктор медицинских наук.
НИИ ДЕТСКОЙ ОНКОЛОГИИ И ГЕМАТОЛОГИИ
РОССИЙСКОГО ОНКОЛОГИЧЕСКОГО НАУЧНОГО ЦЕНТРА ИМ. Н.Н.БЛОХИНА РАМН.
Лечение саркомы мягких тканей по стадиям
На каждом из этапов болезни применяются определенные методы терапии:
1 стадия
: небольшие опухоли конечностей удаляются с помощью операции, после чего в случае необходимости назначается лучевая терапия. Если саркома располагается в других областях организма – голове, шее или животе, перед вмешательством назначаются лучевая или химиотерапия, уменьшающие размер новообразования.
2 и 3 стадии
: также лечатся хирургически, в редких случаях проводится ампутация поврежденной конечности. До и после процедуры могут быть назначены химио- и лучевая терапия.
4 стадия
: редко поддается полному излечению. Самые высокие шансы на выздоровление есть у пациентов, чьи опухоли – основная и дополнительные – могут быть удалены в ходе операции. Если такой возможности нет, назначаются таргетная, химио- и лучевая терапия для снижения симптомов заболевания, продления жизни или улучшения ее качества.
Прогнозы и выживаемость при саркоме мягких тканей
Перспективы каждого человека индивидуальны – они зависят от большого количества факторов, таких как возраст, общее состояние здоровья, тип заболевания, его стадия, место возникновения опухоли, и ответ на лечение.
Для представления примерных прогнозов врачи используют специальный термин – «пятилетняя выживаемость». Этот статистический показатель ничего не говорит о шансах конкретного человека – он показывает только процент людей, оставшихся в живых спустя 5 или более лет с момента постановки диагноза.
Для саркомы мягких тканей цифры выглядят следующим образом:
- на локализованных этапах, пока опухоль не успела выйти за пределы той области, в которой она впервые возникла: примерно 81%;
- на региональных стадиях, при повреждении ближайших тканей или расположенных рядом лимфатических узлов: около 56%;
- при распространении заболевания на отдаленные части тела, такие как легкие: 15%.