Антиангинальные препараты – это группа лекарственных средств, которые применяют для лечения ишемической болезни сердца – стенокардии и инфаркта миокарда.
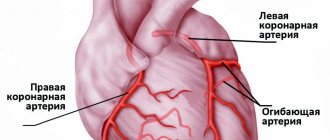
Ишемическая болезнь сердца (ИБС) – это патологическое состояние, связанное с кислородным голоданием сердечной мышцы (миокарда) из-за недостаточного поступления крови к сосудам сердца.
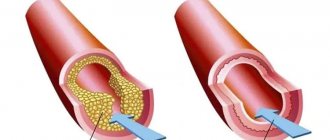
Хроническая ишемическая болезнь сердца проявляется стенокардией. Причинами стенокардии обычно является сужение просвета коронарных (сердечных) сосудов атеросклеротической бляшкой (стенокардия напряжения) или спазмом сосудов (вазоспастическая стенокардия).
Острая ишемическая болезнь сердца проявляется нестабильной стенокардией и инфарктом миокарда. Причиной острой ИБС является частичная или полная закупорка просвета сосудов тромбом.
Нестабильную стенокардию рассматривают как предынфарктное состояние. Чаще всего она переходит в острый инфаркт миокарда, однако в случае быстрого распознания и оказания помощи нестабильная стенокардия способна разрешиться вполне благополучно.
Сужение просвета коронарных сосудов приводит к снижению доставки крови (а вместе с кровью – кислорода и питательных веществ) к миокарду, что проявляется кислородным голоданием сердечной мышцы, болью при физической нагрузке или психоэмоциональном стрессе.
Полная же закупорка просвета коронарных сосудов приводит к резкому дефициту кислорода в питаемых этими сосудами участках сердца и, при отсутствии лечения, их гибели – некрозу.
Лекарственные препараты, применяемые при стенокардии, называют антиангинальными средствами (от старого латинского названия стенокардии: angina pectoris – грудная жаба).
Классификация антиангинальных препаратов
В зависимости от механизма действия антиангинальные препараты классифицируют на:
- препараты, повышающие доставку кислорода к сердцу: ментол, валидол (ментол в ментиловом эфире изовалериановой кислоты), дипиридамол;
- препараты, понижающие потребность сердца в кислороде: β-адреноблокаторы (пропранолол, метопролол, атенолол, бетаксолол, бисопролол, небиволол, карведилол);
- брадикардитические средства (ивабрадин);
- органические нитраты и нитратоподобные средства – сиднонимины (нитроглицерин, изосорбида мононитрат, изосорбида динитрат, пентаэритритила тетранитрат, молсидомин);
Антигипоксанты. Что это такое, и кому они нужны?
Антигипоксантами называют средства, улучшающие усвоение организмом кислорода и снижающие потребность органов и тканей в кислороде, тем самым способствующие повышению устойчивости организма к кислородной недостаточности.
Исследования убедительно свидетельствуют, что наиболее перспективны в борьбе с гипоксией в спорте фармакологические средства, воздействующие на митохондриальные комплексы.
Условно антигипоксанты могут быть разделены на группы:
– препараты непосредственно антигипоксического действия; – корригирующие метаболизм в клетке: – мембранопротекторного действия, – прямого энергизирующего действия (влияющие на окислительно-восстановительный потенциал клетки, цикл Кребса и комплексы дыхательной цепи митохондрий); – действующие на транспортную функцию крови: – повышающие кислородную емкость крови, – повышающие сродство гемоглобина к кислороду, – вазоактивные вещества эндогенной и экзогенной природы.
*Гипоксен
Олифен (гипоксен). Антигипоксант. Механизм действия олифена на клетки заключается в снижении потребления тканями кислорода, его более экономном расходовании в условиях гипоксии.
Олифен – фермент дыхательной цепи синтетической природы. Обладая высокой электронно-обменной емкостью за счет полифенольной структуры молекулы, олифен оказывает шунтирующее действие на стадии образования молочной кислоты из пировино-градной кислоты, образуя ацетил Ко А, который затем вовлекается в цикл трикарбоновых кислот.
Олифен на молекулярном уровне облегчает тканевое дыхание в условиях гипоксии за счет способности непосредственно переносить восстановленные эквиваленты к ферментным системам. Препарат многократно компенсирует недостаток убихинона в условиях гипоксии, так как содержит большое количество функциональных центров.
Таким образом, олифен компенсирует деятельность митохондриальной дыхательной цепи при наличии повреждений на ее участках.
Антиоксидантное действие олифена связано с его полифенольной структурой, которая защищает мембраны клеток и митохондрий от разрушительного воздействия свободных радикалов, образующихся в процессе перекисного окисления липидов. Этот патологический процесс запускается при экстремальных физических и психоэмоциональных воздействиях на организм.
Олифен улучшает переносимость гипоксии за счет увеличения скорости потребления кислорода митохондриями и повышения сопряженности окислительного фосфорилирования.
Будучи препаратом прямого действия, может обеспечить кислородом любую клетку за счет малых размеров собственных молекул. В связи с этим его применение возможно при всех видах гипоксии.
Экономное расходование энергетических запасов происходит за счет переведения с гликолитического на аэробное окисление энергетических субстратов, т е. на более выгодный механизм обмена.
При этом выход энергии увеличивается в 19 раз, так как при анаэробном гликолизе одной молекулы получается 2 молекулы АТФ, а при аэробном – 38 молекул АТФ.
Водорастворимый антиоксидант, обладая высокой энергетической емкостью, ставит большое количество электронных ловушек. Окислительно-восстановительный потенциал олифена – 680, коэнзима Q10 – 122.
Показания к применению в спорте: повышение работоспособности при выполнении мышечной работы в экстремальных условиях соревнований; экономное расходование кислорода тканями в условиях гипоксии; профилактика и преодоление состояния хронической усталости; ускорение восстановления организма после перенесенных нагрузок; улучшение периферического кровотока.
Выводится из организма через 6-8 часов. Побочное действие практически не встречается. В редких случаях возможна тошнота, сухость во рту.
Олифен улучшает усвоение других веществ (лекарств, витаминов) на 25%.
*Кофермент Q-10
Убихинон (кофермент Q-10, коэнзим Q10) – вещество, которое вырабатывается организмом и поступает с пищей. Оно обнаружено в говядине (особенно во внутренних органах – сердце, печени, почках), жирной рыбе, шпинате, арахисе и цельных зернах. Несмотря на то что коэнзим Q10 (CoQ-10) можно найти во многих свежих продуктах, он неустойчив и легко разрушается окислением при переработке и приготовлении продуктов.
CoQ-10 участвует в работе электронтранспортной дыхательной цепи митохондрий. Уменьшает повреждение ткани, вызванное гипоксией, генерирует энергию и повышает толерантность к физическим нагрузкам. Как антиоксидант замедляет процесс старения (нейтрализует свободные радикалы, отдавая свои электроны). Укрепляет иммунную систему.
Наш организм может вырабатывать CoQ-10, если получает в необходимом количестве витамины В2 , В3 , В6 , С, фолиевую и пантотеновую кислоты. В случае нехватки любого из этих витаминов синтез CoQ-10 подавляется.
Не имеет токсичных доз и побочных эффектов. CoQ-Ю принимается в дозировке от 30 до 100 мг в день. На данным момент нет достаточно объективных данных и достоверных объемных исследований по CoQ-1.
*Никотинамид
Никотинамид. Амид никотиновой кислоты и сама никотиновая кислота (витамин РР, ниацин, витамин В3 ), являясь простетической группой ферментов НАД и НАДФ и переносчиками водорода, участвуют в процессах тканевого дыхания, метаболизме жиров, углеводов, аминокислот.
*Цитохром С
Цитохром С (цито Мак). Гемопротеид, катализатор клеточного дыхания. Стимулирует окислительные реакции и активизирует тем самым обменные процессы в тканях, уменьшает гипоксию тканей при различных патологических состояниях. Эффект наступает через несколько минут после в/в введения и продолжается несколько часов.
При применении возможны аллергические реакции. Предрасположенным к аллергическим реакциям рекомендуется проводить пробу с введением 0,5-1 мл цитохрома С, разбавленного 1:10; или 0,1 мл внутрикожно.
*Реамберин
Реамберин. Раствор (1,5%) для инфузий представляет собой хорошо сбалансированный полиионный раствор с добавлением янтарной кислоты, содержащий: натрия хлорида 6,0 г, калия хлорида 0,3 г, магния хлорида 0,12 г, натриевой соли янтарной кислоты 15 г, воды для инъекций до 1 литра. Сбалансированный препарат с осмолярностью, приближенной к нормальной осмолярности плазмы крови человека.
Основной фармакологический эффект препарата обусловлен способностью усиливать компенсаторную активацию аэробного гликолиза, снижать степень угнетения окислительных процессов в цикле Кребса, в дыхательной цепи митохондрий с увеличением внутриклеточного фонда макроэргических соединений (АТФ и креатин-фосфата). Сукцинат натрия (янтарная кислота) по клинической классификации относится к субстратным антигипоксантам. Включаясь в энергетический обмен как субстрат, соли янтарной кислоты направляют процессы окисления по наиболее экономичному пути.
Реамберин оказывает гепатозащитное действие, уменьшая продолжительность процессов перекисного окисления липидов и препятствуя истощению запасов гликогена в клетках печени.
Максимальный уровень концентрации препарата в крови при внутривенном введении наблюдается на первой минуте после введения. Через 40 мин его концентрация возвращается к значениям, близким к фоновым.
*Рибоксин
Инозин (рибоксин). Действие инозина антигипоксическое, антиаритмическое, анаболическое. Повышает активность ряда ферментов цикла Кребса и энергетический баланс. Оказывает положительное влияние на обменные процессы в миокарде – увеличивает силу сокращений и способствует более полному расслаблению миокарда в диастоле (связывает ионы кальция, попавшие в цитоплазму в момент возбуждения клетки), в результате чего возрастает ударный объем; улучшается кровоснабжение тканей, в том числе коронарное кровообращение.
Используется для профилактики метаболических нарушений в миокарде при экстремальных физических нагрузках, при дистрофии миокарда на фоне тяжелых физических нагрузок, нарушениях сердечного ритма, для профилактики заболеваний печени.
При применении возможны тахикардия, обострение подагры, гиперемия и зуд кожи, другие аллергические реакции.
*Актовегин
Актовегин (солкосерил) . Препарат биологического происхождения. Активирует клеточный метаболизм путем увеличения транспорта и накопления глюкозы и кислорода, усиления внутриклеточной утилизации. Улучшает трофику и стимулирует процесс регенерации.
*Милдронат
Милдронат. Улучшает метаболические процессы. Повышает работоспособность, уменьшает симптомы психического и физического перенапряжения; обладает кардиопротекторным и регулирующим систему клеточного иммунитета действиями; устраняет функциональные нарушения в соматической и вегетативной нервной системах. Препарат вызывает уменьшение содержания свободного кар-нитина, снижает карнитинзависимое окисление жирных кислот.
Биодоступность – 78%. Максимальная концентрация в плазме достигается через 1 –2 часа после приема. Период полувыведения – 3-6 часов.
Используется для восстановления после тренировочной и соревновательной нагрузки; физическом перенапряжении, перетренированности.
В редких случаях возможен кожный зуд, диспептические явления, тахикардия, возбуждение, изменения АД.
Применять осторожно при тахикардии и гипотензии.
*Винпоцетин
Кавинтон (винпоцетин) . Препарат, улучшающий мозговое кровообращение и процессы метаболизма в мозговой ткани; способствует транспортировке кислорода к тканям вследствие уменьшения сродства к нему эритроцитов, усиливая поглощение и метаболизм глюкозы; уменьшает повышенную вязкость крови, улучшает микроциркуляцию. Метаболизм глюкозы переключается на энергетически более выгодное аэробное направление. Стимулирует также и анаэробный метаболизм глюкозы.
Назначается в случае острой и хронической недостаточности мозгового кровообращения (транзиторная ишемия в видах спорта на выносливость); посттравматической и гипертензивной энцефалопатии (травмоопасные виды спорта); для уменьшения нарушений памяти; при головокружении; головной боли; двигательных расстройствах.
*Антигипоксическим эффектом обладают также витамины С и Е, адаптогены, ноотропы, оксибутират лития, лимонная и фумаровая кислоты.
При комбинированном применении антигипоксантов происходит усиление их действия.
Основы лечения ишемической болезни сердца
Антиангинальные препараты используют как для купирования (устранения) приступа стенокардии, так и для профилактики возникновения приступов систематически.
Помимо антиангинальных препаратов в лечении стабильной и вазоспастической стенокардии применяют средства для лечения атеросклероза (антиатеросклеротические), профилактики тромбообразования (антиагреганты).
Для лечения нестабильной стенокардии и острого инфаркта миокарда применяют в первую очередь не антиангинальные средства, а фибринолитики (препараты, растворяющие тромбы) и антикоагулянты и антиагреганты (препараты, препятствующие повторному тромбообразованию).
Последние десятилетия характеризуются значительными успехами в профилактике и лечении сердечно-сосудистых заболеваний (ССЗ): артериальной гипертензии (АГ); различных форм ишемической болезни сердца (ИБС) – острого коронарного синдрома (ОКС), инфаркта миокарда (ИМ); хронической сердечной недостаточности (ХСН). Эти достижения обусловлены внедрением в клиническую практику современных высокотехнологичных методов диагностики и лечения левожелудочковой недостаточности, в основу которых заложено четкое представление о механизмах развития ишемии и гибели кардиомиоцитов (структурных и функциональных единиц миокарда), адаптационных изменений центральной гемодинамики.
ИБС широко распространена во всем мире, особенно в экономически развитых странах, занимает ведущее место в структуре инвалидизации и летальности от ССЗ среди социально значимой возрастной группы населения. В большинстве европейских стран распространенность ИБС составляет 20–40 тыс. на 1 млн населения. Смертность от болезней системы кровообращения в Российской Федерации, по данным медицинской статистики за 2010 г., составила 56,5 % от общей летальности; из них более половины приходится на ИБС как на причину летального исхода.
ИБС как “самостоятельное заболевание” была выделена Всемирной организацией здравоохранения (ВОЗ) лишь в 1965 г. в связи с ростом частоты этой патологии, доминирующим участием в прогрессировании нарушений насосной деятельности сердца при ХСН и включена в Международную статистическую классификацию болезней, травм и причин смерти.
При ИБС наблюдается несоответствие уровня потребления миокардом кислорода объему его доставки коронарным кровотоком. Адекватное энергетическое обеспечение насосной деятельности сердца в широком диапазоне его деятельности – от состояния покоя до уровня максимальной нагрузки (соответственно уровню основного обмена целостного организма) зависит от состояния коронарного резерва. Коронарный резерв – это способность коронарного сосудистого русла во много раз увеличивать коронарный кровоток за счет дилатации коронарных сосудов адекватно потребностям миокарда в кислороде.
Кислород является ключевым компонентом окислительного фосфорилирования в синтезе АТФ – “топлива”, обеспечивающего функционирование кардиомиоцитов и в целом насосную деятельность сердца. Энергетический метаболизм в миокарде представляет собой взаимосвязанные механизмы доставки О2 и его утилизации субклеточными структурами кардиомиоцита – митохондриями [1 ,2, 4].
Сердце для энергообеспечения своей деятельности “утилизируeт” различные биологические субстраты: углеводы (глюкозу, гликоген, лактат), свободные жирные кислоты (СЖК), в меньшей степени – аминокислоты (белки). Независимо от энергетического субстрата в заключительной стадии распада биологических субстратов образуется ацетилкоэнзим-А , который вступает в цикл трикарбоновых кислот (цикл Кребса), и с участием О2 в митохондриях образуется энергетический субстрат АТФ.
В физиологических условиях 10 % АТФ образуется при окислительном фосфорилировании в митохондриях за счет аэробного гликолиза (расщепления глюкозы до пирувата). Количества АТФ, образующегося в результате аэробного гликолиза, не хватает для обеспечения работы ионных каналов сарколеммы, в частности для кальциевого насоса саркоплазматического ретикулума (СР), который для обеспечения диастолического расслабления потребляет до 50 % синтезированной энергии. Восполнение остального количества фосфатной энергии для функционирования кардиомиоцита в целом при нормальном кислородном обеспечении происходит за счет окисления СЖК. Метаболизм ЖК при окислительном фосфорилировании обеспечивает до 80 % синтеза АТФ. Однако окисление СЖК по сравнению с гликолизом – менее эффективный источник АТФ: “топлива” для сердца-насоса. При окислении СЖК на выработку одного и того же количества АТФ требуется примерно на 10 % больше кислорода, чем при гликолизе.[1, 4].
СЖК проникают в митохондрии посредством активного транспорта, за который отвечает карнитинпальмитиновый ферментный комплекс, затем в митохондриях происходит β-окисление СЖК. Этот процесс строго контролируется и зависит главным образом от интенсивности транслокации СЖК в митохондрии. В случае умеренной ишемии аэробное окисление СЖК и глюкозы снижается и анаэробный гликолиз становится основным источником АТФ. В этих условиях мобилизуются запасы гликогена на поддержку гликолиза.
При развитии различной степени ишемии (частичная или полная окклюзия коронарной артерии) анаэробный гликолиз остается единственным источником ограниченного образования АТФ. По мере уменьшения доставки О2 снижается активность окислительного метаболизма с образованием ограниченного количества АТФ. Выраженный дисбаланс между потребностью кислорода при окислении глюкозы и СЖК в сторону последних приводит к тому, что при ишемии в митохондриях кардиомиоцитов синтез АТФ переходит на β-окисление ЖК с накоплением множества недоокисленных активных форм ЖК ацилкоэнзима-А (Ацил-КоА) и ацилкарнитина (АцКар), что еще больше усугубляет разобщение окислительного фосфорилирования (рис. 1). Недоокисленные активные формы ЖК, в частности АцКар и Ацил-КоА как метаболиты, блокируют транспорт АТФ от места синтеза в митохондриях к месту их внутриклеточного потребления, оказывают разрушительное действие на мембрану – сарколемму, увеличивая дефицит энергии, необходимой для жизнедеятельности кардиомиоцитов [2, 4, 6, 10].
Параллельно в условиях тяжелой ишемии (отсутствия кровотока) лактат и Н+ накапливаются в кардиомиоцитах, т. е. на фоне анаэробного обмена происходит накопление протонов (Н+, Na+) и происходит “закисление” цитоплазмы. Ионы H+ и Na+ обмениваются на другие катионы (преимущественно на Ca2+), вследствие чего происходит “перегрузка” кардиомиоцитов Ca-ем с формированием незавершенной диастолы – контрактуры миокарда (рис. 2).
Современные достижения в изучении функции клеток (в частности, эндотелия) различных органов указывают на ключевую роль оксидативного стресса – избыточное образование активных форм кислорода (АФК – О2), в формировании ССЗ через перекисное окисление липидов (ПОЛ) клеточной мембраны. Главным источником АФК в клетках являются митохондрии, при нормальном функционировании которых 98 % поступившего кислорода используют для окисления субстратов с образованием АТФ (главного энергетического субстрата клеток) и 2 % – для синтеза АФК, который может значительно возрастать при различных патологических состояниях (рис. 3).
Уменьшение или прекращение доставки О2 к сердечной мышце может быть вызвано различными механизмами: от спазма до тотальной закупорки коронарной артерии. После восстановления коронарного кровотока поврежденные митохондрии не способны полностью утилизировать “нахлынувшее” поступление кислорода, часть которого используется другими окислительными системами клеток и сопровождается образованием повышенного количества АФК. Активность одного из мощных окислительных ферментов – ксантиноксидазы – находится на низком уровне в условиях аэробного обмена, но резко возрастает при гипоксии, кроме того – с переводом Fe3+ в Fe2+. Сочетание этих двух факторов способствует избыточному формированию АФК [8]. Избыточное образование и высвобождение свободных радикалов (АФК) активизируют перекисное окисления липидов (ПОЛ) с повреждением мембран клеток, которые состоят из фосфолипидов, холестерина и белковых включений, выполняющих роль ионных каналов или рецепторов.
Все вышеперечисленное является побудительным моментом для клиницистов при лечении и профилактике возможных осложнений в условиях ишемических эпизодов различных регионов (сердце, ЦНС): применение препаратов с антиоксидантной и антигипоксантной фармакологической направленностью, обладающих плейотропными эффектами (кардио-, нейроцитопротекция), восстановление аэробного внутриклеточного метаболизма. Типичным представителем лекарственных препаратов с подобными фармакокинетическими и фармакодинамическими качествами является Актовегина.
Актовегин – высокоочищенный гемодиализат из крови телят, полученный методом ультрафильтрации, не содержащий эндотоксинов и антигенов и состоящий из биологически активных физиологических компонентов, обладающих высокой биологической активностью: аминокислоты, олигопептиды, нуклеозиды, продукты углеводного и жирового обмена. Фармакологический состав Актовегина формируется 2-этапной ультрафильтрацией с использованием фильтров для выделения молекул разного размера. Молекулярный вес конечного отфильтрованного продукта не превышает 5000 Дальтон. Состав Актовегина был проверен современными аналитическими методиками, включая газовую жидкостную хроматографию в сочетании с масс-спектрометрией. Данные количественных методов анализа возможных метаболитов показали – Актовегин является комбинацией более чем 200 биоактивных молекул.[6, 7, 10].
Метод атомной эмиссионной спектрометрии показал наличие в Актовегине макро-электролитов (Mg, Na, Ca, P, K) и микроэлементов (Si,Cu), которые входят в простатические группы антиоксидантных ферментов (супероксиддисмутазы, глутатионпероксидазы, каталазы). Антиоксидантный эффект Актовегина обусловлен супероксиддисмутазной активностью [8]. Магний, входящий в Актовегин, – компонент кардиопептидных фрагментов и ферментов, выполняет функции каталитического центра, обеспечивающего контроль и запуск энзимобиохимических внутриклеточных процессов.
Антиишемическое действие Актовегина на клеточном уровне осуществляется за счет перевода энергообмена клеток в сторону аэробного гликолиза с торможением β-окисления жирных кислот. Актовегин®, селективно ингибируя 3-кетаоцетил-КоА-каталазы, замедляет ß-окисление жирных кислот, одновременно конкурентно восстанавливая сопряжения между гликолизом и окислительным декарбоксилированием, суммарно ведет к увеличению количества АТФ, что лежит в основе антиишемической защиты кардиомиоцитов Актовегином (рис. 4).
В экспериментальных исследованиях на клеточном уровне показано, что Актовегин® поддерживает энергетический метаболизм сердца. Кардиопротективный эффект Актовегина обусловлен его способностью поддерживать физиологический уровень креатинфосфата (основного переносчика энергии внутри клетки) и АТФ в условиях ишемии, стабилизировать pH внутри клетки (препятствует развитию внутриклеточного метаболического ацидоза), уменьшать повреждение мембраны – сарколеммы – перекисным окислением липидов, вызываемое свободными радикалами. Нормализация метаболического баланса приводит к ограничению накопления неорганического фосфата, Na и Са внутри клетки с сохранением нормальной концентрации К. Одновременно Актовегин® понижает уровень миграции и инфильтрации полинуклеарных нейтрофилов (ингибиция хемотаксиса) в ишемизированных и реперфузируемых тканях сердца, что уменьшает аутоиммунное повреждение миокарда, не оказывая влияния на центральную гемодинамику [4, 5, 9].
Оксидантный стресс вызывает поломку 1 нити ДНК, что приводит к активации ядерного фермента полимеразы поли-АДФ-рибозы (ПАРП). Избыточная активация ПАРП имеет негативные последствия в виде запуска последовательных клеточных процессов, которые в конечном итоге останавливают гликолиз и процесс митохондриального дыхания (окислительное фосфорилирование – цикл Кребса), что приводит к гибели клетки вследствие энергетического истощения и активации оксидативного стресса [8].
Дальнейшие исследования подтвердили роль метаболизма ПАРП как важного механизма в развитии дисфункции эндотелия при кардио-васкулярных патологиях, вызванных нарушением углеводного обмена, – СД, и недавно было подтверждено, что ПАРП может участвовать в развитии диабетической полинейропатии. Обобщая эти данные, можно сделать предположение о важной роли ПАРП при ИБС, цереброваскулярных заболеваниях и диабете [3, 5, 7, 8].
M.W. Elmlinger и соавт., используя клеточные культуры головного мозга (первичные нейроны гиппокампа), в своем исследовании показали ингибирующее влияние Актовегина на процессы оксидантного стресса. В нейронах, обработанных возрастающими концентрациями третбутилгидропероксида (> 0,2 мМ), было обнаружено повышение уровней внутриклеточных АФК (p < 0,001), но в случае использования Актовегина в культуре нейронов отмечено дозозависимое снижение выраженности оксидантного стресса через 10 дней (p < 0,001 при концентрациях > 0,3 мкг/мл) [8]. В исследованиях in vivo влияние Актовегина на анализируемые параметры при экспериментальной диабетической полинейропатии соответствовало результатам, полученным в данном исследовании in vitro [6, 7].
Актовегин® оказывает многоплановое действие через нормализацию потребления и использование кислорода, усиление поступления в клетки глюкозы, благодаря чему восстанавливается клеточный метаболизм [6, 9, 10]. Актовегин® усиливает окислительные процессы, сдвигая баланс окислительно- восстановительных реакций в сторону окисления, что способствует повышению содержания высокоэнергетических фосфатов, таких как АТФ и креатинфосфат. K. Schwabe показал, что Актовегин® активирует внутриклеточные окислительные процессы и ускоряет не только энергетический, но и резервный метаболизм, что в случае заболевания сердца сопровождается усиленным накоплением гликогена и калия. Эти данные стали одним из первых наблюдений, показавших прямое позитивное влияние препарата Актовегин® на метаболизм головного мозга и миокарда [5, 8].
Ранее проведенные исследования документируют – Актовегин® оказывает инсулиноподобное действие через активацию ГЛЮТ 1–4, стимулируя клеточный метаболизм, повышает потребление кислорода и выработку энергии. Одной из составных частей фракций Актовегина является Инозитол-ФосфатОлигосахарид (ИФО-фракция), который через активацию цАМФ и аденилатциклазы способствует внутриклеточной утилизации глюкозы, стимулирует эффективность потребления О2 и снижает образование лактатов.
Действие Актовегина на транспорт глюкозы в кардиомиоцит – инсулиннезависимое (не оказывает влияния на инсулиновые рецепторы), т. к. реализуется через непосредственную активацию ГЛЮТ 1–4, поэтому его эффект сохраняется даже на фоне инсулинорезистентности у больных СД 2 типа. Одновременно ИФО-фракция в синергизме с супероксиддисмутазой и магнием способствует ингибированию ПОЛ клеточных мембран (мембранстабилизирующий эффект) [4, 6–8, 10].
В ряде клинических исследований показано, что применение препарата Актовегин® положительно влияет на когнитивные функции при кардиоваскулярных энцефалопатиях, улучшает психологические и поведенческие реакции, наиболее эффективен при легких и умеренных когнитивных нарушениях [3, 6].
Благодаря разработкам и внедрению в клиническую практику новых медицинских технологий, в частности позитронной эмиссионной томографии (ПЭТ), в настоящее время существует реальная возможность количественной оценки перфузии миокарда in vivo, поглощения кислорода, утилизации глюкозы, ЖК, сократительной способности. ПЭТ позволяет неинвазивным способом изучать поглощение кислорода, метаболизм глюкозы и ЖК с расчетом количественных параметров в абсолютных значениях. В качестве естественного маркера захвата и метаболизма глюкозы при ПЭТ используется [18F]-2-флюоро-2-деоксиD-глюкоза ([18F]ФДГ) – аналог глюкозы, меченный 18-фтором, который не метаболизируется и остается в клеточном цитозоле в неизменном виде. Для количественной оценки метаболизма СЖК в миокарде человека в настоящее время в качестве естественного маркера применяется [18F]-тиа-гепта-деканоевая кислота ([18F]ТДК) – длинноцепочечная ложная ЖК, меченная 18-фтором, накопление которой свидетельствует о β-окислении СЖК в миокарде как основном источнике энергии в миокарде. Для оценки окислительного метаболизма при ПЭТ разработана модель с использованием [1-11C]-ацетат как маркера поглощения миокардом кислорода [1, 4].
На рис. 5 представлены примеры количественной оценки утилизации О2 метаболизма глюкозы (рис. 5А) и свободных жирных кислот (рис. 5Б) до и после внутривенной инфузии 1000 мг Актовегина. Актовегин способствует 3-кратному увеличению утилизации О2 с одновременным 6–7-кратным увеличением захвата глюкозы и аналогичным снижением метаболизма СЖК. Подобная динамика окислительного метаболизма свидетельствует о стимуляции Актовегином аэробного окисления – наиболее выгодного источника макроэнергофосфатов [4].
Имеются данные, что действие Актовегина на пациентов с ИБС, осложненной острой коронарной недостаточностью, многокомпонентно, помимо улучшения метаболизма миокарда позитивно влияет на реологические свойства крови: снижает агрегационную активность тромбоцитов, увеличивает подвижность эритроцитов, снижает вязкость крови (через гипогликемический эффект). Одновременно Актовегин способствует ангиогенезу – развитию коллатерального кровообращения [9].
По данным ряда авторов, применение Актовегина больными в первые сутки развития способствует восстановлению сократительной функции миокарда левого желудочка ИМ через улучшение метаболизма кардиомиоцитов, устраняет электрическую гетерогенность, что суммарно проявляется в снижении частоты осложнений и ранней госпитальной летальности [4, 5].
В наших исследованиях применение Актовегина (от 800 до 1200 мг внутривенно) в острейшей фазе ИМ 49 больными на фоне тромболизиса и стандартной терапии способствовало более эффективному предупреждению развития синдрома “реперфузии” (прогрессирование болевого синдрома, увеличение эпизодов желудочковых аритмий, распространение зоны ИМ, нарастание СН). Группа сравнения – 67 больных ОИМ, которым артифициальный тромболизис проводился без профилактического внутривенного введения Актовегина. Анализы клинического статуса и исследования насосной деятельности сердца до и после лечения по группам представлены в таблице.
Как видно из таблицы, купирование частоты реперфузионного синдрома до 18,4 % в исследуемой группе больных ОИМ по сравнению с контрольной группой больных ОИМ (67 больных ОИМ) – 34 %, было опосредовано за счет улучшения эффективной диастолы (устранение “контрактуры” ишемизированного миокарда). Все параметры потоков крови через митральный клапан, характеризующие диастолическое расслабление миокарда левого желудочка, улучшились статистически достоверно, что способствовало эффективному увеличению фракции выброса левого желудочка – интегрального показателя насосной деятельности сердца. ФВ в исследуемой группе на фоне введения Актовегина увеличилась статистически достоверно (p < 0,05) на 8,4 % (от 39,2 ± 5,5 % до 46,6 ± 2,1%) по сравнению с контрольной группой больных ОИМ (от 39,1 ± 2,9 % до 42,7 ± 3,1 %).
Более эффективное восстановление метаболизма ишемизированного миокарда на фоне введения Актовегина способствует минимизации электрической гетерогенности, что клинически манифестируется уменьшением частоты развития желудочковых нарушений ритма сердечной деятельности: в группе исследования после лечения они имели место в 22,4 % наблюдений, в группе сравнения – в 32,8 %.
Аналогичные результаты были получены и в других клинических наблюдениях [5].
Актовегин как антигипоксант и вторичный антиоксидант при его использовании в клинической практике активирует аэробное дыхание клеток, находящихся в состоянии ишемии и метаболической недостаточности, оказывает системное действие на организм (рис. 6). Основными фармакологическими действиями Актовегина являются повышение эффективности поглощения кислорода и активация транспорта глюкозы, в частности в кардиомиоците. Активация процессов аэробного окисления увеличивает энергетический потенциал миокардиальной клетки. Перечисленные эффекты Актовегина наиболее выраженно проявляются при гипоксическом статусе сердечной мышцы.
Таким образом, развитие кардиососудистых нарушений при ишемических эпизодах сопровождается совокупностью патофизиологических событий, для устранения которых необходим интегрированный фармакологический подход, а не упрощенное однонаправленное воздействие. Множественные кардио- и нейротропный эффекты предполагают одновременное модулирующее влияние на разные повреждающие патологические механизмы (воспаление, апоптоз, оксидантный стресс и многие др.).
В качестве биологического агента, обладающего плейотропными эффектами, Актовегин по своим механизмам действия (антиоксидантному, антигипоксантному) соответствует концепции об интегративном терапевтическом подходе.
В представленном обзоре и анализе собственного опыта показано – Актовегин принимает активное участие в восстановлении баланса клеточного метаболизма путем коррекции ряда патофизиологических процессов, имеющих место при развитии ИБС. Актовегин оказывает кардиопротективное действие на кардиоваскулярный функциональный блок за счет своего антиапоптотического и антиоксидантного действий, активизирует механизмы утилизации глюкозы и кислорода с нормализацией внутриклеточного энергетического баланса, способствующие улучшению насосной деятельности сердца.
Особенности лечения ишемической болезни сердца
Для купирования приступов стенокардии чаще всего используют органические нитраты: нитроглицерин, изосорбида динитрат, а также антагонист кальция нифедипин и сосудорасширяющий препарат валидол – сублингвально (под язык). При таком пути введения эффект возникает очень быстро – в течение 1-3 минут.
Для профилактики приступов стенокардии внутрь (перорально) применяют β-адреноблокаторы, антагонисты кальция, ивабрадин, изосорбида мононитрат, изосорбида динитрат, пентаэритритила тетранитрат, молсидомин, а также кардиопротекторные средства (триметазидин, мельдоний).
Препараты β-адреноблокаторов и антагонистов кальция дополнительно снижают артериальное давление (антигипертензивное действие) и нормализуют сердечный ритм (антиаритмическое действие), поэтому показаны для лечения стенокардии у пациентов с гипертонической болезнью и/или аритмией.
Амиодарон оказывает выраженное антиаритмическое действие, поэтому его применяют при стенокардии на фоне нарушений сердечного ритма – аритмий.
К препаратам органических нитратов развивается толерантность (привыкание) – снижение их эффекта при длительном применении. Во избежание толерантности при приеме органических нитратов нужно делать перерывы в несколько дней или хотя бы на ночь. В случае развития привыкания следует отдать предпочтение препарату с нитратоподобным действием – молсидомину.
Антигипоксанты и антиоксиданты в кардиологической практике
К
лючевая роль тромбоза артерий сердца в формировании острого коронарного синдрома, вплоть до развития острого инфаркта миокарда (ОИМ), в настоящее время постулирована. На смену традиционно сложившейся консервативной терапии коронарной патологии, направленной на предотвращение осложнений: опасных нарушений ритма, острой сердечной недостаточности (ОСН), ограничение зоны повреждения миокарда (путем усиления коллатерального кровотока), в клиническую практику внедрены радикальные методы лечения – реканализация ветвей коронарных артерий путем как фармакологического воздействия (тромболитические средства), так и инвазивного вмешательства – чрескожная транслюминальная балонная или лазерная ангиопластика с установкой стента(ов) или без нее.
Накопленный клинический и экспериментальный опыт указывают, что восстановление коронарного кровотока – «обоюдоострый меч», т.е. в 30% и более развивается «синдром реперфузии», манифестирующий дополнительным повреждением миокарда, вследствие неспособности энергетической системы кардиомиоцита утилизировать «нахлынувшее» поступление кислорода. В результате этого увеличивается образование свободно–радикальных, активных форм кислорода (АК), способствующих повреждению липидов мембран – перекисное окисление липидов (ПОЛ), дополнительному повреждению функционально важных белков, в частности, цитохромной дыхательной цепи и миоглобина, нуклеиновых кислот и других структур кардиомиоцитов [1,7,11]. Такова упрощенная модель постперфузионного метаболического круга развития и прогрессирования ишемического повреждения миокарда. В связи с этим в настоящее время разработаны и активно внедряются в клиническую практику фармакологические препараты противоишемической (антигипоксанты) и антиоксидной (антиоксиданты) защиты миокарда [4,8,10,12,13].
Антигипоксанты
– препараты, способствующие улучшению утилизации организмом кислорода и снижению потребности в нем органов и тканей, суммарно повышающие устойчивость к гипоксии. В настоящее время наиболее изучена антигипоксическая и антиоксидантная роль Актовегина (Nycomed) в клинической практике лечения различных ургентных состояний ССС.
Актовегин
– высокоочищенный гемодиализат, получаемый методом ультрафильтрации из крови телят, содержащий аминокислоты, олигопептиды, нуклеозиды, промежуточные продукты углеводного и жирового обмена (олигосахариды, гликолипиды), электролиты (Mg, Na, Ca, P, K), микроэлементы (Si, Cu).
Основой фармакологического действия Актовегина является улучшение транспорта, утилизации глюкозы и поглощения кислорода:
– повышается обмен высокоэнергетических фосфатов (АТФ);
– активируются ферменты окислительного фосфорилирования (пируват– и сукцинатдегидрогеназы, цитохром С–оксидаза);
– повышается активность щелочной фосфатазы, ускоряется синтез углеводов и белков;
– увеличивается приток ионов К+ в клетку, что сопровождается активацией калий–зависимых ферментов (каталаз, сахараз, глюкозидаз);
– ускоряется распад продуктов анаэробного гликолиза (лактата, b-гидроксибутирата).
Активные компоненты, входящие в состав Актовегина, оказывают инсулиноподобное действие. Олигосахариды Актовегина активируют транспорт глюкозы внутрь клетки, минуя рецепторы инсулина. Одновременно Актовегин модулирует активность внутриклеточных носителей глюкозы, что сопровождается интенсификацией липолиза. Что чрезвычайно важно – действие Актовегина инсулинонезависимое и сохраняется у пациентов с инсулинозависимым сахарным диабетом, способствует замедлению прогрессирования диабетической ангиопатии и восстановлению капиллярной сети за счет новообразования сосудов [2,9].
Улучшение микроциркуляции, которое наблюдается под действием Актовегина, видимо, связано с улучшением аэробного обмена сосудистого эндотелия, способствующего высвобождению простациклина и оксида азота (биологических вазодилататоров). Вазодилатация и снижение периферического сосудистого сопротивления являются вторичными по отношению к активации кислородного метаболизма сосудистой стенки.
Таким образом, антигипоксическое действие Актовегина суммируется через улучшение утилизации глюкозы, усвоение кислорода и снижение потребления миокардом кислорода в результате уменьшения периферического сопротивления.
Антиоксидантное действие Актовегина обусловлено наличием в этом препарате высокой супероксиддисмутазной активности, подтвержденной атомно–эмиссионной спектрометрией, наличием препаратов магния и микроэлементов, входящих в простетическую группу супероксиддисмутазы. Магний – обязательный участник синтеза клеточных пептидов, он входит в состав 13 металлопротеинов, более 300 ферментов, в том числе в состав глутатионсинтетазы, осуществляющей превращение глутамата в глутамин [9].
Накопленный клинический опыт отделений интенсивной терапии позволяет рекомендовать введение высоких доз Актовегина: от 800–1200 мг до 2–4 г. Внутривенное введение Актовегина целесообразно:
– для профилактики синдрома реперфузии у больных ОИМ, после проведения тромболитической терапии или балонной ангиопластики;
– больным при лечении различных видов шока;
– больным, переносящим остановку кровообращения и асфиксию;
– больным с тяжелой сердечной недостаточностью;
– больным с метаболическим синдромом Х.
Антиоксиданты
– блокируют активацию свободнорадикальных процессов (образование АК) и перекисного окисления липидов (ПОЛ) клеточных мембран, имеющих место при развитии ОИМ, ишемического и геморрагического инсультов, острых нарушений регионального и общего кровообращения. Их действие реализуется через восстановление свободных радикалов в стабильную молекулярную форму, не способную участвовать в цепи аутоокисления. Антиоксиданты либо непосредственно связывают свободные радикалы (прямые антиоксиданты), либо стимулируют антиоксидантную систему тканей (непрямые антиоксиданты).
Энергостим
– комбинированный препарат содержащий никотинамидадениндинуклеотид (НАД), цитохром С и инозин в соотношении: 0,5, 10 и 80 мг соответственно.
При ОИМ нарушения в системе энергетического обеспечения происходят в результате потери кардиомиоцитом НАД – кофермента дегидрогеназы гликолиза и цикла Кребса, цитохрома С – фермента цепи переноса электронов, с которым в митохондриях (Мх) сопряжен синтез АТФ через окислительное фосфорилирование. В свою очередь, выход цитохрома С из Мх ведет не только к развитию энергодефицита, но и способствует образованию свободных радикалов и прогрессированию оксидативного стресса, заканчивающихся гибелью клеток по механизму апоптоза. После внутривенного введения экзогенный НАД, проникая через сарколемму и мембраны Мх, ликвидирует дефицит цитозольного НАД, восстанавливает активность НАД–зависимых дегидрогеназ, участвующих в синтезе АТФ гликолитическим путем, способствует интенсификации транспорта цитозольного протона и электронов в дыхательной цепи Мх. В свою очередь, экзогенный цитохром С в Мх нормализует перенос электронов и протонов к цитохромоксидазе, что суммарно стимулирует АТФ–синтезирующую функцию окислительного фосфорилирования Мх. Однако ликвидация дефицита НАД и цитохрома С не нормализует полностью «конвейер» синтеза АТФ кардиомиоцита, так как не оказывает существенного влияния на содержание отдельных компонентов адениловых нуклеотидов, участвующих в дыхательной цепи клеток. Восстановление общего содержания адениловых нуклеотидов имеет место при введении инозина – метаболита, стимулирующего синтез адениловых нуклеотидов. Одновременно инозин усиливает коронарный кровоток, способствует доставке и утилизации кислорода в области микроциркуляции.
Таким образом, целесообразно комбинированное введение НАД, цитохрома С и инозина
для эффективного воздействия на метаболические процессы в кардиомиоцитах, подвергнутых ишемическому стрессу.
Энергостим по механизму фармакологического воздействия на клеточный метаболизм имеет комбинированное влияние на органы и ткани: антоксидантное и антигипоксическое. За счет композитного состава Энергостим, по данным различных авторов, по эффективности лечения ИМ в составе традиционного лечения во много раз превосходит действие других признанных в мире антигипоксантов: в 2–2,5 раза оксибутират лития, рибоксин (инозин) и амитазол, в 3–4 раза – карнитин (милдронат), пирацетам, олифен и солкосерил, в 5–6 раз – цитохром С, асписол, убихинон и триметазидин [1,11]. Рекомендуемые дозы Энергостима в комплексной терапии ИМ: 110 мг (1 флакон) в 100 мл 5% глюкозы 2–3 раза в день в течение 4–5 дней. Все изложенное выше позволяет считать Энергостим препаратом выбора в комплексной терапии ИМ, для профилактики осложнений, являющихся следствием метаболических нарушений в кардиомиоцитах [1,3].
Коэнзим Q10
– витаминоподобное вещество, впервые было выделено в 1957 г. из митохондрий бычьего сердца американским ученым Ф. Крейном. К. Фолкерс в 1958 г. определил его структуру. Вторым официальным названием коэнзима Q10 является убихинон (вездесущий хинон), так как он содержится в различных концентрациях практически во всех тканях животного происхождения. В 60–х годах была показана роль Q10, как электронного переносчика в дыхательной цепи Мх. В 1978 г. П. Митчел предложил схему, объясняющую участие коэнзима Q10 как в электронном транспорте в митохондриях, так и в сопряжении процессов электронного транспорта и окислительного фосфорилирования, за что получил Нобелевскую премию [8].
Коэнзим Q10 эффективно защищает липиды биологических мембран и липопротеидные частицы крови (фосфолипиды – «мембранный клей») от разрушительных процессов перекисного окисления, предохраняет ДНК и белки организма от окислительной модификации в результате накопления активных форм кислорода (АК). Коэнзим Q10 синтезируется в организме из аминокислоты – тирозин при участии витаминов группы Ви С, фолиевой и пантотеновой кислот, ряда микроэлементов. С возрастом биосинтез коэнзима Q10 прогрессивно снижается, а его расход при физических, эмоциональных нагрузках, в патогенезе различных заболеваний и окислительном стрессе возрастает [5].
Более чем 20–летний опыт клинических исследований применения коэнзима Q10 у тысяч больных убедительно доказывают роль его дефицита в патологии ССС, что не удивительно, так как именно в клетках сердечной мышцы наиболее велики энергетические потребности. Защитная роль коэнзима Q10 обусловлена его участием в процессах энергетического метаболизма кардиомиоцита и антиоксидантными свойствами. Уникальность обсуждаемого препарата – в его регенеративной способности под действием ферментных систем организма. Это отличает коэнзим Q10 от других антиоксидантов, которые, выполняя свою функцию, необратимо окисляются сами, требуя дополнительного введения [6].
Первый положительный клинический опыт в кардиологии по применению коэнзима Q10 был получен при лечении больных с дилатационной кардиомиопатией и пролапсом митрального клапана: были получены убедительные данные в улучшении диастолической функции миокарда. Диастолическая функция кардиомиоцита – энергоемкий процесс и при различных патологических состояниях ССС потребляет до 50% и более всей энергии, содержащейся в АТФ, синтезируемого в клетке, что определяет ее сильную зависимость от уровня коэнзима Q10.
Клинические исследования последних десятилетий показали терапевтическую эффективность коэнзима Q10 в комплексном лечении ИБС
, артериальной гипертонии, атеросклероза и синдрома хронической усталости. Накопленный клинический опыт позволяет рекомендовать применение Q10 не только в качестве эффективного препарата в комплексной терапии СС заболеваний, но и как средство их профилактики.
Профилактическая доза Q10 для взрослых – 15 мг/сутки, лечебные дозы 30–150 мг/сутки, а в случаях интенсивной терапии – до 300–500 мг/сутки. Следует принять во внимание, что высокие лечебные дозы при оральном приеме коэнзима Q10 связаны с трудностью усвоения жирорастворимых веществ, поэтому в настоящее время для улучшения биодоступности создана водорастворимая форма убихинона.
Экспериментальные исследования показали профилактический и лечебный эффект коэнзима Q10 при реперфузионном синдроме, документируемые сохранением субклеточных структур кардиомиоцитов, подвергнутых ишемическому стрессу, и функции окислительного фосфорилирования Мх [5,6].
Клинический опыт применения коэнзима Q10 пока ограничен лечением детей с хроническими тахиаритмиями, синдромом удлиненного интервала QT, кардиомиопатиями, синдромом слабости синусового узла [14].
Таким образом, четкое представление о патофизиологических механизмах повреждения клеток тканей и органов, подвергнутых ишемическому стрессу, в основе которых лежат метаболические нарушения – перекисное окисление липидов, имеющих место при различных СС заболеваниях, диктуют необходимость включения антиоксидантов и антигипоксантов в комплексную терапию ургентных состояний.
Литература:
1. Андриадзе Н.А., Сукоян Г.В., Отаришвили Н.О и др. Антигипоксант прямого действия энергостим в лечении ОИМ. Росс. Мед. Вести,2001,№2, 31–42.
2. Бояринов А.П., Пенкнович А.А., Мухина Н.В. Метаболические эффекты нейротропного действия актовегина в условиях гипоксии. Актовегин. Новые аспекты клинического применения. М., 2002, 10–14.
3. Джанашия П.Х., Проценко Е.А., Сороколетов С.М. Энергостим в лечении хронических форм ИБС. Росс. Кард. Ж., 1988,№5, 14–19.
4. Закирова А.Н. Корреляционные связи перикисного окисления липидов, антиоксидантной защиты и микрореологических нарушений в развитии ИБС. Тер.архив, 1966,№3, 37–40.
5. Капелько В.И., Рууге Э.К. Исследование действия коэнзима Q10 (убихинона) при ишемии и реперфузии сердца. Применение антиоксидантного препарата кудесан (коэнзим Q 10 с витамином Е) в кардиологии. М., 2002. 8–14.
6. Капелько В.И., Рууге Э.К. Исследования действия Кудесана при повреждении сердечной мышцы, вызванной стрессом. Применение антиоксидантного препарата кудесан (коэнзим Q10 c витамином Е) в кардиологии. М., 2002, 15–22.
7. Коган А.Х., Кудрин А.Н., Кактурский Л.В. и др. Свободнорадикальные перикисные механизмы патогенеза ишемии и ИМ и их фармакологическая регуляция. Патофизиология, 1992, №2, 5–15.
8. Коровина Н.А., Рууге Э.К. Использование коэнзима Q10 в профилактике и лечении. Применение антиоксидантного препарата кудесан (коэнзим Q10 с витамином Е) в кардиологии. М.,2002, 3–7.
9. Нордвик Б. Механизм действия и клиническое применение препарата актовегина. Актовегин. Новые аспекты клинического применения. М., 2002, 18–24.
10. Румянцева С.А. Фармакологическая характеристика и механизм действия актовегина. Актовегин. Новые аспекты клинического применения . М.,2002, 3–9.
11. Слепнева Л.В. Алексеева Н.И., Кривцова И.М. Острая ишемия органов и ранние постишемические расстройства. М., 1978, 468–469.
12. Смирнов А.В., Криворучка Б.И. Антигипоксанты в неотложной медицине. Анест. И реаниматол., 1998, №2, 50–57.
13. Шабалин А.В., Никитин Ю.П. Защита кардиомиоцита. Современное состояние и перспективы. Кардиология, 1999, №3, 4–10.
14. Школьникова М.А. Отчет Ассоциации детских кардиологов России по применению Кудесана. Применение антиоксидантного препарата кудесан (коэнзим Q10 с витамином Е) в кардиологии. М., 2002, 23.