Септический шок — это системная патологическая реакция на тяжелую инфекцию. Ее характеризуют лихорадка, тахикардия, тахипноэ, лейкоцитоз при идентификации очага первичной инфекции. При этом микробиологическое исследование крови нередко выявляет бактериемию. У части пациентов с синдромом сепсиса бактериемии не выявляют. Когда составляющими синдрома сепсиса становятся артериальная гипотензия и множественная системная недостаточность, то констатируют развитие септического шока.
Виды шока
| Гиповолемический | Кардиогенный | Перераспределительный |
1. Потеря крови:
2. Потеря плазмы:
3. Потеря жидкости:
| 1. Острый инфаркт миокарда (истинный кардиогенный). 2. Нарушения сердечного ритма. 3. Тромбоэмболия легочной артерии (обструкционный) 4. Тампонада сердца | 1. Анафилактический шок. 2. Септический шок (инфекционно-токсический). 3. Спинальный шок (нейрогенный) |
Симптомы
Симптомы шока:
- снижение кровяного давление (может полностью отсутствовать);
- учащение пульса или наоборот, пульс может становится «мягким», слабым и «нитевидным»;
- учащение дыхания;
- резкая слабость;
- бледность кожных покровов;
- кожа может становится бледно-синеватой или бледно-желтой;
- отсутствие мочи;
- отсутствие реакции на боль;
- потеря сознания.
Не всегда данное состояние заканчивается смертью. Шок может развиваться в течение пары минут, часов. Чем раньше данное состояние будет диагностировано, тем больше вероятность спасти жизнь человеку.
Основные симптомы шока:
- Холодная, бледная, влажная кожа.
- Симптом “белого пятна” – замедленное наполнение капилляров кожи после их сдавления (более 2 секунд).
- Тахикардия.
- Вначале возбуждение, потом заторможенность.
- Снижение систолического артериального давления менее 100 мм рт.ст.
- Уменьшение пульсового давления менее 20 мм рт.ст.
- Снижение диуреза (олиго- или анурия).
Шок любой этиологии характеризуется фазностью развития расстройств периферического кровообращения, однако, последовательность развития фаз прослеживается не всегда. Проводимая терапия зависит от вида шока и основной причины.
В детском возрасте наиболее часто оказание неотложной помощи врачом-педиатром требуется при перераспределительном шоке (инфекционно-токсическом и анафилактическом).
Неотложные мероприятия
- Необходимо, прежде всего, остановить артериальное кровотечение прижатием артерии к кости выше места травмы, наложением артериального жгута или закрутки выше места ранения. При этом следует зафиксировать время, когда был наложен жгут.
- Оценить состояние жизнеспособности организма (определить наличие и характер пульса над периферическими и центральными артериями, степень угнетения сознания, проходимость дыхательных путей, эффективность функции внешнего дыхания).
- Обеспечить правильное положение тела пострадавшего. В бессознательном состоянии его следует повернуть на бок, запрокинуть голову назад и несколько опустить верхнюю половину туловища. Отдельного положения требуют больные с переломами позвоночника (на твердой поверхности) и костей таза (с согнутыми в суставах и разведенными ногами). Противопоказано закидывать голову больным с травмой шейного отдела позвоночника!
- Обеспечить иммобилизацию травмированных конечностей стандартными шинами или подручным материалом.
- Наложить на рану повязку. При венозном или капиллярном кровотечении сжимающая повязка действует кровоостанавливающе. При открытом пневмотораксе лейкопластырная повязка герметизирует грудную клетку.
- Обезболить больного. Используют наркотические и ненаркотические анальгетики (1% раствор промедола, 50% раствор анальгина).
У больных с декомпенсированным шоком наркотические анальгетики могут подавить дыхательный центр. Кроме того, исключение стимулирующего влияния боли снижает активность надпочечников, у больных с дефицитом ОЦК может привести к угрожающей гипотензии. Высокая вероятность этих осложнений требует непрерывного наблюдения за больными. При невозможности обеспечения такого надзора (например, при массовом поступлении пострадавших, их транспортировке) с целью обезболивания целесообразно применить средник для неингаляционного наркоза — кетамин (по 2-3 мл 5% раствора, вводить внутримышечно). Он проявляет обезболивающий эффект, стабилизирует артериальное давление и не подавляет дыхательный центр. Для предупреждения нежелательного галлюцинаторного действия кетамина его целесообразно сочетать с введением 1-2 мл 0,5% раствора сибазона.
В места переломов вводят по 10 — 20 мл 0,5% раствора новокаина. В составе специализированной бригады медицинская сестра осуществляет венопункцию и катетеризуют периферические сосуды, помогает врачу при катетеризации артерий и магистральных вен, готовит системы для внутривенных вливаний, измеряет артериальное и центральное венозное давление, записывает электрокардиограмму, проводит оксигенотерапию и искусственную вентиляцию легких пострадавшему и т.д.
Инфекционно-токсический шок
Инфекционно-токсический шок может возникнуть у больных с менингококковой инфекцией, особенно часто при молниеносной форме менингококцемии, стафилококковом и грибковом сепсисах, а также при других острых инфекционных заболеваниях с тяжелым течением (дифтерия, скарлатина и другие).
Стадии инфекционно-токсического шока:
I (компенсированная) — гипертермия, сознание сохранено, возможно возбуждение или беспокойство ребенка, тахипноэ, тахикардия, АД нормальное.
II (субкомпенсированная) — температура тела субфебрильная или нормальная, заторможенность, оглушенность, вялость, выраженные тахипноэ и тахикардия, систолическое артериальное давление снижается на 30-50% от исходного возрастного уровня, положительный симптом «белого пятна», снижение диуреза до 25-10 мл/час.
III (декомпенсированная) – гипотермия, заторможенность вплоть до прострации, резкая тахикардия, резкое тахипноэ, распространенный цианоз кожи и слизистых, олигурия менее 10 мл/час или анурия, падение АД до критического, пульс определяется только на крупных сосудах, положительный симптом «белого пятна». В дальнейшем развивается клиника агонального состояния.
На догоспитальном этапе объем неотложной помощи больным ИТШ зависит от причины и стадии шока и направлен на борьбу с жизнеугрожающими синдромами – гипертермическим, судорожным и т.д.
Неотложная помощь:
- при гипертермии — ввести 50% раствор метамизола (анальгина) в комбинации с 1% раствором дифенгидрамина (димедрола) в дозе 0,1-0,15 мл на год жизни в/мышечно;
- при выраженном психомоторном возбуждении и судорогах — ввести 0,5% раствор диазепама в разовой дозе 0,1 мл/кг массы тела (не более 2 мл на введение) в/венно или в/мышечно;
- при ИТШ, развившемся на фоне менингококкемии, ввести хлорамфеникол (левомицетина сукцинат) в дозе 30 мг/кг в/мышечно;
- при отеке головного мозга — ввести 1% раствор фуросемида (лазикса) из расчета 1-2 мг/кг в/ мышечно (только при систолическом АД не ниже 100 мм рт.ст.) или 25% р-р магния сульфата 1,0 мл на год жизни;
- при ИТШ I стадии — ввести преднизолон из расчета 3-5 мг/кг в/мышечно;
- при ИТШ II стадии:
- кислородотерапия;
- обеспечить доступ к вене;
- ввести преднизолон 5-10 мг/кг массы тела в/венно, при отсутствии эффекта и невозможности транспортировки больного в течение 30-40 мин. — повторное введение преднизолона в тех же дозах;
- в/венное введение кристаллоидных (0,9% р-р натрия хлорида) и коллоидных растворов (реополиглюкин, полиглюкин, 5% альбумин) до нормализации АД (до 15 мл/кг массы тела);
- при ИТШ III стадии:
- кислородотерапия;
- обеспечить доступ к вене (желательно к двум);
- ввести преднизолон 10 мг/кг массы тела в/венно, при отсутствии эффекта — повторное введение в тех же дозах через 30-40 мин;
- ввести в/в струйно 0,9% раствор хлорида натрия в разовой дозе 20 мл/кг до появления отчетливого пульса на лучевой артерии, при отсутствии эффекта повторное болюсное введение в прежней дозе через15-20 мин.
Госпитализация — в ОИТР стационара.
Причины и патогенез развития септического шока:
Частота сепсиса и септического шока неуклонно возрастает с тридцатых годов прошлого века и, по-видимому, будет продолжать возрастать. Тому причинами являются:
1. Все более широкое использование для интенсивной терапии инвазивных устройств, то есть внутрисосудистых катетеров и др.
2. Распространенное применение цитотоксических и иммуносупрессивных средств (при злокачественных заболеваниях и трансплантациях), которые вызывают приобретенный иммунодефицит.
3. Рост продолжительности жизни больных сахарным диабетом и злокачественными опухолями, у которых высок уровень предрасположенности к сепсису.
Бактериальная инфекция — это наиболее частая, причина септического шока. При сепсисе первичные очаги инфекции чаще локализованы в легких, органах живота, брюшине, а также в мочевыводящих путях. Бактериемию выявляют у 40-60% больных в состоянии септического шока. У 10-30% больных в состоянии септического шока невозможно выделить культуру бактерий, действие которых вызывает септический шок. Можно предположить, что септический шок без бактериемии — это результат патологической иммунной реакции в ответ на стимуляцию антигенами бактериального происхождения. По-видимому, данная реакция сохраняется после элиминации из организма патогенных бактерий действием антибиотиков и других элементов терапии, то есть происходит ее эндогенизация. В основе эндогенизации сепсиса могут лежать многочисленные, усиливающие друг друга и реализуемые через выброс и действие цитокинов, взаимодействия клеток и молекул систем врожденного иммунитета и, соответственно, иммуно-компетентных клеток.
Сепсис, системная воспалительная реакция и септический шок — это следствия избыточной реакции на стимуляцию бактериальными антигенами клеток, осуществляющих реакции врожденного иммунитета. Избыточная реакция клеток систем врожденного иммунитета и вторичная по отношению к ней реакция Т-лимфоцитов и В-клеток вызывают гиперцитокинемию. Гиперцитокинемия — это патологический рост содержания в крови агентов ауто- паракриннои регуляции клеток, осуществляющих реакции врожденного иммунитета и приобретенные иммунные реакции.
При гиперцитокинемии в сыворотке крови аномально возрастает содержание первичных провоспалительных цитокинов, фактора некроза опухолей-альфа и интерлейкина-1. В результате гиперцитокинемии и системной трансформации нейтрофилов, эндотелиальных клеток, мононуклеарных фагоцитов и тучных клеток в клеточные эффекторы воспаления во многих органах и тканях возникает лишенный защитного значения воспалительный процесс. Воспаление сопровождается альтерацией структурно-функциональных элементов органов-эффекторов.
Критический дефицит эффекторов обуславливает множественную системную недостаточность.
Менингококковая инфекция
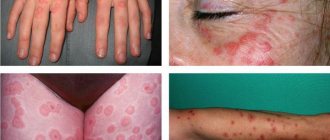
Менингококцемия – одна из форм генерализованной менингококковой инфекции, характеризующаяся острым началом с подъемом температуры тела до фебрильных цифр, общей интоксикацией, кожными геморрагическими высыпаниями, развитием инфекционно-токсического шока.
Клинические проявления менингококковой инфекции:
- Часто острое начало или резкое ухудшение на фоне назофарингита.
- Высокая, стойкая лихорадка с признаками нарушения периферического кровообращения. Ранними признаками молниеносного токсического точения менингококковой инфекции может быть “двугорбый” характер температурной кривой – первое повышение температуры тела до 38,5ºС снижается при помощи жаропонижающих средств, второе (через 9-18 час) — до 39,5-40ºС без эффекта от антипиретиков.
- Геморрагическая сыпь, появляющаяся через несколько часов или на 1-2 сутки после появления лихорадки. Характерная локализация сыпи – наружная поверхность бедер и голени, ягодицы, стопы, кисти, низ живота. Нередко геморрагической сыпи предшествует или сочетается с ней полиморфно-розеолезная или розеолезно-папулезная с той же локализацией, реже – на лице.
- Общемозговая симптоматика: интенсивная головная боль, «мозговая рвота», возможны нарушения сознания, бред, галлюцинации, психомоторное возбуждение, судороги.
- Менингеальный синдром. Обычно присоединяется позднее, на фоне развернутой симптоматики менингококцемии.
Угрожающими синдромами при генерализованных формах менингококковой инфекции являются:
- инфекционно-токсический шок развивается при сверхостром течении менингококцемии. Как правило, симптомы шока возникают одновременно либо после появления геморрагической сыпи. Однако ИТШ может возникать и без высыпаний, поэтому всем детям с инфекционным токсикозом необходимо проводить измерение АД;
- отек головного мозга с дислокацией ствола. Проявляется нарушением сознания, гипертермей, выраженными менингеальными симптомами (в терминальной стадии болезни иногда их отсутствие), судорожным синдромом и необычными изменениями со стороны гемодинамики в виде относительной брадикардии и наклонности к повышению артериального давления. В терминальной стадии отека мозга — абсолютная брадикардия и аритмия дыхания.
Неотложная помощь:
- Обеспечить проходимость верхних дыхательных путей, оксигенотерапия.
- Ввести хлорамфеникол (левомицетина сукцинат) в дозе 25-30 мг/кг в/мышечно.
- В/венное (при невозможности — в/мышечное) введение глюкокортикоидов в пересчете на преднизолон 5-10 мг/кг или дексаметазона 0,6-0,7 мг/кг массы; при отсутствии эффекта и невозможности транспортировки больного необходимо провести повторное введение гормонов в тех же дозах (при ИТШ III стадии доза кортикостероидов может увеличиваться в 2-5 раз).
- Ввести 50% раствор метамизола (анальгина) 0,1 мл/год жизни в/мышечно + 1% р-р дифенгидрамина (димедрола) в дозе 0,1-0,15 мл на год жизни в/мышечно (или 2 % р-р супрастина – 2 мг/кг в/мышечно ) + 2% р-ра папаверина 0,1 мл/год жизни ).
- При возбуждении, судорожном синдроме — 0,5% р-р диазепама в разовой дозе 0,1 мл/кг массы тела (не более 2 мл на введение) в/венно или в/мышечно, при не купирующихся судорогах повторно в той же дозе.
- При выраженном менингеальном синдроме – в/мышечное введение 1% раствор фуросемида из расчета 1-2 мг/кг в/мышечно или 25% р-р магния сульфата 1,0 мл/год жизни в/мышечно.
Вызов реанимационной бригады на себя!!! Госпитализация в ОИТР ближайшего стационара. При подозрении на менингококковую инфекцию показана госпитализация.
Кишечный токсикоз с эксикозом — патологическое состояние, являющееся осложнением острых кишечных инфекций (ОКИ) вследствие воздействия на организм токсических продуктов и значительных потерь жидкости, что приводит к нарушению гемодинамики, водно-электролитного обмена, кислотно-основного резерва, развитию вторичной эндогенной интоксикации.
В патогенезе токсикоза с эксикозом ведущую роль играет дегидратация, которая приводит к дефициту объема вне- (а в тяжелых случаях и внутри-) клеточной жидкости и объема циркулирующей крови. Степень эксикоза (дегидратации) обуславливает выбор терапевтической тактики и влияет на прогноз.
Степени тяжести дегидратации
| Признаки | Степени дегидратации | |||
| I степень | II степень* | III степень | ||
| Дефицит массы тела | До 5 % | 6-9 % | Более 10 % | |
| Дефицит ОЦК | Более 10 % | 11-20 % | Более 20 % | |
| Общее состояние | Хорошее | Возбуждение | Вялое, летаргическое, бессознательное | |
| Стул | Нечастый (4-6 раз в сутки) | До 10 раз в сутки | Частый (более 10 раз в сутки), водянистый | |
| Рвота | Однократная | Повторная (3-4 раза в сутки) | Многократная | |
| Жажда | Умеренная | Резко выраженная | Отказ от питья | |
| Кожная складка | Расправляется быстро | Расправляется медленно ( ≤2 сек) | Расправляется очень медленно (>2 сек) | |
| Слизистые оболочки | Влажные или слегка суховаты | Сухие | Очень сухие, яркие | |
| Цианоз | ||||
| Глазные яблоки | Без особенностей | Мягкие | Западают | |
| Голос | Без особенностей | Ослаблен | Афония | |
| Тоны сердца | Громкие | Слегка приглушены | Глухие | |
| ЧСС | Норма | Умеренная тахикардия | Выраженная тахикардия | |
| Диурез | Сохранен | Снижен | Значительно снижен | |
| Электролиты плазмы крови | Норма | Гипокалиемия | Гипокалиемия | |
| КОС | Норма | Компенсированный ацидоз | Декомпенсированный ацидоз | |
| Метод регидратации | Оральная | Парентеральная | ||
- II степень эксикоза подразделяют на IIА и IIБ (с потерей массы тела 6-7% и 8-9% соответственно).
Мероприятия при дегидратации
Приступая к регидратации детей с эксикозом, необходимо определить, каким путем (орально и/или парентерально) и какой объем жидкости нужно ввести ребенку, с какой скоростью вводить, какими растворами пользоваться. Пероральная регидратация — проводится при эксикозе I, IIА степени, парентеральная – при эксикозе IIБ и III степени.
Амбулаторное лечение возможно (при отсутствии других противопоказаний, см. ниже) при эксикозе I степени с проведением оральной регидратации.
Пероральная регидратационная терапия
Показания: эксикоз I, IIА степени.
- Необходимые растворы — глюкозо-солевые (регидрон, оралит, гастролит, глюкосалан). У детей до 3-х лет глюкозо-солевые растворы целесообразно сочетать с бессолевыми (чай, вода, рисовый отвар и др.) в соотношении 1:1 – при выраженной водянистой диарее, 2:1 – при потере жидкости преимущественно со рвотой, 1:2 – при потере жидкости с перспирацией. Введение солевых и бессолевых растворов чередуется.
Количество жидкости на каждый час введения — дробно по ½ чайной — 1 столовой ложке (в зависимости от возраста) через каждые 5-10 мин. При наличии рвоты регидратация не прекращается, но прерывается на 5-10 мин., а затем вновь продолжается.
Особенности введения растворов на 1-м этапе (первые 6 часов от начала лечения):
- при дегидратации I степени: 50 мл/кг за 6 час. + 10 мл/кг м.т. после каждого жидкого стула или рвоты;
- при дегидратации IIА степени: 80 мл/кг за 6 час + 10 мл/кг м.т. после каждого жидкого стула или рвоты.
На 2-м этапе проводится поддерживающая терапия в количестве продолжающихся потерь жидкости, вводимой на этом этапе (80-100 мл/кг в сутки до прекращения потерь).
Шок. Этиология. Патогенез. Классификация
Термин «шок», обозначающее в английском и французском языке удар, толчок, потрясение, было случайно введено в 1743 году безвестным теперь переводчиком на английский язык книги консультанта армии Людовика XV Le Dran для описания состояния пациентов после огнестрельной травмы. До настоящего времени данный термин широко употребляется для описания эмоционального состояния человека при воздействии на него неожиданных, чрезвычайно сильных психических факторов не подразумевая специфических повреждений органов или физиологических нарушений. Применительно к клинической медицине, шок означает критическое состояние, которое характеризуется резким снижением перфузии органов, гипоксией и нарушением метаболизма. Этот синдром проявляется артериальной гипотензией, ацидозом и быстро прогрессирующим ухудшением функций жизненно важных систем организма. Без адекватного лечения шок быстро приводит к смерти.
Острые кратковременные нарушения гемодинамики могут быть преходящим эпизодом при нарушении сосудистого тонуса, рефлекторно вызванного внезапной болью, испугом, видом крови, духотой или перегревом, а также при сердечной аритмии или ортостатической гипотензии на фоне анемии или гипотонии. Такой эпизод носит название коллапса и в большинстве случаев купируется самостоятельно без лечения. Из-за преходящего снижения кровоснабжения мозга может развиться обморок – кратковременная потеря сознания, которой часто предшествуют нейро-вегетативные симптомы: мышечная слабость, потливость, головокружение, тошнота, потемнение в глазах и шум в ушах. Характерны бледность, низкое АД, бради- или тахикардия. То же самое может развиться у здоровых людей при высокой температуре окружающей среды, поскольку тепловой стресс ведет к значительному расширению кожных сосудов и снижению диастолического АД. Более продолжительные расстройства гемодинамики всегда представляют опасность для организма.
Причины шока
Шок возникает при действии на организм сверхсильных раздражителей и может развиться при различных заболеваниях, повреждениях и патологических состояниях. В зависимости от причины различают геморрагический, травматический, ожоговый, кардиогенный, септический, анафилактический, гемотрансфузионный, нейрогенный и другие виды шока. Могут быть и смешанные формы шока, вызванные сочетанием нескольких причин. С учетом патогенеза происходящих в организме изменений и требующих определенных специфических лечебных мероприятий выделяют четыре основных вида шока
Гиповолемический шок возникает при значительном снижении ОЦК в результате массивного кровотечения или дегидратации и проявляется резким снижением венозного возврата крови к сердцу и выраженной периферической вазоконстрикцией.
Кардиогенный шок возникает при резком снижении сердечного выброса вследствие нарушения сократимости миокарда или острых морфологических изменениях клапанов сердца и межжелудочковой перегородки. Развивается при нормальном ОЦК и проявляется переполнением венозного русла и малого круга кровообращения.
Перераспределительный шок проявляется вазодилятацией, снижением общего периферического сопротивления, венозного возврата крови к сердцу и повышением проницаемости капиллярной стенки.
Экстракардиальный обструктивный шок возникает вследствие внезапного возникновения препятствия кровотоку. Сердечный выброс резко падает несмотря на номальные ОЦК, сократимость миокарда и тонус сосудов.
Патогенез шока
В основе шока лежат генерализованные нарушения перфузии, приводящие к гипоксии органов и тканей и расстройствам клеточного метаболизма (рис. 15. 2. ). Системные нарушения кровообращения являются следствием снижения сердечного выброса (СВ) и изменения сосудистого сопротивления.
Первичными физиологическими нарушениями, уменьшающими эффективную перфузию тканей служат гиповолемия, сердечная недостаточность, нарушение тонуса сосудов и обструкция крупных сосудов. При остром развитии этих состояний в организме развивается «медиаторная буря» с активацией нейро-гуморальных систем, выбросом в системную циркуляцию больших количеств гормонов и провоспалительных цитокинов, влияющих на сосудистый тонус, проницаемость сосудистой стенки и СВ. При этом резко нарушается перфузия органов и тканей. Острые расстройства гемодинамики тяжелой степени, независимо от причин, вызвавших их, приводят к однотипной патологической картине. Развиваются серьезные нарушения центральной гемодинамики, капиллярного кровообращения и критическое нарушение тканевой перфузии с тканевой гипоксией, повреждением клеток и органными дисфункциями.
Нарушения гемодинамики
Низкий СВ — ранняя особенность многих видов шока, кроме перераспределительного шока, при котором в начальных стадиях минутный объем сердца может быть даже увеличен. СВ зависит от силы и частоты сокращений миокарда, венозного возврата крови (преднагрузка) и периферического сосудистого сопротивления (постнагрузка). Основными причинами снижения СВ при шоке бывают гиповолемия, ухудшение насосной функции сердца и повышение тонуса артериол. Физиологическая характеристика различных видов шока представлена в табл. 15. 2.
В ответ на снижение АД усиливается активация адаптационных систем. Сначала происходит рефлекторная активация симпатической нервной системы, а затем усиливается и синтез катехоламинов в надпочечниках. Содержание норадреналина в плазме возрастает в 5-10 раз, а уровень адреналина повышается в 50-100 раз. Это усиливает сократительную функцию миокарда, учащает сердечную деятельность и вызывает селективное сужение периферического и висцерального венозного и артериального русла. Последующая активация ренин-ангиотензинового механизма приводит к еще более выраженной вазоконстрикции и выбросу альдостерона, задерживающего соль и воду. Выделение антидиуретического гормона уменьшает объем мочи и увеличивает ее концентрацию.
При шоке периферический ангиоспазм развивается неравномерно и особенно выражен в коже, органах брюшной полости и почках, где происходит наиболее выраженное снижение кровотока. Бледная и прохладная кожа, наблюдаемая при осмотре, и побледнение кишки с ослабленным пульсом в брыжеечных сосудах, видимые во время операции, — явные признаки периферического ангиоспазма.
Сужение сосудов сердца и мозга происходит гораздо в меньшей степени по сравнению с другими зонами, и эти органы дольше других обеспечиваются кровью за счет резкого ограничения кровоснабжения других органов и тканей. Уровни метаболизма сердца и мозга высоки, а их запасы энергетических субстратов крайне низки, поэтому эти органы не переносят длительную ишемию. На обеспечение немедленных потребностей жизненно важных органов — мозга и сердца и направлена в первую очередь нейроэндокринная компенсации пациента при шоке. Достаточный кровоток в этих органах поддерживается дополнительными ауторегуляторными механизмами, до тех пор, пока артериальное давление превышает 70 мм рт. ст.
Централизация кровообращения – биологически целесообразная компенсаторная реакция. В начальный период она спасает жизнь больному. Важно помнить, что первоначальные шоковые реакции – это реакции адаптации организма, направленные на выживание в критических условиях, но переходя определенный предел, они начинают носить патологический характер, приводя к необратимым повреждениям тканей и органов. Централизация кровообращения, сохраняющаяся в течение нескольких часов, наряду с защитой мозга и сердца таит в себе смертельную опасность, хотя и более отдаленную. Эта опасность заключается в ухудшении микроциркуляции, гипоксии и нарушении метаболизма в органах и тканях.
Коррекция нарушений центральной гемодинамики при шоке включает в себя интенсивную инфузионную терапию, направленную на увеличение ОЦК, использование препаратов влияющих на тонус сосудов и сократительную способность миокарда. Лишь при кардиогенном шоке массивная инфузионная терапия противопоказана.
Нарушения микроциркуляции и перфузии тканей
Микроциркуляторное русло (артериолы, капилляры и венулы) является самым важным звеном системы кровообращения в патофизиологии шока. Именно на этом уровне происходит доставка к органам и тканям питательных веществ и кислорода, а также происходит удаление продуктов метаболизма.
Развивающийся спазм артериол и прекапиллярных сфинктеров при шоке приводит к значительному уменьшению количества функционирующих капилляров и замедлению скорости кровотока в перфузируемых капиллярах, ишемии и гипоксии тканей. Дальнейшее ухудшение перфузии тканей может быть связано с вторичной капиллярной патологией. Накопление ионов водорода, лактата и других продуктов анаэробного обмена веществ приводит к снижению тонуса артериол и прекапиллярных сфинктеров и еще большему снижению системного АД. При этом венулы остаются суженными. В данных условиях капилляры переполняются кровью, а альбумин и жидкая часть крови интенсивно покидают сосудистое русло через поры в стенках капилляров («синдром капиллярной утечки»). Сгущение крови в микроциркуляторном русле приводит к возрастанию вязкости крови, при этом увеличивается адгезия активированных лейкоцитов к эндотелиальным клеткам, эритроциты и другие форменные элементы крови слипаются между собой и образуют крупные агрегаты, своеобразные пробки, которые еще больше ухудшают микроциркуляцию вплоть до развития сладж-синдрома.
Сосуды, блокированные скоплением форменных элементов крови, выключаются из кровотока. Развивается так называемое “патологическое депонирование”, которое еще больше снижает ОЦК и ее кислородную емкость и уменьшает венозный возврат крови к сердцу и как следствие вызывает падение СВ и дальнейшее ухудшение перфузии тканей. Ацидоз, кроме того, снижает чувствительность сосудов к катехоламинам, препятствуя их сосудосуживающему действию и приводит к атонии венул. Таким образом, замыкается порочный круг. Изменение соотношения тонуса прекапиллярных сфинктеров и венул считается решающим фактором в развитии необратимой фазы шока.
Неизбежным следствием замедления капиллярного кровотока является развитие и гиперкоагуляционного синдрома. Это приводит к диссеминированному внутрисосудистому тромбообразованию, что не только усиливает расстройства капиллярного кровоообращения, но и вызывает развитие фокальных некрозов и полиорганной недостаточности.
Ишемическое поражение жизненно важных тканей последовательно приводит к вторичным повреждениям, которые поддерживают и усугубляют шоковое состояние. Возникающий порочный круг способен привести к фатальному исходу.
Клинические проявления нарушения тканевой перфузии — холодная, влажная, бледно-цианотичная или мраморная кожа, удлинение времени заполнения капилляров свыше 2 сек, температурный градиент более 3 оС, олигурия (мочеотделение менее 25 мл/ час). Для определения времени заполнения капилляров следует сдавить кончик ногтевой пластинки или подушечку пальца стопы или кисти в течение 2 секунд и измерить время, в течение которого побледневший участок восстанавливает розовую окраску. У здоровых людей это происходит сразу. В случае ухудшения микроциркуляции побледнение держится длительное время. Подобные нарушения микроциркуляции неспецифичны и являются постоянным компонентом любого вида шока, а степень их выраженности определяет тяжесть и прогноз шока. Принципы лечения нарушений микроциркуляции также не специфичны и практически не отличаются при всех видах шока: устранение вазоконстрикции, гемодилюция, антикоагулянтная терапия, дезагрегантная терапия.
Нарушения метаболизма
В условиях пониженной перфузии капиллярного русла не обеспечивается адекватная доставка питательных веществ к тканям, что приводит к нарушению метаболизма, дисфункции клеточных мембран и повреждению клеток. Нарушаются углеводный, белковый, жировой обмен, резко угнетается утилизация нормальных источников энергии – глюкозы и жирных кислот. При этом возникает резко выраженный катаболизм мышечного белка.
Важнейшие нарушения обмена веществ при шоке — разрушение гликогена, уменьшение дефосфорилирования глюкозы в цитоплазме, уменьшение продукции энергии в митохондриях, нарушение работы натрий-калиевого насоса клеточной мембраны с развитием гиперкалиемии, которая может стать причиной мерцательной аритмии и остановки сердца.
Развивающееся при шоке повышение в плазме уровня адреналина, кортизола, глюкагона и подавление секреции инсулина воздействуют на обмен веществ в клетке изменениями в использовании субстратов и белковом синтезе. Эти эффекты включают увеличенный уровень метаболизма, усиление гликогенолиза и глюконеогенеза. Уменьшение утилизации глюкозы тканями почти всегда сопровождается гипергликемией. В свою очередь гипергликемия может приводить к снижению кислородного транспорта, нарушению водно-электролитного гомеостаза и гликозилированию белковых молекул со снижением их функциональной активности. Значимое дополнительное повреждающее воздействие стрессорной гипергликемии при шоке способствует углублению органной дисфункции и требует своевременной коррекции с поддержанием нормогликемии.
На фоне нарастающей гипоксии нарушаются процессы окисления в тканях, их метаболизм протекает по анаэробному пути. При этом в значительном количестве образуются кислые продукты обмена веществ, и развивается метаболический ацидоз. Критерием метаболической дисфункции служат уровень рН крови ниже 7, 3, дефицит оснований, превышающий 5, 0 мЭкв/л и повышение концентрации молочной кислоты в крови свыше 2 мЭкв/л.
Важная роль в патогенезе шока принадлежит нарушению обмена кальция, который интенсивно проникает в цитоплазму клеток. Повышенный внутриклеточный уровень кальция увеличивает воспалительный ответ, приводя к интенсивному синтезу мощных медиаторов системной воспалительной реакции (СВР). Воспалительные медиаторы играют значительную роль в клинических проявлениях и прогрессировании шока, а также и в развитии последующих осложнений. Повышенное образование и системное распространение этих медиаторов могут приводить к необратимым повреждениям клеток и высокой летальности. Использование блокаторов кальциевого канала повышает выживаемость пациентов с различными видами шока.
Действие провоспалительных цитокинов сопровождается высвобождением лизосомальных ферментов и свободных перекисных радикалов, которые вызывают дальнейшие повреждения — «синдром больной клетки». Гипергликемия и повышение концентрации растворимых продуктов гликолиза, липолиза и протеолиза приводят к развитию гиперосмолярности интерстициальной жидкости, что вызывает переход внутриклеточной жидкости в интерстициальное пространство, обезвоживание клеток и дальнейшее ухудшение их функционирования. Таким образом, дисфункция клеточной мембраны может представлять общий патофизиологический путь различных причин шока. И хотя точные механизмы дисфункции клеточной мембраны неясны, лучший способ устранения метаболических нарушений и предотвращения необратимости шока – быстрое восстановление ОЦК.
Вырабатываемые при клеточном повреждении воспалительные медиаторы, способствуют дальнейшему нарушению перфузии, которая еще больше повреждает клетки в пределах микроциркуляторного русла. Таким образом, замыкается порочный круг — нарушение перфузии приводит к повреждению клеток с развитием синдрома системной воспалительной реакции, что в свою очередь еще больше ухудшает перфузию тканей и обмен веществ в клетках. Когда эти чрезмерные системные ответы длительно сохраняются, становятся автономными и не могут подвергнуться обратному развитию развивается синдром полиорганной недостаточности.
В развитии этих изменений ведущая роль принадлежит фактору некроза опухоли (ФНО), интерлекинам (ИЛ-1, ИЛ-6, ИЛ-8), фактору активации тромбоцитов (ФАТ), лейкотриенам (В4, С4, D4, E4), тромбоксану А2, простагландинам (Е2, Е12), простациклину, гамма-интерферону. Одновременное и разнонаправленное действие этиологических факторов и активированных медиаторов при шоке приводит к повреждению эндотелия, нарушению сосудистого тонуса, проницаемости сосудов и дисфункции органов.
Постоянство или прогрессирование шока может быть следствием, как продолжающегося дефекта перфузии, так и клеточного повреждения или их сочетания. Поскольку кислород — наиболее лабильный витальный субстрат, неадекватная его доставка системой кровообращения составляет основу патогенеза шока, и своевременное восстановление перфузии и оксигенации тканей часто полностью останавливает прогрессирование шока.
Таким образом, в основе патогенеза шока лежат глубокие и прогрессирующие расстройства гемодинамики, транспорта кислорода, гуморальной регуляции и метаболизма. Взаимосвязь этих нарушений может привести к формированию порочного круга с полным истощением адаптационных возможностей организма. Предотвращение развития этого порочного круга и восстановление ауторегуляторных механизмов организма и является основной задачей интенсивной терапии больных с шоком.
Стадии шока
Шок представляет собой динамический процесс, начинающийся с момента действия фактора агрессии, который приводит к системному нарушению кровообращения, и при прогрессировании нарушений заканчивающийся необратимыми повреждениями органов и смертью больного. Эффективность компенсаторных механизмов, степень клинических проявлений и обратимость возникающих изменений позволяют выделить в развитии шока ряд последовательных стадий.
Стадия прешока
Шоку обычно предшествует умеренное снижение систолического АД, не превышающее 20 мм рт. ст. от нормы (или 40 мм рт. ст. при наличии у больного артериальной гипертензии), которое стимулирует барорецепторы каротидного синуса и дуги аорты и активирует компенсаторные механизмы системы кровообращения. Перфузия тканей существенно не страдает и клеточный метаболизм остается аэробным. Если при этом прекращается воздействие фактора агрессии, то компенсаторные механизмы могут восстановить гомеостаз без каких-либо лечебных мероприятий.
Ранняя (обратимая) стадия шока
Для этой стадии шока характерно уменьшение уровня систолического АД ниже 90 мм рт. ст. , выраженная тахикардия, одышка, олигурия и холодная липкая кожа. В этой стадии компенсаторные механизмы самостоятельно не способны поддерживать адекваный СВ и удовлетворять потребности органов и тканей в кислороде. Метаболизм становится анаэробным, развивается тканевой ацидоз и появляются признаки дисфункции органов. Важный критерий этой фазы шока — обратимость возникших изменений гемодинамики, метаболизма и функций органов и достаточно быстрый регресс развившихся нарушений под влиянием адекватной терапии.
Промежуточная (прогрессивная) стадия шока
Это жизнеугрожающая критическая ситуация с уровнем систолического АД ниже 80 мм рт. ст. и выраженными, но обратимыми нарушениями функций органов при немедленном интенсивном лечении. При этом требуется проведение искусственной вентиляции легких (ИВЛ) и использование адренергических лекарственных средств для коррекции нарушений гемодинамики и устранения гипоксии органов. Длительная глубокая гипотензия приводит к генерализованной клеточной гипоксии и критическому нарушению биохимических процессов, которые быстро становятся необратимыми. Именно от эффективности терапии в течение первого так называемого «золотого часа» зависит жизнь больного.
Рефрактерная (необратимая) стадия шока
Для этой стадии характерны выраженные расстройства центральной и периферической гемодинамики, гибель клеток и полиорганная недостаточность. Интенсивная терапия неэффективна, даже если устранены этиологические причины и временно повышалось АД. Прогрессирующая полиорганная дисфункция обычно ведет к необратимому повреждению органов и смерти.
Диагностические исследования и мониторинг при шоке
Шок не оставляет времени для упорядоченного сбора информации и уточнения диагноза до начала лечения. Систолическое АД при шоке чаще всего бывает ниже 80 мм рт. ст. , но шок иногда диагностируют и при более высоком систолическом АД, если имеются клинические признаки резкого ухудшения перфузии органов: холодная кожа, покрытая липким потом, изменение психического статуса от спутанности сознания до комы, олиго- или анурия и недостаточное наполнение капилляров кожи. Учащенное дыхание при шоке обычно свидетельствует о гипоксии, метаболическом ацидозе и гипертермии, а гиповентиляция — о депрессии дыхательного центра или повышении внутричерепного давления.
Диагностические исследования при шоке включают также клинический анализ крови, определение содержания электролитов, креатинина, показателей свертываемости крови, группы крови и резус-фактора, газов артериальной крови, электрокардиографию, эхокардиографию, рентгенографию грудной клетки. Только тщательно собранные и корректно интерпретированные данные помогают принимать правильные решения.
Мониторинг — система наблюдения за жизненно важными функциями организма, способная быстро оповещать о возникновении угрожающих ситуаций. Это позволяет вовремя начать лечение и не допускать развития осложнений. Для контроля эффективности лечения шока показан контроль показателей гемодинамики, деятельности сердца, легких и почек. Число контролируемых параметров должно быть разумным. Мониторинг при шоке должен обязательно включать регистрацию следующих показателей:
- АД, используя при необходимости внутриартериальное измерение;
- частота сердечных сокращений (ЧСС) ;
- интенсивность и глубина дыхания;
- центральное венозное давление (ЦВД) ;
- давление заклинивания в легочной артерии (ДЗЛА) при тяжелом шоке и неясной причине шока;
- диурез;
- газы крови и электролиты плазмы.
Для ориентировочной оценки степени тяжести шока можно рассчитывать индекс Алговера — Бурри, или, как его еще называют, индекс шока – отношение частоты пульса в 1 минуту к величине систолического АД. И чем выше этот показатель, тем большая опасность угрожает жизни пациента. Отсутствие возможности мониторинга какого-либо из перечисленных показателей затрудняет правильный выбор терапии и повышает риск развития ятрогенных осложнений.
Центральное венозное давление
Низкое ЦВД является косвенным критерием абсолютной или косвенной гиповолемии, а его подъем выше 12 см вод. ст. указывает на сердечную недостаточность. Измерение ЦВД с оценкой его ответа на малую нагрузку жидкостью помогает выбрать режим инфузионной терапии и определить целесообразность инотропной поддержки. Первоначально больному в течение 10 минут вводят тест-дозу жидкости: 200 мл при исходном ЦВД ниже 8 см водн. ст. ; 100 мл – при ЦВД в пределах 8-10 см водн. ст. ; 50 мл – при ЦВД выше 10 см водн. ст. Реакцию оценивают, исходя из правила «5 и 2 см водн. ст. »: если ЦВД увеличилось более чем на 5 см, инфузию прекращают и решают вопрос о целесообразности инотропной поддержки, поскольку такое повышение свидетельствует о срыве механизма регуляции сократимости Франка-Старлинга и указывает на сердечную недостаточность. Если повышение ЦВД меньше 2 см вод. ст. – это указывает на гиповолемию и является показанием для дальнейшей интенсивной инфузионной терапии без необходимости инотропной терапии. Увеличение ЦВД в интервале 2 и 5 см водн. ст. требует дальнейшего проведения инфузионной терапии под контролем показателей гемодинамики.
Необходимо подчеркнуть, что ЦВД — ненадежный индикатор функции левого желудочка, поскольку зависит в первую очередь от состояния правого желудочка, которое может отличаться от состояния левого. Более объективную и широкую информацию о состоянии сердца и легких дает мониторинг гемодинамики в малом круге кровообращения. Без его использования более чем в трети случаев неправильно оценивается гемодинамический профиль пациента с шоком. Основным показанием для катеризации легочной артерии при шоке служит повышение ЦВД при проведении инфузионной терапии. Реакцию на введение малого объема жидкости при мониторинге гемодинамики в малом круге кровообращения оценивают по правилу «7 и 3 мм рт. ст. ».
Мониторинг гемодинамики в малом круге кровообращения
Инвазивный мониторинг кровообращения в малом круге производят с помощью катетера, установленного в легочной артерии. С этой целью обычно используют катетер с плавающим баллончиком на конце (Swan-Gans), который позволяет измерить ряд параметров:
- давление в правом предсердии, правом желудочке, легочной артерии и ДЗЛА, которое отражает давление наполнения левого желудочка;
- СВ методом термодилюции;
- парциальное давление кислорода и насыщение гемоглобина кислородом в смешанной венозной крови.
Определение этих параметров значительно расширяют возможности мониторинга и оценки эффективности гемодинамической терапии. Получаемые при этом показатели позволяют:
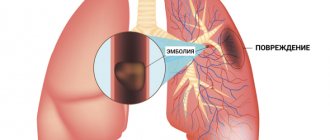
- дифференцировать кардиогенный и некардиогенный отек легких, выявлять эмболию легочных артерий и разрыв створок митрального клапана;
- оценить ОЦК и состояние сердечно-сосудистой системы в случаях, когда эмпирическое лечение неэффективно или сопряжено с повышенным риском;
- корректировать объем и скорость инфузии жидкости, дозы инотропных и сосудорасширяющих препаратов, величины положительного давления в конце выдоха при проведении ИВЛ.
Снижение насыщения кислородом смешанной венозной крови всегда является ранним показателем неадекватности сердечного выброса.
Диурез
Уменьшение диуреза — первый объективный признак снижения ОЦК. Больным с шоком обязательно устанавливают постоянный мочевой катетер для контроля за объемом и темпом мочевыделения. При проведении инфузионной терапии диурез должен быть не менее 50 мл/час. При алкогольном опьянении шок может протекать без олигурии, поскольку этанол угнетает секрецию антидиуретического гормона.
Лечение шока
В зависимости от причин, вызвавших столь негативный ответ организма врач будет принимать различные меры. Безусловно, общий комплекс действий есть при любых видах шока, поскольку направлен на поддержание последних сил организма.
Таким образом, при травматическом шоке следует прежде всего купировать болевой синдром. При необходимости ввести кровоостанавливающие препараты, провести репозицию, наложить повязку.
При кровотечении проводится временная остановка с последующим лигированием и восполнение объема циркулирующей крови. При анафилактическом шоке незамедлительно вводятся глюкокортикостероиды, антигистаминные препараты, проводится искусственная вентиляция легких.
Далее проводят реанимационные действия, применяются экстренные препараты. После стабилизации состояния пациента проводится поддерживающая терапия, интенсивная терапия.
Анатомо-функциональные особенности сердечно-сосудистой системы
Из левого желудочка кровь попадает в артериальную систему большого круга кровообращения. Артерии помещают 15% всего объема циркулирующей крови. По этим сосудам кровь переносится к тканям. Терминальные отделы артерий заканчиваются артериолами (сосудами сопротивления). Они выполняют функцию распределения крови в тканях. Так, повышение тонуса артериол (их спазм) исключает поступления крови в настоящее капиллярный бассейн. Возникает тканевая ишемия, а кровь оттекает в венозную систему через артерио-венозные анастомозы. Снижение тонуса артериол, наоборот, увеличивает их просвет и усиливает кровоснабжение тканей.
Природными вазоконстрикторами (сосудосуживающими веществами) являются:
- адреналин,
- норадреналин,
- серотонин,
- ангиотензин-2.
При стрессах резко увеличивается в крови концентрация катехоламинов (адреналина, норадреналина). Они вызывают спазм артериол; возникает феномен централизации кровообращения со снижением периферического кровотока. Сосудорасширяющее действие оказывают «кислые» метаболиты (лактаты, пируват, адениловая и инозиновой кислоты), брадикинин, гистамин, ацетилхолин, ряд медикаментов (нейролептики, альфа-адренолитики, периферийные вазодилататоры, ганглиоблокаторы и др.), некоторые экзогенные яды и т.п. Их действие вызывает феномен децентрализации кровообращения (раскрытие просвета артериол и перераспределение крови из центральных сосудов на периферию, в капиллярное русло).
Капилляры — это разветвленная сеть мельчайших сосудов организма, общей длиной 90 100 000 километров. Одномоментно функционирует около 20-25% капилляров, в которых происходит переход кислорода и питательных веществ из крови к тканям и выведение из них «отработанных» продуктов метаболизма. Периодически, с интервалом в несколько десятков секунд, раскрываются другие капилляры, куда перераспределяется кровь (эффект вазомоции). Капилляры помещают 12% всей циркулирующей крови. Однако при некоторых патологических состояниях этот объем может увеличиваться в несколько раз.
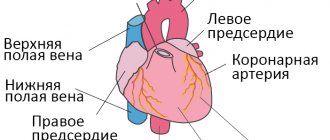
Из капилляров отработана кровь оттекает в венозную систему. Вены играют роль резервуара крови, поскольку содержат основную ее массу (70%). Они, в отличие от артерий, способны изменять свой объем, влияя на поступление крови к сердцу.
Важнейшим гемодинамическим показателем венозной системы является центральное венозное давление (ЦВД). Это давление, которое оказывает кровь на стенки полых вен и правого предсердия. Он является интегральным показателем объема циркулирующей крови, сосудистого тонуса и насосной функции сердца. ЦВД измеряют флеботонометром. В норме он составляет 60-120 мм водного столба.
Центральное венозное давление снижается при:
- кровопотерях;
- чрезмерной потере воды (гипогидратации);
- снижении тонуса артериол и вен.
При этом уменьшается объем притекающей к сердцу крови и, соответственно, и снижается сердечный выброс. При отрицательных показателях ЦВД возникает опасность остановки кровообращения. Повышается венозное давление при:
• сердечной недостаточности (лево- и правожелудочковой);
• избыточном вливании крови и других жидкостей;
• преграде тока крови из правого желудочка сердца (эмболия легочных артерий).
При показателях ЦВД более 150-160 мм рт.ст. на фоне левожелудочковой недостаточности у больных может развиться отек легких. Интегральным показателем гемодинамики артериального отдела сосудистой системы является артериальное давление (систолическое, диастолическое, пульсовое и среднее). Систолическое и диастолическое АД измеряют тонометром, способом Короткова. Пульсовое АД составляет разницу между систолическим и диастолическим.
На величину артериального давления влияют объем сердечного выброса и сопротивление периферических сосудов (артериол). Эта зависимость прямо пропорциональная. Потому повысить артериальное давление у больного можно следующими способами:
- ввести средники сосудосужающего действия (р-р адреналина, мезатона и т.п.);
- увеличить объем циркулирующей крови (переливанием полиглюкина, рефортана т.п.);
- улучшить функциональную способность миокарда (вводя сердечные гликозиды и др.).
Общий объем крови у человека составляет около 7% от массы тела: у мужчин 70 мл / кг, у женщин — 65 мл / кг. Объем циркулирующей крови (ОЦК) несколько меньше, поскольку часть крови не участвует в циркуляции, находясь в сосудистом депо. ОЦК можно измерить, введя в кровяное русло известную концентрацию вещества, напр., синьки Эванса или полиглюкина, и определив степень ее разведения. Итак, измерения ЦВД, АД, сердечного выброса и ОЦК у больных позволяют выявить особенности нарушений кровообращения и проводить адекватную корректирующую терапию.
Острая сердечно-сосудистая недостаточность
Острая сердечно-сосудистая недостаточность — неспособность сердца и сосудов обеспечить адекватное метаболическим потребностям кровоснабжение тканей организма, что приводит к нарушению функций клеток и их гибели.
Причинами патологии могут быть механическая травма, кровотечения, ожоги, чрезмерная потеря воды и солей организмом, интоксикация экзогенными и эндогенными ядами, действие микроорганизмов и их токсинов, гиперчувствительная реакция немедленного типа на аллергены, ишемическая болезнь сердца, аритмии, нарушения нейрогуморальной регуляции сосудистого тонуса и т.д.
Острая сердечная недостаточность — это нарушение насосной функции сердца. Она может развиваться в результате как кардиальных нарушений (заболевания сердца), так и вторично, под влиянием экстракардиальных факторов (инфекция, интоксикация). Острая сердечная недостаточность протекает по лево- и правожелудочковой типами.
Острая левожелудочковая недостаточность — неспособность левого желудочка перекачать кровь из малого круга кровообращения в большой. Чаще всего она возникает при инфаркте миокарда, митральном пороке сердца, стенозе левого атриовентрикулярного отверстия, стенозе и недостаточности аортального клапана, гипертонической болезни, коронарном склерозе сосудов, острой пневмонии.
У больных возникает нарушение кровообращения в коронарных сосудах (который осуществляется только во время диастолы и имеет прерывистый характер) и снижается сердечный выброс. Во время систолы не вся кровь выталкивается в аорту, а частично остается в левом желудочке. Поэтому при диастоле в нем возрастает давление, что приводит к застою крови и в левом предсердии. Правый же желудочек, который сохраняет свою функцию, продолжает нагнетать кровь в легочные сосуды, которые не способны вместить такой ее объем. Растет гидростатическое давление в сосудах малого круга кровообращения; жидкая часть крови преходит в ткань легких.
У больных отмечается удушье (сначала при физической нагрузке, а затем — в состоянии покоя). В дальнейшем приступы удушья сопровождаются кашлем с выделением мокроты розового цвета. Это состояние называется сердечной астмы. При дальнейшем повышении гидростатического давления в капиллярах малого круга кровообращения (свыше 150-200 мм рт.ст.) жидкая часть крови проникает в просвет альвеол. Возникает отек легких. Различают интерстициальный и альвеолярный отек легких.
При интерстициальном отеке из застойных сосудов малого круга выделяется серозная жидкость, инфильтрирует все ткани легких, в том числе перибронхиальные и периваскулярные пространства.
При альвеолярном отеке в просвет альвеол проникает не только плазма, но и эритроциты, лейкоциты, тромбоциты. При дыхании жидкость смешивается с воздухом; образуется большое количество пены, которая нарушает процессы поступления кислорода в кровь. К циркуляторной гипоксии (вследствие сердечной недостаточности) присоединяется гипоксическая гипоксия (вследствие нарушения поступления кислорода).
Состояние больного резко ухудшается. Он занимает вынужденное (сидячее) положение. Нарастает одышка (30-35 дыханий в мин.), которая нередко переходит в удушье. Возникает акроцианоз. Сознание омрачено, наблюдается психомоторное возбуждение (вследствие гипоксии ЦНС). Дыхание клекотливое, с выделением пены розового цвета. В легких выслушиваются множественные разнокалиберные влажные хрипы, которые слышны на расстоянии (симптом «кипящего самовара»).
Различают две формы отека легких: с повышенным артериальным давлением (гипертоническая болезнь, недостаточность аортальных клапанов, при поражениях структур и сосудов головного мозга) и с нормальным или пониженным артериальным давлением (при обширном инфаркте миокарда, остром миокардите, тяжелой митральной или аортальной пороке сердца, тяжелой пневмонии).
Шок
Шок — это патологическое состояние организма, возникающее при воздействии на него чрезмерных раздражителей и проявляющееся нарушением системного кровообращения, микроциркуляции и метаболических процессов в клетках.
Шок возникает при ответе организма на агрессию мобилизацией собственных защитных сил. Универсальной реакцией-ответом на стресс является стимуляция симпатической нервной системы и гипоталамус — надпочечников с высвобождением в кровь большого количества катехоламинов и других вазоактивных веществ. Эти медиаторы возбуждают рецепторы периферических сосудов, вызывая их сужение, одновременно способствуя расширению сосудов жизнеобеспечения.
Возникает централизация кровообращения: целесообразно, с позиций организма, ограничения перфузию кожи, органов брюшной полости, почек для обеспечения нормального кровоснабжения таких жизненно важных органов и систем как центральная нервная система, миокард, легкие. Однако влияние шокогенных факторов (боль, гиповолемия, повреждения тканей и органов, накопление в крови токсичных метаболитов), блокада микроциркуляции вследствие сосудистого спазма и микротромбоза и длительная ишемия тканей ведет к гипоксическому поражению и гибели клеток внутренних органов. Развивается синдром полиорганной недостаточности.