Антибиотики широкого спектра действия: ТОП 20 лучших
В список антибиотиков широкого спектра действия входят препараты из разных групп. Особо высокой активностью обладают лекарственные средства из ряда фторхинолонов, нитроимидазолов, гликопептидов и из группы фосфорной кислоты.
Ниже вы сможете ознакомиться с характеристикой самых лучших антибиотиков широкого спектра действия и способами их применения. Антибиотики назначаются лечащим врачом с учетом чувствительности возбудителя заболевания на основе данных лабораторных исследований. В ряде случаев необходимо срочное назначение антибактериальных средств, тогда выбор падает на антибиотики широкого спектра действия.
При длительном лечении возможно развитие устойчивости бактерий к антибиотикам, в этой ситуации необходимо менять препараты на другие либо применять комплекс из нескольких средств. Длительность антибиотикотерапии определяется тяжестью течения заболевания, наличием осложнений и сопутствующих патологий. Дозы современных антибиотиков широкого спектра действия подбираются лечащим врачом индивидуально с учетом возраста больного и возможных противопоказаний.
Как работают антибиотики нового поколения?
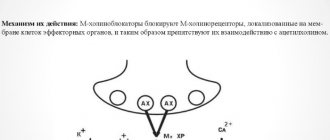
В отличие от лекарственных средств из группы антисептиков, антибиотик обладает должным терапевтическим эффектом не только после наружного нанесения, но и действует системно после перорального, внутривенного, внутримышечного использования.
Антибиотики нового поколения способны:
- Воздействовать на синтез клеточных стенок путем нарушения выработки жизненно важных пептидных комплексов.
- Нарушать функционирование и целостность клеточной мембраны.
- Нарушать синтез белка, необходимого для роста и жизнедеятельности патогенного возбудителя.
- Подавлять синтез нуклеиновой кислоты.
По характеру воздействия на бактериальные клетки, антибиотики делятся на:
- Бактерицидные – патоген погибнет и после этого будет выведен из организма.
- Бактериостатические – активный компонент не убивает бактерии, однако нарушает их способность к размножению.
Важно определить, насколько активно действующее вещество лекарства в отношении того или иного возбудителя патологического процесса. Для этого необходимо пройти ряд лабораторных исследований, назначенных врачом.
Антибиотики XXI века
В первой части статьи мы рассказали про основные мифы связанные с антибиотиками и подробно описали пенициллиновую группу, а сейчас перейдем к антибиотикам следующего поколения.
ЦЕФАЛОСПОРИНЫ
Микробы часто поступают если не разумно, то вполне логично.
Если им угрожают антибиотики пенициллинового ряда, микробы начинают разрушать пенициллины (вот бы нам так — нам что-то мешает, а мы это раз! — и стерли с лица земли).
Слабое звено пенициллинов — это так называемое бета-лактамное кольцо (вы не раз встретите в описании препаратов этот термин, поэтому его лучше запомнить). Вот это бета-лактамное кольцо микробы и научились разрывать. А инструментом для разрыва служат специальные ферменты, бета-лактамазы.
Так что, если говорить коротко, то антибиотики цефалоспориновой группы — все те же пенициллины, которые работают точно так же, но вот бета-лактамаз они не боятся. И значит, могут расправиться с микробами, с которыми не справляется все тот же ампициллин или даже амоксициллин с клавулановой кислотой.
«Гонка вооружений» между микробами и фармацевтами со временем породила второе, третье, а потом и четвертое поколение цефалоспориновых антибиотиков (при произнесении некоторых названий этих лекарств пугаются даже врачи, сразу представляющие, против какой флоры эти антибиотики предназначены).
КОГДА ВРАЧИ НАЗНАЧАЮТ ЦЕФАЛОСПОРИНЫ
При аллергии на обычные пенициллины.
Конечно, химическая структура пенициллинов и цефалоспоринов похожа, но шанс, что пациент не выдаст аллергической реакции на цефалоспорины, все же очень высок; Если пенициллиновые антибиотики не справляются с инфекцией. Такое часто бывает, если пациент заражается каким-нибудь стафилококком или стрептококком уже в больнице: микробы там травлены уже чем угодно, а потому особенно стойкие к таблеткам из обычной аптеки.
Микробы, к сожалению, быстро учатся и быстро эволюционируют. Оно и понятно: для смены поколений им нужно всего-то 20 минут.
И все же врачам всегда рекомендуют начинать лечение с антибиотиков из группы пенициллинов, чтобы не плодить антибиотикоустойчивую флору.
АНТИБИОТИКИ ГРУППЫ МАКРОЛИДОВ
Пенициллин сделал революцию в лечении инфекций. Но очень скоро оказалось, что он способен и убить тоже. То там, то здесь пациенты стали погибать от вызванного пенициллином анафилактического шока (помните — на пенициллин бывают аллергические реакции?).
Что оставалось делать ученым? Только разрабатывать новые антибиотики.
Пенициллин начал массово применяться в 1943 году (в США и СССР, и почти одновременно). А уже в 1949 году Альберто Агилар на Филиппинах нашел новый (после зеленой плесени, из которой был выделен пенициллин) особый грибок, подавляющий рост бактерий.
В США год спустя другой ученый, МакГуир, выделил из него новый антибиотик — эритромицин (в Википедии почему-то упорно пишут, что его выделил Элай Лилли, но это не так — просто МакГуир на него работал).
Эритромицин работает до сих пор: оказалось, что к нему бактерии умеют приспосабливаться намного хуже, чем к пенициллину.
ЧТО УМЕЮТ МАКРОЛИДЫ?
Во-первых, бактерии действительно приспосабливаются к макролидам намного медленнее, чем к пенициллинам.
Но тоже приспосабливаются. Именно поэтому эритромицин сейчас оброс огромным семейством из «младших братьев» — полусинтетических макролидов и азалидов, которые некоторые фармацевты выделяют еще в одну отдельную группу — четвертую и последнюю группу антибиотиков, применяющихся в педиатрии.
Во-вторых, макролиды не убивают бактерий — они лишают их способности размножаться, в результате чего бактериальные клетки, не принося вреда человеку, очень быстро помирают своей смертью или становятся жертвами иммунной системы.
В-третьих, макролиды могут проникать внутрь клеток и настигать бактерий, которые так любят там селиться, — хламидий и микоплазм.
Хламидии и микоплазмы не имеют клеточной стенки, за счет чего неуязвимы для пенициллинов (пенициллины убивают только бактерий, имеющих клеточную стенку. Если клеточной стенки нет — получается задача задушить Колобка — вроде бы и надо за шею, да ее просто не имеется). А вот для макролидов отсутствие клеточной стенки не является препятствием: хламидии и микоплазмы при контакте с макролидами погибают, хотя и не столь быстро.
КОГДА ВРАЧИ НАЗНАЧАЮТ МАКРОЛИДЫ?
— у пациента есть аллергия на пенициллины;
Правила назначения антибиотиков
Чтобы антибиотики были максимально эффективными и при этом не давали серьезных побочных эффектов, необходимо при их подборе и назначении учитывать форму болезни и ее тяжесть, а также определить причину патологии (в идеале по результатам посева выяснить, какой микроб стал причиной воспаления).
Кроме того, важно определить чувствительность бактерий к определенным антибиотикам, которые планируется использовать. Естественно, что в педиатрической практике сделать это сложно, и есть те состояния, при которых промедление в несколько дней, которые уходят на проведение посевов и определение чувствительности к антибиотикам, могут стать фатальными.
Сюда относят острые отиты, ангины или пневмонии, пиелонефриты и некоторые еще состояния. В этих случаях антимикробная терапия назначается немедленно, исходя из клинических рекомендаций и протоколов лечения, которые разработаны за годы лечения. При необходимости, терапия корректируется по результатам посева уже в ходе лечения, при его неэффективности.
Антибиотики: от мифа к препаратам XXI века
Вокруг антибиотиков разгуливает много мифов.
Нам с вами, чтобы быть готовыми к дальнейшему разговору, нужно сразу же разобраться с самыми главными. Их всего три.
АНТИБИОТИКИ ВЫЗЫВАЮТ ДИСБАКТЕРИОЗ
На самом деле нет. Добиться деконтаминации кишечника, то есть состояния, при котором антибиотики убивают ВСЮ флору в кишечнике и там может селиться кто угодно, крайне трудно.
Для этого антибиотики придется принимать месяцами и в достаточно больших дозировках.
В случаях, когда ребенок заболевает острой респираторной инфекцией, такие схемы не назначаются врачами никогда.
АНТИБИОТИКИ ПОДАВЛЯЮТ ИММУННУЮ СИСТЕМУ
На самом деле нет.
Иммунная система формируется по принципу клональной селекции: в ответ на каждый контакт с инфекцией в иммунной системе создается специальный клон клеток — «специалистов» именно по этой инфекции. Врачи называют их клетками памяти.
При повторном заражении этой же инфекцией клетки памяти начинают мгновенно размножаться и подавляют эту инфекцию быстро — часто быстрее, чем она может проявиться.
Так, кстати, работают прививки — создают клоны клеток памяти в ответ на введение убитых, расчлененных или вообще фальшивых инфекций.
Для создания клеток памяти достаточно контакта с возбудителем инфекции, полноценного заболевания вовсе не требуется.
ПРИ ЧАСТОМ ПРИМЕНЕНИИ АНТИБИОТИКОВ ФОРМИРУЕТСЯ ФЛОРА, КОТОРУЮ НЕЛЬЗЯ УБИТЬ НИЧЕМ
А вот это отчасти правда. Действительно, некоторые возбудители инфекций, например пневмококк или золотистый стафилококк, в результате длительного воздействия антибиотиков приобретают устойчивость практически к любым антибактериальным лекарственным препаратам, известным человечеству.
Таких возбудителей можно встретить в хирургических стационарах — особенно тех, которые работают десятилетиями, и врачи, столкнувшись с инфекцией, не сразу поддающейся лечению, обязательно спрашивают у пациента, не находился ли он на лечении в таком вот стационаре в течение длительного времени.
Почему они задают этот вопрос? Да потому, что взять подобный устойчивый ко всему микроорганизм больше просто негде. Вырастить у себя что-то подобное, постепенно притравливая какую-нибудь заразу аптечными антибиотиками, невозможно физически. Жизни не хватит.
Болезни и спектр действия антибиотиков
Еще в конце 19 века бактериолог Ганс Грам выявил, что разные бактерии по-разному реагируют на окрашивание. Одни приобретают ярко-выраженный цвет, другие, напротив, быстро обесцвечиваются. Этот простой опыт с практической точки зрения имел огромную важность. Ведь разная реакция на краситель говорила о свойствах клеточной стенки бактерии. А значит, подсказывала, как именно антибиотики должны воздействовать на микроорганизм.
С тех пор существует базовое деление на грамотрицательные (неокрашивающиеся) и грамположительные (окрашивающиеся) бактерии.
- Грам (+) — возбудители большинства инфекций дыхательных путей, носоглотки, уха, глаза. К ним, в частности, относят стафилококки и стрептококки.
- Грам (-) — бактерии этой группы могут вызывать серьезные болезни. Это кишечная палочка, палочка Коха, сальмонелла, шигелла (возбудитель дифтерии), гонококк, менингококк.
Спектр действия антибиотиков определяется по тому, какие именно бактерии чувствительны к конкретному препарату. И если антибиотики узкого спектра чаще действуют или на Грам (+), или на Грам (-), то широкий спектр позволяет поражать и те, и другие.
Основные группы антибиотиков
Антибиотики это группа природных или полусинтетических органических веществ, способных разрушать микробы или подавлять их размножение. На данный момент известно множество различных видов антибиотиков, наделенных различными свойствами. Знание этих свойств является основой правильного лечения антибиотиками. Индивидуальные качества и действие антибиотика главным образом зависит от его химической структуры. В этой статье мы расскажем о наиболее известных группах антибиотиках, покажем механизм их работы, спектр действия, возможности применения для лечения различных инфекций.
Группы антибиотиков Антибиотики это вещества природного или полусинтетического происхождения. Получают антибиотики путем экстрагирования их из колоний грибков, бактерий, тканей растений или животных. В некоторых случаях исходную молекулу подвергают дополнительным химическим модификациям с целью улучшить определенные свойства антибиотика (полусинтетические антибиотики).
На данный момент существует огромное число всевозможных антибиотиков. Правда, в медицине используется лишь немногие из них, другие, из-за повышенной токсичности, не могут быть использованы для лечения инфекционных болезней у людей. Чрезвычайное разнообразие антибиотиков послужило причиной создания классификации и разделения антибиотиков на группы. При этом внутри группы собраны антибиотики со схожей химической структурой (происходящие из одной и той же молекулы сырья) и действием.
Ниже мы рассмотрим основные группы известных на сегодняшний день антибиотиков: Бета-лактамные антибиотики Группа бета-лактамных антибиотиков включает две большие подгруппы известнейших антибиотиков: пенициллины и цефалоспорины, имеющих схожую химическую структуру.
Группа пенициллинов. Пенициллины получаются из колоний плесневого грибка Penicillium откуда и происходит название этой группы антибиотиков. Основное действие пенициллинов связано с их способностью угнетать образование клеточной стенки бактерий и тем самым подавлять их рост и размножение. В период активного размножения многие виды бактерий очень чувствительны по отношению к пенициллину и потому действие пенициллинов бактерицидное.
Важным и полезным свойством пенициллинов является их способность проникать внутрь клеток нашего организма. Это свойство пенициллинов позволяет лечить инфекционные болезни, возбудитель которых «прячется» внутри клеток нашего организма (например, гонорея). Антибиотики из группы пенициллина обладают повышенной избирательностью и потому практически не влияют на организм человека, принимающего лечение.
К недостаткам пенициллинов можно отнести их быстрое выведение из организма и развитие резистентности бактерий по отношению к этому классу антибиотиков.
Биосинтетические пенициллины получают напрямую из колоний плесневых грибков. Наиболее известными биосинтетическими пенициллинами являются бензилпенициллин и феноксиметилпенициллин. Эти антибиотики используют для лечения ангины, скарлатины, пневмонии, раневых инфекций, гонореи, сифилиса.
Полусинтетические пенициллины получаются на основе биосинтетических пенициллинов путей присоединения различных химических групп. На данный момент существует большое количество полусинтетический пенициллинов: амоксициллин, ампициллин, карбенициллин, азлоциллин.
Важным преимуществом некоторых антибиотиков из группы полусинтетических пенициллинов является их активность по отношению к пенициллинустойстойчивым бактериям (бактерии, разрушающие биосинтетические пенициллины). Благодаря этому полусинтетические пенициллины обладают более широким спектром действия и потому могут использоваться в лечении самых разнообразных бактериальных инфекций.
Основные побочные реакции, связанные с применением пенициллинов носят аллергический характер и иногда являются причиной отказа от использования этих препаратов.
Группа цефалоспоринов. Цефалоспорины также относятся к группе бета-лактамных антибиотиков и обладают структурой, схожей со структурой пенициллинов. По этой причине некоторые побочные эффекты их двух групп антибиотиков совпадают (аллергия).
Цефалоспорины обладают высокой активностью по отношению к широкому спектру различных микробов и потому используются в лечении многих инфекционных болезней. Важным преимуществом антибиотиков из группы цефалоспоринов является их активность по отношению к микробам устойчивым к действию пенициллинов (пенициллинустойчивые бактерий).
Существует несколько поколений цефалоспоринов: Цефалоспорины I поколения (Цефалотин, Цефалексин, Цефазолин) активны по отношению большого количества бактерий и используются для лечения различных инфекций дыхательных путей, мочевыделительной системы, для профилактики постоперационных осложнений. Антибиотики этой группы, как правило, хорошо переносятся и не вызывают серьезных побочных реакций.
Цефалоспорины II поколения (Цефомандол, Цефуроксим) обладают высокой активностью по отношению к бактериям, населяющим желудочно-кишечный тракт, и потому могут быть использованы для лечения различных кишечных инфекций. Также эти антибиотики используются для лечения инфекций дыхательных и желчевыводящих путей. Основные побочные реакции связаны с возникновением аллергии и нарушений работы желудочно-кишечного тракта.
Цефалоспорины III поколения (Цефоперазон, Цефотаксим, Цефтриаксон) новые препараты, обладающие высокой активностью по отношению к широкому спектру бактерий. Преимуществом этих препаратов является их активность по отношению к бактериям нечувствительным к действию других цефалоспоринов или пенициллинов и способность длительной задержки в организме. Используют эти антибиотики для лечения тяжелых инфекций не поддающихся лечению другими антибиотиками. Побочные эффекты этой группы антибиотиков связаны с нарушением состава микрофлоры кишечника или возникновением аллергических реакций.
Антибиотики из группы макролидов Макролиды это группа антибиотиков со сложной циклической структурой. Наиболее известные представители антибиотиков из группы макролидов это Эритромицин, Азитромицин, Рокситромицин.
Действие антибиотиков макролидов на бактерии бактериостатическое – антибиотики блокируют структуры бактерий, синтезирующие белки, в результате чего микробы теряют способность размножаться и расти.
Макролиды активны по отношению ко многим бактериям, однако самым замечательным свойством макролидов, пожалуй, является их способность проникать внутрь клеток нашего организма и разрушать микробы, не имеющие клеточной стенки. К таким микробам относятся хламидии и риккетсии – возбудители атипичной пневмонии, урогенитального хламидиоза и других болезней, неподдающихся лечению другими антибиотиками.
Другой важной особенностью макролидов является их относительная безопасность и возможность проведения длительного лечения, хотя современные программы лечения с использованием макролидов предусматривают ультракороткие курсы длительностью в три дня.
Основные направления использования макролидов это лечения инфекций, вызванных внутриклеточными паразитами, лечение больных с аллергией на пенициллины и цефалоспорины, лечение детей раннего возраста, беременных женщин и кормящих матерей.
Антибиотики из группы тетрациклинов Наиболее известными антибиотиками из группы тетрациклинов являются Тетрациклин, Доксициклин, Окситетрациклин, Метациклин. Действие антибиотиков из группы тетрациклинов бактериостатическое. Также как и макролиды тетрациклины способны блокировать синтез белков в клетках бактерий, однако, в отличие от макролидов, тетрациклины обладают меньшей избирательностью и потому в больших дозах или при длительном лечении могут тормозить синтез белков в клетках организма человека. В то же время тетрациклины остаются незаменимыми «помощниками» в лечении многих инфекций. Основные направления использования антибиотиков из группы тетрациклинов это лечение инфекций дыхательных и мочевыводящих путей, лечения тяжелых инфекций типа сибирской язвы, туляремии, бруцеллеза и пр.
Несмотря на относительную безопасность, при длительном использовании тетрациклины могут быть причиной возникновения тяжелых побочных эффектов: гепатит, поражение скелета и зубов (тетрациклины противопоказаны детям до 14 лет), пороки развития (противопоказание для использования во время беременности), аллергия.
Широкое применение получили мази содержащие тетрациклин. Применяют для локального лечения бактериальных инфекций кожи и слизистых оболочек.
Антибиотики из группы аминогликозидов Аминогликозиды это группа антибиотиков, к которой относятся такие препараты как Гентамицин, Мономицин, Стрептомицин, Неомицин. Спектр действия аминогликозидов чрезвычайно широк и включает даже возбудителей туберкулеза (Стрептомицин).
Аминогликозиды используются для лечения тяжелых инфекционных процессов, связанных с массивным распространением инфекции: сепсис (заражение крови), перитониты. Также Аминогликозиды используются для локального лечения ран и ожогов.
Основным недостатком аминогликозидов является их высокая токсичность. Антибиотики из этой группы обладают нефротоксичностью (поражение почек), гепатотоксичностью (поражение печени), ототоксичностью (могут вызвать глухоту). По этой причине аминогликозиды должны использоваться только по жизненным показаниям, когда являются единственной возможностью лечения и не могут быть заменены другими препаратами.
Левомицетин Левомицетин (Хлорамфеникол) угнетает синтез бактериальных белков, а в больших дозах вызывает бактерицидный эффект. Левомицетин обладает широким спектром действия, однако его использование ограничено из-за риска развития серьезных осложнений. Наибольшая опасность, связанная с использованием антибиотика Хлорамфеникола заключается в поражении костного мозга, вырабатывающего клетки крови.
Противогрибковые антибиотики Противогрибковые антибиотики это группа химических веществ, способных разрушать мембрану клеток микроскопических грибков, вызывая их гибель.
Наиболее известными представителями этой группы являются антибиотики Нистатин, Натамицин, Леворин. Использование этих препаратов в наше время заметно ограничено в связи с малой эффективностью и высокой частотой возникновения побочных эффектов. Противогрибковые антибиотики постепенно вытесняются высокоэффективными синтетическими противогрибковыми препаратами.
Библиография:
- И.М.Абдуллин Антибиотики в клинической практике, Саламат, 1997
- Катцунга Б.Г Базисная и клиническая фармакология, Бином;СПб.:Нев.Диалект, 2000.
Источник
Антибиотики широкого спектра действия: список препаратов
Антибиотики широкого спектра — универсальные бактерицидные препараты, которые помогут избавиться от многих заболеваний. Чаще всего их назначают для лечения различных инфекций, возбудитель которых остается неизвестным. Также они назначаются, если человек заразился быстроразвивающимся и опасным вирусом.
Список современных антибиотиков представлен в таблице ниже:
| Группа | Препарат | Механизм действия |
| Тетрациклины | Доксициклин, Тетрациклин | Убивает бактерии, обладает противовирусным действием |
| Левомицетин | Моксифлоксацин, Левофлоксицин | Противомикробное, противогрибковое и противобактерицидное |
| Полусинтетические пенициллины | Карбенициллин, Тикарциллин | Угнетает синтез клеточной стенки возбудителя |
| Цефалоспорины | Цефтриаксон | Изменяет активность вируса, проникшего в РНК |
| Рифампицинов | Стрептомицин, Амфениколы | Препятствует выработки белка |
| Карбапенемы | Меропенем, Меропенем, Сайронем, Имипенем | Противобактериальное и противовоспалительное, пролонгированного действия |
Также такие средства могут быть показаны в качестве профилактики после серьезных хирургических вмешательств. Помните, что не все дешевые лекарства так плохи.
Цефалоспорины
Активны в отношении стафилококковых инфекций, а также протея, клебсиелл, кишечных палочек, возбудителей ангины и пневмонии, болезней мочевыводящих путей, остеомиелитов, менингитов.
К числу антибиотиков этой группы относятся:
Парентеральные 3 поколение:
| Представители | Торговое название и способ применения |
| Цефотаксим | Клафоран: порошок для инъекционного раствора: по 0,5-2,0 гр. х 1 раз в сутки внутримышечно или внутривенно медленно. Цефосин: порошок для инъекционного раствора: по 1,0 гр. каждые 8-12 часов внутримышечно, внутривенно медленно/капельно. |
| Цефоперазон | Цефобид: порошок для инъекционного раствора: по 2,0-4,0 гр. в сутки за 2 внутримышечные инъекции. Цефпар: порошок для инъекционного раствора: по 2,0-4,0 гр. каждые 12 часов внутривенно/внутримышечно. |
| Цефтриаксон | Цефтриаксон: порошок для инъекционного раствора: по 1,0-2,0 гр. х 1 раз в день внутримышечно/внутривенно. Азаран: порошок для инъекционного раствора: 1,0 гр. растворить в 3,5 мл 1% раствора лидокаина гидрохлорида, внутримышечные инъекции 1 раз в день. |
| Цефтазидим | Фортум: порошок для инъекционного раствора: по 1,0-6,0 гр. х 1 раз в сутки за 2-3 внутривенные/внутримышечные инфузии. Цефтидин: порошок для инъекционного раствора: по 1,0-6,0 гр. х 1 раз в день внутривенно/внутримышечно. |
Парентеральные 3 поколение:
| Представители | Торговое название и способ применения |
| Цефдиторен | Спектрацеф: таблетки: по 0,2-0,4 гр. х 2 раза в день. |
| Цефтибутен | Цедекс: капсулы: по 0,4 гр. одиножды в сутки. |
| Цефиксим | Супракс Солютаб: шипучие таблетки: по 0,4 гр. х 1 раз в день или по 0,2 гр. х 2 раза в день, растворить заранее в стакане с водой. Супракс: капсулы: по 0,4 гр. х 1 раз в сутки. Панцеф: таблетки: по 0,4 гр. одиножды в день или по 0,2 гр. дважды в день. |
5 поколение (парентеральные):
| Представители | Торговое название и способ применения |
| Цефтаролин | Зинфоро: порошок для инъекционного раствора: 0,6 гр. каждые 12 часов внутривенно в течение часа. |
| Цефтобипрол | Зефтера: лиофилизат для инъекционного раствора: не применяется на территории Российской Федерации. |
Макролиды
Макролидам свойственно накапливаться в тканях, а не в сыворотке крови, как остальным группам. Используются в лечении бронхитов и внебольничных пневмоний в качестве монолекарства (в случае непереносимости пенициллинов), патологиях лор-органов (фарингите, синусите, отите, ларингите и прочих) венерических заболеваний (сифилис, гонорея, бленнорея).
К числу антибиотиков этой группы относятся:
14-членные:
| Представители | Торговое название и способ применения |
| Эритромицин | Эритромицин:
|
| Олеандомицин | Олеандомицина фосфат: субстанция-порошок. Практически не применяется в настоящее время. |
| Рокситромицин | РоксиГЕКСАЛ: таблетки: по 0,15 гр. дважды в сутки либо по 0,3 гр. за один прием, курс принимают 10 дней. Эспарокси: таблетки: по 0,15 гр. дважды в сутки за 15 минут до еды либо по 0,3 гр. однократно, курс приема 10 дней. Рулид: таблетки: по 0,15 гр. дважды в сутки, курс приема 10 дней. |
| Кларитромицин | Клацид: таблетки: по 0,5 гр. дважды в день, прием в течение 2-ух недель. Фромилид: таблетки: по 0,5 гр дважды в день, прием в течение 2-ух недель. Кларитросин: таблетки: по 0,25 гр. дважды в сутки, прием в течение 2-ух недель. |
15-членные:
| Представители | Торговое название и способ применения |
| Азитромицин | Сумамед: капсулы: по 0,5 гр. х 1 раз в сутки до или через 2 часа после приема пищи. Азитрокс: капсулы: по 0,25-0,5 гр. х 1 раз в сутки. Азитрал: капсулы: по 0,25-0,5 гр. х 1 раз в день до или после еды. |
16-членные:
| Представители | Торговое название и способ применения |
| Спирамицин | Спирамицин-веро: таблетки: по 2-3 таблетки (3 млн. МЕ) за 2-3 приема в сутки. Ровамицин: таблетки: по 2-3 таблетки (3 млн. МЕ) или 5-6 таблеток (6-9 млн. МЕ) за 2-3 приема в сутки. |
| Джозамицин | Вильпрафен: таблетки: по 0,5 гр. дважды в сутки, не разжевывая, запивая водой. Вильпрафен солютаб: таблетки: по 0,5 гр. х дважды в сутки, не разжевывая либо растворив в 20 мл воды. |
| Мидекамицин | Макропен: таблетки: по 0,4 гр. трижды в сутки, курс приема в течение 2-ух недель. |
Системные антибиотики в терапии бактериальных инфекций кожи и мягких тканей: фокус на макролиды
Бактериальные инфекции кожи, вызывающие ее гнойное воспаление, были выделены в группу инфекционных дерматозов французским ученым H. Leloir в 1891 г. под названием пиодермиты (pyon – гной, derma – кожа). За рубежом пиодермии обычно относят к обширной группе инфекций кожи и мягких тканей (ИКМТ), включающей, помимо инфекций кожи и ее придаточных образований, инфекции подкожно–жировой клетчатки и нижележащих тканей. В экономически развитых странах ИКМТ составляют 1/3 всех инфекционных заболеваний. По данным отечественных исследований, гнойничковые инфекции кожи составляют 30–40% всей дерматологической патологии у лиц трудоспособного возраста, у военнослужащих этот показатель достигает 60%. В детской дерматологической практике данная патология относится к числу наиболее частых и составляет от 30 до 50% всех случаев обращений к врачу [1–3]. Этиология Основной источник ИКМТ – микроорганизмы, контаминирующие и колонизирующие поверхность кожи. Грамположительные кокки S. aureus и S. Pyogenes, способные проникать в толщу эпидермиса при наличии его повреждений, несомненно, играют ведущую роль в этиологии гнойничковых инфекций кожи. Причем S. aureus является наиболее частым возбудителем, несколько реже встречаются инфекции, вызванные S. pyogenes, а также смешанная инфекция с участием обоих микроорганизмов. Согласно результатам зарубежных многоцентровых исследований, кроме S. aureus, S. pyogenes, в развитии ИКМТ могут принимать участие Corynebacterium diphtheriae, P. aeruginosa, Enterobacteriaceae, Streptococcus spp. Большое значение в определении этиологической роли предполагаемого возбудителя имеет тип инфекции (табл. 1). В отличие от первичных пиодермий вторичные, как и большинство некротизирующих ИКМТ инфекций, имеют полимикробную этиологию. Важную роль в развитии инфекции играют вирулентность микроорганизма и степень бактериальной обсемененности. Показано, что вероятность развития инфекции прямо пропорциональна степени бактериальной обсемененности и вирулентности микроорганизма и обратно пропорциональна силе защитной реакции организма. Вероятность колонизации увеличивается при наличии заболеваний кожи аллергического генеза. Так, у больных атопическим дерматитом колонизация пораженных участков S. aureus выявляется в 90% случаев [3]. Патогенез В возникновении той или иной формы пиодермии большую роль играют: вид патогена, его вирулентность, состояние макроорганизма, а также разнообразные эндогенные и экзогенные предрасполагающие факторы, снижающие барьерную и защитную функции кожи. Вирулентность стафилококков и стрептококков определяется рядом выделяемых ими патогенных токсинов и энзимов (коагулазой, лейкоцидином, стрептокиназой, гиалуронидазой стрептолизином, гемолизинами и др.), которые облегчают проникновение патогенов в кожу, приводят к повреждению и расслоению всех слоев эпидермиса, вызывают гемолиз и некротизацию дермы и подлежащих тканей, нарушая их нормальный метаболизм [4,5]. В возникновении и развитии ИКМТ большое значение имеют реактивность организма, его механизмы сопротивления микробной агрессии. Недостаточность иммунокомпетентной системы при этом носит, как правило, вторичный (приобретенный) характер. Она может формироваться в преморбидный период вследствие перенесенных или сопутствующих тяжелых заболеваний. Заболевания эндокринной системы (ожирение, сахарный диабет, недостаточная активность гипофизарно–надпочечниковой системы, щитовидной, половых желез) способствуют снижению механизмов антиинфекционной защиты организма. Более половины больных (52%) хронической пиодермией злоупотребляют углеводами (как правило, легкоусвояемыми), что создает постоянную перегрузку инсулярного аппарата поджелудочной железы и может способствовать расстройствам углеводного обмена той или иной степени, накоплению в тканях углеводов, являющихся благоприятной питательной средой для пиококков. Существенную роль отводят также себорейному состоянию кожи. Вследствие увеличения количества кожного сала и изменения его химического состава происходит снижение стерилизационных свойств кожи и активации гноеродных кокков [6]. Немаловажное значение в развитии гнойничковых заболеваний кожи имеют хронические инфекционные заболевания различных органов и тканей: пародонтоз, кариес, гингивит, тонзиллит, фарингит, инфекции урогенитального тракта, дисбактериоз, кишечные интоксикации, снижающие общую и местную антибактериальную резистентность организма и способствующие развитию у больных последующей специфической сенсибилизации, которая отягощает течение инфекционного процесса. Существенную роль в развитии хронической пиодермии играют заболевания центральной и вегетативной нервной системы, умственное или физическое перенапряжение, «истощающие заболевания» – алкоголизм, голодание, неполноценное питание (недостаток белков, витаминов, минеральных солей, гиповитаминозы, особенно А и С. Витамин А участвует в процессе кератинообразования, витамин С регулирует проницаемость сосудистой стенки, является синергистом кортикостероидов). Большую роль в развитии пиодермий играют различные иммунодефицитные состояния, возникающие вследствие врожденного или приобретенного иммунодефицита (ВИЧ–инфекция, прием глюкокортикостероидов, цитостатиков и иммунодепресантов). Дефекты клеточной антибактериальной защиты в виде угнетения фагоцитарной активности нейтрофилов, нарушения хемотаксиса, а также снижение опсонических факторов сыворотки крови и иммуноглобулинов способствуют хронизации инфекции и частым рецидивам [7]. Важнейшее значение в патогенезе ИКМТ имеют нарушения Т–клеточной системы иммунитета. В основе расстройств специфических механизмов иммунологической реактивности лежит уменьшение числа Т–лимфоцитов в периферической крови, снижение количества СD3– и CD4–клеток и изменение их взаимосвязи с моноцитами, что приводит к ослаблению Т–клеточного иммунного ответа. Недостаточность иммунной системы (иммунологический дисбаланс) больного и антигенная мимикрия возбудителя нередко ведут к хронизации инфекции и формированию бактерионосительства, а нерациональное применение антибиотиков – к резистентности возбудителя [8]. Весомое значение в развитии бактериальных инфекций кожи имеют неблагоприятные воздействия окружающей среды, нарушающие целостность кожного покрова и создающие «входные ворота» для проникновения инфекции. К ним в первую очередь относят влияние высокой или низкой температуры, повышенной влажности, приводящей к мацерации кожи, повышенное загрязнение и микротравматизации профессиональными факторами (маслами, цементом, угольной пылью). Входные ворота для инфекции возникают при бытовых микротравмах (порезы, уколы), расчесах при зудящих дерматозах. Нарушение кожного барьера в виде сухости и истончения рогового слоя способствуют проникновению микроорганизмов в глубокие слои кожи и подлежащие ткани, что приводит к развитию пиодермического процесса. Клинические разновидности ИКМТ ИКМТ представляют собой достаточно многочисленную и разнородную по клинической картине группу заболеваний, приводящих к поражениям различной глубины, распространенности и степени тяжести. Общим, характерным для всех признаком является наличие локального гнойного воспаления, при тяжелом течении сопровождающегося развитием системной воспалительной реакции. Клинические формы зависят от вида этиологического фактора, анатомической локализации, приуроченности к придаткам кожи, глубины и площади поражения, длительности течения процесса. В отечественной дерматологии принята классификация первичных пиодермий, предложенная J. Jadasson еще в 1934 г. и построенная по этиологическому принципу. В ней выделяют: стафилодермии, преимущественно поражающие кожу вокруг придатков (сально–волосяных фолликулов, потовых желез); стрептодермии, поражающие гладкую кожу преимущественно вокруг естественных отверстий и смешанные стрепто–стафилококковые инфекции. В каждой из трех групп в зависимости от глубины поражения выделяют поверхностные и глубокие формы. Кроме того, гнойничковые заболевания кожи разделяют на первичные, возникающие на неизмененной кожи, и вторичные, развивающиеся как осложнения на фоне уже существующего дерматоза, как правило, зудящего (чесотки, экземы, атопического дерматита). По длительности течения различают острые и хронические пиодермии. Стафилоккоковые пиодермии обычно связаны с придатками кожи (волосяными фолликулами, апокриновыми железами). Для них характерно образование глубокой пустулы, в центре которой формируется полость, заполненная гнойным экссудатом. По периферии располагается зона эритематозно–отечной воспалительной кожи. Нагноительный процесс заканчивается формированием рубца (рис. 1). Стрептококковые пиодермии чаще развиваются на гладкой кожи, вокруг естественных отверстий (полости рта, носа) и начинаются с образования фликтены – поверхностно расположенного пузыря с дряблой складчатой покрышкой, внутри которого содержится серозно–гнойное содержимое. Тонкие стенки фликтены быстро вскрываются, и содержимое изливается на поверхность кожи, ссыхаясь в медово–желтые слоистые корочки. Процесс склонен к распространению по периферии в результате аутоинукуляции (рис. 2). Стафилодермиями чаще страдают мужчины, стрептодермиями – женщины и дети [3,4]. В зарубежной литературе все ИКМТ с практической точки зрения делят на три основные группы: первичные пиодермии, в подавляющем большинстве вызванные S. aureus и пиогенными b–гемолитическими стрептококками (преимущественно группы А), и развивающиеся на неизмененной коже (фолликулит, импетиго, рожистое воспаление); вторичные пиодермии развивающиеся на фоне повреждений кожи или сопутствующей соматической патологии (например, пролежни, диабетическая язва стопы, инфекции после укусов животных, послеоперационные раневые и посттравматические инфекции), а также на фоне дерматозов, сопровождающихся зудом и расчесами (аллергический дерматит, псориаз, чесотка и т.д.); некротические инфекции, представляющие наиболее тяжелую форму ИКМТ (целлюлит полимикробной этиологии – синергидный целлюлит, некротизирующий фасциит, мионекроз – газовая гангрена) (рис. 3). При данной патологии определение глубины и распространенности поражения является приоритетом врача–хирурга, т.к. только при хирургической обработке можно наиболее точно определить истинную степень распространения инфекции. Начальная тактика ведения этих пациентов одинакова. Она заключается в раннем проведении хирургического вмешательства и назначении адекватной антимикробной терапии [9]. Лечение ИКМТ Терапия больных с бактериальными инфекциями кожи должна быть комплексной (этиотропной и патогенетической) и проводиться после тщательного анамнестического, клинического и лабораторного обследования больного. Необходимо выявление и лечение сопутствующих заболеваний, обследование на очаги фокальной инфекции, а в случае длительно персистирующего процесса – исследования иммуностатуса. Основным и единственным методом этиотропного лечения больных ИКМТ являются антибиотики. При острых поверхностных нераспространенных процессах (импетиго, фолликулиты, паронихии) терапия может быть ограничена местным применением антибиотиков и антисептиков. Во всех прочих случаях требуется проведение системной антибактериальной терапии. Показаниями к назначению системной антибиотикотерапии являются глубокие формы пиодермий: фурункулы (особенно с локализацией на лице и шее), карбункул, гидраденит, рожистое воспаление, целлюлит. Перечисленные формы бактериальных инфекций кожи имеют длительное, нередко хроническое рецидивирующее течение, большую распространенность процесса и часто сопровождаются симптомами общей интоксикации в виде лихорадки, головной боли, слабости, а также развитием регионарных осложнений (лимфаденит, лимфангит). В качестве этиотропного средства антибиотики используются при лечении дерматоза бактериальной природы – болезни Лайма. Они являются препаратами выбора при лечении вульгарных угрей. В дерматовенерологической практике антибиотики широко применяются как для лечения инфекционных дерматозов, так и заболеваний, обусловленных инфекциями, передающимися половым путем (ИППП) [4]. Перед назначением антибактериального препарата желательно производить посев гноя с определением чувствительности выделенного микроорганизма к различным антибиотикам и по результатам исследования назначать соответствующий препарат. Однако это не всегда выполнимо, особенно при угрозе или развитии осложнений инфекции. Как показывает анализ современной литературы и собственный клинический опыт, сегодня наиболее часто в лечении бактериальных инфекций кожи используются следуюшие группы антибиотиков: 1. β–лактамы: а) природный пенициллин, его дюрантные формы и полусинтетические пенициллины; б) цефалоспорины (1–4 поколения). 2. Макролиды. 3. Тетрациклины. 4. Фторхинолоны. В последние годы пенициллин и его дюрантные препараты редко применяются в терапии ИКМТ, так как подавляющее число штаммов пиококков приобрели способность продуцировать фермент b–лактамазу (пенициллиназу), подавляющую антибактериальную активность пенициллина. Кроме того, β–лактамы относятся к препаратам, имеющим высокую частоту аллергических реакций. Тетрациклины, аминогликозиды в настоящее время используются значительно реже. Это связано с большим количеством резистентных штамов микроорганизмов к этим антибиотикам (из чего следует их низкая терапевтическая активность), а также с наличием тяжелых побочных эффектов. Следует помнить, что тетрациклины противопоказаны при беременности, детям и пациентам с печеночной недостаточностью. Фторхинолоны назначаются в основном при лечении заболеваний, передающихся половым путем, из–за высокой чувствительности к ним возбудителей урогенитальных инфекций, а при пиодермиях используются только при неэффективности других групп антибиотиков. Однако при заболеваниях центральной нервной системы, у беременных, а также в педиатрии диапазон их применения ограничен – они назначаются в основном по жизненным показаниям. Необходимо также не забывать и о фотосенсибилизирующем эффекте фторхинолонов, и связанных с этим мерах предосторожности, особенно весной и летом [10]. Современная лечебная практика предъявляет к выбору антибиотика определенные требования. Прежде всего препарат должен обладать широким спектром антимикробного действия и минимально выраженной антибиотикорезистентностью к микробным агентам, не иметь тяжелых побочных действий, обладать минимальным риском развития аллергических реакций, быть удобным в применении для пациента (наличие пероральной формы, удобного режима дозирования) и доступным по цене. Кроме того, очень важно, чтобы у антибиотика отсутствовали клинически значимые взаимодействия с другими лекарственными препаратами. На сегодняшний день этим требованиям в полной мере соответствуют антибиотики – макролиды. Классификация и механизмы фармакотерапевтического действия макролидов Макролиды уже более 50 лет широко используются в клинической практике. Первый природный антибиотик этой группы – эритромицин (метаболит Streptomyces erythreus) был получен еше в 1952 году. Макролиды можно классифицировать по химической структуре и по происхождению. Основу химической структуры данного класса антибиотиков составляет макроциклическое лактонное кольцо. В зависимости от числа атомов углерода в кольце макролиды подразделяются на 14–, 15– и 16–членные (табл. 2). Среди макролидов выделяют 3 поколения: а) первое поколение: эритромицин, олеандомицин; б) второе поколение: спирамицин, рокситромицин, джозамицин, кларитромицин и др.; в) третье поколение: азитромицин (Азитрал). Антибактериальный эффект макролидов основан на нарушении синтеза рибосомальных белков микробной клетки и ингибировании тем самым процесса воспроизведения возбудителя. Они в основном оказывают бактериостатический эффект, что обусловливает целесообразность их назначения в острой фазе воспаления. Макролиды относятся к «тканевым антибиотикам», т.е. при распределении в организме они накапливаются преимущественно не в кровяном русле, а в тех органах и тканях, где имеется воспаление, создавая тем самым высокие концентрации препарата. Хорошо распределяясь в организме, макролиды способны преодолевать гистогематологические барьеры (за исключением гематоэнцефалического), значительно превосходя в этом β–лактамные антибиотики. Однако широкое (и часто необоснованное) применение достаточно быстро привело к появлению высокого процента эритромициноустойчивых штамов возбудителей, особенно стафилококов. Это, в свою очередь, значительно снизило использование эритромицина в клинической практике [11]. Интерес к макролидам вновь возник в начале 80–х годов XX века, после появления новых поколений антибиотиков этой группы – азалидов (в частности, азитромицина). Азитромицин был синтезирован в 1983 году на основе эритромицина. Препарат по своим фармакокинетическим свойствам превзошел все показатели своего предшественника и стал первым представителем новой группы антибиотиков – азалидов. Уникальность азитромицина базируется на его исключительной фармакокинетике. Азитромицин устойчив в кислой среде, благодаря чему хорошо всасывается после приема внутрь. Одновременный прием с пищей уменьшает всасывание на 50%, поэтому препарат принимают за 1 час до или через 2 часа после еды. Липофильность молекулы азитромицина обеспечивает, помимо высокого уровня всасывания в кишечнике, еще и отличное проникновение препарата в ткани. Быстрое проникновение азитромицина из крови в ткани обеспечивается также низким уровнем связывания азитромицина с белками крови, что дает возможность достигать быстрого терапевтического эффекта при инфекциях, поражающих клетки и ткани. Высокая концентрация препарата в области поражения, в 10–100 раз превышающая концентрацию в кровяном русле, позволяет активно воздействовать на патогенный очаг, тем самым обеспечивая быстрый клинический эффект и скорейшее выздоровление. Современные макролиды (в частности, азитромицин) проявляют наибольщую эффективность в отношении таких возбудителей, как S. pyogenus, S. aureus, S. pneumoniae, некоторых грамотрицательных микроорганизмов (гонококи), а также внутриклеточных возбудителей (в частности, Chlamidia trachomatis и Ureaplasma urealyticum), что обусловливает их высокую востребованность в дерматовенерологической практике [12]. Важное значение для антибактериальной активности макролидов второго поколения имеет их взаимодействие с нейтрофилами. Благодаря своей способности проникать внутрь нейтрофилов и создавать в них высокие концентрации, многие макролиды позитивным образом модифицируют функции данных клеток, влияя, в частности, на хемотаксис, активность фагоцитоза и киллинга. Наряду с противомикробным действием данные антибиотики обладают умеренной противовоспалительной активностью. Активируя клетки макрофагального ряда, они способны проникать в них и при миграции фагоцитирующих клеток в очаг воспаления поступать туда вместе с ними. Уникальность этих препаратов заключается еще и в том, что они обладают выраженным постантибиотическим эффектом, то есть сохраняют высокие концентрации в очаге воспаления в течение 5–7 дней после отмены. Данный саногенетический эффект позволил разработать короткие курсы лечения, не превышающие 3–5 суток, и удобный режим дозирования (1 раз в сутки). Это, в свою очередь, обеспечивает комплаентность лечения и повышает качество жизни больного. Наиболее выражен постбиотический эффект у азитромицина, что позволяет создавать в очагах инфекции концентрацию антибиотика, многократно превышающую МПК в отношении активных возбудителей при лечении как острых, так и хронических инфекций. В последнее время получены доказательства иммуномодулирующего действия азитромицина в эксперименте на здоровых добровольцах. Первая фаза иммуномодулирующего эффекта состоит в дегрануляции нейтрофилов и оксидантного взрыва, что способствовало активизации защитных механизмов. По достижении эрадикации возбудителей отмечалось уменьшении продукции ИЛ–8 и стимуляция апоптоза нейтрофилов, что минимизировало выраженность воспалительной реакции [13]. Макролиды, как природные, так и полусинтетические, по сравнению с другими антибиотиками оказывают минимальное влияние на нормальную микрофлору человеческого организма и не вызывают дисбиоза. Поэтому азитромицин рассматривается не только как высокоэффективный, но и наиболее безопасный антибиотик с минимальным числом противопоказаний к назначению. Нежелательные реакции при его приеме в целом встречаются крайне редко и не превышают 5%. Наиболее частыми побочными эффектами являются симптомы со стороны желудочно–кишечного тракта (тошнота, тяжесть в эпигастральной области), которые, как правило, выражены умеренно, не требуют отмены препарата и быстро проходят при приеме лекарств после еды [11]. Клиническая эффективность азитромицина Как свидетельствуют сравнительные исследования, при ИКМТ среди антибиотиков, применяющихся в амбулаторной практике, наиболее эффективны макролиды нового поколения, в первую очередь 15– и 16–членные (азитромицин, джозамицин, рокситромицин). Накоплен уже 20–летний положительный опыт применения азитромицина в отечественной дерматовенерологической практике. В дерматологии он являются базовой терапией стафилококковых и стрептококковых поражений кожи и мягких тканей (фурункул, импетиго, целлюлит), а в венерологической практике – при лечении ИППП. В отличие от большинства макролидов у азитромицина отсутствуют клинически значимые взаимодействия с другими лекарственными препаратами. Он не связывается с ферментами комплекса цитохрома Р450, вследствие чего не проявляет реакции лекарственного взаимодействия с препаратами, метаболизирующимися по этому пути. Это свойство является немаловажным, поскольку в реальной клинической практике большинство больных, у которых возникают ИКМТ, имеют фоновые или сопутствующие заболевания, по поводу которых получают соответствующее лечение. Также необходимо подчеркнуть, что наряду с хорошей переносимостью и отсутствием выраженных побочных реакций макролиды (азитромицин) имеют еще одно безусловное преимущество по сравнению с другими группами антибиотиков – это то, что он может назначаться беременным и детям [14]. В настоящее время одним из наиболее часто применяемых препаратов в клинической практике является препарат Азитрал (азитромицин), производимый фармацевтической . Азитрал (азитромицин) аналогичен оригинальному азитромицину – первому представителю подгруппы азалидов из группы макролидных антибиотиков, используемому в лечении ИКМТ и урогенитальных инфекций. Исследования показали, что клиническая эффективность препарата, назначаемого в разовой дозе 500 мг в течение 3 дней, сопоставима с эффективностью большинства широко применяемых антибактериальных средств. Это позволяет в 2–3 раза сократить обычный курс антибиотикотерапии, а уникальный фармакокинетический профиль Азитрала обеспечивает одноразовый суточный прием и высокую комплаентность терапии [15]. Благодаря особенностям фармакокинетики и своеобразному спектру антимикробного действия, охватывающему основных возбудителей инфекций мочеполового тракта, азитромицин является препаратом первого выбора в терапии сочетанных ИППП, в том числе хронического осложненного урогенитального хламидиоза и ВЗОМТ у небеременных женщин, и альтернативным средством для лечения этого заболевания в период беременности. При однократном приеме 1 г азитромицина (Азитрала) его концентрация в течение недели в ткани предстательной железы и матки превышает МПК для C. trachomatis (0,125 мкг/мл) в 42,5 раза, а в цервикальном канале – в 12 раз, что является терапевтической концентрацией для лечения этой инфекции. Более того, даже спустя 2 недели терапевтическая концентрация азитромицина в ткани предстательной железы превышает МПК для C. trachomatis в 13,6 раз. Авторами было доказано, что именно при таком приеме в тканях, где вегетируют C. trachomatis, поддерживается высокая терапевтическая концентрация препарата в течение 6–8 циклов развития. Полученные данные свидетельствуют о высокой эффективности пульс–терапии Азитралом (по 1 г 1 раз в неделю, курсовая доза 3 г). в комплексном лечении хронического хламидийного уретропростатита и ассоциирующейся с ним микоуреаплазменной и гарднереллезной инфекции. Важно отметить, что препарат Азитрал хорошо переносится больными, доступен по цене и поэтому может широко использоваться в терапии осложненного урогенитального хламидиоза и ВЗОМТ [16,17]. Изучение эффективности, безопасности и переносимости азитромицина у 30 детей от 6 месяцев до 3 лет со стафилококковыми инфекциями различной локализации ЛОР–органов и кожи показало, что азитромицин (Азитрал) не уступает по эффективности антистафилококковым пенициллинам. Наряду с высокой эффективностью, характеризующейся быстрой и стойкой обратной динамикой основных клинических симптомов и местных воспалительных изменений в 100% случаев отмечалась хорошая переносимость препарата и отсутствие побочных явлений у всех детей. Широкий спектр антимикробной активности, особенности фармакокинетики, низкий процент нежелательных явлений и ряд преимущества перед другими макролидами обусловливают приоритет использования препарата при различных кожных инфекционных процессах (импетиго, фурункулез, фолликулит, целлюлит, паронихия) у детей. Эффективность азитромицина в педиатрической практике, доказанная клиническими испытаниями, позволяет рекомендовать его в качестве альтернативы b–лактамным антибиотикам, а у детей с отягощенным аллергоанамнезом – как препарат выбора [18,19]. Одним из важнейших фармакоэкономических показателей, определяющих выбор антибиотика, является соотношение стоимость/эффективность. Оно определяется, как отношение стоимости лекарственного лечения (для пероральных препаратов она равна стоимости курсовой дозы) к доле успешно пролеченных больных. Следует обратить внимание на то, что Азитрал среди существующих препаратов азитромицина проявляет оптимальное соотношение цена/качество [20]. Известно, что неэффективность антибиотикотерапии во многом определяется снижением чувствительности к применяемому препарату. В настоящее время клинически значимая резистентность к азитромицину отсутствует. По данным мониторинга антибиотикорезистентности устойчивость к азитромицину и другим макролидам последнего поколения среди возбудителей ИКМТ не превышает 2–10%. Чувствительность штаммов S. pyogenes, выделенных на территории России, к антибиотику азитромицин составляет 92%. Как показано в ряде исследований, клиническая эффективность азитромицина выше, чем у тетрациклинов и b–лактамных антибиотиков. Сравнительное клинико–микробиологическое изучение эффективности при глубоких стафилодермиях 5–дневного курса азитромицина и 10–дневного приема цефалексина показало более высокую терапевтическую активность макролида. Эрадикация возбудителя при применении азитромицина отмечалась в 94%, при цефалексине в 90% случаев, клиническое излечение – соответственно в 56 и 53% случаев. При этом частота побочных реакций, как правило, не требующих отмены препарата, не превышает 5%, что значительно ниже по сравнению с эритромицином (до 14%) или пероральными формами b–лактамов [21,22]. Таким образом, азитромицин обладает широким спектром антимикробного действия, высокой бактериостатической активностью по отношению чувствительных к нему инфекций, высокую биодоступность с избирательным действием в очаге воспаления, он малотоксичен, имеет минимум побочных эффектов и удобный режим приема. Следовательно, препарат отвечает современным требованиям рациональной антибиотикотерапии и может быть рекомендован для эффективного применения в дерматовенерологической практике.
Литература 1. Jones M.E., Karlowsky J.A., Draghi D.C, Thornsberry C., Sahm D.F., Nathwani D. Epidemiology and antibiotic susceptibility of bacteria causing skin and soft tissue infections in the USA and Europe: a guide to appropriate antimicrobial treatment. Int J Antimicrob Agent 2003; 22:406–19. 2. Н.Н. Мурашкин, М.Н. Глузмина, Л.С. Галустян. Гнойничковые поражения кожи в практике детского дерматолога: свежий взгляд на старую проблему. РЖКВБ: Научно–практический журнал, 2008, №4, с. 67–71. 3. Белькова Ю.А. Пиодермии в амбулаторной практике. Болезни и возбудители. Клиническая микробиология и антимикробная химиотерапия: № 3, том 7, с. 255–270, 2005. 4. Т.А. Белоусова, М.В. Горячкина. Бактериальные инфекции кожи: проблема выбора оптимального антибиотика. РМЖ 2005, том 13, №16, с. 1086–1089. 5. Таха Т.В., Нажмутдинова Д.К. Рациональный выбор антибиотикотерапии при пиодермиях. РМЖ 2008, том 16, №8, с. 552–555. 6. Новоселов В.С., Плиева Л.Р. Пиодермии. РМЖ 2004, том 12, №5, с. 327–335. 7. Масюкова С.А., Гладько В.В., Устинов М.В., Владимирова Е.В., Тарасенко Г.Н., Сорокина Е.В. Бактериальные инфекции кожи и их значение в клинической практике дерматолога. Consilium medicum 2004, том 6, №3, с. 180–185. 8. T. File. Diagnosis and antimicrobial therapy of skin and soft tissue infections. Ohio, USA. Клиническая микробиология и антимикробная химиотерапия: № 2, том 5, с. 119–125, 2003 9. Шляпников С.А., Федорова В.В. Использование макролидов при хирургичесаких инфекциях кожи и мягких тканей. МРЖ,2004.–т.12,№4,с204–207 10. Гучев И.А., Сидоренко С.В, Французов В.Н. Рациональная антимикробная химиотерапия инфекций кожи и мягких тканей. Антибиотики и химиотерапия. 2003, т.48, 10, с.25–31 11. Parsad D., Pandhi R., Dogras S. A guide to selection and appropriate use ofmacrolides in skin infection Am J Clin Dermatol 2003; 4:389–97 12. Яковлев С.В., .Ухтин С.А. Азитромицин: основные свойства, оптимизация режимов применения на основе фармакокинетических и параметров. Антибиотики и химиотерапия. 2003 т. 48, №2. – с. 22–27 13. Туровский А.Б,.Колбанова И.Г Макролиды в лечении инфекций дыхательных путей с позиций ЛОР–врача: «за» и «против» Consilium medicum, 2010г.,№4, том.12, с.11–14. 14. Прохорович Е.А. Азитромицин. От клинической фармакологии к клинической практике. РМЖ 2006, том 14, №7, с. 567–572 15. Бердникова Н.Г. Актуальные аспекты применения азитромицина (Азитрал) в терапии внебольничных пневмоний у взрослых. РМЖ 2006, том 14, №22, с. 1625–1628. 16. Хрянин А.А., Решетников О.В. Макролиды в лечении хламидийной инфекции у беременных (эффективность, безопасность, экономичность). РМЖ 2008, том 16, №1, с. 23–27. 17. Серов В.Н., Дубницкая Л.В., Тютюнник В.Л. Воспалительные заболевания органов малого таза: диагностические критерии и принципы лечения. РМЖ 2011, том 19, №1, с. 46–50. 18. Талашова С.В. Некоторые аспекты применения антибактериальных препаратов в педиатрии на примере макролидов. РМЖ 2009, том 17, №7, с. 464–466 19. Мазанкова Л.Н., Ильина Н.О. Место азалидов в педиатрической практике. РМЖ 2008, том 16, №3, с. 121–125. 20. Соловьев А.М., Поздняков О.Л., Терещенко А.В. Почему азитромицин считается препаратом выбора для лечения урогенитальной хламидийной инфекции. РМЖ 2006, том 14, №15, с. 1160–1164. 21. Гуров А.В., Изотова Г.Н., Юшкина М.А. Возможности применения препарата Азитрал в терапии гнойно–воспалительных заболеваний ЛОР–органов. РМЖ 2011, том 19, №6, с. 405. 22. Klani R. Double–blind, double–dummy comparison of azithromycin and cephalexin in the treatmen of skin and skin structure infection. Eur.J. Clin. Microbiol. Infect.Dis. 1999,Oct. 10 (10) – p.880–84
Аминогликозиды
Первое поколение используются в лечении чумы и туберкулеза только в сочетании с тетрациклином. Третье и четвертое при туберкулезе, сепсисе, тяжелых госпитальных инфекциях вроде пневмоний.
К числу антибиотиков этой группы относятся:
1 поколение:
| Представители | Торговое название и способ применения |
| Неомицин | Неомицин: наружный аэрозоль: на пораженные области кожи, хорошо встряхнув и расположив баллон на расстоянии 15-20 см, наносить в течение 3 секунд; нанесение повторять по 1-3 раза в день. |
| Стрептомицин | Стрептомицин: порошок для инъекционного раствора: по 0,5–1,0 гр. х 2 раза в сутки внутримышечно. Для приготовления раствора используют стерильную воду/физиологический растор/0,25%-ный новокаин. Расчет: на 1,0 гр. лекарства – 4 мл растворителя. Стрептомицина сульфат. Субстанция-порошок: для внутримышечного введения – по 0,5-1,0 гр. в сутки. Для внутритрахеального/аэрозольного введения – по 0,5-1,0 гр. х 2-3 раза в 7 дней. |
| Канамицин | Канамицин: порошок для инъекционного раствора: по 1,0-1,5 гр. за 2-3 инъекции внутривенно капельно (разовая доза (0,5 гр.) растворяется в 200 мл 5%-го раствора декстрозы). Канамицина сульфат: для внутримышечного введения 0,5 гр./1,0 гр. растворить в 2/4 мл стерильной воды или в 0,25%*ном новокаине. Для внутривенного введение 0,5 гр. растворить в 200 мл физиологического раствора или в 5%-ном растворе глюкозы. |
2 поколение:
| Представители | Торговое название и способ применения |
| Тобрамицин | Тобрекс: капли для глаз: по 1-2 капли, оттянув нижнее веко, каждые 4 часа; при тяжелых инфекциях глаз – по 2 капли каждый час. Тобрисс: капли для глаз: по 1 капле, оттянув нижнее веко, 2 раза в сутки (утром и вечером); при тяжелых инфекциях глаз – по 1 капле х 4 раза в день. Брамитоб: раствор для ингаляций: по 1 ампуле лекарства (0,3 гр.) каждые 12 часов, вводить ингаляционно при помощи небулайзера, курс 28 дней. |
| Гентамицин | Гентамицин: раствор для инъекций: по 0,003-0,005 гр. на 1 кг массы за 2-4 инъекции, вводить внутривенно/внутримышечно. Капли для глаз: по 1-2 капли каждые 1-4 часа, отодвинув нижнее веко. Мазь: на пораженные области кожи по 3-4 нанесения в день. Гентамицина сульфат: порошок до 1,2 мг на 1 кг массы в сутки за 2-3 инъекции (мочевые инфекции); 2,4-3,3 мг на 1 кг массы в сутки за 2-3 инъекции (тяжелые инфекции, сепсис). Вводить лекарство внутримышечно/внутривенно капельно. |
3 поколение:
| Представители | Торговое название и способ применения |
| Фрамицетин | Изофра: спрей для носа: по 1 впрыскиванию в каждый носовой ход х 4-6 раз в день, курс не более 10 суток. |
| Спектиномицин | Кирин: порошок для изготовления суспензии: по 2,0 гр. (5 мл)/4,0 гр. (10 мл) глубоко внутримышечно в верхненаружную часть ягодицы. Для приготовления суспензии нужно добавит 3,2 мл стерильной воды во флакон. Суспензия для разового приема, хранить запрещено. |
| Амикацин | Амикацин: раствор для инфузий: по 0,01-0,015 гр. на 1 кг массы тела в сутки за 2-3 инъекции, вводить внутримышечно/внутривенно (струйно, капельно). Амикацина сульфат: субстанция-порошок: по 0,005 гр. на 1 кг массы каждые 8 часов либо по 0,0075 гр. на 1 кг массы каждые 12 часов, вводить внутримышечно/внутривенно. |
| Нетилмицин | Неттацин: капли для глаз: по 1-2 капли, оттянув нижнее веко, 3 раза в день. Веро-Нетилмицин: раствор для инъекций: по 4-6 мг на 1 кг массы в сутки внутривенно/внутримышечно; при тяжелых инфекциях суточная доза может быть повышена до 7,5 мг на 1 кг. |
АНТИБИОТИКИ РАЗНЫХ ГРУПП
СОВРЕМЕННАЯ АНТИМИКРОБНАЯ ХИМИОТЕРАПИЯ
СОВРЕМЕННАЯ АНТИМИКРОБНАЯ ХИМИОТЕРАПИЯ
Л.С. Страчунский, С.Н. Козлов. Руководство для врачей
| Содержание | ANTIBIOTIC.ru |
Антибактериальные препараты
- Фузидиевая кислота
- Хлорамфеникол
- Рифампицин
- Фосфомицин трометамол
- Спектиномицин
- Мупироцин
- Диоксидин
ФУЗИДИЕВАЯ КИСЛОТА
Фузидин, Фуцидин
Фузидиевая кислота и ее соли обладают бактериостатическим действием и имеют узкий спектр активности. Их главное клиническое значение заключается в действии на стафилококки.
Спектр активности
| Грам(+) кокки: | стафилококки, включая PRSA и многие MRSA. |
| Анаэробы: | С.difficile. |
Не действует на стрептококки, включая пневмококки (!), и энтерококки. К фузидиевой кислоте быстро развивается устойчивость.
Фармакокинетика
Хорошо всасывается в ЖКТ, биодоступность при приеме натощак составляет 90%. Накапливается в костях, суставах. Не проникает через ГЭБ. Выводится в основном через ЖКТ. Т1/2 — 9-14 ч.
Нежелательные реакции
- Диспептические и диспепсические явления.
- Гепатотоксичность (повышение активности трансаминаз, желтуха). Факторы риска:
длительное применение (особенно внутривенно), исходная патология печени. - Флебиты (при внутривенном введении).
Показания
- Стафилококковые инфекции при аллергии или устойчивости к β-лактамам (как правило, в сочетании с рифампицином, эритромицином, линкосамидами).
- C.difficile
-ассоциированная диарея, псевдомембранозный колит (как препарат резерва).
Дозировка
Взрослые
Внутрь — по 0,5-1,0 г каждые 8 ч за 1 ч до еды; внутривенно капельно (в течение 2 ч) по 0,5 г каждые 8 ч.
Дети
Внутрь — 30-60 мг/кг/сут в 3 приёма; внутривенно капельно 20 мг/кг/сут в 3 введения.
Формы выпуска
Таблетки по 0,125 г и 0,25 г; гранулы для приготовления суспензии; флаконы по 0,25 г и 0,5 г порошка для приготовления раствора для инфузий (в виде диэтаноламиновой соли); мазь, 2%; крем, 2%; глазные капли, 1% («Фуциталмик»).
Входит в состав комбинированных препаратов «Фуцидин-Н крем» (в 1 г — 20 мг фузидиевой кислоты, 10 мл гидрокортизона ацетата), «Фуцикорт крем» (в 1 г — 20 мг фузидиевой кислоты, 1 мг бетаметазона валерата).
ХЛОРАМФЕНИКОЛ
Левомицетин
Имеет широкий спектр активности. На пневмококк, менингококк и гемофильную палочку действует бактерицидно, на другую чувствительную микрофлору бактериостатически.
Применяется ограниченно из-за тяжелых нежелательных реакций и вторичной резистентности многих возбудителей.
Спектр активности
| Грам(+) кокки: | стрептококки, включая S.pneumoniae (пенициллинорезистентные пневмококки, как правило, устойчивы); стафилококки (однако многие штаммы устойчивы); энтерококки. |
| Грам(-) кокки: | менингококки, гонококки, М.catarrhalis . |
| Грам(-) палочки: | H.influenzae (включая ампициллинорезистентные штаммы), кишечная палочка, сальмонеллы, шигеллы, бруцеллы, иерсинии. Следует учитывать, что в России 50-90% шигелл и более 10% сальмонелл устойчивы. |
| Анаэробы: | клостридии, анаэробные кокки, бактероиды (включая полирезистентные B.fragilis ). |
| Риккетсии. |
Фармакокинетика
Хорошо всасывается в ЖКТ, биодоступность составляет 70-80% и не зависит от пищи. Хорошо распределяется в организме: проникает через ГЭБ, ГОБ, создает высокие концентрации в ткани мозга, бронхиальном секрете, желчи. Метаболизируется в печени. Выделяется через почки преимущественно в неактивном состоянии, поэтому при почечной недостаточности дозу можно не снижать. Т1/2 у взрослых — 1,5-3,5 ч, у детей — 3-6,5 ч.
Внутрь хлорамфеникол применяется в виде основания, парентерально — в виде неактивного сукцината, активация которого происходит после отщепления остатка янтарной кислоты, но до этого значительная часть препарата может выделиться из организма. Поэтому внутривенно вводятся более высокие дозы, чем внутрь, а внутримышечное введение нерационально из-за непредсказуемости фармакокинетики.
Нежелательные реакции
- Гематотоксичность:
а) обратимая
— ретикулоцитопения, тромбоцитопения, анемия, зависящие от суточной и курсовой дозы; б)
необратимая
— апластическая анемия с почти 100% летальным исходом, которая встречается редко (1 случай на 10-40 тыс пациентов), может развиваться через 6-8 недель после отмены препарата, после однократного и даже местного приёма.
Показания
Учитывая высокую частоту и опасность нежелательных реакций, при всех приведенных ниже показаниях хлорамфеникол рассматривается как резервный антибиотик.
- Бактериальный менингит.
- Абсцесс мозга.
- Интраабдоминальные и тазовые инфекции.
- Генерализованные формы сальмонеллеза.
- Брюшной тиф.
- Риккетсиозы.
- Газовая гангрена.
Предупреждение
Для раннего выявления гематотоксичности необходимо каждые 3 дня проводить клинический анализ крови с определением ретикулоцитов и тромбоцитов.
Дозировка
Взрослые
Внутрь и парентерально — 50-75 мг/кг/сут в 4 приёма (введения) независимо от еды.
Дети
Первая неделя жизни — 25 мг/кг/сут в 1 введение, 2-4 неделя — 25-50 мг/кг/сут в 1-2 введения, старше 4 недель — 25-50 мг/кг/сут в 2-3 введения. Детям старше 1 года — 50-75 мг/кг/сут в 4 введения.
Формы выпуска
Таблетки по 0,25 г и 0,5 г; капсулы по 0,1 г, 0,25 г и 0,5 г; 0,25% глазные капли; флаконы по 0,5 г и 1,0 г порошка для приготовления раствора для инфузий.
РИФАМПИЦИН*
Римактан
Полусинтетический бактерицидный антибиотик, обладающий широким спектром активности.
Спектр активности
| Микобактерии: | M.tuberculoisis, M.leprae , «атипичные» микобактерии ( M.avium, M.kansasii, M.marinum и др.). |
| Грам(+) кокки: | стрептококки, включая многие пенициллинорезистентные пневмококки; стафилококки, включая PRSA и многие MRSA. Энтерококки устойчивы. |
| Грам(-) кокки: | гонококки, менингококки. |
| Грам(-) палочки: | Н.influenzae (включая штаммы, устойчивые к ампициллину и хлорамфениколу), легионеллы, F.tularensis . Бактерии кишечной группы ( E.coli , сальмонеллы и др.) малочувствительны. |
Анаэробы устойчивы.
Фармакокинетика
Хорошо всасывается в ЖКТ, биодоступность при приеме натощак составляет 95%, но снижается в присутствии пищи. Проникает в различные жидкости и ткани, проходит через ГЭБ. Метаболизируется в печени. Выделяется с желчью и мочой, частично со слюной и слезной жидкостью. T1/2 — 1-4 ч, при почечной недостаточности не изменяется.
Нежелательные реакции
Малые:
- диспептические и диспепсические явления;
- окрашивание мочи, слюны и слезной жидкости в оранжево-красный цвет.
Большие:
- гепатотоксичность (вплоть до развития гепатита);
- гематотоксичность: тромбоцитопения, гемолитическая анемия;
- гриппоподобный синдром (лихорадка, артралгия, миалгия). Чаще развивается при возобновлении приёма препарата после перерыва в лечении.
Лекарственные взаимодействия
Рифампицин является индуктором микросомальных ферментов печени, поэтому он усиливает метаболизм многих препаратов: сердечных гликозидов, теофиллина, глюкокортикоидов, оральных контрацептивов и др., что может привести к снижению их терапевтического эффекта.
Показания
- Основное — туберкулёз, при котором рифампицин применяется обязательно в сочетании с изониазидом и другими противотуберкулёзными препаратами.
- Профилактика и лечение атипичных микобактериозов у ВИЧ-инфицированных пациентов (в сочетании с азитромицином, кларитромицином и др.).
- Лепра.
- Легионеллез (в сочетании с эритромицином).
- Стафилококковые инфекции, вызванные MRSA (в сочетании с ванкомицином, ко-тримоксазолом, фузидиевой кислотой, фторхинолонами).
Дозировка
Взрослые
Внутрь — 0,45-0,6 г/сут в 1-2 приёма за 1 ч до еды; при туберкулёзе — 10-20 мг/сут в один прием (не более 0,6 г/сут). Внутривенно капельно — 0,45-0,6 г/сут в одно введение в течение 3 ч. При стафилококковой (MRSA) инфекции по 0,45 г 2 раза в сутки, внутрь или внутривенно.
Дети
Внутрь — 10-20 мг/кг/сут (не более 0,6 г/сут) в 1-2 приёма; внутривенно капельно — 10-20 мг/кг/сут в одно введение.
Формы выпуска
Капсулы по 0,15 г, 0,3 г и 0,45 г; таблетки по 0,15 г, 0,3 г, 0,45 г и 0,6 г; флаконы по 0,15 г и 0,6 г порошка для приготовления раствора для инфузий.
* В США известен под генерическим названием рифампин.
ФОСФОМИЦИН ТРОМЕТАМОЛ
Монурал
Бактерицидный антибиотик с преимущественной активностью в отношении грамотрицательной флоры.
Спектр активности
| Грам(-) палочки: | E.coli , протеи и некоторые другие, включая полирезистентные штаммы. |
| Грам(+) кокки: | умеренно чувствительны стафилококки. |
Устойчивы стрептококки, энтерококки, Р.aeruginosa
и анаэробы.
Фармакокинетика
Биодоступность при приеме внутрь натощак составляет 60%. Хорошо распределяется в организме, проникая в различные органы и ткани. Высокие концентрации отмечаются в почках. Выводится в неизмененном виде с мочой. T1/2 — 4 ч.
Нежелательные реакции
- Диспептические явления, диарея (редко).
- Головная боль, головокружение.
Показания
- Цистит (острый и рецидивирующий).
- Бактериурия у беременных.
Дозировка
Взрослые
Внутрь — при остром цистите 3,0 г однократно; при рецидивирующем — две дозы по 3,0 г через 24 ч.
Дети старше 5 лет
Внутрь — 2,0 г однократно.
Форма выпуска
Гранулы в пакетиках по 3,0 г.
СПЕКТИНОМИЦИН
Тробицин
Имеет структурное сходство с аминогликозидами, является аминоциклитолом. Обладает бактериостатическим эффектом и узким спектром активности. Основное клиническое значение имеет активность против N.gonorrhoeae
. Чаще всего используется при аллергии на β-лактамы.
Спектр активности
N.gonorrhoeae
, включая пенициллиноустойчивые штаммы.
Фармакокинетика
Хорошо всасывается при внутримышечном введении. Плохо проходит через тканевые барьеры. Не метаболизируется, выводится почками в неизмененном виде. Т1/2 — 2-3 ч.
Нежелательные реакции
В целом хорошо переносится. В отличие от аминогликозидов не обладает нефротоксичностью и ототоксичностью. Иногда отмечаются сыпь, крапивница, лихорадка, головокружение, тошнота, инфильтраты в месте инъекции.
Показания
- Острый неосложнённый гонорейный уретрит, цервицит, проктит.
- Диссеминированная гонорея.
Предупреждение
Не следует использовать спектиномицин при гонорейном фарингите, так как он не создает адекватных концентраций в слюне.
Дозировка
Взрослые
Внутримышечно: при уретрите, цервиците, проктите — 2,0 г однократно; при диссеминированной инфекции — по 2,0 г каждые 12 ч в течение 3 дней.
Форма выпуска
Флаконы по 2,0 г порошка для приготовления раствора для инъекций с приложением растворителя.
МУПИРОЦИН
Бактробан
Препарат природного происхождения, проявляющий в зависимости от концентрации бактериостатическое или бактерицидное действие. Предназначен для местного применения. Наиболее важная отличительная черта мупироцина — высокая активность против стафилококков, включая штаммы, резистентные к пенициллину, аминогликозидам, макролидам, линкосамидам, в том числе MRSA. Практически не влияет на нормальную микрофлору кожи.
Спектр активности
| Грам(+) кокки: | S.aureus (влючая MRSA), коагулазонегативные стафилококки; стрептококки групп A, B, C, G. |
| Грам(-) палочки: | E.coli, P.multocida. |
Не действует на энтерококки, грамположительные палочки, большинство энтеробактерий, P.aeruginosa
, анаэробы
Фармакокинетика
Всасывание через неповрежденную кожу составляет не более 0,25%, при повреждениях кожи усиливается. Может подвергаться медленной частичной инактивации в кожи. Из-за высокой степени связывания с белками активность снижается в присутствии сыворотки крови.
Нежелательные реакции
- Местные — зуд, жжение, сыпь (особенно при нанесении на поврежденную кожу и слизистые оболочки).
- При интраназальном применении иногда отмечается изменение вкуса.
Показания
- Инфекции кожи — фурункулез, фолликулит, целлюлит, импетиго (включая буллезные формы), рожа, трофические язвы, инфицированные дерматозы (в том числе инфицированная экзема), инфицированные раны, ссадины, ожоги.
- Наружный отит (кроме злокачественного).
- Санация носителей MRSA.
Предупреждения
- Избегать попадания мази в глаза. Нельзя использовать дерматологическую мазь интраназально.
- С осторожностью применять у пациентов с почечной патологией, так как пропиленгликоль, входящий в мазевую основу, может всасываться через кожу и оказывать нефротоксический эффект.
- Не следует применять при беременности ввиду отсутствия данных о безопасности.
Дозировка
Взрослые и дети
Дерматологическая мазь наносится на пораженные участки кожи 2-3 раза вдень. Назальная мазь в количестве равном размеру спичечной головки вводится в обе половины носа 2-3 раза в день в течение 5-7 дней.
Формы выпуска
Мазь дерматологическая, 2%; мазь назальная, 2%.
ДИОКСИДИН
Синтетический препарат, оказывающий бактерицидное действие и обладающим широким антимикробным спектром. В связи с высокой токсичностью предназначен главным образом для местного применения.
По мнению некоторых российских клиницистов, при тяжелых инфекциях может быть использован системно в качестве препарата резерва, поскольку он действует на полирезистентные микроорганизмы. Однако контролируемых клинических исследований диоксидина не проводилось; критерии оценки чувствительности микрофлоры отсутствуют.
Фармакокинетика
При внутривенном введении проникает в различные ткани и жидкости. Не метаболизируется, выводится почками. Хорошо всасывается через раневую поверхность при местном применении. Количественные параметры (Т1/2 и др.) не установлены.
Нежелательные реакции
- Острые реакции (в момент введения) — лихорадка, озноб, головная боль, тремор. Меры профилактики:
медленное введение, премедикация антигистаминными препаратами. - Дистрофия и деструкция надпочечников (дозозависимая) с развитием острой надпочечниковой недостаточности.
- Эмбриотоксическое, тератогенное и мутагенное действие.
Показания
Местно
— орошение инфицированных ран, промывание полостей, инстилляции в мочевой пузырь.
Внутривенно
— тяжёлые инфекции (сепсис, перитонит и др.), но только по жизненным показаниям при отсутствии других, менее токсичных антибиотиков.
Противопоказания
- Детский возраст.
- Надпочечниковая недостаточность.
Дозировка
Взрослые
Внутривенно медленно — 10 мг/кг/сут в 2-3 введения.
В полости — 10-50 мл 1% раствора 1-2 раза в сутки (не более 70 мл в сутки).
Формы выпуска
Ампулы по 10 мл и 20 мл 0,5% раствора для внутривенного введения; ампулы по 10 мл 1% раствора для местного и внутриполостного применения; мазь, 5%.
| Copyright © 2000-2007 ANTIBIOTIC.ru Размещено: 15.05.2004 |
Адрес этой страницы: https://www.antibiotic.ru/books/mach/mac0113.shtml
Дата последнего изменения: 24.05.2004 18:56
Карбапенемы
С карбапенемами, как правило, мы сталкиваемся крайне редко или не сталкиваемся вовсе. И это замечательно — ведь эти антибиотики показаны для лечения тяжелейших госпитальных инфекций, угрожающих жизни. Спектр действия карабапенемов включает большинство существующих патологических штаммов, включая устойчивые.
К числу антибиотиков этой группы относятся:
| Представители | Торговое название и способ применения |
| Дорипенем | Дорипрекс: порошок для инъекционного раствора: по 0,5 гр. внутривенно каждые 8 часов. Для изготовления раствора порошок нужно растворить в 10 мл изотонического раствора хлорида натрия, полученную смесь добавить в пакет со 100 мл изотонического раствора хлорида натрия либо 5%-го раствора глюкозы. |
| Эртапенем | Инванз: лиофилизат для инъекционного раствора: по 1,0 гр. в сутки, вводить за 1 инъекцию внутривенно/внутримышечно. |
| Меропенем | Меронем: порошок для инъекционного раствора:
Лекарство вводят внутривенно медленно (в течение 5 минут; раствор готовят, добавляя 5 мл стерильной воды на 250 мг препарата) либо внутривенно капельно (в течение 15-30 минут; раствор готовят, добавляя 50-200 мл изотонического хлорида натрия). Меропенем: порошок для инъекционного раствора:
|
| Имипенем + циластатин | Циласпен: порошок для инъекционного раствора: способ изготовления раствора и применения аналогичен вышеуказанному. Тиепенем: порошок для инъекционного раствора: по 1,0-2.0 гр. в сутки, вводить за 3-4 инфузии внутривенно капельно. Для изготовления раствора нужно добавить изотонический хлорид натрия во флакон в соотношении 100 мл хлорида натрия на 0,5 гр. препарата, встряхнуть до полной однородности. Цилапенем: порошок для инъекционного раствора: по 1,0-2.0 гр. в сутки, вводить за 3-4 инфузии внутривенно капельно. Для изготовления раствора нужно добавить 100 мл изотонического хлорида натрия во флакон и встряхнуть до однородности. Тиенам: порошок для инъекционного раствора: по 2,0 гр. в сутки, вводить за 4 инъекции внутривенно/внутримышечно. |
Пенициллины
С открытием антибиотика именно этой группы — Бензилпенициллина — врачи поняли, что микробы можно победить. Несмотря на свой почтенный возраст Бензилпенициллин применяется до сих пор, а в некоторых случаях является препаратом первой линии. Однако к средствам широкого спектра действия относятся другие, более новые пенициллиновые антибиотики, которые можно разделить на несколько групп.
| Представители | Торговое название и способ применения |
| Ампициллин | Ампициллин:
|
| Амоксициллин + клавулановая кислота | Амоксиклав: таблетки: 1 таблетка (250+125 мг) трижды в день либо 1 таблетка (500+125 мг) дважды в день; принимать во время еды, курс приема в течение 2-ух недель. Порошок для суспензии: для расчета дозы лекарства воспользоваться приложенными таблицами. Аугментин: таблетки: 1 таблетка (250+125 мг) трижды в день, курс приема в течение 2-ух недель. Порошок для суспензии: во флакон с порошком добавить 60 мл чистой воды комнатной температуры, подождать 5 минут, долить объем воды до метки на флаконе, перемешать. Флемоклав Солютаб: таблетки: 1 таблетка (500+125 мг) трижды в день либо 1 таблетка (875+125 мг) дважды в день; не разжевывать, принимать в начале еды, курс приема в течение 2-ух недель. |
| Амоксициллин | Флемоксин Солютаб: таблетки: по 0,5 гр. дважды в сутки, курс приема в течение 2-ух недель. Амоксициллин: таблетки: по 0,5 гр. дважды в сутки, курс приема в течение 2-ух недель. Амосин: капсулы: аналогичный режим и длительность приема. Порошок для суспензии: порошок из пакетика высыпать в стакан с теплой чистой водой, перемешать. |
Фторхинолоны
Наверное, ни один врач не сможет представить свою лечебную практику без фторхинолоновых антибиотиков. Первые синтезированные представители этой группы отличались узким спектром действия. С развитием фармацевтики открывались все новые поколения фторхинолоновых антибактериальных средств и расширялся спектр их активности.
К числу антибиотиков этой группы относятся:
| Представители | Торговое название и способ применения |
| Спарфлоксацин | Спарфло: таблетки: 0,1-0,4 гр. в сутки (в зависимости от вида и тяжести инфекции). |
| Гатифлоксацин | Гатиспан: таблетки: 0,4 гр. х 1 раз в сутки, не разжевывая, курс 10 дней. |
| Моксифлоксацин | Мофлаксия: таблетки: 0,4 гр. х 1 раз в сутки, не разжевывая, курс 14 дней. Авелокс: таблетки: 0,4 гр. х 1 раз в сутки, не разжевывая, курс 14 дней. |
| Левофлоксацин | Таваник: таблетки: 0,25 гр. (2 таблетки) дважды в день либо 0,5 гр. (1 таблетка) 1 раз в день, запивая водой, курс 14 дней. Флорацид: таблетки: 0,5 гр. дважды в сутки, не разжевывая. |
Антибиотики при ангине, бронхите и кашле
Воспалительные заболевания верхних дыхательных путей – одни из наиболее часто встречаемых в клинической практике. Таким болезням, как ангина и бронхит, подвержены как дети, так и взрослые. Иногда эти патологические состояния могут вызываться вирусами, однако нередко присоединяется и бактериальная инфекция. В этом случае, необходимо применять антибактериальные препараты (антибиотики). Следует напомнить, что антибиотикотерапия должна проводиться только после полного обследования пациента, постановки диагноза и проверки чувствительности флоры к тому или иному антибиотику.
Для лечения этих заболеваний могут быть назначены следующие препараты:
| Название и группа препарата | Дозировка |
| Флемоксин Солютаб. Пенициллиновая группа, действующее вещество – Амоксициллин. |
|
| Сумамед. Группа макролидов, действующее вещество – Азитромицин. |
|
| Гатиспан. Группа фторхинолонов, действующее вещество – Гатифлоксацин. | 1 таблетка 400 мг в сутки. |
| Авелокс. Группа фторхинолонов, действующее вещество – Моксифлоксацин. | 1 таблетка 400 мг в сутки. |
| Рулид. Группа макролидов, действующее вещество – Рокситромицин. | Взрослым и детям массой свыше 40 кг – 2 таблетки 150 мг 1-2 раза в день. В остальных случаях дозировка рассчитывается индивидуально. |
| АзитРус. Группа макролидов, действующее вещество – Азитромицин. | Взрослым и детям старше 12 лет – 1 капсула или таблетка 500 мг в сутки. Детям старше 3 лет – 10 мг на 1 кг веса в сутки. |
О присоединении бактериальной инфекции могут свидетельствовать резкое повышение температуры тела, нарастание признаков общей интоксикации (слабости, головной и мышечной боли, головокружения), кашель с отхождением гнойной мокроты.
Нужно ли принимать антибиотик при ОРВИ?
Антибиотики НЕ назначаются для лечения ОРВИ, так как они неэффективны в борьбе с вирусами. Однако при неправильном лечении простуды и гриппа, к вирусу может присоединиться бактериальная инфекция и вызвать осложнения (синусит, отит, пневмонию и др). В этом случае прием антибиотиков станет необходимостью. Однако врач не станет назначать антибиотики заранее для профилактики осложнений, так как существует риск присоединения других микроорганизмов, и возникнет необходимость приема еще одного антибиотика.
Принципы подбора лучших антибиотиков для детей
Для того чтобы антибиотики были максимально эффективными, безопасными и не давали побочных эффектов, важно соблюдать в их назначении определенные принципы и правила.
Тогда антибиотики, подобранные врачом, будут лучшими в лечении патологии:
- назначаются антибиотики только при доказанной микробной инфекции или при высоких шансах на ее развитие, при осложненных формах патологий, когда высоки риски неблагоприятных исходов болезни
- препараты подбираются по наиболее вероятным в данном регионе и для данного возраста возбудителям, данным по их резистентности к определенным средствам
- важно учитывать предыдущие эпизоды лечения антибиотиками, если они проводились в предыдущие три месяца, чтобы исключить носительство резистентных штаммов
- при назначении препаратов в поликлинической практике применимы только пероральные формы, только по особым показаниям назначают инъекции.
Запрещены к приему в условиях домашнего лечения препараты, обладающие потенциально токсичными эффектами – группа аминогликозидов, хлорамфеникол, фторхинолоновые препараты и бисептол. При подборе антибиотиков для сложных клинических ситуаций также важно учитывать ограничения возраста – например, для тетрациклинов, допустимых только с 12-ти лет, так ка более ранние сроки их приема грозят серьезными последствиями для здоровья.
Возможные осложнения
При всех преимуществах, которые дает широкой спектр действия антибиотиков, такие медикаменты нельзя считать панацеей. Их бесконтрольное применение может сказываться на здоровье.
В частности, возникают следующие осложнения:
- По некоторым данным, дети, которые в первый год жизни принимали антибиотики широкого спектра, больше подвержены развитию астмы.
- Неправильное применение антибиотиков может приводить к понижению чувствительности к препаратам. Часто это наблюдается у людей, которые не прошли полный курс терапии, а прекратили лечение до указанного врачом срока. В таком случае антибиотик успел убить только слабые и чувствительные бактерии. Оставшиеся же начинают размножаться, вызывают новый виток болезни, но уже не поддаются лечению первоначальным антибиотиком.
- Длительное применение некоторых препаратов приводит к серьезным осложнениям. Пенициллины могут оказать токсическое действие на ЦНС, а стрептомицин — поразить слуховой нерв.
- Уничтожение полезной микрофлоры и последующие проблемы со стороны желудочно-кишечного тракта. Антибиотики широко спектра действия уничтожают все бактерии, в том числе и необходимые нам. Поэтому часто вместе с ними выписываются пробиотики или пребиотки, которые помогают сохранить состояние кишечника в норме.
Поэтому универсальный спектр действия антибиотиков — вовсе не повод лечиться ими самостоятельно. Только врач может подобрать подходящий препарат, прописать дозы, назначить продолжительность курса. И, конечно же, именно специалист определяет целесообразность приема антибиотиков как таковых.
Антимикробные средства. Классификация антимикробных препаратов
По спектру активности антимикробные препараты делятся на: антибактериальные, антигрибковые и антипротозойные. Кроме того, все антимикробные средства делят на препараты узкого и широкого спектра действия.
К препаратам узкого спектра действия преимущественно на грамположительные микроорганизмы относятся, например, природные пенициллины, макролиды, линкомицин, фузидин, оксациллин, ванкомицин, цефалоспорины I поколения. К препаратам узкого спектра действия преимущественно на грамотрицательные палочки относятся полимиксины и монобактамы. К препаратам широкого спектра действия относятся тетрациклины, левомицетин, аминогликозиды, большинство полусинтетических пенициллинов, цефалоспорины начиная со 2 поколения, карбопенемы, фторхинолоны. Узкий спектр имеют антигрибковые препараты нистатин и леворин (только против кандиды), а широкий – клотримазол, миконазол, амфотерицин В.
По типу взаимодействия с микробной клеткой антимикробные препараты делятся на:
· бактерицидные – необратимо нарушают функции микробной клетки либо ее целостность, вызывая немедленную гибель микроорганизма, применяются при тяжелых инфекциях и у ослабленных больных,
· бактериостатические – обратимо блокируют репликацию или деление клетки, применяются при нетяжелых инфекциях у неослабленных больных.
По кислотоустойчивости антимикробные препараты классифицируются на:
· кислотоустойчивые – могут применяться перорально, например, феноксиметилпенициллин,
· кислотонеустойчивые – предназначены только для парентерального применения, например, бензилпенициллин.
В настоящее время используются следующие основные группы антимикробных препаратов для системного применения.
¨ Лактамные антибиотики
Лактамные антибиотики (табл. 9.2) из всех антимикробных препаратов наименее токсичны, так как, нарушая синтез клеточной стенки бактерий, не имеют мишени в организме человека. Их применение при наличии чувствительности к ним возбудителей является предпочтительным. Наиболее широкий спектр действия среди лактамных антибиотиков имеют карбапенемы, они используются как препараты резерва – только при инфекциях, резистентных к пенициллинам и цефалоспоринам, а также при госпитальных и полимикробных инфекциях.
¨ Антибиотики других групп
Антибиотики других групп (табл. 9.3) имеют различные механизмы действия. Бактериостатические препараты нарушают этапы синтеза белка на рибосомах, бактерицидные – нарушают либо целостность цитоплазматической мембраны, либо процесс синтеза ДНК и РНК. В любом случае они имеют мишень в организме человека, поэтому по сравнению с лактамными препаратами более токсичны, и должны использоваться только при невозможности применения последних.
¨ Синтетические антибактериальные препараты
Синтетические антибактериальные препараты (табл. 9.4) также имеют различные механизмы действия: ингибирование ДНК-гиразы, нарушение включения ПАБК в ДГФК и т.д. Также рекомендуются к применению при невозможности использования лактамных антибиотиков.
¨ Побочные эффекты антимикробных препаратов,
их профилактика и лечение
Антимикробные препараты обладают целым рядом разнообразных побочных эффектов, некоторые из которых могут привести к тяжелым осложнениям и даже к летальному исходу.
Аллергические реакции
Аллергические реакции могут иметь место при применении любого антимикробного препарата. Могут развиться аллергический дерматит, бронхоспазм, ринит, артрит, отек Квинке, анафилактический шок, васкулит, нефрит, волчаночноподобный синдром. Чаще всего они наблюдаются при применении пенициллинов и сульфаниламидов. У некоторых пациентов развивается перекрестная аллергия на пенициллины и цефалоспорины. Зачастую отмечаются аллергии на ванкомицин и сульфаниламиды. Очень редко дают аллергические реакции аминогликозиды и левомицетин.
Профилактике способствует тщательный сбор аллергологического анамнеза. Если пациент не может указать, на какие именно антибактериальные препараты в у него наблюдались аллергические реакции, перед введением антибиотиков необходимо выполнение проб. Развитие аллергии независимо от тяжести реакции требует немедленной отмены вызвавшего ее препарата. В последующем введение даже сходных по химической структуре антибиотиков (например, цефалоспоринов при аллергии на пенициллин) допускается только в случаях крайней необходимости. Лечение инфекции должно быть продолжено препаратами других групп. При тяжелых аллергических реакциях требуется внутривенное введение преднизолона и симпатомиметиков, инфузионная терапия. В нетяжелых случаях назначаются антигистаминные препараты.
Раздражающее действие на путях введения
При пероральном применении раздражающее действие может выражаться в диспепсических явлениях, при внутривенном введении – в развитии флебитов. Тромбофлебиты чаще всего вызывают цефалоспорины и гликопептиды.
Суперинфекция, в том числе дисбактериоз
Вероятность дисбактериоза зависит от широты спектра действия препарата. Наиболее часто возникающий кандидомикоз развивается при применении препаратов узкого спектра через неделю, при применении препаратов широкого спектра – уже от одной таблетки. Однако цефалоспорины относительно редко дают грибковую суперинфекцию. На 1 месте по частоте и тяжести вызываемого дисбактериоза находится линкомицин. Нарушения флоры при его применении могут принять характер псевдомембранозного колита – тяжелого заболевания кишечника, вызываемого клостридиями, сопровождающегося диареей, дегидратацией, электролитными нарушениями, и в отдельных случаях осложняющегося перфорацией толстой кишки. Гликопептиды тоже могут вызвать псевдомембранозный колит. Часто вызывают дисбактериоз тетрациклины, фторхинолоны, левомицетин.
Дисбактериоз требует отмены применявшегося препарата и длительного лечения эубиотиками после предварительной антимикробной терапии, которая проводится по результатам чувствительности микроорганизма, вызвавшего воспалительный процесс в кишечнике. Применяемые для лечения дисбактериоза антибиотики не должны оказывать влияния на нормальную кишечную аутофлору – бифидо- и лактобактерии. Однако при лечении псевдомембранозного колита используется метронидазол или, как альтернатива, ванкомицин. Необходима также коррекция водно-электролитных нарушений.
Нарушение толерантности к алкоголю — свойственно всем лактамным антибиотикам, метронидазолу, левомицетину. Проявляется появлением при одновременном употреблении алкоголя тошноты, рвоты, головокружения, тремора, потливости и падения артериального давления. Пациенты должны быть предупреждены о недопустимости приема алкоголя на весь период лечения антимикробным препаратом.
Органоспецифичные побочные эффекты для различных групп препаратов:
· Поражение системы крови и кроветворения – присущи левомицетину, реже линкосомидам, цефалоспоринам 1 поколения, сульфаниламидам, производным нитрофурана, фторхинолонам, гликопептидам. Проявляется апластической анемией, лейкопенией, тромбицитопенией. Необходима отмена препарата, в тяжелых случаях заместительная терапия. Геморрагический синдром может развиться при применении цефалоспоринов 2-3 поколения, нарушающих всасывание витамина К в кишечнике, антисинегнойных пенициллинов, нарушающих функции тромбоцитов, метронидазола, вытесняющего кумариновые антикоагулянты из связей с альбумином. Для лечения и профилактики используются препараты витамина К.
· Поражение печени – присущи тетрациклинам, которые блокируют ферментную систему гепатоцитов, а также оксациллину, азтреонаму, линкозаминам и сульфаниламидам. Холестаз и холестатический гепатит могут вызвать макролиды, цефтриаксон. Клиническими проявлениями служит повышение печеночных ферментов и билирубина в сыворотке крови. При необходимости применения гепатотоксических антимикробных средств более недели необходим лабораторный контроль перечисленных показателей. В случае повышения АСТ, АЛТ, билирубина, щелочной фосфатазы или глутамилтранспептидазы лечение должно быть продолжено препаратами других групп.
· Поражение костей и зубов характерны для тетрациклинов, растущих хрящей – для фторхинолонов.
· Поражение почек присуще аминогликозидам и полимиксинам, которые нарушают функции канальцев, сульфаниламидам, вызывающим кристаллурию, цефалоспоринам поколения, вызывающим альбуминурию, и ванкомицину. Предрасполагающими факторами являются старческий возраст, заболевания почек, гиповолемия и гипотензия. Поэтому при лечении данными препаратами необходима предварительная коррекция гиповолемии, контроль диуреза, подбор доз с учетом функции почек и массы ткла, Курс лечения должен быть коротким.
· Миокардит – побочный эффект левомицетина.
· Диспепсия, не являющаяся следствием дисбактериоза, характерна при применении макролидов, которые обладают прокинетическими свойствами.
· Различные поражения ЦНС развиваются от многих антимикробных препаратов. Наблюдаются:
— психозы при лечении левомицетином,
— парезы и периферические параличи при применении аминогликозидов и полимиксинов за счет их курареподобного действия (поэтому их нельзя применять одновременно с миорелаксантами),
— головная боль и центральная рвота при использовании сульфаниламидов и нитрофуранов,
— судороги и галлюцинации при использовании аминопенициллинов и цефалоспоринов в высоких дозах, являющиеся результатом антагонизма этих препаратов с ГАМК,
— судороги при применении имипенема,
— возбуждение при использовании фторхинолонов,
— менингизм при лечении тетрациклинами из-за увеличения ими продукции ликвора,
— нарушения зрения при лечении азтреонамом и левомицетином,
— периферическая нейропатия при применении изониазида, метронидазола, левомицетина.
· Поражение слуха и вестибулярные расстройства – побочный эффект аминогликозидов, более свойственный 1 поколению. Так как данный эффект связан с накоплением препаратов, длительность их применения не должна превышать 7 дней. Дополнительными факторами риска являются старческий возраст, почечная недостаточность и одновременное применение петлевых диуретиков. Обратимые изменения слуха вызывает ванкомицин. При появлении жалоб на снижение слуха, головокружение, тошноту, неустойчивость при ходьбе необходима замена антибиотика на препараты других групп.
· Поражения кожи в виде дерматита характерны для левомицетина. Тетрациклины и фторхинолоны вызывают фотосенсибилизацию. При лечении этими препаратами не назначаются физиотерапевтические процедуры, и следует избегать нахождения на солнце.
· Гипофункцию щитовидной железы вызывают сульфаниламиды.
· Тератогенность присуща тетрациклинам, фторхинолонам, сульфаниламидам.
· Возможен паралич дыхательной мускулатуры при быстром внутривенном введении линкомицина и кардиодепрессия при быстром внутривенном введении тетрациклинов.
· Электролитные нарушения вызывают антисинегнойные пенициллины. Особо опасно развитие гипокалиемии при наличии заболеваний сердечно-сосудистой системы. При назначении данных препаратов необходим контроль ЭКГ и электролитов крови. При лечении используют инфузионно-корригирующую терапию и диуретики.
Микробиологическая диагностика
Эффективность микробиологической диагностики, абсолютно необходимой для рационального подбора антимикробной терапии, зависит от соблюдения правил забора, транспортировки и хранения исследуемого материала. Правила забора биологического материала включают:
— взятие материала из области, максимально приближенной к очагу инфекции,
— предотвращение контаминации другой микрофлорой.
Транспортировка материала должна с одной стороны обеспечить жизнеспособность бактерий, а с другой — предотвратить их размножение. Желательно, чтобы материал хранился до начала исследования при комнатной температуре и не более 2 часов. В настоящее время для забора и транспортировки материала используются специальные плотно закрывающиеся стерильные контейнеры и транспортные среды.
В не меньшей степени эффективность микробиологической диагностики зависит от грамотной интерпретации результатов. Считается, что выделение патогенных микроорганизмов даже в малых количествах всегда позволяет отнести их к истинным возбудителям заболевания. Условно патогенный микроорганизм считают возбудителем, если он выделяется из стерильных в норме сред организма или в большом количестве из сред, не характерных для его обитания. В противном случае он является представителем нормальной аутофлоры либо контаминирует исследуемый материал в процессе забора или исследования. Выделение малопатогенных бактерий из нехарактерных для их обитания областей в умеренных количествах свидетельствует о транслокации микроорганизмов, однако не позволяет отнести их к истинным возбудителям заболевания.
Гораздо сложнее бывает интерпретировать результаты микробиологического исследования при высевании нескольких видов микроорганизмов. В таких случаях ориентируются на количественное соотношение потенциальных возбудителей. Чаще значимыми в этиологии данного заболевания бывают 1-2 из них. Следует иметь в виду, что вероятность равной этиологической значимости более чем 3 различных видов микроорганизмов незначительна.
В основе лабораторных тестов на выработку грамотрицательными микроорганизмами БЛРС лежит чувствительность БЛРС к ингибиторам бета-лактамаз, таким как клавулановая кислота, сульбактам и тазобактам. При этом, если микроорганизм семейства энтеробактерий оказывается резистентен к цефалоспоринам 3 поколения, а при добавлении к этим препаратам ингибиторов бета-лактамаз демонстрирует чувствительность, то данный штамм идентифицируется как БЛРС-продуцирующий.
Антибиотикотерапия должна быть направлена только на истинный возбудитель инфекции! Однако в большинстве стационаров микробиологические лаборатории не могут установить этиологию инфекции и чувствительность возбудителей к антимикробным препаратам в день поступления больного, поэтому неизбежным является первичное эмпирическое назначение антибиотиков. При этом учитываются особенности этиологии инфекций различных локализаций, характерные для данного лечебного учреждения. В связи с чем необходимы регулярные микробиологические исследования структуры инфекционных заболеваний и чувствительности их возбудителей к антибактериальным препаратам в каждом стационаре. Анализ результатов такого микробиологического мониторинга необходимо проводить ежемесячно.
Таблица 9.2.
Лактамные антибиотики.
| Группа препаратов | Название | Характеристика препарата | |||||
| Пенициллины | Природные пенициллины | натриевая и калиевая соли бензилпени-циллина | вводятся только парентерально, действуют 3-4 часа | высоко эф-фективны в своем спек-тре действия, но этот спектр узок, кроме того, препараты неустойчивы к лактамазам | |||
| бициллин 1,3,5 | вводятся только пар-ентерально, действуют от 7 до 30 суток | ||||||
| феноксиметилпенициллин | препарат для перорального применения | ||||||
| Антистафило-кокковые | оксациллин, метициллин, клоксациллин, диклоксациллин | имеют меньшую антимикробную ак-тивность, чем природные пеницил-лины, но устойчивы к лактамазам ста-филококков, могут применяться per os | |||||
| Амино-пенициллины | ампициллин, амоксициллин, бакампициллин | препараты широкого спектра действия, могут применяться per os, но неустойчивы к бета-лактамазам | |||||
| Комбиниро-ванные | Ампиокс — ампициллин+ +оксациллин | препарат широкого спектра действия, устойчивый к бета-лактамазам, может применяться per os | |||||
| Антисине-гнойные | карбенициллин, тикарциллин, азлоциллин, пиперациллин, мезлоциллин | имеют широкий спектр действия, дей-ствуют на штаммы синегнойной палоч-ки, не вырабатывающие бета-лактамаз, в процессе лечения возможно быстрое развитие устойчивости к ним бактерий | |||||
| Защищенные от лактамаз — препараты с кла-вулановой кисло-той, тазобакта-мом,сульбактамом | амоксиклав, тазоцин, тиментин, циазин, уназин | препараты являются комбинацией пенициллинов широкого спектра действия и ингибиторов бета-лактамаз, поэтому действуют на штаммы бактерий, вырабатывающие бета-лактамазы | |||||
| Цефалоспорины | 1 поколения | цефазолин | антистафи-лококковый препарат для парентераль-ного прим. | не устойчи-вы к лакта-мазам, име-ют узкий спектр действия | с каждым поколе-нием цефало-споринов расширя-ется их спектр и снижает-ся ток-сичность, цефало-спорины хорошо перено-сятся и занимают первое место по частоте примене-ния в стацио-нарах | ||
| цефалексин и цефаклор | применяются per os | ||||||
| 2 поколения | цефаклор, цефураксим | применяются per os | устойчивы к лактама-зам, спектр включает и грамполо-жительные, и грамотри-цательные бактерии | ||||
| цефамандол, цефокситин, цефуроксим, цефотетан, цефметазол | применяются только паренте-рально | ||||||
| 3 поколения | цефтизоксим, цефотаксим, цефтриаксон, цефтазидим, цефоперазон, цефменоксим | только для парентераль-ного приме-нения, обла-дают антиси-негнойной активностью | устойчивы к лактамазам грамотрица-тельных бактений, не эффектив-ны при стафило-кокковых инфекциях | ||||
| цефиксим, цефтибутен, цефподоксим, цефетамет | применяются per os, обла-дают анти-анаэробной активностью | ||||||
| 4 поколения | цефипим, цефпирон | самый широкий спектр действия, применяются парентерально | |||||
| Цефалоспорины с ингибиторами бета-лактамаз | сульперазон | Имеет спектр действия цефоперазона, но действует и на лактамазо-продуцирующие штаммы | |||||
| Карбапенемы | имипенем и его комбина-ция с цилоста-тином, предо-храняющая от разрушения в почках, — тиенам | Более активен к грамположительным микроорганизмам | имеют самый широкий из лактамных антибиотиков спектр действия, включа-ющий анаэробы и сине-гнойную палочку, и устой-чивы ко всем лактамазам, к ним практически не выра-батывается резистентность, они могут применяться практически при любых возбудителях, исключая метициллинрезистентные штаммы стафилококка, и в виде монотерапии даже при тяжелых инфекциях, обладают эффектом последействия | ||||
| меропенем | Более активен к грамотрицательным микроорганизмам | ||||||
| эртапенем | |||||||
| Моно-бактамы | азтреонам | препарат узкого спектра, действует только на грамотрицательные палочки, но очень эффективен и устойчив ко всем лактамазам | |||||
Таблица 9.3.
Антибиотики других групп.
| Группа препа-ратов | Название | Характеристика препарата | |
| Глико-пептиды | ванкомицин, тейкопламин | имеют узкий грамположительный спектр, но в нем очень эффективны, в частности действуют на метициллинрезистентные стафилококки и на L-формы микроорганизмов | |
| Полимиксины | Это самые токсичные антибиотики, используются только для местного применения, в частности per os, так как они не всасываются в ЖКТ | ||
| Фузидин | низкотоксичный, но и низкоэффективный антибиотик | ||
| Левомицетин | высоко токсичен, в настоящее время используется в основном при менингококковых, глазных и особо опасных инфекциях | ||
| Линкоз-амины | линкомицин, клиндамицин | менее токсичны, действуют на стафилококк и анаэробные кокки, хорошо проникают в кости | |
| Тетра-цик-лины | природные – тетрациклин, полусинтети-ческие – метациклин, синтетические – доксициклин, миноциклин | антибиотики широкого спектра действия, включающего анаэробы и внутриклеточных возбудителей, токсичны | |
| Амино-глико-зиды | 1 поколения: стрептомицинканамицин мономицин | высоко токсичны, ис-пользуются только мест-но для деконтаминации ЖКТ, при туберкулезе | токсичные антибиотики достаточно широкого спектра действия, плохо действуют на грамположительные и анаэробные микроорганизмы, однако усиливают действие на них лактамных антибиотиков, в каждом последующем поколении снижается их токсичность |
| 2 поколения: гентамицин | широко используется при хирургических инфекциях | ||
| 3 поколения: амикацин, сизомицин, нетилмицин, тобрамицин | действуют на некото-рые микроорганизмы, устойчивые к гента-мицину, в отношении синегнойной палочки наиболее эффективным является тобрамицин | ||
| Макро-лиды | природные: эритромицин, олеандомицин | низко токсичные, но и низко эффективные анти-биотики узкого спектра действия, действуют толь-ко на грамположительных кокков и внутрикле-точных возбудителей, могут применяться per os | |
| полусинтети-ческие: рок-ситромицин, кларитроми-цин, флури-тромицин | тоже действуют на внутриклеточных возбудителей, спектр несколько шире, в частности включает геликобактер и моракселлу, хорошо проходят все барьеры в организме, проникают в различные ткани, обладают эффектом последействия до 7 суток | ||
| азолиды: азитромицин (сумамед) | обладают теми же свойствами, что и полусинтетические макролиды | ||
| Рифампицин | используется в основном при туберкулезе | ||
| Противогриб-ковые антиби-отики | флуконазол, амфотерицинВ | амфотерицин В высокотоксичен, используется при отсутствии чувствительности возбудителей к флуконазолу | |
Таблица 9.4.
Синтетические антибактериальные препараты.
| Группа препаратов | Название | Характеристика препарата | ||
| Сульфаниламиды | Резорбтив-ного действия | норсульфазол, стрептоцид, этазол | препараты короткого действия | препараты широкого спектра действия, у возбудителей часто вырабаты-вается перекрестная устойчивость ко всем препаратам этого ряда |
| сульфадиметоксин, сульфапиридазин, сульфален | препараты продолжительного действия | |||
| Действую-щие в просвете кишечника | фталазол, сульгин, салазопиридазин | салазопиридазин – используется при болезни Крона, неспецифическом язвенном колите | ||
| Местного примене-ния | сульфацил-натрий | используется в основном в офтальмологии | ||
| Производные нитрофурана | фурагин, фуразолидон, нитрофурантоин | обладают широким спектром действия, включающим клостридии и простейших, в отличие от большинства антибиотиков не угнетают, а стимулируют иммунитет, применяются местно и per os | ||
| Производные хиноксалина | хиноксидин, диоксидин | обладают широким спектром действия, включающим и анаэробы, диоксидин применяется местно или парентерально | ||
| Производные хинолона | невиграмон, оксолиниевая и пипемидиновая кислота | действуют на группу кишечных грамотрицательных микроорганизмов, используются в основном при уроло-гических инфекциях, к ним быстро развивается резистентность | ||
| Фтор-хинолоны | офлоксацин, ципрофлоксацин, пефлоксацин, ломефлоксацин, спарфлоксацин, левофлоксацин, гатифлоксацин, моксифлоксацин, гемифлоксацин | высокоэффективные препараты широ-кого спектра, действуют на синегнойную палочку и внутриклеточных воз-будителей, на многие штаммы, проду-цирующие лактамазы, хорошо перено-сятся, широко используются в хирургии, наибольшей антисинегнойной активностью обладает ципрофлоксацин, а наибольшей антианаэробной активностью — моксифлоксацин | ||
| Производные 8-оксихинолина | нитроксолин, энтеросептол | действуют на многие микроорганизмы, грибы, простейших, применяются в урологии и при кишечных инфекциях | ||
| Нитроимида-золы | метронидазол, тинидазол | действуют на анаэробные микроорганизмы, простейших | ||
| Специфические противотуберкулезные, противосифилитические, противовирусные, противоопухолевые препараты | применяются преимущественно в специализированных учреждениях | |||
Итог
Антибиотики являются мощными веществами природного, синтетического или полусинтетического происхождения, которые способствуют подавлению роста и жизнедеятельности патогенных микроорганизмов.
Препараты широкого спектра действия эффективны против большинства бактерий одновременно, а их новое поколение наносит минимальный вред организму.
Подбор подходящего лекарства зависит в первую очередь от диагноза, затем от механизма его действия, степени токсического воздействия и фармакокинетических свойств. Самостоятельный выбор и применение антибактериальных препаратов опасен и недопустим.