Фенилкетонурия
(ФКУ) ― наследственное нарушение метаболизма аминокислот, в первую очередь фенилаланина (ФА), входящего в состав белков. Вещество участвует в укладке белка и стабилизации белковых структур.
Первые симптомы: частое срыгивание, рвота, экземы, судороги, исходящий от мочи и кожи запах плесени. Ребенок может был вялым либо, наоборот, гиперактивным. Отстает в психомоторном развитии, наблюдаются признаки олигофрении. Диагноз может быть поставлен в родильном доме. Все дети с фенилкетонурией безусловно получают статус «ребенок-инвалид».
Лечение заболевания заключено в соблюдении специальной низкобелковой диете, не содержащей продукты с ФА.
Определение заболевания
Фенилкетонурия ― это врожденная, генетическая патология, подразумевающая нарушения гидроксилирования фенилаланина. Характеризуется накоплением в организме аминокислоты и продуктов ее метаболизма, что ведет к тяжелым поражениям центральной нервной системы. Впервые заболевание было описано норвежским врачом И. А. Феллингом в 1934 году.
Изучая болезнь специалисты установили, что за наличие болезни отвечает единственный ген фенилаланингидроксилазы. Первое успешное лечение было разработано и проведено в 1950 году в Англии.
В неонатальном периоде клиника отсутствует. Патология проявляется в первые полгода жизни ребенка. В дальнейшем накопление вещества приводит к тяжелым нарушениям развития. Поэтому крайне важно сразу после рождения выявить дефект и не допустить употребление продуктов, содержащих фенилаланин. Более позднее соблюдение диеты не устранит полученные нарушения, но не допустит развития новых.
Патология одинаково часто встречается среди лиц обоих полов. Расовых особенностей не выявлено. Большое количество больных в таких странах как Китай, Турция, Ирландия. В среднем по России с фенилкетонурией рождается каждый 7-ми тысячный ребенок.
Лекарства
Фото: saratov24.tv
Сапроптерина дигидрохлорид
Лекарственная форма: таблетки. Выпускаются в дозировке 100мг (76,8мг сапроптерина).
Обязательно выпить полученный раствор не позже 15 минут после приготовления.
Доза препарата рассчитывается исходя из массы тела пациента.
Информация носит справочный характер и не является руководством к действию. Не занимайтесь самолечением. При первых симптомах заболевания обратитесь к врачу.
Причины фенилкетонурии
Существует три типа генетического отклонения, первый считается классическим, поскольку диагностируется в более чем 90% случаев. Второй и третий ― более редкая форма патологии. Симптоматика схожа во всех типах, заболевание приводит к умственной отсталости. При классической форме фенилкетонурии избежать этого можно диетотерапией, но атипичные варианты, к сожалению, коррекции не подлежат.
- Классическая фенилкетонурия (I тип) ― это низкая выработка фенилаланингидроксилазы (ФАГ), что приводит к собиранию в естественных жидкостях организма фенилаланина и продуктов его расщепления. Патология вызвана мутированным геном РАН.
- Фенилкетонурия II типа ― недостаток дигидроптеридинредуктазы, что препятствует преобразованию фенилаланина в тирозин. Патология из-за мутации гена QDPR.
- Фенилкетонурия III типа ― недостаток 6-пирувоилтетрагидроптеринсинтазы, нужной для синтеза тетрагидробиоптерина. Патология вызвана мутированным PTS-геном.
Все формы заболевания наследуются по аутосомно-рецессивной форме. Это означает, что генетический дефект может быть унаследован у одного из родителей. Половая принадлежность родителя и ребенка не играет роли.
Наследование аутосомно-рецессивной фенилкетонутии
В том случае, если будущая мама заболела фенилкетонурией, риск унаследования заболевания ребенком зависит от генотипа будущего отца. Если отец ребенка не является носителем аномального гена, ребенок родится здоровым (но будет носителем). С другой стороны, если отец ребенка несет ген фенилкетонурии, вероятность рождения больного ребенка составляет 50%.
Беременным также очень важно соблюдать диету — слишком высокий уровень фенилаланина может привести к порокам у ребенка (порокам сердца, конечностей или умственной отсталости).
Классификация
Фенилкетонурия в настоящее время не имеет общепризнанной мировой классификации. Над этим вопросом ведутся дебаты, наравне с изучением заболевания. Чуть ранее, до расшифровки генов, считалось, что степень поражения интеллектуальных способностей зависит от степени активности фермента. Поэтому текущая квалификация признана устаревшей. Не учитывает она и другие симптоматические факторы.
При диагностировании ставят:
- I тип (дефицит ФАГ) ― концентрация ФА больше 20 мг/дл.
- Средняя форма ФКУ ― ФА от 8,1 до 20 мг/дл.
- Легкая форма ГФА-уровень ― ФА от 2,1 до 8,0 мг/дл.
При уровне до 8,0 мг/дл фенилкетонурию считают доброкачественной. Она не требует специального лечения, но необходимо наблюдение первый год жизни ребенка. Контролирует состояние врач-педиатр, невролог, генетик.
Выделяют также еще одну форму фенилкетонурии, не требующую коррекции. Это транзиторная форма ГФА в период новорожденности. Возникает, как правило, при недоношенности, что обусловлено функциональной незрелостью организма. Транзиторная фенилкетонурия ― это временное повышение ФА-уровня, способное подняться до критических значений. При этом клиника отсутствует либо проявления весьма незначительны. Через несколько месяцев биохимические показатели приходя в норму.
Патогенез
Механизм зарождения и развития фенилкетонурии связан с нарушением обмена органического соединения ― аминокислоты фенилаланина. Метаболический блок препятствует преобразованию фенилаланина в тирозин. Аминокислота не только не преобразуется, а накапливается в виде токсичных метаболитов:
- фенилмолочная кислота;
- фенилпировиноградная кислота;
- фенилуксусная кислота;
- фенилэтиламин и прочее.
Скопление фенил-веществ оказывает токсическое действие на ЦНС. В настоящий момент механизм еще до конца не изучен, врачам не известен патогенез дисфункции головного мозга.
Существуют предположения, что поражение нервной системы является результатом ряда факторов. Среди них как прямое токсического воздействие фенилаланина, так и нарушение обмена белков, липопротеидов и гликопротеидов, сбой гомонального метаболизмеа и мембранного транспорта аминокислот. Все это в комплексе имеет важное значение для созревания и правильного функционирования ЦНС.
Симптомы
I тип. Первые признаки у ребенка проявляются в возрасте от 2 месяцев до полугода.
- Апатичность либо, наоборот, повышенная раздражительность.
- Отсутствие интереса к окружению, людям, предметам, обстановке.
- Частое срыгивание.
- Аллергический дерматит.
- Нарушение мышечного тонуса.
- Пониженное давление.
- Судороги.
- Иногда развивается микроцефалия (малый размер черепа относительно других частей тела) и гидроцефалия (избыточная жидкость, омывающая головной мозг).
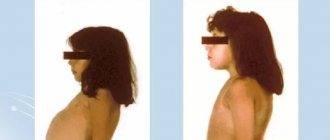
К характерным симптомам относятся гипопигментация кожи, волос, радужной оболочки глаз. Моча имеет специфический запах плесени или его еще называют «мышиным» запахом. Эпилептические припадки наблюдаются у половины больных, часто является первым выраженным клиническим симптомом. Приступ характеризуется «салаамовыми» судорогами, напоминающими кивки. Они случаются часто, плохо поддаются антиконвульсантному лечению.
Если не корректировать концентрацию ФА, болезнь прогрессирует. Как правило, уровень IQ у таких детей не превышает 20, при норме от 85. Умственная отсталость настолько сильная, что отсутствуют эмоциональные реакции, наблюдаются психопатии и шизофреноподобные расстройства.
II тип. Первая симптоматика проявляется на первом году жизни.
- Повышенная возбудимость.
- Задержка развития.
- Обильное слюнотечение.
- Сниженное артериальное давление.
- Частое повышение температуры тела.
- Сухожильная гиперрефлексия (повышение рефлексов) или спастический тетрапарез (обессиливание всех четырех конечностей).
- Миоклоническая эпилепсия (генерализованные приступы, преимущественно возникающие после пробуждения).
- Микроцефалия.
Отличительная особенность второго типа ― гибель нейронов, нарушение метаболизма фолатов, а также кальцификация в различных отделах головного мозга. Болезнь быстро прогрессирует, может привести к смерти ребенка в течение 2 — 3 лет.
III тип. Симптомы дефицита пирувоилтетрагидроптеринсинтетазы схож с проявлениями болезни Паркинсона:
- Постуральная нестабильность и трудности походки. Сложно либо невозможно поддерживать определенное положение всего тела или конечностей.
- Гипокинезия (низкая двигательная активность, ограниченный темп и объем движений).
- Гиперсаливация (повышенное слюноотделение).
- Нарушения глотания.
- Окулогирные кризы (симметричное отклонение обоих глаз, обычно направленное вверх).
В 80% случаев этот тип заболевания сопровождается снижением количества биогенных аминов в ликворе. Лечение затруднено тем, что раннее снижение концентрации ФА может вызвать серьезные патологические изменения. Несоблюдение диетотерапии приведет к замедлению развития речи, низкому интеллекту, проблемам с памятью.
Диагностика
Выявить фенилкетонурию можно в первые дни после рождения до появления какой-либо симптоматики. Для определение концентрации фениламина в крови проводят:
- микробиологический тест;
- хроматографию;
- флюориметрию;
- масс-спектрометрию.
Во всех случаях биологическим материалом выступают сухие пятна капиллярной крови младенца.
С недавнего времени анализ на фенилкетонурию входит в программу неонатального скрининга. Его проводят всем новорожденным, особенно важно исследование для недоношенных детей. Критерий диагностирования ― повышенная концентрация фенилаланина при норме 0 — 2 мг/дл. Повышенный уровень требует проведения уточняющей диагностики. Потребуется установить сам факт наличия фенилкетонурии и выявить ее причину.
- Если скрининг-тест показал высокие результаты уровня ФА, дополнительно может быть назначено:
- Фенилаланин-нагрузочная диагностика для выявления нозологической формы заболевания.
- Молекулярно-генетический анализ для установления формы: классическая, II или III тип.
- Секвенирование гена РАН, если молекулярно-генетическая диагностика дала отрицательный результат по гену ФАГ.
- Анализ на птерины в урине для исключения птерин-зависимых форм.
Дифференциальное диагностирование фенилкетонурии проводят с такими патологиями, как нарушение функции печени, галактоземия и с другими заболеваниями.
Лечение
Симптоматическая терапия при любой формой фенилкетонурии неэффективна. Существует только один способ предотвратить негативные последствия заболевания ― диетотерапия. Из рациона исключают высокобелковые и содержащие фенилаланин продукты. Недостающее количество белка восполняют специализированным лечебным питанием, с максимально низким содержанием аминокислоты ФА или полностью ее лишенным. Следует учитывать, что эффективность терапии напрямую зависит от времени начала коррекции и уже произошедших патологических изменений.
Цель лечебного питания при классической форме заболевания ― это предотвращение развития нарушений ЦНС, физического и умственного развития. Легкая форма ГФА допускает расширение диеты под строгим наблюдением врача за состоянием ребенка и биохимическими показателями. Под запретом: мясо, рыба, орехи, шоколад и бобовые, все виды яиц, творог и сыры. Также следует исключить продукты, содержащие искусственный подсластитель аспартам.
Критерий эффективности лечения ― уровень ФА в крови.
Народные средства
Фото: vestiregion.ru
Диетотерапия является методом лечения, пришедшим из народной медицины. Методом проб и ошибок было установлено, что исключение из рациона детей с определёнными симптомами пищи, содержащей высокое количество белка, облегчало их состояние. Для смягчение некоторых неврологических симптомов (раздражительность, беспокойство) возможно применение отваров ромашки, мяты, мелиссы, боярышника.
Рассматриваемое заболевания требует постоянного наблюдения пациентов специалистами. Рекомендуется не пренебрегать рекомендациями лечащего врача.
Информация носит справочный характер и не является руководством к действию. Не занимайтесь самолечением. При первых симптомах заболевания обратитесь к врачу.
Прогноз и профилактика
Проведения массового скрининга в родильных домах позволяет своевременно выявить генетическое отклонение. Вовремя начать соблюдение диетотерапии и, как следствие, предотвратить тяжелые последствия. В противном случае прогноз в отношении умственного развития неблагоприятный.
Классическая ФКУ имеет благоприятный прогноз если диагностирована в первые недели жизни ребенка и соблюдаются все требования врачей. Такие дети ходят в обычные школы, способны получить высшее образовании и вести нормальный образ жизни.
Во время подготовки к беременности пара должна пройти предварительное генетическое тестирование на наличие мутаций в гене РАН. Если у одного из родителей есть дефектный ген, шанс родить ребенка с ФКУ 1:4 и 100% если оба родителя больны.
Женщины с установленной фенилкетонурией при беременности и грудном вскармливании должны соблюдать строгую диету. Высокая концентрация аминокислоты в крови и околоплодных водах оказывает серьезное тератогенное воздействие на плод.
При беременности
Женщинам с фенилкетонурией, которых успешно лечили с помощью диеты, следует крайне внимательно относится к своему состоянию во время вынашивания ребенка, ведь даже при генетически нормальном развитии плода высок риск нарушений из-за повышенного уровня фенилаланина и его метаболитов в кровоток матери как серьезного тератогенного фактора с нейротропной токсичностью. Поэтому, перед зачатием таким пациенткам рекомендуют вернуться к строгой диете и придерживаться ее всю беременность.
Особая диета должна ограничивать потребление до 15-20 мг/кг фенилаланина в сутки, и при этом следить, чтобы не развивался дефицит незаменимых аминокислот.