Дорогие друзья, здравствуйте!
Сегодня мы с вами поговорим о гормональных наружных средствах. Их в ассортименте аптек – несколько десятков, и самостоятельно разобраться в них непросто.
Надеюсь, что эта статья будет для вас лучом света в темном царстве топических (т.е. местных) стероидных средств, и буквально через несколько минут вы будете знать принципы рекомендаций препаратов этой группы, поскольку уделить внимание каждому препарату в рамках одной статьи невозможно. Да и не нужно.
Но на некоторых из них я остановлюсь чуть подробнее.
В этой статье мы с вами рассмотрим:
- Как действуют топические стероиды?
- От чего зависит их лечебный эффект?
- Как они делятся?
- Какие нежелательные реакции бывают при их использовании?
- Какие препараты этой группы безопаснее других?
- Когда какую лекарственную форму рекомендовать?
- На что нужно обращать внимание при выборе подобного средства конкретному покупателю?
- Сколько наружного средства выдавливать на палец? Вы узнаете секрет дозирования этих препаратов.
Вы готовы?
Тогда поехали!
Немного истории
Первый топический кортикостероид появился в 1952 году. Это была мазь гидрокортизона. Ее сразу подхватили дерматологи и стали использовать в своей практике лечения различных дерматитов, псориаза, экземы и прочих кожных заболеваний, протекающих с зудом, покраснением, отеком, утолщением и шелушением кожи.
И все бы ничего, но, к сожалению, не всегда мазь гидрокортизона справлялась со своими задачами.
Разработки более эффективного стероида для местного применения продолжались, и через 2-3 года кому-то из ученых пришла в голову мысль прицепить к исходной молекуле гормона атом галогена. Галогены – это 5 элементов периодической системы Менделеева, из которых нас с вами интересуют только два: фтор и хлор.
Поначалу для повышения противовоспалительной активности стероидного наружного средства был выбран фтор.
Ура! Получившиеся препараты, действительно, во много раз превосходили своих предшественников по противовоспалительной активности. История не сообщает их имена. Подозреваю, что это были Синалар, Флуцинар, Синафлан, Фторокорт.
Но фторированные стероиды резко повысили частоту местных и системных побочных реакций.
Позже на фармрынке появились стероидные средства, содержащие в своей молекуле не фтор, а хлор, который сделал эти препараты более безопасными.
А затем были разработаны синтетические негалогенизированные топические стероиды, эффективность которых сопоставима с фторированными препаратами, а безопасность – с родоначальником этой группы гидрокортизоном.
В практике современного дерматолога топические глюкокортикостероиды (ТГКС) занимают особое место. С их помощью удается быстро справиться с симптомами воспаления при многих дерматозах. Большинство врачей не представляют свою ежедневную практику без данных лекарственных средств. «Революция» в дерматологии произошла в 1952 г., когда впервые был применен гидрокортизон для лечения дерматитов, что стало переломным моментом в терапии воспалительных заболеваний кожи.
В 60-е гг. XX века отечественные ученые В.А. Рахманов, Н.С. Смелов, А.А. Студницин отмечали положительный эффект гидрокортизоновой мази при лечении экземы, нейродермита, дерматитов. С тех пор прошло почти 50 лет, и топические стероиды все эти годы сохраняют свои лидирующие позиции в терапии наиболее распространенных дерматозов. Это обусловлено тем, что ТГКС обладают следующими фармакодинамическими эффектами [1, 2]:
— противовоспалительным;
— иммуносупрессивным;
— сосудосуживающим;
— антипролиферативным;
— противозудным.
Механизм действия ТГКС связан с гипосенибилизацией рецепторов клеток кожи к гистамину и серотонину, блокадой гистаминазы А2, повышением активности гиалуронидазы, что вызывает уменьшение проницаемости сосудистой стенки, экссудации, зуда, а также с нормализацией тонуса сосудов, стабилизацией клеточных мембран.
Противовоспалительный эффект ТГКС обусловлен ингибирующим влиянием на фосфолипазу А2, необходимую для синтеза арахидоновой кислоты. Этот механизм ингибирования приводит к подавлению образования медиаторов воспаления (простагландины, лейкотриены, интерлейкины, компоненты комплемента и др.). Происходит снижение выброса лизосомальных ферментов. ТГКС вызывают торможение миграции лимфоцитов, макрофагов, задержку пролиферации фибробластов и синтеза коллагена, уменьшение числа клеток Лангерганса и тучных клеток. Все это обеспечивает клинический эффект ТГКС.
В первые годы использования топических препаратов гидрокортизона было отмечено, что они хорошо переносились больными, однако их эффективность при псориазе и других дерматозах была невысокой [2]. Следующим шагом было добавление двойной связи в молекулу стероида. Так появился преднизолон — препарат, активность которого превышает активность гидрокортизона в 4 раза. С целью увеличения противовоспалительной активности еще в 50-е годы было предложено включить в молекулу кортикостероида один или два атома галогенов (фтора или хлора). Наступил новый этап в истории создания стероидов — синтез галогенизированных препаратов.
Бетаметазона дипропионат — второй по силе действия топический стероид после клобетазола пропионата, b-изомер дексаметазона — имеет только один атом фтора, что значительно снижает риск побочных эффектов, но без снижения противовоспалительной активности (рис. 1).
Рис. 1. Формула бетаметазона дипропионата.
В настоящее время арсенал ТГКС, зарегистрированных в России, насчитывает более 40 наименований. Такое обилие сходных по механизму действия лекарственных средств создает трудности при выборе определенного препарата для конкретного больного стероидчувствительным дерматозом. Актуальным является создание современного алгоритма топической терапии стероидчувствительных дерматозов.
Терапия дерматологических заболеваний с применением ТГКC диктует необходимость четкого соблюдения определенных принципов подбора препаратов, их лекарственных форм и комбинаций, грамотного их использования.
Выбор ТГК должен определяться его фармакологическими свойствами, формой и стадией патологического процесса, наличием осложнений, общим состоянием, возрастом больного и рядом других факторов.
Разнообразие наружных препаратов и их лекарственных форм рассчитано на опыт и квалификацию дерматолога, его умение рационально использовать все возможности топической терапии при правильной постановке диагноза и стадии, выраженности воспалительного процесса.
При вторичном инфицировании очагов поражения следует применять комбинированные препараты с противомикробными, а в ряде случаев — с противогрибковыми средствами, при гиперкератотических процессах — с кератолитическими. Менее сильные ТГКC рекомендуется использовать на участках с тонкой кожей (лицо, складки), а также у детей и пожилых пациентов. При беременности не рекомендуется применять ТГКC длительно и на больших участках кожного покрова (категория С).
Необходимо учитывать факторы окружающей среды (температура, влажность), способствующие быстрейшему всасыванию препарата. На скорость и полноту всасывания ТГКC влияет липофильность, определяющая системную биодоступность, особенности метаболизма препарата, сила и концентрация действующего вещества, особенности лекарственной основы препарата, дополнительное наличие пенетрантов, а также технологические особенности изготовления препарата [1, 2].
Известно о повышенной проницаемости кожи новорожденных детей за счет тонкого рогового слоя и рыхлого расположения ороговевающих клеток, обильного кровоснабжения и незначительного подкожножирового слоя. Значимо большее соотношение площади поверхности тела к массе тела, изменение плотности глюкокортикостероидных рецепторов и их способности опосредовать гормональный сигнал, недоразвитость метаболизирующих ферментных систем до 2—4-й недели жизни.
В пожилом возрасте также повышена проницаемость кожи в связи с ее истончением, уменьшением количества сосудов, проницаемости сосудистой стенки. Отмечаются нарушения микроциркуляции в коже (стазы, микротромбозы, запустевания капилляров), происходит изменение метаболизма и выведения лекарственных препаратов [2].
В процессе проникновения ТГКС через кожу возникает концентрационный градиент между основой препарата и роговым слоем эпидермиса, далее значимы коэффициент распределения и коэффициент диффузии. На скорость и полноту всасывания ТГКС через кожу влияют влажность и температура кожи, предшествующие кожные поражения, анатомическая локализация процесса. Так, увеличение влажности и температуры кожи приводит к повышению трансдермальной абсорбции препарата, что достигается окклюзионной повязкой или мазью на гидрофобной основе. Наиболее быстрое и полное всасывание препарата происходит с поверхности лица и кожных складок. Системная абсорбция препарата с области лица достигает 7%, подмышечных впадин — 4% [3].
Таким образом, в целях повышения эффективности терапии больных стероидчувствительными дерматозами возникает необходимость разработки оптимизированного дифференцированного подхода к назначению наружного лечения с учетом стадии развития воспалительного процесса, остроты проявлений и выраженности отдельных клинических симптомов в типичных локализациях заболеваний.
Бактериальные и грибковые агенты играют значимую роль в патогенезе аллергодерматозов. Комбинированный состав ТГКС препаратов позволяет воздействовать на основное заболевание и вторичную флору [4]. К таким комбинированным препаратам, эффективным в терапии дерматозов, осложненных вторичной бактериальной и/или микотической инфекцией, относится препарат Акридерм ГК
[5, 6]. Данная комбинированная терапия оптимальна за счет сочетания бетаметазона дипропионата 0,05%, гентамицина сульфата 0,1%, клотримазола 1%.
Крем Акридерм ГК
имеет гидрофильную эмульсионную основу, обладающую эмолентным увлажняющим действием, содержит нипагин (метиловый эфир параоксибензойной кислоты) с антимикробным и антисептическим эффектом и пропиленгликоль, потенцирующий действие ТГКС и усиливающий антимикробный эффект нипагина.
Гентамицин — антибиотик широкого спектра действия из группы аминогликозидов. Антибактериальное действие гентамицина сульфата проявляется в отношении значительного спектра возбудителей: Staphylococcus
spp.
,Pseudomonas
spp.
,Proteus
spp.
,Esherichiacoli,Klebsiella
spp
.,Enterococcusfaecalis,Shigella
spp
.
и др.
Клотримазол — универсальное антимикотическое средство, обладающее активностью в отношении дерматофитов, грибов рода Candida
, возбудителей разноцветного лишая и эритразмы. Механизм действия клотримазола заключается в подавлении синтеза эргостерола (основная часть клеточной стенки гриба), а также во влиянии на митохондриальные пероксидазные ферменты с последующим повышением концентрации перекиси водорода, лизисе грибковых клеток (фунгицидный эффект) [7, 8].
Выраженный клинический эффект препарата Акридерм ГК
обусловлен высокой лечебной активностью каждого компонента, удачным сочетанием действующих начал в его составе, создающим эффект симбиоза. Лечебное действие доказано при ряде заболеваний. Препарат наносят на чистую кожу (кроме лица) тонким слоем, 2 раза в день, при этом не следует массировать кожу и втирать препарат. При необходимости (при гиперкератозных процессах) препарат можно наносить на подсушенную кожу после ванны или душа. Рекомендовано долгосрочное противорецидивное лечение при средне-тяжелом и тяжелом течении процесса с применением дерматологических эмолентных средств от 1 до нескольких раз в сутки.
Результаты многочисленных исследований показали, что комбинированный препарат Акридерм ГК
обладает высокой терапевтической эффективностью при хронических дерматозах, осложненных бактериальной и микотической инфекцией, средство позволяет сократить длительность проводимой терапии, увеличить периоды ремиссии и уменьшить число обострений, улучшить прогноз заболеваний при отсутствии побочных явлений [9, 10].
Таким образом, наиболее эффективны в качестве местной терапии комбинированные препараты, в состав которых, кроме ТГКС, входят антибактериальные и антимикотические средства, что позволяет воздействовать одновременно на все звенья патологического процесса.
В особой защите нуждаются участки кожи с тонким кожным барьером и сниженной барьерной функцией — веки, кожа задней поверхности ушной раковины, лицо, сгибательные поверхности суставов. При локализации воспалительного процесса на коже лица для ускорения процесса восстановления кожного покрова и предотвращения обострений заболевания, смягчения и увлажнения поврежденной, чувствительной, воспаленной и сухой кожи, восстановления нормального водного баланса и уровня липидов кожного покрова, эластичности, защиты кожи на длительный период рекомендованы средства, обладающие выраженным увлажняющим, смягчающим и регенерирующим действием. К ним относится комплекс липидов, мочевина, глицерин и другие биоорганические соединения, которые входят в состав натурального увлажняющего фактора (рис. 2) и обеспечивают длительное увлажнение кожи, восстановление гидролипидной пленки и водного баланса поврежденной кожи.
Рис. 2. Компоненты натурального увлажняющего фактора.
Увлажняющий эффект мочевины обусловлен поглощением воды из дермы и удержанием ее в клетках эпидермиса, снижением трансэпидермальной потери влаги. Благодаря кератолитическому действию мочевина может выступать проводником других активных веществ, включаемых в препараты. Также мочевина длительно сохраняет абсорбирующие и антисептические свойства, предотвращая возникновение инфицирования, не отмечено побочных эффектов, аллергических реакций при применении мочевины. Исследователи отмечают положительные результаты применения препаратов с мочевиной в терапии пациентов с экземой, дерматитами, кератозом, псориазом, ихтиозом, атопическим дерматитом [11—15].
Современные требования к топическим стероидам следующие: они должны обладать высокой эффективностью, подтвержденной в исследованиях, отвечающих стандартам доказательной медицины (многоцентровые рандомизированные клинические исследования, соответствующие стандартам GCP); иметь разнообразные лекарственные формы для местного применения, необходимые для достижения эффекта на разных стадиях воспалительного процесса и на любом участке кожи; быть безопасными (низкая всасываемость, минимум побочных эффектов, возможность длительного использования); быть удобными в применении (нанесение 1 раз в сутки; отсутствие запаха, жирного блеска; не пачкают одежду).
Всеми перечисленными свойствами обладает метилпреднизолона ацепонат — негалогенизированный препарат из группы топических стероидов, имеющий оптимальное сочетание высокой местной активности и минимального системного и местного побочного действия. Данный эффект МПА обусловлен включением эфирных боковых цепей в его структуру. МПА — диэфир (рис. 3), характеризующийся высокой липофильностью (короткая цепь жирных кислот в положениях С17 и С21), что позволяет ему быстро и легко проникать через роговой слой кожи в дерму. Отсутствие фтора и хлора в положениях С6, С9 или С12 обеспечивает минимум местных и системных побочных эффектов [16, 17].
Рис. 3. Химическая структура метилпреднизолона ацепоната.
По силе действия МПА превосходит ряд современных кортикостероидных препаратов. В отличие от них он практически не оказывает системного глюкокортикоидного и минералокортикоидного действия. Процесс биоактивации МПА в очаге воспаления в коже происходит значительно быстрее, чем в здоровой коже. Весьма незначительно проникновение МПА, его метаболитов в кровь, время их полужизни в крови, при этом связь с белком транскортином достаточно велика, что и определяет практически полное отсутствие системных побочных эффектов у МПА. Более высокое сродство метаболитов МПА (17-пропионата и свободного метилпреднизолона) к стероидным рецепторам кожи, чем у исходного вещества, проявляется в длительном, выраженном подавлении процесса воспаления, гиперпролиферации и аллергических реакций, кроме того исследователями отмечено, что одним из продуктов метаболизма МПА является уксусная кислота, оказывающая антисептическое действие [17].
Клиническая эффективность и безопасность МПА доказана в клинических исследованиях с участием более 15 000 взрослых и детей, что позволяет объективно оценить данный препарат [18—20].
В терапии атопического дерматита (АД) у детей из топических стероидов наилучшие показатели отмечены у препаратов последнего поколения, к которым относится МПА. При применении один раз в сутки МПА — эффективное и безопасное средство для лечения АД у детей [21, 22].
Фирмой АО АКРИХИН создан новый препарат — крем Комфодерм М
2: уникальная комбинация МПА и 2% мочевины. Целью создания лекарственного препарата
Комфодерм М
2 было повышение эффективности лечения стероидчувствительных дерматозов за счет комбинации ТГКС с увлажняющим компонентом — 2% мочевиной. Сочетанное применение МПА и 2% мочевины более эффективно, чем раздельное действие данных лекарственных средств, что значительно расширяет спектр применения и позволяет проводить терапию стероидчувствительных дерматозов даже на участках с тонкой чувствительной кожей: лицо, шея, складки.
Стероидчувствительные дерматозы среднетяжелого и тяжелого течения, в том числе АД, нуждаются в долгосрочном контроле, мягком противорецидивном лечении. Топические ингибиторы кальциневрина являются нестероидными иммуномодуляторами и обладают выраженным эффектом в сравнении с плацебо как при краткосрочном, так и при длительном использовании. Такролимус можно использовать для поддерживающей терапии АД средней степени тяжести и тяжелых форм (2 раза в неделю, например, в понедельник и четверг), с нанесением на участки кожи, на которых наиболее часто возникают очаги поражения, у пациентов с частыми обострениями (свыше 4 эпизодов в год) с целью предупреждения новых обострений и продления периода ремиссии. Данная терапия показана только тем пациентам, у которых ранее наблюдался ответ на лечение такролимусом по схеме 2 раза в день продолжительностью не более 6 нед (т.е. лечение привело к полному или почти полному разрешению кожного процесса). Данных по аналогичному использованию пимекролимуса нет. Через 12 мес поддерживающей терапии необходимо оценить динамику клинических проявлений и решить вопрос о целесообразности продолжения использования такролимуса [23, 24].
Дерматовенерологам будет интересно новое противовоспалительное средство для местного применения отечественного производства — Такропик
(такролимус), который относится к группе ингибиторов кальциневрина. Ингибирование фосфатазной активности кальциневрина происходит в результате связи
Такропика
со специфическим цитоплазматическим белком иммунофилином (FK506) и формирования комплекса — такролимус, FKВР12, кальций, кальмодулин и кальциневрин. В многоплановом механизме действия такролимуса также следует отметить его ингибирующее влияние на высвобождение медиаторов воспаления из тучных клеток, базофилов и эозинофилов, отсутствие атрофогенного действия.
Для долгосрочного контроля препарат Такропик
в дозировке 0,1% применяют в терапии АД у подростков и взрослых от 16 лет 2 раза в неделю, в дозировке 0,03% — в терапии АД у детей с 2 лет 2 раза в неделю длительностью до года, возможно сочетание с дерматологическими эмолентными средствами.
Для топической терапии стероидчувствительных дерматозов у детей АО АКРИХИН предложен новый препарат — крем Комфодерм К
— метилпреднизолона ацепонат 0,1% (МПА) и керамиды, благодаря гидрофильной основе это средство можно применять даже в острой стадии воспалительного процесса.
Керамиды впервые были выделены из мозговой ткани. Свое второе название — церамиды — они получили от латинского слова cerebrum
(мозг). Позже было обнаружено, что церамиды составляют основу липидной прослойки между роговыми чешуйками кожи. Керамиды относятся к классу сфинголипидов. Это сложные липиды, состоящие из нескольких блоков — жирного спирта сфингозина или фитосфингозина (образует гидрофильную «голову») и одной жирной кислоты (липофильный «хвост»). Среди керамидов особо выделяются длинноцепочечные керамиды, в состав которых входит линолевая кислота. Эти керамиды «прошивают» соседние липидные слои и связывают их в единую структуру. При недостатке линоленовой кислоты страдает синтез керамидов, соответственно липидная прослойка рогового слоя теряет целостность и распадается. Следствием этого является сухость кожи и связанные с этим другие симптомы (шелушение, повышенная чувствительность, раздражение и т. д.) [25] Снижение количества керамидов в коже является одним из этиологических факторов атопического дерматита (рис. 4), поэтому включение керамидов в комплексную терапию атопического дерматита у детей способствует облегчению заболевания [26].
Рис. 4. Нарушение структуры липидного состава эпидермиса при атопическом дерматите.
При наружном применении Комфодерм К
подавляет воспалительные и аллергические кожные реакции, усиленную пролиферацию, уменьшая субъективные ощущения и объективные проявления воспаления. Препарат показан в топической терапии стероидчувствительных дерматозов детям с 4-месячного возраста. Крем
Комфодерм К
наносят тонким слоем на очаги воспаления 1 раз в сутки не более 4 нед детям и до 12 нед — взрослым.
В хронической стадии кожного воспалительного процесса у детей рекомендована 0,1% мазь Комфодерм
(МПА), которая также появилась в новой линии
Комфодерм
. Рекомендации по применению: 1 раз в день до 4 нед совместно с дерматологическими эмолентными средствами.
Наш многолетний опыт лечения больных стероидчувствительными дерматозами показывает, что принятие решения о выборе между ТГКС и нестероидным препаратом, например, из группы антагонистов кальциневрина, в каждом конкретном случае в большой степени зависит от состояния пациента при его первом обращении к дерматологу. Нами был предложен современный алгоритм выбора наружного препарата при топической терапии стероидчувствительных дерматозов с учетом остроты, характера, локализации патологического процесса, длительности заболевания, предшествующего лечения и его эффективности, возраста пациента. При включении в алгоритм мы отдавали предпочтение современным ТГКС с высоким профилем безопасности и доказанной эффективностью (рис. 5, 6).
Рис. 5. Алгоритм комплексной топической терапии стероидчувствительных дерматозов у детей.
Рис. 6. Алгоритм комплексной наружной терапии стероидчувствительных дерматозов.
В дерматологической клинике Уральского научно-исследовательского института дерматовенерологии и иммунопатологии была проведена апробация предложенных алгоритмов в терапии больных различными стероидчувствительными дерматозами. Клиническая эффективность позволяет рекомендовать предложенные алгоритмы терапии к широкому применению в практике врача-дерматолога.
Следует подчеркнуть, что дифференцированный подход к выбору топической терапии больных стероидчувствительными дерматозами, с учетом остроты, характера, локализации патологического процесса, длительности заболевания, предшествующего лечения и его эффективности, возраста пациента позволит повысить эффективность терапии в период обострения, избежать нежелательных эффектов, существенно уменьшить системную фармакологическую нагрузку, достичь стойкую, длительную ремиссию и, в конечном счете, значительно улучшить качество жизни таких пациентов.
Когда применяются топические стероиды?
Показаний к применению этих препаратов довольно много. Но если их обобщить, то это все хронические заболевания кожи, в основе которых лежит воспаление или аллергия, или усиленное деление клеток рогового слоя кожи.
Они могут проявляться покраснением, зудом, мокнутием, избыточной сухостью кожи, шелушением, образованием мелких пузырьков.
Это всевозможные дерматиты (атопический, себорейный, контактный, солнечный), псориаз, красный плоский лишай.
Исключение составляет периоральный дерматит. Он проявляется прыщиками и покраснением вокруг рта. При этой форме дерматита применение стероидных наружных средств противопоказано. Замечена связь между применением топических стероидов и появлением периорального дерматита после их отмены. Причины неясны.
Местные кортикостероиды применяются также при тяжелых укусах насекомых, выраженном старческом зуде, аногенитальном зуде.
Есть нюанс по поводу аногенитального зуда. Например, старенькие препараты (Синафлан, Флуцинар и др.) противопоказаны при этой проблеме. Они не предназначены для нанесения на слизистые, т.к. высок риск системных эффектов.
Возможности системных и топических стероидов в лечении воспалительных заболеваний кишечника у детей
Воспалительные заболевания кишечника (ВЗК), к которым относятся болезнь Крона (БК) и неспецифический язвенный колит (НЯК), являются наиболее тяжелой патологией желудочно-кишечного тракта (ЖКТ) и характеризуются хроническим, неуклонно прогрессирующим течением с риском развития кишечных и внекишечных осложнений. Примерно у трети больных заболевание впервые манифестирует в возрасте до 18 лет. В последние годы в развитых странах Европы и Северной Америки отмечается неуклонный рост частоты ВЗК, распространенность которых у детей варьирует от 3,4 до 7,1:100?000 [1]. В России подъем заболеваемости наметился лишь в последние годы, однако этот рост оказался весьма существенным. По нашим данным, заболеваемость среди детей г. Санкт-Петербурга составляет примерно 2:100?000 в год, а распространенность — 6:100?000, то есть соответствует европейской. Если заболеваемость НЯК у детей в течение последних 7 лет практически не изменилась и составила 0,4:100?000, то заболеваемость БК неуклонно растет почти в геометрической прогрессии: так, в 2002 г. она составляла 0,125:100?000, а в 2008 г.?— 1,7:100?000 детского населения Санкт-Петербурга, в 4 раза превысив заболеваемость НЯК.
Этиология ВЗК остается неизвестной, но предполагается, что срыв иммунологической толерантности к кишечным антигенам является ключевым фактором патогенеза. В результате утрачивается иммунологический контроль над процессом прогрессирующего воспаления в кишечнике. В связи с тем, что именно воспаление является доминирующим механизмом развития как НЯК, так и БК, лечение обострения обоих заболеваний проводится препаратами с противовоспалительным действием: 5-аминосалициловой кислотой (5-АСК) или глюкокортикостероидами (ГКС). По нашим данным, в терапии ГКС нуждаются не менее 70% детей с ВЗК.
В физиологическом состоянии эндогенные глюкокортикоиды противодействуют активации врожденного и адаптивного иммунного ответа [1, 2]. Низкие дозы экзогенных стероидов могут также следовать этому физиологическому пути, но, назначенные в высоких дозах, ГКС включают другие механизмы действия. После пассивной диффузии в клетку они связываются со специфическими цитоплазматическими глюкокортикоидными рецепторами, которые представлены в большинстве клеток организма в количестве от 2000 до 30?000 связывающих сайтов. Этот комплекс затем поступает в ядро клетки и вступает в контакт с отвечающими на глюкокортикоиды элементами (glucocorticoid response elements — GRE) ДНК в регионе специфических генов. В результате происходит супрессия генов, кодирующих транскрипцию воспалительных белков, в частности, сигнальных молекул каскада MAPK (mitogen-activated protein kinase). Параллельно усиливается синтез IkВа — ингибитора ключевого фактора транскрипции NFkB, благодаря чему подавляется образование специфических транспортных РНК (тРНК) и укорачивается период их полураспада. Поскольку тРНК отвечают за регуляцию синтеза и высвобождения провоспалительных цитокинов TNF-альфа, IFN-гамма, IL-23, IL-17 и других, участвующих в реализации воспалительного ответа при ВЗК, при назначении ГКС уровень их снижается. Это также редуцирует образование арахидоновой кислоты и ее последующий метаболизм с образованием лейкотриенов и простагландинов [3].
Прямое воздействие ГКС на транскрипцию генов, активаторов воспаления, играет главную роль в достижении противовоспалительного эффекта, но не исчерпывается только им. Негенетические механизмы включают торможение активации эндотелиальной NO-синтетазы. NO является одним из важных участников воспалительного каскада при ВЗК, оказывающим влияние на лейкоцитарно-эндотелиальное взаимодействие и способствующим вазодилятации и микроциркуляторным расстройствам. ГКС активируют процессы фосфорилирования, облегчают вход кальция внутрь клеток [4].
Таким образом, ГКС, взаимодействуя с различными молекулами, оказывают многостороннее воздействие, которое через целый ряд механизмов реализуется в мощный противовоспалительный эффект.
Системные ГКС (преднизолон, гидрокортизон, метилпреднизолон и др.) применяются в лечении ВЗК в течение нескольких десятилетий. Обычно больные ВЗК хорошо отвечают на терапию системными стероидами, и хотя плацебо-контролируемых исследований эффективности и безопасности преднизолона при этой патологии у детей не проводилось, сравнение с энтеральным искусственным питанием, как единственным методом терапии, показало, что эффективность системных стероидов при БК достигает 85% [5], при НЯК — 82% [6].
Ответ пациента на терапию ГКС, в том числе гормонорезистентность, зависит от генетически детерминированной плотности глюкокортикоидных рецепторов, а также от аффинности (сродства) к ним конкретного ГКС. Если первая составляющая сугубо индивидуальна и связана с мутациями гена рецептора ГКС, то вторая может быть изменена путем оптимального выбора препарата. Сравнительные исследования показали, что к препаратам с наиболее высокой аффинностью относится будесонид. Топическая активность, то есть активность в области освобождения действующего вещества, зависит от аффинности: чем выше аффинность, тем выше местное воздействие. Таким образом, будесонид можно отнести к наиболее эффективным топическим стероидам [7].
Общеизвестно, что длительные курсы системных ГКС сопряжены с развитием целого ряда нежелательных побочных эффектов: лунообразное лицо, стрии, угревая сыпь, гипертрихоз, повышение артериального давления, гипергликемия, остеопороз и др. Серьезной проблемой является также гормонозависимость: 31% детей с БК и 45% с НЯК были гормонозависимы спустя год после установления диагноза, что требовало назначения цитостатической терапии [8, 9]. Это соответствует данным, полученным у взрослых пациентов [10]. В связи с этим в лечении локальных воспалительных процессов в последние годы отдается предпочтение гормональным препаратам с наименьшей системной биодоступностью и преимущественным местным действием, таким как будесонид, беклометазон, флутиказон и гидрокортизон. Этот подход стал общепринятым в лечении таких заболеваний, как бронхиальная астма и аллергический ринит, но пока не нашел широкого применения в гастроэнтерологии. Лишь в последние годы в лечении ВЗК стали применять препарат будесонида Буденофальк®, содержащий 3 мг активного вещества в каждой капсуле. Капсулы Буденофалька® растворяются в желудке, но в каждой из них находится около 350 гранул диаметром 1 мм, покрытых кислотоустойчивой оболочкой, содержащей эудрагит S. Покрытие разрушается при рН выше 6,4, что соответствует уровню терминального отдела подвздошной кишки. Поэтому максимум действия препарата достигается в илеоцекальной области. Поскольку будесонид в препарате представлен в активной форме, он начинает действовать сразу же после высвобождения. Благодаря химической структуре, а именно С-16,17альфа-ацетониду, будесонид обладает высокой липофильностью и быстро проникает сквозь клеточные мембраны.
Классические ГКС (гидрокортизон, преднизолон, метилпреднизолон, дексаметазон и др.) обладают высокой системной биодоступностью, в то время как этот показатель у будесонида очень низок [11]. Низкая системная биодоступность будесонида является следствием гастроинтестинального захвата, регулируемого Р-гликопротеином, продуктом MDR1 (multidrug resistance) гена, и биотрансформации в печени цитохромом р450 3А (CYP 3A). При первом же поступлении будесонида в печень образуются его метаболиты: 6-бета-гидроксибудесонид и 16-альфа-гидроксипреднизолон, глюкокортикоидная активность которых составляет всего 1–10% активности всосавшегося в кровь будесонида. Системная биодоступность будесонида у детей (9 ± 5%) близка к таковой у взрослых (11 ± 7%) [12], соответственно, системная элиминация, рассчитанная по периоду полураспада и клиренсу препарата, не отличается у взрослых и детей [13].
Конверсия препарата в печени в 6-бета-гидроксибудесонид происходит у детей в 1,5 раза быстрее, чем у взрослых, отражая более высокую активность ферментов CYP 3A в печени [13]. В связи с этими особенностями фармакодинамики, будесонид (Буденофальк®) не требует расчета дозы на килограмм массы или площадь поверхности тела, одна и та же доза применяется как у взрослых, так и у детей, стартовая доза препарата составляет 9 мг в день. Поскольку побочные эффекты ГКС обусловлены их системным действием, особенности фармакокинетики будесонида, состоящие в сочетании высокой аффинности к местным ГКС-рецепторам и низкой системной биодоступности, создают препарату уникальные свойства. Будесонид обладает выраженным местным противовоспалительным эффектом при минимальном количестве побочных реакций, что подтверждено клиническими исследованиями, однако опыт применения этого препарата в детской практике небольшой.
Целью нашей работы была оценка эффективности будесонида (Буденофалька®) у детей с ВЗК в сравнении с терапией месалазином и преднизолоном.
Материал и методы: под нашим наблюдением находились 37 больных (24 с НЯК и 13 с БК) в возрасте от 8 до 17 лет (средний возраст 14,3 года). Диагноз ВЗК был установлен впервые всем пациентам. К моменту начала лечения все дети находились в стадии обострения заболевания. НЯК у всех больных имел умеренную активность и носил тотальный характер, БК имела локализацию в илеоцекальной области, у 6 больных с поражением других отделов толстой кишки. Внекишечные проявления в виде первичного склерозирующего холангита были диагностированы у 2 больных с НЯК, артрита — у 1 пациента с НЯК и 1 — с БК.?Пациенты были рандомизированы на группы: 12 больных получали месалазин (Салофальк) в дозе 50 мг/кг/с, 14 — преднизолон в дозе 1 мг/кг/с в течение 2 недель с последующим постепенным снижением до поддерживающей дозы 5 мг/с, 11 детей (4 с БК и 7 с НЯК) получали Буденофальк® в дозе 9 мг/с на протяжении 2 месяцев с последующим снижением до 6 мг/с.
Наблюдение за пациентами осуществлялось в течение года с оценкой через 1, 3, 6 и 12 месяцев от начала лечения. При этом в динамике проводилась балльная оценка выраженности кишечного синдрома (КС), общеклинической активности (ОКА), эндоскопической активности (Э), лабораторной активности (Л), белково-калорийной недостаточности (БКН), динамики внекишечных проявлений (ВП) при их наличии, все данные суммировались в виде общей балльной оценки (S).
Результаты и их обсуждение
На фоне лечения Салофальком снижение проявлений КС и Э было достигнуто через 3 месяца, при этом разница в сравнении с исходным показателем составила в среднем 3,0 ± 0,4 балла как для КС, так и для Э. Дальнейшее лечение сопровождалось более медленными темпами снижения активности, эндоскопическая ремиссия была достигнута у 60% больных. Назначение преднизолона сопровождалось более быстрыми темпами снижения активности, уже через 1 месяц КС снизился на 7,1 ± 1,2 балла, Э — на 8,2 ± 0,8 балла, Л — на 5,1 ± 0,7 балла, однако после снижения дозы на фоне поддерживающей терапии уже через 3 месяца наблюдалось постепенное повышение активности КС и Э в среднем на 2,3 ± 0,3 балла. На фоне лечения Буденофальком® снижение активности происходило более медленными темпами, чем на фоне преднизолона, через 3 месяца КС снизился на 3,6 ± 0,7 балла, Э — на 6,2 ± 0,8 балла, Л — на 5,4 ± 0,7 балла.
В последующие месяцы ухудшения состояния не отмечалось, напротив, наблюдалось дальнейшее снижение активности, через 6 месяцев от начала лечения ремиссия достигнута у 7 из 11 больных (64%). Ремиссия в течение 6 месяцев лечения достигнута у 50% больных, получавших Салофальк, 57% — Преднизолон и 67% — Буденофальк® (), рецидив заболевания в течение года наблюдался у 8% детей на фоне приема Салофалька, 64% — поддерживающей терапии Преднизолоном и 18% — Буденофальком®. Таким образом, эффективность топического стероида через 6 месяцев оказалась наиболее высокой в сравнении с 5-СК и системными ГКС, а его профилактический эффект в поддержании ремиссии через 1 год приближался к таковому у Салофалька. Следует отметить, однако, что слишком раннее снижение дозы Буденофалька® с 9 мг до 6 мг (через 1–2 месяца), учитывая постепенное наступление эффекта на фоне его приема, сопряжено с риском обострения, поэтому целесообразно назначать полную дозу в течение 6 месяцев, до наступления полной ремиссии, и только после этого постепенно снижать ее. В этом случае достигается не только лечебный, но и противорецидивный эффект препарата. Усиление терапии в виде перехода на системные ГКС или повышения их дозы потребовалось у 42% больных, получавших Салофальк, 7% — Преднизолон и 18% — Буденофальк®, цитостатики были назначены 43% больных на фоне Преднизолона и лишь 18% — на фоне Буденофалька®.
Наиболее значительные различия были получены в количестве и выраженности побочных реакций на терапию. У детей, получавших Буденофальк®, в 27% отмечалась лишь незначительная лунообразность лица, в то время как на фоне Преднизолона побочные реакции наблюдались у всех пациентов (), побочные реакции отмечены и у 11% больных, получавших Салофальк. Таким образом, проведенное нами исследование подтвердило достаточно высокую эффективность Буденофалька® применительно как к больным БК, так и НЯК с умеренной активностью. Препарат показал сравнимую с системными стероидами эффективность на фоне значительно большей безопасности, что особенно важно в детском возрасте. Наши данные согласуются с результатами двух рандомизированных клинических исследований по сравнению эффективности и безопасности системных (Преднизолон) и топических (будесонид) ГКС, которые были проведены у детей. В работе A.?Levin с соавт. [14] 33 пациента (средний возраст 14,3 года) с активной БК слабой или умеренной активности были рандомизированы на две группы, одна из которых в течение 12 недель получала Буденофальк® в дозе 9 мг/с, а другая — Преднизолон в дозе 40 мг/с. Группы не отличались по возрасту, локализации, активности и продолжительности болезни. Ремиссия, рассчитанная по Педиатрическому индексу активности БК (PCDAI < 10) на 12 неделе лечения, была достигнута у 9 из 19 (47%) детей, получавших Буденофальк®, и 7 из 14 (50%), получавших Преднизолон. Однако побочные эффекты наблюдались у 71% детей, получавших Преднизолон, и лишь у 32% — Буденофальк®. Тяжесть косметических побочных эффектов была значительно ниже при назначении Буденофалька®.
J.?C.?Escher с соавт. [15] провели контролируемое мультицентровое рандомизированное двойное слепое исследование. Совместными усилиями Рабочей группы по ВЗК ESPGHAN, 36 центров из 8 стран Европы приняли в нем участие. В исследование были включены 48 пациентов с впервые выявленной активной БК с илеоцекальной локализацией, средний возраст которых составил 13 лет. Больные были рандомизированы на две группы, одна из которых получала будесонид в дозе 9 мг/с в течение 12 недель, вторая — Преднизолон в дозе 1 мг/кг/с в первые 4 недели с последующим снижением в течение 4 недель до 2,5 мг/с. Первая оценка эффективности проводилась через 8 недель лечения по достижению ремиссии (индекс Беста < 150). Через 2 недели лечения 50% детей в каждой группе достигли ремиссии. К 8-й неделе ремиссия в группе детей, получавших Преднизолон, наблюдалась у 71%, будесонид — у 55%, через 12 недель ремиссия сохранялась у 55% больных, получавших будесонид, и сократилась до 60% в группе детей, получавших преднизолон. Таким образом, как и в исследовании A.?Levin, достоверных различий в эффективности системных и топических стероидов в лечении активной БК у детей получено не было.
Побочные эффекты будесонида, по данным мультицентрового исследования J.?C.?Escher [15], наблюдались у детей гораздо реже, чем при назначении Преднизолона, как и в нашем исследовании, отмечалась лишь небольшая лунообразность лица, изредка гирсутизм и перемены настроения. Подавления функции коры надпочечников, по данным утреннего уровня кортизола в плазме, практически не отмечено при назначении будесонида, в отличие от Преднизолона. Ретроспективная оценка роста детей препубертатного возраста, получавших будесонид, показала, что скорость их роста соответствовала нижней возрастной границе нормы (2 см/год) [16].
Метаанализ исследований, проведенных у взрослых, показал, что будесонид более эффективен, чем месалазин, но равен или чуть уступает эффективности системных ГКС при лечении БК с илеоцекальной локализацией умеренной активности [17]. Однако все исследования, проведенные у взрослых, продемонстрировали значительно меньшее число побочных эффектов будесонида по сравнению с системными ГКС. Базируясь на этих данных, Европейская ассоциация по изучению БК и НЯК (ECCO) рекомендует будесонид в качестве препарата выбора при илеоцекальной локализации БК слабой или умеренной активности [5].
Поддерживающая терапия будесонидом в ремиссии проспективно не изучалась у детей. Системные кортикостероиды в низких дозах оказались неэффективными в поддержании ремиссии, и, поскольку их длительный прием сопряжен у детей с нарушением роста и минерализации костей, рекомендуемый курс назначения системных ГКС при обострении ВЗК не должен превышать 3 месяца. Метаанализ 4 рандомизированных плацебо-контролируемых исследований у взрослых с БК показал, что поддерживающая терапия будесонидом в дозе 6 мг/с не эффективна в поддержании ремиссии [18], у детей в настоящее время она не рекомендуется. Полученные нами результаты позволяют рекомендовать длительные курсы Буденофалька® (не менее 6 месяцев в полной дозе с последующим снижением), при которых реализуется не только противовоспалительное, но и противорецидивное действие препарата. С учетом высокого профиля безопасности, отмеченного как нами, так и зарубежными исследователями, длительное назначение Буденофалька® (до одного года) может быть применено у детей с ВЗК без риска развития нежелательных побочных реакций.
Выводы
- Применение топических стероидов (Буденофальк®) эффективно при умеренной активности болезни Крона и неспецифического язвенного колита у детей.
- Буденофальк® более эффективно редуцирует кишечные, но не системные проявления ВЗК.
- Побочные реакции при лечении Буденофальком® слабо выражены и сводятся к незначительному лунообразному изменению лица.
- Буденофальк® следует назначать в стартовой дозе 9 мг/сут в течение 6 месяцев и снижать дозу только после наступления полной ремиссии.
- Буденофальк® в поддерживающей дозе может оказывать противорецидивное действие.
Литература
- Mamula P., Marcowitz J.?E., Baldassano R.?N. Pediatric Inflammatory Bowel Disease. Springer, 2007, 662 p.
- Marcowitz J., Grancher K., Kohn N. et al. A multicenter trial of 6-mercaptopurine and prednisone in children with newly diagnosed Crohn disease // Gastroenterology, 2000, v. 119, s. 4, p. 895– 902.
- Rhen T., Cidlowski J.?A. Antiinflammatory action of glucocorticoids — new mechanisms for old drugs // N.?Engl. J.?Med., 2005, v. 353 (s. 16), 1711–1723.
- Barnes P.?J., Adcock I.?M. How do corticosteroids work in asthma? // Ann.Intern. Med., 2003, v. 139 (s.5 pt1), p. 359–370.
- Travis S.?P., Stange E.?F., Lemann M. et al. European evidence based consensus on the diagnosis and management of Crohn disease: current management // Gut, 2006, v. 55, s. 1, p. 16–35.
- Travis S.?P., Stange E.?F., Lemann M. et al. European evidence based consensus on the management of ulcerative colitis: current management // J.of Crohn’s and Colitis, 2008, v. 2, p. 24–62.
- Mollmann H.?W., May B. et al. Glucocorticoid therapy in chronic inflammatory bowel disease — from basic principles to rational therapy.Kluwer academic publishers, Dordrecht, Boston, London,1996, p.42–60
- Marcowitz J., Hyams J., Mack D. et al. Corticosteroid therapy in the age of infliximab: acute and 1-year outcomes in newly diagnosed children with Crohn disease.?— Clin.Gasteroenterol. Hepatol., 2006, v.4 (s.9), p.1124–1129.
- Hyams J., Marcowitz J., Lerer T. et al. The natural history of corticosteroid therapy for ulcerative colitis in children // Clin Gastroenterol. Hepatol., 2006, v. 4, s. 9, p. 1118–1123.
- Faubion W.?A., Loflus E.?V., Harmsen W.?S. et al. The natural history of corticosteroid therapy for inflammatory bowel disease: a population-based study // Gastroenterology, 2001, v. 121 (s. 2), p. 255–260.
- Brattsand R. Steroid development: a case of enhanced selectivity for the bowel wall // Res. Clin. Forums, 1993, v. 15, p. 17–31.
- Lundin P.?D., Edsbacker S., Bergstrand M. et al. Pharmacokinetics of budesonide controlled ileal release capsules in children and adults with active Crohn disease // Aliment. Pharmacol. Ther., 2003, v. 17 (1), p. 85–92.
- Dilger K., Alberer M., Busch A. et al. Pharmacokinetics and pharmacodynamic action of budesonide in children with Crohn disease // Aliment. Pharmacol. Ther., 2006, v. 23 (3), p. 387–396.
- Levine A., Weizman Z., Broide E. et al. A comparison of budesonide and prednisone for treatment of active pediatric Crohn disease // J.?Pediatric. Gastroenterol. Nutr., 2003, v. 36 (2), p. 248–252.
- Escher J.?C. Budesonide versus prednisolone for treatment of active Crohn disease in children: a randomized, double-blind< controlled, multicentre trial//Eur.J.Gastroenterol. Hepatol.,2004, v.16 (1), p. 47–54
- Kundhal P., Zachos M., Holmes J.?L., Griffiths A.?M. Controlled ileal release budesonide in pediatric Crohn disease: efficacy and effect on growth // J.?Pediatr. Gastroenterol. Nutr., 2001, v. 33 (1), p.75–80.
- Otley A., Steinhart A.?H. Budesonide for induction of remission in Crohn disease // Cochrane Database Syst. Rev., 2005 (4): CD000296.
- Simms L., Stenhart A.?H. Budesonide for maintenance of remission in Crohn disease // Cochrane Database Syst. Rev., 2001 (1): CD002913.
Е. А. Корниенко*, доктор медицинских наук, профессор Е. А. Ломакина* Н. К. Залетова* С. А. Фадина**
*Санкт-Петербургская государственная педиатрическая медицинская академия Росздрава, **Детская городская клиническая больница № 5 им. Н. Ф. Филатова, Санкт-Петербург
Контактная информация об авторах для переписки
Как действуют топические стероиды?
Если объяснить по-простому, то топические стероиды проникают в клетки кожи и связываются с имеющимися там стероидными рецепторами. После этого запускается каскад реакций, в результате которых уменьшается выброс биологически активных веществ, вызывающих воспалительную реакцию. В частности, уменьшается выброс гистамина – виновника воспалительных и аллергических реакций, сужаются сосуды, уменьшаются зуд, отек, покраснение.
Но это еще не все. Топические стероиды тормозят деление клеток кожи, которое при некоторых заболеваниях выходит из-под контроля, и его нужно обуздать. Например, при псориазе.
Но вместе с тем они подавляют местный иммунитет. Защитная функция кожи снижается, и поэтому в списке побочных реакций мы можем прочитать:
- Стероидные угри,
- Активация вирусной, бактериальной или грибковой инфекции,
- Задержка регенерации ран, трофических язв.
Это далеко не полный перечень побочных реакций, которые могут вызывать наружные стероиды.
Помимо снижения местного иммунитета, гормоны подавляют функцию фибробластов. Фибробласты — самые главные клетки кожи, т.к. они вырабатывают все, что ей нужно для полного счастья. Ну, и нам, конечно.
Это гиалуроновая кислота, коллаген, эластин, которые отвечают за увлажненность, упругость и эластичность кожи.
Если подавляется функция фибробластов, кожа попросту атрофируется. Внешне атрофированная кожа выглядит блестящей, морщинистой, и через нее начинают просвечивать мелкие внутрикожные и подкожные сосуды, т.е. появляются телеангиэктазии.
Этим же объясняется возможное появление стрий (растяжек).
Как анаболические стероиды влияют на мозг?
Анаболические стероиды действуют не так, как другие наркотики; они не оказывают краткосрочного воздействия на мозг. Наиболее важным отличием является то, что стероиды не активируют систему вознаграждения напрямую, они не вызывают быстрого увеличения в мозгу химического дофамина, которого усиливают большинство наркотиков.
Неправильное использование анаболических стероидов может привести к негативным психическим последствиям, таким как:
параноидальная (экстремальная, необоснованная) ревность
крайняя раздражительность и агрессия («бешеная ярость»)
бред — ложные убеждения или идеинарушение суждения
нарушение мышления
мания
Прочие нежелательные реакции
Иногда наружные стероидные средства вызывают тахифилаксию. Этот термин означает, что эффективность препарата при повторном применении снижается.
После длительного применения кортикостероидов возможен синдром отмены, когда все симптомы разгораются с новой силой. Получается замкнутый круг.
В ряде случаев препараты этой группы вызывают аллергический дерматит.
К тяжелым последствиям относится подавление функции надпочечников и развитие синдрома Иценко-Кушинга (лунообразное лицо, ожирение, отечность конечностей и пр.), надпочечниковой недостаточности, развитие стероидной язвы желудка.
У детей длительное использование препаратов этой группы приводит к нарушению секреции гормона роста и задержке роста.
Так что, когда при жалобах покупателя на кожный зуд и шелушение ваша рука сразу тянется за Синафланом, вспомните эту статью.
Как делятся топические кортикостероиды?
Классификация по активности:
Принцип назначения топического стероида по активности:
- Стероиды слабой активности назначаются при слабо выраженных воспалительных проявлениях. Раньше, до появления современных топических стероидов, их использовали при локализации воспаления на лице, шее, в области складок, т.к. здесь самый тонкий эпидермис, высокая плотность стероидных рецепторов и много сосудов. Поэтому выше риск побочных реакций.
- Препараты средней степени активности показаны при отсутствии эффекта от средств 1 класса и при более выраженном воспалении.
- Сильные топические стероиды применяются при выраженном воспалении: покраснение кожи, отечность, участки уплотнения (бляшки), выраженный зуд, а также при утолщении кожи (гиперкератозе).
- Очень сильные стероиды назначаются, как правило, при неэффективности препаратов первых трех групп.
Классификация местных кортикостероидов по составу
По составу топические стероиды делятся на галогенизированные и негалогенизированные.
Галогенизированные – такие, в молекуле которых содержится один или несколько атомов галогенов (фтора или хлора).
Галогенизированные дают больше нежелательных реакций, т.к. галоген в молекуле действующего вещества замедляет метаболизм стероида, и он дольше существует в активной форме. К тому же они плохо связываются с транспортными белками и медленнее выводятся из организма.
Особенно грешат этим старенькие препараты: Флуцинар, Синафлан, Фторокорт.
Галогенизированные, в свою очередь, делятся на фторсодержащие и хлорсодержащие.
Фторсодержащие – это Лоринден, Фторокорт, Триакорт, Синафлан, Флуцинар, Акридерм, Целестодерм-В, Белодерм, Дермовейт.
Фторсодержащие препараты чаще других вызывают атрофию кожи при длительном применении.
Хлорсодержащие – это Элоком, Афлодерм. Если их сравнивать с фторсодержащими, то лечебный эффект при их использовании наступает быстрее, и они более безопасны.
Негалогенизированные – это Адвантан и Локоид. Отличаются низкой частотой нежелательных реакций и минимальным системным действием.
Публикации
Опыт применения топических стероидов в дерматологической практике для лечения распространенных форм дерматозов, таких, как атопический дерматит (АД), экзема, псориаз, насчитывает более 50 лет. Однако проблема выбора оптимального средства наружной терапии актуальна и сейчас.
Современная терапия аллергодерматозов, наряду с элиминационными и диетическими мероприятиями, а также лекарственными препаратами, действие которых направлено на различные звенья патогенеза, включает в себя применение наружных средств. Местная терапия строится индивидуально с учетом периода заболевания, его клинико-морфологической формы, наличия сопутствующих изменений кожи и осложнений. Особенно важен правильный выбор в лечении осложненных форм аллергодерматозов в связи с тем, что в патогенезе заболевания участвуют различные факторы (бактериальные, грибковые и др.). Консенсус дерматологов и педиатров предусматривает раннюю наружную терапию с использованием наружных кортикостероидов при выраженном обострении процесса на коже, длительный контроль заболевания, безопасную эффективную терапию, обеспечивающую одновременно раннее облегчение симптомов и длительный контроль.
Механизм противовоспалительного эффекта глюкокортикостероидов (ГКС) объясняется широким спектром иммунорегуляторного воздействия на клетки, отвечающие за развитие и поддержание аллергического воспаления кожи (клетки Лангерганса, лимфоциты, эозинофилы, макрофаги, тучные клетки и другие) и вазоконстрикторным эффектом на сосуды кожи, уменьшающим отек. Использование топических ГКС подавляет 3 основных компонента развития аллергического воспаления: высвобождение медиаторов, миграцию клеток в зону поражения и их пролиферацию.
Противовоспалительная активность и выраженность побочных эффектов от применения ГКС зависят от структуры их молекулы и лекарственной формы препарата. Один из первых ГКС для наружного применения — гидрокортизон является слабым наружным противовоспалительным препаратом, так как медленно проникает через эпидермис и недостаточно прочно связывается с ГКС-рецепторами клеток, обеспечивающими транспорт препарата в ядро клетки и его дальнейшую фармакологическую активность. В связи с этим были созданы более активные синтетические производные: эстерифицированные (молекула стероида модифицирована путем введения эфиров жирных кислот) и галогенизированные (включены галогены — фтор или хлор).
Введение в молекулу гидрокортизона фтора позволило значительно увеличить противовоспалительную активность препаратов. Однако увеличение терапевтической активности привело к параллельному усилению выраженности местных побочных эффектов. Нежелательные эффекты обусловлены высокой способностью фторированных ГКС-препаратов связываться с соответствующими рецепторами не только иммунокомпетентных клеток, участвующих в воспалении, но и других клеток кожи, вызывая при длительном применении атрофические процессы в коже. Применение фторсодержащих ГКС в большом объеме (на обширные очаги поражения) может приводить к появлению системных эффектов за счет подавления выработки эндогенных глюкокортикостероидов. Современная классификация кортикостероидов для наружного применения подразделяет их на 7 основных групп.
| Сила действия | Группа | Препарат | Форма выпуска | Коммерческое название | % активного вещества | |
| Очень сильные | 1 | Клобетазола пропионат | крем, мазь, раствор | Psoriderm | 0,05 | |
| Бетаметазона дипропионат | крем, мазь | Diprolene | 0,05 | |||
| Дифлоразона диацетат | мазь | Psorcon | 0,05 | |||
| Сильные | 2 | Мометазона фуроат | мазь | Elocom | 0,1 | |
| Бетаметазона дипропионат | мазь | Diprosone | 0,05 | |||
| Амцинонид | мазь | Cyclocort | 0,1 | |||
| Дифлоразона диацетат | мазь | Florone, Maxiflor | 0,05 | |||
| Галцинонид | крем | Halog | 0,1 | |||
| Флуоцинонид | крем, гель, мазь | Lidex | 0,05 | |||
| Дезоксиметазон | крем, гель, мазь | Topicort | 0,25 | |||
| 3 | Бетаметазона дипропионат | крем | Diprosone | 0,05 | ||
| Амцинонид | крем, лосьон | Cyclocort | 0,1 | |||
| Триамцинолона ацетонид | Крем,мазь | Neoderm, Ftorocort | 0,1 | |||
| Дифлоразона диацетат | крем | Florone | 0,05 | |||
| Галцинонид | мазь | Halog | 0,1 | |||
| Бетаметазона валерат | мазь | Celestoderm, Valisone | 0,1 | |||
| Умеренно сильные | 4 | Флурандренолид | мазь | Cordran | 0,05 | |
| Мометазона фуроат | крем | Elocom | 0,1 | |||
| Триамцинолона ацетонид | крем | Kenalog | 0,1 | |||
| Флуоцинолона ацетонид | мазь | Flucinar, Sinaflan | 0,025 | |||
| Гидрокортизона валерат | мазь | Westcort | 0,2 | |||
| 5 | Флурандренолид | крем | Cordran | 0,05 | ||
| Бетаметазона дипропионат | лосьон | Diprosone | 0,05 | |||
| Мометазона фуроат | лосьон | Elocom | 0,1 | |||
| Бетаметазона валерат | крем | Celestoderm, Valisone | 0,1 | |||
| Гидрокортизона бутират | крем | Locoid | 0,1 | |||
| Триамцинолона ацетонид | лосьон | Kenalog | 0,1 | |||
| Флуоцинолона ацетонид | крем | Synalar, Flucinar | 0,025 | |||
| Гидрокортизона валерат | крем | Westcort | 0,2 | |||
| Слабые | 6 | Бетаметазона валерат | лосьон | Valisone | 0,05 | |
| Триамцинолона ацетонид | крем | Aristocort | 0,1 | |||
| Дезонид | крем | DesOwen, Tridesilone | 0,05 | |||
| Флуоцинолона ацетонид | крем, р-р | Synalar | 0,01 | |||
| Аклометазона дипропионат | крем, мазь | Aclovate | 0,05 | |||
| 7 | Топические стероиды на основе гидрокортизона, дексаметазона, флуметалона, преднизолона и метилпреднизолона | |||||
В лечении осложненных форм АД и микробной (микотической, паратравматической, нумулярной, импетигинозной) экземы наиболее эффективными являются комбинированные ГКС для наружного применения. Выделяют следующие группы препаратов:
— ГКС (гидрокортизон, преднизолон, деперзолон) слабые и умеренно-сильные в сочетании с антибиотиками (окситетрациклин, левомицетин и др.); например — гиоксизон (содержит гидрокортизона ацетат и окситетрациклина гидрохлорид), оксикорт (содержит гидрокортизон и окситетрациклин);
— сильные ГКС в комбинации c АБ – синалар Н (флуоцинолон и неомицин), целестодерм В (бетаметазона валерат, гарамицин), дипрогент (бетаметазона дипропионат и гентамицина сульфат), випсогал (бетаметазона дипропионат, флуоцинолон-ацетонид, гентамицина сульфат, салициловая кислота, пантенол);
— ГКС слабые и умеренно-сильные в сочетании с антисептиками (хлоргексидин, сера, йодоксихинолин), например — сибикорт (гидрокортизон и хлоргексидин), ауробин (преднизолона капронат, триклозан, лидокаин), кортомицетин (гидрокортизона ацетат и левомицетин), сульфодекортем (гидрокортизона ацетат и осажденная сера), дермозолон (йодгидроксихинолин и преднизолон). Известны комбинации сильных ГКС для местного применения –лоринден С (йодгидроксихинолин и флуметазон), синалар К (флуоцинолон и клиохинол), флуцинар (флуоцинолон и клиохинол), сикортен плюс (галометазон и триклозан);
— ГКС слабые и умеренно-сильные в сочетании с противогрибковыми веществами (миконазол, натамицин), например, пимафукорт (содержит гидрокортизон, натамицин и неомицин), микозолон ( миконазол и деперзолон (мазипредон);
— ГКС сильные в сочетании с противогрибковыми веществами – травокорт (изоконазолнитрат и дифлукортолон валерат).
Учитывая тот факт, что в патогенезе различных форм микробной экземы, осложненных форм микотической инфекции, пустулезного псориаза, играют роль одновременно и микробные, и грибковые агенты, максимально эффективными ГКС наружного применения будут:
— препараты, содержащие одновременно и антибактериальные, и противогрибковые средства – Неодерм (грамицидин, неомицина сульфат, нистатин, триамцинолона ацетонид).
Показаниями к применению препарата являются дерматозы, чувствительные к лечению кортикостероидами, а также вторично инфицированные бактериями или грибами, включая атопический дерматит, себорейный дерматит, малассейзия инфекции, паховую эпидермофитию, эпидермофитии стоп, смешанные формы интертриго стоп, псориаз, аллергический контактный дерматит, микробную экзему. Крем «Неодерм» разрешается применять на мокнущие поверхности и опрелости. Крем «Неодерм» сочетает в себе противовоспалительный, противозудный, противоаллергический и антиэкссудативный эффект триамцинолона ацетонида с противогрибковой активностью нистатина и широким антибактериальным действием неомицина сульфата и грамицидина. Нистатин оказывает противогрибковое и антибактериальное действие (является противогрибковым антибиотиком, относящимся к группе полиенов-макролидов). Обладает преимущественно фунгистатическим эффектом за счет связывания с эргостерином и повреждения барьерной функции мембраны грибов. Активен в отношении Candida albicans, а также грибов рода Aspergillus. Неомицина сульфат, антибиотик широкого спектра действия из группы аминогликозидов, действует бактерицидно и обеспечивает высокоэффективное местное лечение первичных и вторичных бактериальных инфекций кожи. Активен в отношении грамотрицательных микроорганизмов: Pseudomonas aeruginosa, Aerobacter aerogenes, Escherichia coli, Proteus vulgaris, Klebsiella pneumoniae; грамположительных микроорганизмов: Streptococcus spp. (чувствительные штаммы альфа- и бета-гемолитического стрептококка группы А), Staphylococcus aureus (коагулаза-положительные, коагулаза-отрицательные и некоторые штаммы, продуцирующие пенициллиназу). В качестве побочных эффектов может отмечаться контактная аллергическая реакция на неомицин. Риск развития побочных эффектов возрастает при применении наружных ГКС, содержащих антибиотики, более 7-10 дней, что требует построения рациональной врачебной тактики в отношении наружного лечения больных дерматозами, своевременного использования «чистых» ГКС или других средств наружной терапии. Грамицидин – антибиотик, обладающий одновременно бактериостатическим и бактерицидным действием, активен в отношении Streptococcus spp., Staphylococcus spp., анаэробных бактерий, что особенно важно при лечении поражений складок. Существуют также литературные данные об эффективности «Неодерма» в наружной терапии больных пустулезным псориазом. Это объясняется особенностями микробной флоры кожи и местными иммунными изменениями, а также целесообразностью воздействия не только на бактерии, но и на грибковые микроорганизмы.
С целью определения эффективности препарата «Неодерм» для наружной терапии осложненных форм экземы у взрослых была сформирована группа из 29 человек (18 — мужчины, 11 – женщины), страдающие различными формами экземы: 13 — микробная нумулярная экзема, 10 — микотическая экзема стоп, 3 — паратравматическая экзема, 2 — импетигинозная экзема голеней, 1 — варикозная экзема голеней. У 24 пациентов экзематозный процесс находился в стадии обострения и сопровождался выраженной везикуляцией, мокнутием, у остальных экзема находилась в подострой стадии, сопровождаясь эритемой и инфильтрацией в очагах. Помимо наружной терапии все пациенты получали гипосенсибилизирующие и антигистаминные препараты внутрь.
Системно кортикостероиды не назначались. Препарат «Неодерм» применялся 2 раза в сутки в течении 7-10 дней. На фоне терапии отмечался выраженный регресс клинических симптомов заболевания уже к 3-4 дню лечения (мокнутие регрессировало на 3-й день терапии у 21 из 24 пациентов, симптомы острого воспаления значительно уменьшились у всех пациентов на 7-й день лечения, инфильтрация на 10-й день терапии сохранялась лишь у 5-х). В дальнейшем пациентам проводилось симптоматическая противовоспалительная наружная терапия. Побочных эффектов при применении препарата «Неодерм» не наблюдалось. Таким образом, крем «Неодерм» высокоэффективен при комбинированных поражениях кожи, вызванных смешанной инфекцией и сопровождающихся выраженной воспалительной реакцией. Это позволяет рекомендовать его для широкого применения в дерматологической практике как противовоспалительное, антибактериальное и антимикотическое средство в качестве первого этапа наружной терапии дерматозов.
Также в современной литературе (И.М. Корсунская, Е.В. Дворянкова, 2002) нами были обнаружены данные об использовании аналогичного препарата в детской дерматологической практике. Выбор конкретного препарата зависит от знания морфофункциональных особенностей детской кожи, механизма действия, химической структуры и фармакокинетики применяемого средства, местных и системных побочных эффектов. В детской дерматологической практике должна быть четко обоснована необходимость назначения глюкокортикостероидных средств и методика использования. Назначая их, следует руководствоваться следующими принципами: максимальная эффективность, безопасность, минимальная кратность нанесения. До 40% случаев атопического дерматита осложняются вторичным инфицированием кожи (К.Н. Суворова, В.Т. Куклин, 1996), что способствует хронизации аллергического воспаления. Для лечения осложненных форм АД у детей в комплексной терапии применяются топические кортикостероиды в комбинации с антибиотиками и противогрибковыми средствами.
Сочетание в одном препарате противоаллергического, антибактериального и противогрибкового эффектов делает «Неодерм» оптимальным для наружного лечения осложненных форм АД у детей. С целью определения эффективности и безопасности применения препарата «Неодерм» у детей старше 5 лет препарат назначался 12 пациентам в возрасте 6-14 лет со среднетяжелым и тяжелым течением атопического дерматита, осложненным инфекцией. Препарат назначался 2 раза в день. Наружная терапия сочеталась с системными гипосенсибилизирующими и антигистаминными препаратами. Регресс клинических симптомов заболевания (уменьшение зуда, гиперемии, отека, мокнутия) отмечался уже на 2-й день лечения у 8 из 12 пациентов, на 5-6 день лечения островоспалительные симптомы заболевания регрессировали у всех детей. Длительность наружной терапии у детей составляла не более 6 дней. Приведенные данные свидетельствуют о том, что применение «Неодерма» значительно повышает эффективность лечения осложненных форм АД у детей и ведет к сокращению сроков лечения обострений.
Имеются также данные об эффективности препарата «Неодерм» в лечении пиодермий, сопровождающихся значительным отеком, микроспории гладкой кожи, преимущественно в тех случаях, когда в анамнезе имелся атопический дерматит разной степени тяжести, крапивница и бронхиальная астма, отмечались аллергические кожные реакции на средства, обычно применяемые для лечения микроспории (йод и серно-салициловая или серно-дегтярная мази). Перечень показаний для применения крема «Неодерм» постоянно расширяется.
В заключении необходимо отметить, что средства наружной терапии аллергических заболеваний кожи пополнились еще одним высокоэффективным препаратом «Неодерм», применение которого как у детей, так и у взрослых позволяет сократить сроки лечения комбинированными кортикостероидами и увеличить эффективность терапии осложненных форм аллергических заболеваний кожи.
Список литературы:
- Атопический дерматит у детей: диагностика, лечение и профилактика. Научно-практическая программа Союза педиатров России. Международный Фонд охраны здоровья матери и ребенка. Москва.2000.-76с.
- Бутов Ю.С., Ланге Д.А. Перечень антигистаминных препаратов, применяемых в дерматологии/Российский журнал кожных и венерических болезней, 1999,№5.-с70-72.
- Гущин И.С. Антагонисты Н1-рецепторов как противоаллергические лекарственные средства/ Терапевтический архив,1997,№10.-с 27-34.
- Итоги и перспективы применения топических корикостероидов польского Фармзаводы Ельфа А.О. Самгин М.А., Монахов С.А. /Рецепт, 2005/Приложение.- с9-16.
- Кожные и венерические болезни. Руководство для врачей/ Под ред. Скрипкин Ю.К. Медицина,1995;2:88-96.
- Козин В.М. Наружная фармакотерапия дерматозов: Учеб. Пособие.-Мн.:Выш.шк.,1997.-80с.
- Козин В.М. Дерматология:Учеб.пособие.-Мн.:Выш.шк.,1999.-304с.
- Короткий Н.Г., Таганов А.В., Тихомиров А.Л. Современная наружная терапия дерматозов. Тверь, 2001.528с.
- Лекарственные препараты в России. Справочник Видаль. М.,2005.
- Лечение дерматозов у детей. Ф.А. Зверькова, И.А. Горланов, В.П. Качанов. Санкт-Петербург.2-е изд., 1999.-63с.
- Наружные кортикостероиды в терапии аллергодерматозов. Ю.С. Бутов, Ю.А. Родина/Рецепт, 2005/Приложение.-С2-8.
- Ревыкина В.А. Общие принципы диагностики и лечения пищевой аллергии у детей/ Русский медицинский журнал,2000, том 8,№7.-с1-8.
- Сосновский А.Т. Яговдик Н.З. Дерматологический справочник.-Мн.:Выш.шк.,1992.-512с.
- И.А.Шахтмейстер, Н.Л.Шимановский ©, 1999-2000.Российский государственный медицинский университет, Москва. Российская детская клиническая больница, Москва. Применение местных кортикостероидов наружно.
Шиманская И.Г.
Медицинская панорама №1, 2007г.
Комбинированные наружные средства, содержащие кортикостероиды
Все препараты, которые я назвала выше, применяются, когда дерматиты, псориаз, экзема и другие заболевания протекают без особенностей.
Но бывает, что они осложняются бактериальной инфекцией, и тогда на стандартных высыпаниях появляются гнойнички, усиливаются гиперемия кожи и зуд. В этом случае показаны препараты 2 в 1: гормон + антибактериальный компонент.
К таким препаратам относятся:
- Целестодерм-В с гарамицином,
- Белогент,
- Дипрогент,
- Гиоксизон,
- Оксикорт,
- Лоринден С,
- Флуцинар Н,
- Акридерм Гента.
Гормоны применяются и при микозе стопы, если он протекает с выраженной воспалительной реакцией, когда усиливаются краснота кожи, зуд, появляется мокнутие. В этой ситуации назначают комбинированный препарат, содержащий антимикотик и гормон:
- Травокорт,
- Кандид Б.
В сложных случаях, когда неясно, что здесь присоединилось: то ли бактериальная, то ли грибковая инфекция, то ли все вместе, назначают препараты 3 в 1, которые содержат гормон + антибиотик + антимикотик:
- Тридерм,
- Пимафукорт,
- Акридерм ГК.
И еще одна группа комбинированных средств – это препараты, содержащие гормон и салициловую кислоту. При различных кожных заболеваниях, например, при том же псориазе, отмечается гиперкератоз. Роговой слой утолщается, и через него наружные средства проникнуть не могут. Что в этом случае нужно делать? Размягчить его с помощью салициловой кислоты.
В данной ситуации лучше всего подойдут препараты:
- Белосалик,
- Дипросалик,
- Лоринден А,
- Акридерм СК.
Что нужно учитывать при выборе лекарственной формы?
Теперь по поводу выбора лекарственной формы.
Здесь учитываются:
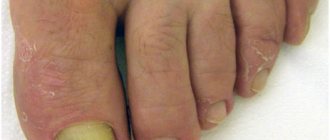
- Место нанесения препарата. Например, Синафлан, Флуцинар и Фторокорт нельзя наносить на лицо и прочие нежные участки кожи, т.к. здесь всасываемость препарата очень высокая.
Привожу всасываемость наружных средств на разных участках тела сверху вниз от минимальной к максимальной:
- Подошва,
- Ладони,
- Предплечье,
- Спина,
- Волосистая часть головы,
- Лицо,
- Гениталии.
- Возраст пациента.
Глубина проникновения препарата максимальна при использовании его в форме мази, меньше – в форме крема, еще меньше – в форме лосьона, эмульсии или раствора.
Через нежную детскую кожу препараты всасываются быстрее, и системные эффекты проявятся быстрее. Поэтому нужно строго соблюдать возрастные ограничения и длительность курса, рекомендованную производителем. Если в конкретной ситуации можно предложить и мазь, и крем, лучше отдать предпочтение крему. Но это не значит, что детям нельзя рекомендовать мази. При соответствующей симптоматике можно и даже нужно. Дальше разберем.
Будьте осторожны и с пожилыми людьми. С возрастом кожа теряет коллаген и эластин, снижается синтез кожных липидов, которые выполняют защитную функцию, истончается эпидермис. Поэтому, если симптоматика позволяет, для них тоже лучше отдавать предпочтение крему. Или тем препаратам, который дают минимум побочных.
- Симптоматика и стадия заболевания:
- Кожа сухая или нет?
- Покраснение сильное или умеренное?
- Кожа утолщенная?
- Есть ли мокнутие?
- Есть ли на коже гнойники?
- Зона поражения. Чем она больше, тем больше наносится на кожу топического стероида, тем выше риск системных реакций. Если по состоянию кожи можно рекомендовать и мазь, и крем, предпочтение крему. Но некоторые современные средства можно наносить на обширные участки. Смотрите дальше.
Креативные стратегии топической терапии псориаза
В современных публикациях по лечению псориаза подавляющее большинство работ принадлежит изучению генно-инженерных биологических препаратов и их влиянию на течение и прогноз данной патологии. Несмотря на это, для практикующих дерматологов сохраняет актуальность проблема оптимизации топической терапии, поскольку в большинстве случаев у пациентов, страдающих псориазом, поражено менее 10 % поверхности тела. Низкая приверженность к лечению, разные предпочтения пациентов, различные типы кожи и другие факторы требуют создания новых стратегий и их индивидуальной оптимизации под каждого пациента.
Американские дерматологи из Университета Калифорнии Karina Koo, Caleb Jeona и Tina Bhutania озаботились тем, что в последние годы все меньше публикаций посвящено данному методу лечения псориаза, что в скором времени, учитывая подобную тенденцию, может привести к полной утрате его применения. В связи с этим они выполнили обзор более 15 статей, касающихся этой темы, в котором обобщили имеющиеся данные по следующим пяти стратегиям топической терапии псориаза:
- Проактивная терапия;
- Ротационная терапия;
- Последовательная терапия;
- «Резкий старт» с высокоактивного топического средства для усиления эффективности средств с более медленным началом действия;
- Комбинированное лечение с применением нескольких более безопасных, но менее эффективных топических препаратов.
Некоторые из вышеперечисленных методов были утверждены в качестве вариантов для лечения других хронических воспалительных заболеваний кожи. Однако, по мнению авторов данного обзора, ввиду единства патогенетических механизмов эти стратегии применимы и для лечения псориаза.
Предотвращение рецидивов: проактивная терапия
Активность псориаза варьирует с течением времени, его рецидивы непредсказуемы, поэтому при первых признаках повышения активности возможно использование более безопасных топических ГКС с целью «подавления в зародыше» рецидива заболевания. Что представляет из себя проактивная терапия? Суть ее заключается в интенсивном местном лечении до почти полного исчезновения всех очагов поражения с последующим длительным прерывистым нанесением топических ГКС в сниженных дозах на ранее пораженные участки кожи.
Поскольку спектр безопасности топических средств, применяемых для проактивной терапии (в основном речь идет о топических ГКС и ингибиторе кальциневрина — такролимусе), достаточно благоприятен при надлежащем применении, следует обеспечить наличие этих препаратов дома у пациента, чтобы их можно было использовать при первых признаках обострения.
Эффективность проактивной терапии была показана в основном для лечения атопического дерматита (Wollenberg A et al., Allergy 2008; Fukuie T et al., Journal of Dermatology, 2016), однако авторы обзора считают возможным использование результатов этих исследований в лечении больных псориазом.
Ротационная терапия
Топическая ротационная терапия предполагает чередование двух топических средств с разным механизмом действия для поддержания эффективности лечения с сохранением приемлемого профиля безопасности при длительном применении.
Как правило, такая стратегия предполагает использование стероидного и нестероидного средств. Топические стероиды характеризуются быстрым началом действия. Однако следует учитывать, что наиболее эффективные высокоактивные топические стероиды при длительном применении приводят к развитию крайне нежелательных побочных эффектов. С целью минимизации таких побочных эффектов при использовании стероидов рекомендуются периодические «стероидные каникулы».
Ротационная терапия предполагает резкий переход с топического стероида на более безопасный, но менее эффективный нестероидный препарат. В рамках этой стратегии возможно использование только тех средств, для которых было продемонстрировано, что резкое переключение с топического стероида не приведет к рецидиву заболевания.
Возможность такой стратегии была изучена для схемы клобетазол-кальцитриол. В исследовании, включившем в себя 170 больных псориазом, в течение месяца проводилась терапия спреем клобетазола (прим. — в РФ зарегистрирован только в форме крема/мази) дважды в день с внезапным переходом на мазь кальцитриола дважды в день. Результаты лечения клобетазолом превзошли ожидания: у 93 % пациентов в конце 4 недели терапии кожа была чистой, почти чистой или с легкими проявлениями заболевания. Кроме того, этот результат сохранялся в течение 4 недель терапии кальцитриолом. Выраженное уменьшение доли пациентов, заболевание у которых было под контролем, произошло между 8 и 12 неделями терапии кальцитриолом — с 92 до 74 %.
Авторы исследования сделали вывод о том, что минимальный риск рецидива при использовании схемы клобетазол-кальцитриол достигается при переключении препаратов каждые 4 недели, не дожидаясь выраженного ухудшения. Авторы обзора указывают, что теоретически такая схема с ежемесячным чередованием двух препаратов может использоваться на протяжении неопределенно длительного времени. Эта стратегия может предотвратить развитие тахифилаксии к клобетазолу, возникающей при постоянном его применении.Также в данной ситуации нет необходимости длительного приема стероидов — создаются «стероидные каникулы», которые возможны благодаря периодам применения кальцитриола.
Таким образом, предложенная схема позволяет креативно использовать топические средства, добиваясь максимальной эффективности при сохранении приемлемого уровня безопасности в долгосрочной перспективе. Вероятно, ротационная терапия возможна и с применением других средств — это предстоит оценить в будущих исследованиях.
Последовательная терапия
Последовательная терапия предполагает комбинацию мощных топических стероидов с более мягкими нестероидными препаратами в заранее предусмотренной последовательности, позволяющей максимизировать эффективность в начале лечения и обеспечить более безопасную долгосрочную поддерживающую терапию.
Схема обычно включает три ступени:
- Индукция ремиссии или фаза «очищения» кожи;
- Переходная фаза;
- Фаза поддерживающей терапии.
Во время первой фазы акцент стоит на максимальной эффективности. При первом обращении к дерматологу псориаз, как правило, плохо контролируется или даже находится в состоянии рецидива — такая ситуация требует быстрого разрешения.
В инициальной фазе лечения возможно ежедневное применение высокоактивных топических стероидов как основного средства в комбинации с нестероидными препаратами, такими как аналог витамина D, в качестве вспомогательного средства. В клинических исследованиях показано, что комбинированная терапия топическими стероидами и аналогами витамина D более эффективна, чем применение только высокоактивных стероидов дважды в день.
Вторая, «переходная» фаза предполагает продолжение терапии нестероидными средствами дважды в день в будние дни и топическими стероидами в выходные. Цель переходной фазы — плавный переход из первой фазы с ее акцентом на высокоактивных топических стероидах в третью фазу поддерживающей терапии, предполагающей применение более безопасных средств. Успехи ротационной терапии обсуждались и ранее, однако нет убедительных доказательств использования других высокоактивных ГКМ, кроме клобетазола, в связи с чем нет возможности оценить риск развития обострений или рецидивов при их отмене.
Рисунок 1 | Стандартная последовательная терапия. Источник: Evolution of Topical Therapy in the Treatment of Psoriasis: A Review //Journal of Psoriasis and Psoriatic Arthritis. – 2015
Рисунок 2 | Последовательная терапия с применением комбинации бетаметазон/кальципотриол. Источник: Evolution of Topical Therapy in the Treatment of Psoriasis: A Review //Journal of Psoriasis and Psoriatic Arthritis. – 2015
Использование последовательной стратегии позволяет минимизировать риск рецидива благодаря постепенной отмене высокоактивного стероида в переходную фазу. Эффективность такого метода продемонстрирована в клиническом исследовании, в котором было показано, что чередование нестероидных препаратов в будние дни со стероидными в выходные позволяет контролировать псориаз в два раза лучше, чем только использование стероидов по выходным.
В рамках последовательной терапии возможно применение и других схем, в которых переход с более мощных препаратов на более безопасные, предназначенные для длительной поддерживающей терапии, осуществляется не только в пределах средств для топического применения, например, переход с циклоспорина на ацитретин или фототерапию.
«Резкий старт» с высокоактивного стероида для усиления эффективности средств с более медленным началом действия
Поскольку псориаз относится к хроническим заболеваниям, неудивительно, что некоторые терапевтические стратегии были разработаны с учетом предпочтительной долгосрочной эффективности в ущерб быстрому началу эффекта. Это относится, в частности, к таким препаратам для системного применения, как апремиласт и ацитретин, а также к фототерапии, включая UVB или комбинацию псоралена и UVA Однако нередко требуется, исходя из тяжести течения псориаза или предпочтений самого пациента, чтобы эффект от применяемого ЛС развивался в максимально короткий срок. происходило в ультракороткий срок. В таких ситуациях совместное назначение высокопотентных стероидов может ускорить начало действия медленнодействующих препаратов.
Терапия комбинацией более безопасных, не менее эффективных методов
Доступные средства для лечения псориаза можно условно разделить на более эффективные, но менее безопасные при длительном приеме, и менее эффективные, подходящие для длительного приема. Возможно использование комбинации средств из второй группы с целью «суммации» их терапевтического эффекта с сохранением при этом приемлемого уровня безопасности. Рациональность такого подхода продемонстрирована, например, для комбинаций кальципотриола и UVB-терапии; кальципотриола с системными препаратами — ацитретином, циклоспорином или метотрексатом.
Таким образом, в обзоре литературы продемонстрировано, что многие стратегии для лечения псориаза основаны на комбинировании препаратов с разным механизмом действия. Однако авторы обзора обращают внимание, что комбинированные схемы рациональны не для всех препаратов или методов лечения. Так, например, топические средства, имеющие кислотную среду — а это большинство топических стероидов, — могут инактивировать кальципотриол при прямом контакте этих двух средств. В то же время правильное сочетание некоторых средств с применением описанных в обзоре стратегий способно значительно улучшить результаты лечения псориаза.
Источник:
Koo K., Jeon C., Bhutani T. Beyond monotherapy: a systematic review on creative strategies in topical therapy of psoriasis //Journal of Dermatological Treatment. – 2022. – Т. 28. – №. 8. – С. 702-708.
Алгоритм выбора формы топического стероида
- При хроническом процессе, который проявляется сухостью кожи, шелушением, незначительной краснотой, назначаются мази.
Они отличаются высоким содержанием липидов, заменяющих собой нарушенный липидный слой эпидермиса, например, при атопическом дерматите. Восстанавливают барьерную функцию кожи.
Недостатки: жирность кожи после нанесения, пятна на одежде.
- Кремы, гели содержат в 2 раза меньше липидов, не препятствуют испарению воды с поверхности кожи. Применяются при острых процессах с выраженной краснотой, отечностью кожи, мокнутием, а также там, где участки кожи соприкасаются друг с другом: паховые складки, локтевые, подколенные сгибы.
Хорошо впитываются и не оставляют пятен на одежде.
- Лосьоны, аэрозоли, растворы, эмульсии чаще всего применяются на волосистой части головы.
Эти лекарственные формы назначают также для нанесения на кожу в области складок, т.к. выше я уже говорила, что эпидермис здесь очень тонкий, поэтому нужна форма с минимальным проникновением, чтобы уменьшить риск нежелательных реакций.
Преимущества некоторых наружных кортикостероидов
Выделю несколько препаратов, которые имеют ряд явных преимуществ.
Афлодерм – создан специально для нанесения на нежные участки кожи: лицо, шею, область гениталий.
Детям разрешен с 6 мес, может применяться беременными и кормящими.
Крем – при остром воспалении с мокнутием.
Мазь – при хроническом процессе с сухостью и шелушением кожи.
Максимальный курс – 3 недели.
Адвантан – негалогенизированный препарат, а значит, максимально безопасный. Системное действие минимально.
Если другие препараты наносятся 2-3 раза в день, то Адвантан всего 1 раз в день.
Может использоваться длительно: у взрослых до 12 недель, у детей – до 4 недель.
Детям разрешен к применению с 4 мес.
Мазь оптимально рекомендовать при хроническом процессе: сухость, незначительное шелушение. Высыпания неяркие.
Жирная мазь – тоже при хроническом процессе, но когда кожа очень сухая, трескается, сильно шелушится.
Крем рекомендуется при остром воспалении: кожа красная, сильный зуд. Участков мокнутия нет.
Эмульсия – применяется при остром воспалении (краснота, зуд, мокнутие), а также при фотодерматозах, солнечных ожогах.
Адвантан может использоваться на больших участках кожи.
Не оставляет жирных пятен на одежде, не имеет запаха.
Локоид – негалогенизированный сильный кортикостероид. Я думаю, вы уже усвоили, что это значит: риск системных эффектов и местных нежелательных реакций сведены к минимуму.
Детям разрешен к применению с 6 месяцев. Может использоваться на нежных участках кожи.
Локоид мазь рекомендуется, если зуд и покраснение сопровождаются очень сильной сухостью, утолщением и огрубением кожи, вплоть до трещин.
Локоид крем применяется при выраженном покраснении кожи и зуде без мокнутия.
Локоид Липокрем – крем, насыщенный липидами. Рекомендуется, если кожа сухая, шелушится, при этом отмечаются выраженная гиперемия и зуд.
Локоид Крело – последнее слово означает «Кремовый лосьон». Это уникальная лекарственная форма, аналогов которой нет. Используется при выраженном воспалении и покраснении с мокнутием и образованием пузырей. Смягчает и успокаивает кожу, обладает заживляющим действием. Не оставляет следов. Может наноситься на волосистую часть головы и нежные участки кожи.
Элоком – нефторированный стероид высокой степени противовоспалительной активности. Нежелательные реакции встречаются редко.
Детям – с 2 лет.
Интересен тем, что наносится всего один раз в сутки. Может применяться длительно – до 12 недель.
Мазь – на сухую кожу.
Крем или лосьон используются при воспалении нежных участков кожи (лицо, шея, складки, гениталии).
Лосьон назначают также для применения на волосистой части головы (себорейный дерматит, псориаз).
Если сравнить Элоком с препаратом Целестодерм-В, то лечебный эффект при его использовании наступает в 1,5-2 раза быстрее, и побочные эффекты он дает реже.
Элоком С – помимо мометазона, содержит салициловую кислоту, т.е. кератолитик. Его наносят на грубую, утолщенную кожу. В частности, он используется при среднетяжелой и тяжелой формах псориаза.
Топические глюкокортикостероиды нового поколения в наружной терапии дерматозов
Эффективность наружной терапии кожных заболеваний обеспечивается удачно подобранными в зависимости от патологии и стадии воспаления наружными формами препаратов. При лечении кожных болезней, особенно сопровождающихся воспалительными явлениями, необходимо обращать внимание на то, что каждая стадия болезни требует различных лекарственных средств и методов их применения. Иногда несмотря на правильно подобранный медикамент, улучшение не наступает, и тогда необходимо подобрать новую лекарственную форму.
Поскольку кожа, ее рецепторный аппарат привыкают к лекарствам, то для достижения терапевтического эффекта в процессе лечения приходится менять лекарственные средства. У больных, страдающих аллергодерматозами (экзема, атопический дерматит), кожа иногда реагирует усилением воспаления на вещества, которые обычно ее не раздражают. Поэтому средства для наружного лечения данной группы заболеваний подбирают осторожно. Широкое применение в дерматологии находят топические глюкокортикостероиды, но иногда их использование вызывает осложнения, в частности, атрофию кожи. Поэтому с большим энтузиазмом дерматологами был принят новый препарат — элоком (мометазона фуроат), синтетический 17-гетероциклический кортикостероид, который начал выпускаться с 1987 г. в США и сравнительно недавно (с 1996 г.) появился в России.
Клинические испытания мометазона фуроата позволили предположить, что его эффективность сравнима с эффективностью сильных стероидов. В то же время исследование степени атрофии кожи и побочного системного воздействия на гипофизарно-надпочечниковую систему показало, что препарат по безопасности сравним со слабыми стероидами. Всасываемость крема элокома составляет 0,4% от наносимой дозы, мази — 0,7%, что соответствует критериям “идеального” по безопасности глюкокортикостероида.
Мы изучали эффективность элокома (0,1% крема, 0,1% мази и лосьона). Наличие разных лекарственных форм позволяет применять препарат на разных стадиях воспалительного процесса и при различной его локализации (например, на волосистой части головы). Действующее вещество — мометазон фуроат, нефторированный синтетический кортикостероид, обладает противовоспалительным, противозудным и сосудосуживающим эффектом. Все три лекарственные формы имеют хорошую основу, сохраняющую рН кожи. Высокий уровень безопасности позволяет использовать элоком в педиатрии и гериатрии. Так, элоком с большим эффектом применяли у детей от 6 месяцев до 12 лет, страдающих атопическим дерматитом и экземой. Даже при 4-х недельном использовании крема или мази не было выявлено никаких побочных осложнений, в том числе и атрофии кожи. Такая безопасность в применении характерна для 1% гидрокортизоновой мази (при меньшей эффективности). Отличительной особенностью элокома является высокая активность в сочетании с редкостью системных (не влияет на функцию гипофиза и надпочечников) и местных (практически не вызывает атрофии кожи, гипертрихоза, фолликулитов и других проявлений вторичной инфекции) побочных действий по сравнению с другими кортикостероидами.
За 3 года под нашим наблюдением находилось 285 больных, страдающих различными дерматозами: истинная экзема кожи лица и конечностей — 129, атопический дерматит — 98, псориаз с локализацией в области кожи лица и ладоней — 24, интегументные формы красной волчанки — 16, острый аллергический дерматит — 18, которые получали топический кортикостероид элоком. Большинство из них были в возрасте от 20 до 45 лет.
Аллергический дерматит
18 больным с острыми проявлениями аллергического дерматита с локализацией на коже лица была назначена наружная монотерапия Учитывая, что у больных имелись острые проявления в виде резкого отека, гиперемии и мокнутия, им был назначен элоком в виде 0,1 % крема, что позволило при таких выраженных острых состояниях кожи заменить применявшиеся ранее до 15-20 раз в сутки примочки. Крем наносили тонким слоем на пораженные участки кожи 1 раз в день. Уже на 1-3 сутки отмечались исчезновение мокнутия, резкое уменьшение отека, гиперемии, а на 4-5 сутки наступало полное выздоровление, что позволило в 2-3 раза сократить пребывание больных в стационаре.
Истинная экзема и атопический дерматит
Особую группу составили 129 больных с острыми и подострыми проявлениями истинной экземы с преимущественной локализацией в области кожи лица, тыльной и ладонной поверхности кистей и 98 больных с атопическим дерматитом в возрасте от 18 до 37 лет. Длительность заболевания колебалась от 12 до 30 лет с частыми рецидивами. Все больные поступили в клинику в стадии обострения процесса. У этой группы больных имелись выраженные воспалительные изменения, инфильтрация, лихенификация в сгибах, тыле кистей, на шее, рассеянные пятнисто-папулезные элементы на коже туловища, лица, конечностей, множественные экскориации, трещины, шелушение. У 26% больных с тяжелым рецидивирующим течением болезни и выраженным зудом кожи имелась непереносимость многих наружных лекарственных средств (деготь, нафталан, дерматол, борная кислота). В качестве наружной терапии был назначен 0,1% крем элоком в сочетании с общей терапией традиционными средствами (сосудистые, седативные, антигистаминные препараты, энтеросорбенты и др.). На 3-5 сутки у больных наблюдалось исчезновение зуда, мокнутия, гиперемии. Через 7-10 дней отмечено клиническое выздоровление, что позволило перевести больных на дневной стационар для окончания общей терапии и сократить сроки лечения до 14-20 дней.
Больным с атопическим дерматитом назначали 0,1% мазь элоком преимущественно на открытые участки кожи 23% больных получали топический стероид впервые, а остальные ранее лечились различными глюкокортикоидными мазями, но эффекта в последнее время не было. Мазь элоком наносили один раз в день тонким слоем. У 97% больных на 3-5 день уменьшились гиперемия, инфильтрация, число экскориаций и почти исчез зуд кожи. Общая продолжительность лечения элокомом у 92 больных составила 7-8 дней, 4 — 10 дней, у 2 человек эффекта не отмечалось, и элоком был отменен. Все больные получали соответствующую диету, седативную и другую общую терапию. Применение в качестве наружного средства элокома позволило перевести 98% больных на дневной стационар и сократить пребывание в нем до 14-15 дней.
Псориаз
Больным с различными формами псориаза назначали 0,1% мазь элоком на кожу лица и кистей и 0,1% лосьон на волосистую часть головы. Назначение элокома при псориазе является патогенетически обоснованным, т.к. он подавляет продукцию трех цитокинов: интерлейкина 1, 6 и альфа-фактора некроза опухолей. Длительность заболевания составила от 2 до 20 лет, возраст больных — от 21 года до 65 лет. Назначение мази элоком на открытые участки кожи (лицо, кисти) и лосьона на волосистую часть головы, достижение быстрого терапевтического эффекта уже на 5-7 день позволило всех больных перевести на дневной стационар для продолжения общей терапии и физиотерапии.
Дискоидная красная волчанка
При лечении дискоидной красной волчанки сложным является правильный выбор наружной терапии, которая была бы эффективной. В течение последних десятилетий местно применяли фторсодержащие кортикостероидные мази под окклюзионную повязку на ночь, а днем — смазывание очагов 2-3 раза в день. Поскольку фторсодержащие кортикостероидные мази при длительном применении вызывают атрофию кожи, то их применение оправдано при дискоидной красной волчанке, т.к. конечной целью при данном заболевании является получение на месте очага рубцовой атрофии. Однако часто приходится сталкиваться с усилением эритемы при длительном применении фторсодержащих кортикостероидов за счет образования телеангиоэктазий. Элоком является кортикостероидным препаратом без содержания фтора, определяющим для выбора данного препарата явилось то, что входящий в его состав мометазон фуроат обладает не только противовоспалительным, но и сосудосуживающим действием.
Нами учитывалось не только активность элокома в сравнении с другими кортикостероидными мазями, но и тот факт, что элоком не вызывает при длительном применении появление гипертрихоза, вторичной инфекции, что особенно важно, т.к. дискоидная красная волчанка локализуется преимущественно на лице. Наружное применение элокома сочеталось с общей терапией (гидроксихлорохин, препараты кальция, никотиновая кислота).
Среди больных красной волчанкой было 4 мужчины и 4 женщины. Давность заболевания колебалась от 5 до 15 лет. У всех больных процесс на коже характеризовался тяжелым, постоянно рецидивирующим течением. У 3-х больных были выражены в значительной степени гиперкератотические изменения. Мазь наносили тонким слоем 1 раз в день на пораженные участки кожи. На 5-7 сутки мы отмечали уменьшение инфильтрации кожи, исчезновение чешуек, на 14-20 сутки исчезли эритема и гиперкератоз и на местах бывших очагов сформировалась рубцовая атрофия. Терапевтический эффект не был достигнут лишь у одной больной: из-за усиления эритемы и появления зуда элоком был отменен. У остальных 5 больных переносимость препарата была хорошей и получен высокий терапевтический эффект.
Тридерм
Крем тридерм содержит кортикостероид (бетаметазона дипропионат), антибиотик (гентамицин) и антимикотик (клотримазол). Тридерм использовался для наружной терапии 253 больных, страдающих аллергодерматозами, осложненными присоединением вторичной инфекции, а также дерматозами, возникшими в результате длительного и вялотекущего микробного процесса на фоне трофических нарушений кожного покрова и больных, страдающих хроническими пиококковыми дерматозами, резистентными к любым наружным методам.
В первую группу (n=173) вошли больные аллергическим дерматитом, атопическим дерматитом, истинной экземой, осложненные присоединением вторичной инфекции. Вторую группу (n=51) составили больные паратравматической микробной экземой, возникшей на фоне варикозного симптомокомплекса и 15 больных микотической экземой, спровоцированной чаще дрожжеподобными грибами рода Candida, реже — грибами рода Trichophyton (красный и межпальцевой). Кроме того, в эту группу были включены больные с вялотекущей хронической стрептодермией — 6 человек. Особая группа была представлена 9 больными с кандидозным поражением крупных складок.
При назначении препарата тридерм в первую очередь учитывались его противовоспалительный и противомикробный (противомикотический) эффекты при отсутствии характерного для стероидных препаратов привыкания и побочных действий (истончение и атрофия эпидермиса, возникновение телеангиоэктазий, гипертрихоза и т.д.). Препарат наносили тонким слоем на очаги поражения 2 раза в сутки. У большинства (89%) больных крем использовался как монотерапия.
Наиболее выраженный терапевтический эффект отмечен у больных, страдающих аллергическим дерматитом, истинной и профессиональной экземой, осложненной вторичной инфекцией. Следует отметить, что препарат наносили на обширные поверхности кожного покрова, включая открытые участки — лицо, шею, руки. Воспалительную реакцию, проявляющуюся гиперемией, отеком и мокнутием удалось купировать на 2-3 день, узелковые высыпания рассасывались на 3-4 день без поэтапного подбора наружных средств по классической схеме от влажновысыхающих повязок до эпителизирующих мазей, что позволили перевести больных через 3-5 дней на долечивание в дневном стационаре.
Больным с атопическим дерматитом, у которых в анамнезе были указания на длительное бесконтрольное лечение гормональными мазями, тридерм назначали на традиционные “проблемные зоны” с учетом частого осложнения кожного процесса в этих участках экзематизацией или стойкой лихенификацией и трещинами. Противовоспалительное действие тридерма проявлялось на 3-7 день использования, при этом отмечалось рассасывание инфильтраций, заживление трещин, прекращение мокнутия, вызванного, как правило, вторичным инфицированием.
Во второй группе больных с микробной (паратравматической) и микотической экземой назначение тридерма было направлено, в первую очередь, на микробную, чаще стрептококковую или микотическую инфекцию, вызывающую стойкую аллергическую реакцию кожных покровов. Следует отметить, что именно у этих больных кожный воспалительный процесс протекает на фоне выраженных нарушений функции периферических сосудов (варикозный симптомокомплекс, трофические язвы, хронический тромбофлебит, облитерация сосудов, травматические повреждения, ознобление и т.д.), поэтому больным обязательно назначается общая терапия (сосудистые, антигистаминные и другие средства).
Возрастные изменения, интеркуррентные соматические заболевания, непереносимость многих лекарственных препаратов отягощали течение кожного процесса и затрудняли выбор наружных методов лечения. Мы использовали тридерм у этой группы больных, учитывая противомикробное действие входящего в его состав гентамицина, и противогрибковое — клотримазола. Положительное действие препарата проявилось в значительном уменьшении зуда, гиперемии и отека, подсыхании участков мокнутия, хотя инфильтрация сохранялась и требовала в дальнейшем назначения рассасывающих мазей в сочетании с сосудистыми препаратами, десенсибилизирующими средствами и антиоксидантами.
Для лечения больных с кандидозным поражением крупных складок крем тридерм использовался в течение 4-7 дней лишь для снятия сильной воспалительной реакции с последующим переходом на другие фунгицидные средства. У пациентов со стойким поражением углов рта, обусловленных как кандидозной, так и стрептококковой инфекциями, препарат успешно применялся в течении 3-4 дней.
Тридерм использовали у 3 больных хронической доброкачественной семейной пузырчаткой Хейли-Хейли. По современным представлениям, это генетически обусловленное заболевание, проявляющееся нарушением синтеза или созревания тонофибрилл кератиноцитов, что приводит к дисфункции и гибели десмосом и ослаблению межклеточных связей. Возникновению пузырей на коже при этом заболевании способствуют механические, химические, а также аллергические и микробные факторы. Очаги поражения располагаются в складках шеи, подмышечных складках и под молочными железами и представлены эритематозными бляшками фестончатых очертаний, окаймленными отслаивающимся эпидермисом. Поверхность бляшек была мацерирована и покрыта извилистыми, мозговидными трещинами, отделяющими серозно-гнойный экссудат, на периферии очагов отмечалось скопление желтоватых корок.
Крем тридерм наносили 2 раза в день на протяжении 7-19 дней. Эффект в виде уплощения участков поражения наступал к 4-5 дню. Важно отметить, что наступали стойкая эпителизация эрозий, прекращение возникновения свежих пузырей, очищение поверхности от корковых наслоений, что позволило достичь ремиссии длительностью от 6 месяцев до 1 года, рецидив заболевания протекал значительно слабее, чем до использования препарата. Применение монотерапии тридермом при доброкачественной семейной пузырчатке позволило не назначать глюкокортикоиды внутрь.
Выводы
Существование 3 лекарственных форм элокома — лосьона, крема и мази — дает возможность применять его в разных стадиях воспалительного процесса. Элоком обладает выраженным противовоспалительным, сосудосуживающим и особенно противозудным эффектом, что позволяет применять его в виде 0,1% крема при острых состояниях кожи. Применение элокома 1 раз в сутки удобно и экономически выгодно. Практическое отсутствие побочных эффектов позволяет применять элоком и при локализации воспалительного процесса на коже лица. Элоком быстро купирует клинические проявления заболевания и позволяет перевести больных на лечение в условиях дневного стационара, что существенно сокращает длительность и стоимость госпитализации, улучшает качество жизни пациентов. Использование элокома у детей для купирования острых и хронических дерматозов возможно с 2-х-летнего возраста.
Тридерм является быстродействующим препаратом широкого спектра действия, что позволяет применять его при лечении дерматозов аллергической, бактериальной и микотической природы, а также при торпидно протекающем дерматозе наследственного происхождения (болезнь Хейли-Хейли).
Бетаметазон + клотримазол + гентамицин –
Тридерм (торговое название)
(Shering-Plough)
Мометазона фуроат –
Элоком (торговое название)
(Shering-Plough)
| Приложения к статье |
«Сколько вешать в граммах»? Доза на кончике пальца
Вас никогда покупатели не спрашивали, сколько нужно выдавить мази из тюбика? Ведь это тоже влияет на лечебную эффективность и риск побочных. Нанесешь мало — не подействует, или подействует слабо. Намажешь много — могут быть жжение, краснота и прочие нежелательные реакции.
Какой-то хороший человек придумал единицу измерения наружного средства.
Она называется «единица на кончике пальца», или ЕКП.
Количество препарата, выдавленного из тюбика с отверстием диаметром 5 мм и занимающего на указательном пальце со стороны ладони расстояние от его кончика до ближайшего сустава, составляет одну дозу. Одна ЕКП – это примерно 0,5 грамма.
Смотрите:
Чтобы ориентироваться вам, какой объем наружного средства идет на разные части тела, и когда какой объем тюбика предложить, обнаружила вот такую замечательную схему:
Заканчивая этот разговор, хочу подытожить:
Подбирая наружное средство, не забудьте выяснить, кому его берут, какой участок тела собираются мазать, какова площадь участка поражения, а также:
- Кожа сухая или нет?
- Покраснение сильное или умеренное?
- Кожа утолщенная?
- Есть ли мокнутие?
- Есть ли на коже гнойники?