Распространенность, этиология и общие подходы к лечению
Инфекции верхних дыхательных путей (ВДП) и ЛОР–органов относятся к числу самых распространенных заболеваний. В структуре общей заболеваемости в Москве они составляют примерно 19 % и находятся на втором месте среди всех патологий [1].
Той или иной формой синусита страдают примерно 5–15 % взрослого населения и 5 % детей [1]. В России острый синусит ежегодно переносят около 10 млн человек [2], причем не менее 80 % из них составляют люди трудоспособного возраста [3]. Он является и одним из наиболее широкораспространенных заболеваний у детей.
На долю острого среднего отита в структуре заболеваний ЛОР–органов приходится 20–30 % [4, 5]. В Европе его частота у взрослого населения составляет 1–5 % в год [6]. В США острый средний отит ежегодно регистрируется у 10 млн человек [5], им страдает около 14 % населения [7]. В течение первого года жизни по крайней мере один эпизод заболевания переносят 62 % детей, к двум–трем годам – 80–94 % [8, 9]. Острый средний отит занимает лидирующие позиции в структуре обращения за медицинской помощью в педиатрии, обусловливая 33 % всех посещений врача [8,9].
Основное клиническое проявление тонзиллофарингита – боль в горле, наблюдается у взрослого человека в среднем два–три раза в год [10]. Фарингит, вызванный бета–гемолитическим стрептококком группы А, относится к числу самых распространенных бактериальных инфекций у детей младше двух лет. Хронический тонзиллит встречается у 2–3 % детей в возрасте 3 лет, 6,5 % – 5–6 лет, 12–13 % – 10–12 лет и у 25–35 % лиц в возрасте 18–20 лет [11]. Его распространенность среди часто болеющих детей 2–6 лет достигает 43 % [12].
Инфекции ВДП и ЛОР–органов потенциально опасны в отношении развития серьезных осложнений и летальных исходов, риск которых значительно повышается в случае нерациональной терапии первичного заболевания. Так, тонзиллиты и фарингиты могут осложняться инфекциями соседних органов (средним отитом, синуситом, бронхитом), а также вызывать тяжелые регионарные осложнения (паратонзиллярные, боковоглоточные и заглоточные абсцессы и др.), требующие экстренных хирургических вмешательств, и системные осложнения – ревматизм, гломерулонефрит, васкулиты и др. Острый средний отит является одной из ведущих причин менингита, абсцесса головного мозга и тромбоз асигмовидного синуса [4]. Синуситы могут приводить к развитию тяжелых орбитальных и внутричерепных осложнений.
Инфекции ВДП и ЛОР–органов сопряжены и со значительными финансовыми потерями. Например, в США прямые и непрямые расходы, связанные с острым средним отитом, превышают 3,5 млрд долл. в год [13], на лечение острого бактериального синусита ежегодно затрачивается 3,5 млрд [14], в т. ч. у детей до 12 лет – 1,8 млрд [15]. В России средняя продолжительность временной нетрудоспособности при остром синусите составляет 11,6 дня [16]. Экономические потери, обусловленные только временной нетрудоспособностью, оцениваются в 232 млн долл. США, или 0,15 % внутреннего валового продукта РФ [16]. Таким образом, правильный выбор лечения при инфекциях ВДП и ЛОР–органов имеет наряду с клиническим большое экономическое значение. Адекватная терапия этих инфекций является и важным фактором профилактики бактериальной резистентности.
К сожалению, повсеместно наблюдающийся рост устойчивости основных возбудителей инфекций ВДП и ЛОР–органов ко многим антибактериальным средствам, включая препараты первого ряда, значительно ограничивает выбор антибиотиков для эмпирической терапии. Например, распространение бета–лактамазопродуцирующих штаммов Н. influenzae и М. catarrhalis и появление пенициллинустойчивых пневмококков уже ставят под сомнение правомерность применения амоксициллина в качестве препарата первого ряда при остром среднем отите и других внебольничных инфекциях [17].
Кроме того, в последние годы наблюдаются изменения в этиологической структуре инфекций ВДП и ЛОР–органов, что вызывает необходимость пересмотра подходов к ведению больных с инфекциями данной локализации. Прежде всего это обусловлено возрастающей ролью “атипичных” бактериальных возбудителей (M. pneumoniae, C. pneumoniae) в этиологии острых респираторных заболеваний (ОРЗ), ларинготрахеита и других инфекций дыхательных путей, особенно у лиц молодого возраста и детей [18]. Например, в рандомизированном исследовании, участниками которого были 353 ребенка в возрасте от 1 года до 14 лет с рецидивирующими ОРЗ и 208 здоровых детей (контрольная группа), “атипичные” возбудители были выявлены у 54 % пациентов основной группы по сравнению с 3,8 % детей из контрольной группы (р < 0,0001) [18]. В этом исследовании также показано, что краткосрочный (в течение месяца) и долговременный (в течение шести месяцев) клинический эффект наблюдался значительно чаще у пациентов, получавших наряду с симптоматической терапией азитромицин, чем у детей, получавших только симптоматическую терапию. Причем долговременный клинический эффект азитромицина (снижение частоты рецидивов) был выражен при инфекции, вызванной не только “атипичными” патогенами, но и другими возбудителями. Результаты исследования позволили прийти к заключению, что “атипичные” бактерии играют достаточно большую роль в возникновении рецидивирующих инфекций дыхательных путей у детей и что длительная терапия азитромицином может не только значительно улучшить течение острого эпизода заболевания, но и снизить риск возникновения его рецидивов.
В другом недавно проведенном исследовании показано, что при отсутствии адекватного лечения острый тонзиллофарингит у детей, ассоциированный с атипичными бактериями, может приводить к неблагоприятным исходам и сопряжен с высоким риском рецидивов [19]. Эти данные заставляют более критично относиться к современным рекомендациям, не поддерживающим применение антибиотиков у большинства пациентов при острой инфекции данной локализации, и способствуют повышению роли макролидов в их терапии.
В настоящее время азитромицин фактически уже приобрел статус антибиотика первой линии для лечения инфекций дыхательных путей и ЛОР–органов, несмотря на то что в большинстве рекомендаций ему отводится позиция препарата, альтернативного бета–лактамам [20]. Это обусловлено благоприятными фармакологическими свойствами азитромицина, доказанными эффективностью и безопасностью, возрастанием этиологической роли атипичных возбудителей.
Обоснование целесообразности применения азитромицина при инфекциях ВДВ и ЛОР–органов с фармакологической точки зрения
Подобно другим макролидам, азитромицин активен в отношении основных возбудителей инфекций ВДВ и ЛОР–органов (S. рпеumoniae, S. pyogenes, M. catarrhalis), включая атипичные патогены (микоплазмы, хламидии). Его преимуществом перед другими макролидами является клинически значимая активность в отношении распространенного возбудителя острого среднего отита и острого бактериального синусита Н. influenzae. Как и другие макролиды, азитромицин оказывает бактериостатический эффект, но благодаря уникальным фармакокинетическим свойствам способен создавать очень высокие внутритканевые и внутриклеточные концентрации и соответственно действовать бактерицидно, в т. ч. на патогены, находящиеся внутри клеток [21].
Для азитромицина характерны постантибиотические эффекты в отношении S. pyogenes, S. pneumoniae, H. influenzae, L. pneumophila. По продолжительности постантибиотического эффекта в отношении ряда микроорганизмов, например Н. influenzae и Legionella pneumophila, он превосходит кларитромицин [22, 23]. Усилению действия азитромицина способствуют его противовоспалительные и иммуномодулирующие свойства [24].
Азитромицин отличается от эритромицина и других макролидов улучшенными фармакокинетическими свойствами: он превосходит другие антибиотики этой группы по кислотоустойчивости (в 300 раз выше, чем у эритромицина), более стабильно всасывается из желудочно–кишечного тракта и имеет большую биодоступность. Высокая липофильность азитромицина обусловливает его широкое распределение в организме (объем распределения – 31 л/кг) и хорошее проникновение в ткани и биологические жидкости. Его концентрации в различных тканях после однократного введения в 20–1000 раз превышают таковые в плазме крови [25, 26]. Очень высокие концентрации препарата создаются в дыхательных путях и ЛОР–органах: в бронхиальном секрете, легких, альвеолярной жидкости, миндалинах, аденоидах, среднем ухе и придаточных пазухах носа [27, 28]. Они намного превышают минимальные подавляющие концентрации антибиотика для наиболее часто встречающихся патогенов, вызывающих инфекции соответствующей локализации.
Азитромицин значительно превосходит эритромицин по способности проникать в придаточные пазухи носа [29]. Его максимальные концентрации в слизистой оболочке гайморовой пазухи создаются уже через два часа после введения и значительно превышают уровень антибиотика в сыворотке крови. Исследования, проведенные в клинике Л.С. Страчунского, показали, что через два часа после приема 500 мг азитромицина его концентрации в слизистой оболочке гайморовой пазухи в восемь раз превышали таковые в сыворотке крови, в то время как максимальные концентрации эритромицина были примерно в три раза ниже сывороточных [30]. В плацебо–контролируемом исследовании у животных с экспериментальным риносинуситом азитромицин, создавая высокие концентрации в очаге инфекции, обеспечивал быстрый клиренс бактерий и исчезновение воспаления [31]. Напротив, новый фторхинолон с бактерицидным действием моксифлоксацин, создающий низкие концентрации в очаге и имеющий непродолжительный постантибиотический эффект, оказывал слабое влияние на клиренс бактерий и воспалительный процесс [31].
Азитромицин очень быстро достигает высоких концентраций в миндалинах и аденоидах. Через 2–24 часа после приема его концентрации в миндалинах превышают МПК для S. pyogenes в 30 раз [30]. Период полувыведения азитромицина из ткани миндалин достигает 3,2 суток [32]. У детей в возрасте от двух до восьми лет, получавших трехдневный курс лечения суспензией азитромицина в дозе 10 мг/кг/сут, уровень антибиотика в миндалинах и аденоидах через четыре дня после завершения терапии более чем в 900 раз превышал его сывороточные концентрации [26]. У пациентов с рецидивирующим или хроническим тонзиллитом после приема азитромицина внутрь в дозе 250 мг два раза в сутки высокие концентрации препарата в миндалинах сохранялись на протяжении семи дней [26].
Высокие уровни азитромицина определяются в слизистых оболочках этмоидальной пазухи и в барабанной полости [26]. У детей со средним отитом в течение суток после начала терапии концентрации азитромицина в среднем ухе достигают 8–9 мг/кг [33].
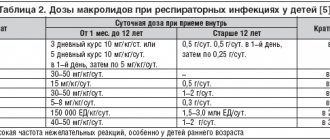
Данные об уровнях концентраций антибиотика в дыхательных путях и ЛОР–органах, полученные в фармакокинетических исследованиях, суммированы в таблице.
Азитромицин метаболизируется в незначительной степени с образованием неактивных метаболитов [36]. Препарат выводится преимущественно с желчью. Элиминация азитромицина имеет двухфазный характер, период полувыведения из организма составляет 35–79 часов [37, 38] и не изменяется при почечной и печеночной недостаточности и циррозе печени [39, 40].
Благоприятные фармакокинетические свойства позволяют принимать азитромицин однократно в сутки короткими курсами по три–пять дней, а при некоторых инфекциях – даже в виде однократной дозы. Существенных различий в фармакокинетике антибиотика (накопление в макрофагах, тканевые и клеточные концентрации) при использовании трех– и пятидневных курсов лечения не обнаружено [41].
Уникальный режим приема азитромицина обеспечивает ему преимущества перед другими антибиотиками в отношении приверженности больных терапии. Этому способствует и возможность его использования вне зависимости от приема пищи. Несмотря на то что азитромицин рекомендуют принимать перед едой, несколько целенаправленных исследований продемонстрировали, что пища не оказывает существенного влияния на биодоступность этого антибиотика в различных лекарственных формах [42]. Достоинством азитромицина в педиатрии являются и благоприятные органолептические свойства детской суспензии препарата [43, 44].
Азитромицин отличается хорошей переносимостью. Нежелательные реакции при его применении развиваются редко. Частота развития нежелательных реакций препарата у взрослых и детей составляет около 9 % [45], в то время как при лечении эритромицином она достигает 30–40 % [46]. Серьезные побочные реакции при применении азитромицина в клинических исследованиях регистрировались крайне редко, а их причинно–следственная связь с препаратом окончательно не установлена. Согласно результатам мета–анализов, частота отмены азитромицина из–за побочных реакций составляет 0,7 % при инфекциях нижних дыхательных путей и 0,8 % – при инфекциях верхних дыхательных путей [47, 48].
Азитромицин обладает низким аллергогенным потенциалом. Аллергические реакции наблюдаются менее чем у 1 % пациентов, в то время как при лечении пенициллинами они развиваются в 10 % случаев, а цефалоспоринами – в 4 % [46]. Наиболее распространенными побочными явлениями являются диспептические расстройства азитромицина, частота которых, по данным нескольких контролируемых клинических исследований, колеблется от 6 до 9 % [49]. Так, в педиатрических клинических исследованиях диарея наблюдалась у 1–6 % участников, боль в животе – у 1–4 %, тошнота – у 0,5–2 %, рвота – у 1–6 %. Повышение уровня печеночных ферментов встречалось у 0–1 % детей, получавших азитромицин, против 2–4 % детей, принимавших эритромицин [49].
Отсутствие выраженного влияния на ферменты системы цитохрома Р450 в печени обеспечивает азитромицину низкий потенциал клинически значимых лекарственных взаимодействий, что определяет его достаточно высокую безопасность при сочетанном применении с другими лекарственными средствами. По этому показателю азитромицин превосходит большинство макролидов, которые по влиянию на цитохром Р450 располагаются в следующем порядке: кларитромицин > эритромицин > рокситромицин > азитромицин > спирамицин [50].
Применение азитромицина достаточно безопасно и в период беременности. Он является единственным полусинтетическим макролидом, отнесенным в классификации FDA к категории В. К этой категории относят препараты, не оказывающие неблагоприятного эффекта на плод и течение беременности в экспериментах на животных. Существуют и клинические данные, подтверждающие безопасность применения азитромицина у беременных женщин [29].
Использование макролидов для эмпирической терапии инфекций дыхательных путей и ЛОР–органов обосновано и с точки зрения низкого уровня резистентности к ним распространенных возбудителей инфекций этой локализации в России. По данным многоцентрового исследования ПеГаС–1 (2000), частота резистентности пневмококка к азитромицину составляет 5 %, к эритромицину – 6 %, к кларитромицину – колеблется от 2 до 13 % [24]. Более того, согласно данным японских авторов, азитромицин сохраняет активность в отношении пневмококков, резистентных к другим макролидам [51]. “Преодоление” низкого уровня устойчивости микроорганизмов, по–видимому, связано с фармакокинетическими особенностями азитромицина.
Доказательства эффективности азитромицина при инфекциях ВДП и ЛОР–органов
Высокая эффективность азитромицина при инфекциях ВДП и ЛОР–органов у взрослых и детей доказана в контролируемых клинических исследованиях. В период с 1991 по 2001 г. эффективность азитромицина при инфекциях ВДП и ЛОР–органов изучалась не менее чем в 29 рандомизированных клинических исследованиях, участниками которых были 7240 пациентов, включая 4263 детей [52]. Наряду с пятидневными курсами лечения изучались и укороченные режимы терапии, позволяющие повысить приверженность лечению и снизить его стоимость. Трехдневные курсы терапии азитромицином сравнивались с 7–14–дневными курсами лечения кларитромицином, рокситромицином, феноксиметилпенициллином, амоксициллином/клавуланатом и цефаклором. В большинстве исследований короткий курс азитромицина не уступал по клинической и бактериологической эффективности стандартным курсам препаратов сравнения, а в некоторых – даже превосходил их.
В настоящее время азитромицин является единственным антибиотиком, разрешенным FDA для применения короткими курсами при остром бактериальном синусите. Основанием для разрешения послужили результаты многоцентрового рандомизированного двойного слепого исследования с участием 936 пациентов [53]. В нем сравнивались эффективность и безопасность двух режимов лечения: азитромицином – по 500 мг 1 раз в сутки в течение 3 или 6 дней и амоксициллином/клавуланатом по 625 мг 3 раза в день в течение 10 дней. Эффективность всех режимов терапии оказалась одинаковой, однако при лечении амоксициллином/клавуланатом побочные явления наблюдались чаще (51,1 %), чем при применении 3–дневных (31,1 %; р < 0,001) или 6–дневных курсов азитромицина (37,6 %; р < 0,001). В группе амоксициллина/клавуланата также было больше пациентов, выбывших из исследования (n = 28) вследствие побочных эффектов, чем в группах азитромицина (n = 7 и 11 соответственно при 3– и 6–дневном курсе).
Сопоставимая эффективность трехдневных курсов азитромицина со стандартными курсами лечения амоксициллином/клавуланатом подтверждена еще в трех клинических исследованиях, причем в двух из них эффект азитромицина развивался быстрее эффекта препарата сравнения. Результаты отечественного рандомизированного клинико–фармакоэкономического исследования показали, что трехдневный курс азитромицина обеспечивает излечение острого синусита в более короткие сроки, чем десятидневный курс амоксициллина/клавуланата, эффективнее предупреждает рецидивы заболевания, лучше переносится, характеризуется меньшим количеством побочных реакций, чем препарат сравнения, и более выгоден с экономической точки зрения [54].
В контролируемых исследованиях продемонстрирована высокая клиническая и бактериологическая эффективность азитромицина при тонзиллофарингитах у взрослых и детей. Показано, что по клинической эффективности азитромицин не уступает феноксиметилпенициллину и эритромицину. Есть данные о более быстром купировании симптомов заболевания у пациентов, получавших трех– и пятидневные курсы азитромицина, по сравнению с пациентами, получавшими стандартный курс феноксиметилпенициллина и рокситромицина [55, 56]. В то же время в некоторых исследованиях выявлена более низкая бактериологическая эффективность азитромицина по сравнению с феноксиметилпенициллином [57–59] и более высокая частота рецидивов заболевания в отдаленном периоде у пациентов, получавших азитромицин [60, 61]. Возможно, это обусловлено недостаточной дозой азитромицина, применяемой в этих исследованиях.
Мета–анализ контролируемых клинических исследований показал, что эффективность азитромицина при тонзиллофарингите в значительной степени зависит от дозы и режима терапии [58]. У детей курсовая доза препарата должна составлять 60 мг/кг (3 дня по 20 мг/кг или 5 дней по 12 мг/кг). Согласно результатам мета–анализа, в этой курсовой дозе азитромицин достоверно (р < 0,00001) превосходил по эффективности 10–дневные курсы лечения антибиотиками сравнения. Причем бактериологическая неудача у детей, получавших азитромицин в курсовой дозе 60 мг/кг, наблюдалась в пять раз реже, чем при применении десятидневных курсов антибиотиков сравнения. Напротив, в курсовой дозе 30 мг/кг азитромицин уступал (р = 0,02) по эффективности в педиатрии стандартным курсам антибиотиков сравнения. У детей трехдневные режимы терапии оказались менее эффективны, чем пятидневные. Напротив, у взрослых пациентов трехдневные режимы лечения превосходили по эффективности пятидневные. При применении трехдневных режимов терапии (500 мг/сут) у взрослых прослеживалась тенденция к более высокой эффективности азитромицина по сравнению с десятидневными курсами антибиотиков сравнения (р = 0,14).
В единственном клиническом исследовании применялась однократная доза азитромицина (30 мг/кг) у больных с тонзиллитом, которая не уступала по эффективности десятидневному курсу лечения антибиотиком сравнения [62], однако вопрос о возможности применения однократной дозы азитромицина для лечения острого тонзиллофарингита требует дальнейшего изучения.
Азитромицин зарекомендовал себя эффективным средством лечения острого среднего отита. В клинических исследованиях показана эффективность его трех– и пятидневных курсов, а в 2003 г. он был разрешен FDA для лечения острого среднего отита у детей и в однократной дозе.
Эффективность и безопасность однократной дозы азитромицина (30 мг/кг) были изучены в достаточно большом количестве клинических исследований у детей с неосложненным острым средним отитом. Обобщенные результаты четырех исследований свидетельствуют о том, что в целом клиническая эффективность однократной дозы азитромицина у детей с острым отитом составляет 84 %, в т. ч. при инфекции, вызванной Streptococcus pneumoniae – 91 %, Haemophilus influenzae – 77 %, Moraxella catarrhalis – 100 %, Streptococcus pyogenes – 64 %, смешанной инфекции S. pneumoniae и H. influenzae – 25 % [63]. Переносимость препарата была очень хорошей: побочные эффекты развивались редко и преимущественно проявлялись легкими транзиторными желудочно–кишечными расстройствами. В двух наиболее крупных исследованиях частота побочных эффектов азитромицина была ниже, чем у антибиотиков сравнения – амоксициллина и амоксициллина/клавуланата.
Согласно результатам мета–анализа, частота неэффективности при применении коротких (меньше пяти дней) курсов азитромицина и 7–10–дневных курсов амоксициллина не различается [64]. При этом азитромицин достоверно реже (на 19 %; р < 0,05) вызывает побочные явления, чем амоксициллин.
Таким образом, азитромицин отвечает практически всем требованиям, предъявляемым к “идеальным” препаратам для лечения инфекций верхних дыхательных путей и ЛОР–органов:
· проявляет высокую активность в отношении основных возбудителей инфекций данной локализации, включая “атипичные” патогены, этиологическая роль которых в последнее время возрастает;
· обладает благоприятными фармакокинетическими свойствами, позволяющими достигать высоких концентраций антибиотика в очаге инфекции и применять его однократно в день короткими курсами;
· обладает доказанной в адекватных клинических исследованиях эффективностью и безопасностью и хорошо переносится больными;
· благодаря удобному режиму терапии и хорошей переносимости позволяет достигать высокой приверженности пациентов лечению;
· ассоциируется с низким уровнем резистентности основных патогенов и, возможно, “преодолевает” низкий уровень устойчивости благодаря уникальным фармакокинетическим свойствам.
Химические свойства[править | править код]
Макролиды получили свое название благодаря макроциклическому лактонному кольцу (14-членному у эритромицина и кларитромицина и 15-членному у азитромицина), с которым соединен по крайней мере один остаток дезоксисахара. Кларитромицин отличается от эритромицина метальной группой, замещающей водород гидроксильной группы в положении 6, а у азитромицина в состав лактонного кольца входит дополнительный атом азота с присоединенной к нему метильной группой. Благодаря этим структурным отличиям азитромицин и кларитромицин более стабильны в кислой среде, лучше проникают в ткани и обладают более широким спектром действия. Химические формулы макролидов следующие:
Структурная формула эритромицина Структурные формулы кларитромицина и азитромицина
Антимикробная активность[править | править код]
Эритромицин обычно оказывает бактериостатический эффект, но в высоких концентрациях на высокочувствительные микроорганизмы может действовать бактерицидно. In vitro эритромицин наиболее активен в отношении аэробных грамположительных кокков и палочек (Steigbigel, 2000). МПК для чувствительных штаммов Streptococcus pyogenes и Streptococcus pneumoniae колеблется от 0,015 до 1 мкг/мл. Однако число устойчивых к эритромицину штаммов стрептококков растет. Механизм устойчивости одинаков для всех макролидов, поэтому такие штаммы перекрестно устойчивы и к другим препаратам этой группы. Вследствие широкого применения макролидов доля устойчивых к ним штаммов Streptococcus pyogenes может достигать 40% (Seppala et al., 1997; Esposito et al., 1998). У Streptococcus pneumoniae распространенность устойчивости к макролидам особенно велика среди пенициллиноустойчивых штаммов и составляет 60% по сравнению с 5% среди пенициллиночувствительных штаммов (Thomsberry et al., 1997; Thomsberry et al., 1999). МПК эритромицина для зеленящих стрептококков составляет 0,06—3,1 мкг/мл.
К эритромицину чувствительны некоторые стафилококки, но МПК для них колеблется в широких пределах (для Staphylococcus epidermidis — от 8 до более чем 32 мкг/мл, для Staphylococcus aureus — от 0,12 до более чем 128 мкг/мл). Больничные штаммы Staphylococcus aureus часто устойчивы к макролидам; кроме того, Staphylococcus aureus может приобрести устойчивость в ходе лечения. Устойчивые к макролидам штаммы Staphylococcus aureus проявляют перекрестную устойчивость к клиндамицину (Fass, 1993). К эритромицину чувствительны многие грамположительные палочки: МПК для Clostridium perfringens составляет 1 мкг/мл, для Corynebacterium diphtheriae — 0,2—3 мкг/мл, для Listeria monocytogenes — 0,25—4 мкг/мл.
На большинство энтеробактерий эритромицин не действует, но проявляет активность в отношении других грамотрицательных микроорганизмов. In vitro он умеренно активен в отношении Haemophilus influenzae (МПК 1—32 мкг/мл) и Neisseria meningitidis (МПК 0,4—1,6 мкг/мл), высокоактивен в отношении большинства штаммов Neisseria gonorrhoeae (МПК0,12—2 мкг/мл; Ste-igbigel, 2000). Кроме того, он действует на Pasteurella mul-tocida, Borrelia spp. и Bordetella pertussis. Штаммы Bacteroides fragilis часто устойчивы к эритромицину (МПК 2—32 мкг/мл), a Campylobacter jejuni — чувствительны (МПК 0,5—4 мкг/мл). Эритромицин эффективен при инфекциях, вызванных Mycoplasma pneumoniae (МПК 0,004—0,02 мкг/мл) и Legionella pneumophila (МПК 0,01—2 мкг/мл). Для большинства штаммов Chlamydia trachomatis МПК составляет 0,06—2 мкг/мл. In vitro к эритромицину чувствительны и некоторые атипичные микобактерии, включая Mycobacterium scrofulaceum. Чувствительность Mycobacterium kansasii и Mycobacterium avium-intracellulare колеблется (Molavi and Weinstein, 1971). Mycobacterium fortuitum устойчива к эритромицину.
Кларитромицин немного активнее эритромицина в отношении чувствительных к последнему штаммов стрептококков и стафилококков, умеренно активен в отношении Haemophilus influenzae и Neisseria gonorrhoeae. Кроме того, кларитромицин хорошо действует на Moraxella catarrhalis, Chlamydia spp., Legionella pneumophila, Borrelia burgdorferi, Mycoplasma pneumoniae, Mycobacterium leprae (Chan et al., 1994).
Азитромицин в целом менее активен, чем эритромицин, в отношении грамположительных бактерий (стрептококки, энтерококки), но немного сильнее, чем эритромицин и кларитромицин, действует на Haemophilus influenzae и Campylobacter spp. (Peters et al., 1992). Азитромицин высокоактивен в отношении Moraxella catarrhalis, Pasteurella multocida. Chlamydia spp., Mycoplasma pneumoniae. Legionella pneumophila, Borrelia burgdorferi, Fuso-bacterium spp. и Neisseria gonorrhoeae.
Микроорганизм считается чувствительным к новым макролидам (кларитромицину и азитромицину), если МПК для него не превышает 2 мкг/мл. Исключение составляет Haemophilus influenzae: МПК для чувствительных к кларитромицину штаммов не превышает 8 мкг/мл, а МПК для чувствительных к азитромицину штаммов —4 мкг/мл.
Азитромицин и кларитромицин активнее эритромицина в отношении Mycobacterium avium-intracellulare. Новые макролиды действуют также на некоторых простейших (Toxoplasma gondii, Cryptosporidium spp., Plasmodium spp.).
Читайте также[править | править код]
- Антибиотики (антимикробные средства) Выбор антибиотика
- Комбинированная антибиотикотерапия
- Профилактическая антибиотикотерапия
- Механизмы действия антибиотиков
- Сульфаниламиды, триметоприм/сульфаметоксазол
- Хинолоны и мочевые антисептики
- Бета-лактамные антибиотики Пенициллины
- Цефалоспорины
- Карбапенемы
- Ингибиторы бета-лактамаз
- Тетрациклины
- Противотуберкулезные средства (антимикобактериальные) Изониазид
- Рифампицин
- Этамбутол
- Стрептомицин
- Пиразинамид
- Прочие противотуберкулезные препараты
Побочные эффекты[править | править код]
Эритромицин редко вызывает тяжелые побочные эффекты. Аллергические реакции включают лихорадку, эозинофилию и сыпь, которые могут наблюдаться по отдельности или в сочетании друг с другом. После отмены препарата симптомы быстро исчезают. Самый тяжелый побочный эффект — холестатиче-ский гепатит. Его вызывает в основном эритромицина эстолат, очень редко — эритромицина этилсукцинат или эритромицина стеарат (Ginsburg and Eichenwald, 1976). Заболевание начинается примерно через 10—20 сут после начала лечения с тошноты, рвоты и схваткообразной боли в животе. Боль при этом нередко такая же, как при | остром холецистите, что может послужить поводом для ненужного хирургического вмешательства. Вскоре появляется желтуха, иногда сопровождаемая лихорадкой, лейкоцитозом, эозинофилией и повышением активности аминотрансфераз. При биопсии печени обнаруживают холестаз, перипортальную инфильтрацию нейтрофи-лами, лимфоцитами и эозинофилами, а иногда и некроз гепатоцитов. Проявления гепатита редко сохраняются дольше нескольких дней после отмены препарата. Возможно, холестатический гепатит возникает в результате аллергической реакции на эритромицина эстолат (Tolman et al., 1974). Возможно небольшое повышение активности печеночных ферментов в сыворотке (McCormack et al., 1977).
При приеме внутрь, особенно в больших дозах, эритромицин часто вызывает боль в эпигастрии, иногда довольно сильную. При в/в введении тоже возможны желудочно-кишечные нарушения — схваткообразная боль в животе, тошнота, рвота, понос. Показано, что эритромицин усиливает моторику ЖКТ, связываясь с рецепторами мотилина (Smith et al., 2000). Желудочно-кишечные нарушения дозозависимы и чаще встречаются у детей и молодых людей (Seifert etal., 1989). Более длительная ин-фузия (в течение 1 ч) и предварительное назначение гликопирро-ния бромида смягчают эти симптомы (Bowler et al., 1992). В/в введение препарата в дозе 1 г, даже при разведении в большом объеме жидкости, часто сопровождается тромбофлебитом. При медленном введении риск этого осложнения снижается.
Имеются сообщения о том, что эритромицин вызывает нарушения сердечного ритма, в том числе удлинение интервала QT и, на его фоне, желудочковую тахикардию. В большинстве случаев эти нарушения возникали у больных с заболеваниями сердца либо наблюдались при назначении эритромицина одновременно с такими препаратами, как цизаприд и терфенадин (Вгап-driss et al., 1994).
Применение эритромицина в больших дозах (эритромицина глюкогептонат или эритромицина лактобионат, 4 г/сут в/в, либо большие дозы эритромицина эстолата внутрь) может сопровождаться преходящим нарушением слуха (Karmody and Weinstein, 1977).
Механизм действия[править | править код]
Макролиды — бактериостатические антибиотики, подавляющие синтез белка путем обратимого связывания с 505-субъединицей рибосом (рис. 47.3; Brisson-Noel et al., 1988). Макролиды действуют на ту же мишень, что и хлорамфеникол, конкурентно ингибируя его связывание с рибосомами (рис. 47.2). Изменение 50S-субъединицы рибосом вследствие мутации, нарушающее связывание макролидов с мишенью, приводит к развитию лекарственной устойчивости. В отличие от хлорамфеникола, препятствующего образованию пептидной связи, макролиды действуют на этапе транслокации — переноса вновь синтезированной молекулы пептидил-тРНК изаминоацильногоучастка рибосомы в пептидильный участок.
Грамположительные бактерии накапливают почти в 100 раз больше эритромицина, чем грамотрицательные.
В щелочной среде антимикробная активность препарата гораздо выше, вероятно потому, что в неионизированной форме, преобладающей при высоком pH, он значительнолучше проникает в бактериальные клетки (Sabath etal., 1968; Vogel et al., 1971).
Приобретенная устойчивость к макролидам обусловлена тремя основными механизмами:
- активным выведением препарата из клетки (у стафилококков переносчик кодируется геном mrsA, у Streptococcus pyogenes—геном mefA, у Streptococcus pneumoniae — геном mefE),
- уменьшением сродства рибосом к препарату, обусловленным их метилированием под действием индуцируемого или конститутивного фермента метилтрансферазы (этот фермент кодируется генами егтА, егтВ и егтС)
- гидролизом макролидов эстеразами энтеробактерий (Barth61dmy et al., 1984).
Второй механизм, опосредуемый генами егт, обусловливает устойчивость не только к макролидам, но и к линкозамидам и стрептограминам (фенотип MLSB). Все эти препараты действуют наоднуиту же мишень, метилирование которой приводит к формированию устойчивости. Существует еще один механизм устойчивости к макролидам, обнаруженный у Bacillussubtilis, Campylobacter spp. и грамположительных кокков. Он обусловлен хромосомными мутациями, изменяющими строение белка 508-субъединицы рибосом.
Лекарственные взаимодействия[править | править код]
Эритромицин и кларитромицин взаимодействуют с другими лекарственными средствами (Periti et al., 1992). Эритромицин усиливает действие астемизола, карбамазепина, глюкокортикоидов, циклоспорина, дигоксина, алкалоидов спорыньи, терфенадина, теофиллина, триазолама, вальпроевой кислоты и варфарина, вероятно, путем ингибирования микросомальных ферментов печени, участвующих в метаболизме этих лекарственных средств (Ludden, 1985; Martell et al., 1986; Honig et al., 1992). Кларитромицин, близкий по строению к эритромицину, взаимодействует с теми же препаратами. Азитромицин, по-видимому, не вступает в лекарственные взаимодействия, так как, в отличие от эритромицина и кларитромицина, имеет в своем составе 15-членное лактонное кольцо. Тем не менее назначать азитромицин одновременно с перечисленными выше препаратами следует с осторожностью.