ДВС-синдром относится к частым и наиболее тяжелым, жизненно опасным нарушениям системы гемостаза (гемостаз — комплекс реакций организма, направленных на предупреждение и остановку кровотечений).
Синонимы ДВС-синдрома — тромбогеморрагический синдром, коагулопатия потребления, гиперкоагуляционный синдром, синдром дефибринации.
ДВС-синдром (синдром диссеминированного внутрисосудистого свертывания) – это:
- вторичный патологический процесс, возникающий при постоянной и длительной стимуляции системы гемостаза;
- патологический процесс, имеющий фазовое течение, с первоначальной активацией и последующим глубоким нарастающим истощением всех звеньев системы гемостаза вплоть до полной утраты способности крови свертываться с развитием катастрофических неконтролируемых кровотечений и тяжелого генерализованного геморрагического синдрома;
- патологический процесс, при котором отмечается прогрессирующее рассеянное внутрисосудистое свертывание крови с множественным и повсеместным образованием микросгустков крови и агрегатов ее форменных элементов, что ухудшает ее реологические характеристики, блокирует микроциркуляцию в тканях и органах, вызывает в них ишемические повреждения и ведет к полиорганным поражениям.
Причины
Пусковыми факторами ДВС-синдрома могут явиться самые разнообразные интенсивные или длительные стимулы, так или иначе укладывающиеся в триаду Вирхова – нарушения циркуляции крови, ее свойств или сосудистой стенки.
ДВС-синдром возникает:
1. При нарушении реологических характеристик крови и гемодинамики
- любой вид шока,
- кровопотеря,
- интоксикация,
- сепсис,
- резус-конфликтная беременность,
- остановка кровообращения и последующая реанимация,
- гестозы,
- атония матки,
- предлежание плаценты,
- массаж матки
2. При контакте крови с поврежденными клетками и тканями
- атеросклероз,
- антенатальная гибель плода,
- онкологические заболевания
3. При изменении свойств крови и при массивном поступлении в кровь тромбопластических веществ
- лейкозы,
- эмболия околоплодными водами,
- переливание несовместимой крови,
- септический аборт,
- отслойка нормально расположенной плаценты с кровоизлиянием в матку,
- приращение плаценты,
- разрыв матки,
- операции на паренхиматозных органах: матке, печени, легких, простате, почках;
- острая лучевая болезнь,
- синдром длительного сдавления,
- гангрена,
- трансплантация органов, химиотерапия, панкреонекроз, инфаркт миокарда и прочее).
Прогрессирование диссеминированного внутрисосудистого свертывания
Десеминированная внутрисосудистая свертываемость начинается с избыточной активности системы свертываемости крови и чрезмерного тромбообразования в вашем организме. Чрезмерное тромбообразование обычно стимулируется веществами, которые попадают в кровь, с возможными причинами, перечисленными выше.
Поскольку факторы свертывания крови и тромбоциты расходуются, остаётся меньше факторов свертывания крови, доступных для использования в реальных местах кровотечения, вследствие этого возникает сильное кровотечение.
Результаты этого процесса (т.е. аномальные небольшие тромбообразования (микротромбы) и/или кровотечения) обнаруживаются во многих органах и тканях. Существенные изменения могут произойти в некоторых органах вашего организма, таких как почки, легкие, мозг, надпочечники или плацента.
Осложнения
Осложнения ДВС-синдрома следующие:
- острая почечная недостаточность (ОПН);
- изменение психического статуса;
- дыхательная дисфункция;
- печеночная дисфункция;
- опасный для жизни тромбоз и кровоизлияние (у пациентов с ДВС средней и высокой степени тяжести);
- тампонада сердца (происходит скопление жидкости между листками перикарда);
- гемоторакс (скопление крови в плевральной полости);
- внутрицеребральная гематома;
- гангрена и потеря конечностей;
- шок;
- смерть.
Симптомы ДВС-синдрома
В течении ДВС-синдрома выделяют 4 стадии:
1 стадия – фаза гиперкоагуляции и гиперагреции тромбоцитов;
2 стадия – переходная фаза (разнонаправленные сдвиги в свертываемости крови как в сторону гипер-, так и в сторону гипокоагуляции);
3 стадия – фаза глубокой гипокоагуляции (кровь не сворачивается вообще);
4 стадия – разрешающая фаза (либо показатели гемостаза нормализуются, либо развиваются осложнения, приводящие к летальному исходу).
Симптоматика ДВС-синдрома зависит от многих факторов (причины, которая его вызвала, клиники шока, нарушений всех звеньев гемостаза, тромбозов, сниженного объема сосудистого русла, кровотечения, анемии, нарушения функций и дистрофии органов-мишеней, нарушения обмена веществ).
В первую фазу отмечается повышенная свертываемость крови, моментальное образование сгустков в крупных сосудах и тромбов в мелких (во время операции). У больного невозможно взять кровь на анализ, так как она тут же сворачивается. Как правило, первая фаза протекает очень быстро и остается незамеченной врачами. Отмечается резкое снижение артериального давления, кожные покровы бледные, покрыты холодным липким потом, пульс слабый (нитевидный). Затем развивается дыхательная недостаточность в силу поражения легких, влажный кашель и крепитация в легких, цианоз кожи, холодные ступни и кисти.
Во вторую фазу сохраняются те же симптомы, что и в первой стадии ДВС-синдрома, плюс в процесс вовлекаются почки (почечная недостаточность), надпочечники, пищеварительный тракт (тошнота, рвота, боли в животе, диарея). В головном мозге образуются микротромбы (головная боль, головокружение, судороги, потеря сознания вплоть до комы, парезы и параличи, инсульты).
Третья фаза (стадия гипокоагуляции) характеризуется массивными кровотечениями, как из первоначального очага, так и из других органов (кишечное и желудочное кровотечения вследствие изъязвления слизистой, кровь в моче – поражение почек, мокрота с примесью крови при откашливании).
Также характерно развитие геморрагического синдрома (появление массивных кровоизлияний, гематом, петехий, неостанавливающееся кровотечение в местах инъекций и во время проведения операции, кровоточивость десен, кровотечение из носа и прочее).
Четвертая фаза при своевременном и адекватном лечении ведет к восстановлению гемостаза и остановке кровотечения, но нередко заканчивается летальным исходом при массивном поражении внутренних органов и кровотечении.
Тромбоз: норма или патология?
Для того чтобы разобраться, в чем же причина и каковы механизмы возникновения такого тяжелого нарушения как ДВС-синдром, нужно знать основные этапы свертывания крови.
Человек постоянно сталкивается с риском возможных травм, от мелких царапин или порезов до серьезных ранений, поэтому природой предусмотрен специальный защитный механизм – тромбоз, то есть образование кровяного свертка в месте повреждения сосуда.
В организме существует две противоположно направленные системы – свертывающая
и
противосвертывающая, правильное взаимодействие которых способствует тромбообразованию в случае необходимости, а также жидкому состоянию крови в сосудах при отсутствии каких-либо повреждений. Эти системы гемостаза играют очень важную защитную роль.
Образование тромба
При нарушении целостности сосудистой стенки происходит активация свертывающей системы, целый каскад реакций которой и приводит к образованию тромба (сгустка в просвете сосуда или камере сердца). Непосредственное участие в этом принимают белки плазмы, в частности фибриноген, а также тромбоциты, факторы свертывания, образующиеся в печени, и различные ферменты. Результатом является формирование свертка крови, закрывающего дефект сосудистой стенки и препятствующего дальнейшему кровотечению.
Для поддержания жидкого состояния крови и препятствия бесконтрольному образованию тромбов существуют специфические антитромботические механизмы
, реализуемые действием так называемых
антикоагулянтов
– веществ, предотвращающих возникновение массивного тромбоза (белки плазмы, протеолитические ферменты, эндогенный гепарин). Кроме того, препятствием тромбозу является быстрый кровоток и так называемый фибринолиз, то есть растворение белка фибрина и удаление его из сосудистого русла при помощи ферментов, циркулирующих в плазме крови и выделяемых лейкоцитами, тромбоцитами и другими клетками. Остатки фибрина после его разрушения поглощаются лейкоцитами и макрофагами.
При изменении взаимодействия компонентов системы гемостаза при различных заболеваниях и травмах, происходит дискоординация в работе свертывающей и противосвертывающей систем, что способствует массивному неконтролируемому тромбообразованию наряду с кровотечениями. Эти механизмы составляют основу патогенеза ДВС-синдрома, являющегося угрожающим жизни осложнением.
Диагностика
Основные лабораторные исследования:
- определение тромбоцитов (при ДВС-синдроме отмечается снижение тромбоцитов во 2, 3 и 4 фазы);
- время свертываемости крови (норма 5 – 9 минут, в 1 стадию укорочение показателя, в последующие – удлинение времени);
- время кровотечения (норма 1 – 3 минуты);
- АЧТВ (активированное частичное тромбопластическое время – увеличение во 2 и 3 фазах ДВС-синдрома);
- протромбиновое время, тромбиновое время, определение активированного времени рекальцификации плазмы – АВР (увеличение во вторую и третью стадию ДВС-синдрома);
- лизис сгустка (в норме нет, в 3 фазу лизис быстрый, а в 4 фазу сгусток не формируется);
- фибриноген (норма 2 – 4 г/л, снижается во 2, 3 и 4 стадии);
- исследование феномена фрагментации эритроцитов вследствие повреждения их нитями фибрина (в норме тест отрицательный, положительный тест свидетельствует о ДВС-синдроме);
- снижение эритроцитов (анемия, уменьшение объема крови);
- снижение гематокрита (гиповолемия);
- определение кислотно-щелочного и электролитного баланса.
Приложение Б. Алгоритмы ведения пациента
Приложение Б1. Алгоритм диагностики и коррекции ДВС-синдрома
Приложение Б2. Алгоритм коррекции коагулопатического кровотечения (ДВС-синдрома)а
Приложение Б3. Алгоритм применения фактора VII и концентрата протромбинового комплекса при коагулопатическом кровотечении (ДВС-синдроме)
Лечение ДВС-синдрома
Терапию ДВС-синдрома осуществляет врач, столкнувшийся с данной патологией (то есть лечащий врач) вкупе с реаниматологом. При хроническом течении ДВС-синдрома его лечением занимается терапевт с гематологом.
В первую очередь необходимо устранить причину ДВС-синдрома. Например, при сепсисе назначается антибактериальная и трансуфизионная (внутривенное вливание препаратов крови) терапия, при травматическом шоке – адекватное обезболивание, иммобилизация, оксигенация и раннее хирургическое вмешательство. Или при опухолевых заболеваниях – химио- и радиотерапия, при инфаркте миокарда – купирование болевого синдрома, восстановление сердечного ритма и гемодинамики, при акушерской и гинекологической патологии радикальные меры (экстирпация матки, кесарево сечение).
Восстановление гемодинамики и реологических свойств крови осуществляется путем инфузионно-трансфузионных вливаний.
Показано вливание свежезамороженной плазмы, которая не только восстанавливает объем циркулирующей крови, но и содержит все факторы свертывания.
Также вводят кристаллоидные (физ. раствор, глюкоза) и коллоидные растворы (полиглюкин, реополиглюкин) в отношении 4/1 и белковые препараты крови (альбумин, протеин).
Назначается антикоагулянт прямого действия – гепарин. Доза гепарина зависит от стадии ДВС-синдрома (в 1 – 2 фазы она значительная). При значительной анемии переливается свежая (не более 3 суток) эритроцитарная масса.
В лечении тяжелого генерализованного ДВС-синдрома применяют фибриноген и концентраты свертывающих факторов крови (криопреципетат). Используют игинбиторы протеолиза – антипротеазы, для подавления тканевых протеаз, которые высвобождаются при повреждении клеток (контрикал, трасилол, гордокс). Также назначаются кортикостероиды (гидрокортизон, дексаметазон), так как они повышают свертываемость крови.
Параллельно ведется борьба с полиорганной недостаточностью (поддержка функций легких, почек, желудочно-кишечного тракта, надпочечников). Во 2 – 4 фазах ДВС-синдрома для восстановления местного гемостаза применяют смесь из аминокапроновой кислоты, сухого тромбина, этамзилата натрия и адроксона. Данную смесь вводят в брюшную полость через дренажи, перорально, в виде тампонов в полость матки и влагалища, а смоченные раствором салфетки наносят на рану.
Весь процесс интенсивной терапии занимает 1 – 5 суток (в зависимости от тяжести ДВС-синдрома), а последующее лечение продолжается до полного или практически полного восстановления всех полиорганных нарушений.
Главная / Издательство / ДВС-синдром как одно из проявлений системного воспалительного ответа
2.2.2. ДВС-синдром как одно из проявлений системного воспалительного ответа
Диссеминированное внутрисосудистое свертывание крови – динамиче-ский патологический процесс, характеризующийся последовательной сменой генерализованной гиперкоагуляции с внутрисосудистым свертыванием кро-ви, агрегацией тромбоцитов, блокадой микроциркуляции и гипокоагуляции с гипофибриногенемией и тромбоцитопенией потребления.
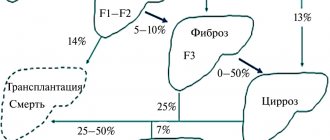
ДВС-синдром – неспецифический процесс, утяжеляющий самые разнооб-разные формы патологии: инфаркт миокарда, осложненный кардиогенным шоком, различные виды злокачественных новообразований, обширные опе-ративные вмешательства, тяжелую гипоксию, переливание несовместимой крови, системную красную волчанку, иммунокомплексные заболевания, цир-роз печени, акушерскую патологию (преждевременная отслойка плаценты, эмболия околоплодными водами, внутриутробная гибель плода) (Балуда В.П., 1979; Гаврилов О.К., 1981; Баркаган З.С., 1983).
Диссеминированное внутрисосудистое свертывание крови нередко возни-кает при таких критических состояниях, как тяжелые инфекции, септицемия, сепсис, септический шок, являясь проявлением синдрома системного воспа-лительного ответа.
По сводным статистикам крупных многопрофильных клинических цен-тров, первое место среди причин ДВС-синдрома занимают генерализованные бактериальные и вирусные инфекции, септицемия. На их долю приходится до 50% патологии (Баркаган З.С., 1981). Развитие ДВС-синдрома при септи-ческой инфекции является в значительной мере цитокинопосредованным процессом (St.schon RC., Dorinsky PM, 1993; А. Гулло, 1997).
Касаясь патогенеза диссеминированного внутрисосудистого сверты-вания крови, представляющего собой в ряде случаев проявление систем-ного вос-палительного ответа при массивных травматических поврежде-ниях тканей, оперативных вмешательствах, родовых травмах, септических инфекциях, следует отметить общие закономерности развития ДВС, включающие сле-дующие инициирующие механизмы развития:
1. Первичное поражение сосудистой стенки, десквамация эндотелия, об-нажение субэндотелиальных белков: коллагена, тромбосподина, фибро-нектина, фактора Виллебранда, обладающих способностью активировать процессы адгезии и агрегации тромбоцитов, активировать XII фактор Хаге-мана с последующей активацией внутреннего механизма формирования про-тромбиназной активности, системы комплемента, фибринолиза, калликреин-кининовой систем. Таким образом, одномоментно запускаются тромбоци-тарное звено системы гемостаза, коагуляционный гемостаз, сочетающиеся с дальнейшей деструкцией сосудистой стенки под влиянием вазоактивных компонентов комплемента, калликреин-кининовой системы.
Следует отметить, что повреждение эндотелиальных клеток неизменно влечет за собой освобождение тканевого тромбопластина (III фактора свер-тывания крови, источник образования — эндотелий и гладкомышечные эле-менты сосудов) и соответственно активацию внешнего механизма формиро-вания протромбиназы при участии VII плазменного фактора и ионов Са. И в данном случае индуцирование внешнего механизма формирования протром-биназы, как и при активации внутреннего механизма, возникает усиление фибринолитических реакций в связи с тем, что поврежденный эндотелий яв-ляется источником активаторов плазминогена тканевого типа.
Указанные механизмы одномоментной активации тромбоцитарно-сосудистого звена системы гемостаза, коагуляционного гемостаза и фибри-нолиза могут инициироваться в различных участках микроциркуляции, весь-ма отдаленных от зоны альтеративно-деструктивных процессов как под влиянием бактерий, вирусов, токсинов, особенно эндотоксина грамотрица-тельных бактерий, иммунных комплексов, так и различных медиаторов вос-паления гуморального и клеточного происхождения (Бахдарчьян Э.А., Паль-чикова Е.И., 1984; Пак С.Г., Синельникова М.Н., Цукерман Д.Б. и соавт., 1987; Орлов В.А., Якунин Г.А., 1987; Грачев С.В., Якунин Г.А., Новачадов В.В., Ярошенко И.Ф., 1992).
2. Первичное преимущественное воздействие патогенного фактора на тромбоциты, индукция процессов адгезии, агрегации тромбоцитов, высвобо-ждение из тромбоцитов биогенных аминов, тромбоцитарных факторов свер-тывания крови, в частности, 3-го и 4-го, инициирующих образование тром-бина с возможной последующей активацией под влиянием тромбина ряда факторов формирования протромбиназы, развития каскада реакций вторич-ной активации коагуляционного гемостаза.
Эндотоксины бактерий, иммунные комплексы, антитела обладают спо-собностью интенсивно акцептироваться тромбоцитами. В связи с этим выра-женная активация тромбоцитарного звена системы гемостаза отмечается при воспалительных процессах бактериальной и иммуно-аллергической приро-ды.
3. Сочетанное практически одномоментное воздействие бактериальных токсических, иммуноаллергических факторов на тромбоцитарно-сосудистое и коагуляционное звенья системы гемостаза.
4. Развитие альтернативных механизмов гемокоагуляции за счет актива-ции моноцитарно-макрофагального и эритроцитарного звеньев системы ге-мостаза.
Как известно, клеточные элементы мононуклеарной фагоцитирующей системы играют исключительно важную роль в эндоцитозе, переработке ан-тигенов и представлении их Т-хелперам в комплексе с Iа-белком. Однако следует отметить, что антигенстимулированные мононуклеарные фагоциты могут синтезировать около 100 различных биологически активных соедине-ний – монокинов, причем среди монокинов имеется группа высокоактивных соединений, регулирующих процессы гемостаза и фибринолиза в случае раз-вития неспецифических патологических реакций, синдрома системного дей-ствия воспаления на организм (Dinarello CA, Cannon J.G., Wolff S.M., 1988; Yacobs R.F., Tabor D.R., 1989; Shalaby M.R., Waage A., Aarden L. et al., 1989; Cotran R.S., Pober J.S., 1990).
В физиологических условиях моноциты, тканевые макрофаги практически не продуцируют факторы гемокоагуляции и фибринолиза.
В зоне воспаления моноциты, тканевые макрофаги, активированные эндо-токсином, продуктами распада тканей начинают синтезировать и секретиро-вать в окружающую среду различные регуляторы гемостатического потен-циала крови, в частности, тканевый тромбопластин, К-зависимые факторы свертывания крови и некоторые К-независимые (V, VII, IX, X), причем X фактор синтезируется макрофагами в частично активированном виде.
К числу макрофагальных цитокинов относят также фибронектин, тром-боспондин, протеогликаны, обеспечивающие процессы адгезии и агрегации тромбоцитов, то есть начальные механизмы активации тромбоцитарного зве-на системы гемостаза.
Макрофаги могут обеспечивать и альтернативную регуляцию активности фибринолиза в зоне воспаления и за его пределами в случае развития син-дрома системного воспалительного ответа за счет секреции активатора плаз-миногена, а также ингибиторов плазминогена и плазмина.
В отличие от макрофагов, другие виды лейкоцитов лишены способности вырабатывать тромбопластин и другие активаторы свертывания крови.
При развитии ряда бактериальных инфекций и интоксикаций, характери-зующихся интенсивным освобождением в кровоток эндотоксинов, экзоток-синов с гемолизирующей активностью, ферментов патогенности, а также в случаях вторичного избыточного накопления в эритроцитах продуктов липо-пероксидации, приводящих к дестабилизации эритроцитарных мембран и усилению гемолиза эритроцитов, возможны определенные сдвиги гемостати-ческого потенциала крови, вносимые гемолизированными эритроцитами.
Как известно, при повреждении мембран эритроцитов возникает актива-ция гемостаза за счет освобождения АДФ и мембранных фосфолипидных матриц. В то же время на мембранных фосфолипидных матрицах эритроци-тов интенсивно сорбируются факторы свертывающей и фибринолитической систем. Микромембраны эритроцитов способны выполнять роль матриц в механизмах формирования протромбиназной активности по внутреннему пу-ти активации свертывающей системы (Ашкинази И.Я., 1977).
Таким образом, различные по своей природе патогенные факторы, вызы-вающие развитие локального воспалительного процесса и синдром системно-го воспалительного ответа, вызывают активацию прокоагулянтной системы крови за счет массивного генерализованного повреждения сосудистой стен-ки, повышения ее адгезивных свойств, активации тромбоцитарного звена системы гемостаза, а в ряде случаев моноцитарно-макро-фагального и эрит-роцитарного альтернативных путей гемокоагуляции.
Естественно, что в каждом конкретном случае патологии можно выявить определенную специфику инициирующих механизмов активации коагуляци-онного, тромбоцитарно-сосудистых звеньев системы гемостаза, но очень бы-стро в динамике патологии в связи с каскадом взаимо-модулирующих реак-ций гемостаза теряются специфические особенности расстройств коагуляци-онного потенциала крови, возникает фаза гиперкоагуляции с последующей гипокоагуляцией потребления.
В развитии ДВС-синдрома следует выделять следующие фазы:
I. Гиперкоагуляции и агрегации клеток крови.
II. Переход гиперкоагуляции в гипокоагуляцию.
III. Стадия глубокой гипокоагуляции, вплоть до полной несвертываемости крови, обусловлена потреблением, блокадой и расщеплением ряда факторов свертывания крови, накоплением и циркуляцией продуктов их распада, обла-дающих антикоагулянтной активностью, а также тромбоцитопенией потреб-ления.
IV. Восстановительная стадия при благоприятном течении заболевания, или стадия формирования полиорганной недостаточности в случае преобла-дания механизмов декомпенсации и повреждения.
ДВС-синдром может носить острый, подострый, хронический и рециди-вирующий характер (Гаврилов О.К., 1981).
Острая форма возникает при септических инфекциях, обширных опера-тивных вмешательствах, кровопотере, ожогах, переливании несовместимой крови, а также при отслойке плаценты, эмболии амниотической жидкостью, внутриутробной гибели плода, атонии матки, септическом аборте, при трав-матическом, геморрагическом, кардиогенном, анафилактическом шоках.
В случае острого течения ДВС-синдрома фаза гиперкоагуляции чрезвы-чайно кратковременна.
Подострое течение ДВС-синдрома имеет место при почечной недоста-точности, злокачественных новообразованиях, лейкозах.
Рецидивирующая и хронические формы могут иметь место при раке, сис-темных воспалительных аутоиммунных заболеваниях и других формах пато-логии.
Отмечают возможность локального поражения микроциркуляции при ДВС внутри того или иного органа и генерализованных расстройствах. (Ма-чабели М.С., 1970; Балуда В.П., 1979).
Касаясь клинической картины ДВС-синдрома, необходимо отметить, что она прежде всего складывается из симптомов основного заболевания, инду-цирующего развитие ДВС, а также явлений гемокоагуляционного шока, фаз-ных сдвигов гемостаза и фибринолиза.
ДВС-синдром, начавшийся с шока, всегда имеет более тяжелый исход, нежели бесшоковые формы (Баркаган З.С., 1988).
В клинической картине чрезвычайно сложно проследить за трансформа-цией септического, травматического, геморрагического, кардиогенного шока в гемокоагуляционный, поскольку характерными неспецифическими призна-ками шока различной этиологии являются первоначальное развитие спазма периферических сосудов, централизация кровотока, что сочетается с нор-мальным или повышенным уровнем АД, цианозом, одышкой, олигоанурией, похолоданием конечностей (гипердинамическая фаза шока).
Однако по мере прогрессирования патологии возникает децентрализация кровотока, развиваются патологическое депонирование крови, парез микро-сосудов, сладж-синдром, прогрессирующее падение АД вплотьдо критиче-ских величин, выраженные расстройства микроциркуляции в перифериче-ских органах и тканях, полиорганная недостаточность (почечная, печеночная, надпочечниковая недостаточность, шоковое легкое).
В диагностике ДВС-синдрома важное значение отводится динамике таких лабораторных показателей гемостаза, как число тромбоцитов, уровень фиб-риногена, тромбиновое время, протромбиновое время, парциальное тромбо-пластиновое время, уровень антитромбина III, уровень фибриногена, этано-ловый и протаминсульфатный тесты.
Следует отметить, что лабораторные исследования гемостаза позволяют выявить как наклонность к тромбообразованию, гиперкоагуля-ционные сдви-ги, так и гипокоагуляционные расстройства.
При остром ДВС-синдроме возможно быстрое развитие тромбоцито-пении и гипофибриногенемии. Истинной афибриногенемии при ДВС-синдроме практически не бывает, часто наблюдается усиление связывания фибриногена с фибринмономерами и образованием растворимого фибрина. При затяжных и хронических формах ДВС гипофибриногенемия встречается крайне редко, поскольку указанная форма ДВС нередко возникает на фоне исходной гиперфибриногенемии, свойственной многим затяжным формам инфекционных и воспалительных процессов (Баркаган З.С., 1988), иниции-рующих развитие ДВС-синдрома.
Тромбоцитопения потребления практически всегда сопутствует остро-му и подострому ДВС-синдрому.
В начальной фазе ДВС в периферической крови выявляется большое ко-личество агрегатов тромбоцитов, сочетающееся со снижением агрегационной функции оставшихся в кровотоке клеток. Последнее обуслов-лено токсиче-ским воздействием на тромбоциты продуктов распада тканей, бактериаль-ных, токсических и ферментных факторов патоген-ности, свободных радика-лов, ингибирующим воздействием на процесс агрегации продуктов деграда-ции фибрина, возвратом в циркуляцию из микротромбов части тромбоцитов, уже подвергшихся истощению (Баркаган З.С., 1988).
При медленно протекающем ДВС-синдроме число тромбоцитов может быть нормальным или даже повышенным.
Важным диагностическим признаком ДВС-синдрома является повреж-дение, фрагментация эритроцитов, появление их обломков вплоть до форми-рования клинико-лабораторных признаков гемолиза эритроцитов.
При острых и подострых формах ДВС протромбиновое время увеличено благодаря снижению активности V фактора и уровня фибриногена; тромби-новое время обычно увеличено, что обусловлено гипофибрино-генемией и ингибирующим воздействием продуктов деградации фибрино-гена (ПДФ).
ПДФ ингибируют коагулирующую активность тромбоцитов и процесс полимеризации фибринового сгустка.
При ДВС-синдроме, как правило, положительна реакция паракоагуляции с использованием протаминсульфатного и этанолового теста для определе-ния растворимого фибрин-мономера (Гаврилов О.К., 1981)
Прямым подтверждением ДВС служат обнаружение тромбов в системе микроциркуляции, а также выявление фибринопептидов А, В.
Важным диагностическим тестом ДВС-синдрома является содержание в крови антитромбина III. На I стадии ДВС – гиперкоагуляции, когда возникает выраженная активация сериновых протеаз – тромбина и фактора Ха, гепарин в комплексе с антитромбином III инактивирует эти протеазы. В последую-щем гепарин ингибируется 4-м тромбоцитарным фактором, а в процессе инактивации сериновых протеаз усиленно расходуется антитромбин III, что приводит к его быстрому истощению. Уровень антитромбина III в крови бы-стро снижается. Как правило, в фазе гиперкоагуляции интенсивно расходует-ся и другой антикоагулянт — протеин С.
Снижение антитромбина III и протеина С при острых формах ДВС обго-няет депрессию факторов свертывания крови. В случае снижения антитром-бина III до 75% возникают гепаринрезистентность и тромбогенность, по-скольку антитромбин III является кофактором гепарина.
Сравнительно рано при ДВС снижается и содержание в плазме некоторых активаторов плазминогена (прекалликреина, высокомолекулярного кинино-гена). При глубоком повреждении эндотелия в крови возрастает уровень фактора Виллебранда.
Следует отметить, что во II фазе ДВС-синдрома (переходной от гипер- к гипокоагуляции) возникает разнонаправленность сдвигов многих показате-лей, когда одни тесты еще свидетельствуют о гиперкоагуляции, а другие — о гипокоагуляционных.
В отличие от вышеописанных сдвигов показателей гемостаза, свойствен-ных острой и подострой формам ДВС, при хроническом ДВС диагностика нередко затруднена.
В фазе гиперкоагуляции хронической формы ДВС отмечены повышение активности прокоагулянтных факторов, гиперфибриногенемия, тромбоцитоз, уменьшение парциального тромбопластинового времени. При хронических формах ДВС могут иметь место как развитие тромбоцитоза, так и развитие тромбоцитопении и гипофибриногенемии.
Одним из частых и опасных проявлений ДВС является развитие геморра-гического синдрома, возникающего при острой форме ДВС в фазе гипокоа-гуляции. Однако в ряде случаев уже в ранней фазе гипер-коагуляции или в переходной фазе от гипер- к гипокоагуляции возникают множественные ге-моррагии на фоне нормального или сниженного содержания фибриногена в крови. Повышение кровоточивости характеризуется появлением синяков, кровоподтеков, гематом, кровоизлияний в различные органы, диффузным пропотеванием крови в брюшную и плевральную полости, развитием носо-вых, желудочно-кишечных, легочных, почечных, маточных кровотечений.
Повышенная кровоточивость при ДВС-синдроме приводит к развитию постгеморрагической анемии, а в тяжелых случаях – к геморрагическому шоку.
Характерной особенностью ДВС-синдрома является блокада микроцирку-ляции в различных органах и тканях с последующим нарушением их трофи-ки и функциональной активности.
Шок-органами при ДВС-синдроме являются легкие, почки, желудок и кишечник, реже поражается печень.
Закупорка сосудов легких микросгустками фибрина, агрегатами клеток крови, избыточное накопление в легких вазоактивных соединений приводят к развитию отека легких, появлению инфарктов легких, респираторного ди-стресс-синдрома. Последний характеризуется появле-нием одышки, цианоза, гипоксемией и гиперкапнией.
Расстройства системной гемодинамики и микроциркуляции при ДВС-синдроме приводят к развитию преренальной и ренальной форм почечной недостаточности, характерными признаками которой являются олигоанурия, появление в моче белка, цилиндров, эритроцитов, увеличение в крови оста-точного небелкового азота, расстройства электролитного баланса и кислотно-основного состояния.
Нередко отмечаются тяжелые сочетанные осложнения ДВС-синдрома в виде шокового легкого и острой почечной недостаточности, или почечной и печеночной недостаточности. Нередко при почечной недостаточности разви-вается гемолитико-уремический синдром.
Микротромбоз и стаз в сосудах слизистой 12-перстной кишки и желудка, появление множества геморрагий приводят к глубоким дистрофическим из-менениям в слизистой, нарушения репаративной регенерации слизистой, по-явлению острых эрозий и кровотечений.
Вторичное поражение печени при ДВС-синдроме встречается значитель-но реже, проявляется развитием паренхиматозной желтухи. Чаще нарушение структуры и функции печени предшествует развитию ДВС-синдрома, явля-ясь одной из его причин.
При ДВС-синдроме септического происхождения, а также осложняющего различные виды шока, возможно развитие надпочечниковой недостаточно-сти, центрогенного несахарного диабета.
предыдущий раздел | содержание| следующий раздел