Гидрокарбонат натрия
(лат. Natrii hydrocarbonas), другие названия:
бикарбонат натрия
,
чайная сада
,
питьевая
или
пищевая сода
,
двууглекислый натрий
— неорганическое соединение, натриевая кислая соль угольной кислоты с химической формулой NaHCO3.
В обычном виде — мелкокристаллический порошок белого цвета.
Используется в промышленности, пищевой промышленности, в кулинарии, в медицине как нейтрализатор химических ожогов кожи и слизистых оболочек концентрированными кислотами и для снижения кислотности желудочного сока. Также применяется в буферных растворах.
Применение
Двууглекислый натрий (бикарбонат), применяется в химической, пищевой, легкой, медицинской, фармацевтической промышленности, цветной металлургии, поставляется в розничную торговлю.
- в химической промышленности — для производства красителей, пенопластов и других органических продуктов, фтористых реактивов, товаров бытовой химии, наполнителей в огнетушителях, для отделения двуокиси углерода, сероводорода из газовых смесей (газ поглощается в растворе гидрокарбоната при повышенном давлении и пониженной температуре, раствор восстанавливается при подогреве и пониженном давлении).
- в легкой промышленности — в производстве подошвенных резин и искусственных кож, кожевенном производстве (дубление и нейтрализация кож), текстильной промышленности (отделка шелковых и хлопчатобумажных тканей).
- в пищевой промышленности — хлебопечении, производстве кондитерских изделий, приготовлении напитков.
Кулинария
Основное применение питьевой соды — кулинария, где она применяется, преимущественно, в качестве основного или дополнительного разрыхлителя
при выпечке (так как при нагревании выделяет углекислый газ), самостоятельно или в составе комплексных разрыхлителей (например, пекарского порошка, в смести с карбонатом аммония), например, в бисквитном и песочном тесте.
Медицина
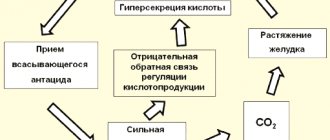
Раствор питьевой соды используется в качестве слабого антисептика для полосканий, а также как традиционное кислотонейтрализующее средство от изжоги и болей в желудке (современная медицина не рекомендует применять из-за побочных эффектов, в том числе, из-за «кислотного рикошета») или для устранения ацидоза и т. п.
Пожаротушение
Гидрокарбонат натрия входит в состав порошка, применяемого в порошковых системах пожаротушения, утилизируя тепло и оттесняя кислород от очага горения выделяемым углекислым газом.
Химические свойства
Гидрокарбонат натрия — кислая натриевая соль угольной кислоты. Проявляет все свойства соли сильного основания и слабой кислоты. В водных растворах имеет слабощелочную реакцию. В широком диапазоне концентраций в водном растворе pH раствора изменяется незначительно, на этом основано применение раствора вещества в качестве буферного раствора.
Реакция с кислотами
Гидрокарбонат натрия реагирует с кислотами с образованием соответствующей кислоте соли, например, хлорида натрия, сульфата натрия и угольной кислоты, которая в процессе реакции распадается на углекислый газ и воду, при этом углекислый газ выделяется из раствора в виде пузырьков:
NaHCO3 + HCl → NaCl + H2CO3 H2CO3 → H2O + CO2↑ 2NaHCO3 + H2SO4 → Na2SO4 + 2H2O + 2CO2↑
В быту обычно применяется реакция «гашения соды» уксусной кислотой, с образованием ацетата натрия или гашение лимонной кислотой с образование цитрата натрия, реакция с уксусной кислотой:
NaHCO3 + CH3COOH → CH3COONa + H2O + CO2↑
Ссылки
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое «Питьевая сода» в других словарях:
ПИТЬЕВАЯ СОДА — гидрокарбонат натрия NaHCO3; см. Сода … Большой Энциклопедический словарь
питьевая сода — гидрокарбонат натрия, NaHCO3; см. Сода. * * * ПИТЬЕВАЯ СОДА ПИТЬЕВАЯ СОДА, гидрокарбонат натрия NaHCO3; см. Сода (см. СОДА) … Энциклопедический словарь
Питьевая сода — гидрокарбонат натрия NaHCO3, см. Сода … Большая советская энциклопедия
ПИТЬЕВАЯ СОДА — гидрокарбонат натрия, NаHСО3; см. Сода … Естествознание. Энциклопедический словарь
питьевая сода — бикарбонат … Cловарь химических синонимов I
СОДА — название, общее для нескольких химических продуктов, обладающих щелочными свойствами: 1) сода каустическая, или едкий натр, являющаяся сильной щёлочью (см. Каустик); 2) сода кальцинированная и кристаллическая (или углекислая), называемая в быту… … Краткая энциклопедия домашнего хозяйства
Сода — (Питьевая сода, двууглекислый натрий, бикарбонат натрия NaHCO3 и карбонат натрия Na2CO3). Современная пищевая сода типичный промышленный продукт. Однако она была известна человечеству задолго до нашей эры в естественном состоянии… … Большая энциклопедия кулинарного искусства
Сода — Сода: Кальцинированная сода карбонат натрия Na2CO3. Кристаллическая сода общее название кристаллогидратов кальцинированной соды: Натрит Na2CO3*10H2O. Термонатрит Na2CO3*H2O. Питьевая сода, пищевая сода, двууглекислая… … Википедия
СОДА — СОДА: кальцинированная сода (карбонат натрия) Na2CO3 (кристаллы, tпл 858шC) и питьевая, или пищевая, сода (гидрокарбонат натрия) NaHCO3. Кальцинированная сода встречается в природе в виде минералов, содержится в подземных рассолах, рапе соляных… … Современная энциклопедия
Содержание
- 1 Химические свойства 1.1 Реакция с кислотами
- 4.1 В химической промышленности
Сода: Различные названия — одна суть
Официальное, систематическое название: Гидрокарбонат натрия
Общеупотребительные, традиционные названия: Пищевая сода, питьевая сода, натрий двууглекислый, бикарбонат натрия.
Это все разные «имена» одной химической сущности — NaHCO 3 . Встречается в чистом виде в природе как кристаллы НАХКОЛИТА. Запомните это название. Именно сода, добытая из этого минерала, является чистой и натуральной.
Под этими названиями можно встретить в продаже белый кристаллический порошок, с содержанием гидрокарбоната натрия не менее 99%. Который чаще всего зовется «Сода Пищевая».
Как вы наверное уже поняли, качество «Пищевой Соды» напрямую зависит от её состава. А состав определяется уровнем исходного сырья, методом и культурой производства, качеством сопутствующих в производстве химикатов (или их отсутствия в случае с водным методом).
1% примесей (если это 1%. ) — это много или мало?
1% мышьяка в продукте? Доза вроде бы не смертельная, но доказано, что при ежедневном употреблении мышьяк даже в следовых количествах вызывает медленное отравление и рак.
1% алюминия в еде? Крохотное количество алюминия при регулярном потреблении способствует появлению разнообразных умственных расстройств, в том числе болезни Альцгеймера.
Что же может входить в этот 1% в так называемой «Пищевой соде»?
По ГОСТ 2014 года в остатке могут быть: мышьяк, соли аммония, алюминий и другие примеси.
Если добавлять половинку чайной ложки такой соды в блинчики раз в неделю — последствий, скорее всего, не будет.
Источник
Получение
В промышленности гидрокарбонат натрия получают аммиачно-хлоридным способом. В концентрированный раствор хлорида натрия, насыщенный аммиаком, под давлением пропускают углекислый газ. В процессе синтеза происходят две реакции:
NH3 + CO2 + H2O → NH4HCO3 NH4HCO3 + NaCl → NaHCO3↓ + NH4Cl
В холодной воде гидрокарбонат натрия мало растворим, и его отделяют от охлаждённого раствора фильтрованием, а из полученного после фильтрования раствора хлорида аммония снова получают аммиак, возвращаемый в производство вновь:
2NH4Cl + Ca(OH)2 → 2NH3↑ + CaCl2 + 2H2O
Цена Натрия гидрокарбоната
Купить в аптеке Бикабонат натрия в форме 4%-ного раствора можно за 15-28 грн. В российских аптеках его цена от 103 до 160 рублей (зависит от объема флакона и производителя).
Сколько стоит сода пищевая?
Цена пищевой соды за кг — в среднем 2,5 грн (17-25 российских рублей), за пачку 500 г — 3,8 грн (11-16 российских рублей).
Купить оптом гидрокарбонат натрия можно примерно за 3,2-3,5 тыс. грн/т (около 10 тыс. руб./т).
- Интернет-аптеки РоссииРоссия
- Интернет-аптеки УкраиныУкраина
ЗдравСити
- Натрия гидрокарбонат р-р д/инф. 40мг/мл фл. 200мл №28ОАО Дальхимфарм
1880 руб.заказать
Аптека Диалог
- Натрия гидрокарбонат (фл. 40мг/мл 200мл)Дальхимфарм
1727 руб.заказать
показать еще
Аптека24
- Натрия гидрокарбонат 4% 100 мл раствор ТОВ»Юрія-Фарм», Україна
27 грн.заказать - Натрия гидрокарбонат 4% 200 мл раствор ТОВ»Юрія-Фарм», Україна
35 грн.заказать
Отзывы
Сода — это проверенное временем средство “для красоты, чистоты и здоровья”. Именно такие отзывы о Натрия гидрокарбонате можно найти в сети Интернет. Его используют для чистки лица, отбеливания зубов и лечения кариеса, для похудения и ухода за волосами, а также для определения беременности.
К слову, отзывы о соде пищевой для похудения весьма оптимистичны, но лишь в тех случаях, когда она рассматривалось не как панацея, а как вспомогательное средство. Некоторые девушки отмечают, что после содовой ванны у них сразу уходило до 2 кг веса, но без физических нагрузок, корректировки питания процедуры не дали бы видимого результата.
Нетрадиционная медицина использует Натрия гидрокарбонат для лечения рака. Найти отзывы о лечении содой при онкологии с описанием результатов лечения самим человеком довольно сложно. Известно лишь то, что пациенты врача, который пропагандирует этот метод лечения, также умирают.
Статистики излечившихся от рака содой нет. Самолечение, когда речь идет о раке, чревато потерей времени и шанса на излечение.
Побочные действия
Длительное применение гидрокарбоната натрия приводит к алкалозу (повышению рН крови), клиническими проявлениями которого являются:
- тошнота;
- рвота;
- ухудшение аппетита (до полной потери);
- боли в животе;
- тетанические судороги (в особо тяжелых случаях);
- повышение АД.
При использовании суппозиториев может развиваться послабляющий эффект, возникают позывы на дефекацию, урчание, диарея и метеоризм.
Форма выпуска
Порошок для приготовления раствора для инфузионной терапии. В пакетах по 50 г.
Порошок для приготовления раствора для местного применения и перорального приема. В пакетах по 10, 25 и 50 г.
Раствор для инфузий 4%. Выпускается по 2 и 5 мл в одноразовых контейнерах из полимерных материалов; по 100, 200 и 400 мл в бутылках; по 100 и 250 мл в полимерных контейнерах.
Таблетки 0,3 и 0,5 г.
Свечи для ректального применения 0,3, 0,5 и 0,7 г по 10 суппозиториев в упаковке.
Примечания[ | ]
- Глинка Н. Л.
Общая химия. — М.: «Химия», 1977, переработанное. — С. 441. — 720 с. - ↑ 1234Машковский М.Д.
Лекарственные средства (пособие по фармокотерапии для врачей). — Медицина, 1998. — С. 112. — 688 с. - Полоскание при зубной боли — рекомендации
- Полоскание рта содой как средство от воспалений
- Инструкция
- Sodium Bicarbonate (копия Archive.org) // American Cancer Society, 11/28/2008 (англ.): «Available peer-reviewed medical journals do not support claims that sodium bicarbonate works as a cancer treatment.»
- Chambers, Michael
Sodium bicarbonate [USP:JAN]
(неопр.)
.
ChemIDplus
. U.S. National Library of Medicine. - ГОСТ 2156-76 «Натрий двууглекислый. Технические условия» Архивная копия от 13 января 2010 на Wayback Machine
Аналоги
Синонимами являются препараты Сода Буфер и Натрия бикарбонат. Код ATC 4-го уровня совпадает с Глюксилом, Калия хлоридом, Кальция хлоридом, Ксилатом, Лактоксилом, Магния сульфатом, Натрия хлоридом, Плериго, Реамберином.
Термическое разложение[ | ]
При температуре выше 60 °C гидрокарбонат натрия начинает распадаться на карбонат натрия, углекислый газ и воду (процесс разложения наиболее эффективен при 200 °C:
2 N a H C O 3 → 60 − 200 ∘ C N a 2 C O 3 + H 2 O + C O 2 ↑ . {\displaystyle {\mathsf {2NaHCO_{3}{\xrightarrow {60-200^{\circ }C}}Na_{2}CO_{3}+H_{2}O+CO_{2}\uparrow }}.}
При этом процессе вследствие выделения углекислого газa и воды (в виде водяного пара) масса исходного вещества уменьшается примерно на 37 %.