Химические свойства
Гипохлорит Натрия — что это такое? Это неорганическое соединение, в составе которого находится до 95% активного хлора. Вещество имеет несколько нетривиальных, исторических названий: «лабарракова вода», «жавелевая вода». Химическая формула гипохлорита натрия: NaOCl. Молекулярная масса соединения = 74,4 грамма на моль. В связи с тем, что вещество достаточно неустойчиво в свободном состоянии, оно чаще всего применяется в форме пентагидрата или водного раствора. У раствора сильный, резкий запах хлора. Безводная форма вещества синтезируется в виде бесцветных кристаллов, которые хорошо растворяются в воде. Пентагидрат обладает желто-зеленым оттенком, кристаллы ромбической формы.
По своим химическим свойствам – это сильный окислитель. Гипохлорид легко разлагается до хлорида Na и кислорода, при нагревании подвергается диспропорционированию. В воде диссоциирует на ионы. Вещество подвергает коррозии большинство металлов.
Гипохлорит Натрия производится в огромных количествах. Около половины синтезированного вещества применяют в бытовой химии и медицине, остальное – в промышленности. Существует два метода производства средства: химический, хлорирование водного раствора натрия гидроксида (концентрированный и основной) и электролитический, используют электролизные установки для электролиза водного хлорида натрия.
Химическое соединение активно применяется в промышленности:
- в качестве отбеливателя ткани, древесины и других продуктов;
- при промышленной и санитарно-гигиенической обработке зерна, трубопроводов, резервуаров в виноделии и пивоварении и т. д.;
- в химическом производстве антраниловой кислоты, хлорпикрина, аскорбиновой кислоты, крахмала, а аналитической химии при фотометрии;
- для обеззараживания и очистки промышленных стоков и воды в системах коммунального водоснабжения;
- в пищевой промышленности и фармацевтике;
- в военном деле при дегазации отравляющих веществ.
Вещество используют в бытовой химии, его часто можно обнаружить в составе отбеливателей, средств для дезинфекции и очистки. В медицине используют наружно или местно в качестве противовирусного, бактерицидного и противогрибкового средства; в небольших концентрациях — для обработки операционных ран, в гинекологии и акушерстве, оториноларингологии, в стоматологии (эндодонтия).
Химическое соединение может оказывать вредное воздействие на организм человека, при вдыхании оказывать удушающий и раздражающий эффект. При попадании средства в глаза вещество вызывает химический ожог, может привести к потере зрения. Средство раздражает кожу, в больших концентрациях вызывает отмирание тканей, язвы и ожоги. После приема внутрь 3-6% раствора у человека развивается ацидоз, раздражение пищевода, более высокие концентрации могут вызвать перфорацию пищеварительного тракта. Несмотря на это, при соблюдении рекомендации по использованию препаратов, воды и бытовой химии, гипохлорит считается достаточно безопасным средством. Не обладает канцерогенными, мутагенными и тератогенными средствами. Токсическая доза при внутривенном введения для человека составляет 45 мг на кг веса; пероральная – 1 грамм на кг. Также считается, что вещество не создает экологических проблем, так как в окружающей среде быстро разлагается до воды, кислорода и поваренной соли. Класс опасности для концентрированных растворов (до 20%): 1 – по химической активности; 3 – опасность для здоровья человека. Не территории Российской Федерации гипохлорит Na выпускают по ГОСТу 11086-76.
Введение
Гипохлоритами называют соли хлорноватистой кислоты HClO. Наиболее распространенными из них являются гипохлорит натрия, гипохлорит кальция и гипохлорит калия. Гипохлориты широко применяются для обеззараживания питьевой воды, отбеливания, дегазации и дезинфекции. Гипохлориты являются одними из самых важных химических соединений.
Таблица 1. Наиболее распространенные гипохлориты.
| Систематическое наименование | Традиционное название | Хим. формула | CAS № | М, г/моль |
| Гипохлорит натрия | Хлорноватистокислый натрий, лабарракова вода (гипохлорит натрия в смеси с хлоридом натрия и гидроксидом натрия) | NaClO | 7681–52–9 | 74,44 |
| Гипохлорит калия | Хлорноватистокислый калий, жавелевая вода (гипохлорит калия в смеси с гидрокарбонатом калия и хлоридом калия) | KClO | 7778–66–7 | 90,55 |
| Гипохлорит кальция | Хлорноватистокислый кальций, хлорная известь (гипохлорит кальция в смеси с хлоридом кальция, оксихлоридом кальция и гидроксидом кальция) | Ca(ClO)2 | 7778–54–3 | 142,98 |
Фармакодинамика и фармакокинетика
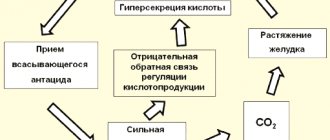
Натрия Гипохлорит – одно из сильнейших антибактериальных средств. Гипохлорит-ион проявляет высокую активность по отношению к множеству известных микроорганизмов, причем действует в достаточно низких концентрациях. Наивысшая активность проявляется при нейтральном рН. Образующиеся при разложении вещества частицы окисляют биополимеры в структуре вредоносных агентов, разрушают молекулы практически всех орг. субстратов. Средство проявляет активность по отношению к грамотрицательным бактериям, кишечной палочке, серрации, синегнойной палочке, грамположительным бактериям, патогенным грибам, простейшим, вирусам. Однако лекарство не действует на возбудители криптоспоридиоза и лямблиоза. Средство не обладает тератогенными, канцерогенными и мутагенными свойствами.
Методы анализа
Качественными реакциями на гипохлорит-ион могут служить:
- окисление йодид-иона до йода в сильнокислой среде;
- выпадение коричневого осадка метагидроксида таллия(III) (TlO(OH)) при действии щелочного раствора соли таллия (I);
- цветная реакция с 4,4´-тетраметилдиаминодефенилметаном или N,N´-диокситрифенил метаном в присутствии бромата калия.
Наиболее распространенным методом количественного анализа гипохлорит-иона является титриметрический метод с использованием йодида калия. Для проведения испытания водный раствор или водную суспензию, содержащие гипохлорит-ион, смешивают с избытком раствора йодида калия в сернокислой среде. Выдерживают герметично закрытую смесь в течение 5 минут в темном месте. Выделившийся йод титруют стандартизированным раствором тиосульфата натрия. В качестве индикатора вблизи точки эквивалентности используют крахмальный раствор.
При количественном определении гипохлорит-иона косвенным йодометрическим методом результаты анализа пересчитывают на кон в ыделившегося при реакции
2H+ + ClO– + Cl– = Cl2↑ + H2O.
Альтернативным методом количественного определения гипохлорит-иона является потенциометрический анализ с использованием бром-ионселективного электрода. Концентрацию гипохлорит-иона находят методом добавок анализируемого раствора к стандартному раствору или методом уменьшения концентрации анализируемого раствора при его добавлении к стандартному раствору.
Показания к применению
Применяют наружно и вводят внутрь полости в концентрации 0,06%:
- для профилактики при операциях на грудной клетке, плевральной и брюшной полости;
- при ранениях, распространенном перитоните, абсцессе, остеомиелите;
- при проведении перитонеального диализа на брюшной полости;
- пациентам с эмпинемой плевры (туберкулез, гной в плевральной полости);
- при обработке влагалища перед операцией и после операции, при кольпите, бартолините, трихомониазе, эндометриозе, хламидиозе, аднексите, лапароскопии, гистероскопии, чревосечении;
- в качестве профилактического средства и для лечения гнойно-септических осложнений после кесарева сечения;
- после операций на мочевых путях и почках, после простатэктомии;
- при гнойном отите, фарингите, насморке;
- для лечения микозов и дифтерии;
- при истинной экземе и экземе микробной этиологии;
- пациентам со стафилодермией, стрептодермией, простым герпесом и угревой сыпью.
Раствор применяют для инъекционного введения при эндо- и экзотоксикозах, отравлениях, сепсисе, ожогах, заболеваниях печени и почек.
В виде жидкости и гелей вещество используют для дезинфекции оборудования в пищевой промышленности, при обработке поверхностей.
Источники
- Handbook of detergents. Part A: Properties/ Edited by Guy Broze. New York: Marsell Dekker, 1999. 809 p.
- Фурман Л. А. Хлорсодержащие окислительно-отбеливающие и дезинфицирующие вещества. М.: Химия, 1976. 88 с.
- Ушакова В.Н. Мойка и дезинфекция. Пищевая промышленность, торговля, общественное питание. – СПб.: Профессия, 2009. 288 с.
- ГОСТ 1692–85. Известь хлорная. Технические условия.
- ГОСТ 11086–76. Гипохлорит натрия. Технические условия.
- Лидин Р.А. и др. Константы неорганических веществ: справочник / Под ред. проф. Р.А. Лидина. М.: Дрофа, 2000. 480 с.
- Химическая энциклопедия/ Гл. ред. И.Л. Кнунянц. М.: Советская энциклопедия, 1992. Т. 3. 555 с.
- Вредные вещества в промышленности. Справочник для химиков, инженеров и врачей/ Под ред. проф. Н.В. Лазарева и проф. И.Д. Гадаскиной. Л.: Химия, 1977. Т. 3. 608 с.
- https://ru.wikipedia.org/wiki/Гипохлорит_натрия
Препараты, в которых содержится (Аналоги)
Совпадения по коду АТХ 4-го уровня:
Нафталанская нефть
Супорон
Нафтадерм
Винилин
Перекись водорода
Марганцовка
Йодоформ
Пантоцид
Бриллиантовый зеленый
Эктерицид
Салицилово-цинковая паста
Элекасол
Салицилово-Цинковая мазь
Формалин
Формагель
Асептолин
Ксероформ
Витаон
Олазоль
Формидрон
Средство является активным действующим компонентом препаратов Амукин, Унисепт. Его добавляют в состав дезинфицирующих растворов.
Производство гипохлорита натрия
Мировые показатели объемов производства препарата приближаются к нескольким миллионам тонн. Потребности человечества в антисептике постоянно растут вместе с ростом населения, потребления искусственно подготовленной воды и общим развитием цивилизации на планете.
В промышленности используют такие методы получения:
- Основной процесс. Это химический путь получения ГПХН, который не отличается от реакции, открытой Антуаном Лабарраком в 1820 году и заключается в обработке едкого натра обычным хлором.
- Низкосолевой процесс. Здесь также происходит обработка гидроксида натрия хлором, только она протекает за две стадии, что позволяет получать концентрированные до 40% растворы, которые отличаются чистотой.
- Электролиз. Этот способ представляет собой знакомое всем разложение раствора с помощью тока. В качестве исходного вещества используют морскую воду или раствор поваренной соли.
Наиболее эффективным способом получения товарного ГПХН является низкосолевой процесс. В России так производит гипохлорит натрия фирма GOODHIM.
Спектральная активность дезинфицирующих средств
| № | Химическая группа, препарат | К1 | К2 | ||||||
| Кишечные | Капельные | Респира- | Энтеро- | Дермато- | Спорообра- | ||||
| инфекции | инфекции | торные | вирусные | микозы | зующие | ||||
| бакт. | бакт. | вирусные | инфекции | возбудители | |||||
| этиологии | этиологии | инфекции | |||||||
| 1. | ХЛОР АКТИВНЫЕ СОЕДИНЕНИЯ | ||||||||
| 1. | Хлорная известь | 0,2-1,0 | 0,2-10,0 | 0,5 | 1,0-3,0 | 10 | 10,0-20,0 | 10 / 0,2 = 50 | 20 / 0,2 = 100 |
| 2. | Нейтральный гипохлорит | 0,5-0,6 | 0,15-0,5 | 0,15-0,3 | 0,6-0,9 | 0,3 | 1,0-7,5 | 0,9 / 0,15 = 6 | 7,5 / 0,15 = 50 |
| кальция | |||||||||
| 3. | Гипохлорит кальция | 0,1-7,0 | 0,1-7,0 | 0,5 | 1,0-7,0 | 1,5 | 3,5-8,0 | 7,0 / 0,1 = 70 | 8,0 / 0,1 = 804. |
| технический | |||||||||
| Гипохлорит натрия, | 0,125-0,25 | 0,125-0,5 | 0,125-0,25 | 0,5 | 0,3-0,5 | не активен | 0,5 / 0,125 = 4 | —— | |
| получаемый | |||||||||
| электрическим | |||||||||
| 5. | Хлорамин | 0,05-3,0 | 0,005-5,0 | 0,5 | 1,0-3,0 | 5 | не активен | 5 / 0,05 = 100 | —— |
| 6. | Na (K) соль | 0,1-0,2 | 0,1-0,5 | 0,1 | 0,1-0,3 | 0,5 | 2-5,0 | 0,5 / 0,1 = 5 | 5 / 0,1 = 50 |
| дихлоризоциану- | |||||||||
| ровой кислоты | |||||||||
| 7. | Хлорцин | 0,5-2,0 | 0,5-2,0 | 1 | 2,0-5,0 | 2,0-5,0 | 7,5 | 5 / 0,5 = 10 | 7,5 / 0,5 = 15 |
| 8. | Препарат ДП-2 | 0,1-0,2 | 0,1-1,0 | 0,5 | 0,1-0,5 | 0,3-0,5 | 3,0-7,5 | 1 / 0,1 = 10 | 7,5 / 0,1 = 75 |
| 9. | Сульфохлорантин | 0,1-0,2 | 0,1-2,5 | 0,1 | 0,1-0,2 | 1 | не активен | 2,5 / 0,1 = 25 | —— |
| 2. | ПЕРЕКИСНЫЕ СОЕДИНЕНИЯ | ||||||||
| 10. | Пергидроль (Перекись водорода) | 3 | 3 | 2 | 3,0-4,0 | 2,0-4,0 | 3,0-6,0 | 4,0 / 2,0 = 2 | 6,0 / 2,0 =3 |
| 11. | Дезоксон (надуксусная кислота) | 1,0-2,0 | 1,0-2,0 | 2 | 1,0-2,0 | 1,0-2,0 | 20 | 2,0 / 1,0 = 2 | 20,0 / 1,0 = 20 |
| 12. | Грилен (Н2О + ЧАС) | 0,25-2,5 | 0,25-2,5 | 1,0-2,0 | 2,0-3,0 | 1 | 3,0-6,0 | 3,0 / 0,25 = 12 | 6,0 / 0,25 = 24 |
| 3. | ПОВЕРХНОСТНО-АКТИВНЫЕ ВЕЩЕСТВА | ||||||||
| 13. | Амфолан | 0,5-2,0 | 0,5-2,0 | не активен | 2,0 / 0,5 = 4 | —— | |||
| 14. | Ниртан | 1,5-3,0 | 1,5-3,0 | не активен | 3,0 / 1,5 = 2 | —— | |||
| 4. | ПРОЧИЕ | ||||||||
| 15. | Гибитан | 0,5 | 0,5 | не активен | 0,5 / 0,5 = 1 | —— | |||
| 16. | Полисепт | 1 | 1 | не активен | 1,0 / 1,0 = 1 | —— | |||