Streptococcus pneumoniae (пневмококк)
Пневмококк
(лат.
Streptococcus pneumoniae
) — вид грамположительных факультативно анаэробных α-гемолитических бактерий. Клетки
Streptococcus pneumoniae
, как и других стрептококков, имеют сферическую форму. Чаще всего располагаются парами, но в жидких средах образует цепочки.
Streptococcus pneumoniae
является наиболее частым (в 20–60%) возбудителем опасного заболевания — внебольничной пневмонии, смертной от которой составляет 5%. Кроме того,
Streptococcus pneumoniae
может вызывать такие заболевания человека, как средний отит, острый негнойный синусит, ринит, ларингит, бронхит, менингит, сепсис, остеомилит, септический артрит, эндокардит, перитонит и другие.
Streptococcus pneumoniae
является вторым (после
Haemophilus influenzae
) по распространённости и важности пневмотропным микроорганизмом в микробном спектре при хронических бронхолегочных заболеваниях у детей в периоде обострения.
Пневмония
Пневмония является одной из форм острой респираторной инфекции, воздействующей на легкие. При пневмонии альвеолы лёгких заполняются гноем и жидкостью, что делает дыхание болезненным и ограничивает поступление кислорода.
Пневмония является важнейшей отдельно взятой инфекционной причиной смертности детей во всем мире. В 2013 году от пневмонии умерли 935 тысяч детей в возрасте до 5 лет. Она является причиной 15% всех случаев смерти детей в возрасте до 5 лет во всем мире.
Существует несколько путей распространения пневмонии. Бактерии, которые обычно присутствуют в носе или горле ребенка, могут инфицировать легкие при их вдыхании. Они могут также распространяться воздушно-капельным путем при кашле или чихании. Кроме того, пневмония может передаваться через кровь, особенно во время родов или сразу после них.
У детей в возрасте до 5 лет с симптомами кашля и/или затрудненного дыхания, сопровождающимися или не сопровождающимися высокой температурой, диагноз пневмонии ставится при наличии учащенного дыхания или втяжения нижней части грудной клетки, если грудная клетка втягивается или отводится назад при вдохе (у здорового человека при вдохе грудная клетки расширяется).
Пневмонию, вызванную бактериями, можно излечить антибиотиками. Предпочтительным антибиотиком является амоксициллин в диспергируемых таблетках (ВОЗ. Инф. бюлл. №131).
Ухудшение эпидемиологической ситуации в Москве по внебольничным пневмониям пневмококковой этиологии в 2016 г.
В Постановлении Главного государственного санитарного врача по городу Москве от 29.7.2016 г. № 8 отмечается:
- за 6 месяцев 2016 года по сравнению с аналогичным периодом отмечен рост заболеваемости внебольничными пневмониями на 27 %, в том числе пневмококковой этиологии — в 1,9 раза
- показатели смертности москвичей от внебольничной пневмонии возросли в 1,5 раза, летальности — в 2 раза
- наибольшее количество заболевших приходится на москвичей старше 40 лет, страдающих хроническими заболеваниями
- растёт удельный вес госпитализированных из числа заболевших внебольничной пневмонией:
- в 2014 году — 70,9%
- в 2015 году — 75,8%
- за 6 месяцев 2016 года — 77,0%
- 20-25% имеют хроническую обструктивную болезнь лёгких
- до 15,8% имеют ишемическую болезнь сердца
- 14,3% — хроническую сердечно-сосудистую недостаточность
- 9,6% — сахарный диабет
Streptococcus pneumoniae в систематике бактерий
По современным представлениям вид Streptococcus pneumoniae
относится к роду стрептококков, (
Streptococcus
), который входит в семейство
Streptococcaceae
, порядок
Lactobacillales
, класс
Bacilli
, тип
Firmicutes
, <�группу без ранга>
Terrabacteria group
, царство Бактерии.
Антибиотики, активные в отношении Streptococcus pneumoniae. Вакцины
Следующие антимикробные средства (из представленных в данном справочнике) активны в отношении Streptococcus pneumoniae
: азитромицин, кларитромицин, левофлоксацин, офлаксацин, джозамицин, доксициклин, ванкомицин, амоксициллин, моксифлоксацин, рокситромицин.
К ципрофлоксацину Streptococcus pneumoniae
чувствителен умеренно.
Для профилактики пневмококковых инфекций применяются полисахаридные конъюгированные адсорбированная вакцины «Превенар» и «Превенар 13» фирмы Pfizer H.C.P. Corporation (США). В России производство 13-валентной вакцины «Превенар 13» локализовано . В 2016 году в России зарегистрирована пневмококковая полисахаридная вакцина Пневмовакс 23 производства Merck & Co. для активной иммунизации против пневмококковой инфекции у взрослых и детей старше 2 лет, пациентов с хроническими заболеваниями или сниженным иммунитетом, содержащая смесь высокоочищенных капсульных полисахаридов из 23 наиболее распространенных и инвазивных серотипов Streptococcus pneumoniae:
1, 2, 3, 4, 5, 6B, 7F, 8, 9N, 9V,10A, 11A, 12F, 14, 15B, 17F, 18C, 19F, 19A, 20, 22F, 23F, 33F.
Streptococcus pneumoniae в МКБ-10
Streptococcus pneumoniae
упоминается в «Классе I. Некоторые инфекционные и паразитарные болезни (A00-B99)» Международной классификации болезней МКБ-10, в блоках:
- «A30-A49 Другие бактериальные болезни», в рубрике «A40.3 Септицемия, вызванная Streptococcus pneumoniae
. Пневмококковая септицемия» - «B95-B98 Бактериальные, вирусные и другие инфекционные агенты» и имеет код рубрики «B95.3 Streptococcus pneumoniae
как причина болезней, классифицированных в других рубриках». Данный код предназначен для использования в качестве дополнительного, когда целесообразно идентифицировать инфекционных агентов болезней, классифицированных в других рубриках.
а также в «Классе X. Болезни органов дыхания (J00-J99)»:
- в блоке «J10-J18 Грипп и пневмония», «J13 Пневмония, вызванная Streptococcus pneumoniae
. Бронхопневмония, вызванная
S. pneumoniae
»
На сайте GastroScan.ru в разделе «Литература» имеются подразделы «Микрофлора, микробиоценоз, дисбиоз (дисбактериоз)» и «Бронхолёгочные заболевания, ассоциированные с заболеваниями ЖКТ», содержащий публикации для профессионалов здравоохранения.
В видео «Семиотика кашля у детей», ориентированном на педиатров, профессор Д.Ю. Овсянников затрагивает проблемы, связанные с бактериальным бронхитом у детей, ассоциированным, в частности, с S. pneumoniae
.
Назад в раздел
Механизмы резистентности S. pneumoniae и стратегии применения антибиотиков
Streptococcus pneumoniae — основной возбудитель внебольничной пневмонии, менингита, сепсиса, бактериемии и среднего отита. Пенициллин, вошедший в клиническую практику в начале 1940-х годов, при пневмококковых инфекциях показал крайне высокую клиническую эффективность, однако уже в 1967 году появились первые подтвержденные сообщения о выделении устойчивых к нему изолятов. Еще через 10 лет вспышка пневмококковой инфекции в Южной Африке подтвердила существование множественной резистентности этого возбудителя к пенициллину, тетрациклину, эритромицину, левомицетину, клиндамицину и рифампицину. Исследования показали, что устойчивые к антибиотикам изоляты S. pneumoniae выделяются и у пациентов, ранее не получавших антибактериальную терапию. Распространение антибиотикорезистентности, связанное с чрезмерным и порой неоправданным использованием антибиотиков, стало серьезной проблемой медицины.
Американские фармакологи и инфекционисты опубликовали обзор, посвященный механизмам устойчивости пневмококка к антибактериальным препаратам разных фармакологических групп. От этих механизмов зависит, как быстро наличие генетических маркеров антибиотикорезистентности у бактерий становится клинически значимым, насколько легко они распространяются в популяции, можем ли мы преодолеть резистентность изменением режима применения тех же самых антибиотиков. В конечном счете выбор препарата «первой линии» для эмпирической терапии определяется не только текущим уровнем чувствительности S. pneumoniae, но и влиянием такого выбора на дальнейшую эволюцию антибиотикорезистентности.
Для лечения пневмококковых инфекций чаще всего применяются препараты группы бета-лактамов. Определение понятия чувствительности к ним S. pneumoniae, которое регулярно пересматривается Институтом клинических и лабораторных стандартов США (CLSI), с течением времени претерпело серьезные изменения. Так, в 2002 году были введены раздельные критерии чувствительности изолятов, выделенных при пневмококковом менингите и «неменингеальных» инфекциях, к парентеральным цефалоспоринам 3 и 4-го поколений. В 2008 году аналогичным образом были установлены более лояльные критерии чувствительности к пенициллину для «неменингеальных» изолятов S. pneumoniae, так как накопились сообщения о высокой эффективности пенициллина при пневмонии, вызванной пневмококками, которые по прежним критериям относились к нечувствительным. Дополнительно CLSI определил критерии чувствительности для разных путей введения пенициллина: парентерального и перорального. Эти изменения были связаны с тем, что абсорбция антибиотика и его проникновение в очаг инфекции в значительной степени определяют клинический эффект. Новые подходы к оценке чувствительности привели к снижению распространенности пенициллин-резистентных штаммов S. pneumoniae. Следует отметить и то, что страны Европы в последние годы переходят на критерии определения чувствительности EUCAST (Европейского комитета по определению чувствительности к антимикробным препаратам), которые несколько отличаются от критериев CLSI. Поэтому, сравнивая данные о пенициллин-резистентности пневмококков в разные годы и в разных странах, необходимо учитывать, какие именно критерии использовались авторами каждой публикации.
Устойчивость S. pneumoniae к пенициллину и другим бета-лактамам развивается вследствие мутации, приводящей к структурным изменениям пенициллин-связывающего белка (ПСБ). К семейству ПСБ относятся ферменты, отвечающие за синтез пептидогликанов бактериальной клетки. При их блокировании пенициллином нарушается целостность клеточной стенки, что ведет к лизису клетки и ее гибели. У S. pneumoniae описаны 6 видов ПСБ; три из них имеют наибольшее значение для развития резистентности: ПСБ1а, ПСБ2х и ПСБ2b, при этом мутация гена ПСБ1а приводит лишь к снижению чувствительности к пенициллину.
Чувствительность бактерий к антибиотикам in vitro оценивается по значению минимальной подавляющей концентрации (МПК) — это та концентрация препарата, которая приводит к видимому подавлению роста возбудителя в тестовой среде. Так как у пневмококка присутствует несколько видов ПСБ, единичной мутации еще недостаточно для формирования высокого уровня резистентности к пенициллину. Накопление мутаций приводит к постепенному и ступенчатому нарастанию МПК, и для развития клинически значимой резистентности к пенициллинам необходимо сочетание нескольких мутаций. Такой механизм в значительной степени может преодолеваться увеличением дозы препарата или изменением режима его применения. Сниженная чувствительность или резистентность S. pneumoniae к пенициллину распространяется и на другие бета-лактамные антибиотики. В меньшей степени нарушается связывание парентеральных цефалоспоринов 4 и 5-го поколений и карбапенемов.
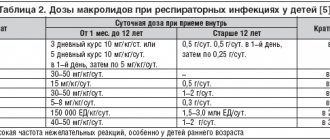
Группу макролидов объединяет наличие в структуре молекулы лактонового кольца, которое может состоять из 12–16 атомов. Механизм действия этих антибиотиков связан с блокированием рибосомальной РНК бактерий и подавлением РНК-зависимого синтеза белка. Уровень устойчивости S. pneumoniae к макролидам в США в настоящее время варьирует от 20 до 40 %. Формирование нечувствительности к этой группе антибиотиков может быть связано с двумя независимыми механизмами:
Первый механизм связан с эффлюксом — способностью микроорганизма активно выводить антибиотик из клетки. Этот механизм кодируется геном mef(A) бактерий и реализуется за счет работы внутриклеточного насоса — эффлюксной помпы. Он характерен для 14- и 15-членных макролидов; 16-членные макролиды эффлюксу не подвержены. В прежние годы эффлюкс приводил к небольшому увеличению МПК и низкому уровню резистентности пневмококка к макролидам. Создание высоких концентраций препарата в очаге инфекции иногда помогало преодолеть работу эффлюксной помпы. Однако в последние годы МПК для изолятов S. pneumoniae, обладающих механизмом эффлюкса, увеличились еще в 2–4 раза, и это практически лишило макролиды способности действовать в очаге инфекции, вызванной устойчивыми к ним возбудителями.
Второй механизм, связанный с наличием гена erm(B), состоит в модификации области связывания антибиотика с его мишенью — 23S РНК, компонентом 50S субъединицы бактериальных рибосом. Приобретение бактерией этого гена сразу приводит к развитию высокого уровня устойчивости к 14-, 15- и 16-членным макролидам, линкозамидам и стрептограмину В (MSLB-фенотип). MSLB-фенотип резистентности пневмококка превалирует во всем мире, хотя в отдельных регионах, в частности, в США, преобладает вариант, связанный с геном mef(A). Также описаны изоляты, имеющие сразу оба механизма резистентности. Их доля в последние годы нарастает, и при этом они обычно устойчивы к целому ряду антибиотиков.
Единственный препарат из этой группы, который в настоящее время используется в клинической практике — это клиндамицин. Механизм его действия обусловлен связыванием с 50S субъединицей рибосом микробной клетки и, таким образом, ингибированием синтеза белка. В результате невозможности формирования пептидных связей нарушается строение клеточной стенки, что приводит к уменьшению адгезии S. pneumoniae к клеткам хозяина и увеличению фагоцитарной активности в отношении самой бактерии. Клиндамицин относится к бактериостатическим препаратам, но в отношении некоторых штаммов S. pneumoniae действует бактерицидно. Из-за высокой активности против стрептококков и стафилококков клиндамицин используется для лечения вторичных внебольничных инфекций, развивающихся на фоне инфекции S. pneumoniae, и в качестве альтернативного препарата при наличии устойчивости к бета-лактамным антибиотикам.
Хотя линкозамиды и макролиды имеют разную химическую структуру, для них характерен один и тот же механизм резистентности пневмококка, связанный с геном erm B. Данные исследования SENTRY, проведенного в 2008 году, показывают, что лишь 80 % штаммов S. pneumoniae в США чувствительны к клиндамицину. В 2011 году этот показатель оказался еще ниже — 78 %. Для клиндамицина характерен феномен индуцибельной резистентности, развивающейся в ходе терапии, поэтому его не следует использовать для эмпирической терапии тяжелых пневмококковых инфекций при отсутствии данных диско-диффузионного теста на подавление чувствительности бактерий к клиндамицину в присутствии макролида.
На момент открытия фторхинолонов повсеместно наблюдалась высокая чувствительность S. pneumoniae к этим антибиотикам. Тем не менее, ципрофлоксацин сегодня не рассматривается в качестве противопневмококкового препарата, так как его фармакокинетические параметры в терапевтических дозах не препятствуют селекции резистентных изолятов. В 2007 году Американское общество инфекционных болезней (IDSA) и Американское торакальное общество (ATS) исключили ципрофлоксацин и другие ранние фторхинолоны из перечня препаратов для лечения инфекций, вызванных S. pneumoniae. Фторхинолоны последнего поколения обладают высокой противопневмококковой активностью, доступны как в парентеральной, так и в пероральной форме и играют важную роль в лечении пневмококковых инфекций, устойчивых к другим антибиотикам.
Фторхинолоны непосредственно подавляют синтез ДНК бактерий. Для репликации ДНК микроорганизма необходимо наличие двух ферментов — ДНК-гиразы и топоизомеразы, которые блокируются хинолоновым кольцом этой группы антибиотиков. У отдельных фторхинолонов отмечается разное сродство к ферментам, участвующим в репликации, при этом большинство препаратов имеют большее или меньшее сродство к обоим из них. Первое и второе поколения фторхинолонов действуют преимущественно на топоизомеразу II, а последующие поколения — на топоизомеразу IV, что увеличивает их активность в отношении грамположительных бактерий, включая S. pneumoniae.
Описаны 3 механизма формирования резистентности пневмококков к действию фторхинолонов.
Первый из них связан с накоплением мутаций генов топоизомеразы (parC и parE) и ДНК-гиразы (gyrA и gyrB), приводящих к структурным изменениям активных сайтов ферментов. Для развития высокого уровня устойчивости к фторхинолонам 3–4-го поколений необходимо сочетание двух мутаций: gyrA и parC. Мутации генов gyrB и parЕ встречаются редко, и их клиническое значение неясно.
Второй механизм связан с действием эффлюксной помпы, которая удаляет антибиотик из бактериальной клетки. Способность бактерий к активному выведению антибиотика для разных фторхинолонов неодинакова — так, левофлоксацин подвержен эффлюксу в значительно меньшей степени, чем ципрофлоксацин.
Третий механизм — плазмидная резистентность, связанная с продукцией плазмидами белков, защищающих мишени действия фторхинолонов. Такой механизм распространен в США, Европе и Восточной Азии. Обычно он приводит к низкому уровню резистентности, но может вносить вклад и в развитие резистентности высокого уровня за счет кумулятивного действия при сочетании с другими механизмами.
Результаты исследования SENTRY (2008) показали, что в Северной Америке 99,4 % штаммов S. pneumoniae были чувствительны к «новым» фторхинолонам. Однако отмечаются и отдельные очаги более высокой резистентности — так, в Италии в период с 2001 по 2004 год устойчивыми к левофлоксацину были 5,6 % штаммов S. pneumoniae. Поэтому, несмотря на благополучную ситуацию в настоящий момент, при назначении и использовании фторхинолонов последних поколений должна сохраняться бдительность и осторожность, чтобы сохранить их как «препараты резерва».
Доксициклин, препарат из группы тетрациклинов, был введен в практику как недорогой препарат для эмпирической терапии внебольничной пневмонии в 1940-х годах. К 2002 году 16,6 % пенициллин-резистентных S. pneumoniae были устойчивы к тетрациклину. В последние десятилетия количество устойчивых к тетрациклину штаммов пневмококка повсеместно нарастает.
Самый важный механизм формирования устойчивости S. pneumoniae к действию тетрациклинов — защита рибосом, позволяющая бактерии синтезировать белок даже при связывании антибиотика с рибосомальной мишенью. Механизм такой защиты точно не известен, но в нем участвуют белки, кодируемые генами tet(O) и tet(M). Имеются сообщения о том, что доксициклин более активен, чем тетрациклин, в отношении штаммов пневмококка, несущих ген tet(M). Этот антибиотик может применяться для лечения пневмококковых инфекций, но для этого должна быть подтверждена высокая чувствительность к нему S. pneumoniae в данном регионе. Необходимо учитывать, что доксициклин относится к антибиотикам широкого спектра действия, поэтому применение его при пневмококковых инфекциях должно быть ограничено во избежание роста резистентности других бактерий.
Комбинация триметоприма и сульфаметоксазола известна с 1968 года. Целесообразность создания такой комбинации была связана с синергичным воздействием этих двух препаратов на метаболизм фолиевой кислоты бактерии. Сульфаметоксазол блокирует фермент дигидроптероат-синтетазу, а триметоприм — дигидрофолат-редуктазу, которые участвуют в образовании нуклеиновых кислот. Таким образом, ко-тримоксазол препятствует размножению бактерий, т. е. обладает бактериостатическим действием.
Первоначально комбинация использовалась для лечения инфекций мочевыводящих путей, однако в дальнейшем показания для ее применения расширились и стали включать острый синусит, острый средний отит и обострение хронического бронхита. В силу низкой цены ко-тримоксазол был включен ВОЗ в перечень жизненно важных препаратов. Уже в 1980-х годах были описаны первые случаи устойчивости S. pneumoniae к триметоприму/сульфаметоксазолу. В дальнейшем ее быстрый рост был связан с очень частым назначением этих препаратов для лечения острого среднего отита у детей и профилактики СПИДа у взрослых — показание, в то время считавшееся оправданным. Триметоприм и сульфаметоксазол — препараты разных фармакологических групп, к ним существуют разные механизмы бактериальной резистентности, однако, поскольку они применяются в комбинации, то соответствующие генетические маркеры у одного и того же штамма обычно сочетаются. По данным эпидемиологических исследований, 1/3 штаммов S. pneumoniae в США устойчивы к ко-тримоксазолу, и этот показатель в разных регионах варьирует от 25 до 45 %. На данный момент подобная картина характерна как для развитых, так и для развивающихся стран. В силу этого ко-тримоксазол не должен рассматриваться как препарат выбора для лечения инфекций, вызванных S. pneumoniae.
Распространение устойчивости S. pneumoniae к большинству антибиотиков для современной медицины приобрело характер эпидемии. Выбор препарата для эмпирической терапии пневмококковых инфекций должен диктоваться как текущим уровнем антибиотикорезистентности, так и риском ее дальнейшего распространения в популяции. Наряду со строгим контролем использования антибиотиков должны прорабатываться альтернативные стратегии для уменьшения формирования резистентности микроорганизмов, включающие и возможности вакцинации.
Выявление возбудителя стрептококковой инфекции (Streptococcus pneumoniae), в ходе которого с помощью метода полимеразной цепной реакции (ПЦР) определяется генетический материал (ДНК) пневмококка в образце биоматериала.
Синонимы русские
Пневмококк, Вейксельбаума диплококк, Френкеля диплококк.
Синонимы английские
Diplococcus pneumoniae.
Метод исследования
Полимеразная цепная реакция (ПЦР).
Какой биоматериал можно использовать для исследования?
Венозную кровь, мазок из зева (ротоглотки), мазок из носоглотки, мокроту, плевральную жидкость, ликвор.
Как правильно подготовиться к исследованию?
- Рекомендуется употребить большой объем жидкости (чистой негазированной воды) за 8-12 часов до сбора мокроты.
- За 3-4 часа до взятия мазков из ротоглотки (зева) не употреблять пищу, не пить, не чистить зубы, не полоскать рот/горло, не жевать жевательную резинку, не курить. За 3-4 часа до взятия мазков из носа не закапывать капли/спреи и не промывать нос. Взятие мазков оптимально выполнять утром, сразу после ночного сна.
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Streptococcus pneumoniae (пневмококк) – грамположительный диплококк, являющийся основным возбудителем внебольничной пневмонии. Также этот микроорганизм может вызывать менингит и сепсис. Имеются данные о роли пневмококка в развитии и прогрессировании бронхиальной астмы и хронического бронхита.
Наиболее подвержены стрептококковой пневмонии и менингиту люди со сниженным иммунным статусом: дети, пожилые люди, ВИЧ-инфицированные, страдающие алкоголизмом и наркоманией.
Существует несколько лабораторных методов выделения пневмококка: бактериологический (посев мокроты на питательные среды), микроскопия мокроты и выявление генетического материала (ДНК) S. pneumoniae методом полимеразной цепной реакции.
Достаточно часто образец мокроты оказывается неинформативным, а результат его окраски по Граму – ложноотрицательным. Результат бактериологического метода может быть получен только через несколько дней, что затрудняет диагностику и откладывает начало специфической терапии. В отличие от этих методов, ПЦР обладает высокой чувствительностью и специфичностью и позволяет получить точный результат в максимально короткие сроки после доставки образца в лабораторию. ПЦР не требует наличия большого количества жизнеспособных микроорганизмов в образце биоматериала, так как определяется не сам микроорганизм, а его генетический материал. Данное преимущество позволяет устанавливать этиологию заболевания на фоне начатой антибактериальной терапии. Также полностью исключены ложноположительные результаты.
Так как S. pneumoniae – представитель нормальной микрофлоры верхних и нижних отделов дыхательных путей большинства людей, для диагностики пневмококковой пневмонии требуется не только обнаружение этого микроорганизма в мокроте, но и наличие дополнительных клинических и лабораторных признаков инфекционно-воспалительного процесса в органах дыхания. Например, S. pneumoniae, выявленный в мокроте пациента без клинических признаков инфекционного поражения легких, без отклонений в анализе крови и без изменений на рентгенограмме, следует рассматривать как нормального представителя микрофлоры дыхательных путей.
Для чего используется исследование?
- Для диагностики инфекционных (пневмонии, хронического бронхита) и инфекционно-аллергических заболеваний легких.
Когда назначается исследование?
При наличии:
- симптомов типичной внебольничной пневмонии (лихорадка, одышка и боль в грудной клетке, кашель с отхождением мокроты оранжевого цвета («ржавой» мокроты);
- симптомов обострения хронического бронхита (кашель с мокротой на фоне повышения температуры тела, усиления потливости, недомогания).
Что означают результаты?
Референсные значения: отрицательно.
Положительный результат:
- пневмококковая пневмония;
- обострение хронического бронхита.
Отрицательный результат:
- отсутствие пневмококковой инфекции.
Что может влиять на результат?
- Большинство людей является бессимптомными носителями пневмококка в верхних и нижних отделах дыхательных путей, поэтому результат исследования следует интерпретировать с учетом других клинических и лабораторных признаков заболевания.