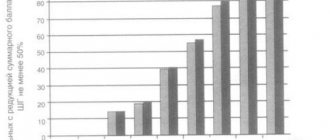
Схемы лечения больных раком молочной железы в комбинации с химиотерапией
1-й день – за 30 мин до химиотерапии ФНО-Т (Рефнот®) в дозе 200 тыс. ЕД однократно п/к + химиотерапия + стандартная антиэметическая терапия. 2-й, 3-й, 4-й, 5-й дни – ФНО-Т (Рефнот®) в дозе 200 тыс. ЕД однократно п/к 1 раз в сутки. Курсовая доза ФНО-Т (Рефнот®) – 1 млн ЕД (2 упаковки). (Эффективность доказана в ходе клинических исследований, проведенных в ФГУ НИИ онкологии им. Н.Н. Петрова под руководством директора института, чл.-корр. РАМН, профессора, д.м.н. В.Ф. Семиглазова).
Рекомендации:
Препарат вводится п/к в наружную поверхность плеча или бедра, места инъекций чередуются. При проявлении гематологической токсичности лечения проводится редукция доз химиопрепаратов для всех последующих циклов согласно утвержденным режимам. Для усиления противоопухолевого и иммуномодулирующего эффектов терапии рекомендовано дополнительное введение ИНФ гамма (Ингарон® производства ООО «НПП “Фармаклон”», Россия).
Схема ИНФ-гамма + ФНО-Т + химиотерапия:
За день до химиотерапии ИНФ-гамма (Ингарон®) в дозе 500 тыс. МЕ однократно в/м или п/к. 1-й день – за 30 мин до химиотерапии ФНО-Т (Рефнот®) в дозе 200 тыс. ЕД однократно п/к + химиотерапия + стандартная антиэметическая терапия. 2-й, 4-й, 6-й, 8-й дни – ИНФ гамма (Ингарон®) в дозе 500 тыс. МЕ однократно в/м или п/к 1 раз в сутки. 3-й, 5-й, 7-й, 9-й дни – ФНО-Т (Рефнот®) в дозе 200 тыс. ЕД однократно п/к 1 раз в сутки. Курсовая доза ФНО-Т (Рефнот®) – 1 млн ЕД (2 упаковки); курсовая доза ИНФ гамма (Ингарон®) – 2,5 млн МЕ (1 упаковка). (Эффективность доказана в ходе клинических исследований, проведенных в ФГУ НИИ онкологии им. Н.Н. Петрова под руководством директора института, чл.-корр. РАМН, профессора, д.м.н. В.Ф. Семиглазова).
Рекомендации:
При п/к введении препаратов места инъекций чередуются. При проявлении гематологической токсичности лечения проводится редукция доз химиопрепаратов для всех последующих циклов согласно утвержденным режимам.
Схемы лечения онкологических больных препаратом РЕФНОТ® в качестве иммуномодулятора
Схема с химиотерапией:
ФНО-Т (Рефнот®) в дозе от 100 тыс. до 400 тыс. ЕД однократно п/к 5 дней в неделю, затем 2 дня перерыв в течение 2-4 недель перед курсом химиотерапии. (Эффективность доказана в ходе клинических исследований, проведенных в отделении комбинированных методов лечения ГУ «Российский онкологический научный центр им. Н.Н. Блохина» РАМН под руководством заместителя директора по науке, чл.-корр. РАН, профессора, д.м.н. М.Р. Личиницера).
Рекомендации:
Препарат вводится п/к в наружную поверхность плеча или бедра, места инъекций чередуются. При тромбоцитопении менее 80х103 /мкл введение ФНО-Т (Рефнот®) следует прекратить до повышения числа тромбоцитов не менее 100х103 /мкл. Лечение проводить до прогрессирования или развития лимитирующих побочных эффектов.
Схема монотерапии:
ФНО-Т (Рефнот®) в дозе от 100 тыс. до 400 тыс. ЕД однократно п/к 5 дней в неделю, затем 2 дня перерыв в течение длительного времени (Эффективность доказана в ходе клинических исследований, проведенных в отделении комбинированных методов лечения ГУ «Российский онкологический научный центр им. Н.Н. Блохина» РАМН под руководством заместителя директора по науке, чл.-корр. РАН, профессора, д.м.н. М.Р. Личиницера).
Рекомендации:
Препарат вводится п/к в наружную поверхность плеча или бедра, места инъекций чередуются. При тромбоцитопении менее 80х103 /мкл введение ФНО-Т (Рефнот®) следует прекратить до повышения числа тромбоцитов не менее 100х103 /мкл. Лечение проводить длительно при отсутствии прогрессирования, либо до развития лимитирующих побочных эффектов.
Тимозин альфа 1 – иммуностимулятор широкого спектра
Тимозин альфа 1 – эффективный иммуностимулятор широкого спектра и его место в современной терапии инфекционных и онкологических заболеваний
Реклама. Биологически активная добавка от “Рашн Пептаид” с пептидами семян фенхеля – Эндохелс. Способствует нормализации работы кишечника и послаблению.
Тимозин α1 (тимозин альфа 1, тимальфазин, Thymosin alpha 1, Tα1) представляет собой пептидный фрагмент, полученный из протимозина альфа, белка, который у человека кодируется геном PTMA. Тимозин α1 был первым из пептидов, содержащихся в 5-ой фракции тимозина, выделенного из тимусной ткани теленка, который удалось полностью секвенировать в 1976 году, а затем и синтезировать. Определяемая концентрация тимозина α1 также обнаруживается в сыворотке крови здоровых людей (~1 нг/мл). В отличие от β-тимозинов, тимозин α1 продуцируется из более длинного предшественника – протимозина α, состоящего из 113 аминокислот, и представляет собой последовательность из 28 аминокислот:
Ac-Ser-Asp-Ala-Ala-Val-Asp-Thr-Ser-Ser-Glu-Ile-Thr-Thr-Lys-Asp-Leu-Lys-Glu-Lys-Lys-Glu-Val-Val-Glu-Glu-Ala-Glu-Asn-OH
N-концевой остаток пептида, серин, ацетилирован. Пептид не гликозилирован, имеет молекулярную массу 3108 Da и характеризуется высокой кислотностью.
Главной особенностью тимозинов является их способность участвовать в регуляции, дифференцировке и функционировании тимус-зависимых лимфоцитов (Т-клеток, Т-лимфоцитов). Тимозин α1 может индуцировать дифференцировку и созревание Т-лимфоцитов, ингибировать апоптоз Т-лимфоцитов и стимулировать иммунную систему к дифференцировке Т-хелперов 1. Тимозин α1 является основным компонентом 5-той фракции тимозина, и считается ответственным за активность этого препарата в восстановлении иммунной функции у животных, лишенных вилочковой железы. Известно, что он усиливает клеточный иммунитет у людей, а также у подопытных животных. Последнее позволяет считать тимозин α1 перспективным препаратом для усиления иммунного ответа при лечении различных заболеваний.
В настоящее время тимозин α1 одобрен в качестве иммуномодулятора более чем в 37 странах мира, включая Россию, для лечения гепатита В и С, а также используется для усиления иммунного ответа в терапии вирусных инфекций, иммунодефицитах, ВИЧ/СПИД и злокачественных новообразований. Наиболее часто применяют тимозин α1 для лечения хронического гепатита В и в качестве адъюванта вакцин. Так, клинические исследования показывают, что он может быть полезен при муковисцидозе, септическом шоке, остром респираторном дистресс-синдроме, перитоните, острой цитомегаловирусной инфекции, туберкулезе, остром респираторном синдроме и легочных инфекциях, при хроническом гепатите B и при состояниях иммунодефицита. Кроме того, изучена возможность использования тимозина α1 в лечении рака, например, гепатоцеллюлярной карциномы, в комбинации с традиционной химиотерапией. Такой подход называют иммунной противораковой терапией и в настоящее время считают одним из наиболее прогрессивных методов лечения.
Механизм действия тимозина α1 в качестве иммуностимулятора все еще не полностью исследован, однако имеющиеся данные позволяют утверждать, что одним из путей активации иммунного ответа является способствование апоптозу регуляторных Т-клеток (Т-супрессоров, Тreg), которые подавляют иммунный ответ. Их ингибирующее действие помогает снизить наносимый воспалением вред. Увеличение процента регуляторных Т-клеток является часть механизма самозащиты от серьезных воспалительных реакций, но, при этом, также может вызвать вторичное иммунное ингибирование. Соответственно, снижение доли регуляторных Т-клеток в популяции Т-лимфоцитов способствует более мощному иммунному ответу. Одной из проблем является поддерживание Т-клеток на должном уровне, сохраняя баланс про- и противовоспалительных реакций.
Введение тимозина α1 стабилизирует колебания процентного содержания регуляторных Т-клеток и концентрации цитокинов. При подавленном иммунитете организма, тимозин α1 может ингибировать высвобождение противовоспалительных цитокинов и стимулировать высвобождение провоспалительных цитокинов. В то же время, тимозин α1 подавляет увеличение концентрации регуляторных Т-клеток, которые является важным фактором, вызывающим иммуносупрессию. В различных исследованиях in vitro было показано, что содержание клеток CD4+, CD8+ и CD3+ увеличивается. Также показано, что тимозин α1 увеличивает выработку IFN-g, IL-2, IL-3 и экспрессию рецептора IL-2 после активации митогенами или антигенами, повышает активность NK-клеток, увеличивает выработку ингибирующего миграцию фактора (MIF) и ответ антител на Т-клеточные антигены. Также обнаружено, что тимозин α1 препятствует индуцированному дексаметазоном апоптозу тимоцитов in vitro. В опытах in vivo введение тимозина α1 животным с иммуносупрессией, вызванной в результате химиотерапии, опухолевой нагрузки или облучения, показало, что пептид защищает от цитотоксического повреждения костного мозга, прогрессирования опухоли и оппортунистических инфекций, тем самым увеличивая время выживания и количество выживших. Многие эффекты тимозина α1 in vitro и in vivo интерпретируются как влияние либо на дифференцировку плюрипотентных стволовых клеток в тимоциты, либо на активацию тимоцитов в Т-клетки. Также показано, что in vitro данный препарат усиливает экспрессию Toll-подобных рецепторов (TLR), включая TLR2 и TLR9, в дендритных клетках мышей и человека, а также активирует каскады реакций NF-kB и JNK/P38/AP1. Активация дендритных клеток обеспечивает еще один возможный путь, объясняющий иммуномодулирующее и противовирусное действие тималфазина.
Кроме того, показано, что тимозин α1 восстанавливает моноцитарную экспрессию лейкоцитарного антигена человека (HLA-DR или mHLA-DR). Ключевым преимуществом использования тимозина α1 в клинике является его признанная биологическая безопасность с высокой переносимостью in vivo без побочных эффектов в широком диапазоне дозировок. О случаях преднамеренной или случайной передозировки у людей не известно. Токсикологические исследования на животных показали отсутствие побочных реакций в однократных дозах до 20 мг/кг и в повторных дозах до 6 мг/кг/сутки в течение 13 недель (высшие изученные дозы). Высшая однократная доза, проверенная на животных, равняется 800-кратной клинической дозе. Отсутствие токсичности наблюдалось во время клинических испытаний у более чем 900 пациентов, которые получали тимозин α1, что резко контрастирует с большинством других модификаторов биологического отклика, таких как α-интерферон (IFN-α) и интерлейкин-2 (IL-2), чьи значительные побочные эффекты и токсичность вызывают проблемы у большинства пациентов. Период полураспада тимозина α1 составляет около 2 часов. У пациентов уже через сутки после введения показатели плазмы крови возвращаются к исходному уровню. Большая часть (до 60 %) тимозина α1 выводится с мочой. При многократном введении кумуляция препарата не обнаружена. Эти данные показывают, что применение тимозина α1 хорошо вписывается в контекст иммуномодулирующей терапии, поскольку он способен поддерживать иммунный гомеостаз без токсичного воздействия.
Только за период с 2002 по 2022 года на различных стадиях завершения находится не менее 23 клинических исследований тимозина α1 с вовлечением нескольких тысяч пациентов; его изучению просвещено около 3 тыс. научных публикаций.
Некоторое представление о широте спектра биоактивности тимозина α1 дает нижеприведенный перечень, в основе которого лежат как экспериментальные данные, так и результаты обсчета потенциальных мишеней данного препарата при различных заболеваниях: рак (колоректальный, легкого, груди, мочевого пузыря, простаты, щитовидной железы, желудка, лейкемия, менингеальное новообразование, аденокарцинома пищевода, лимфома, гепатоцеллюлярная карцинома, нейробластома); аутоиммунные реакции (энцефаломиелит, аутоиммунный / рассеянный склероз, болезнь Крона; язвенный колит, системный склероз, ревматоидный артрит, красная волчанка, миастения Гравис, склеродермия, волчаночный нефрит, вторичный гиперпаратиреоз, диабет), ряд заболеваний легких, старческие заболевания и инфекционные болезни, а также около 45-ти других тяжелых состояний. Помимо этого, есть данные по применению тимозина α1 в случаях тяжелого сепсиса и для профилактики инвазивных инфекций у пациентов с трансплантированным костным мозгом. Для наглядности, важнейшие области применимости тимозина α1 представлены на схеме ниже:
| ТИМОЗИН α1 | |||||||||||||||
| Инфекционные заболевания | Иммунодефицит и старение | Онкологические заболевания | |||||||||||||
| · Гепатит B · Гепатит С · СПИД · ОРВИ · сепсис · острый респираторный дистресс-синдром / ХОБЛ · инфекции после трансплантации костного мозга · тяжелый сепсис и профилактика инвазивных инфекций при трансплантации костного мозга | · старение · аутоиммунные заболевания · иммунодефицит · вакцинный адъювант (усилитель вакцины) · снижение минеральной плотности костей · болезнь Альцгеймера · продление жизни | · меланома · рак легких · гепатоцеллю-лярная карцинома | |||||||||||||
Из множества проведенных исследований по биоактивности тимозина α1, рассмотрим наиболее практически значимые результаты клинических испытаний в соответствии с типами заболеваний. Поскольку к настоящему времени проведено огромное количество исследований, ниже представлены результаты метаанализа.
Инфекционные заболевания.
Хронический гепатит B (CHB) по-прежнему является серьезной клинической проблемой из-за его чрезвычайной распространённости (более 260 млн. человек) и неблагоприятных последствий (цирроз печени, декомпенсация печени и гепатоцеллюлярная карцинома – ГЦК). Основная цель лечения CHB состоит в том, чтобы навсегда подавить репликацию вируса и уменьшить воспаление печени, замедляя или предотвращая декомпенсацию, развитие цирроза и прочие фатальные последствия.
Клинические испытания по оценки безопасности и эффективность тимозина α1 проводились для лечения пациентов с CHB. Тимозин α1 был испытан в качестве препарата для монотерапии или в сочетание с современными доступными лекарственными средствами, в том числе IFN-α и нуклеозидными аналогами. В целом, тимозин α1 приводил к частоте ремиссии заболевания от 26 до 41 % при подкожном введении в течение 6–12 месяцев в дозе 1,6 мг два раза в неделю на выборке из 56 пациентов. По данным метаанализа, включавшего два исследования на двух группах пациентов (353 и 199 человек, причем показатели групп были сопоставимы на исходном уровне), показано значительное увеличение вирусологического ответа после терапии тимозином α1 в конце лечения, через 6 и 12 месяцев после лечения: 0,56, 1,67 и 2,67, соответственно. Сообщается, что через 6 месяцев наблюдения при использовании тимозина α1 наблюдалось значительно большее подавление репликации вируса (OR = 3,71, 95 % Cl: 2,05, 6,71, где OR – отношение шансов, Cl – доверительный интервал относительного риска), и нормализировался уровень аланин-трансаминазы (OR = 3,12, 95 % Cl: 1,74, 5,62) по сравнению с пациентами, получавшими только IFN-α. Сразу после окончания лечения не было различий между двумя группами по вирусологическому или биологическому ответу. Однако пациенты, получавшие тимозин α1, значительно чаще демонстрировали полный ответ через 6 месяцев в конце периода наблюдения (OR = 2,69, 95 % Cl: 1,47, 4,91) по сравнению с получавшими IFN-α. Единственным неблагоприятным явлением, о котором сообщалось при введении тимозина α1, был дискомфорт в месте инъекции. В другом метаанализе, включавшем 583 гепатит B-положительных пациентов (HBeAg), сравнивали эффект монотерапии ламивудином с комбинированной терапией ламивудином плюс тимозин α1. Выявлено статистически значимое превосходство комбинированной терапии в сравнении с монотерапией ламивудином. Также, были проведены другие исследования по сочетанию тимозина α1 со стандартными методами лечения CHB (IFN-α и нуклеозидными аналогами). Во всех случаях тимозин α1 способствовал повышению эффективности стандартных методов лечения без увеличения их токсичности. На основе этих данных, Азиатско-Тихоокеанской ассоциацией по изучению печени тимозин α1 был выбран в качестве варианта терапии CHB.
Хронический гепатит С является глобальной проблемой здравоохранения (распространенность > 185 млн. человек). Как и гепатит В, хронический гепатит С (CHC) вызывает развитие цирроза и ГЦК.
Метаанализ ряда исследований по оценки активности тимозина α1 для лечения CHC в сочетании с IFN-α показал, что тимозин α1 в сочетании с IFN-α более эффективен по сравнению с одним IFN-α. Несмотря на такие многообещающие результаты, добавление тимозина α1 в курс повторного лечения CHC-пациентов (выборка 552 человек), не отвечающих на терапию препаратами pegIFN альфа-2a или 2b плюс рибавирин, не привело к увеличению вирусологического ответа. Однако была выдвинута гипотеза, что тимозин α1 может играть вторичную терапевтическую роль в качестве адъюванта в профилактике рецидивов у пациентов, достигающих вирусологического ответа во время терапии.
Сепсис. Тяжелый сепсис связан с высоким уровнем смертности – около 30 %. В США тяжелый сепсис поражает > 750 тыс. человек ежегодно. Кроме того, из-за появления бактерий, устойчивых к карбапенемам, и недоступности эффективных антибиотиков для лечения этого состояния, существует высокая потребность в новом методе лечения. Основными причинами, которые играют решающую роль в смертельном исходе этого заболевания, считаются иммунологические расстройства и системный воспалительный ответ, а не инфекция как таковая, что является обоснованием для использования иммуномодулирующих агентов, таких как тимозин α1.
Результаты масштабного исследования, проведенного в Китае (361 пациент в состоянии тяжелого сепсиса), показали, что среди пациентов, получавших подкожно тимозин α1 в дозировке 1,6 мг дважды в день в течение 5 дней, и затем ежедневно в течение дополнительных 2 дней, на 28 день после начала лечения смертность составила 26,0 % против 35,0 % в контрольной группе, получавшей 1 мл физиологического раствора подкожно с тем же графиком. Относительный риск смерти в группе получавших тимозин α1 составил 0,74 по сравнению с контрольной группой. В другом крупном клиническом исследовании тимозин α1 применялся в комбинации с ингибитором протеазы (342 пациента с тяжелым сепсисом). Рассматривалась 28-дневная и 90-дневная смертность, и показатели были значительно лучше в группе, получавшей тимозин α1 по сравнению с контролем (25,1 против 38,3 % и 37,1 против 52,1 %, соответственно). Метаанализ эффективности иммуномодулирующей терапии на основе тимозина α1 при тяжелом сепсисе, обобщающий 12 контролируемых клинических испытаний на 1480 пациентах, 751 из которых получали тимозин α1, показал значительно более низкую смертность независимо от ее причин в группе пациентов, получавших тимозин α1 (усреднённый коэффициент риска 0,68).
Хроническая обструктивная болезнь легких. В клинических испытаниях на 108 пожилых ХОБЛ-пациентов стационара показано снижение заболеваемости вторичной инфекцией и сокращение пребывание в стационаре для группы пациентов, получавших лечение тимозином α1. Побочных явлений не наблюдалось. В другом исследовании 80 пациентов с ХОБЛ получали 10 доз тимозина α1 или стандартную терапию. Через 3 и 6 месяцев после лечения количество пациентов с обострением симптомов был значительно ниже в группе, получавшей лечение тимозином α1.
Острая недостаточность дыхательной системы – опасное для жизни состояние со смертность до 40 %. В исследовании на 46 пациентах с трансплантированными почками смертность была значительно ниже в группе, получавшей тимозин α1, чем в контрольной (21,9 против 50 %).
Тимозин α1 как вакцинный адъювант (усилитель вакцины).
В рамках нормального процесса старения происходит постепенное снижение выработки гормонов и функционировании тимуса, что может способствовать снижению иммунитета. Установлено, что тимозин α1 является агонистом TLR9. TLR представляют собой семейство белков, которые опосредуют врожденный иммунитет; стимуляция агонистом одного или нескольких TLR может усилить адаптивный иммунный ответ, что критично для гуморального иммунитета. Тимозин α1 вызывает активацию и стимуляцию сигнальных путей, которые инициируют продуцирование иммуно-связанных цитокинов, а также влияет на Т-клетки, что подробнее описано в части, посвященной механизму действия препарата.
В исследованиях по эффективности вакцинации на фоне введения тимозина α1 объектом сравнения была моновалентная вакцина против гриппа H1N1 с адъювантом MF59. Ответ на высокую дозу тимозина α1 являлся статистически значимым и был замечен раньше, чем при использовании MF59, и поддерживался на 42 день после вакцинации. Переносимость такой комбинации была отличной.
ВИЧ/СПИД. Поскольку иммунные реакции играют важную роль в профилактике заражения ВИЧ-инфекцией человека, считается, что индукция сильного иммунного ответа, особенно ответа Т-киллеров (CTL) против ВИЧ-1 может иметь большое значение для предотвращения возникновения приобретенного синдрома иммунодефицита (СПИД). В исследовании, где применялась комбинация тимозина α1, зидовудина и IFN-α показано, что такая терапия ведет к значительному увеличению числа и активности зрелых Т-клеток CD4+ и снижению титра ВИЧ. Еще одно интересное исследование касалось безопасности и эффективности тимозина α1 в сочетании с высокоактивной антиретровирусной терапией (ВААРТ) для стимуляции восстановления иммунитета. Результаты показали, что тимозин α1 хорошо переносится и может значительно повышать уровень Т-рецепторных эксцизионных колец (sjTREC). Последний является важным критерием иммунологического мониторинга. Длительное терапевтическое применение тимозина α1 при ВИЧ всё ещё находится на стадии исследований.
Онкологические заболевания. Первые клинические исследования были выполнены в конце 90-ых годов на пациентах с меланомой и немелкоклеточным раком легких, и показали положительный эффект при лечении комбинацией тимозина α1 с дакарбазином в сочетании с IL-2 или с IFN-α у пациентов с метастатической меланомой. Исследование на 20 субъектах с неоперабельной метастатической меланомой III или IV стадии, показало хорошую переносимость препарата, увеличенное среднее время выживания и среднее время до прогрессирования, с общим уровнем ответа у 50 % и 15 % пациентов в течение более 3 лет. Исследование также показало, что сочетание тимозина α1 с IFN-α привело к значительной защите от дакарбазин-индуцированного снижения активности NK-клеток и количества Т-клеток CD4+. Этот результат достоверно подтвердился и на выборке из 488 пациентов с метастатической меланомой. Другие экспериментальные исследования показали, что добавление тимозина α1 совместно с IFN-α к химиотерапии цисплатином/этопозидом или ифосфамидом у пациентов с немелкоклеточным раком легких привело к улучшению иммунных параметров и реакции на терапию. Токсичность химиотерапии также значительно снизилась, уменьшился процент субъектов с миелосупрессией III или IV стадии (0 против 50 % в контроле). Использование при гепатоцеллюлярной карциноме (ГЦК) тимозина α1 совместно с транскатетерной артериальной химиоэмболизацией привело к статистически значимому увеличению выживаемости (82 против 41 %) и значительному увеличению иммунного ответа (цитотоксические Т-клетки и NK-клетки) на выборках от 12 до 57 человек. Как показывают многолетние исследования и клиническая практика, тимозин α1, в сочетании со стандартной терапией, влияет на множество типов рака. Воздействие тимозина α1 на ГЦК, немелкоклеточный рак легкого и меланому подтверждает то, что препарат является полезным агентом для лечения этих заболеваний. Также, in vivo и in vitro исследования выявили связь с раком молочной железы, предполагающую потенциальное улучшение ответа в сочетании с химиотерапией. Исследование in vitro на клетках рака груди продемонстрировали способность тимозина α1 индуцировать апоптоз посредством активации митохондриального апоптотического каскада и PTEN (фосфатаза и гомолог тензина), который обеспечивает ингибирование сигнального пути PI3K/Akt/mTOR. Подчеркивается, что лечение тимозином α1 усиливает иммунные реакции в мононуклеарных клетках периферической крови, также препарат может восстанавливать ослабленный опухолью или химио-/радиотерапией иммунный надзор, ускоряя дифференцировку Т-клеток и повышая активность естественных клеток-киллеров, экспрессию антигена класса I главного комплекса гистосовместимости (MHC class I) и ассоциированных с опухолью антигенов на клетках-мишенях. Продемонстрировано, что тимозин α1 усиливает цитотоксичность iNKT-клеток (небольшая популяция T-клеток, экспрессирующих инвариантный рецептор Vα24-Jα18 T-клеток со значительным потенциалом для противоопухолевой терапии) против рака толстой кишки за счет усиления экспрессии CD1d. Тимозин α1 также предложен в качестве эффективного адъюванта для вакцинотерапии дендритных клеток при лечении гематологических злокачественных новообразований, таких как острый лимфобластный лейкоз, благодаря промотированию фенотипического и функционального созревания дендритных клеток, обладающих способностью индуцировать противоопухолевый иммунитет к лейкозным клеткам.
В целом, инновационные открытия в лечении рака обусловлены мощным синергизмом тимозина α1 и химиотерапии, в основе которого лежит двойное действие препарата как на эффекторные клетки, так и на опухолевые клетки.
В настоящее время тимозин α1 выпускается под торговым названием ZADAXIN (thymalfasin) в виде лиофилизата, содержащего 1.6 мг химически синтезированного тимозина α1, идентичного человеческому, 50 мг маннитола и снабжается натриево-фосфатным буфером для доведения раствора до pH 6.8. Препарат предназначен для подкожного введения и предписывается для монотерапии или в комбинации с интерфероном для лечения хронического гепатита B и С, а также в качестве адъюванта при вакцинации против гриппа и гепатита B. Рекомендованная дозировка составляет 1.6 мг (900 µg/m2) дважды в неделю на протяжении от 6 до 12 месяцев. Пациентам с массой тела до 40 кг рекомендована дозировка 40 µg/kg. Побочные эффекты редки редкими и незначительны: дискомфорт в месте инъекции, редкие случаи эритемы, преходящей атрофии мышц, полиартралгии в сочетании с отеком рук и сыпью.
Появление новых лекарств и биологических продуктов часто означает разработку новых вариантов лечения. «Переориентация» уже известных лекарств путем выявления возможности неизвестного ранее применения существующего лекарственного средства на других клеточных мишенях или заболеваниях позволяет уменьшить время, затраты и риск за счет сокращения или устранения нескольких этапов доклинических и клинических испытаний, необходимых для обнаружения и разработки лекарственного средства de novo. В связи с этим, несмотря на свою почти 50-летнюю известность, тимозин α1 все еще является объектом повышенного интереса в качестве потенциального лекарственного препарата с низкой токсичностью для терапии широкого спектра заболеваний.
Thymosin alpha 1 (3 mg)
Тимозины
TB-500 – вездесущий заживляющий пептид
Тимозины и Тимозин альфа 1
Препараты Тимуса: Тимулин, Тималин, Тимоген, Имунофан
https://russianpeptide.com/timozin-beta-4-i-ego-aktin-svyazyivayushhiy-domen-stimulyatsiya-rosta-volos/
Эндохелс. Что это?