Не больной, не здоровый, а просто раздражённый.
СРК — это хроническое функциональное расстройство кишечника. По статистике до 10-15% людей страдает от раздражительности собственного кишечника4.
Как же распознать синдром раздраженного кишечника?
Основной признак СРК — боль в животе (не менее 1 раза в неделю), связанная, как минимум, с двумя из трех симптомов нарушений стула:
— его расстройством: диареей или запором, или их чередованием;
— и/или изменением его частоты;
— и/или изменением его консистенции.
Часто СРК сопровождается вздутием и метеоризмом.
Симптомы СРК хронические — рецидивируют не менее 3-х месяцев с дебютом не ранее полугода.
Какие причины побуждают наш кишечник нервничать?
Стресс. Замечено, что во многих случаях именно он является спусковым крючком СРК: волнения, связанные с личной жизнью, важными событиями, хроническое недосыпание, психологические травмы и многое другое.
Инфекционные заболевания. Одна из причин возникновения СРК — это перенесённые острые кишечные инфекции. В период пандемии COVID-19 создаются предпосылки развития СРК у людей, перенесших данное заболевание3.
Как врачи ставят диагноз СРК?
Главное при подозрении на СРК – исключить другое заболевание, которое может протекать под маской СРК и требовать совсем другого лечения. Поэтому, при появлении описанных симптомов первое, что необходимо сделать – пойти к врачу для обследования с целью исключения других заболеваний. Нужно помнить, что СРК – диагноз исключения и установить его может только врач после назначенного им обследования.
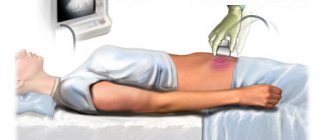
До того, как поставить диагноз СРК, специалист проведет осмотр и обследование. Чаще всего назначаются:
— Анализ крови;
— УЗИ;
— ЭФГДС;
— Колоноскопия;
— Анализ кала.
Диагноз СРК устанавливается только после того, как проведенные исследования не выявят органических заболеваний.
Итак, если это СРК, то что теперь?
Спокойствие, только спокойствие: СРК — штука неприятная, но для жизни совершенно не опасная.
Лечение СРК комплексное:
Диета. Из меню исключаются продукты, провоцирующие обострение, например, капуста, копченая рыба и так далее.
Консультация психолога или психотерапевта. Для того, чтобы научиться управлять тем самым стрессом. И не стоит бояться психологов (это тоже стресс) – они не кусаются, мы проверяли.
Медикаментозное лечение. Лекарственная терапия заключается в устранении назойливых симптомов – боли, спазмов, вздутия, нарушений стула.
Это Спазмолитики.
Французский препарат МЕТЕОСПАЗМИЛ® содержит спазмолитик Алверин и ветрогонное Симетикон, он помогает справиться с поставленными задачами[1]. Алверин снимает спазм, уменьшает повышенную чувствительность ЖКТ к боли и устраняет расстройства стула[2]. Симетикон поглощает пузырьки газа, устраняя тем самым вздутие живота 1.
МЕТЕОСПАЗМИЛ® — единственный зарегистрированный в РФ препарат с подобным составом[3]. Он даже включен в рекомендации гастроэнтерологов при СРК и в пандемию Covid-19[4].
Имеются противопоказания, необходимо проконсультироваться со специалистом.
Пробиотики.
Исследования показывают, что синдром раздраженного кишечника сопровождается дисбактериозом — нарушением баланса нормальной микрофлоры кишечника. Специальный пробиотик ПробиоЛог СРК содержит особую тройную комбинацию штаммов пробиотических бактерий, которая способствует нормализации микрофлоры кишечника при этом состоянии[5].
Штаммы пробиотических бактерий ПробиоЛога СРК подбирались учеными на основании возможностей их прицельного действия. Поэтому ПробиоЛог СРК применяется при данном состоянии для коррекции микрофлоры кишечника, улучшения качества жизни и поддержки нормального пищеварения. Режим приема — по 1 капсуле в день в течение не менее 3-х недель. Оптимальный курс – 6 недель5.
Комбинация штаммов ПробиоЛога СРК включена в рекомендации не только при СРК, но и в период пандемии COVID-19 для коррекции вызванных вирусом изменений микрофлоры в кишечнике и предупреждения дальнейших нарушений у людей, перенесших инфекцию4.
С СРК можно и нужно жить полноценной жизнью! Главное, меньше нервничать и чётко следовать рекомендациям врача.
Синдром раздраженного кишечника у детей: основные причины и подходы к терапии
В развитие заболевания имеют значение личностные и психологические аспекты, генетическая предрасположенность, факторы питания, изменение висцеральной гиперчувствительности, нарушения моторной активности и нейроэндокринной системы (ось «головной мозг — кишечник»), повышение проницаемости кишки, нарушение состава кишечной микробиоты. Качественные и количественные изменения микрофлоры оказывают влияние на функцию кишечника, выступая в качестве причины нарушений его двигательной активности, чувствительности и нейроиммунных взаимоотношений, включая нарушение экспрессии рецепторов слизистой оболочки и изменения функции гипоталамо-гипофизарно-надпочечниковой системы. В педиатрической практике возможности использования медикаментозных препаратов значительно ограничены возрастом пациентов. В терапии предпочтение необходимо отдавать селективным препаратам, влияющим на висцеральную чувствительность и пробиотикам с доказанной эффективностью и безопасностью штаммов.
Сведения об авторах:
Захарова Ирина Николаевна – д.м.н., профессор, заведующая кафедрой педиатрии им. Г.Н. Сперанского ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России;; e-mail: [email protected]
Сугян Нарине Григорьевна – кандидат медицинских наук, доцент кафедры педиатрии педиатрии им. Г.Н. Сперанского ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России;
Бережная Ирина Владимировна — кандидат медицинских наук, доцент кафедры педиатрии педиатрии им. Г.Н. Сперанского ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России.
Ключевые слова: дети, синдром раздраженной кишки, прокинетики, тримебутин, необутин, пробиотики, максилак.
Синдром раздраженного кишечника (СРК) является самым распространенным функциональным заболеванием кишечника у взрослых, представляя значимую социальную проблему с негативным влиянием на качество жизни. В большинстве стран мира частота встречаемости СРК составляет в среднем около 20%, варьируя от 9 до 48%. Мало информации о распространенности СРК у детей, например, в США по данным разных авторов частота составляет от 1,2 до 2,9% [1]. Оценить распространенность СРК в популяции трудно, т. к. статистические данные значимо различаются даже в разных регионах одной страны. Эпидемиологические показатели, обобщенные по данным опросников в разных странах мира, показывают, что чифры колеблются от 10 до 25%. По данным мета-анализа, суммарная распространенность заболевания оказалась около 11,2% (95% ДИ, 9,8–12,8) с различием в регионах земного шара: от самой низкой в Южной Азии (7%) до самой высокой в Южной Америке (21%). Показано, что первые несколько месяцев после установки диагноза «СРК» больные переносят до 4 атак с выраженной болью в животе. В дальнейшем у 30–40% увеличиваются светлые промежутки между обострениями. Примерно у половины пациентов с СРК (45%) развиваются хронические заболевания верхних отделов ЖКТ (диспепсия, хронический гастрит, ГЭРБ и др.) через несколько лет течения СРК.
Функциональные нарушения ЖКТ одна из самых загадочных проблем современной медицины, так как, несмотря на огромный спектр диагностических процедур, до конца понять этиологию и патогенез не представляется возможным. Уже около 30 лет мы используем клинические рекомендации, известные под названием Римские критерии. В 2016 году вышла новая редакция клинических рекомендаций функциональных нарушений ЖКТ – Рим IV, в которые входят разделы функциональных гастроинтестинальных расстройств ФГИР) у взрослых, детей и подростков. Появившаяся доказательная база в течение последних 10 лет обеспечила основу для рекомендаций «Рим IV пересмотра». При некоторых расстройствах органов пищеварения комитет использовал клинический опыт и консенсус членов комитета, все еще не имея достоверных научных данных, для этих разделов. В научной литературе можно встретить разные интерпретации перевода «functional gastrointestinal disorders» — функциональные гастроинтестинальные расстройства (ФГИР), функциональные расстройства органов пищеварения (ФРОП) и другие. ФРОП более полно отражает проблему, так как консенсус охватывает функциональные нарушения верхних и нижних отделов ЖКТ и расстройства билиарного тракта.
В критериях Рима III подчеркивалось, что для установления функциональных нарушений нужно исключить органическое заболевание. В Римских критериях IV пересмотра фраза «нет доказательств в пользу воспалительного, анатомического, метаболического или неопластического процесса, объясняющего симптомы у субъекта» был удален из диагностических критериев [2]. Вместо этого добавлено «после соответствующего медицинского обследования, симптомы не могут быть отнесены к другому заболеванию». Это изменение позволяет выборочное обследование для подтверждения положительного диагноза ФРОП. Также отмечено, что ФРОП могут сосуществовать с другими органическими и хроническими воспалительными заболеваниями [3]. Точно так же у одного пациента могут быть разные ФРОП. В последней версии рекомендаций международного консенсуса Римские критерии-IV (Rome-IV), опубликованной в 2016 г., функциональные кишечные расстройства рассматриваются как спектр кишечных симптомов в 6 категориях, которые определяются как расстройства взаимодействия «кишка — головной мозг» («ЖКТ — ЦНС (центральная нервная система») (disorders of gut-brain interaction) [4].
В новую редакцию Римских критериев IV (2016) включены новые расстройства, это функциональная тошнота и функциональная рвота. Изменена формулировка «боль в животе, связанная с функциональными желудочно-кишечными расстройствами» на «функциональные абдоминальные болевые расстройства». В эту группу внесен новый термин — функциональная абдоминальная боль (иным образом «FAP-NOS») для описания детей абдоминальной болью, диагностические критерии которых недостаточны для включения под определенное расстройство, например, СРК, функциональная диспепсия или абдоминальная мигрень.
Термин «дискомфорт» в новой редакции Римских критериях IV изъят из определения, поскольку сложно проводить грань между дискомфортом и абдоминальной болью у детей. Кроме того, как диагностический критерий, отсутствуют такие жалобы, как вздутие, растяжение или другие ощущения пациента [5].
В основе ФРОП лежат комбинированные физиологические и морфологические отклонения, связанные с висцеральной гиперчувствительностью, нарушениями моторики ЖКТ, защитного слизистого барьера, иммунной функции и состава кишечной микробиоты, а также расстройствами со стороны ЦНС.
В развитии ФРОП у детей в раннем возрасте немаловажную роль играют такие факторы, как морфофункциональная незрелость, недостаточная активность панкреатических и гастроинтестинальных ферментов, нарушение микробиоценоза, недостаточность мукозального иммунитета. В более старшем возрасте висцеральная гиперчувствительность обусловлена совокупностью факторов: социальными взаимоотношениями, стрессом, переутомлением, нарушением режима дня, отдыха.
В основе развития СРК лежит взаимодействие двух основных патогенетических механизмов: психосоциального воздействия и нарушения моторной функции толстой кишки, что проявляется повышением висцеральной чувствительности и нарушением двигательной функции кишки (таблица 1).
Таблица 1. Диагностические критерии СРК для детей (признаки должны присутствовать не менее 2 месяцев) [1].
| Должны присутствовать следующие симптомы: | |
| 1. Абдоминальная боль не менее 4 дней в месяц, ассоциированная с 1 или более из следующих симптомов: | а. связано с дефекацией; б. ассоциирована изменением частоты опорожнения; c. ассоциирована с изменением формы (внешнего вида) стула. |
| 2. При СРК с запором боль не проходит после опорожнения (если боль проходит после опорожнения, то у ребенка функциональный запор, а не СРК). | |
| 3. После соответствующей оценки симптомы не могут быть отнесены под другое заболевание. | |
Боль может быть различной интенсивности, локализуется, как правило, внизу живота, хотя может отмечаться и в других его отделах. Она часто усиливается при погрешностях в диете, психоэмоциональной нагрузке, переживаниях, также при физической нагрузке. Важно отметить, что абдоминальная боль исчезает в ночное время, когда ребенок спит.
Если боль проходит после опорожнения, то в этом случае, скорее всего, у ребенка имеет место функциональный запор, а не СРК с запором. Установлено, что у 75% детей, страдающих запором, присутствует абдоминальная боль, что подпадает под критерии СРК. Но и пациенты с СРК длительно наблюдаются с диагнозом функциональный запор не получая эффективной медицинской помощи. Комитет рекомендует пациентам с запором и абдоминальной болью на начальном этапе проводить лечение только от запора. Если боль в животе проходит после лечения запора, то у пациента функциональный запор. Если боль не проходит, вероятно, у ребенка имеет место СРК с запором. Аналогично, в случае возможного СРК с диареей. На первом этапе нужно исключить кишечную инфекцию с рецидивирующим, хроническим течением, целиакию, мальабсорбцию углеводов и реже воспалительное заболевание кишечника. Важно обратить внимание на тревожные сигналы («симптомы тревоги», «красные флаги»), при наличии которых нужно исключить органическую патологию органов ЖКТ. Указывается, что чем больше присутствует тревожных симптомов, тем выше вероятность органического заболевания (Таблица 2). Определение фекального кальпротектина все чаще используется как неинвазивный скрининг для исключения воспалительного заболевания кишечника (ВЗК) [6].
Таблица 2. Симптомы тревоги у пациентов с ФРОП.
| Семейный анамнез воспалительного заболевания кишечника, целиакии или язвенная болезнь; |
| Постоянная боль в правом верхнем или правом нижнем квадранте; |
| Дисфагия, одинофагия; |
| Рецидивирующая рвота; |
| Кровотечения из органов желудочно-кишечного тракта; |
| Ночная диарея; |
| Артрит; |
| Периректальные поражения; |
| Немотивированное похудание, потеря веса, недостаточность питания; |
| Задержка полового созревания; |
| Необъяснимая лихорадка; |
У детей, как и у взрослых, СРК можно разделить на разные типы, отражающие преобладающий характер стула (СРК с запор, СРК с диареей, СРК с запором и диарея и неуточненный СРК) и эти типы теперь включены в Рим IV [7].
Таблица 3. Функциональные расстройства органов пищеварения: нарушение взаимодействия ЖКТ и ЦНС по данным Римских критериев IV (коды Рим IV и МКБ-10).
| С. Кишечные расстройства | ||
| С.1 Синдром раздраженного кишечника (СРК) | СРК с преобладанием запора (СРК-3) СРК с преобладанием диареи (СРК-Д) СРК смешанного типа (СРК-См) Неклассифицируемый СРК (СРК-Н) | |
| Формулировка | Коды Рим IV | МКБ-10 |
| Функциональный запор | С.2 | K59.0 запор K58.2 Синдром раздраженного кишечника с преобладанием запоров |
| Функциональный понос | С.3 | K59.1 Функциональная диарея K58.1 Синдром раздраженного кишечника с преобладанием диареи |
| Функциональное абдоминальное вздутие/растяжение | С.4 | R14 Метеоризм и родственные состояния K59.9 Функциональное нарушение кишечника неуточненное K58.8 Другой или неуточненный синдром раздраженного кишечника |
| Неспецифическое функциональное кишечное расстройство | С.5 | K59.2 Неврогенная возбудимость кишечника, не классифицированная в других рубриках K58.3 Синдром раздраженного кишечника со смешанными проявлениями |
| Опиоид-индуцированный запор | С.6 | K59.0 Запор |
Сложность этио-патогенеза заболевания у детей объясняется совокупностью факторов: личностные психологические аспекты, генетическая предрасположенность, факторы питания, развитие висцеральной гиперчувствительности, нарушения моторной активности, изменения в нейроэндокринной системе (ось «головной мозг — кишечник»), повышение проницаемости кишечника, нарушение состава кишечной микробиоты.
В научных исследованиях показано, что висцеральная гиперчувствительность может быть связана с детским психологическим стрессом (тревога, депрессия, импульсивность, гнев) [8].
У детей с СРК могут наблюдаться повышенный уровень стресса, беспокойства, депрессии и эмоциональных проблем, о которых они сообщают сами [9]. Тяжелые заболевания, требующие медицинского инвазивного вмешательства в раннем возрасте (например, операция) связаны с более высоким риском развития ФРОП у детей, включая СРК [10].
Патофизиология СРК включает воздействие внешних раздражающих факторов (стресс, высокая эмоциональная нагрузка, недостаток сна и т. д.), что возбуждает ЦНС, вегетативный ответ, с воздействием на нейроэндокринную систему кишечника, включая гипоталамо-гипофизарно-надпочечниковую (кортизол) систему. Это нарушает двигательную активность кишечника, усиливает спазм гладкой мускулатуры, нарушает пассаж кишечного содержимого. С другой стороны, изменения двигательной активности кишечника приводят к перевозбуждению внутрикишечных нервных волокон, клеток Кахаля, усиливая спазм гладких мышц, изменяется микробиота, что влияет на среду и синтез КЖК. Таким образом, возникает порочный круг (таблица 4).
Таблица 4. Патофизиология развития СРК: связь «головной мозг – кишка» [11].
| Нарушение функционирования оси «головной мозг – кишка» | ||
| Кортикотропин-релизинг-фактор (CRF) | Активация энтеральной нервной системы | Изменение микробиоты |
| Активирует CRF-1 рецепторы → усиление моторики при стрессе Провоспалительная активность → увеличение синтеза ИЛ-1 и ИЛ-2 Усиление ответа на эндотоксины Повышение уровня кортизола и адреналина Повышение сенситивности кишечных нервов | Избыточное высвобождение Нейротрансмиттеров → нарушение перистальтики Повышенная дегрануляция тучных клеток → нарушение серотонинового сигнального каскада Дисбаланс синтеза провоспалительных и воспалительных медиаторов Повышение проницаемости кишечного барьера | Нарушение местного иммунитета Экспрессия синтеза нейротрансмиттеров (серотонин, ГАМК, гистамин, ацетилхолин, мелатонин и др.) Нарушение слизистого барьера и микробной биопленки Модуляция кишечной чувствительности афферентных волокон |
Часто СРК развивается после перенесенной острой кишечной инфекции, отмечено повышение содержания провоспалительных цитокинов в слизистой оболочке ЖКТ и развивается постинфекционный СРК [12]. Систематический обзор, опубликованный в 2015 году, показал частоту регистрации постинфекционной функциональной диспепсии и СРК в популяции, включая детей 10,0% (ФД, n = 976; ОГЭ, n = 9737) и 13,1% (СРК, n = 1128; ОГЭ, n = 8624), соответственно. Так же указано длительное сохранение расстройств, установлено, что через 1 год после перенесенного о. гастроэнтерита постинфекционная функциональная диспепсия сохранилась у 13,5 % пациентов (n = 380; ОГЭ n = 2807) и синдром раздраженной кишки у 38,9% детей (n = 86 ; ОГЭ n = 221) [13].
В другом исследовании указана роль паразитарной инфекции (Balantidiumcoli, Strongyloidesstercoralis, Ascarislumbricoides, Necatoramericanus, Ancylostomaduodenale, Taeniasolium, Taeniasaginataи Hymenolepisnana) в развитии постинфекционных ФРОП, в частности в развитии СРК (OР составил: 1,69), функционального запора (Oр: 4,13) [14].
Роли кишечной микробиоты в патофизиологии СРК в настоящее время посвящено большое количество экспериментальных и клинических исследований. Были продемонстрированы изменения в микробиоме кишечника, хотя неясно, являются ли эти изменения причиной или результатом СРК и его симптомов [15].
Установлено, что качественные и количественные изменения микрофлоры оказывают влияние на функцию кишечника, выступая в качестве причины нарушений его двигательной активности, чувствительности и нейроиммунных взаимоотношений, включая нарушение экспрессии рецепторов слизистой оболочки и изменения функции гипоталамо-гипофизарно-надпочечниковой системы. Известно, что кишечная микрофлора утилизирует нерастворимые углеводы и выделяются метаболиты, среди них важное значение имеют короткоцепочечные жирные кислоты (уксусная, пропионовая и масляная кислоты). Именно эти короткоцепочечные жирные кислоты (КЦЖК) в разных отделах толстой кишки оказывают противоположное влияние на моторную ее активность, через стимуляцию определенных рецепторов, вырабатывающих биологически активные вещества. В проксимальных отделах толстой кишки КЦЖК стимулируют рецепторы L-клеток, которые вырабатывают регуляторный полипептид PYY, замедляющий двигательную активность не только толстой, но и тонкой кишки. А в дистальных отделах КЦЖК стимулируют рецепторы Ecl-клеток, вырабатывающих гистамин, который, действуя на 5-HT 4-рецепторы афферентных волокон блуждающего нерва, инициирует рефлекторное ускорение моторики. Среди КЦЖК, важное значение для колоноцитов имеет масляная кислота (бутират), которая является важнейшим энергетическим источником для колоноцитов, синтеза липидов мембран, защитного барьера и проницаемости слизистой оболочки толстой кишки, подавления окислительного стресса, воспаления, колоректального канцерогенеза, восстановления водно-электролитного баланса. Кроме этого, масляная кислота (бутират) оказывает регулирующее влияние на кишечную моторику [16].S.A.Vanhoutvin с соавт. изучали влияние масляной кислоты (бутирата) на висцеральную гиперчувствительность у здоровых добровольцев. Участникам исследования ректально вводили масляную кислоту. Результаты исследования показали, что введение масляной кислоты повышало порог болевой чувствительности и снижало боль и дискомфорт, вызванные раздуванием ректального баллона, что оценивалось по аналоговой шкале. При этом отмечено, что введение бутирата имело дозозависимый эффект, чем выше была доза бутирата, тем больше снижалась висцеральная чувствительность [17].
Применение одного из штаммов Bifidobacterium bifidum у пациентов с симптомами СРК приводило к значимому снижению таких симптомов как боль/дискомфорт в животе, метеоризм, нарушение пищеварения у 57% пациентов по сравнению с 21% в группе плацебо [19].
В метаанализе проводилась оценка результатов 24 клинических исследований с участием 2001 пациентов с СРК. Результаты анализа показали достоверное уменьшение симптомов боли и общих симптомов у пациентов при применении мультиштаммовых пробиотиков. Мультиштаммовые пробиотики оценивались в 12 РКИ с участием 1197 пациентов со значительным влиянием на симптом абдоминальной боли (ОР = 0,81; 95% ДИ 0,67–0,98, р
По данным исследований, проведенных у пациентов с СРК, с применением различных пробиотиков и их комбинаций установлено, что:
- L. rhamnosus LGG., L. Rhamnosus, B. animalis B. lactis – способствуют стабилизации кишечной микрофлоры [20, 21].
- S.thermophillus, L. acidophilus, B. longum – приводят к оптимизации слизистого барьера кишечника [21];
- L. rhamnosus LGG., L. Rhamnosus, B. animalis, B. lactis ; L. acidophilus, B. Bifidum – способствуют снижению абдоминальной симптоматики [22];
- B. longum, L. Acidophilus, L. lactis, S. thermophilus, L. plantarum – повышают показатель качества жизни пациентов [23, 24];
- L. Acidophilus, L. lactis, S.thermophillus (Drouault-Holowacz S et al. A double blind randomized controlled trial of a probiotic combination in 100 patients with irritable bowel syndrome. Gastroenterol Clin Biol 2008), B. bifidum [25, 26] – помогают устранить вздутие живота [25].
Результаты систематического обзора (Simrén М. 2014) подтверждают роль синбиотических комплексов, — сочетание мульти штаммовых пробиотиков и пребиотиков в комплексной терапии проявлений СРК (54).
Один из мультиштаммовых пробиотиков является Максилак, в состав которого входят бифидобактерии (Bifidobacteriumlongum, Bifidobacteriumbreve, Bifidobacteriumbifidum) и лактобактерии (Lactobacillusacidophilus, Lactobacillusrhamnosus, Lactobacilluscasei, Lactobacillusplantarum, Lactobacilluslactis), Streptococcusthermophilus 108 КОЕ, а также пребиотический компонент фруктоолигосахарид. Инновационная капсула DRcaps™, в свою очередь, нейтрализует негативное воздействие кислого содержимого желудка, солей желчных кислот и пищеварительных ферментов.
Ведущую роль в структуре абдоминального болевого синдрома наиболее часто играет спастическая висцеральная боль, в основе которой лежит непроизвольное сокращение гладких мышц кишечника, не сопровождающееся их немедленным расслаблением. Селективные миотропные спазмолитики имеют возрастные ограничения у детей. По клинической эффективности тримебутин сопоставим с такими спазмолитиками, как пинаверия бромид и мебеверин в терапии боли в животе при СРК у взрослых [27].
Механизм действия тримебутина заключается в стимуляции периферических опиоидных (энкефалиновых) рецепторов (μ-, k-, δ-) на протяжении всего ЖКТ. Связывание с k-рецепторами приводит к снижению мышечной активности, а связывание с μ- и δ-рецепторами вызывает ее стимуляцию. При этом препарат не оказывает влияние на другие рецепторы. Тримебутин оказывает прямое действие на гладкомышечные клетки через рецепторы миоцитов и ганглиев энтеральной нервной системы, имитируя действие энкефалинов [28]. На российском фармацевтическом рынке присутствует дженерик препарата тримебутина: Необутин® (выпускается в таблетированной форме в дозировках 100 и 200 мг), который разрешен детям с 3-х лет. Препарат оказывает нормализирующее влияние на моторную функцию желудочно-кишечного тракта: в зависимости от исходного состояния ЖКТ он оказывает стимулирующее или расслабляющее воздействие на ЖКТ. Кроме того, тримебутин оказывая влияние на Na+ и Ca2+-каналов, обеспечивает анестезирующее действие и прямой спазмолитический эффект, таким образом опосредованно нормализует моторику ЖКТ и висцеральную гиперчувствительность.
Проведена сравнительная оценка эффективности терапии препаратами, координирующими моторику кишечника (тримебутин) как монотерапии, так и в комбинации с пробиотиками у детей в возрасте 5-17 лет с симптомами СРК. В первой группе (n=15) проводилась терапия тримебутином в возрастной дозировке курсом 1 месяц, во второй группе (n=15) проводилась комбинированная терапия тримебутин + пробиотики. Авторы определяли уровень фекального кальпротектина (белка, отражающего выраженность воспалительного процесса), как показателя воспаления в кишечнике. Уровень кальпротектина у пациентов с СРК был исходно повышен у 27,3% детей, средний уровень показателя превышал нормальные показатели в 2 раза.
Полученные результаты показали высокую эффективность тримебутина (у 82% детей) при монотерапии, и наилучший результат (до 98%) при комбинации тримебутина с пробиотиком. В группе плацебо купирование абдоминальной боли наблюдалось у 22 % детей. Нормализация стула у 99% детей второй группы и 15% группы плацебо [29].
В другом исследовании оценивали распространенность СРК у детей и эффективность тримебутина в коррекции клинической симптоматики. Были включены 345 детей и подростков от 4-18 лет. Распространенность СРК в соответствии с критериями Рима III у детей и подростков составила 22,6%, причем преобладающим подтипом был СРК с запором. 78 детей и подростков с нормальными лабораторными показателями и установленным диагнозом СРК были рандомизированы на две группы: 39 пациентов получали тримебутин 300 мг в сутки три недели, 39 пациентов не получали медикаментозного лечения. Клиническое улучшение наблюдалось у 94,9% пациентов, принимавших тримебутин против 20,5% в группе, не применявшей медикаментозное лечение (P
Таким образом, применение синбиотических комплексов, содержащих мультиштаммовый состав пробиотических штаммов лакто- и бифидобактерий, оказывающих позитивное влияние на качественный и количественный состав микрофлоры ЖКТ, и тримебутина малеата, способного оказывать прямое нормализующее действие на моторную функцию желудочно-кишечного тракта, имеет основание для включения в комплексную терапию синдрома раздраженного кишечника у детей.
Узнать больше
Список литературы
- Van Tilburg MAL, Walker L, Palsson O, et al. Prevalence of child/adolescent functional gastrointestinal disorders in a national U.S. community sample. Gastroenterology 2014;144(Suppl 1):S143–S144.
- Dhroove G, Chogle A, Saps M. A million-dollar work-up for abdominal pain: is it worth it? J Pediatr Gastroenterol Nutr 2010;51:579–583.
- Faure C, Giguere L. Functional gastrointestinal disorders and visceral hypersensitivity in children and adolescents suffering from Crohn’s disease. Inflamm Bowel Dis 2008;14:1569–1574.
- Drossman D. A., Hasler W. L. Rome IV — Functional GI disorders: disorders of Gut- Brain interaction // Gastroenterology. 2016. Vol. 150 (6). P.1262–1279.
- Jeffrey S. Hyams, Carlo Di Lorenzo, Miguel Saps, Robert J. Shulman, Annamaria Staiano, Miranda van Tilburg. Childhood Functional Gastrointestinal Disorders: Child/ Adolescent // Gastroenterology 2016;150:1456–1468.
- Henderson P, Casey A, Lawrence SJ, et al. The diagnostic accuracy of fecal calprotectin during the investigation of suspected pediatric inflammatory bowel disease. Am J Gastroenterol 2012;107:941–949.
- Rajindrajith S, Devanarayana NM. Subtypes and symptomatology of irritable bowel syndrome in children and adolescents: a school-based survey using Rome III criteria. J Neurogastroenterol Motil 2012;18:298–304.
- Iovino P, Tremolaterra F, Boccia G, et al. Irritable bowel syndrome in childhood: visceral hypersensitivity and psychosocial aspects. Neurogastroenterol Motil 2009;21. 940-e74.
- Waters AM, Schilpzand E, Bell C, et al. Functional gastrointestinal symptoms in children with anxiety disorders. J Abnorm Child Psychol 2013;41:151–163.
- Bonilla S, Saps M. Early life events predispose the onset of childhood functional gastrointestinal disorders. Rev Gastroenterol Mex 2013;78:82–91.
- Захарова И.Н., Бережная И.В., Холодова И.Н., Зайденварг Г.Е. Боли в животе у ребенка: тактика педиатра. Учебное пособие для врачей. – М.: ФГБОУ ДПО РМАНПО. –2020. – 128 с.
- Saps M, Pensabene L, Turco R, et al. Rotavirus gastroenteritis: precursor of functional gastrointestinal disorders? J Pediatr Gastroenterol Nutr 2009;49:580–583.
- S. Futagami 1, T Itoh, C Sakamoto. Systematic review with meta‐analysis: post‐infectious functional dyspepsia// Aliment Pharmacol Ther . 2015 Jan;41(2):177-88. doi: 10.1111/apt.13006.
- Blitz J, Riddle MS and Porter CK (2018) The Risk of Chronic Gastrointestinal Disorders Follow in Acute Infection with Intestinal Parasites. Front. Microbiol. 9:17. doi: 10.3389/fmicb.2018.00017.
- Rajilic-Stojanovic M, Biagi E, Heilig HG, et al. Global and deep molecular analysis of microbiota signatures in fecal samples from patients with irritable bowel syndrome. Gastroenterology 2011;141:1792–1801.
- Hamer HM. Review article: the role of butyrate on colonic function. Aliment Pharmacol Ther. 2008;27:104-19.
- Vahoutvin SA, Troost FJ, Kilkens TO. The effects of butyrate enemas on visceral perception in healthy volunteers. Neurogastroenterol Motil. 2009;21(9):952-76.
- S. Guglielmetti, D. Mora, M. Gschwender & K. Popp. Randomised clinical trial: Bifidobacterium bifidum MIMBb75 significantly alleviates irritable bowel syndrome and improves quality of life –– a double-blind, placebo-controlled study. Aliment Pharmacol Ther 2011.
- Alexander C. Ford, MBChB, MD et al. Efficacy of Prebiotics, Probiotics, and Synbiotics in Irritable Bowel Syndrome and Chronic Idiopathic Constipation: Systematic Review and Meta-analysis. Am J Gastroenterol 2014; 109:1547–1561; doi: 10.1038/ajg.2014.202.
- Michael J Fox et al. Can probiotic yogurt prevent diarrhoea in children on antibiotics? A doubleblind, randomised, placebo-controlled study. BMJ Open 2015.
- Ki Cha B et al. The effect of a multispecies probiotic mixture on the symptoms and fecal microbiota in diarrhea-dominant irritable bowel syndrome: a randomized, double-blind, placebo-controlled trial. J Clin Gastroenterol 2012; 46.
- Williams EA, Stimpson J, et al. Clinical trial: a multistrain probiotic preparation significantly reduces symptoms of irritable bowel syndrome in a double-blind placebo controlled study. Aliment Pharmacol Ther 2009.
- Drouault-Holowacz S et al. A double blind randomized controlled trial of a probiotic combination in 100 patients with irritable bowel syndrome. Gastroenterol Clin Biol 2008);
- Simrén M, Ohman L, Olsson J, Svensson U, Ohlson K, Posserud I, Strid H. Clinical trial: the effects of a fermented milk containing three probiotic bacteria in patients with irritable bowel syndrome — a randomized, double-blind, controlled study. Aliment Pharmacol, Ther 2010.
- А Randomized Clinical Trial of Synbiotics in Irritable Bowel Syndrome: Dose-Dependent Effects on Gastrointestinal Symptoms and Fatigue Sang-Hoon Lee, Doo-Yeoun Cho at al, The Korean Academy of Family Medicine. Received: May 16, 2022,
- L. plantarum (Ducrotté P, Sawant P, Jayanthi V. Clinical trial: Lactobacillus plantarum 299v (DSM 9843) improves symptoms of irritable bowel syndrome. World J Gastroenterol 2012; 18.
- Rahman M. Z., Ahmed D. S., Mahmuduzzaman M. et al. Comparative efficacy and safety of trimebutine versus mebeverine in the treatment of irritable bowel syndrome // Mymensingh Med J. 2014; 23 (1): 105–113.
- Трухан Д. И., Багишева Н. В., Голошубина В. В., Гришечкина И. А. Тримебутин в лечении гастроинтестинальных функциональных расстройств // Международный журнал прикладных и фундаментальных исследований. 2016; 11 (6): 1072–1076.
- Типикина М.Ю., Корниенко Е.А.. Патогенетически обоснованная стратегия терапии синдрома раздраженного кишечника у детей. Вопросы детской диетологии. 2014; 12(1): 22-27.
- Gülcan S Karabulut. The Incidence of Irritable Bowel Syndrome in Children Using the Rome III Criteria and the Effect of Trimebutine Treatment. J Neurogastroenterol Motil. 2013;19(1): 90-3. doi: 10.5056.
Как проявляется симптомы СРК
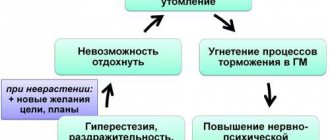
Пациент может заподозрить у себя признаки СРК, если его проблемы с кишечником связаны с психогенным фактором, то есть включают реакцию на изменение эмоционального состояния — волнение, тревогу, расстройство. Часто симптоматика может запускаться на фоне стресса перед важным мероприятием или в поездке на большие расстояния — когда кишечник в путешествиях перестает работать по привычной схеме.
Иногда болезнь может проявлять себя в форме так называемой «реакции отказа». У студента начинает сильно болеть живот перед экзаменом, на котором он боится провалиться. У человека с симптомами социальной фобии, со страхом выступления на публике приступ запускается нависшей над ним необходимостью выступить с докладом, когда воображение начинает рисовать ему картины провала или позора. В принципе, такая реакция несколько раз в жизни может происходить у многих людей, но у пациентов с СРК она закрепляется, становится ригидной, то есть привычным способом реагирования организма: сильный стресс уже прошел, а живот продолжает беспокоить по каждой мелочи.
Часто симптоматика может запускаться на фоне стресса перед важным мероприятием или в поездке на большие расстояния — когда кишечник в путешествиях перестает работать по привычной схеме.
СРК может протекать в сцепке с паническим расстройством. Есть люди, которые при паническом приступе испытывают внезапные сильные позывы к дефекации. Это отдельный вид панических атак.
Избыток возбуждающих, стимулирующих веществ в крови (адреналина, серотонина и других нейромедиаторов) вызывает тревогу, страх, сердцебиение, чувство нехватки воздуха и другие неприятные телесные ощущения, в том числе, обильное мочевыделение или жидкий стул. Приступ, как правило, развивается быстро — за десять минут, а длится примерно двадцать-тридцать минут. Человека захлестывает необъяснимый ужас. После пережитого криза появляется чувство подавленности, безысходности, жалости к себе. Перенесенные несколько раз приступы порождают страх перед повторением и «тревогу ожидания». Отсюда страх СРК-ашников ездить в общественном транспорте, ходить в театры, кино, на свидания.
Опасность и осложнения
СРК с преобладанием запоров снижает качество жизни человека. Длительное отсутствие стула может стать причиной хронической интоксикации организма, истощения защитных сил, обострения дерматологических заболеваний и аллергии. Боли способствуют сниженному эмоциональному фону, могут ограничивать социальную активность, стать причиной раздражительности и нервозности.
В долгосрочной перспективе постоянные запоры могут быть фактором риска развития онкологических заболеваний пищеварительной системы, атеросклероза, тромбозов, инфарктов, инсультов. Застой кала приводит к перерастяжению стенок кишечника и сопутствующим структурным изменениям, и воспалительным процессам.