Диацереин-СЗ (Diacerein-SZ)
Продолжительность лечения в зависимости от достигнутого результата может быть длительной. В период, предшествующий развитию терапевтического эффекта, препарат Диацереин-СЗ можно принимать одновременно с анальгетиками и нестероидными противовоспалительными препаратами.
Необходим периодический контроль показателей крови, печеночных ферментов, мочи. При ухудшении функции почек врач должен снизить дозу препарата.
Не рекомендуется применение диацереина при быстропрогрессирующем остеоартрозе тазобедренного и коленного суставов вследствие медленного развития клинического эффекта лекарственного средства.
Диарея
Прием диацереина часто приводит к развитию диареи (см. раздел «Побочное действие»), что может вызвать обезвоживание и гипокалиемию.
При развитии диареи следует прекратить прием препарата и немедленно связаться с врачом, чтобы обсудить альтернативное лечение.
Необходимо проявлять осторожность, если пациент одновременно получает диуретики, так как могут развиться обезвоживание и гипокалиемия.
Особую осторожность следует соблюдать при гипокалиемии у пациентов, получавших сердечные гликозиды (дигитоксин, дигоксин) (см. раздел «Взаимодействие с другими лекарственными препаратами»).
Следует избегать одновременного применения слабительных лекарственных средств.
Гепатотоксичностъ
В ходе пострегистрационного мониторинга были выявлены случаи повышения активности печеночных ферментов в сыворотке крови и симптоматическое острое поражение печени (см. раздел «Побочное действие»).
Перед началом лечения пациента следует опросить о сопутствующих, текущих и имеющихся в анамнезе заболеваниях печени, провести обследование для выявления нарушений функционального состояния печени. Заболевания печени являются противопоказанием к применению диацереина (см. раздел «Противопоказания»).
Необходимо выполнять контроль лабораторных и клинических проявлений повреждения печени, соблюдать меры предосторожности при одновременном применении с другими лекарственными средствами с характерным риском развития гепатотоксических реакций. Пациентам следует рекомендовать ограничить потребление алкоголя во время применения диацереина.
Лечение препаратом диацереина необходимо прекратить, если выявлено повышение активности печеночных ферментов или подозревается развитие симптомов поражения печени. Пациента следует проинформировать о признаках и симптомах гепатотоксичности и рекомендовать немедленно обращаться к врачу в случае появления подозрения на развитие симптомов поражения печени.
Диацереин в терапии остеоартрита коленных суставов: результаты сравнительного исследования
Остеоартроз – одно из наиболее распространенных заболеваний суставов, встречающееся преимущественно в средней и старшей возрастных группах. Поскольку в мире наблюдается постоянное увеличение числа людей пожилого возраста, остеоартроз становится все более значимой проблемой здравоохранения. В последние годы активно изучается патогенез остеоартроза, при этом значительная роль отводится провоспалительным механизмам развития заболевания и, в частности, цитокиновой регуляции. В связи с этим обсуждается и сама дефиниция данной нозологической формы – большинство авторов предлагают пользоваться термином «остеоартрит», который мы и будем использовать в дальнейшем. Основным клиническим проявлением остеоартрита (ОА) является боль в пораженном суставе, интенсивность которой зависит как от выраженности воспалительных изменений, так и от стадии ОА (структурных нарушений хрящевой ткани, субхондральной кости и окружающих сустав мягких тканей). Заболевание отличается как значительной гетерогенностью в плане клинических проявлений, так и различной скоростью прогрессирования структурных нарушений, поэтому основными задачами, стоящими в настоящее время перед клиницистами и исследователями, являются выделение контингента пациентов с быстропрогрессирующими вариантами течения ОА и разработка оптимального эффективного алгоритма терапевтического воздействия. Роль провоспалительных цитокинов в развитии остеоартрита
Несмотря на значительный прогресс в понимании патогенетических механизмов развития ОА, причинно-следственные связи в процессе его развития и прогрессирования окончательно не установлены. Консенсусным является понимание того, что ОА – это гетерогенное заболевание с различными факторами риска развития и его дальнейшего течения. При этом наиболее важной задачей является установление механизмов быстрого прогрессирования ОА крупных суставов (с тяжелыми структурными повреждениями суставных тканей) и возможностей фармакологической коррекции таких нарушений, т. к. эта категория пациентов, как правило, уже через 5–7 лет нередко нуждается в хирургическом лечении. В здоровом суставе гомеостаз хряща и кости поддерживается благодаря сбалансированности анаболических и катаболических процессов, которые регулируются про- и противовоспалительными медиаторами, в т. ч. интерлейкинами (ИЛ-1, -2, -6 и др.), фактором некроза опухоли-α (ФНО-α) и др. [1]. При ОА гиперпродукция ИЛ-1 приводит к смещению баланса в сторону катаболических и антианаболических процессов, следствием чего являются снижение синтеза компонентов хрящевого матрикса, усиление его деградации и ремоделирование субхондральной кости. В частности, доказана способность ИЛ-1 усиливать образование хондроцитами катаболических факторов – матриксных металлопротеиназ (ММП) и оксида азота (NO), а также снижать экспрессию специфических ферментов – тканевых ингибиторов металлопротеиназ (tissue inhibitors of metalloproteinases (TIMP)), ингибирующих активность ММП [2, 3]. ИЛ-1 также обладает способностью индуцировать синтез активаторов энзимов, одним из которых является урокиназоподобный активатор плазминогена. Плазминоген, в свою очередь, активирует про-ММП, что ведет к последующей деградации хрящевого матрикса [2]. Доказано, что ИЛ-1 опосредованно индуцирует апоптоз хондроцитов и синовиоцитов, а также играет ключевую роль в индукции воспалительных реакций, следствием чего является нарушение функциональной активности хондроцитов и уменьшение объема хрящевой ткани при ОА [1]. Наряду со стимуляцией продукции других провоспалительных цитокинов ИЛ-1 по механизму положительной обратной связи индуцирует повышенную собственную выработку клетками-продуцентами. Так, сигнал, передаваемый на рецептор ИЛ-1, вызывает активацию фактора транскрипции и ядерного фактора κB (NF-κB), которые, в свою очередь, активируют экспрессию гена ИЛ-1, что ведет к дальнейшему образованию цитокина с развитием целого каскада патофизиологических реакций: деградации хряща, ремоделированию субхондральной кости и прогрессированию воспалительных изменений [4]. Таким образом, учитывая патогенетическое значение ИЛ-1 в индукции и поддержании воспалительного процесса при ОА посредством влияния на механизмы апоптоза хондроцитов, костное ремоделирование, снижение активности анаболических процессов в хрящевой ткани, приводящих к деградации внеклеточного матрикса и прогрессированию заболевания, следует отметить, что лекарственные препараты, влияющие на продукцию и активность ИЛ–1, могут потенциально способствовать замедлению процессов прогрессирования ОА.
Диацереин – компонент патогенетической терапии остеоартрита
Одним из симптоматических препаратов медленного действия для лечения ОА (SYSADOA – Symptomatic slow-activ drug in osteoarthritis) является диацереин, механизм действия которого заключается в ингибировании продукции и патофизиологических эффектов ИЛ-1. В многочисленных исследованиях было продемонстрировано, что существенный положительный эффект от его применения наступает через 2–4 нед. от начала приема препарата с клинически значимыми отличиями от плацебо на 4–6-й нед. [5, 6]. Улучшение симптомов заболевания наблюдается также и через некоторое время после окончания курса терапии (так называемый «эффект последействия»), что является важным позитивным фактором, влияющим на долгосрочную стратегию лечения ОА (с учетом хронического течения заболевания). Диацереин обладает уникальным механизмом действия, отличающим его от других лекарственных препаратов для лечения ОА. В частности, в многочисленных исследованиях было показано эффективное ингибирование диацереином продукции и активности ИЛ-1 и других катаболических цитокинов, которые экспрессируются при ОА, что сопровождалось уменьшением степени деградации хрящевой ткани [7, 8]. Этому способствовало также снижение активности плазмина, ММП и других протеаз, оказывающих отрицательное влияние на матрикс хряща. Кроме того, в исследовании N. Felisaz et al. (1999) было продемонстрировано, что диацереин обладает способностью увеличивать экспрессию трансформирующих факторов роста (TGF-β1 и -β2) в культуре хондроцитов, что приводило к увеличению числа и активности клеток с повышением образования гиалуронана, коллагена и протеогликанов [9]. Таким образом, диацереин, обладая проанаболическим воздействием на хрящ, может рассматриваться как важный фармакологический агент в комплексной терапии ОА. Эта точка зрения подтверждена результатами исследования M. Dougados et al. (2001), которые провели оценку структурно-модифицирующего действия диацереина у больных с первичным коксартрозом [10]. Авторы установили, что рентгенографическое прогрессирование (сужение суставной щели тазобедренного сустава не менее чем на 0,5 мм) в группе больных, принимавших диацереин, было значительно менее выражено и развивалось позднее по сравнению с группой пациентов, принимавших плацебо. Важным преимуществом диацереина является также установленный факт наличия эффекта последействия при его применении, что было продемонстрировано в двойном слепом рандомизированном плацебо-контролируемом исследовании K. Pavelka et al. [11].
Диацереин в терапии ОА коленных суставов
Целью
данного исследования явилось изучение клинической эффективности, переносимости и безопасности препарата диацереин (Диафлекс) в сравнении с хондроитина сульфатом натрия у больных с ОА коленных суставов при непрерывном приеме в течение 12 мес., а также оценка эффекта «последействия» препаратов.
Материал и методы
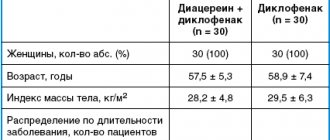
В исследование было включено 30 больных (28 женщин и 2 мужчины) с ОА коленных суставов II-III стадии (по Kellgren – Lawrence), соответствующих критериям Американской коллегии ревматологов (АКР, 1986 г.). Средний возраст больных составил 60,4±6,2 года, длительность заболевания – 5,9±4,5 года. Исследование проводилось в соответствии с основными принципами надлежащей клинической практики. Участие в исследовании допускалось только после добровольного подписания пациентом информированного согласия и получения разрешения локального этического комитета. При включении пациентов в исследование учитывались следующие критерии: • мужчины и женщины в возрасте 45–75 лет; • первичный тибиофеморальный ОА коленного сустава (согласно критериям АКР, 1986 г.); • боль при ходьбе > 40 мм по визуальной аналоговой шкале (ВАШ); • рентгенологическая стадия II–III (по Kellgren – Lawrence). Критерии исключения: • вторичный гонартроз (в т. ч. при ревматоидном артрите, подагре, после внутрисуставного перелома и др.); • внутрисуставные инъекции глюкокортикоидов, препаратов гиалуроновой кислоты в течение 3-х мес. до начала исследования; • асептический некроз мыщелков бедренной и/или большеберцовой кости; • предшествующие оперативные вмешательства на коленном суставе; • сопутствующие тяжелые заболевания: артериальная гипертензия III стадии, нестабильная стенокардия, сердечно-сосудистая недостаточность, сахарный диабет 1-го типа, тяжелые поражения печени и почек; • острая язва желудка (12-перстной кишки) в течение последнего месяца перед исследованием. Критериями исключения больного в ходе исследования являлись неэффективность терапии (сохранение или усиление болевого синдрома, требующее изменения тактики лечения), развитие серьезных нежелательных явлений, отказ пациента от исследования или нарушение протокола исследования. Общая продолжительность исследования составила 15 мес. (12 мес. – прием препаратов и 3 мес. – наблюдение). Всего было запланировано 8 визитов: В.0 – скрининг, период «отмывки» (3–7 дней) в случае предшествующего приема нестероидных противовоспалительных препаратов (НПВП); В.1 – рандомизация, начало терапии; В.2 – В.7 – плановые визиты через 2 нед., 1,5, 3, 6, 9 и 12 мес. после начала терапии соответственно и В.8 – заключительный осмотр через 3 мес. после окончания терапии (оценка последействия препаратов). Для оценки эффективности и безопасности терапии использовались следующие критерии: интенсивность боли по ВАШ (мм), тест «Встань и иди» (в секундах), индекс WOMAC (боль, скованность, функциональная недостаточность), опросник состояния здоровья EQ-5D, потребность в анальгетиках, оценка эффективности терапии врачом и пациентом, оценка переносимости проводимой терапии. Все пациенты были рандомизированы в 2 группы по 15 больных в каждой: 1-я принимала диацереин (Диафлекс) в дозе 50 мг 2 р./сут в течение 12 мес., 2-я – хондроитина сульфат натрия (Хондроксид) в дозе 500 мг 2 р./сут. При наличии у пациента болевого синдрома в первые 7 дней терапии допускалось назначение парацетамола до 2 г/сут, а затем – по требованию. Характеристика групп обследованных пациентов представлена в таблице 1. Практически у всех обследованных пациентов были диагностированы коморбидные состояния (табл. 2).
Из 30 больных, включенных в исследование, полный курс лечения завершили 26 (86,7%); на протяжении исследования из каждой группы выбыло по 2 пациента: из 1-й – из-за развития побочных явлений (диарея, кожная сыпь), из 2-й – в результате низкой эффективности терапии. Статистическая обработка материала проводилась с использованием стандартных методов, в т. ч. сравнение в группах по методу Вилкоксона для количественных показателей и χ2 – для качественных.
Результаты
Основными жалобами больных, страдающих ОА, являются боли в пораженном суставе и последующее нарушение его функциональной активности, а само заболевание при этом нелетально, поэтому очень важными критериями оценки комбинированной терапии являются степень купирования болевого синдрома и улучшение функциональной активности пациентов, что в конечном итоге оказывает влияние на качество жизни больных. Также важным было изучить не только время наступления анальгетического эффекта, но и его продолжительность. Результаты исследования свидетельствуют о том, что у больных на фоне приема исследуемых препаратов наблюдалось значимое уменьшение болевого синдрома, что выражалось в снижении индекса ВАШ (табл. 3). Следует обратить внимание на то, что, несмотря на отсутствие достоверных различий в группах в зависимости от длительности терапии, показатель ВАШ (боли) сохранялся < 30 на протяжении всего периода активного приема препаратов. Пациенты с сопутствующим ОА кистей (формирующиеся узелки Гебердена были диагностированы у 4-х пациентов 1-й группы и у 2-х из 2-й группы) отмечали значимое уменьшение болей в дистальных межфаланговых суставах уже на 7–10 сут от начала приема Диафлекса.
Для оценки функциональной активности пациентов использовался тест «Встань и иди», который проводился всем больным до начала лечения, в процессе терапии и спустя 3 мес. после завершения курса фармакотерапии. В соответствии с протоколом для проведения теста мы использовали кресло с подлокотниками, секундомер. Пациента просили встать с кресла, пройти 5 м, обойти предмет, расположенный на полу, вернуться и сесть на кресло. Время фиксировалось секундомером. Этот тест хорошо отражает реальные возможности пациента в повседневной жизни, т. к. в зависимости от выраженности стартовых болей в пораженном коленном суставе и интенсивности болей в целом можно оценить функциональные способности больного. Согласно представленным данным (рис. 1), в динамике у обследованных больных время на выполнение данного теста сокращалось, что свидетельствует о повышении функциональной активности и уменьшении выраженности стартовых болей. Значимой разницы между группами выявлено не было. Следует отметить, что результаты данного теста оставались стабильными и после окончания фармакотерапии (период В.7 – В.8).
При анализе суммарного индекса WOMAC (боль, скованность, функциональная недостаточность суставов) у больных 2-й группы отмечалось практически линейное его снижение на протяжении всего периода наблюдения, в то время как у пациентов 1-й группы (принимавших Диафлекс) динамика этого показателя существенно отличалась (рис. 2). Так, в первые 6 мес. терапии наблюдалось выраженное снижение индекса WOMAC с последующей его стабилизацией и формированием «плато» на достаточно низком уровне вплоть до визита 8. При изучении отдельных показателей индекса WOMAC (оценка боли, функциональной недостаточности суставов) у обследованных больных в 2-х группах наблюдалась такая же тенденция – более выраженный клинический эффект, включая и скорость его развития, при применении Диафлекса (рис. 3, 4). Таким образом, можно констатировать, что анальгетический эффект при использовании Диафлекса является более выраженным и развивается раньше, чем в случае применения хондроитина сульфата натрия.
С представленными данными коррелировала и общая оценка эффективности терапии исследуемыми препаратами (рис. 5). Так, «значительное улучшение» и «улучшение» констатировали 11 пациентов, принимавших Диафлекс, а «отсутствие эффекта» или «ухудшение» – 2 (во 2-й группе – 9 и 4 больных соответственно). На фоне применения исследуемых препаратов у больных обеих групп снизилась общая потребность в приеме парацетамола, при этом анальгетик был полностью отменен у 7 (46,7%) пациентов, принимающих Диафлекс, и у 3 (20%), принимающих хондроитина сульфат натрия.
Можно констатировать, что больные, принимавшие Диафлекс, в целом лучше оценивали эффективность терапии, чем пациенты 2-й группы, что, возможно, было связано с субъективными ощущениями от более быстрого купирования болевого синдрома. В то же время, как уже было отмечено ранее, при сравнении итоговых результатов различных показателей как к концу терапевтической фазы (В.7 – 12 мес.), так и в период последующего наблюдения (В.8 – 15 мес.) достоверных различий между группами получено не было. Переносимость исследуемых препаратов была удовлетворительной. За весь период из исследования выбыло 4 пациента: 2 больных из 1-й группы – по причине непереносимости исследуемого препарата и 2 больных из 2-й группы – в связи с неэффективностью терапии (ухудшение состояния, потребовавшее проведения внутрисуставных инъекций – больные были исключены на визитах В.6 и В.7 соответственно). Двое больных 1-й группы были исключены из исследования на 2 и 4 визитах (В.2 и В.4) из-за развития диареи (снижение дозы препарата до 50 мг/сут, как рекомендуется в таких случаях в инструкции по применению Диафлекса, не предусматривалось протоколом), также 3 (20%) пациента из этой группы отмечали незначительное потемнение мочи (метаболиты препарата преимущественно выводятся с мочой).
Заключение
Результаты исследования свидетельствуют о том, что длительное применение симптоматических препаратов медленного действия (SYSADOA) – Диафлекса и хондроитина сульфата натрия является эффективным методом лечения ОА коленных суставов с учетом их влияния на боль и функциональную активность пациентов. Так как ОА, по сути, является нелетальным заболеванием, то различные существующие на сегодняшний день терапевтические методы (фармакологические и нелекарственные), обладающие минимальными побочными эффектами при высоком терапевтическом индексе, могут рассматриваться как наиболее перспективные у этих пациентов при долгосрочном использовании. Анализ результатов 12-месячного применения препаратов Диафлекс и хондроитина сульфат натрия у больных с ОА коленного сустава показал их эффективность в отношении купирования клинических симптомов заболевания (боль, скованность, ограничение движений) на фоне отмены НПВП и снижения дозы (или полной отмены) парацетамола. Вместе с тем, с учетом данных проведенного исследования, применение Диафлекса может быть предпочтительным у пациентов с ОА коленного сустава из-за более быстрого нарастания клинического эффекта, а также у больных с полиостеоартритом с формирующимися узелками Гебердена в связи с хорошей анальгетической эффективностью препарата в отношении мелких суставов кистей. Прием Диафлекса у обследованных больных сопровождался положительным клиническим эффектом уже через 2–3 нед. от начала приема препарата и нарастал на протяжении всего периода лечения. Так, уже к 4-й нед. у пациентов отмечалась положительная динамика всех изучаемых клинических симптомов: выраженности болевого синдрома, в т. ч. стартовых болей, скованности, функции суставов. Представленные результаты согласуются с данными литературы, свидетельствующими о том, что диацереин значимо улучшает симптомы болезни по сравнению с плацебо, обладает выраженным последействием и не вызывает тяжелых нежелательных явлений, в связи с чем он рекомендуется в качестве препарата для длительной терапии ОА [12].
Выводы
1. Применение симптоматических препаратов медленного действия – Диафлекса и хондроитина сульфата натрия у больных с ОА коленных суставов продемонстрировало высокую клиническую эффективность, безопасность, хорошую переносимость, редкое возникновение нежелательных реакций. 2. Диафлекс продемонстрировал более быстрый (через 2–4 нед.) клинический эффект в отношении симптомов ОА, в т. ч. при поражении мелких суставов кистей, что, вероятно, связано с особенностями механизма действия препарата. 3. Назначение препаратов из группы SYSADOA позволяет минимизировать развитие побочных эффектов у коморбидных больных за счет уменьшения дозы (длительности назначения) НПВП и других лекарственных средств. 4. Более предпочтительными являются терапевтические курсы продолжительностью 6 мес. и более, а наличие у этих препаратов эффекта последействия позволяет проводить курсовую терапию ОА. 5. Более выраженный эффект последействия наблюдался при применении Диафлекса, что подтверждает нарастание положительной динамики индекса WOMAC и после окончания 12-месячного курса терапии. Полученные результаты мы связываем с механизмом действия диацереина.