Инсулин растворимый [человеческий генно-инженерный]
Международное наименование лекарственного вещества:
Инсулин растворимый [человеческий генно-инженерный] (Insulin soluble ) Перечень препаратов, содержащих действующее вещество Инсулин растворимый [человеческий генно-инженерный], приведен после описания.
Фармакологическое действие:
Препарат инсулина короткого действия. Взаимодействуя со специфическим рецептором внешней мембраны клеток, образует инсулинрецепторный комплекс. Повышая синтез цАМФ (в жировых клетках и клетках печени) или непосредственно проникая в клетку (мышцы), инсулинрецепторный комплекс стимулирует внутриклеточные процессы, в т.ч. синтез ряда ключевых ферментов (гексокиназа, пируваткиназа, гликогенсинтаза и др.). Снижение концентрации глюкозы в крови обусловлено повышением ее внутриклеточного транспорта, усилением поглощения и усвоения тканями, стимуляцией липогенеза, гликогеногенеза, синтеза белка, снижением скорости продукции глюкозы печенью (снижение распада гликогена) и др. После п/к инъекции действие наступает в течение 20-30 мин, достигает максимума через 1-3 ч и продолжается, в зависимости от дозы, 5-8 ч. Длительность действия препарата зависит от дозы, способа, места введения и имеет значительные индивидуальные особенности.
Фармакокинетика:
Полнота всасывания зависит от способа введения (п/к, в/м), места введения (живот, бедро, ягодицы), дозы, концентрации инсулина в препарате и др. Распределяется в тканях неравномерно. Не проникает через плацентарный барьер и в грудное молоко. Разрушается инсулиназой, в основном в печени и почках. T1/2 — от нескольких до 10 мин. Выводится почками (30-80%).
Показания:
Сахарный диабет типа 1, сахарный диабет типа 2: стадия резистентности к пероральным гипогликемическим ЛС, частичная резистентность к пероральным гипогликемическим ЛС (комбинированная терапия); диабетический кетоацидоз, кетоацидотическая и гиперосмолярная кома; сахарный диабет, возникший во время беременности (при неэффективности диетотерапии); для интермиттирующего применения у больных сахарным диабетом на фоне инфекций, сопровождающихся высокой температурой; при предстоящих хирургических операциях, травмах, родах, при нарушениях обмена веществ, перед переходом на лечение пролонгированными препаратами инсулина.
Противопоказания:
Гиперчувствительность, гипогликемия.
Побочные действия:
Аллергические реакции (крапивница, ангионевротический отек — лихорадка, одышка, снижение АД); гипогликемия (бледность кожных покровов, усиление потоотделения, испарина, сердцебиение, тремор, чувство голода, возбуждение, тревожность, парестезии в области рта, головная боль, сонливость, бессонница, страх, депрессивное настроение, раздражительность, необычное поведение, неуверенность движений, нарушения речи и зрения), гипогликемическая кома; гипергликемия и диабетический ацидоз (при низких дозах, пропуске инъекции, несоблюдении диеты, на фоне лихорадки и инфекций): сонливость, жажда, снижение аппетита, гиперемия лица); нарушение сознания (вплоть до развития прекоматозного и коматозного состояния); преходящие нарушения зрения (обычно в начале терапии); иммунологические перекрестные реакции с инсулином человека; повышение титра антиинсулиновых антител с последующим ростом гликемии; гиперемия, зуд и липодистрофия (атрофия или гипертрофия подкожной жировой клетчатки) в месте введения. В начале лечения — отеки и нарушение рефракции (носят временный характер и проходят при продолжении лечения).
Взаимодействие:
Фармацевтически несовместим с растворами др. ЛС. Гипогликемическое действие усиливают сульфонамиды (в т.ч. пероральные гипогликемические ЛС, сульфаниламиды), ингибиторы МАО (в т.ч. фуразолидон, прокарбазин, селегилин), ингибиторы карбоангидразы, ингибиторы АПФ, НПВП (в т.ч. салицилаты), анаболические стероиды (в т.ч. станозолол, оксандролон, метандиенон), андрогены, бромокриптин, тетрациклины, клофибрат, кетоконазол, мебендазол, теофиллин, циклофосфамид, фенфлурамин, препараты Li+, пиридоксин, хинидин, хинин, хлорохинин, этанол. Гипогликемическое действие ослабляют глюкагон, соматропин, ГКС, пероральные контрацептивы, эстрогены, тиазидные и «петлевые» диуретики, БМКК, тиреоидные гормоны, гепарин, сульфинпиразон, симпатомиметики, даназол, трициклические антидепрессанты, клонидин, БМКК, диазоксид, морфин, марихуана, никотин, фенитоин, эпинефрин, блокаторы H1-гистаминовых рецепторов. Бета-адреноблокаторы, резерпин, октреотид, пентамидин могут как усиливать, так и ослаблять гипогликемическое действие инсулина.
Особые указания:
Перед взятием инсулина из флакона необходимо проверить прозрачность раствора. При появлении инородных тел, помутнении или выпадении в осадок субстанции на стекле флакона препарат использоваться не может. Температура вводимого инсулина должна соответствовать комнатной. Дозу инсулина необходимо корректировать в случаях инфекционных заболеваний, при нарушении функции щитовидной железы, болезни Аддисона, гипопитуитаризме, ХПН и сахарном диабете у лиц старше 65 лет. Причинами гипогликемии могут быть: передозировка инсулина, замена препарата, пропуск приема пищи, рвота, диарея, физическое напряжение; заболевания, снижающие потребность в инсулине (далеко зашедшие заболевания почек и печени, а также гипофункция коры надпочечников, гипофиза или щитовидной железы), смена места инъекции (например, кожа на животе, плечо, бедро), а также взаимодействие с др. ЛС. Возможно снижение концентрации глюкозы в крови при переводе больного с инсулина животных на инсулин человека. Перевод больного на инсулин человека должен быть всегда медицински обоснован и проводиться только под контролем врача. Склонность к развитию гипогликемии может ухудшать способность больных к активному участию в дорожном движении, а также к обслуживанию машин и механизмов. Больные сахарным диабетом могут купировать ощущаемую ими самими легкую гипогликемию с помощью приема сахара или пищи с высоким содержанием углеводов (рекомендуется всегда иметь с собой не менее 20 г сахара). О перенесенной гипогликемии необходимо информировать лечащего врача для решения вопроса о необходимости коррекции лечения. При лечении инсулином короткого действия в единичных случаях возможно уменьшение или увеличение объема жировой ткани (липодистрофия) в области инъекции. Этих явлений в значительной степени удается избежать путем постоянной смены места инъекции. В период беременности необходимо учитывать снижение (I триместр) или увеличение (II-III триместры) потребности в инсулине. Во время родов и непосредственно после них потребность в инсулине может резко снизиться. В период лактации необходимо ежедневное наблюдение в течение нескольких месяцев (до стабилизации потребности в инсулине). Больные, получающие более 100 ЕД инсулина в сутки, при смене препарата требуют госпитализации.
Препараты, содержащие действующее вещество Инсулин растворимый [человеческий генно-инженерный]:
Актрапид НМ, Биосулин Р, Гансулин Р, Генсулин Р, Инсулин генно-инженерный человеческий, Инсулин Ч био Р, Инсуман Рапид ГТ, Инсуран Р, Рекомбинантный человеческий инсулин, Ринсулин Р, Росинсулин Р, РОСИНСУЛИН Р Медсинтез, Хумодар Р 100 Рек, Хумулин Р
Информация, приведенная в данном разделе, предназначена для медицинских и фармацевтических специалистов и не должна использоваться для самолечения. Информация приведена для ознакомления и не может рассматриваться в качестве официальной.
Эволюция препаратов базального инсулина: от простого к сложному
- Окминян Гоар Феликсовна
- Латышев Олег Юрьевич
- Киселева Елена Валентиновна
- Касаткина Эльвира Петровна
- Самсонова Любовь Николаевна
Резюме
Инсулинотерапия является основным компонентом терапии сахарного диабета 1-го типа. С момента открытия инсулина в 1920-х гг. и по настоящее время продолжается процесс модернизации инсулинов. За 100 лет инсулинотерапия прошла долгий путь от препаратов инсулина, полученных из поджелудочной железы крупного рогатого скота, до аналогов инсулина II поколения, наиболее близко имитирующих его физиологическую секрецию. В статье представлен обзор эволюции препаратов базального инсулина. Основная тенденция в его модернизации заключается в пролонгации действия. Использование базальных инсулинов II поколения позволяет достигать компенсации сахарного диабета при снижении риска развития гипогликемии.
Ключевые слова:инсулинотерапия, базальный инсулин, гипогликемия, фармакодинамика, фармакокинетика, инсулин длительного действия II поколения
Финансирование.
Исследование не имело спонсорской поддержки.
Конфликт интересов.
Авторы заявляют об отсутствии конфликта интересов.
Для цитирования:
Окминян Г.Ф., Латышев О.Ю., Киселева Е.В., Касаткина Э.П., Самсонова Л.Н. Эволюция препаратов базального инсулина: от простого к сложному // Эндокринология: новости, мнения, обучение. 2022. Т. 10, № 1. C. 18-25. DOI: https://doi.org/10.33029/2304-9529-2021-10-1-18-25
Основными целями лечения сахарного диабета 1-го типа (СД1) являются поддержание концентрации глюкозы в пределах целевого диапазона и минимизация частоты гипогликемии или гипергликемии, которые могут приводить к развитию острых и хронических осложнений заболевания. Инсулинотерапия с момента внедрения в практику и по настоящее время остается единственным методом терапии СД1, так как в основе его развития лежит абсолютный дефицит инсулина, возникающий в результате аутоиммунного повреждения β-клеток поджелудочной железы. Следовательно, инсулинотерапия при СД1 носит заместительный характер и должна максимально имитировать физиологическую секрецию инсулина. Кроме того, эксперты ISPAD, ADA и других профессиональных сообществ регулярно ужесточают требования к компенсации СД1 [1-3]. Для достижения рекомендованного уровня компенсации, максимально близкого к нормальному состоянию уровня углеводного обмена, рекомендуется базис-болюсная инсулинотерапия в режиме многократных инъекций с разделением инсулина на фоновый, или базальный, и пищевой, или прандиальный [4].
История инсулинотерапии
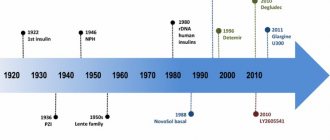
Открытие инсулина считается одним из главных достижений в медицине. В журнале «Lancet» в 2022 г. опубликована статья «100-летие инсулина: рождение идеи», в которой авторы представили на временной шкале несколько возможных этапов, кульминацией которых стало выделение инсулина, подходящего для использования человеком (рис. 1) [5]. 17 мая 1921 г. Фредерик Дж. Бантинг и Чарльз Х. Бест (под руководством Джона Дж.Р. Маклеода) начали доклинические исследования в Университете Торонто. 3 августа 1921 г. сырые экстракты из поджелудочной железы собаки впервые показали эффективность в снижении гипергликемии у этого животного с удаленной поджелудочной железой. Первым пациентом, получившим инсулинотерапию 23 января 1922 г., был подросток — Леонард Томпсон. 14-летний пациент с СД1 из больницы общего профиля Торонто, Канада, впечатляюще отреагировал на инъекции очищенного экстракта инсулина, который был приготовлен доктором Д. Коллипом. Терапия оказалась настолько эффективной, что практически одновременно началось промышленное производство препарата инсулина. В 1923 г. за открытие инсулина Бантингу и Бесту была вручена Нобелевская премия. Авторы статьи, отдавая дань уважения исследованиям канадских врачей, в год столетия знаменательного открытия признают, что любая из этих дат уникальна и заслуживает внимания.
Рис. 1.
История открытия инсулина
С момента получения первого препарата инсулина из поджелудочной железы крупного рогатого скота процесс модификации препаратов инсулина не прекращается [4-7]. Первым шагом в процессе создания современных базальных препаратов было добавление к инсулину, полученному из поджелудочной железы крупного рогатого скота, протамина, что привело к созданию первого пролонгированного инсулина (NPH-инсулина). Для этого потребовалось пройти путь длиной в четверть века, первый препарат с использованием этой технологии был создан в 1946 г. История модификации препаратов базального инсулина развивалась следующим образом. В 1982 г. был впервые разработан рекомбинатный инсулин. Для пролонгирования действия базального рекомбинантного инсулина также использовался протамин. В 2000 г. был впервые представлен аналоговый препарат базального инсулина — гларгин, в 2005 г. второй аналоговый препарат базального инсулина — детемир. А с 2015 г. в эндокринологическую практику введено II поколение аналогов базального инсулина — гларгин 300 ЕД/мл и деглудек [8, 9].
Спектр доступных практическому здравоохранению инсулинов включает короткие и пролонгированные препараты человеческих генно-инженерных инсулинов, препараты аналогов инсулина ультракороткого и длительного действия, комбинации инсулина, концентрированные инсулины, предоставляя широкие возможности для врачей, осуществляющих инсулинотерапию (см. таблицу) [4].
Характеристика инсулинов
Принципы заместительной инсулинотерапии
Главная характеристика любой заместительной гормональной терапии, в том числе инсулинотерапии при СД1, — максимальная имитация физиологической секреции гормона, дефицит которого возник в организме. В целом секреция инсулина, направленная на поддержание определенного уровня гликемии и обеспечивающая энергетическую адаптацию организма к постоянно меняющимся условиям, зависит от большого количества факторов и крайне вариабельна. С 1980-х гг. для имитации физиологической секреции инсулина у пациентов с СД1 используется интенсифицированный, или базис-болюсный, режим введения препаратов, разных по продолжительности действия. Прандиальный инсулин — короткий по продолжительности действия, перед каждым основным приемом пищи необходим для утилизации той глюкозы, которая поступает в кровь после еды, при его введении; важно добиться синхронизации пика активного действия инсулина с пиком всасывания глюкозы. Базальный режим обеспечивает контроль синтеза гликогена и его распад в печени. В качестве базиса используется пролонгированный инсулин.
В физиологических условиях инсулин из поджелудочной железы направляется непосредственно в печень, в систему воротной вены элиминируется примерно половина этого гормона, и лишь остальное количество попадает в периферическое кровообращение. В результате концентрация инсулина в крови воротной вены существенно выше, чем на периферии. При подкожном введении инсулин сначала проходит по большому и малому кругу кровообращения, а затем по печеночным артериям достигает мишени — гепатоцитов. Следовательно, для достижения физиологической концентрации инсулина в печени необходим гораздо более высокий его уровень в периферической крови, чем это бывает у здорового человека. По этой причине при подкожном введении инсулина при сахарном диабете приходится считаться с наличием различной степени периферической гиперинсулинемии.
По времени действия препараты инсулина разделяют на препараты ультракороткого и короткого действия, средней продолжительности и длительного действия. Время действия инсулина определяется уникальной фармакокинетикой и фармакодинамикой каждого инсулина [10, 11]. Фармакокинетика зависит от концентрации инсулина в кровотоке, которая возникает после подкожной инъекции. Фармакодинамика относится к временной динамике воздействия на концентрацию глюкозы в крови. Поскольку все инсулины обладают широким спектром воздействия на организм, они должны назначаться с пониманием фармакокинетики и фармакодинамики для достижения оптимального эффекта — поддержания уровня глюкозы в крови в целевом диапазоне, избегая развития гипогликемических состояний. Модификации как самой молекулы инсулина, так и состава его препаратов позволили максимально приблизиться к естественному инсулиновому ответу. Препараты инсулина разработаны так, чтобы обеспечивать либо его постоянный базальный уровень, либо повышение уровня в ответ на прием пищи.
Механизмы пролонгации действия инсулина
Процесс усовершенствования препаратов инсулина продолжается постоянно. Основные требования к прандиальному инсулину заключаются в способности достигать максимальной концентрации в крови через короткий промежуток времени после введения и достаточно быстрой элиминации из кровотока. Это позволяет достигать синхронизации содержания инсулина и уровня глюкозы после приема пищи, а также избегать гипогликемии в перерывах между приемами пищи.
Рис. 2.
Механизмы пролонгации действия инсулина
Такими характеристиками обладают аналоговые прандиальные инсулины I и II поколения.
Противоположные требования предъявляются к фармакокинетике и фармакодинамике базального инсулина. Основной характеристикой базального инсулина является удлинение времени всасывания молекулы инсулина из места введения в кровоток. Чем медленнее инсулин поступает из подкожной жировой клетчатки в кровоток, тем дольше он находится в организме и тем самым более точно имитирует базальную секрецию собственных β-клеток. Следовательно, основной задачей исследователей является разработка и совершенствование технологий, замедляющих процесс всасывания инсулина из места введения (рис. 2). Все процессы, определяющие длительность действия инсулина в организме, происходят в месте его введения — в подкожной жировой клетчатке [9, 10].
Первым механизмом пролонгации действия инсулина послужило добавление молекулы протамина. Вначале данная технология использовалась при пролонгации действия инсулина, полученного из поджелудочной железы крупного рогатого скота. Позднее, после создания препаратов рекомбинантного инсулина, данная технология была применена для пролонгации его действия [6].
Следующая технология, изменяющая время всасывания инсулина из места введения, — изменение последовательности аминокислот в молекуле инсулина, что приводит к формированию временных связей между ними и образованию крупных комплексов. Высвобождение инсулина из такого комплекса требует времени, что замедляет процесс его всасывания [9, 10].
Также для пролонгации действия инсулина было предложено присоединить к его молекуле жирные кислоты, что приводит к образованию временной обратимой связи с альбумином. Высвобождение инсулина из комплекса с альбумином тоже требует времени и удлиняет время его поступления и действия.
В последние годы был предложен новый механизм пролонгации инсулина, который заключается в повышении концентрации препарата в растворе, что снижает скорость его всасывания [13-15].
Человеческий (рекомбинантный) базальный инсулин NPH
Инсулин NPH относится к инсулинам средней продолжительности действия. После введения препарата инсулина NPH в подкожную жировую клетчатку происходит его замедленное высвобождение из связи с протамином, что определяет фармакологический профиль данной группы препаратов [7]. Однако в процессе использования в клинической практике было выявлено, что препараты NPH обладают рядом недостатков. К ним относится пиковый профиль действия, что создает риск развития гипогликемических состояний в ночные часы, при подборе дозы вечерней инъекции пролонгированного инсулина. Кроме того, высокая вариабельность действия инсулина приводит к непредсказуемым колебаниям уровня глюкозы крови. Вариабельность в том числе обусловлена лекарственной формой препарата — в виде суспензии, что требует перемешивания перед инъекцией. Это дало основание предположить, что и человеческие препараты инсулина не в состоянии полностью имитировать эффекты эндогенного гормона [7, 8].
Аналоги базального инсулина I поколения
В основе идеи создания аналоговых инсулинов пролонгированного действия лежит изменение последовательности аминокислот в молекуле инсулина, или присоединение молекулы жирных кислот, что приводит к изменению процесса всасывания инсулина из подкожной жировой клетчатки и удлинения его действия (рис. 3).
Рис. 3.
Развитие инсулинов
Первым базальным аналоговым инсулином был инсулин гларгин (Лантус®), зарегистрированный в 2000 г., позднее, в 2005 г. был представлен инсулин детемир (Левемир®) [9, 10].
Для получения инсулина гларгин в молекуле человеческого инсулина проведена замена аминокислоты аспарагина на аминокислоту глицин и добавлены 2 аргининовых остатка. Модификация аминокислотной последовательности в молекуле инсулина позволяет веществу находиться в растворимой форме в кислой среде. После введения инсулина гларгин в подкожную жировую клетчатку кислотность среды изменяется на физиологическую, что приводит к формированию микропреципитатов. Постепенное высвобождение инсулина из сформировавшегося депо пролонгирует действие инсулина. Осадок, индуцированный pH, растворяется медленно, обеспечивая профиль времени действия со сглаженным пиком и средней продолжительностью действия до 24 ч. В большинстве случаев гларгин назначают 1 раз в день [6-8].
По-другому осуществляется процесс пролонгации инсулина детемир: к аминокислоте лизин присоединен остаток жирной миристиновой кислоты. В результате после введения инсулина в подкожную жировую клетчатку происходит спонтанное образование дигексамеров. Кроме того, за счет присоединения молекулы жирной кислоты формируется временная связь с молекулой альбумина. Процесс высвобождения инсулина из связи с альбумином требует времени, что и определяет пролонгированное действие инсулина детемир. По сравнению с инсулином NPH у инсулина детемир более медленное начало действия с пиком через 6 ч и продолжительностью действия до 24 ч. Однако по сравнению с инсулином гларгин инсулин детемир имеет более короткую продолжительность действия, и поэтому может потребоваться назначать его 2 раза в день, особенно при низкой дозе препарата [8].
Аналоги базального инсулина I поколения были разработаны для преодоления ограничений ранее применявшихся базальных инсулинов, таких как инсулин NPH, они имеют меньшую вариабельность абсорбции и большую продолжительность действия [6-9].
Аналоги базального инсулина II поколения
Несмотря на высокую эффективность и безопасность, в частности более низкую частоту гипогликемии, при использовании аналогов базального инсулина I поколения по сравнению с NPH-инсулинами фармакологический профиль этих препаратов отличается от базальной секреции эндогенного инсулина. При использовании аналогов базального инсулина сохраняются риски развития гипогликемии. Гипогликемия, с одной стороны, является острым жизнеугрожающим состоянием. С другой стороны, страх развития гипогликемии лимитирует врача и пациента при титрации дозы инсулина. Вторая проблема — недостаточная длительность действия инсулина. Это определило необходимость дальнейшей модификации и совершенствования аналоговых препаратов базального инсулина (рис. 4). Кроме того, многие пациенты с СД1 все еще испытывают заметные различия в уровнях глюкозы в течение дня. Эти часто непредсказуемые колебания гликемии затрудняют оптимизацию доз инсулина и достижение желаемых гликемических целей. Следовательно, базальный инсулин, который ведет к более стабильному контролю глюкозы с уменьшенным риском гипогликемии, обеспечит явное клиническое преимущество. Поиск базального инсулина с более чем 24-часовой продолжительностью действия и «плоским профилем» привел к тому, что в арсенале эндокринологов появились аналоги базального инсулина II поколения сверхдлительного действия. К ним относятся препараты деглудек и гларгин 300 ЕД/мл [6-8].
Рис. 4.
Эволюция аналогов базального инсулина: преодоление ограничений
При разработке препарата деглудек использована следующая технология пролонгации инсулина: в молекуле аминокислота треонин удалена и к лизину присоединена боковая цепь, состоящая из глутаминовой кислоты и 16-углеродной жирной кислоты с концевой группой карбоновой кислоты. Благодаря подобной структуре инсулин деглудек существует в растворе в виде дигексамеров, которые после подкожной инъекции быстро самоассоцируются, образуя мультигексамерные комплексы. Их образование значительно замедляет процесс диссоциации и последующее всасывание мономера. Связывание мономеров с альбумином в кровотоке также замедляет распределение деглудека в периферических тканях и выведение его из организма, что приводит к пролонгации действия. Инсулин деглудек имеет продолжительность действия не менее 42 ч [8].
Другая технология пролонгации действия инсулина разработана для инсулина гларгин 300 (Туджео®). Троекратно концентрированная версия инсулина гларгина была разработана для увеличения продолжительности действия. Формула молекулы инсулина в препарате гларгин 300 ЕД/мл полностью соответствует препарату гларгин 100 ЕД/мл. Однако в препарате гларгин 300 ЕД/мл то же самое количество вещества растворено в меньшем объеме. В результате такой модификации пространство, занимаемое инсулином после введения в подкожную жировую клетчатку, уменьшается, что приводит к снижению скорости поступления инсулина в кровоток. Гларгин 300 ЕД/мл отличается от гларгина 100 ЕД/мл более плавным фармакокинетическим профилем и длительностью действия (до 36 ч) за счет снижения объема вводимого препарата, уменьшения площади поверхности подкожного депо, более медленного и плавного высвобождения из депо [11].
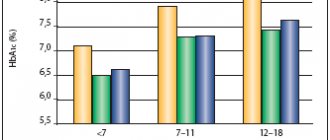
Фармакологические характеристики инсулин гларгин 300 ЕД/мл в сравнении с таковыми инсулина гларгин 100 ЕД/мл изучены в многочисленных исследованиях. Проанализированы и опубликованы результаты 6 многоцентровых рандомизированных исследований из серии EDITION с участием пациентов с СД1 и СД2, объединенных схожим дизайном. Эффективность и безопасность гларгина 300 ЕД/мл по сравнению с гларгином 100 ЕД/мл проанализирована у пациентов с СД1 в 3 международных рандомизированных открытых исследованиях III фазы: EDITION 4, EDITION JP и EDITION JUNIOR [12-14]. Конечными точками оценки эффективности были изменение среднего уровня гликированного гемоглобина, средней концентрации глюкозы в плазме натощак как по данным лабораторного исследования, так и по результатам самоконтроля через 26 нед по сравнению с исходными показателями. Конечные точки безопасности включали частоту эпизодов тяжелой гипогликемии от исходного уровня до 6-го месяца (основной период лечения), от исходного уровня до 8-й недели (период титрования) и от 9-й недели до 6-го месяца (период поддерживающего лечения). К тому же были проанализированы изменения средней дозы инсулина и массы тела по сравнению с исходным уровнем до 26-й недели, а также побочные явления, включая частоту диабетического кетоацидоза и других серьезных осложнений [12].
Результаты исследования показали сопоставимую эффективность препарата гларгин 300 ЕД/мл, сходное снижение уровня гликированного гемоглобина и глюкозы плазмы натощак от исходного уровня по сравнению с инсулином гларгин 100 ЕД/мл. При этом сходная эффективность 2 препаратов инсулина была достигнута за счет более низкой частоты тяжелой гипогликемии в случае использования препарата гларгин 300 ЕД/мл независимо от времени инъекции и меньшим набором массы тела.
Задача еще одного исследования, посвященного эффективности и безопасности базального инсулина II поколения при СД1, заключалась в сравнении контроля гликемии у пациентов, получавших инсулин гларгин 300 ЕД/мл и гларгин 100 ЕД/мл с использованием технологии непрерывного мониторирования глюкозы (рис. 5) [15, 16]. В качестве основного исхода исследования выбран такой показатель, как время нахождения в целевом диапазоне, который в настоящее время рассматривается в качестве альтернативы гликированному гемоглобину при оценке эффективности инсулинотерапии. В качестве дополнительных исходов выбраны параметры гликемического контроля, получаемые при проведении непрерывного мониторирования глюкозы, и частота гипогликемии по данным самоконтроля.
Рис. 5.
Эволюция технологии мониторирования уровня глюкозы
Результаты исследования показали, что время нахождения в целевом диапазоне было сопоставимо между группами пациентов, получавших гларгин 300 и гларгин 100 ЕД/мл. Но был показан более низкий прирост уровня глюкозы в крови в течение последних 4 ч 24-часового интервала между инъекциями. Кроме того, усредненные 24-часовые кривые гликемии в группе гларгин 300 ЕД/мл были более плавными (более низкая вариабельность) независимо от времени инъекции (утро или вечер). Как и в исследовании EDITION, частота подтвержденной ночной гипогликемии и тяжелой гипогликемии была ниже в группе пациентов, получавших гларгин 300 ЕД/мл, по сравнению пациентами, использующими гларгин 100 ЕД/мл [15, 16].
Предсказуемые профили времени действия аналогов инсулина пролонгированного действия II поколения со сглаженными пиками и увеличенной продолжительностью действия лучше имитируют секрецию эндогенного базального инсулина по сравнению с инсулинами средней продолжительности действия. Эти свойства аналогов пролонгированного действия также могут снизить риск гипогликемии, особенно в ночное время.
Открытие инсулина ознаменовало новую эру для людей с СД, которая привела к значительному увеличению продолжительности и улучшению качества жизни. Конечная цель инсулинотерапии — имитировать физиологическую секрецию инсулина, а достижения в области разработок препаратов базального инсулина привели к созданию нового поколения аналоговых препаратов инсулина длительного действия. Применение этих препаратов позволяет добиваться лучшей компенсации СД, в том числе за счет снижения риска развития гипогликемии. Инсулин прошел путь от плохо определенных экстрактов поджелудочной железы животных до чистых и точно контролируемых препаратов, которые можно назначать и вводить с высокой точностью и предсказуемостью действия.
Прошедшее столетие стало временем перемен и инноваций в области инсулинотерапии, начиная с выделения инсулина, очистки и концентрирования экстрактов поджелудочной железы животных, разработки препаратов с пролонгированным действием, перехода к человеческому инсулину и далее к аналогам человеческого инсулина, полученным с помощью технологии рекомбинантной ДНК.
Литература
1. DiMeglio L.A., Acerini C.L., Codner E., Craig M.E., Hofer S.E., Pillay K. et al. ISPAD Clinical Practice Consensus Guidelines 2018: Glycemic control targets and glucose monitoring for children, adolescents, and young adults with diabetes // Pediatr. Diabetes. 2018. Vol. 19, suppl. 27. P. 105-114. DOI: https://doi.org/10.1111/pedi.12737 PMID: 30058221.
2. Battelino T., Danne T., Bergenstal R.M., Amiel S.A., Beck R., Biester T. et al. Clinical targets for continuous glucose monitoring data interpretation: recommendations from the International Consensus on Time in Range // Diabetes Care. 2022. Vol. 42, N 8. P. 1593-1603. DOI: https://doi.org/10.2337/dci19-0028 PMID: 31177185; PMCID: PMC 6973648.
3. American Diabetes Association. Glycemic Targets: Standards of Medical Care in Diabetes-2020 // Diabetes Care. 2022. Vol. 43, suppl. 1. P. S 66-S 76. DOI: https://doi.org/10.2337/dc20-S006 PMID: 31862749.
4. Алгоритмы специализированной медицинской помощи больным сахарным диабетом / под ред. И.И. Дедова, М.В. Шестаковой, А.Ю. Майорова. 9-й вып. Москва : УП ПРИНТ, 2022.
5. Hegele R.A., Maltman G.M. Insulin’s centenary: the birth of an idea // Lancet Diabetes Endocrinol. 2022. Vol. 8, N 12. P. 971-977. DOI: https://doi.org/10.1016/S2213-8587(20)30337-5 PMID: 33129375.
6. Garber A.J. Will the next generation of basal insulins offer clinical advantages? // Diabetes Obes. Metab. 2014. Vol. 16, N 6. P. 483-491. DOI: https://doi.org/10.1111/dom.12219 PMID: 24118819.
7. Bolli G.B., Andreoli A.M., Lucidi P. Optimizing the replacement of basal insulin in type 1 diabetes mellitus: no longer an elusive goal in the post-NPH era // Diabetes Technol. Ther. 2011. Vol. 13, suppl. 1. P. S 43-S 52. DOI: https://doi.org/10.1089/dia.2011.0039 PMID: 21668336.[11]
8. Hirsch I.B., Juneja R., Beals J.M., Antalis C.J., Wright E.E. The Evolution of insulin and how it informs therapy and treatment choices // Endocr. Rev. 2022. Vol. 41, N 5. P. 733-755. DOI: https://doi.org/10.1210/endrev/bnaa015
9. Pettus J., Santos Cavaiola T., Tamborlane W.V., Edelman S. The past, present, and future of basal insulins // Diabetes Metab. Res. Rev. 2016. Vol. 32, N 6. P. 478-496. DOI: https://doi.org/10.1002/dmrr.2763 PMID: 26509843.
10. Cheng A.Y.Y., Patel D.K., Reid T.S., Wyne K. Differentiating basal insulin preparations: understanding how they work explains why they are different // Adv. Ther. 2022. Vol. 36, N 5. P. 1018-1030. DOI: https://doi.org/10.1007/s12325-019-00925-6
11. Heise T., Mathieu C. Impact of the mode of protraction of basal insulin therapies on their pharmacokinetic and pharmacodynamic properties and resulting clinical outcomes // Diabetes Obes. Metab. 2022. Vol. 19, N 1. P. 3-12. DOI: https://doi.org/10.1111/dom.12782 PMID: 27593206; PMCID: PMC 5215074.
12. Home P.D., Bergenstal R.M., Bolli G.B., Ziemen M., Rojeski M., Espinasse M. et al. New insulin glargine 300 units/mL versus glargine 100 units/mL in people with type 1 diabetes: a randomized, phase 3a, open-label clinical trial (EDITION 4) // Diabetes Care. 2015. Vol. 38, N 12. P. 2217-2225. DOI: https://doi.org/10.2337/dc15-0249 PMID: 26084341.
13. Anderson J.E. An evolutionary perspective on basal insulin in diabetes treatment: innovations in insulin: insulin glargine U-300 // J. Fam. Pract. 2016. Vol. 65, N 10. Suppl. P. S 23-S 28. PMID: 27846339.
14. Danne T., Matsuhisa M., Sussebach C. et al. Lower risk of severe hypoglycaemia with insulin glargine 300 U/mL versus glargine 100 U/mL in participants with type 1 diabetes: a meta-analysis of 6-month phase 3 clinical trials // Diabetes Obes. Metab. 2022. Vol. 22, N 10. P. 1880-1885. DOI: https://doi.org/10.1111/dom.14109
15. Bergenstal R.M., Bailey T.S., Rodbard D., Ziemen M., Guo H., Muehlen-Bartmer I. et al. Comparison of insulin glargine 300 units/mL and 100 units/mL in adults with type 1 diabetes: continuous glucose monitoring profiles and variability using morning or evening injections // Diabetes Care. 2022. Vol. 40, N 4. P. 554-560. DOI: https://doi.org/10.2337/dc16-0684 PMID: 28115474.
16. Subramanian S., Baidal D., Skyler J.S., Hirsch I.B. The management of type 1 diabetes. 2016 Nov 16. In: K.R. Feingold, B. Anawalt, A. Boyce, G. Chrousos, W.W. de Herder, K. Dungan et al. (eds). Endotext [Internet]. South Dartmouth, MA: MDText.com, 2000. PMID: 25905338.
Актрапид нм инсулин растворимый (генно-инженерный) раствор для инъекций 100ме/мл 10мл №1
Побочные действия
Побочные реакции, отмечавшиеся у пациентов на фоне терапии препаратом Актрапид НМ, преимущественно были дозо-зависимыми и были обусловлены фармакологическим действием инсулина. Как и при применении других препаратов инсулина, наиболее частым побочным эффектом является гипогликемия. Она развивается в случаях, когда доза инсулина значительно превышает потребность в нем. В ходе клинических исследований, а также в ходе применения препарата после его выпуска на потребительский рынок было установлено, что частота гипогликемии различна у разных популяций пациентов и при использовании различных режимов дозирования, поэтому указать точные значения частоты не представляется возможным.
При тяжелой гипогликемии могут отмечаться потеря сознания и/или судороги, может произойти временное или постоянное нарушение функции головного мозга и даже смерть. Клинические исследования показали, что частота гипогликемии в целом не различалась у пациентов, получавших человеческий инсулин, и у пациентов, получавших инсулин аспарт.
Ниже приводятся значения частоты побочных реакций, выявленных в ходе клинических исследовании, которые были расценены как связанные с применением препарата Актрапид НМ. Частота определялась следующим образом: нечасто ( > 1/1000,
Со стороны иммунной системы: нечасто — крапивница, сыпь, очень редко — анафилактические реакции. Симптомы генерализованной гиперчувствительности могут включать генерализованную кожную сыпь, зуд, потливость, нарушения со стороны органов ЖКТ, ангионевротический отек, одышку, сердцебиение, снижение АД, Обморок / потерю сознания . Реакции генерализованной гиперчувствительности могут создавать угрозу для жизни.
Со стороны нервной системы: очень редко — периферическая нейропатия. Если улучшение контроля уровня глюкозы в крови было достигнуто очень быстро, может развиться состояние, называемое острая болезненная невропатия, которое обычно обратимо.
Со стороны органа зрения: нечасто нарушения рефракции. Нарушения рефракции обычно отмечаются на начальном этапе инсулинотерапии. Как правило, эти симптомы носят обратимый характер, очень редко — диабетическая ретинопатия. Если в течение длительного времени обеспечивается адекватный контроль гликемии, то риск прогрессирования диабетической ретинопатии снижается. Однако интенсификация инсулинотерапии с резким улучшением контроля гликемии может приводить к временному усилению выраженности диабетической ретинопатии.
Со стороны кожи и подкожных тканей: нечасто липодистрофия. Липодистрофия может развиваться в месте проведения инъекций в том случае, когда не осуществляют постоянную смену места инъекции в пределах одной области тела.
Со стороны организма в целом, а также реакции в месте введения препарата: нечасто реакции в месте проведения инъекции. На фоне терапии инсулином могут возникать реакции в месте проведения инъекции (покраснение кожи, припухлость, зуд, болезненность, образование гематомы в месте проведения инъекции). Однако в большинстве случаев эти реакции носят преходящий характер и в процессе продолжения терапии исчезают. Отечность обычно отмечается на начальном этапе инсулинотерапии. Как правило, этот симптом носит преходящий характер.
Биосимиляры аналогов инсулина: что мы должны о них знать
Использование биотехнологических препаратов в разных отраслях медицины значительно изменило прогноз многих тяжелых заболеваний. Инсулин гларгин – первый и наиболее изученный аналог инсулина длительного действия. В связи с тем что срок патентной защиты многих аналогов инсулина, в том числе инсулина гларгина, близится к окончанию, открываются возможности для создания их версий, или биосимиляров. Однако высокая сложность молекулярного строения и особые технические требования к производству биопрепаратов не позволяют относиться к биосимилярам как к воспроизведенным копиям химических лекарственных средств. В данной статье рассматриваются существующие и потенциальные проблемы, связанные с производством, регистрацией и использованием биосимиляров инсулина гларгина: современные европейские требования к подтверждению биоэквивалентности препаратов, вариабельность действия гларгина и его биосимиляров, особенности их фармакокинетики и фармакодинамики, а также иммуногенные и онкогенные свойства.
Рисунок. Значения LBGI в ночные часы на разных видах базального инсулина (показаны медианы и квартили)
Особенности синтеза биотехнологических препаратов
Технический прогресс в области биологии и медицины, ускоряющийся с каждым десятилетием, радикально изменил прогноз многих тяжелых заболеваний. Так, в начале прошлого столетия совершенно новые возможности в лечении сахарного диабета (СД) дало открытие инсулина. В 1974 г. был осуществлен полный химический синтез человеческого инсулина [1], а чуть позже появился генно-инженерный человеческий инсулин, который стал первым патентованным препаратом, синтезированным с помощью технологии рекомбинантной ДНК. В 1982 г. он был одобрен для клинического использования [2].
Все современные препараты инсулина относятся к классу лекарственных средств, производимых с помощью биотехнологий. Медицинской биотехнологией называют методы получения лекарств из живых клеток – бактерий, вирусов, дрожжевых грибов, культур клеток различных тканей. В отличие от химического синтеза препаратов процесс создания биоинженерных препаратов гораздо более чувствителен к деталям технологии: требуются тщательный выбор и очистка субстрата, точнейшее соблюдение температурного режима, использование строго определенных концентраций растворов и т.д.
Препараты, синтезируемые химическим путем, имеют сравнительно простую химическую структуру и способ производства. Воспроизведенная копия такого препарата (дженерик) должна содержать активное вещество с той же молекулярной структурой и физико-химическими, фармакокинетическими свойствами, иметь такую же активность, лекарственную форму и путь введения, что и оригинальный препарат. Из-за хорошей воспроизводимости технологии получения химических лекарств доказательства биоэквивалентности достаточно, чтобы считать дженерик идентичным оригинальному препарату, дополнительных клинических испытаний не требуется [3]. Поэтому для дженериков предусмотрена сокращенная процедура регистрации, что приводит к снижению их себестоимости.
Иначе обстоит дело с биотехнологическими препаратами. Воспроизвести точную копию молекулы такого препарата практически невозможно, так как биоинженерные препараты представляют собой белки. Белки имеют высокую молекулярную массу (в 100–1000 раз больше, чем у обычных химических препаратов) и крайне сложную структуру молекулы, включающую первичный, вторичный, третичный и иногда четвертичный уровни. В процессе формирования пространственной структуры, отвечающей за биологические свойства, молекула белка значительно модифицируется за счет внутримолекулярных сшивок, вырезаний частей молекулы, присоединения различных химических групп. Именно поэтому даже очищенный оригинальный препарат неоднороден и представлен целым рядом белковых молекул, незначительно различающихся между собой [4], а малейшие изменения технологии синтеза могут существенно изменить биологические свойства конечного продукта [5].
Кроме того, культуры клеток, в которых происходит биосинтез, высоко изменчивы. Внедрение в клетку нужного фрагмента ДНК каждый раз приводит к получению несколько отличной рекомбинантной ДНК. Однажды созданная линия рекомбинантных клеток уникальна. Эта линия дает начало оригинальному банку клеток, к характеристикам которого приспосабливается весь дальнейший процесс производства препарата [5, 6]. Следовательно, получить точную копию биопрепарата, используя другой банк клеток, принципиально невозможно.
Биосимиляры
Истечение срока патентной защиты оригинального биопрепарата открывает возможность для создания его версии, или биосимиляра (англ. biological drug – биологический препарат и similar – похожий). Биосимиляр – это воспроизведенное при помощи биотехнологий лекарственное средство, схожее с оригинальным биотехнологическим лекарственным средством и представленное на регистрацию по истечении срока действия патента оригинального лекарственного средства.
Это различие важно понимать, назначая неоригинальные синтетические и биотехнологические препараты.
Биосимиляры – это не дженерики. Та степень сходства, которая существует между оригинальным химическим препаратом и его дженериком, недостижима в области биотехнологических продуктов. Введение отдельного термина для версий биопрепаратов жестко разграничивает группы воспроизводимых препаратов.
Последствия, к которым может привести отличие структуры биосимиляра от структуры соответствующего оригинального препарата, непредсказуемы. Имеются данные о развитии смертельно опасного осложнения после небольшого изменения технологии производства рекомбинантного эритропоэтина [7]. Именно поэтому европейские специалисты отмечают, что сокращенная процедура регистрации, принятая для дженериков, неприемлема для биосимиляров [8, 9].
Впервые термин «биосимиляр» и его определение появились в 2003 г. в директиве Европейского союза, где подчеркивалась важность отличий биосимиляров от дженериков [10]. Впоследствии Европейское агентство по лекарственным средствам (European Medicines Agency – EMA) разработало ряд руководств, касающихся биопрепаратов и биосимиляров, которые регулярно пересматриваются и обновляются [11–13]. Данные руководства содержат требования к проведению доклинических и клинических исследований биосимиляров [12], оценке иммуногенности [13] и др. Согласно требованиям EMA биосимиляр прежде всего должен обладать высокой степенью сходства с оригинальным препаратом как по физико-химическим, так и по биологическим свойствам. Рекомендуется ступенчатый подход к сравнению оригинальных препаратов и биосимиляров, включающий доклинические и клинические этапы. При этом объем исследований на каждом следующем этапе зависит от результатов предыдущего [12]. Принципы, заложенные в этих документах, отразились в законодательстве некоторых стран.
Российская законодательная база по биосимилярам в настоящее время находится на стадии разработки. В 2013 г. была опубликована позиция Российской ассоциации эндокринологов в отношении биологических препаратов [14]. Проект федерального закона «О внесении изменений в Федеральный закон № 61 “Об обращении лекарственных средств”», касающийся создания нормативно-правовой базы по регистрации лекарственных препаратов, сначала обсуждался в рамках экспертной сессии, посвященной проблеме биосимиляров (2014) [15], а затем публично. После этого в Федеральном законе № 61 были сделаны соответствующие поправки и изменения. Так, в ст. 4 появились термины «биологический лекарственный препарат», «биоаналоговый лекарственный препарат (биоаналог)», «препарат сравнения», «взаимозаменяемые лекарственные препараты». В ноябре 2014 г. законопроект был принят Госдумой во втором чтении, в декабре подписан Президентом РФ. Предполагается, что большинство норм закона вступят в силу с 2016 г. [16, 17].
Биосимиляры человеческого инсулина и его аналогов: подтверждение соответствия
В настоящее время проблемы создания и оценки эффективности биосимиляров особенно актуальны для аналогов человеческого инсулина.
С начала 2000-х гг. целый ряд компаний начал производство неоригинальных препаратов рекомбинантного человеческого инсулина в странах, где регулирующие правовые нормы в отношении биопрепаратов не были развиты или отсутствовали. Так, в Польше был выведен на рынок Генсулин, в Индии – Инсуген, Восулин, Биосулин N, Биосулин R и Биосулин 30/70 [2].
В России также используются препараты рекомбинантного инсулина человека различных производителей. Сравнительный анализ их фармакокинетических характеристик показал, что разные препараты инсулина с одинаковым международным непатентованным наименованием имеют колоссальные различия по времени начала действия, пику и продолжительности действия, а также составу дополнительных ингредиентов [18], что, несомненно, влияет на эффективность инсулинотерапии.
Именно поэтому для биосимиляров инсулина EMA рекомендует проведение следующего минимума клинических исследований [19]:
- фармакокинетики – не менее одного однодозового перекрестного исследования с подкожным введением, предпочтительно у пациентов с СД 1 типа;
- фармакодинамики. Проведение тестов, демонстрирующих эквивалентность инсулинов, в частности двойных слепых перекрестных исследований с использованием эугликемического гиперинсулинемического клэмпа, отражающих соотношение «время – эффект», с предоставлением данных о скорости инфузии глюкозы и концентрации инсулина, а также обоснованием выбора популяции;
- эффективности биосимиляра и оригинального инсулина (достаточно сравнить уровень гликированного гемоглобина (HbA1c));
- иммуногенности инсулина (продолжительность исследования не менее шести месяцев).
В настоящее время биосимиляры аналогов инсулина, в том числе инсулина гларгина, получили доступ на рынок в таких странах, как Китай, Индия, Пакистан, Перу, Таиланд, Мексика и Кения [2, 6]. В большинстве из них версии инсулина зарегистрированы без соблюдения требований к демонстрации идентичности оригинальному препарату Лантус () [6].
Так, в Китае эффективность Базалина (препарата, позиционируемого как «отечественный» гларгин) и его биоэквивалентность Лантусу были установлены только на основании результатов эугликемического клэмпа у здоровых добровольцев. В другом исследовании биоэквивалентность воспроизведенного в Китае препарата и оригинального гларгина была установлена на основании показателей тощаковой и постпрандиальной гликемии у пациентов с СД 2 типа при применении инсулина в комбинации с пероральными сахароснижащими препаратами. В 2006 г. производство Базалина начато китайско-корейской корпорацией. В 2009 г. в Колумбии заявка местного производителя на регистрацию Базалина была отклонена в связи с отсутствием иммуногенетических исследований [2].
Гларитус, один из первых биосимиляров гларгина, был зарегистрирован в Индии () в 2009 г. [20]. В настоящее время его иммуногенность и безопасность по сравнению с Лантусом еще оцениваются в рандомизированном открытом исследовании фазы III с участием пациентов с СД 1 типа (NCT01352663). Завершение работы планируется не раньше января 2016 г. [21]. Для демонстрации биоэквивалентности Гларитуса Лантусу проводилось сравнительное исследование фазы I с использованием клэмп-методов (NCT01357603). Исследование завершено в августе 2012 г., однако его результаты пока не опубликованы [22].
Еще одна неоригинальная версия гларгина, которая производится в Индии с 2009 г. , – препарат Базалог. В многоцентровом рандомизированном открытом исследовании фазы III с участием 215 пациентов с СД 1 типа было показано, что применение Базалога и Лантуса позволяет достичь сравнимого гликемического контроля. Такое заключение сделано на основании уровня HbA1c, частоты эпизодов гипогликемии, тощаковой и постпрандиальной гликемии. Однако в протоколе исследования не предусматривалось проведения эугликемического клэмпа [23].
Из аналогов инсулина длительного действия потенциальным образцом для создания биосимиляров являются гларгин и детемир. Однако данные о разработке версий последнего пока отсутствуют. При этом имеются сведения о попытках создать версии аналогов инсулина ультракороткого действия, таких как лизпро и аспарт [6].
Вариабельность действия аналогов инсулина и биосимиляров
Известно, что метаболические эффекты, индуцированные одной и той же дозой инсулина, существенно различаются у разных людей (межиндивидуальная вариабельность действия) и даже у одного человека (интраиндивидуальная вариабельность действия). Данные различия могут быть связаны с особенностями скорости абсорбции и метаболизма инсулина (фармакокинетический аспект вариабельности), а также действия инсулина на чувствительные клетки (фармакодинамический аспект). Для оценки фармакокинетической вариабельности определяют концентрацию инсулина в плазме крови, для оценки фармакодинамической вариабельности применяют клэмп-методы.
Высокая вариабельность кинетики и действия инсулина затрудняет подбор дозы и повышает риск развития гипогликемий [24]. Именно поэтому EMA требует при сравнении биосимиляра с оригинальным инсулином приводить результаты эугликемического гиперинсулинемического клэмпа, в том числе временной профиль введения раствора глюкозы [19].
В исследованиях с использованием клэмп-методов у гларгина по сравнению с НПХ-инсулинами было показано более раннее начало и более равномерный профиль действия c достижением стабильного плато [25]. У больных СД 1 типа межиндивидуальная фармакокинетическая и фармакодинамическая вариабельность гларгина в дозе 0,3 ЕД/кг была достоверно ниже таковой НПХ-инсулина (р
С вариабельностью действия инсулина связана вариабельность гликемии (ее колебания в течение суток), для оценки которой сегодня существует около 30 различных методов [27]. Так, в многоцентровом исследовании, включавшем 116 больных СД 2 типа (уровень HbA1c 4,5–8%), оценивалось влияние перевода с НПХ-инсулина на гларгин на показатели вариабельности гликемии, рассчитанные по данным непрерывного мониторинга. После перевода на гларгин наблюдалось значительное увеличение площади под кривой гликемии (AUC), ограниченной нормальными значениями, уменьшение AUC в зоне гипергликемии, а также снижение суточных колебаний уровня глюкозы [28].
При оценке действия пролонгированных аналогов инсулина наиболее показательны данные по вариабельности гликемии в ночные часы и натощак. Так, анализ показателей ночной вариабельности гликемии, в частности высокочувствительного индекса риска гипогликемии (low blood glucose index – LBGI), у пациентов с СД 2 типа, получавших гларгин (n = 27) и НПХ-инсулин (n = 22), продемонстрировал значительное снижение LBGI на фоне применения гларгина по сравнению с НПХ-инсулином (p = 0,04) (рисунок) [29].
Таким образом, снижение вариабельности гликемии, достигаемое за счет снижения вариабельности действия препарата, – одно из главных преимуществ гларгина перед пролонгированными человеческими инсулинами. Это служит основанием для перевода на гларгин тех пациентов, у которых отмечаются резкие колебания гликемии.
Однако можно ли утверждать, что описанный эффект будет выражен в той же степени у биосимиляров гларгина?
Феномен вариабельности действия разных препаратов одного и того же инсулина обусловлен рядом факторов. Первый – особенности производства и хранения инсулина.
Производство инсулина – сложный многостадийный процесс, включающий [6, 18]:
1) подготовку отрезка ДНК, кодирующей молекулу инсулина (вектора);
2) выбор платформы или «хозяина», то есть тех клеток, в ДНК которых будет интегрирован вектор и которые затем будут производить инсулин. Обычно это бактерии (Escherichia coli
) или грибы (Saccharomyces cerevisiae или Pichia pastoris);
3) трансфекцию, то есть перенос векторной ДНК в генетический аппарат «хозяина»;
4) отбор клеток и выделение клеточной линии, содержащих рекомбинантную ДНК;
5) культивирование клеток в питательной среде, в которой нарабатываются продукты их жизнедеятельности, в том числе белок, закодированный векторной ДНК;
6) извлечение и очистку продукта от С-пептида (при использовании E. coli
);
7) формирование вторичной структуры инсулина путем образования дисульфидных мостиков и отщепления ненужных аминокислотных последовательностей (при использовании E. coli,
при использовании грибов белок секретируется в питательную среду уже сформированным в нужную пространственную структуру);
 очистку и концентрацию с использованием кристаллизации и хроматографии, лиофилизацию, изготовление лекарственной формы.
очистку и концентрацию с использованием кристаллизации и хроматографии, лиофилизацию, изготовление лекарственной формы.
На любой стадии производства белкового препарата могут появиться различия, затрагивающие как первичную структуру молекулы, так и ее финальную пространственную упаковку, определяющую биологические свойства. Кроме того, возможно образование побочных продуктов, связанных с экспрессией вектора и ведущих к различиям в процессинге белка (например, окисление и гликозилирование). Так, для производства Лантуса, оригинального гларгина, в качестве платформы используется E. coli
, а для синтеза Базалога – грибы
Pichia pastoris
. Это приводит к прикреплению трех дополнительных полисахаридных остатков к молекуле Базалога.
Известно, что другие различия в используемых материалах и методах биосинтеза и хранения продукта (условия культивации, состав питательной среды, дизайн оборудования) также вносят вклад в вариабельность свойств конечного продукта [6].
Еще одна важная задача – сохранить неизменность препарата. Данные кристаллографии свидетельствуют, что позиция А21 в молекуле инсулина аргинин-B31-аргинин-B32 вовлекается в несколько межгексамерных контактов. Замена аспарагина в позиции А21 на глицин (глицин A21) привела к уменьшению количества межгексамерных связей, то есть меньшей кристаллизации, что обеспечило стабильность при длительном хранении [1].
Проводилось сравнение уровня белков с высокой молекулярной массой (high molecular weight proteins – HMWP) до и после хранения при температуре +25 °C в оригинальном и неоригинальных препаратах гларгина. Оказалось, что уровень HMWP исходно находился в пределах допустимых значений во всех образцах, через 28 дней хранения он значительно превышал норму в образцах Гларитуса и Базалина, оставаясь практически неизменным в образце Лантуса [6].
Второй фактор вариабельности действия – техника инъекции инсулина. Биосимиляры аналогов инсулина, как правило, поставляются на рынок с собственными устройствами для введения (инъекторами, или шприц-ручками). Согласно руководству EMA устройства для введения инсулина также подлежат жесткому контролю качества [30].
Не так давно проведены испытания инъекторов Pen Royale и DispoPen, предназначенных для введения Гларитуса, инъектора GanLee Pen для Базалина, инъекторов ClikSTAR и SoloSTAR для Лантуса. Показано, что неоригинальные устройства имеют более высокий коэффициент вариации при введении определенных доз инсулина. Сила, необходимая для инъекции инсулина, оказалась выше у инъекторов, предназначенных для введения биосимиляров [31].
Иммуногенная и митогенная активность аналогов инсулина и биосимиляров
Инсулин, как и любой биопрепарат, может вызывать реакцию иммунной системы. Среди возможных причин выделяют измененную структуру белка действующего вещества и наличие примесей (например, фрагментов клеток-продуцентов или продуктов реакции с вспомогательными веществами). Иммунная реакция может проявляться по-разному – от выработки антител, не снижающих эффективность терапии, до полной нейтрализации и инактивации инсулина антителами.
Есть предположение, что основная причина выработки антител на рекомбинантный человеческий инсулин – его способность к агрегации в мультимеры. Возможной причиной агрегации считается взаимодействие инсулина с покрытиями, встречающимися в процессе производства, хранения и введения. Агрегаты усиливают иммуногенность экзогенного инсулина, изменяя толерантность В-лимфоцитов, так как представляют повторяющиеся эпитопы, «напоминающие» бактериальные антигены и вызывающие образование специфических антител [6, 32].
ΕΜΑ предписывает тщательно изучать иммуногенность биопрепаратов [13]. При этом первичной конечной точкой является формирование антител к биопрепарату. В настоящее время иммуногенные свойства большинства биосимиляров изучены недостаточно.
Как и человеческий инсулин, гларгин оказывает метаболический и рост-стимулирующий (митогенный) эффекты в клетках-мишенях. Митогенный эффект реализуется главным образом через рецепторы инсулиноподобного фактора роста 1 (ИФР-1). Известно, что в условиях in vitro
способность гларгина вызывать активацию (аутофосфорилирование) рецептора ИФР-1 в пять – восемь раз выше, чем у нативного инсулина. Однако в условиях
in vivo
избыточной стимуляции рецептора ИФР-1 не происходит. Дело в том, что в организме гларгин трансформируется с образованием двух основных метаболитов – M1 и M2, а также промежуточного продукта IM. Сначала с карбоксильного конца В-цепи удаляется остаток аспарагина (образуется промежуточный метаболит IM), далее – еще один аспарагиновый остаток с того же конца, при этом В-цепь становится идентичной таковой в молекуле инсулина человека (метаболит М1). Биотрансформация начинается уже в месте инъекции и значительно ускоряется в плазме [24]. В итоге основным метаболитом гларгина является M1: он быстро попадает в кровоток и его концентрация в течение 24 часов преобладает над концентрацией интактного гларгина и всех других метаболитов [33, 34]. Отщепление дополнительных аргининовых остатков в процессе биотрансформации нивелирует повышенную способность гларгина к стимуляции рецептора ИФР-1 [33, 35].
Последние эксперименты на двух линиях клеток рака молочной железы человека (MCF-7), в различной степени экспрессирующих рецептор ИФР-1 и инсулиновый рецептор, показали, что пролиферативный эффект гларгина не отличается от эффекта человеческого инсулина и других инсулиновых аналогов. Митогенные свойства, связанные с активацией сигнального пути ИРФ-1, не сопровождались усилением пролиферативного ответа из-за быстрого превращения гларгина в метаболиты М1 и М2 [36]. Анализ результатов экспериментальных исследований, посвященных митогенным свойствам инсулиновых аналогов, продемонстрировал, что пролиферативный и онкогенный потенциал гларгина не отличается от потенциала инсулина человека [37].
Согласно требованиям EMA в обязательные доклинические тесты в ходе испытаний препаратов инсулина должны включаться биоанализ аффинности в условиях in vitro
, анализ содержания инсулина и связывания с рецепторами ИФР-1, а также влияния на пролиферацию клеток [18]. Для известных в настоящее время биосимиляров гларгина результаты подобных исследований еще не получены [20, 21, 38].
Данные последних клинических исследований свидетельствуют о сходном риске развития онкологических заболеваний при лечении гларгином и другими инсулинами. Метаанализ 29 рандомизированных клинических исследований фаз II–IV, включавших в общей сложности 10 880 больных СД 1 и 2 типа, из которых 5657 получали гларгин, показал, что терапия данным аналогом не ассоциирована с увеличением частоты злокачественных новообразований [39]. Исследование ORIGIN, наиболее масштабное по количеству участников (12 537 человек) и длительности наблюдения (6,2 года), также не выявило каких-либо изменений в частоте развития рака и смертей от онкологических заболеваний у лиц с дисгликемией, получавших гларгин (по сравнению со стандартным лечением) [40]. Онкогенный потенциал биосимиляров гларгина еще необходимо изучать.
Заключение
Анализ приведенных данных свидетельствует о возможности существенных различий фармакокинетических и фармакодинамических свойств пролонгированных аналогов инсулина и их биосимиляров. Биосимиляр аналога инсулина может безопасно заменить оригинальный препарат только в том случае, если он имеет сопоставимую вариабельность действия, а его онкогенные и иммуногенные свойства изучены в клинических исследованиях.
Между тем в системах здравоохранения ряда стран, включая Россию, практикуется автоматическая замена оригинальных препаратов инсулина на биосимиляры, априори считающиеся эквивалентами. Подобная практика, по выражению L. Heinemann, напоминает огромный эксперимент, в котором участники не давали согласия на участие и не были информированы о возможных последствиях [8].
Гларгин – первый и наиболее изученный длительно действующий аналог инсулина, способный удовлетворять потребность в базальном инсулине на протяжении 24 часов. Эффективность и безопасность оригинального препарата гларгина (Лантуса) доказана многочисленными клиническими исследованиями. Однако вариабельность эффекта, иммуногенные и митогенные свойства биосимиляров гларгина изучены недостаточно.
В настоящее время очевидна необходимость введения специального регулирования обращения биосимиляров в Российской Федерации, установления комплексных требований к определению их эффективности и безопасности по каждому показанию, осуществления специальных мер по фармаконадзору, особенно в отношении отслеживания иммуногенности в долгосрочном периоде, формирования базы данных по безопасности уже обращающихся и вновь регистрируемых препаратов. Такой подход, зафиксированный в позиции экспертов Российской ассоциации эндокринологов [14], может служить основой для принятия решения о возможности применения и взаимозаменяемости тех или иных биосимиляров аналогов инсулина.
100-летие открытия инсулина: успешный научный эксперимент, спасший миллионы жизней людей с диабетом
В 2022 году весь мир отмечает 100-летие открытия инсулина. Это открытие положило начало ряду революционных исследований и разработок, которые в корне изменили жизнь людей с сахарным диабетом. Однако, несмотря на значительные успехи, достигнутые в диабетологии, люди с диабетом все еще сталкиваются с рядом проблем.
Еще век назад диагноз «сахарный диабет» звучал как смертный приговор – у большинства больных это заболевание неминуемо приводило к летальному исходу. Все изменилось в 1921 году, когда канадскими учеными Фредериком Бантингом и Чарльзом Бестом был открыт инсулин.
Для привлечения внимания общества к проблемам этого серьезного хронического заболевания в год празднования юбилейной даты ОООИ «Российская Диабетическая Ассоциация» и компания Ново Нордиск заключили соглашение о партнерстве.
Основными задачами соглашения являются повышение осведомленности населения о сахарном диабете и его рисках, о роли открытия инсулина в борьбе с этим серьезным заболеванием и популяризация историй успеха людей с диабетом. «Открытие инсулина является одним из величайших достижений медицины XX века, с которым может сравниться только открытие антибиотиков, потому что благодаря инсулину были спасены миллионы жизней людей с диабетом. К тому же это редкий пример в истории, когда успешный научный эксперимент за очень короткий срок дал потрясающий результат в клинической практике. На сегодняшний день инсулин остается незаменимым препаратом в лечении сахарного диабета, и еще долгие годы будет им оставаться, – считает президент ОООИ «Российская Диабетическая Ассоциация», заведующий отделом прогнозирования и инноваций диабета ФГБУ «НМИЦ эндокринологии» Минздрава России, д.м.н. Александр Майоров. – Обеспечение пациентов с диабетом инсулином, внедрение в медицинскую практику более совершенных и доступных для населения препаратов инсулина, открывающих новые возможности в лечении заболевания, позволяют избежать многих серьезных осложнений. При этом для лучшей компенсации заболевания одного применения инсулина недостаточно – надо научить пациента управлять не заболеванием, а жизнью с заболеванием». В честь 100-летия открытия инсулина в России запущен сайт www.insulin100.ru, на котором можно более подробно узнать про историю открытия инсулина и развития мировой диабетологии, а также ознакомиться с актуальными вопросами, связанными с сахарным диабетом.
С момента открытия инсулина в лечении сахарного диабета произошел невероятный прогресс благодаря появлению более совершенных препаратов инсулина и систем введения. Практически сразу после открытия инсулина, в 1923 году в Дании Нобелевским лауреатом Августом Крогом была основана фармацевтическая компания, известная сегодня как Novo Nordisk A/S. С самого начала своей деятельности основатели компании Ново Нордиск стремились к тому, чтобы в конечном итоге победить это заболевание. Учеными компании Ново Нордиск были разработаны четыре поколения инсулина: с 1920-х годов прошлого столетия компания выпускала животные инсулины, в 1980-е годы был разработан генно-инженерный человеческий инсулин, в 1990-е годы созданы первые аналоги инсулина, а в 2010-е годы компания представила аналоги инсулина нового поколения. Вкладом компании в развитие диабетологии стало внедрение в 1946 году в клиническую практику первого пролонгированного инсулина (НПХ), созданного Хансом Кристианом Хагедорном, а также разработка и внедрение в 1970-1980-е гг. идеологии базис-болюсной терапии.
«В России история применения датских инсулинов началась еще на заре инсулинотерапии, когда в 1924 году советскими властями они были рекомендованы для лечения сахарного диабета. Чтобы повысить доступность инновационных препаратов инсулина для российских пациентов с диабетом в 2015 году компания Ново Нордиск открыла в Калужской области высокотехнологичный завод, на котором с 2022 года налажено производство готовой лекарственной формы. В настоящее время компания продолжает инвестировать в российский завод, осуществляя трансфер передовых технологий, – рассказывает вице-президент и генеральный директор компании Ново Нордиск в России и Беларуси Ханс Дюиф. – Мы уделяем большое внимание не только инновациям, но и повышению доступности лекарственных препаратов для пациентов с диабетом».
Компания Ново Нордиск обладает полным портфелем современных инсулинов. В мире препараты компании для лечения этого заболевания ежедневно используют более 32 миллионов человек, в том числе в России – около полумиллиона пациентов.
Для решения проблем сахарного диабета компания принимает активное участие в научных исследованиях, реализует различные социальные программы, направленные на поддержку пациентского сообщества, а также на информирование населения о рисках неправильного образа жизни.
Развитие медицины не стоит на месте, и применение инсулина в лечении диабета с каждым годом открывает перед пациентами новые перспективы. В наше время благодаря применению аналогов инсулина четвертого поколения, максимально приближенных к физиологическому профилю действия, имеющих низкую вариабельность гликемии и низкую частоту развития гипогликемий, а также гибкий режим введения, люди с этим хроническим заболеванием могут жить практически полноценной и активной жизнью.
В то же время для пациентов с диабетом до сих пор существует целый ряд нерешенных вопросов и актуальных проблем. Например, при этом хроническом заболевании для комплаентности пациентов, более комфортного управления своим заболеванием всегда важен вопрос повышения удобства терапии: возможность гибкого режима дозирования, использование современных средств безболезненного введения инсулина.
Одной из значимых проблем остается и доступность инноваций: неравенство в области здравоохранения может способствовать ограничению доступа части населения к современным методам лечения и в результате приводить к росту затрат системы здравоохранения уже на лечение тяжелых осложнений диабета, во много раз превышающих затраты на своевременную терапию этого заболевания.
Еще один вопрос, который стоит на повестке дня, – это ситуация с дискриминацией больных диабетом. Например, для детей и подростков с диабетом до сих пор действует ограничение на занятия некоторыми видами спорта. Хотя при адекватном контроле глюкозы крови, соблюдении правил по введению инсулина и питанию регулярная физическая активность у пациентов с сахарным диабетом, являясь одним из факторов, дополняющих лечение заболевания, способствует укреплению здоровья и улучшению качества жизни.
Источник: пресс-релиз компании Novo Nordisk