В настоящее время для лечения депрессии, особенно в амбулаторной практике, используются относительно новые антидепрессанты — селективные ингибиторы обратного захвата серотонина (СИОЗС), обладающие значительно меньшим количеством побочных эффектов, чем трициклические антидепрессанты, за счет избирательного влияния на обмен серотонина (избирательное торможение захвата 5-НТ).
СИОЗС представлены такими препаратами как: флуоксетин (прозак), флувоксамин (феварин), сертралин (золофт, стимулотон, асентра), пароксетин (паксил, рексетин), ципрамил (циталопрам, ципралекс).
В отличие от ТЦА, особенностью действия серотонинергических антидепрессантов является их селективное влияние на серотонинергическую систему, первоначально выявленное в лабораторных исследованиях (Wong D.,с соавт., 1974; Fuller R., с соавт., 1977). Эффективность терапии депрессии СИОЗС, составляет не менее 65% (Mulrow D., с соавт., 2000)
Благодаря сродству этих препаратов и их активных метаболитов к серотониновым рецепторам происходит блокада обратного захвата серотонина на уровне пресинаптических окончаний, тем самым повышается концентрация медиатора в синаптической щели, что в свою очередь ведет к снижению синтеза и кругооборота серотонина (Stark Р., с соавт., 1985).
Избирательное, но неспецифическое для определенного подтипа рецепторов (Stahl S., 1993) действие СИОЗС не всегда повышает эффективность лечения, особенно если речь идет о терапии пациентов, страдающих тяжелой депрессией (Anderson I., Tomenson B., 1994; Burce M., Prescorn S., 1995).
Препараты группы СИОЗС имеют совершенно разную химическую структуру и отличаются друг от друга по фармакокинетическим параметрам, дозировкам и профилям побочных эффектов. Селективность подавления обратного захвата 5-НТ уменьшает количество побочных эффектов, улучшает переносимость и снижает частоту отказов от приема препаратов в сравнении с ТЦА (Anderson I., Tomenson T., 1994).
Таблица Сравнительная характеристика СИОЗС по интенсивность эффекта антидепрессанта
| Препарат | Интенсивность эффекта |
| Пароксетин (рексетин, паксил) | + + + |
| Флувоксамин (феварин) | + + |
| Сертралин (стимулотон, золофт) | + + |
| Ципрамил (ципралекс, циталопрам, целекса) | + |
| Флуоксетин (прозак, флуксал) | + |
Примечание: +++— значительная интенсивность, ++— умеренная интенсивность , + — слабая выраженность эффекта.
Необходимо подчеркнуть относительную безопасность СИОЗС (меньшее число и выраженность побочных явлений) и большую комфортность лечения (возможность проведения терапии в амбулаторных условиях).
СИОЗС отличаются также низкой токсичностью (риск смертельного исхода при отравлении или передозировке практически равен нулю), а также возможностью использования препаратов этой группы у пациентов с противопоказаниям к применению ТЦА (нарушение сердечного ритма, затруднение мочеиспускания в связи с гипертрофией предстательной железы, закрытоугольная глаукома) (Машковский М.Д., 1997).
Следует отметить, что в литературе отмечены случаи центральных и переферических побочных эффектов в процессе лечения СИОЗС (Baldessarini R., 1989).
Эти препараты являются более дорогостоящими антидепрессантами, по сравнению с другими препаратами, использующимися для лечения депрессии.
Большинство из селективных ингибиторов обратного захвата серотонина (СИОЗС) являются пролонгами и используются в фиксированных дозах. Фармакокинетика различных представителей группы СИОЗС имеет свои особенности в зависимости от возраста пациентов и соматической отягощенности. Так период полураспада флувоксамина несколько увеличивается у пожилых пациентов и больных с патологией печени (Raghoebar M., Roseboom H., 1988). На продолжительность периода полураспада сертралина также оказывает влияние возраст (Warrington S.1988), а на эффекте флуоксетина достаточно существенно отражаются функциональные возможности печени (Bergstrom M., Lemberg L, с соавт., 1988).
Клинические испытания СИОЗС продемонстрировали, что они, как и ТЦА, являются эффективным средством при большинстве депрессивных состояний, включающих в себя тревогу, нарушения сна, психомоторную ажитацию и заторможенность. ( Levine S. с соавт., 1987, Dunlop S. с соавт., 1990, Claghorn J., 1992, Kiev A., 1992).
Таблица Сравнительная оценка дополнительного терапевтического эффекта СИОЗС
| Препарат | Терапевтический эффект |
| Флуоксетин (прозак, флуксал) | Растормаживающий |
| Флувоксамин (феварин) | Седативный, анксиолитический |
| Сертралин (стимулотон, золофт) | Анксиолитический, антифобический, вегетативно-стабилизирующий |
| Ципрамил (ципралекс, циталопрам) | Анксиолитический |
| Пароксетин (паксил, рексетин) | Анксиолитический, седативный |
Показаниями к применению СИОЗС являются выраженные и средне тяжелые депрессии (типа простой) с нерезко выраженной тревогой и беспокойством (Pujynski S., с соавт., 1994;. Pujynski S, 1996). Кроме того СИОЗС могут использоваться для терапии личностных расстройств, включающих в себя реакции гнева и проявления импульсивности.
В медицинской литературе подчеркивается чувствительность витальных нарушений к действию этих антидепрессантов (Laakmann G. с соавт. 1988).
В ряде исследований описано, что пациенты, у которых в структуре синдрома преобладала тоска, демонстрировали хороший терапевтический ответ при применении СИОЗС (Reimherr F. et al., 1990, Tignol G. et al., 1992; Мосолов С.Н., Калинин В.В., 1994).
Учитывая, хорошую переносимость данных лекарственных средств их рекомендуют применять в пожилом возрасте.
В то же время большинство исследователей отмечают достаточно высокую анксиолитическую активность СИОЗС (Amin M. с соавт., 1989; Kiev А., 1992, , Бовин Р.Я., с соавт. 1995, Иванов М.В с соавт. 1995). На начальных этапах появления СИОЗС в отечественной литературе встречались указания на низкую эффективность, а иногда даже усиление тревоги при применении СИОЗС у больных с тревожной депрессией (Калинин В.В., Костюкова Е.Г., 1994, Лопухов И.Г. с соавт., 1994, Мосолов С.Н., с соавт., 1994).
В течение последних лет были проведены исследования, в которых представлены сравнительные оценки СИОЗС с ТЦА. Большинство авторов отмечает, что активность новых соединений сравнима с традиционными препаратами (Guelri J.. с соавт., 1983; Shaw D., с соавт., 1986; Hale A. С соавт., 1991, Fontaine R. С соавт., 1991). При сравнении СИОЗС с ТЦА, традиционно применяющемся при лечении тревожно-депрессивных состояний, как правило, указывается, что различия в эффективности исследуемых препаратов по способности купировать чувство тревоги не являются статистически значимыми (Feighner J., 1985, Laws D. С соавт., 1990, Авруцкий Г.Я., Мосолов С.Н., 1991, Doogan D., Gailard V., 1992).
По мнению многих авторов СИОЗС в ряде случаев эффективны тогда, когда применение ТЦА оказалось нерезультативным (Weilburg J.B. с соавт., 1989, Beasley C.M. с соавт.. 1990; Иванов М.В. с совт., 1991; Бовин Р.Я. с соавт., 1992; Серебрякова Т.В., 1994; Бовин Р.Я., с соавт. 1995). По данным Beasley C., Sayler M. (1990), пациенты, резистентные к ТЦА, в 50-60% случаев оказываются чувствительными к новым препаратам.
Необходимо подчеркнуть большую по сравнению с ТЦА безопасность СИОЗС (меньшее число и выраженность побочных явлений), большую комфортность лечения (возможность проведения терапии в амбулаторных условиях) (Boyer W. Feighner J., 1996).
При приеме ТЦА 30% пациентов вынуждены отказаться от лечения из-за выраженности побочных действий, тогда как в случае назначения новых препаратов только у 15% больных приходится прерывать прием лекарств (Cooper G., 1988).
S. Montgomery, S. Kasper (1995) показали, что частота прекращения приема препаратов из-за побочных эффектов была у 14 % пациентов, лечившихся СИОЗС и у 19 % — ТЦА. Преимущество антидепрессантов второго поколения особенно важно в ходе длительной терапии (Medavar Т. с соавт., 1987).
Р.Я. Бовин (1989) указывает на возрастающую опасность возникновения суицида на ранних этапах терапии ТЦА. В то время как, в большинстве исследований, посвященым СИОЗС, авторы обращают внимание на высокую направленность этих препаратов против суицида (Fava M. с соавт., 1991; Cohn D. с соавт., 1990; Sacchetti E. с соавт., 1991).
Помимо терапии депрессии, все чаще предпринимаются попытки длительного применения антидепрессантов (флуоксетин, сертралин) для профилактики ее рецидивов.
Cohn G.N. с соавт., (1990), учитывая хорошую переносимость СА, рекомендуют их использование в геронтопсихиатрии.
Не существует единого мнения относительно скорости наступления эффекта при применении СИОЗС. По мнению иностранных авторов, клинический эффект СИОЗС обнаруживается позднее, чем ТЦА (Roose S, с соавт. 1994). В то же время отечественные ученые указывают, что у CИОЗС регистрируется тенденция к более быстрому наступлению терапевтического эффекта, по сравнению с другими антидепрессантами (Авруцкий Г.Я, Мосолов С.Н, 1991).
В группе СИОЗС различные препараты отличаются по силе действия на рецепторы и уровню селективности. Причем селективность и сила действия не совпадают. Было установлено, что пароксетин является более мощным ингибитором серотонинового возврата, в то время как циталопрам — более селективным. Различия в селективности и мощности действия на рецепторы определяют не только особенности терапевтического эффекта того или иного препарата, но и наличие побочных эффектов (Thopas D., с соавт., 1987; Hyttel G., 1993).
При прочих равных условиях рецидивы депрессии чаще отмечаются после терапии флуоксетином, чем пароксетином и после лечения циталопрамом, чем сертралином; при почти равном количестве рецидивов на фоне лечения сертралином и пароксетином.
Поскольку флувоксамин и пароксетин обладают выраженным седативным и противотревожным эффектом, то они по спектру своей активности приближаются к таким препаратам, как амитриптилин или доксепин. Большинство других препаратов, особенно флуоксетин, больше напоминают профиль имипрамина, так как обладают растормаживающим эффектом и могут усилить проявления тревоги и беспокойства (Caley Ch.,1993; Pujynski S., с соавт., 1994; Montgomery S., Johnson F., 1995). В отечественной литературе также имеются указания на низкую эффективность, а иногда даже усиление тревоги при применении СИОЗС у больных с тревожной депрессией (Калинин В.В., Костюкова Е.Г., 1994, Лопухов И.Г. с соавт., 1994, Мосолов С.Н., с соавт., 1994).
Вследствие растормаживающего эффекта подобные препараты не следует применять при тревоге, беспокойстве, двигательной расторможенности, бессоннице, суицидальных мыслях и тенденциях. По мнению, S. Pujynski (1996) относительным противопоказанием к применению СИОЗС являются психотические формы депрессии. Однако, Feighner J., Bouer W (1988), напротив, отмечают позитивный эффект данных препаратов даже при психотическом варианте депрессии.
Наиболее частыми побочными эффектами при приеме ингибиторов серотонина считаются гастроинтестинальные расстройства: тошнота и рвота, запоры и жидкий стул. У ряда больных отмечается снижение веса.
Таблица Сравнительная характеристика СИОЗС по выраженности побочных эффектов
| Препарат | Побочные эффекты |
| Пароксетин (паксил, рексетин) | + + + |
| Флувоксамин (феварин) | + + + |
| Сертралин (стимулотон, золофт) | + + |
| Флуоксетин (прозак, флуксал) | + + |
| Ципрамил (ципралекс, циталопрам) | + |
Примечание: +++ — значительная выраженность побочных эффектов, ++ — умеренная выраженность побочных эффектов, + — слабая выраженность побочных эффектов
Следующими по частоте побочными эффектами являются: беспокойство, тревога, бессонница, реже повышенная сонливость.
Особенно тревожат больных сексуальные расстройства, которые могут иметь место при использовании данных препаратов. Наиболее частые из них: снижение либидо, слабость эрекции и трудность достижения оргазма. При выраженных сексуальных расстройствах, развившихся на фоне терапии СИОЗС дозы препаратов обычно снижают или отменяют на несколько дней. В ряже случаев назначают препараты, являющиеся антагонистами серотонина (ципрогептадин) или лекарственные средства , усиливающие сексуальные функции (йохимбин).
К наиболее часто упоминающимся противопоказаниям к приему СИОЗС относятся: повышенная чувствительность к препарату, беременность (известны случаи терапии депрессии в этот период флуоксетином) и кормление грудью (влияние СИОЗС на плод и развитие ребенка мало изучены), эпилепсия, нарушение функций почек и печени. Препараты этой группы нельзя применять при отравлениях алкоголем и психотропными средствами. СИОЗС нельзя применять ранее, чем через 2 недели после окончания терапии неселективными ингибиторами МАО, а также вместе с другими препаратами серотонинергического действия (Feihner J., Boyer W., 1996).
Все зарегистрированные СИОЗС могут провоцировать смену фаз с депрессивной на маниакальную у лиц с биполярным течением заболевания, но такая смена фаз происходит реже, чем при применении ТЦА ( Харкевич М.Ю., 1996). Кроме того, при лечении антидепрессантами дистимии у 10% больных возникает легкая степень мании.
В связи с тенденцией к более широкому применению ингибиторов обратного захвата серотонина при лечении депрессии имеет смысл остановиться на особенностях отдельных представителей данной группы препаратов.
В своей практической работе врач-психиатр в ряде случаев сталкивается с трудностями разграничения клинических проявлений депрессии от побочных эффектов СИОЗС, синдрома отмены СИОЗС, а также потенциально опасного для жизни серотонинового синдрома.
| Узнайте подробнее: Профессиональная помощь при депрессии |
В практике врача-психиатра особое значение в процессе терапии СИОЗС имеет дифференциальная диагностика синдрома отмены этих препаратов, их побочных эффектов и серотонинового синдрома с клинической симптоматикой депрессии. Для синдрома отмены СИОЗС, возникающего в случае быстрого снижения дозы препарата или его резкой отмены, характерны такие признаки как: головокружение, тошнота, тревога и головная боль. Как отмечалось выше, побочные эффекты СИОЗС обычно проявляются в первые две недели терапии и выражаются в астении, диареи, тошноте, тревоге, головокружении, нарушение сна, нервнозности и треморе. Для серотонинового синдрома, возникающего при передозировке СИОЗС или его сочетании с ТЦА, типичны спазмы в животе, психомоторное возбуждение, диарея, судороги, тахикардия, гипо или гипертония, потливость гипертермия. При депрессии стержнем депрессивного состояния является ангедония.
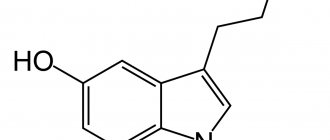
Флуоксетин
Одним из первых ингибиторов обратного захвата серотонина был флуоксетин (прозак), с начала 80-х годов, активно применявшийся для терапии различных расстройств депрессивного спектра. Кроме того, было отмечено его позитивный эффект при лечении булимии.
Флуоксетин назначают в дозе 20 мг. один раз в сутки утром, при необходимости дозу увеличают до 40-80 мг. (помимо таблетированных форм за рубежом используется специальный раствор флуосетина 4 мг/ мл.).
Препарат хорошо всасывается при пероральном назначении, деметилируется в печени с образованием неактивных метаболитов и фармакологически активного норфлуоксетина. Вследствие особенностей метаболизма на эффекте флуоксетина достаточно существенно отражаются функциональные возможности печени (Bergstrom M., Lemberg L, et al., 1988). Он подавляет активность печеночных цитохромов Р4502D6, а следовательно замедляет метаболизм ряда психотропных средств, включая ТЦА, с повышением их концентрации в плазме, что определяет возможность появления токсических эффектов (Creve N., et.al., 1992).
Максимальная концентрация в крови при приеме флуоксетина достигается через 6 часов. Он обладает наиболее продолжительным периодом «полужизни» из всех СИОЗС, который составляет в данном случае двое-трое суток, а период «полужизни» его активного метаболита — норфлуоксетина достигает 7-9 суток. Данное обстоятельство обеспечивает преимущество при лечении пациентов, которые эпизодически могут забыть о приеме очередной дозы, но, с другой стороны усложняют замену препарата на другие антидепрессанты (особенно ИМАО). Для достижения стабильной концентрации активного вещества требуется несколько недель. Отмечено, что, несмотря на анксиолитический эффект, флуоксетин способен усилить проявления тревоги и возбуждения на начальном этапе терапии.
По своему спектру действия флуоксетин, больше напоминает профиль имипрамина, так как обладает растормаживающим эффектом и может, как отмечалось выше, усилить проявления тревоги и беспокойства (Caley Ch.,1993; Pujynski S., et al., 1994; Montgomery S., Johnson F., 1995). Существует точка зрения, согласно которой, вследствие растормаживающего эффекта флуоксетин не следует применять при тревоге, беспокойстве, двигательной расторможенности, бессоннице, суицидальных мыслях и тенденциях, однако, последние исследования показали, что прием флуосетина не увеличивает опасность суицида (Freemante N., et.al., 2000).
Флуоксетин (прозак), по сравнению с другими СИОЗС, значительно медленнее устраняет признаки депрессии (на протяжении 2-3 недель), однако, конечный его эффект, оказался аналогичным эффекту других препаратов этого класса (Edwards J., Anderson I., 1999). Существуют наблюдения, согласно которым по своей эффективности снятия симптомов депрессии флуоксетин приблизительно равен ТЦА (Beasley C., с соавт., 1991).
В то же время, встречается точка зрения, согласно которой флуоксетин уступает при этом другим СИОЗС по способности купировать общие проявления депрессии (Williams J., с соавт., 2000).
В первые дни применения флуоксетина, а также, возможно, и на дальнейших этапах лечения могут наблюдаться тошнота, акатизия, головные боли, нарушение остроты зрения, кожные аллергические реакции. При приеме флуосетина отмечены сексуальные дисфункции (Guthrie S., 1991; De Vane C. 1994; Pujynski S., 1996).
Флувоксамин
Флувоксамин (феварин), как селективный ингибитор обратного захвата серотонина, обладает отчетливо активирующим, повышающим настроение эффектом, он успокаивает, стабилизирует деятельность вегетативной системы и может быть рекомендован при сочетании депрессии с тревогой. Кроме того, позитивным моментом лечения флувоксамина является его сравнительно быстрое начало и плавность действия, что, как правило, способствует установлению хороших отношений между пациентом и его лечащим врачом.
Флувоксамин назначается в дозе 50 мг. в сутки один раз в вечернее время. Дозу препарата можно увеличить до 100 мг. (средняя доза эффективности) в течении 5-7 дней. При необходимости дозировка препарата может в дальнейшем повышаться с интервалом в 2-4 недели (максимальная суточная дозировка — 500 мг.), начиная с дозы 150 мг. препарат назначается несколько раз в день.
Активные метаболиты флувоксамина неизвестны. Средний период полувыведения составляет 20 часов, концентрация в плазме не пропорциональна принятой дозе
Симптоматика тревожного расстройства в большинстве случаев устраняется ранее депрессивного. Это клинически проявлялось улучшением общего состояния пациентов, приводя их к большей собранности, уверенности и внешнему успокоению. Отмечается эффективность данного препарата у больных с навязчивыми состояниями и социальной фобией, в частности, в детском возрасте.
Присоединение флувоксамина к атипичным нейролептикам позволяет уменьшить выраженность первичной негативной симптоматики у больных хронической шизофренией. В то же время, сравнительными исследованиями было показано, что из группы селективных ингибиторов обратного захвата серотонина он обладает наибольшим количеством побочных эффектов (Freemante N., с соавт.., 2000), наименьшим — сертралин (Edwards J., Anderson I., 1999).
Насколько опасен прием антидепрессантов? Какие бывают побочные эффекты?
Антидепрессанты вызывают некоторые побочные эффекты. У препаратов из разных групп они выражены в разной степени. Например, СИОЗС наиболее безопасны, большинство пациентов, которые их принимают, не испытывают каких-либо проблем. В то же время, ИМАО способны вызывать опасные для жизни побочные эффекты. Они несовместимы с некоторыми видами лекарств и даже с продуктами питания.
К сожалению, самые безопасные препараты не всегда оказываются эффективными. В таких случаях не остается ничего иного, кроме как прибегнуть к «тяжелой артиллерии». Врач должен хорошо оценить состояние пациента и назначить наиболее подходящие лекарства в оптимальных дозировках.
Иногда у пациентов младше 25 лет антидепрессанты усиливают суицидальные наклонности, особенно в первые недели приема и при изменении дозировки. Однако, в долгосрочной перспективе они, как правило, улучшают настроение и уменьшают вероятность суицида.
Циталопрам
Циталопрам имеет значительно более высокий уровень селективности в отношении переносчиков серотонина, по сравнению с транспортерами норадреналина и дофамина.
Препарат назначают в дозе 20 мг. в сутки один раз в день утром. Для большинства пациентов эта доза является наиболее эффективной, максимальная суточная доза препарата — 60 мг.
Циталопрам практически не вступает в лекарственные взаимодействия, в связи с тем, что мало влияет на активность некоторых ферментов печени (энзимная система цитохрома Р450). Поэтому он часто используется при терапии депрессивных состояний, развивающихся в следствии хронических соматических заболеваний. Межлекарственные взаимодействия препарата минимальны. Под действием цитохрома P450 циталопрам превращается в два основных метаболита: деметилциталопрам и дидеметилциталопрам. Эти метаболиты обладают фармакологической активностью, но гораздо меньшей, чем у самого циталопрама. Период полувыведения циталопрама составляет 30 часов. Он характеризуется линейной зависмостью концентрации в плазме в зависимости от дозы в терапевтическом интервале. Для лечения тяжелых депрессий дозу препарата следует увеличить.
Применение циталопрама рекомендовано в общемедицинской практике, у пожилых больных и лиц, перенесших мозговой инсульт.
При назначении циталопрама крайне незначительным оказался процент мужчин с нарушением сексуальной функции — побочным эффектом сравнительно часто встречающимся при назначении препаратов этой группы. Головная боль и тошнота оказались наиболее частыми побочными эффектами при лечении циталопрамом на протяжении первых двух недель его приема.
Как понять, с какого антидепрессанта лучше всего начинать?
Изначально врач назначает препарат, который, по его мнению, лучше всего подходит для конкретного пациента. Узнать наверняка, что будет работать эффективнее, невозможно, но есть некоторые факторы, на которые можно ориентироваться: тип и симптомы депрессии, побочные эффекты препаратов, общее состояние здоровья пациента, сопутствующие заболевания.
Если у вас есть родственники, страдающие депрессией, и у них хорошо работают те или иные препараты, есть вероятность, что те же лекарства будут эффективны и для вас.
Антидепрессанты могут быть назначены во время беременности и кормления грудью, но с осторожностью. Врач должен хорошо взвесить возможные риски.
Сертралин
Сертралин (золофт, стимулотон, асентра) характеризуется тимоаналептическим (анксиолитическим) действием средней выраженности. Отсутствуют вегетостабилизирующее, седативное, тимеректическое, адренергическое и холинолитическое (мускариновое) действие. Препарат не влияет на психомоторные функции, обладает слабым антифобическим и очень слабым гипотензивным эффектом.
Показанием к применению являются легкие и умеренно выраженные тоскливые депрессии с вторичной тревогой и соматоформными расстройствами. После получения удовлетворительного эффекта продолжение лечения сертралином позволяет предупредить рецидив депрессии или его появление в последующем.
Сертралин также используется для лечения обсессивно-компульсивных расстройств (ОКР).
Как правило, антидепрессивный эффект наступает через одну неделю терапии.
После достижения начального эффекта длительное до 2-х лет лечение сертралином обеспечивает его достаточную эффективность и хорошую переносимость. Сертралин применяют для лечения панических расстройств, синдрома посттравматических стрессорных расстройств (ПТСР). Начальный терапевтический эффект в этом случае может проявиться в течение 7 дней, однако полный эффект обычно достигается позже — через 2-4 недели (возможно и в течении более длительного времени, особенно при ОКР). Существует точка зрения, согласно которой препарат редуцирует обычно вторичную, связанную с тоскливой депрессией, тревогу.
Сертралин (золофт, стимулотон) сравнительно малотоксичный антидепрессант из группы СИОЗС, его используют в детской психиатрии, а также в случаях расстройств депрессивного спектра, развивающихся после острого эпизода шизофрении.
Сертралин назначают в дозе 50 мг. в сутки (обычно один раз в день утром, независимо от приема пищи). Дозу можно увеличивать по 50 мг. в неделю. Рекомендуемые суточные дозы: для стационарного лечения депрессии — 50-100 мг., для амбулаторного применения — 25-50 мг. В случае необходимости дозу увеличивают с интервалом 2-4 недели (максимальная суточная доза — 200 мг.).
В терапевтических дозах сертралин ингибирует захват серотонина тромбоцитами. Он активно метаболизируется в печени, примерно его 98% присутствует в организме в связанном с белками виде, а его основной метаболит обладает слабой фармакологической активностью. В отличие от большинства антидепрессантов он преимущественно связывается с a1-гликопротеином, тогда как другие лекарственные средства взаимодействуют в основном с альбумином.
На продолжительность периода полураспада сертралина оказывает влияние возраст. У детей метаболизм сертралина является более активным (Warrington S.1988). Учитывая последнее обстоятельство, препарат рекомендуется применять у детей в меньшей дозе, чтобы избежать чрезмерных уровней его концентрации в плазме. В то же время, по данным других авторов фармакокинетический профиль у подростков и пожилых людей существенно не отличается от профиля пациентов в возрасте от 18 до 65 лет.
Сертралин медленно всасывается в течении 4-6 часов, элиминируется через желудочно-кишечный тракт и почки, равновесная концентрация препарата достигается в течение одной недели после начала лечения.
Средний период полувыведения сертралина составляет 22-36 часов. Равновесные концентрации сертралина устанавливаются через 1 неделю лечения.
Патология почек почти не сказывается на клиренсе сертралина. В то же время, при патологии печени период «полужизни» сертралина в сыворотке, равно как и его концентрация в плазме, возрастают почти на 50%.
Побочные явления: тремор, тошнота, сухость во рту, диарея. Обычно побочные явления спонтанно проходят к концу 4 недели терапии. Ранние нежелательные побочные эффекты особенно характерны при лечении панических расстройств.
Противопоказаниями к назначению препарата являются заболевания печени, почек с нарушением их функции. После отмены препарата ИМАО назначают не ранее, чем через 5 недель.
При хроническом приеме сертралина к нему развивается привыкание, поскольку его продолжительный прием приводит к снижению числа его рецепторов (Anthony P., с соавт., 2002 ).
Применение селективных ингибиторов обратного захвата серотонина в неврологической практике
Развитие депрессии может быть ситуационно обусловлено, однако у неврологических больных она, как правило, вызвана органическим поражением головного мозга или дисбалансом нейромедиаторных систем. Больные хроническими неврологическими заболеваниями в большей степени подвержены депрессии, чем больные с соматической патологией [15]. Неврологические заболевания, при которых может возникать депрессия, весьма многочисленны. Это расстройство входит в число частых симптомов при болезни Паркинсона, синдроме паркинсонизма, острых и хронических цереброваскулярных заболеваниях, дегенеративных деменциях, болевых синдромах, рассеянном склерозе, опухолях мозга [18,19,21,26]. Энцефалопатия, развивающаяся на поздних стадиях печеночной и почечной недостаточности, ряде эндокринных, гематологических и системных расстройств, при алкоголизме, также нередко сопровождается развитием депрессии, что связано с гипоксическим, дисметаболическим и токсическим поражением головного мозга. Депрессивные нарушения могут быть обусловлены длительным приемом лекарственных препаратов. Перечень этих препаратов достаточно велик, и многие весьма широко используются. Это b–блокаторы, блокаторы кальциевых каналов, кортикостероиды, анаболические стероиды, оральные контрацептивы, сердечные гликозиды, барбитураты, клоназепам. Нейролептическая депрессия возникает на фоне длительного приема больших доз нейролептиков (бутерофеноны, флуфеназин, хлорпромазин, рисперидон) и сопровождается экстрапирамидными расстройствами [2,6,26]. Депрессивные расстройства могут протекать под маской деменции и могут сопровождать ее развитие. При этом депрессия наблюдается часто при сосудистой деменции и реже – при болезни Альцгеймера [4]. Современный патоморфоз депрессии привел к изменению ее клинической картины, нарастанию частоты атипичных, скрытых, стертых форм. В настоящее время доля типичных случаев составляет лишь 10%, а основная масса депрессий протекает атипично. В практике врача–невролога депрессия чаще всего выступает под маской синдрома вегетативной дистонии, хронических болевых синдромов, инсомнии, нейроэндокринных расстройств [15,29,32]. К наиболее ярким проявлениям синдрома вегетативной дистонии относятся вегетативные кризы (панические атаки) [6]. Другой весьма нередкой маской депрессии являются хронические болевые синдромы, в том числе и у детей. Депрессия сопровождает и может усиливать конверсионные расстройства в рамках психогенных и психоорганических заболеваний. Механизмы, лежащие в основе депрессии, в настоящее время активно изучаются. Показано, что в эмоциональных реакциях участвует не только лимбическая система, но и корковые структуры. Особое значение придают лобным долям головного мозга [30]. При ряде психических расстройств, которые традиционно считались “функциональными”, выявлены морфологические изменения нервной ткани, причем не только на микроструктурном уровне (в виде атрофии синапсов, укорочения дендритов и гибели части нейронов), но и на макроструктурном (в виде уменьшения объема гиппокампа и некоторых других отделов мозга). Более того, в последние годы было показано, что патологические процессы в мозге могут быть частично обратимыми под влиянием терапии препаратами, обладающими нейротрофическими и нейропротективными свойствами [15,16]. По некоторым данным, при депрессии обнаруживаются признаки гиперреактивности гипоталамо–гипофизарно–надпочечниковой системы, есть также сведения об увеличении количества нейронов, секретирующих кортикотропин–рилизинг фактор. У 33–66% больных депрессией отмечается гиперплазия надпочечников, а содержание кортизола повышено и положительно коррелирует с тяжестью состояния. Хроническая гиперкортизолемия способствует формированию инсулинорезистентности, артериальной гипертензии, гиперпродукции стероидов, гипергликемии, гиперхолестеринемии, повышающих риск сердечно–сосудистых осложнений [34]. По экспериментальным данным, в ситуациях хронического болевого, эмоционального или социального стресса (являющихся моделями депрессии) статистически достоверно уменьшается объем гиппокампа (до 10%, как и у больных депрессией), в зубчатой извилине снижается число гранулярных клеток, а в полях СА1 и СА3 гиппокампа уменьшаются размеры тел пирамидных клеток и развивается атрофия их дендритов (до 50% длины), что ведет к нарушению нормального функционирования лимбической системы и ее связей с другими отделами мозга [11]. Таким образом, последствия хронического стресса и аффективные расстройства у человека, как и сходные с депрессией нарушения поведения у животных, ассоциируются с повреждением и гибелью мозговых клеток. Эти данные согласуются с представлениями о том, что тревожные расстройства, вызванные стрессогенными факторами, могут не просто предшествовать, но и являться причиной, по крайней мере, некоторых форм депрессивных расстройств. Преимущественная локализация морфологических изменений прежде всего в лимбической системе, базальных ганглиях и ростральных отделах коры может объяснять развивающиеся при депрессии нарушения как эмоциональных, так и моторных и когнитивных функций. Предполагается, что эти морфологические изменения являются следствием цитотоксического действия ряда агентов, прежде всего возбуждающих аминокислот и, возможно, кальция [11]. Развитию эксайтотоксичности в немалой степени способствуют отмечаемое при депрессии повышенное содержание кортикостероидов (главным образом кортизола), и дефицит g–аминомасляной кислоты [2]. Не исключено, что в основе ряда нарушений лежат нейромедиаторные дисфункции, скорее всего, связанные с недостаточностью центральных серотонинергических и норадренергических структур. Некоторые авторы также упоминают в патогенезе депрессии роль гипогликемии и возможного снижения мозгового кровотока. Особое значение в патогенезе депрессии у пожилых придается сосудистому поражению субкортикально–фронтальных связей с возникновением, помимо депрессии, нарушений исполнительных функций, психомоторной заторможенности, апатии. В настоящее время рассматривается несколько патофизиологических механизмов влияния депрессии на состояние сердечно–сосудистой системы у пожилых. Одним из основных патологических процессов при депрессивных расстройствах является дисбаланс вегетативной нервной системы с активацией симпатического отдела. Повышенное выделение катехоламинов приводит к увеличению потребности миокарда в кислороде вследствие возрастания частоты сердечных сокращений, артериального давления и силы сокращения миокарда. Установлено, что появление депрессии у пациентов с заболеваниями сердечно–сосудистой системы сопровождается значимым снижением вариабельности сердечного ритма, отражая ухудшение регуляторных механизмов и снижение адаптационных возможностей организма в ответ на стресс [13,22]. Достижением нейронауки в последние годы стало доказательство, что деструктивные процессы, происходящие при аффективных расстройствах, являются частично обратимыми под влиянием успешной терапии препаратами, проявляющими нейротрофические и нейропротективные свойства [17]. Восстановление ткани мозга и его функций связывают с реорганизацией и формированием новых синапсов, удлинением и разрастанием (sprouting) дендритов и аксонов с нейрогенезом. Действие антидепрессантов при этом не ограничивается их регуляторным влиянием на содержание моноаминергических нейротрансмиттеров в синаптической щели и в пресинаптических структурах, а также на число и чувствительность постсинаптических рецепторов, но распространяется и на внутриклеточные каскады нейрохимических процессов. Одним из образуемых при этом соединений является цАМФ–элементсвязывающий белок (CREB), активирующий «поздний» ген мозгового нейротрофического фактора (англ. brain derived neurotrophic factor – BDNF), который, в свою очередь, усиливает экспрессию гена основного цитопротективного белка bcl–2, подавляющего апоптоз, что способствует восстановлению и выживанию нейронов [15]. Симптомы депрессии могут быть очевидными. Наряду с угнетенностью (в типичных случаях в виде витальной тоски) депрессия включает идеаторное и двигательное торможение со снижением мотивации к действию или тревожное возбуждение (вплоть до ажитации). Свойственная депрессивным больным психическая гипералгезия (душевная боль) сопряжена с чувством вины, снижением самооценки, суицидальными мыслями, а тягостное физическое самоощущение – с «соматическими» симптомами, такими как расстройства сна с трудностями засыпания и ранними пробуждениями; резкое снижение аппетита и массы тела; снижение либидо и нарушения менструального цикла вплоть до аменореи и др. Сниженное настроение обычно сохраняется на протяжении всего депрессивного приступа. Типичным признаком депрессии является также суточный ритм с улучшением или (реже) ухудшением самочувствия к вечеру. Атипичные проявления депрессии – это отсутствие в ряде случаев жалоб на сниженное настроение или фиксация пациента на возбудимости или тревожности, а не на сниженном настроении. Боль и психосоматические нарушения также могут быть атипичными проявлениями депрессии. Критериями диагностики маскированных депрессий являются: частое несоответствие жалоб больного характеру морфологических изменений; возможность отсутствия объективных признаков соматического заболевания; периодичность (сезонность) манифестации симптоматики заболевания; ремиттирующее течение с возможной сменой фаз обострений и рецидивов; связь самочувствия с биологическим ритмом физиологических функций (больные лучше чувствуют себя в вечернее время); частые повторные обращения за медицинской помощью; недостаточная эффективность симптоматической терапии или отсутствие таковой; улучшение самочувствия на фоне приема антидепрессантов. Выявление депрессивных расстройств в значительной степени облегчается при использовании психометрических шкал и тестов, применение которых позволяет снизить затраты времени врача на обследование. Наиболее известными среди субъективных психометрических шкал для скрининга депрессии являются Госпитальная шкала тревоги и депрессии [A. Zigmond, 1983] шкала Цунга [W.W. Zung, 1965], опросник депрессии Бека [А. Beck, 1961] [2,3,17,20,28,34,35]. Основой диагностики депрессии является оценка анамнеза и клинических данных. Результаты параклинических методов обследования (включая нейровизуализацию) большого значения не имеют, они лишь помогают исключить неврологические или соматические причины заболевания. Выявляемость депрессии врачами общей практики не превышает 50% [16,35]. В определенной степени это обусловлено малой специфичностью клинических проявлений данного заболевания. Так, например, потеря веса и повышенная утомляемость могут отмечаться не только при депрессии, но и при онкологических заболеваниях, сахарном диабете и заболеваниях щитовидной железы. В неврологической практике диагностика депрессии вызывает сложности не только из–за частого сочетания неврологической симптоматики и депрессии при поражении центральной нервной системы, но и из–за влияния неврологического заболевания на эмоциональное поведение больного. Так, характерная для паркинсонизма замедленность и скудость движений в сочетании с нарушением ритма и интонаций речи затрудняет правильную оценку эмоционального статуса. Еще более усложняется эта задача у больных с выраженными когнитивными или речевыми нарушениями различного генеза [4,7]. Пристального внимания заслуживают жалобы на хроническую боль – одну из наиболее частых «масок» депрессии. Сочетание депрессии и хронических болевых синдромов отмечается у 50–60 % больных. Терапия антидепрессантами является основным методом лечения депрессивных состояний. Вопрос о начале медикаментозной терапии становится актуальным, если симптоматика сохраняется на протяжении 2–4 недель и более. Следует отметить, что около 50% случаев неэффективности терапии связано с ее неадекватным применением [5,6]. Наиболее распространенными ошибками, помимо несвоевременного начала лечения, а также недостаточного учета клинических показаний и противопоказаний к препарату, являются проведение шаблонной (без учета индивидуальных особенностей) терапии низкими дозами или, наоборот, частая смена, «жонглирование» препаратами без соблюдения экспозиции нужной длительности, или преждевременная отмена терапии, или игнорирование пациентом врачебных назначений [12]. Как известно, во многих случаях клинический эффект развивается постепенно, и подавление актуальной психопатологической симптоматики еще не означает достижения стабильной ремиссии и окончания лечения. Действие антидепрессантов обычно проявляется не сразу, а через несколько недель (обычно от 3 до 6) после начала приема, о чем надо своевременно информировать пациента. После регресса симптомов депрессии терапию продолжают 4–5 месяцев. Неэффективность лечения, связанная с истинной лекарственной резистентностью, встречается очень редко, поэтому лишь если эффект подобранного препарата в адекватной дозе не проявляется через 6–8 недель, переходят на антидепрессант другой группы. Важно подчеркнуть, что в большинстве случаев отсутствие эффекта от лечения обусловлено не истинной лекарственной резистентностью, а недостаточной дозой или небольшой продолжительностью терапии, а также несоблюдением врачебных назначений. Возможности психотерапии, которая при необходимости может дополняться антидепрессантами, в настоящее время обсуждаются, однако эффективность подобного терапевтического подхода требует дальнейшего изучения. В неврологической практике зачастую приходится сталкиваться с ограничительной тактикой использования антидепрессантов [6]. Из числа лиц с эпидемиологическим диагнозом депрессии в амбулаторной практике (набравших более 18 баллов по шкале депрессий Центра эпидемиологических исследований) лечение получали 72,2% больных. Однако применялись, как правило, медикаментозные средства растительного происхождения и транквилизаторы. Антидепрессанты принимали лишь 8,7% больных депрессиями. Если препараты этой группы все же назначали, то, как правило, в достаточно низких суточных дозах [6]. В российском многоцентровом исследовании Компас установлено, что неврологи лишь ненамного чаще, чем другие специалисты (терапевты, кардиологи), назначают какую–либо терапию по поводу депрессивных состояний вообще (74% против 67,2 и 67,8% соответственно) и тимолептики, в частности (14,1% против 7,2 и 6,5% соответственно) [5]. Таким образом, роль медикаментозной коррекции депрессии нуждается в дополнительных обсуждениях. Антидепрессанты – лекарственные средства, способствующие редукции обусловленных депрессией идеаторных, двигательных и сомато–вегетативных расстройств. В основе клинического эффекта современных антидепрессантов лежит коррекция функций серотонинергической и норадренергической систем головного мозга. Весьма удобной является классификация антидепрессантов по механизму нейрохимического действия (табл. 1). Среди клинических классификаций антидепрессантов наибольшее распространение получила удобная и простая классификация П. Кильгольца с выделением препаратов с преимущественно седативным, стимулирующим или сбалансированным действием (табл. 2). Научная разработка современных антидепрессантов, с одной стороны, идет в направлении увеличения специфичности их биохимического действия. В частности, синтезируются и апробируются избирательные агонисты и антагонисты моноаминовых нейрорецепторов. Найдены вещества, избирательно воздействующие на определенные типы рецепторов (5НТ1, 5НТ2, и 5НТ3 серотониновые рецепторы). Примерами могут служить прямые агонисты 5НТ1а серотониновых рецепторов (флезиноксан, ипсапирон и др.). В то же время сохраняется тенденция к разработке средств широкого действия на различные моноаминовые системы с минимальным влиянием на рецепторы, с которыми связано развитие побочных явлений (милнаципран, венлафаксин, нефазодон, миртазапин, дулоксетин и др.). И, наконец, механизм действия некоторых препаратов с тимоаналептической активностью не связан прямо с моноаминовой системой или недостаточно ясен (например, тианептин, алпразолам, S–аденозилметионин, нейропептиды и др.) [12,17,27,33]. Среди наиболее изученных на фармацевтическом рынке за последние два десятилетия получили распространение так называемые антидепрессанты третьего поколения, являющиеся представителями нового класса фармакологических средств – селективных ингибиторов обратного захвата серотонина. К ним, в частности, относится флувоксамин [3,12,14]. В отличие от трициклических антидепрессантов селективные ингибиторы обратного захвата серотонина больше адресуются к широкому кругу депрессивных состояний невротического уровня. Они обладают большей широтой спектра психотропного действия при меньшем числе вызываемых побочных эффектов. Ядерные варианты меланхолического синдрома эндогенной депрессии с типично циркадной симптоматикой, тяжелые (психотические) депрессии и депрессивно–бредовые состояния хуже реагируют на терапию ингибиторами обратного захвата серотонина. Напротив, депрессивные состояния с обессивно–фобической, ипохондрической и тревожной симптоматикой невротического уровня лечатся достаточно успешно. Помимо депрессий с атипичной симптоматикой, была показана высокая эффективность серотонинергических антидепрессантов при тревожных и обессивно–компульсивных расстройствах в чистом виде или коморбидных с депрессией, а также при паническом расстройстве, постравматическом стрессовом расстройстве, социальной фобии, соматоформных нарушениях и других тревожных расстройствах [1,10,12,14,27]. Анализ ряда рандомизированных испытаний сравнения клинического эффекта группы селективных ингибиторов обратного нейронального захвата с трициклическими антидепрессантами, такими как имипрамин, обнаружил сходные положительные эффекты неселективных и селективных препаратов. При подведении итогов всех клинических испытаний стало ясно, что у селективных препаратов нет никаких четких преимуществ перед эталонными трициклическими антидепрессантами. Негативные же эффекты препаратов этих групп различаются существенно. Например, вероятность седативного эффекта, антихолинергического эффекта и нарушений сердечного ритма при использовании селективных ингибиторов обратного нейронального захвата серотонина меньше, чем при применении обычных антидепрессантов. С другой стороны, негативные эффекты селективных ингибиторов обратного нейронального захвата затрагивают желудочно–кишечный тракт, вызывая тошноту и диарею, а также могут привести к бессоннице, возбуждению, экстрапирамидным расстройствам (лекарственный паркинсонизм) и синдрому отмены. При сравнении негативных эффектов селективных ингибиторов обратного нейронального захвата и обычных антидепрессантов нельзя не прийти к выводу, что одна группа негативных эффектов меняется на другую и нет никакой разницы в количестве людей, которые могут принимать эти две группы антидепрессантов. В ходе 58 клинических испытаний изучались пациенты, которые прекратили прием антидепрессантов, и при этом не было обнаружено значимой разницы между селективными ингибиторами обратного нейронального захвата и обычными антидепрессантами. Таким образом, многочисленные научные исследования этой группы препаратов, в том числе проведенные в сравнении с эталонными трициклическими антидепрессантами, традиционно используемыми в психиатрии и неврологии при лечении депрессий (амитриптилином, имипрамином, кломипрамином и др.), показали их высокую терапевтическую эффективность, сопоставимую с трициклическими соединениями, при меньшем числе побочных явлений [2,6,8,9,12,14,31,33]. Однако несмотря на принадлежность к одной группе химических соединений, спектр антидепрессивной активности различных селективных ингибиторов обратного нейронального захвата имеет свои особенности, которые определяют преимущественные показания к их индивидуальному назначению и заслуживают обсуждения. Флувоксамин является родоначальником антидепрессантов группы селективных ингибиторов обратного захвата серотонина, первым и наиболее широко изученным препаратом этой группы. Флувоксамин зарегистрирован более чем в 80 странах, имеет самую большую (среди антидепрессантов) базу данных клинических исследований, включающую описание результатов лечения 38 тыс. пациентов. На сегодняшний день опубликовано более 5000 научных работ, посвященных изучению препарата. Препарат успешно применяется с 1983 г. в терапии депрессивных расстройств разной степени выраженности, а также так называемых пограничных психических нарушений (тревожных, панических, обсессивно–компульсивных, поведенческих и пр., в том числе у детей от 8 лет) [10]. Механизм действия флувоксамина связан с избирательным ингибированием обратного захвата серотонина нейронами головного мозга и характеризуется минимальным влиянием на норадренергическую передачу. Флувоксамин обладает невыраженной способностью связываться с a–адренергическими, b–адренергическими, гистаминергическими, мускариновыми холинергическими, дофаминергическими или серотонинергическими рецепторами. Флувоксамин обладает выраженными анксиолитическими и седативными свойствами и служит препаратом выбора для лечения депрессий в сочетании с тревогой, паникой и психомоторной ажитацией. Препарат отличает также умеренная психостимулирующая активность, следствием чего является отсутствие суицидогенности, гиперстимуляции, усиления раздражительности, нарушений сна. Мощный вегетостабилизирующий эффект флувоксамина особенно важен при лечении невротических, соматизированных депрессий и дистимий. Отсутствие поведенческой токсичности не нарушает внимание, память и когнитивные функции. Флувоксамин является эффективным антидепрессантом при лечении депрессий различного типа и различной степени выраженности. Это подтверждено, в частности, данными мета–анализа, согласно которым флувоксамин является препаратом выбора при лечении больных с тяжелой депрессией в условиях стационара. Кроме того, доказана эффективность флувоксамина в предупреждении рецидивов депрессии. После курса лечения препаратом рецидивы развивались в три раза реже, а период ремиссии до первого рецидива был в два раза продолжительнее, чем при применении плацебо. Выраженный антикверинговый эффект флувоксамина устраняет или снижает патологическое влечение к алкоголю. В психиатрической практике препарат продемонстрировал хорошую эффективность при коррекции негативной (дефицитарной) симптоматики у больных шизофренией. В клиническом отделе эндогенных психических расстройств и аффективных состояний Научного Центра психического здоровья РАМН в разные периоды проходили клиническое изучение флуоксетин, флувоксамин, сертралин и пароксетин. Всего этими препаратами прошли курсовое лечение 129 больных эндогенной депрессией. Флувоксамин позволял снизить тяжесть депрессии в этой группе до легкой степени уже к 5 дню лечения, но как «значительный» его терапевтический эффект регистрировался после 14 дня (второй недели) лечения, а к концу курсового лечения суммарная балльная оценка симптомов депрессии по шкале Гамильтона снижалась на 64,6%. Флувоксамин показал хороший терапевтический эффект в равной мере при депрессивных состояниях легкой и средней степени тяжести, что при условии его хорошей изученности делает его препаратом выбора при данной группе состояний. Тимолептический эффект флувоксамина проявился на уровне 76,1%, тогда как седативно–анксиолитический и стимулирующий компоненты действия флувоксамина были практически одинаковыми и менее глубокими, они проявлялись на уровне 67,8 и 64,5%, соответственно [14]. Измайлова И.Г. и соавт. оценивали эффект флувоксамина в группе детей с головной болью напряжения. Начальная доза флувоксамина составляла 12,5 мг на ночь, с дальнейшим постепенным повышением дозы по 12,5 мг каждые два дня до оптимальной суточной дозы – 50–75 мг. Курс лечения составил 1,5–2 месяца. Указанную фармакотерапию сочетали с массажем, психотерапией, физиотерапией. Клинический эффект в виде уменьшения головной боли и улучшения настроения пациенты начинали отмечать к концу первой недели лечения, побочных эффектов не наблюдалось. Через 1,5 месяца терапии у 25 детей полностью купировались имевшиеся нарушения; у 5 детей отмечалось снижение интенсивности и частоты приступов цефалгии. Динамическое изучение психовегетативного статуса показало достоверное снижение астено–вегетативных и тревожно–депрессивных расстройств до близких к нормальным показателям, что подтверждает анксиолитическое, антидепрессантное, вегетотропное и мягкое антиастеническое действие препарата в детской популяции. Катамнез (6 месяцев) подтвердил сохранение достигнутых результатов у 20 детей. Терапия антидепрессантами различной структуры традиционно давно применяется при хронической алкогольной болезни. Ряд отечественных и европейских исследователей убедительно высказываются в пользу центральной серотониновой недостаточности как основного нейрохимического механизма развития депрессии при алкоголизме. С помощью антидепрессантов можно не только воздействовать на депрессивные расстройства, но и купировать патологическое влечение к алкоголю. И в этом плане наиболее предпочтительны селективные ингибиторы обратного захвата серотонина, снижающие патологическое влечение к алкоголю. По многочисленным отечественным данным, именно флувоксамин – антидепрессант «преимущественно седативного действия с выраженными не только тимоаналептическими, но и вегетостабилизирующими и анксиолитическими эффектами» – наиболее предпочтителен при хроническом алкоголизме и наркоманиях в силу высокой коморбидности алкогольным депрессиям тревожных, фобических, сомнологических, соматовегетативных расстройствах, а также агрессивности и суицидального поведения [10]. Хорошая переносимость флувоксамина, в частности, отсутствие седативного побочного эффекта, позволяет использовать его в амбулаторной практике, без снижения качества жизни пациента. Важно подчеркнуть, что флувоксамин является не только максимально изученным, но и экономически наиболее доступным препаратом из группы селективных ингибиторов захвата серотонина. Важнейшим условием успеха лечения является рациональное сочетание фармакотерапии с социореабилитационными и психотерапевтическими мероприятиями, включая психообразовательную работу с активным вовлечением больного и его родственников в лечебный процесс.
Литература 1. Вознесенская Т.Г. Антидепрессанты в неврологической практике // Лечение нервных болезней. 2000. № 1. С. 8–13. 2. Вознесенская Т.Г. Депрессия в неврологической практике и ее лечение // Неврологический журнал. 2006. Т. 11. № 6. С. 4–11. 3. Глушков Р.Г., Андреева Н.И., Алеева Г.Н. Депрессии в общемедицинской практике // РМЖ. 2005. Т. 13. № 12. С. 858–60. 4. Дамулин И.В. Болезнь Альцгеймера и сосудистая деменция / под ред. Н.Н. Яхно. М., 2002. 85 с. 5. Депрессия в общемедицинской практике. Результаты программы Компас. //Оганов Р.Г., Ольбинская Л.И., Смулевич А.Б. и др. – Изд: Сервье, 2004. 6. Дробижев М.Ю., Воробьева О.В. Диагностика и лечение депрессий в неврологической практике: современное состояние проблемы.//Консилиум Медикум. – 2006. – №8. 7. Захаров В.В., Яхно Н.Н. Нарушения памяти. М., 2003. 160 с. 8. Краснов В.Н. Современные подходы к терапии депрессий // РМЖ. 2002. Т. 10. № 12–13. С. 553–55. 9. Крылов В.И. Антидепрессанты в общемедицинской практике. Эффективность и безопасность терапии. // «ФАРМиндекс–Практик», – 2003 – №5, с. 22–32. 10. Милопольская И.М. Коньков Е.М., Булаев В.М. Феварин в терапии хронического алкоголизма. //Консилиум Медикум. – 2006. – №3. 11. Мосолов С.Н. Биологические основы современной антипсихотической терапии // Российский психиатрический журнал, 1998, N6, с.712. 12. Мосолов С.Н. Клиническое применение современных антидепрессантов. // Медицинское информационное агенство. С.П., 1995, с. 568. 13. Оздоева Л.Д. Взаимосвязь факторов риска атеросклероза и тревожно–депрессивных состояний у мужчин из неорганизованной популяции // Кардиваскулярная терапия и профилактика. 2003. № 2(1). С. 59–64. 14. Пантелеева Г.П., Абрамова Л.И., Коренев А.Н. Сравнительная характеристика терапевтической эффективности нового поколения антидепрессантов из группы СИОЗС. //Журн. Современная психиатрия. – 1998. – 6. с. 12–16. 15. Симаненков В.И. От теории психосоматической медицины – к терапевтической практике // Медлайн–экспресс. 2006. № 4 (187). С. 3–7. 16. Смулевич А.Б. Депрессии в общей медицине. //М.: Медицинское информационное агентство, 2001. 256 с. 17. Смулевич А.Б. Подходы к терапии депрессий в общемедицинской практике // РМЖ. 2003. Т. 11. № 21. С. 1192–96. 18. Aarsland D, Cummings JL. Depression in Parkinson disease. Acta Psychiatr Scand 2002;106:161–62. 19. Alexopoulos GS. Vascular disease, depression and dementia. J Am Ger Soc 2003;51:1178–80. 20. Alexopoulos GS, Kiosses DN, Klimstra S, et al. Clinical presentation of the «depression–executive dysfunction syndrome» of late life. Am J Ger Psychiatr 2002;10:98–106. 21. Barber R. Noncognitive symptoms. In: Cerebrovascular Disease, Cognitive Impairment and Dementia. Second edition. Ed by J O’Brien et al. London, New York Martin Dunitz 2004, p. 253–69. 22. Carney R.M., Freedland K.E., Rich M.W., Jaffe A.S. Depression as a risk factor for cardiac events in established coronary heart disease: a review of possible mechanisms // Ann Behav Med 1995; 17:142–149. 23. Cipriani A, Barbui C, Geddes JR. Suicide, depression, and antidepressants. Brit Med J 2005; 330:373–74. 24. Devenand DP, Pelton GH, Roose SP. Depressive features in dementia. In: Evidence–based Dementia Practice. Ed by N Qizilbash et al. Oxford: Blackwell Sciences 2002, p. 695–98. 25. Helzer E, Pryzbeck TR. The coocurrence of alcoholism with other psychiatric disorders in the general population and its impact of treatment. I Stud Alcohol 1998; 49 (3): 219–24. 26. House A. Defining, recognizing and managing depression in neurological practice. Pract Neurol 2003;3:196–203. 27. Hyttel I. Pharmacological characterization of selective serotonin reuptake inhibitors (SSRls). Int Clin Psychopharmacol 1994; 9 (suppl. 1): 19–26. 28. Katona C. Managing depression and anxiety in the elderly patient. Eur Neuropsychopharm 2000;10(Suppl. 4):S427–S432. 29. Lipowski Z. Somatization and depression// Psychosomatics. – 1988 – Vol. 31, № 1 – P. 13 – 21. 30. Navarro V, Gasto C, Lomena F, et al. Prognostic value of frontal functional neuroimaging in lateonset severe major depression. Brit J Psychiatr 2004;184:306–11. 31. Scott J. Treatment of chronic depression. New Engl J Med 2000:342:1518–20. 32. Shenal BV, Harrison DW, Demaree HA. The neuropsychology of depression: a literature review and preliminary model. Neuropsychol Rev 2003;13:33–42. 33. Snow V, Lascher S, Mottur–Pilson C. Pharmacologic treatment of acute major depression and dysthymia. Ann Int Med 2000;132:738–42. 34. Taylor G. Emotional expressiveness and psychosomatic process// Psychosomatic medicine and contemporary psychoanalysis(Ed. G. Taylor) – 1989 – P. 73– 113. 35. Tylee A. Depression in Europe: experience from the DEPRES II survey. Eur Neuropsychopharm 2000;10(Suppl. 4):S445–S448.
![Таблица 1. Побочные эффекты ИПП [1, 4–7] (окончание) Table 1. Proton-pump inhibitors side effects [1, 4–7]](https://laram-halal.ru/wp-content/uploads/tablica-1-pobochnye-effekty-ipp-1-4-7-okonchanie-table-330x140.jpg)