Введение
В последние десятилетия заболеваемость нейроэндокринными опухолями (НЭО) неуклонно растет. НЭО — относительно редкая гетерогенная группа новообразований с ежегодной заболеваемостью 35 случаев на 100 000 человек. Обновленная ВОЗ классификация гастроэнтеропанкреатических (ГЭП) опухолей верифицирует их в зависимости от локализации, клинических проявлений и степени дифференцировки. Из-за медленного роста и отсутствия ранних симптомов большинство НЭО часто диагностируют на поздних стадиях, когда варианты лечебного воздействия ограничены [1].
НЭО возникают в любых органах, где имеются эндокринные клетки. Эти новообразования могут не давать клинической симптоматики, однако в случае их функциональности развиваются эндокринные синдромы, представляющие угрозу здоровью и жизни пациентов.
Задачей лечения больных с НЭО являются ликвидация самой опухоли и подавление симптомокомплекса, обусловленного карциноидным синдромом. Единственным радикальным методом лечения остается хирургический, а при невозможности его использования торможение опухолевого роста и подавление гормональной экспрессии аналогами соматостатина (в частности, октреотидом) позволяют продлить жизнь и улучшить ее качество у больных.
Производство [ править ]
Пищеварительная система [ править ]
Соматостатин секретируется дельта-клетками в нескольких местах пищеварительной системы, а именно в пилорическом антральном отделе , двенадцатиперстной кишке и островках поджелудочной железы . [13]
Соматостатин, высвобождаемый в антральном отделе привратника, проходит через портальную венозную систему к сердцу, затем попадает в системный кровоток, чтобы достичь мест, где он будет оказывать свое тормозное действие. Кроме того, высвобождение соматостатина из дельта-клеток может действовать паракринным образом. [13]
В желудке соматостатин действует непосредственно на продуцирующие кислоту париетальные клетки через рецептор, связанный с G-белком (который ингибирует аденилатциклазу, таким образом эффективно противодействуя стимулирующему эффекту гистамина), уменьшая секрецию кислоты. [13] Соматостатин может также косвенно снижать выработку кислоты в желудке, предотвращая высвобождение других гормонов, включая гастрин и гистамин, которые эффективно замедляют процесс пищеварения.
Мозг [ править ]
| Sst экспрессируется в интернейронах конечного мозга мыши на 15.5-й день эмбриона. Атласы мозга Аллена | Экспрессия Sst у взрослой мыши. Атласы мозга Аллена |
Соматостатин вырабатывается нейроэндокринных нейронов вентромедиального ядра в гипоталамусе . Эти нейроны проецируются на срединное возвышение , где соматостатин высвобождается из нейросекреторных нервных окончаний в гипоталамо-гипофизарную систему через аксоны нейронов. Соматостатин затем осуществляется до передней доли гипофиза , где он ингибирует секрецию гормона роста из somatotrope клеток. Нейроны соматостатина в перивентрикулярном ядре опосредуют эффекты отрицательной обратной связи гормона роста.по собственному выпуску; нейроны соматостатина реагируют на высокие циркулирующие концентрации гормона роста и соматомединов, увеличивая высвобождение соматостатина, тем самым снижая скорость секреции гормона роста.
Соматостатин также продуцируется несколькими другими популяциями, которые проецируются центрально, т. Е. В другие области мозга, а рецепторы соматостатина экспрессируются во многих различных участках мозга. В частности, популяции нейронов соматостатина происходят в дугообразном ядре , [14] в гиппокампе , [15] и коротколатентное ядро одиночного тракта . [ необходима цитата
]
Использование аналогов соматостатина в лечении НЭО
Октреотид, первый синтетический аналог соматостатина, первоначально использовался для коррекции клинических проявлений карциноидного синдрома. Недавние исследования показали, что лечение октреотидом может быть не только симптоматическим, но и таргетным, учитывая противоопухолевые эффекты препарата. Разработан октреотид длительного действия, который обеспечивает большее удобство введения [2].
Клинические эффекты октреотида пролонгированного действия
Октреотид продемонстрировал хорошее действие на гормональную гиперсекрецию и рост НЭО. Препарат играет ключевую роль в коррекции симптоматики, вызванной секрецией нейропептидов у пациентов с высокодифференцированными карциномами, обладает противоопухолевой активностью при карциноидах кишечника, значительно увеличивая время прогрессирования НЭО. Октреотид пролонгированного действия эффективен как в качестве монотерапии, так и в сочетании с химио- или радионуклидной терапией пептидных рецепторов [3]. Препарат вводят 1 раз в месяц, он оказывает эффективное и безопасное противоопухолевое и симптоматическое действие при непрерывном поддержании концентрации в организме [4–6].
Карциноиды представляют собой в основном медленно растущие НЭО с низкой пролиферативной активностью. Октреотид остается стандартом симптоматической терапии карциноидного синдрома, обладая антипролиферативной активностью, одновременно тормозит рост опухолей. Хотя лечение октреотидом само по себе редко приводит к ремиссии опухолевого процесса, он замедляет прогрессирование опухоли. Если радикальные или интервенционные методы лечения метастазов в печень невозможны, или метастазы не ограничиваются одной локализацией, то единственным вариантом остается системное лечение аналогами соматостатина [7]. Стандартное консервативное лечение проводится октреотидом, интерфероном-α и химиотерапией. Из-за сложности исследований эффективности, а также высокого потенциала побочных эффектов широкое применение интерферона-α в лечении метастатических НЭО ограничено, а высокодифференцированные НЭО не обладают высокой чувствительностью к химиотерапии из-за низкой скорости митоза, высоких уровней антиапоптотического белка Bcl-2 и повышенной экспрессии гена резистентности ко многим лекарственным средствам. Поэтому наиболее перспективным пока остается применение аналогов соматостатина [8].
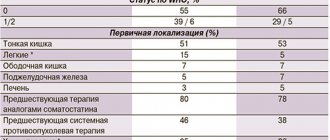
Аналоги соматостатина являются стандартом лечения пациентов с функционирующими НЭО гастроэнтеропанкреатической локализации. Снижение гормональной гиперсекреции получено более чем у 70% пациентов со злокачественными функционирующими НЭО кишечника и поджелудочной железы, стабилизация опухолевого роста наблюдалась более чем у 50% пациентов с прогрессирующим ростом опухоли [9]. Гастроэнтеропанкреатические нейроэндокринные опухоли (ГЭП НЭО) представляют собой относительно редкую группу гетерогенных новообразований с индолентным течением. Использование октреотида в их лечении кардинально изменило терапевтическую тактику. Клинические исследования PROMID и RADIANT-2 подтвердили преимущества лечения ГНО октреотидом пролонгированного действия: примерно в половине случаев размер опухоли стабилизировался и примерно у 10% пациентов уменьшался. Октреотид длительного действия имеет надежный профиль безопасности и хорошо переносится, прекращение лечения из-за побочных эффектов встречается редко [10–13].
Исследование PROMID (плацебо-контролируемое проспективное рандомизированное исследование пациентов с метастатическими НЭО кишечника), проведенное в 18 центрах Германии и включавшее 85 больных, продемонстрировало антипролиферативный эффект октреотида пролонгированного действия при высокодифференцированных НЭО желудочно-кишечного тракта, 40% из которых были функционирующими и 60% нефункционирующими, со статистически значимым увеличением выживаемости без прогрессирования по сравнению с плацебо. Доказала свою эффективность и комбинированная терапия аналогами соматостатина вкупе с радионуклидной терапией [14].
Функции [ править ]
D-ячейка видна вверху справа, а соматостатин представлен средней стрелкой, указывающей влево.
Соматостатин классифицируется как ингибирующий гормон [6] и вызывается низким pH. [ необходима цитата
] Его действия распространяются на разные части тела. Высвобождение соматостатина подавляется блуждающим нервом . [16]
Передний гипофиз [ править ]
В передней доле гипофиза эффекты соматостатина следующие:
- Подавление высвобождения гормона роста (GH) [17] (тем самым противодействуя эффектам гормона, высвобождающего гормон роста (GHRH))
- Подавление высвобождения тиреотропного гормона (ТТГ) [18]
- Ингибирование аденилатциклазы в париетальных клетках
- Подавление высвобождения пролактина (ПРЛ)
Желудочно-кишечная система [ править ]
- Соматостатин гомологичен кортистатину (см. Семейство соматостатина ) и подавляет высвобождение желудочно-кишечных гормонов.
- Уменьшает скорость опорожнения желудка, уменьшает сокращение гладких мышц и кровоток в кишечнике [17]
- Подавляет выработку гормонов поджелудочной железы Высвобождение соматостатина запускается бета-клеточным пептидом урокортином3 (Ucn3) для ингибирования высвобождения инсулина . [19] [20]
- Подавляет высвобождение глюкагона [19]
Возможности коррекции дозы октреотида
Пациентам, которые не отвечают или перестают реагировать на стандартные дозы октреотида, назначают высокие дозы этого препарата, которые приводят к снижению или нормализации выработки биологически активных аминов и нейропептидов [15]. Поиск литературы, посвященной эффективности и безопасности октреотида пролонгированного действия в дозах, превышающих одобренные FDA для лечения НЭО (30 мг/мес.), в базах данных PubMed (за 1998–2012 гг.) и Кохрейновской библиотеки (за 2000–2013 гг.) выявил 1086 публикаций. В 11 исследованиях сообщалось об использовании более высоких доз для контроля симптомов и прогрессирования опухоли, хотя количественная оценка тяжести симптомов и анализа качества жизни не проводилась. В 10 исследованиях сообщалось об эффективности препарата у 260 больных в диапазоне доз от 40 мг/мес. или 30 мг в 3 нед. до 120 мг/мес. В 8 исследованиях изложено клиническое мнение экспертов о целесообразности повышения дозы препарата до 60 мг/мес. для контроля симптомов и предотвращения прогрессирования опухоли. Восемь исследований были посвящены безопасности высоких доз, при этом не отмечалось повышенной токсичности, ассоциированной с дозами, превышающими 30 мг/мес. [16].
J.R. Strosberg et al. (2014) изучили возможности увеличения дозы октреотида у пациентов с НЭО. Пациенты с карциноидным синдромом или НЭО поджелудочной железы получали дозу октреотида более 30 мг каждые 4 нед. в период с 2000 по 2012 г. Среди 239 пациентов с НЭО было 53% мужчин, средний возраст при первой эскалации дозы составил 60 лет (стандартное отклонение (SD) 11 лет), время от начала увеличения дозы — 1,7 года (SD 2,0 года). Основными показаниями к увеличению дозы были проявления карциноидного синдрома или иная гормональная активность (62%), а также рентгенологически подтвержденное прогрессирование опухоли (28%). Наиболее часто дозу увеличивали до 40 мг каждые 4 нед. (71%) и 60 мг каждые 4 нед. (18%). Из 90 пациентов, у которых до первого повышения дозы отмечались приливы, 73 (81%) либо перестали испытывать их вовсе, либо отмечали их меньшую выраженность. Из 107 пациентов с диареей 85 (79%) отметили ее урежение или полное купирование после первой эскалации дозы. Это исследование показало, что увеличение дозы вводимого октреотида может привести к улучшению контроля проявлений карциноидного синдрома [17].
Октреотид пролонгированного действия стабилизирует высокодифференцированные опухоли кишечника, но анализ выживаемости не проводился из-за недостаточного количества описанных случаев. Для купирования карциноидного синдрома часто применяются высокие дозы препарата. S.C. Lau et al. (2018) провели исследование с целью определить, коррелирует ли доза октреотида с выживаемостью пациентов с ГНО. Сравнили общую выживаемость у 170 пациентов, которые получали низкие (<30 мг) и высокие (≥30 мг) дозы октреотида. Исходные характеристики в группах были сходными: средний возраст 62–63 года, мужчин было 50 (58%); 46 (48%) опухолей локализовались в тонкой кишке, а 74 (66%) имели метастазы в печени. Среднее время от постановки диагноза до начала лечения составило 5,5 и 6,0 мес. соответственно. Лечение октреотидом пролонгированного действия было инициировано с целью коррекции нейроэндокринных симптомов (71%), стабилизации состояния (23%) или контроля биомаркеров (6%). Медиана общей выживаемости оказалась больше в группе получавших высокие дозы октреотида (66 мес. по сравнению с 22 мес., многофакторное отношение рисков (ОР) 0,5; р<0,01). Возраст ≥65 (ОР 1,9; р<0,01) и опухоли поджелудочной железы (ОР 1,7; р=0,03) были предикторами худшей выживаемости [18].
У пациентов с НЭО поздних стадий (1999–2009 гг.), получающих лечение октреотидом пролонгированного действия в течение 12 мес., сравнили 5-летнюю выживаемость в зависимости от получаемой ими дозы в течение 28 дней, усредненной за первые 3 мес.: низкой (≤20 мг), средней (21–30 мг) и высокой (>30 мг). Среди 222 пациентов 81 (36%) получал низкие дозы, 82 (37%) — средние и 59 (27%) — высокие. Многофакторный анализ показал, что по сравнению со средней низкая доза была ассоциирована со значительно худшей выживаемостью (ОР 2,00; p=0,001), тогда как высокая исходная доза (ОР 1,09; p=0,719) не показала дополнительных преимуществ по сравнению со средней. Это популяционное исследование определило потенциальные преимущества препарата в дозе 21–30 мг в отношении выживаемости для пожилых пациентов с НЭО поздних стадий [19].
K. Al-Efraij et al. провели ретроспективный обзор лечения неоперабельных пациентов с НЭО и метастазами, получавших октреотид пролонгированного действия в дозе 30 мг/мес. и выше с 2005 по 2011 г. Увеличение дозы октреотида было ассоциировано с эффективным нивелированием симптомов НЭО у пациентов, которые были невосприимчивы к стандартным дозам [20].
Исследования эффективности октреотида пролонгированного действия
S. Saglam et al. (2015) ретроспективно проанализировали медицинские карты 23 пациентов с нефункциональными метастатическими или неоперабельными ГЭП НЭО, которые получали лечение октреотидом пролонгированного действия в качестве первой линии в дозе 30 мг каждые 4 нед. Первичными и вторичными конечными точками были выживаемость без прогрессирования (ВБП) и общая выживаемость (ОВ); пациенты наблюдались в среднем в течение 47 мес. В среднем ВБП и ОВ составили 25,0±3,4 мес. [95% ДИ: 18,4; 31,5] и 71,3±9,5 мес. [95% ДИ: 52,7; 89,9] соответственно, с оценкой 5-летней ОВ 58%. Пациенты с ≤25% опухолевой нагрузки на печень имели лучшую ВБП по сравнению с пациентами, имевшими >25% таковой (32,2±6,2 против 19,4±2,7 мес.; р=0,043). Октреотид является эффективным вариантом лечения с хорошей переносимостью у пациентов с высокодифференцированными нефункциональными ГЭП НЭО [21].
F. Cioppi et al. (2017) провели продольное открытое исследование LARO-MEN1 с целью оценки возможности раннего назначения препарата в качестве профилактического подхода для лечения ГЭП НЭО, связанного с синдромом множественной эндокринной неоплазии 1 типа (MЭН1). Было обследовано 30 пациентов с МЭН1, и 8 из них, у которых выявлялись небольшие (<2 см) НЭО и повышение по крайней мере одного из гормонов гастроэнтеропанкреатической зоны, вводили октреотид пролонгированного действия в дозе 10 мг в/м каждые 28 дней. Препарат показал хорошую эффективность и безопасность, у большинства пациентов за 6-летний период лечения размер опухоли оставался стабильным. Исследование подтвердило возможность профилактического использования октреотида с целью отсрочить или избежать операции у таких пациентов [22, 23].
Изучив базу данных Medicare, C. Shen et al. (2014) выявили пациентов в возрасте ≥65 лет, у которых в период 1999–2007 гг. был диагностирован карциноидный синдром. 2450 (51%) пациентам из 4848 с болезнью на поздней стадии и 81 (10%) пациенту из 807 с солитарной НЭО был назначен октреотид длительного действия на период 6 меc. от начала заболевания. Многофакторная модель пропорциональных рисков выявила, что препарат обеспечил рост 5-летней выживаемости для больных с запущенными стадиями заболевания (ОР 0,61; р≤0,001) [24].
Адренокортикальный рак имеет плохой прогноз, и современные варианты лечения, такие как схемы химиотерапии на основе митотана или платины, обладают ограниченной эффективностью. X. Wang et al. (2019) продемонстрировали пациента с метастазами адренокортикального рака с низкой толерантностью к митотану, которому была назначена терапия октреотидом пролонгированного действия после проведенной сцинтиграфии октреосканом; получен хороший ответ на терапию у этого пациента [25].
Клинические исследования продемонстрировали синергическое действие между октреотидом пролонгированного действия и ингибитором протеинкиназ эверолимусом. Активность и безопасность эверолимуса оценивали в сочетании с октреотидом пролонгированного действия у 50 пациентов с НЭО гастроэнтеропанкреатического тракта и легких. Пациенты получали эверолимус в дозе 10 мг/день в сочетании с октреотидом пролонгированного действия в дозе 30 мг каждые 28 дней. Первичной конечной точкой была частота объективного ответа (ЧОО). Первичная локализация опухолей: в поджелудочной железе (14 пациентов), легких (11 пациентов), подвздошной кишке (9 пациентов), тощей и двенадцатиперстной кишке (2 пациента) и при неизвестной локализации (14 пациентов); у 13 (26%) пациентов имел место карциноидный синдром. ЧОО составила 18%; у 2% пациентов отмечен полный ответ, у 16% — частичный, и 74% достигли стабилизации заболевания. Рассчитанный клинический эффект составил 92%. Сочетанная терапия эверолимусом с октреотидом оказалась эффективной, хорошо переносилась и, как показало исследование, может использоваться в качестве первой линии терапии у пациентов с НЭО [26].
В исследовании RADIANT-2 эверолимус в комбинации с октреотидом пролонгированного действия продемонстрировал увеличение продолжительности жизни пациентов с запущенными НЭО, проявляющимися карциноидным синдромом, на 5,1 мес. по сравнению с получающими плацебо плюс октреотид пролонгированного действия [27].
Y.M. Liu et al. (2019) оценивали опухолевую нагрузку, снижающую эффективность и безопасность транскатетерной артериальной эмболизации (TAЭ) в сочетании с терапией октреотидом пролонгированного действия при метастазировании НЭО в печень. В исследовании приняли участие 29 пациентов с такой патологией, проходивших лечение в больнице Университета Сунь Ятсена в 2014–2018 гг. Средний возраст составил 25–69 (50±11) лет. У всех пациентов были гистологически подтверждены метастазы высокодифференцированной опухоли в печень: 17 пациентов получили комбинированную терапию — TAЭ в сочетании с октреотидом пролонгированного действия и 12 пациентов — только октреотидом пролонгированного действия. Объем поражения печени оценивали в соответствии с критериями RECIST (Response Evaluation Criteria In Solid Tumors) 1.1. Было показано, что проведение TAЭ в сочетании с октреотидом пролонгированного действия эффективнее снижало опухолевую нагрузку по сравнению с монотерапией октреотидом [28].
В исследовании, проведенном Г.С. Емельяновой и соавт. (2012), приняли участие 67 больных с морфологически подтвержденным диагнозом НЭО различной локализации, диссеминированным прогрессирующим опухолевым процессом. Иммуногистохимическое исследование выполнено 53 больным, 14 пациентов имели только цитологическую верификацию диагноза. Проводилось лечение Октреотидом-депо в монорежиме и в сочетании с интерфероном-α в дозе 3 млн МЕ 3 р./нед. подкожно. Октреотид-депо в дозе 20–40 мг получали 47 пациентов: 17 — в виде монотерапии, 30 — в сочетании с химиотерапией. Эффективность лечения оценивали по контролю роста опухоли. Ответ опухоли на лечение оценивали в соответствии с критериями RECIST. Контроль симптоматики карциноидного синдрома оценивали по опросникам качества жизни, изменению частоты приливов и случаев диареи. Клиническим ответом считалось снижение приливов до менее 1 раза в неделю и уменьшение частоты диареи — менее 4 раз в сутки или, если диарея отмечалась 2–4 раза в сутки, уменьшение ее частоты, а также исчезновение болей в животе. Симптоматический эффект Октреотида-депо был получен у всех пациентов, препарат позволил контролировать симптомы карциноидного синдрома у всех исследуемых, переносимость была хорошей, увеличения токсичности иммуно- и химиотерапии не отмечалось [29].
История эволюции [ править ]
У позвоночных обнаружено шесть генов соматостатина . Предлагаемая в настоящее время история возникновения этих шести генов основана на трех событиях полногеномной дупликации, которые имели место в эволюции позвоночных наряду с локальными дупликациями у костистых рыб. Предковый ген соматостатина был продублирован во время первого события дупликации всего генома (1R) для создания SS1
и
SS2
. Эти два гена были продублированы во время второго события дупликации всего генома (2R), чтобы создать четыре новых гена соматостатина:
SS1, SS2, SS3
и один ген, который был утрачен во время эволюции позвоночных. Тетраподы сохранили
SS1
(также известный как
SS-14
и
SS-28
) и
SS2
(также известный как кортистатин ) после разделения в клонах Sarcopterygii и Actinopterygii . У костистых рыб
SS1, SS2
и
SS3
были продублированы во время третьего события дупликации всего генома (3R), чтобы создать
SS1, SS2, SS4, SS5
и два гена, которые были потеряны во время эволюции костистых рыб.
SS1
и
SS2
прошли через локальное дублирование, чтобы дать начало
SS6
и
SS3
. [8]
Клинические наблюдения
Октреотид пролонгированного действия купирует клинические проявления у пациентов с НЭО и обладает противоопухолевой активностью у пациентов с метастатическими НЭО кишечника, но остается неясным, обладает ли он антипролиферативным действием у пациентов с запущенными НЭО поджелудочной железы. H. Kitade et al. (2018) сообщили о 71-летнем мужчине с множественными метастазами в печень НЭО поджелудочной железы, который получал лечение эверолимусом по 10 мг и сунитинибом по 25 мг ежедневно в течение 3 нед. Однако терапия была прекращена из-за прогрессирования заболевания и серьезных побочных эффектов. Октреотид пролонгированного действия исходно вводился одновременно с эверолимусом; уровень опухолевых маркеров заметно снизился, и метастазы печени уменьшились в размерах. Иммуногистохимическое исследование образцов опухолей, полученных до лечения, показало высокий уровень экспрессии соматостатинового рецептора 2 типа. Клиническое наблюдение позволило предположить, что октреотид пролонгированного действия может быть вариантом лечения прогрессирующих НЭО поджелудочной железы после отмены эверолимуса и сунитиниба [30].
T. Arao et al. (2017) представили 54-летнюю женщину, госпитализированную для лечения акромегалии. Уровень гормона роста (ГР) составлял 39,8 нг/мл, инсулиноподобного фактора роста-1 (ИФР-1) — 717 нг/мл, уровень ГР не подавлялся (22,9 нг/мл) при проведении перорального глюкозотолерантного теста. МРТ показала, что опухоль размером 21×17 мм распространяется в правую супраселлярную область и проникает в кавернозный синус. Начато лечение октреотидом пролонгированного действия в дозе 20 мг каждые 4 нед. После введения трех доз уровни ГР и ИФР-1 снизились до 2,19 нг/мл (до 1,69 после проведения глюкозотолерантного теста) и 205 нг/мл соответственно. Снижение уровней ГР и ИФР-1, уменьшение размеров опухоли и инвазии кавернозного синуса позволили выполнить оперативное лечение без последующих осложнений. Предоперационное введение октреотида пролонгированного действия улучшило результаты лечения акромегалии [31].
Беременность при акромегалии возникает редко и протекает благоприятно, но в этот период может произойти увеличение размеров опухоли. Коррекция роста опухоли во время беременности сложна из-за потенциальных осложнений возможного хирургического вмешательства и побочных эффектов противоопухолевых препаратов. A.M. Hannon et al. (2019) описали уникальный случай применения октреотида у 32-летней женщины с акромегалией, выявленной на 11-й нед. беременности. Имела место крупная макроаденома, проникающая в супраселлярную цистерну, на 20-й нед. беременности развилась битемпоральная гемианопсия. Пациентка отказалась от операции, ей было назначено лечение октреотидом 100 мкг 3 р./сут подкожно, приведшее к нормализации полей зрения после 2 нед. терапии. Дальнейшее уменьшение полей зрения на 24-й нед. беременности заставило увеличить дозу октреотида до 150 мкг 3 р./сут; зрение оставалось стабильным до конца беременности. На сроке 14 нед. был диагностирован гестационный диабет, а с 22-й нед. назначен инсулин. Других акушерских осложнений не было, рост плода продолжался до конца беременности. Проведено плановое кесарево сечение на сроке 34 нед., масса тела плода при рождении составляла 3,2 кг, 9 баллов по шкале Aпгар, врожденных аномалий не выявлено. Менструальный цикл после родов регулярный. Женщине назначили октреотид пролонгированного действия в дозе 40 мг и направили на операцию. Через 2 года после родов ребенок развивался нормально. Впервые было описано возникновение акромегалии во время беременности и улучшение параметров периметрии октреотидом [32].
Гигантские аденомы гипофиза представляют собой доброкачественные опухоли диаметром ≥4 см. Они проявляются симптоматикой, обусловленной гиперсекрецией одного или нескольких гормонов гипофиза и вовлечением в рост окружающих структур, а сдавление гипофиза может привести к гипопитуитаризму. F. Dicuonzo et al. (2019) сообщили о молодой женщине с акромегалией с неоперабельной гигантской секретирующей ГР аденомой гипофиза, распространяющейся до кавернозного синуса, орбитальной полости, верхнечелюстного синуса, клиновидного синуса и височной ямки справа. Лечение октреотидом пролонгированного действия помогло быстро снять головную боль и двустороннюю гемианопсию, возникшую вследствие вовлечения в процесс перекреста зрительных нервов, уменьшить клинические проявления акромегалии и со временем контролировать рост опухоли, усилить фертильность, позволило пациентке забеременеть. Терапию отменили во время беременности. Пациентка родила здорового сына. Размер опухоли в конце беременности и при последующем наблюдении не увеличивался. Данный случай подтверждает возможность благоприятного исхода беременности у пациентки, страдающей акромегалией [33].
Синдром эктопической продукции адренокортикотропного гормона (АКТГ) — редкое заболевание, часто сопровождается тяжелым гиперкортицизмом, требующим хирургического вмешательства. P. Rodrigues et al. (2012) описали 33-летнего пациента, госпитализированного в 1993 г. с клиническими проявлениями синдрома Кушинга. У него отмечались высокие уровни АКТГ в плазме и резко повышенное выделение свободного кортизола с мочой, которые не подавлялись высокими дозами дексаметазона. Гипофиз на МРТ выглядел нормально, но КТ грудной клетки выявила 1,7 см образование в левом легком. Инструментальные исследования показали наличие АКТГ-продуцирующей нейроэндокринной карциномы с отдаленными метастазами. Пациент получал химиотерапию вкупе с октреотидом, что привело к благоприятному клиническому и биохимическому результату. Авторы подчеркивают долгосрочный ответ на медикаментозную терапию октреотидом с превосходным антипролиферативным эффектом [34].
A. Kanno et al. (2017) представили случай инсулиномы у женщины 80 лет с приступами гипогликемии. Пациентка отказалась от хирургического лечения, подкожное введение 50 мкг октреотида перед сном предотвращало гипогликемию в ночное время. Препарат способен подавлять секрецию инсулина, хотя не существует конкретного протокола для его использования в таких случаях. Пациентка не могла сама ежедневно вводить препарат, ей назначили октреотид пролонгированного действия, что предотвратило эпизоды гипогликемии в течение 4 нед., и качество жизни пациентки существенно улучшилось [35].
Ссылки [ править ]
- ^ a b c GRCh38: Ensembl, выпуск 89: ENSG00000157005 — Ensembl , май 2022 г.
- ^ a b c GRCm38: выпуск Ensembl 89: ENSMUSG00000004366 — Ensembl , май 2022 г.
- «Human PubMed Reference:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США
. - «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США
. - «соматостатин». Encyclopdia Britannica. Энциклопедия Britannica Online. Энциклопедия Britannica Inc., 2016. Интернет. 04 mag. 2016 < https://www.britannica.com/science/somatostatin >.
- ^ a b Costoff A. «Раздел 5, Глава 4: Структура, синтез и секреция соматостатина» . Эндокринология: эндокринная поджелудочная железа
. Медицинский колледж Джорджии. п. 16. Архивировано из оригинала 5 апреля 2008 года . Проверено 19 февраля 2008 . - «препропротеин соматостатина [Homo sapiens]» . Справочная последовательность NCBI
. Национальный центр поддержки биотехнологической информации (NCBI). - ^ a b c Лю И, Лю Д, Чжан И, Ли С, Лю Х, Линь Х (сентябрь 2010 г.). «Эволюция соматостатина у позвоночных». Джин
.
463
(1–2): 21–8. DOI : 10.1016 / j.gene.2010.04.016 . PMID 20472043 . - Gahete MD, Кордова-Chacón Дж, Дюран-Прадо М, Малагон М.М., Мартинес-Фуэнтес AJ, Грация-Наварро F, Луке Р. М., Кастаньо JP (июль 2010 г.). «Соматостатин и его рецепторы от рыб до млекопитающих» . Летопись Нью-Йоркской академии наук
.
1200
: 43–52. DOI : 10.1111 / j.1749-6632.2010.05511.x . PMID 20633132 . S2CID 23346102 . - «Энтрез Джин: Соматостатин» .
- ↑
Shen LP, Pictet RL, Rutter WJ (август 1982 г.). «Соматостатин I человека: последовательность кДНК» .
Труды Национальной академии наук Соединенных Штатов Америки
.
79
(15): 4575–9. DOI : 10.1073 / pnas.79.15.4575 . PMC 346717 . PMID 6126875 . - ↑
Shen LP, Rutter WJ (апрель 1984 г.). «Последовательность гена соматостатина I человека».
Наука
.
224
(4645): 168–71. DOI : 10.1126 / science.6142531 . PMID 6142531 . - ^ a b c Boron WF, Boulpaep EL (2012). Медицинская физиология
(2-е изд.). Филадельфия, Пенсильвания: Эльзевир. ISBN 9781437717532. - Минами, Широ; Камегай, Джун; Сугихара, Хитоши; Сузуки, Нобучика; Вакабаяси, Ичиджи (1998). «Гормон роста ингибирует собственную секрецию, воздействуя на гипоталамус через свои рецепторы на нейроны нейропептида Y в дугообразном ядре и нейроны соматостатина в перивентрикулярном ядре» . Эндокринный журнал
.
45
. Проверено 10 января 2022 года . - Стефанелли, Томас; Бертоллини, Кристина; Люшер, Кристиан; Мюллер, Доминик; Мендес, Пабло (февраль 2016 г.). «Интернейроны соматостатина гиппокампа контролируют размер ансамблей нейрональной памяти» . Нейрон
.
89
(5). DOI : 10.1016 / j.neuron.2016.01.024 . PMID 26875623 . Проверено 10 января 2022 года . - Holst JJ, Skak-Нильсен Т, Orskov С, Сайером-Poulsen S (август 1992 г.). «Блуждающий контроль высвобождения соматостатина, вазоактивного кишечного полипептида, гастрин-высвобождающего пептида и HCl из неантрального желудка свиньи». Скандинавский журнал гастроэнтерологии
.
27
(8): 677–85. DOI : 10.3109 / 00365529209000139 . PMID 1359631 . - ^ а б Bowen R (2002-12-14). «Соматостатин» . Биомедицинские гипертексты
. Государственный университет Колорадо . Проверено 19 февраля 2008 . - Первая помощь для USMLE Step 1, 2010. Страница 286.
- ^ a b Costoff A. «Раздел 5, Глава 4: Структура, синтез и секреция соматостатина» . Эндокринология: эндокринная поджелудочная железа
. Медицинский колледж Джорджии. п. 17. Архивировано из оригинала на 31 марта 2008 года . Проверено 19 февраля 2008 . - ↑
van der Meulen T, Donaldson CJ, Cáceres E, Hunter AE, Cowing-Zitron C, Pound LD, Adams MW, Zembrzycki A, Grove KL, Huising MO (июль 2015 г.). «Урокортин3 опосредует соматостатин-зависимый контроль секреции инсулина с отрицательной обратной связью» .
Природная медицина
.
21
(7): 769–76. DOI : 10.1038 / nm.3872 . PMC 4496282 . PMID 26076035 .