- Симптомы ФП
- Патогенез и общая клиническая картина
- Причины ФП и факторы риска
- Методы диагностики
- Стратегии лечения ФП
- Применение препарата Пропанорм при ФП
Фибрилляция предсердий (ФП) – синоним более применимого в странах СНГ термина «Мерцательная аритмия».
Фибрилляция предсердий является наиболее распространенным нарушением сердечного ритма. ФП не связана с высоким риском внезапной смерти, поэтому ее не относят к фатальным нарушениям ритма, как, например, желудочковые аритмии.
Фибрилляция предсердий
Один из самых распространенных видов наджелудочковых тахиаритмий – фибрилляция предсердий (ФП). Фибрилляцией называют быстрое нерегулярное сокращение предсердий, при этом частота их сокращений превышает 350 в минуту. Появление ФП характеризуется нерегулярным сокращением желудочков. На долю ФП приходится более 80 % всех пароксизмальных суправентрикулярных тахиаритмий. Фибрилляция предсердий возможна у пациентов всех возрастных категорий, однако у больных пожилого возраста распространенность синдрома увеличивается, что связано с учащением органической патологии сердца.
Причины развития и факторы риска
Сердечная патология
- ОИМ (нарушение проводимости и возбудимости миокарда).
- Артериальная гипертензия (перегрузка ЛП и ЛЖ).
- Хроническая сердечная недостаточность (нарушение структуры миокарда, сократительной функции и проводимости).
- Кардиосклероз (замещение клеток миокарда соединительной тканью).
- Миокардиты (нарушение структуры при воспалении миокарда).
- Ревматические пороки с поражением клапанов.
- Дисфункция СУ (синдром тахи-бради).
Внесердечная патология
- Заболевания щитовидной железы с проявлениями тиреотоксикоза.
- Наркотическая или иная интоксикация.
- Передозировка препаратов наперстянки (сердечных гликозидов) при лечении сердечной недостаточности.
- Острая алкогольная интоксикация или хронический алкоголизм.
- Неконтролируемое лечение диуретиками.
- Передозировка симпатомиметиков.
- Гипокалиемия любого происхождения.
- Стресс и психоэмоциональное перенапряжение.
Возрастные органические изменения.
С возрастом структура миокарда предсердий претерпевает изменения. Развитие мелкоочагового кардиосклероза предсердий может стать причиной фибрилляции в пожилом возрасте.
Профилактика
Первичная профилактика фибрилляции предсердий предусматривает грамотное лечение сердечной недостаточности и артериальной гипертензии. Вторичная профилактика состоит в:
- соблюдении врачебных рекомендаций;
- проведении кардиохирургического лечения;
- ограничении психических и физических нагрузок;
- отказе от спиртных напитков, курения.
Также больной должен:
- рационально питаться;
- контролировать массу тела;
- следить за уровнем сахара в крови;
- не принимать бесконтрольно лекарственные препараты;
- ежедневно измерять артериальное давление;
- лечить гипертиреоз и гипотиреоз.
Данная статья размещена исключительно в познавательных целях и не является научным материалом или профессиональным медицинским советом.
Классификация фибрилляции предсердий
По продолжительности клинических проявлений.
Различают следующие формы ФП:
- Пароксизмальная (приступообразная).
Одиночные эпизоды ФП, длящиеся не более 48 часов в случае применения кардиоверсии, либо до 7 суток в случае спонтанного восстановления ритма. - Персистирующая форма.
Эпизоды фибрилляции предсердий, длящиеся более 7 суток без спонтанного восстановления, либо фибрилляция, поддающаяся кардиоверсии (медикаментозной или электрической) через 48 часов и более. - Постоянная форма(хроническая).
Непрерывная ФП, не поддающаяся кардиоверсии, в случае если врачом и пациентом принято решение оставить попытки восстановить синусовый ритм.
По величине ЧСС
- Тахисистолическая.
Фибрилляция предсердий с частотой желудочковых сокращений более 90–100 уд. в мин. - Нормосистолическая.
AV-узел позволяет желудочкам сокращаться с частотой 60–100 уд/мин. - Брадисистолическая.
ЧСС при этой форме фибрилляции не достигает 60 уд./мин.
Типы мерцательной аритмии (МА)
Термин «мерцательная аритмия» может обозначать два следующих вида суправентрикулярной тахиаритмии.
Фибрилляция (мерцание предсердий).
В норме электрический импульс возникает в синусовом узле (в стенке правого предсердия), распространяется по миокарду предсердий и желудочков, вызывая их последовательное сокращение и выброс крови. При ФП электрический импульс распространяется хаотично, заставляя предсердия «мерцать», когда волокна миокарда сокращаются несогласованно и очень быстро. В результате хаотичной передачи возбуждения на желудочки, они сокращаются неритмично и, как правило, недостаточно эффективно.
Трепетание предсердий.
В этом случае сокращение волокон миокарда происходит в более медленном темпе (200–400 уд./мин.). В отличие от ФП, при трепетании предсердия все-таки сокращаются. Как правило, за счет периода рефрактерности атриовентрикулярного узла на желудочки передается не каждый электрический импульс, поэтому они сокращаются не в столь быстром темпе. Однако, как и при фибрилляции, при трепетании насосная функция сердца нарушается, а миокард испытывает дополнительную нагрузку.
Осложнения мерцательной аритмии
По последним данным, пациенты с мерцательной аритмией попадают в группу риска не только по развитию тромбоэмболического инсульта, но и инфаркта миокарда. Механизмы поражения таковы: при фибрилляции предсердий невозможно полноценное сокращение предсердий, поэтому кровь в них застаивается и в пристеночном пространстве предсердий образуются тромбы. Если такой тромб с током крови попадает в аорту и в менее крупные артерии, то возникает тромбоэмболия артерии, питающей какой-либо орган: головной мозг, сердце, почки, кишечник, нижние конечности. Прекращение кровоснабжения вызывает инфаркт (некроз) участка этого органа. Инфаркт мозга называется ишемическим инсультом. Наиболее часто встречаются осложнения:
- Тромбоэмболия и инсульт.
Чаще всего мишенью оказывается головной мозг (по прямым каротидным артериям тромб достаточно легко «выстреливает» в этом направлении). По статистике, каждый пятый пациент с инсультом имеет в анамнезе фибрилляцию предсердий. - Хроническая сердечная недостаточность.
Фибрилляция и трепетание предсердий могут вызвать усиление симптомов недостаточности кровообращения, вплоть до приступов сердечной астмы (острой левожелудочковой недостаточности) и отека легких. - Дилатационная кардиомиопатия.
Тахисистолическая форма МА, когда частота сокращений желудочков постоянно превышает 90 ударов, быстро приводит к патологическому расширению всех сердечных полостей. - Кардиогенный шок и остановка сердца
. В редких случаях приступ мерцания или трепетания предсердий с выраженными гемодинамическими нарушениями может привести к аритмогенному шоку – жизнеугрожающему состоянию.
Диета
При фибрилляции предсердий больной должен употреблять продукты, богатые витаминами, микроэлементами и веществами, способными расщеплять жиры. Имеются в виду:
- чеснок, лук;
- цитрусовые;
- мед;
- клюква, калина;
- кешью, грецкие орехи, арахис, миндаль;
- сухофрукты;
- кисломолочные продукты;
- проросшие зерна пшеницы;
- растительные масла.
Из рациона нужно исключить:
- шоколад, кофе;
- алкоголь;
- жирное мясо, сало;
- мучные блюда;
- копчености;
- консервы;
- наваристые мясные бульоны.
Не допустить образования тромбов помогает яблочный уксус. 2 ч. л. нужно развести в стакане теплой воды и добавить туда ложку меда. Пить за полчаса до еды. Профилактический курс составляет 3 недели.
Медикаментозная терапия
Выделяют следующие направления лекарственной терапии фибрилляции предсердий: кардиоверсия (восстановление нормального синусового ритма), профилактика повторных пароксизмов (эпизодов) наджелудочковых аритмий, контроль нормальной частоты сокращений желудочков сердца. Также важная цель медикаментозного лечения при МА – предотвращение осложнений – различных тромбоэмболий. Лекарственная терапия ведется по четырем направлениям.
Лечение антиаритмиками.
Применяется, если принято решение о попытке медикаментозной кардиоверсии (восстановления ритма с помощью лекарств). Препараты выбора –
пропафенон, амиодарон.
Пропафенон
– один из наиболее эффективных и безопасных лекарственных препаратов, который используется для лечения наджелудочковых и желудочковых нарушений сердечного ритма. Действие пропафенона начинается через 1 ч после приема внутрь, максимальная концентрация в плазме крови достигается через 2–3 ч и длится 8–12 ч.
Контроль ЧСС.
В случае невозможности восстановить нормальный ритм необходимо привести мерцательную аритмию в нормоформу. Для этой цели применяют бета-адреноблокаторы, антагонисты кальция недигидропиридинового ряда (группы верапамила), сердечные гликозиды и др.
Бета-адреноблокаторы
. Препараты выбора для контроля работы сердца (частоты и силы сокращений) и артериального давления. Группа блокирует бета-адренергические рецепторы в миокарде, вызывая выраженный антиаритмический (урежение ЧСС), а также гипотензивный (снижение АД) эффект. Доказано, что бета-блокаторы статистически увеличивают продолжительность жизни при сердечной недостаточности. Среди противопоказаний к приему – бронхиальная астма (так как блокировка бета 2-рецепторов в бронхах вызывает бронхоспазм).
Антикоагулянтная терапия.
Для снижения риска тромбообразования при персистирующей и хронической формах ФП обязательно назначают препараты, разжижающие кровь. Назначают антикоагулянты прямого (гепарин, фраксипарин, фондапаринукс и пр.) и непрямого (варфарин) действия. Существуют схемы приема непрямых (варфарин) и так называемых новых антикоагулянтов – антагонистов факторов свертывания крови (прадакса, ксарелто). Лечение варфарином сопровождается обязательным контролем показателей свертываемости и, при необходимости, тщательной коррекцией дозировки препарата.
Метаболическая терапия.
К метаболическим препаратам относятся лекарственные средства, улучшающие питание и обменные процессы в сердечной мышце. Эти препараты якобы оказывают кардиопротективное действие, защищая миокард от воздействия ишемии. Метаболическая терапия при МА считается дополнительным и необязательным лечением. По последним данным, эффективность многих препаратов сравнима с плацебо. К таким лекарственным средствам относятся:
- АТФ (аденозинтрифосфат);
- ионы К и Mg;
- кокарбоксилаза;
- рибоксин;
- милдронат;
- предуктал;
- мексикор.
Диагностика и лечение любого вида аритмии требует немалого клинического опыта, а во многих случаях – высокотехнологичного аппаратного оснащения. При фибрилляции и трепетании предсердий главная задача врача – по возможности устранить причину, приведшую к развитию патологии, сохранить функцию сердца и предотвратить осложнения.
ФИБРИЛЛЯЦИЯ И ТРЕПЕТАНИЕ ПРЕДСЕРДИЙ
Фибрилляция предсердий (ФП) является самой распространенной тахиаритмией, выявляемость которой существенно увеличивается с возрастом. По данным Фрэмингемского исследования, она диагностируется у 2-4% в общей популяции людей старше 65 лет, тогда как до 60 лет – менее чем у 1%. Не менее трети госпитализированных в связи с нарушениями ритма сердца составляют больные с ФП, а в старших возрастных группах, по нашим данным, их количество достигает 70%. Популяционные исследования свидетельствуют, что трепетание предсердий (ТП) встречается существенно реже, чем фибрилляция предсердий: не более 0,09% в общей популяции, а в возрасте более 80 лет – 0,7%.
Приоритет электрокардиографической диагностики ФП у человека связывается с именами двух европейских ученых – C.Rothberger и H.Winterberg, которые в 1909 г. описали ее характерные ЭКГ признаки. В то же время, T.Lewis в 1920 г. первым высказал предположение, что причиной данной аритмии может быть циркуляция волны возбуждения в предсердиях. Трепетание предсердий и критерии его ЭКГ дифференциальной диагностики с ФП впервые были описаны в 1911 г. W.Jolly и W.Ritchie.
ЭКГ-диагностика
Электрокардиографическая диагностика фибрилляции и трепетания предсердий, как правило, редко вызывает затруднения. ЭКГ-признаками ФП являются отсутствие зубцов Р, вместо которых регистрируются маленькие, нерегулярные, различной амплитуды и формы асциляции, называющиеся волнами F (частота их от 350 до 600 в минуту) и различные по продолжительности интервалы R-R.
Частота желудочковых ответов при нормальной атриовентрикулярной (АВ) проводимости и отсутствии дополнительных путей предсердножелудочкового проведения составляет от 100 до 160 в минуту.
В отличие от фибрилляции предсердий, при которой нет их эффективного сокращения, ТП сопровождается регулярным и координированным возбуждением миокарда предсердий и их активной систолой. Электрокардиографически выделяют два типа ТП. Тип 1
(«типичное» или «исулучшать» АВ проведение вплоть до развития ТП 1:1 с очень большой частотой желудочковых сокращений и соответствующими отрицательными гемодинамическими проявлениями.
Клиника
У большинства больных с фибрилляцией и трепетанием предсердий диагностируются сердечно-сосудистые заболевания. Так фибрилляция предсердий часто регистрируется при АГ и ИБС и у 40-50% больных с митральным стенозом, идущих на операцию. Кроме того, ФП развивается у 10-20% больных с тиреотоксикозом, у 20-50% взрослых пациентов с дефектом межпредсердной перегородки, у 25% больных с дилатационной и 10% — с гипертрофической кардиомиопатиями. Она возникает у 25-30% больных после операции коронарного шунтирования и в 40% случаев – при хирургических вмешательствах на клапанах сердца. Причиной ФП может быть алкогольное поражение сердца («праздничное сердце»). Реже ФП встречается при амилоидозе и саркоидозе сердца, гипотиреозе, дефекте межжелудочковой перегородки, хронических заболеваниях легких.
У 5-11% пациентов не удается обнаружить признаков заболевания сердечно-сосудистой системы, легких или эндокринной патологии. В этих случаях используют термин «идиопатическая» ФП («изолированная» фибрилляция предсердий – lone atrial fibrillation). Среди молодых больных идиопатическая ФП составляет от 20 до 45% всех случаев пароксизмальной и персистирующей ФП. Выделяют вагусную, адренергическую и смешанную (неопределенную) идиопатическую ФП. Есть данные о семейной предрасположенности к развитию ФП, а некоторые авторы считают, что причиной возникновения аритмии у этих больных могут быть структурные изменения миокарда предсердий, как следствие перенесенного малосимптомного миокардита.
Необходимо выделить фибрилляцию и трепетание предсердий при острых заболеваниях и состояниях: инфаркт миокарда, острый перикардит, пневмония, травма грудной клетки, острая алкогольная интоксикация, интоксикация сердечными гликозидами, прием симпатомиметиков и др. Приступы ФП/ТП у этих больных, как правило, не рецидивируют после разрешения основного заболевания или прекращения интоксикации и, в связи с этим, часто не требуют длительной профилактической антиаритмической терапии.
Фибрилляция и трепетание предсердий ухудшают гемодинамику, утяжеляют течение основного заболевания и приводят к увеличению смертности в 1,5-2, раза у больных с органическим поражением сердца. Неклапанная (неревматическая) ФП увеличивает риск ишемического инсульта в 2-7 раз по сравнению с контрольной группой (больные без ФП), а при ревматическом митральном пороке с хронической ФП он возрастает в 15-17 раз. Частота ишемического инсульта при неревматической фибрилляции предсердий в среднем составляет около 5% в год. Фибрилляция предсердий является причиной инсульта у 7-31% больных старше 60 лет. Низкий риск инсульта у больных с идиопатической ФП моложе 60 лет (1% в год) и несколько выше (2% в год) в возрасте 60-70 лет (Mayo clinic study, 1980). Существенно повышается риск тромбоэмболических осложнений и при трепетании предсердий.
Классификация
Традиционно фибрилляцию и трепетание предсердий, как и другие тахиаритмии, делили на пароксизмальную и хроническую. Однако в 2001 г. эксперты американских коллегии кардиологов и ассоциации сердца и европейского общества кардиологов (АСС/АНА/ESC) предложили другую классификацию ФП (принята Всероссийский научным обществом кардиологов в 2005 г):
1. Впервые выявленная
.
2. Пароксизмальная
: продолжительность до 7 дней, купируется самостоятельно.
3. Персистирующая
: продолжительность обычно более 7 дней, самостоятельно не купируется.
4. Постоянная
: кардиоверсия (медикаментозная или электрическая) неэффективна или не проводилась.
Можно согласиться с мнением М.М.Gallagher (1997), что в ряде случаев придется выделять смешанную форму ФП (пароксизмально-персистирующую), когда некоторые эпизоды мерцания предсердий проходят самостоятельно, а другие требуют кардиоверсии.
По частоте желудочковых сокращений выделяют бради-, нормо-, и тахисистолическую формы ФП/ТП (частота желудочковых сокращений в 1 минуту соответственно менее 60, от 60 до 99, 100 и более).
ЛЕЧЕНИЕ
Основными направлениями в лечении фибрилляции и трепетания предсердий являются:
1. Установление причины ФП и ТП и воздействие на нее (хирургическое лечение митрального порока, лечение гипертиреоза, ограничение или прекращение приема алкоголя, устранение передозировки сердечными гликозидами, симпатомиметиками и др.).
2. Профилактика тромбоэмболических осложнений.
3. Контроль ЧСС, купирование и предупреждение рецидивов аритмии. В таблице 1 представлена классификация антиаритмических препаратов E.Vaughan Williams.
Таблица 1. Классификация антиаритмических препаратов E.Vaughan Williams*
| Класс I Блокаторы натриевых каналов: | |
| IA дизопирамид, новокаинамид, хинидин; | |
| IВ лидокаин, мексилетин, фенитоин (дифенин); | |
| IС флекаинид, морицизин (этмозин), пропафенон. | |
| Класс II Блокаторы бета-адренергических рецепторов. | |
| Класс III Препараты, увеличивающие продолжительность потенциала действия: амиодарон, соталол, дофетилид, ибутилид и др. | |
| Класс IV Блокаторы кальциевых каналов: верапамил, дилтиазем. | |
* Отечественные антиаритмики этацизин и аллапинин относятся к IС классу, а нибентан – к III классу.
КУПИРОВАНИЕ ПАРОКСИЗМОВ
Известно, что 50-60% недавно развившихся (менее 48 часов) пароксизмов ФП прекращаются самостоятельно. Спонтанное восстановление синусового ритма происходит значительно реже при затянувшейся (более 7 суток) фибрилляции предсердий, а фармакологическая кардиоверсия большинством антиаритмиков в эти сроки становится значительно менее эффективной. Алгоритм неотложной терапии ФП/ТП представлен на схеме 1.
Схема 1. Купирование пароксизма фибрилляции предсердий.
ТПЭхоКГ – транспищеводная эхокардиография; ЭИТ – электроимпульсная терапия; * — при высоком риске тромбоэмболии (тромбоэмболия в анамнезе, тяжелая сердечная недостаточность, митральный стеноз и др.), вероятно, перед кардиоверсией необходимо проведение ТПЭхоКГ или длительная терапия антикоагулянтами; ** — использовать только в специализированных кардиологических отделениях; *** — электрическая кардиоверсия — основной метод купирования затянувшихся приступов ФП/ТП (более 48 часов) независимо от состояния сократимости миокарда ЛЖ; **** — при высоком риске срыва ритма и развития тромбоэмболий длительная антитромботическая терапия.
Нецелесообразно купировать
:
1. Кратковременные, хорошо переносимые приступы фибрилляции и трепетания предсердий.
2. Пароксизмы ФП/ТП (при отсутствии неотложных показаний) у больных с высоким риском их рецидива: синдром слабости синусового узла, особенно при отсутствии имплантированного электрокардиостимулятора; нелеченый гипертиреоз; значительное увеличение камер сердца, рефрактерность к профилактической антиаритмической терапии и др. У этих больных проводится урежение ЧСС и профилактика тромбоэмболий (непрямые антикоагулянты или аспирин).
Когда пароксизм тахиаритмии приводит к критическому ухудшению состояния больного, показано немедленное проведение ЭИТ
. Трансторакальную электрическую кардиоверсию фибрилляции предсердий, которая должна быть синхронизирована с собственной электрической активностью сердца (параллельно с зубцом R на ЭКГ), начинают с разряда мощностью 200 Дж (для бифазного тока энергия разряда меньше). Когда первый разряд неэффективен, наносят разряды более высокой мощности – 300, 360 Дж. ТП часто купируется разрядом низкой энергии – 100 Дж. Если первая попытка ЭИТ не была успешной, рекомендуется изменить позицию электродов (передне-заднюю на передне-боковую или наоборот), ввести антиаритмик перед повторной кардиоверсией (для этой цели предлагается в/в введение ибутилида или нибентана), а в специализированных отделениях использовать трансвенозную эндокардиальную электрическую кардиоверсию.
При продолжительности пароксизма фибрилляции или трепетания предсердий более 2-х суток
необходимо назначение непрямых антикоагулянтов (поддержание МНО на уровне 2,0-3,0) в течение 3-4 недель до и после электрической или медикаментозной кардиоверсии. Когда длительность ФП/ТП неизвестна, использование непрямых антикоагулянтов до и после кардиоверсии также необходимо. В настоящее время, в основном, применяются производные кумарина (варфарин).
Непрямые антикоагулянты перед кардиоверсией длительно не применяются, если с помощью транспищеводной ЭхоКГ исключены внутрисердечные тромбы (в 95% случаев они локализуются в ушке левого предсердия). Это так называемая ранняя кардиоверсия
: в/в введение нефракционированного гепарина (сначала струйно 60 ЕД/кг, но не более 4000 ЕД, затем капельно со скоростью, обеспечивающей увеличение АЧТВ в 1,5-2,0 по сравнению с контрольным значением) и/или непродолжительный прием непрямого антикоагулянта (доведение МНО до 2,0-3,0) перед кардиоверсией и продолжение его приема 3-4 недели после восстановления синусового ритма. Таким образом, транспищеводная эхокардиография экономит время перед кардиоверсией, что особенно важно у больных с нестабильной гемодинамикой.
Если продолжительность аритмии даже более 48 часов, при неотложной ЭИТ у больных с осложненным течением ФП/ТП ее не откладывают до достижения терапевтической гипокоагуляции. Внутривенно струйно вводится нефракционированный гепарин и затем проводится его в/в инфузия под контролем АЧТВ. После восстановления синусового ритма терапия пероральными антикоагулянтами (МНО 2,0-3,0) продолжается 3-4 недели.
Трепетание предсердий труднее поддается урежению и купированию антиаритмиками
, поэтому при нем чаще используют электроимпульсную терапию и электрокардиостимуляцию. Доказано, что применение ряда антиаритмиков I и III классов (новокаинамид, дизопирамид, пропафенон, ибутилид) перед кардиостимуляцией, «облегчая проникновение» импульса в цепь re-entry, увеличивает ее эффективность и уменьшает риск провокации ФП.
Если нет показаний для экстренной ЭИТ, одной из основных целей при тахисистолической фибрилляции или трепетании предсердий является урежение ЧСС и только затем, если пароксизм самостоятельно не прекратится, его купируют. Как уже указывалось выше, перед медикаментозной кардиоверсией ФП/ТП (особенно трепетания предсердий), протекающих с высокой ЧСС, антиаритмическими препаратами IA и IC классов блокада проведения в АВ узле обязательна, потому что они могут существенно увеличить частоту сокращений желудочков.
Контроль за ЧСС (урежение до 70-90 в минуту) осуществляется в/в введением верапамила, дилтиазема, бета-адреноблокаторов, сердечных гликозидов (предпочтение отдается дигоксину), амиодарона, а в менее острых ситуациях можно рекомендовать пероральное использование верапамила, дилтиазема, бета-адреноблокаторов:
1. Верапамил
5-10 мг (0,075-0,15 мг/кг) в/в в течение 2 минут или перорально 120-360 мг/сут.
2. Дилтиазем
20 мг (0,25 мг/кг) в/в в течение 2 минут (продолжительная инфузия 5-15 мг/час) или перорально 180-360 мг/сут.
3. Метопролол
5,0 мг в/в в течение 2-3 минут (можно ввести до 3-х доз по 5,0 мг с интервалом в 5 минут) или перорально 25-100 мг дважды в день.
4. Пропранолол
5-10 мг (до 0,15 мг/кг) в/в в течение 5 минут или перорально 80-240 мг/сут.
5. Эсмолол
0,5 мг/кг в/в в течение 1 минуты (продолжительная инфузия 0,05-0,2 мг/кг/мин).
6. Дигоксин
0,25-0,5 мг в/в, затем для быстрого насыщения можно вводить по 0,25 мг в/в каждые 4 часа до суммарной дозы не более 1,5 мг. Поддерживающая доза 0,125-0,25 мг.
7. Амиодарон
5-7 мг/кг в/в за 30-60 мин (15 мг/мин), затем в/в инфузия до 1,2-1,8 г/сут (50 мг/час). Перорально: 800 мг/сут. – 1 неделя, 600 мг/сут. – 1 неделя, 400 мг/сут. – 4-6 недель, затем поддерживающая доза 100-200 мг/сут.
Верапамил, дилтиазем и бета-блокаторы являются препаратами первой линии
для экстренного в/в урежения ЧСС, так как эти антиаритмики высокоэффективны и быстро (в течение 5-10 минут) проявляют свое действие. При в/в введении дигоксина устойчивое замедление частоты желудочкового ритма достигается существенно позже (через 2-4 часа). Однако если снижена сократительная функция ЛЖ (застойная сердечная недостатолько сердечными гликозидами или амиодароном. У больных с высоким риском системной эмболии (ФП/ТП продолжительностью более 2 суток) амиодарон для уменьшения частоты сердечных сокращений является резервным препаратом: возможно восстановление синусового ритма и, следовательно, появление «нормализационных» тромбоэмболий.
В таблице 2 представлены основные антиаритмики, используемые для фармакологической кардиоверсии ФП/ТП.
В ряде международных рекомендаций (ACC/AHA/ESC, 2000, 2001, 2003) отмечается, что купирование пароксизма ФП/ТП у больных с сердечной недостаточностью или ФВ менее 40% надо проводить амиодароном.
Другие антиаритмики должны использоваться с осторожностью или не применяться из-за довольно высокого риска развития аритмогенных эффектов и отрицательного влияния на гемодинамику. Метаанализ результатов плацебо-контролируемых исследований по кардиоверсии амиодароном ФП показал позднее купирование им пароксизмов аритмии: достоверное различие в эффективности между амиодароном и плацебо отмечено не ранее, чем через 6-8 часов после их внутривенного применения.
Учитывая это, после в/в введения «нагрузочной» дозы амиодарона (5 мг/кг за 30-40 минут) целесообразно затем продолжить его в/в инфузию (300-600 мг) в течение 6-12 часов (скорость введения 50 мг/час).
Если аритмия не прекращается, можно продлить в/в введение амиодарона или решить вопрос о проведении ЭИТ. Урежение частоты желудочковых сокращений при внутривенном использовании амиодарона происходит довольно быстро (блокада бета-адренергических рецепторов и кальциевых каналов), что облегчает переносимость ФП/ТП.
Таблица 2. Антиаритмические препараты для внутривенного купирования фибрилляции и трепетания предсердий
| Препарат | Доза и способ введения | Основные побочные эффекты |
| Амиодарон | В/в введение 5-7 мг/кг за 30-60 мин. (15 мг/мин.), затем продолжение в/в введения 1,2-1,8 г/сут. (50 мг/час) | Гипотензия, брадикардия, удлинение интервала QT, тахикардия «пируэт» (редко) |
| Ибутилид* | В/в введение 1 мг за 10 мин. При необходимости повторное в/в введение 1 мг | Удлинение интервала QT, тахикардия «пируэт» |
| Нибентан * | В/в 0,125 мг/кг. Возможно повторное введение через 15 мин. | Удлинение интервала QT, тахикардия «пируэт» |
| Новокаинамид* [] | В/в инфузия 1,0-1,5 г (до 15-17 мг/кг) со скоростью 30-50 мг/мин. | Гипотензия, удлинение интервала QT, тахикардия «пируэт», «улучшение» АВ проведения с возрастанием ЧСС |
| Пропафенон*¨ | В/в введение 1,5-2,0 мг/кг за 10-20 мин. | Гипотензия, расширение комплекса QRS, трепетание предсердий с быстрым АВ проведением |
| Флекаинид*¨ | В/в введение 1,5-3,0 мг/кг за 10-20 мин. | Гипотензия, расширение комплекса QRS, трепетание предсердий с быстрым АВ проведением |
* — Сердечная недостаточность или ФВ менее 40% — использовать с осторожностью или не применять; [] – эффективность меньше, чем у других перечисленных препаратов; ¨
— хроническая ИБС – использовать с осторожностью или не применять (нестабильная стенокардия, ИМ – противопоказаны)
Высокой эффективностью в фармакологической кардиоверсии фибрилляции и особенно трепетания предсердий обладают ибутилид
и
нибентан
. Эффективность нибентана в купировании пароксизмальных ФП и ТП составляет более 80%, а аритмогенные эффекты – 2,9% ЖТ «torsades de pointes» и 7,8% брадикардия (Л.Розенштраух и соавт., 2003 г.). Нибентан и ибутилид должны применяться только в специализированных отделениях под электрокардиографическим контролем (противопоказаны больным с сердечной недостаточностью, удлиненным интервалом QT и при СССУ).
Эффективными антиаритмиками, которые рекомендуются для клинического использования с целью конверсии фибрилляции предсердий, являются препараты IС класса пропафенон и флекаинид
. Они эффективны при внутривенном и пероральном применении. Для перорального купирования принимают однократно
600 мг
пропафенона или
300 мг
флекаинида. Синусовый ритм у больных с ФП восстанавливается через 2-6 часов после их перорального применения. По данным нашего плацебо-контролируемого исследования, эффективность пропафенона при фибрилляции предсердий (однократный пероральный прием 600 мг, наблюдение 8 часов) составляет около 80%. Однако в нескольких рандомизированных, контролируемых исследованиях подчеркиваются не очень большие возможности в/в введенного пропафенона в конверсии ТП (не более 40%). Наши наблюдения также указывают на довольно низкую эффективность пропафенона и при пероральном купировании ТП. Применение антиаритмиков IС класса противопоказано у больных с острой ишемией миокарда (нестабильная стенокардия, ИМ).
Эффективность в купировании ФП новокаинамида (должен вводиться в/в не струйно, а капельно – скорость 30-50 мг/мин) выше плацебо, но меньше, чем у всех вышеперечисленных антиаритмических препаратов.
Когда пароксизм фибрилляции или трепетания предсердий развивается у больного с синдромом слабости синусового узла
(синдром брадикардии-тахикардии) без имплантированного электрокардиостимулятора (ЭКС), то при отсутствии экстренных показаний надо проводить наблюдение за ним до спонтанного прекращения приступа, так как использование антиаритмиков увеличивает риск появления выраженной брадикардии после окончания аритмии.
Для купирования пароксизмов ФП/ТП при СССУ у больных без ЭКС используют антиаритмики IА класса (дизопирамид, новокаинамид, хинидин), антихолинергическое действие которых уменьшает риск развития асистолии после восстановления синусового ритма. Однако электроимпульсная терапия является более безопасным методом их купирования, чем применение антиаритмических средств. Конверсия тахиаритмии даже с помощью антиаритмиков IА класса или ЭИТ может осложниться асистолией или появлением замещающего ритма с низкой ЧСС. В связи с этим восстановление синусового ритма рекомендуется проводить в стационаре под прикрытием временной электрокардиостимуляции. При имплантированном ЭКС купирование ФП и ТП осуществляется по общим принципам.
У больных с синдромом Вольфа-Паркинсона-Уайта (ВПУ)
частота сокращений желудочков во время ФП и ТП, как правило, бывает более высокой, чем у пациентов без синдрома предвозбуждения желудочков, и достигает 220-250 в минуту и более, а на ЭКГ регистрируется тахикардия с неправильным ритмом и широкими комплексами QRS. Использование верапамила, дилтиазема, сердечных гликозидов противопоказано при синдроме ВПУ, так как они, уменьшая рефрактерность пучка Кента, могут увеличить ЧСС и даже вызвать фибрилляцию желудочков. ФП/ТП купируют препаратами, ухудшающими проведение по дополнительному пути предсердно-желудочкового проведения. Международные рекомендации по лечению больных с ФП (АСС/АНА/ESC, 2001) предлагают с этой целью применять в первую очередь в/в введение
новокаинамида или ибутилида (нибентан)
. Когда ФП или ТП при синдроме ВПУ осложняется тяжелыми расстройствами гемодинамики, проводится экстренная электрическая кардиоверсия.
Развитие пароксизма фибрилляции или трепетания предсердий у больного с гипертрофической кардиомиопатией (ГКМП)
приводит к появлению или нарастанию симптомов застойной сердечной недостаточности. Поэтому им, как правило, необходимо восстановление синусового ритма. Принимая во внимание существенное увеличение риска аритмогенного действия (в том числе развития тахикардии типа «пируэт») ряда антиаритмических препаратов у больных со значительной гипертрофией миокарда, вероятно, что для купирования ФП/ТП при ГКМП целесообразно использовать амиодарон или ЭИТ.
(Окончание следует.)
ПРОФИЛАКТИКА ТРОМБОЭМБОЛИЧЕСКИХ ОСЛОЖНЕНИЙ И РЕЦИДИВОВ
Стратификация риска тромбоэмболических осложнений, профилактика ишемического инсульта и системных эмболий являются одной из важнейших задач лечения фибрилляции и трепетания предсердий.
Метаанализ одиннадцати исследований по первичной и вторичной профилактике инсультов при ФП показал, что непрямые антикоагулянты уменьшают риск их развития в среднем на 61%, а аспирин немногим более чем на 20%. Необходимо отметить, что применение аспирина только в довольно высокой дозе (325 мг/сут) показало возможность статистически значимого снижения частоты случаев ишемического инсульта и других системных эмболий.
Поэтому больным с ФП, относящимся к группе высокого риска по тромбоэмболических осложнениям (сердечная недостаточность, ФВ 35% и менее, артериальная гипертензия, ишемический инсульт или транзиторная ишемическая атака в анамнезе, митральный стеноз и др.), должны назначаться непрямые антикоагулянты (поддержание МНО, в среднем, на уровне 2,0-3,0). Больным с неклапанной (неревматической) фибрилляцией предсердий, не относящимся к группе высокого риска, целесообразен постоянный прием аспирина (325 мг/сут.). Больным моложе 60 лет с идиопатической ФП, у которых риск тромбоэмболических осложнений очень низкий, профилактическую терапию можно не проводить. Проведение антитромботической терапии у больных с ТП основывывается на учете тех же факторов риска, как и при ФП, потому что риск тромбоэмболических осложнений при ТП выше, чем на синусовом ритме, но несколько меньше, чем при ФП.
Производным кумарина (варфарин и др.) отдается предпочтение перед другой группой непрямых антикоагулянтов – производных индандиона (фенилин) в связи с их хорошей биодоступностью и стабильностью достигнутой гипокоагуляции.
Эксперты ACC/AHA/ESC (2001) предлагают следующие конкретные рекомендации по антитромботической профилактике у больных с фибрилляцией предсердий:
1. Возраст менее 60 лет (нет заболеваний сердца – lone AF): аспирин 325 мг/сут.
или без лечения.
2. Возраст менее 60 лет (есть заболевание сердца, но нет таких факторов риска, как сердечная недостаточность, ФВ 35% и меньше, артериальная гипертензия): аспирин 325 мг/сут.
3. Возраст 60 лет и более (сахарный диабет или ИБС): пероральные антикоагулянты (МНО 2,0-3,0).
4. Возраст 75 лет и более (особенно женщины): пероральные антикоагулянты (МНО до 2,0)
5. Сердечная недостаточность: пероральные антикоагулянты
(МНО 2,0-3,0).
6. ФВ ЛЖ 35% или менее: пероральные антикоагулянты (МНО 2,0-3,0).7. Тиреотоксиоз: пероральные антикоагулянты (МНО 2,0-3,0).
8. Артериальная гипертензия: пероральные антикоагулянты (МНО 2,0-3,0).
Необходимое условие – адекватный контроль АД.
9. Ревматические пороки сердца (митральный стеноз): пероральные антикоагулянты (МНО 2,5-3,5 или более).
10. Искусственные клапаны сердца:
пероральные антикоагулянты (МНО 2,5-3,5 или более).
11. Тромбоэмболия в анамнезе: пероральные антикоагулянты (МНО 2,5-3,5 или более).12. Наличие тромба в предсердии по данным ТПЭхоКГ: пероральные антикоагулянты (МНО 2,5-3,5 или более).
Недавно представлены доказательства достаточно высокой эффективности прямого ингибитора тромбина ксимелагатрана
(не нужен контроль показателей коагуляции) в профилактике ишемического инсульта у больных с ФП (исследования SPORTIF III и V, 2005)
У больных с малосимптомной рецидивирующей пароксизмальной и персистирующей ФП/ТП в большинстве случаев нет необходимости в применении антиаритмических препаратов. У них проводится профилактика тромбоэмболических осложнений и контроль ЧСС. Если клинические симптомы выражены, требуется противорецидивная и купирующая терапия, сочетающаяся с контролем ЧСС и антитромботическим лечением.
При редких нетяжелых, но затяжных приступах ФП/ТП, оправдано назначение пероральной купирующей терапии. В то же время, частые гемодинамически значимые и редкие пароксизмы с тяжелой клинической симптоматикой требуют профилактической антиаритмической терапии. При частых приступах эффективность антиаритмиков или их комбинаций оценивают по клинике, при редких – проводят чреспищеводную электрокардиостимуляцию (ЧПЭС
) после 3-5 дневного приема препарата, а при назначении амиодарона после насыщения им. Для предупреждения рецидивов ФП/ТП у больных без органического поражения сердца и ИБС используются антиаритмические
препаратыIА, IС и III классов
. Больным с бессимптомной дисфункцией ЛЖ или симптомной хронической сердечной недостаточностью (ХСН) терапия антиаритмиками
I класса
противопоказана в связи с риском ухудшения прогноза жизни. Нецелесообразно применение препаратов IC класса при ИБС (особенно в период ее обострения).
Таблица 3
Антиаритмики, используемые для профилактики пароксизмов фибрилляции и треператия предсердий.
| хинидин — 750-1500 мг/сут. дизопирамид — 400-800 мг/сут. пропафенон — 450-900 мг/сут. аллапинин — 75-150 мг/сут. | этацизин — 150-200 мг/сут. флекаинид — 200-300 мг/сут. амиодарон (поддерживающая доза) — 100-200 мг/сут. соталол — 160-320 мг/сут. дофетилид — 500-1000 мкг/сут. |
При контроле за антиаритмической терапией надо учитывать сопутствующие заболевания и другие состояния, влияющие на её эффективность и безопасность. Аритмогенное действие антиаритмических средств реже проявляется у больных с идиопатической ФП/ТП в то же время при тяжелом органическом поражении сердца, электролитных нарушениях, гипоксии и др. они возникают значительно чаще. Лечение антиаритмиками требует наблюдения за шириной комплекса QRS (особенно когда используются антиаритмические средства IС класса) и продолжительностью интервала QT (терапия антиаритмиками IА и III классов). Ширина комплекса QRS не должна увеличиваться более чем на 50% от исходного уровня, а корригированный интервал QT не должен превышать 500 мс.
Наибольшим профилактическим антиаритмическим эффектом обладает амиодарон
. Метаанализ результатов опубликованных плацебо-контролируемых исследований показал, что применение малых поддерживающих доз амиодарона (
менее 400 мг/сут
) не вызывает увеличения поражения легких и печени по сравнению с группой плацебо (V.R.Vorperian et al., 1997). В отдельных клинических исследованиях показана более высокая профилактическая эффективность препаратов IС класса (пропафенон, флекаинид) по сравнению с антиаритмиками IА класса хинидином и дизопирамидом. По нашим данным, эффективность пропафенона составляет 65%. В последние годы появился ряд сообщений о целесообразности использования ингибиторов АПФ в комплексной профилактической антиаритмической терапии ФП. Продолжение этих исследований покажет практическую значимость данных предположений.
ВЫБОР ПРЕПАРАТА ДЛЯ ПРОФИЛАКТИЧЕСКОЙ АНТИАРИТМИЧЕСКОЙ ТЕРАПИИ
Можно согласиться с мнением, выраженным в международных рекомендациях по ведению больных с фибрилляцией предсердий (2001), что противорецидивную терапию у больных без патологии сердца или с минимальными структурными изменениями его следует начинать с антиаритмиков IС класса (пропафенон, флекаинид
), добавим к ним отечественные препараты этого же класса (
аллапинин и этацизин
), и
соталола
, так как они достаточно эффективны и лишены выраженных экстракардиальных побочных действий. Если эти антиаритмики не предотвращают рецидивов ФП/ТП или их использование сопровождается побочными эффектами, нужно переходить к назначению антиаритмических препаратов второй линии (
амиодарон, дофетилид
), а затем при необходимости и третьей – препаратов IА класса (
дизопирамид, хинидин
) или применять нефармакологические методы лечения.
Ишемическая болезнь сердца (особенно при наличии постинфарктного кардиосклероза) и сердечная недостаточность увеличивают риск проявления аритмогенных свойств антиаритмических препаратов. Поэтому лечение фибрилляции и трепетания предсердий у больных с застойной сердечной недостаточностью, как правило, ограничивается использованием амиодарона и дофетилида
. Высокая эффективность и безопасность амиодарона при сердечной недостаточности и ИБС (включая ИМ) доказана достаточно давно, а дофетилида – в проведенных в 2000 г. плацебо-контролируемых исследованиях DIAMOND CHF и DIAMOND MI.
У больных ишемической болезнью сердца рекомендуемая последовательность назначения антиаритмиков следующая: 1) соталол
, 2)
амиодарон, дофетилид
; 3)
дизопирамид, хинидин
. Соталол рассматривается экспертами АСС/АНА/ЕSС как препарат первого ряда при ИБС из-за того, что он сочетает в себе свойства бета-адреноблокатора (безусловно, полезные при данном заболевании) и эффективного антиаритмика III класса. Аритмогенные эффекты (брадикардия и желудочковая тахикардия, в том числе типа «пируэт»), проявляющиеся в основном в начале лечения соталолом, требуют особого внимания. Необходима ежедневная регистрация ЭКГ (контроль за продолжительностью интервалов QT, РQ, частотой желудочковых сокращений, появлением желудочковой эктопии) в первые 4 дня приема препарата.
Артериальная гипертензия, приводя к гипертрофии миокарда левого желудочка, увеличивает риск развития полиморфной желудочковой тахикардии «torsades de pointes». В связи с этим антиаритмическим препаратам, которые существенно не влияют на продолжительность реполяризации и интервала QT (IС класс
), а также
амиодарону
, хотя и удлиняющему его, но крайне редко вызывающему желудочковую тахикардию, отдается предпочтение в предупреждении рецидивов ФП/ТП у больных с повышенным артериальным давлением. Таким образом, алгоритм фармакотерапии данного нарушения ритма при артериальной гипертензии представляется следующим: 1) гипертрофия миокарда ЛЖ 1,4 см и более — использовать только
амиодарон
; 2) гипертрофии миокарда ЛЖ нет или она менее 1,4 см – начинать лечение с
пропафенона, флекаинида
(иметь в виду возможность применения отечественных антиаритмиков IС класса
аллапинина и этацизина
), а при их неэффективности использовать
амиодарон, дофетилид, соталол
. На следующем этапе лечения (неэффективность или появление побочных действий у вышеперечисленных препаратов) применяют
дизопирамид
или
хинидин
.
Верапамил, дилтиазем и сердечные гликозиды не должны применяться для противорецидивной терапии у больных с синдромом ВПУ, потому что они могут утяжелять течение аритмии.
У больных с синдромом слабости синусового узла
и пароксизмами ФП/ТП расширены показания для имплантации ЭКС. Постоянная электрокардиостимуляция нужна им как для лечения симптомной брадиаритмии, так и для безопасного проведения антиаритмической терапии.
При ГКМП
для профилактики пароксизмов тахиаритмии назначается амиодарон, а для урежения частоты желудочковых сокращений – бета-блокаторы или антагонисты кальция (верапамил, дилтиазем).
Вполне вероятна возможность внесения изменений в вышеизложенные рекомендации по профилактике рецидивов пароксизмальной и персистирующей ФП при появлении новых данных контролируемых исследований по эффективности и безопасности антиаритмических препаратов у больных с различными заболеваниями сердечно-сосудистой системы, так как в настоящее время их явно недостаточно.
При отсутствии эффекта от монотерапии используют сочетания антиаритмических препаратов, начиная с половинных доз. Наиболее изучены комбинации бета-блокаторов, верапамила с амиодароном и препаратами IС класса. Дополнением, а в ряде случаев и альтернативой профилактической терапии (о чем уже говорилось выше) может быть назначение препаратов, ухудшающих АВ проведение и урежающих частоту сокращений желудочков во время пароксизма ФП/ТП. Эффективность и безопасность такой тактики лечения ФП/ТП доказана в исследовании AFFIRM (2002).
Применение препаратов, ухудшающих проведение в АВ соединении, обосновано также при отсутствии эффекта от профилактической антиаритмической терапии. При их использовании надо добиваться, чтобы ЧСС при тахиаритмии в покое составляла от 60 до 80 в минуту, а при умеренной физической нагрузке – не более 100-110 в минуту. Сердечные гликозиды мало эффективны для контроля ЧСС у больных, ведущих активный образ жизни, так как у них первичным механизмом урежения частоты желудочковых сокращений является увеличение парасимпатического тонуса. Поэтому сердечные гликозиды являются препаратами выбора, очевидно, только в двух клинических ситуациях: при сердечной недостаточности и у больных с малой физической активностью. Во всех остальных случаях отдается предпочтение антагонистам кальция (верапамил, дилтиазем) или бета-адреноблокаторам. Для урежения ЧСС можно использовать комбинации вышеперечисленных препаратов.
При тяжелых, рефрактерных к медикаментозному лечению пароксизмах фибрилляции и трепетании предсердий применяют хирургические методы лечения.
Юрий БУНИН,
профессор кафедры кардиологии Российской медицинской академии последипломного образования.
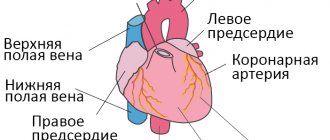
Симптомы ФП
В зависимости от формы аритмии (постоянная или приступообразная) и восприимчивости больного клиническая картина ФП варьирует от отсутствия симптомов до наличия признаков сердечной недостаточности. Больные могут жаловаться на:
- перебои в работе сердца;
- «клокотания» и/или боль в груди;
- резкое увеличение ЧСС;
- потемнение в глазах;
- общую слабость, головокружение (на фоне гипотензии);
- предобморочные состояния или обмороки;
- ощущение нехватки воздуха, одышку и чувство страха.
Фибрилляция предсердий и трепетание предсердий может сопровождаться учащенным мочеиспусканием, вызванным повышенной выработкой натрийуретического пептида. Приступы, длящиеся несколько часов или суток и не проходящие самостоятельно, требуют медицинского вмешательства.
Диагностика
Диагностика фибрилляции предсердий включает:
- Анализ жалоб пациента и анамнеза. Выясняется, когда начались перебои в работе сердца, возникают ли боли в груди, имели ли место обмороки.
- Анализ анамнеза жизни. Врач изучает, перенес ли больной какие-либо операции, есть ли у него хронические болезни, вредные привычки. Также уточняется, страдал ли кто-то из родственников от болезней сердца.
- Общий анализ крови, мочи, биохимия.
- Физикальный осмотр. Оценивается состояние кожных покровов, их цвет. Выясняется, есть ли шумы в сердце, хрипы в легких.
- Гормональный профиль (проводится для изучения уровня гормонов щитовидной железы).
- Электрокардиография. Основной ЭКГ признак фибрилляции предсердий – отсутствие зубца, который отражает нормальное синхронное сокращение предсердий. Также выявляется нерегулярный сердечный ритм.
- Холтеровское мониторирование электрокардиограммы. Кардиограмму записывают на протяжении 1-3 суток. В результате определяют наличие бессимптомных эпизодов, форму болезни, условия, способствующие возникновению и прекращению приступа.
- Эхокардиография. Направлена на изучение структурных сердечных и легочных изменений.
- Рентгенография грудной клетки. Показывает увеличенные размеры сердца, изменения, возникшие в легких.
- Тредмил-тест или велоэргометрия. Предполагает использование ступенчатой возрастающей нагрузки.
- Чреспищеводная эхокардиография. Больному вводится в пищевод зонд со специальным ультразвуковым датчиком. Метод дает возможность обнаружить тромбы в предсердиях и их ушках.
Причины ФП и факторы риска
Заболевания различного генеза
Наиболее часто ФП возникает у пациентов с заболеваниями сердечно-сосудистой системы – артериальной гипертензией, ИБС, хронической сердечной недостаточностью, пороками сердца – врожденными и приобретенными, воспалительными процессами (перикардит, миокардит), опухоли сердца. Среди острых и хронических заболеваний, не связанных с патологией сердца, но влияющих на возникновение фибрилляции предсердий, выделяют нарушения функций щитовидной железы, сахарный диабет, хроническую обструктивную болезнь легких, синдром сонного апноэ, болезни почек и др.
Возрастные изменения
Фибрилляцию предсердий называют «аритмией дедушек», так как заболеваемость этой аритмией резко увеличивается с возрастом. Развитию данного нарушения сердечного ритма могут способствовать электрические и структурные изменения предсердий,. Однако специалисты отмечают, что мерцательная аритмия может возникнуть у молодых людей, не имеющих патологии сердца: до 45 % случаев пароксизмальной и до 25 % случаев персистирующей фибрилляции.
Другие факторы риска
Фибрилляция предсердий может развиваться на фоне употребления алкоголя, после удара электрического тока и операций на открытом сердце. Пароксизмы могут спровоцировать такие факторы, как физическая нагрузка, стрессовые состояния, жаркая погода, обильное питье. В редких случаях имеется наследственная предрасположенность возникновения ФП.
Причины
Главная причина фибрилляции предсердий – это сбой в работе проводящей системы сердца, который вызывает нарушение порядка сердечных сокращений. Мышечные волокна в такой ситуации сокращаются не синхронно, а в разнобой, предсердия не могут сделать один мощный толчок каждую секунду и вместо этого дрожат, не проталкивая требуемое количество крови в желудочки.
Причины, вызывающие фибрилляцию предсердий, условно разделяют на сердечные и несердечные. К первой группе относятся:
- Высокое артериальное давление. Сердце при гипертонии работает в усиленном режиме и выталкивает очень много крови. Сердечная мышца не справляется с увеличившейся нагрузкой, растягивается и значительно ослабевает. Нарушения затрагивают и синусовый узел, проводящие пучки.
- Клапанные пороки сердца, сердечные заболевания (кардиосклероз, инфаркт миокарда, миокардит, ревматический порок сердца, тяжелая сердечная недостаточность).
- Врожденные пороки сердца (отмечается недостаточное развитие сосудов, питающих сердце, слабая сформированность сердечной мышцы).
- Опухоли сердца (вызывают нарушения в строении проводящей системы, не дают проходить импульсу).
- Перенесенные операции на сердце. В послеоперационный период может образовываться рубцовая ткань, которая замещает собой уникальные клетки проводящей системы сердца. Из-за этого нервный импульс начинает проходить по другим путям.
В группу несердечных причин входят:
- физическое переутомление;
- вредные привычки, алкоголь;
- стрессы;
- большие дозы кофеина;
- вирусы;
- болезни щитовидки;
- прием некоторых лекарственных средств (мочегонные, адреналин, «Атропин»);
- хронические болезни легких;
- сахарный диабет;
- удар электротоком;
- синдром ночного апноэ;
- электролитические нарушения.
Методы диагностики
Сначала требуется определить индивидуальный риск инсульта:
Определение риска инсульта при первичной * (если инсультов ранее не было) профилактике (J Am Coll Cardiol 2001;38:1266i-1xx).
| Источник | Высокий риск | Средний риск | Низкий риск |
| Atrial Fibrillation Investigators (1) ** | Возраст 65 лет и старше Гипертензия в анамнезе ИБС Диабет | Возраст моложе 65 лет Отсутствие признаков высокого риска | |
| American College of Chest Physicians (2) | Возраст старше 75 лет Гипертензия в анамнезе Дисфункция ЛЖ *** Более 1 фактора среднего риска | Возраст 65 — 75 лет Диабет ИБС Тиреотоксикоз | Возраст моложе 65 лет Отсутствие факторов риска |
| Stroke Prevention in Atrial Fibrillation (3) | Женщины старше 75 лет Систолическое АД более 160 мм рт. ст. Дисфункция ЛЖ ** | Гипертензия в анамнезе Отсутствие признаков высокого риска | Отсутствие признаков высокого риска Отсутствие гипертензии в анамнезе |
Получение обязательных данных
Изучение истории болезни и жалоб пациента. Необходимо выяснить конкретные симптомы, которыми проявляется фибрилляция предсердий, определить ее клиническую форму, дату появления первых признаков, частоту и продолжительность пароксизмов, определить предрасполагающие факторы и провоцирующие заболевания, эффективность проводимого лечения.
Проведение ЭКГ, ЭхоКГ. Эти обследования позволяют определить вид нарушений сердечного ритма, оценить размеры камер сердца и состояние клапанов, изменение сократимости миокарда.
Исследование крови. Для определения функции щитовидной железы (Т3, Т4) и гипофиза (ТТГ), выявления недостатка электролитов (калия) и признаков острого ревматизма или миокардита.
Получение дополнительных данных
Холтеровское мониторирование ЭКГ. Круглосуточная регистрация ЭКГ позволяет проконтролировать и оценить ЧСС в разное время суток (включая период сна) при обычном режиме дня пациента, зафиксировать приступы ФП.
Запись пароксизмов ФП онлайн. Данная разновидность холтеровского мониторирования позволяет фиксировать сигналы электрокардиограммы, передаваемые по телефону, непосредственно в момент приступа.
Велоэргометрия, тредмил-тест и другие нагрузочные пробы. Эти методы применяются в случае, когда не установлен адекватный контроль ЧЖС (при хронической ФП), для провокации аритмии, вызываемой физической нагрузкой, а также для исключения ишемии сердца перед лечением антиаритмиками 1C-класса.
Чреспищеводная эхокардиография. Данное исследование помогает выявить наличие тромба в левом предсердии до проведения кардиоверсии.
Электрофизиологическое исследование. ЭФИ проводится для объяснения механизма тахикардии, выявления и хирургического лечения предрасполагающей аритмии (радиочастотная абляция).
Стратегии лечения ФП
Для лечения больных с фибрилляцией предсердий используются две принципиальные стратегии:
- rhythm control – восстановление синусового ритма (медикаментозная или электрическая кардиоверсия с последующей профилактикой рецидива;
- rate control – контроль ЧЖС, сочетаемый с антикоагулянтной или антиагрегантной терапией (если ФП сохраняется).
Стратегия лечения конкретного пациента выбирается в зависимости от многих факторов, и, прежде всего, это форма заболевания – пароксизмальная или персистирующая фибрилляция предсердий. Так, в первом случае приступ необходимо купировать (особенно это касается самого первого проявления ФП). При персистирующей форме мерцательной аритмии назначается постоянный прием лекарственных препаратов, направленный на контроль ЧСС и профилактику инсульта.
Согласно результатам последних исследований, применение пропафенона обеспечивает высокую эффективность восстановления и удержания синусового ритма. Следуя рекомендациям ВНОК по диагностике и лечению фибрилляции, данный препарат относят к первому ряду лекарственных средств, применяемых при персистирующей форме ФП для фармакологической кардиоверсии (класс I, уровень доказательности А).
Лечение
Консервативное лечение фибрилляции предсердий (мерцательной аритмии)
Мерцательная аритмия является фактором риска ишемического инсульта, развивающегося в результате формирования тромбов в полости левого предсердия. Первоочередными средствами при лечении мерцательной аритмии являются препараты, предотвращающие тромбообразование. Их назначает врач, т.к. требуется контроль за системой свертывания крови. Эти средства показаны практически всем пациентам, которые страдают мерцательной аритмией независимо от того, постоянно присутствует аритмия или возникает приступами (пароксизмальная форма аритмии). Риск инсульта одинаков как при наличии хронической формы аритмии, так и при пароксизмальной форме аритмии.
У пациентов с пароксизмальной формой мерцательной аритмии решается вопрос о профилактике возникновения приступов аритмии. Если приступ возник впервые, антиаритмические препараты не назначаются. Могут быть рекомендованы препараты для контроля частоты сердечных сокращений и улучшения переносимости повторных пароксизмов нарушений ритма. Антиаритмические средства также не назначаются, если приступы аритмии у пациента протекают бессимптомно и не снижают его качество жизни. При рецидиве нарушений ритма и ухудшении переносимости пароксизмов кардиолог-аритмолог совместно с пациентом решает вопрос о назначении антиаритмических препаратов или хирургическом лечении аритмии (катетерной абляции).
При развитии затяжного приступа мерцательной аритмии, который не прошел самостоятельно, необходимо обратиться к специалисту кардиологу-аритмологу, который выберет наиболее подходящий для пациента метод купирования аритмии. Отработана методика медикаментозного восстановления нормального сердечного ритма, а также процедура восстановления ритма методом электрической кардиоверсии. Для восстановления ритма необходима определенная медикаментозная подготовка, схему которой определит врач, исходя из индивидуальных особенностей течения заболевания. С появлением новейших высокоэффективных антиаритмических средств предпочтение отдается медикаментозному восстановлению ритма.
При трансформации пароксизмальной формы мерцательной аритмии в хроническую основной задачей является контроль частоты сердечных сокращений. При наличии тахисистолии (высокой частоты сердечных сокращений) назначаются средства, урежающие частоту сокращений сердца, первоочередными из которых являются бета-адреноблокаторы. Неотъемлемой частью терапии мерцательной аритмии сердца является лечение заболевания, спровоцировавшего нарушение ритма – ишемической болезни сердца, сердечной недостаточности, артериальной гипертензии, нарушений в работе щитовидной железы и других.
Обратиться к кардиологу-аритмологу необходимо в случае:
- развития приступа мерцательной аритмии впервые в жизни,
- развития очередного приступа аритмии, не купирующегося привычными средствами,
- неэффективности назначенной ранее антиаритмической терапии.
Применение препарата Пропанорм при ФП
Купирование пароксизмов
Стратегия, называемая «таблеткой в кармане», основана на приеме нагрузочной дозы Пропанорма, позволяющей восстановить сердечный ритм как при лечении в стационаре, так и амбулаторно. Согласно данным многих плацебо-контролируемых исследований, эффективность однократного приема per os 450-600 мг пропафенона составляет от 56 до 83 % (Boriari G, Biffi M, Capucci A, et al., 1997). По данным всероссийского исследования «ПРОМЕТЕЙ», в котором приняли участие 764 пациента с рецидивирующей формой фибрилляции предсердий, эффективность нагрузочной дозы препарата составила 80,2 %.
Профилактика пароксизмов
Стратегия основана на ежедневном приеме препарата для предотвращения пароксизмов. Многоцентровое, открытое, рандомизированное, проспективное сравнительное исследование «Простор» дало следующие предварительные результаты.
- Пропанорм® не приводит к ухудшению показателей гемодинамики у пациентов с артериальной гипертензией, ишемической болезнью сердца и хронической сердечной недостаточностью с сохраненной систолической функцией. Применение препарата при фибрилляции предсердий в целях профилактики способствует снижению числа госпитализаций, связанных с декомпенсацией кровообращения, на 72,9 %.
- Антиаритмическая эффективность Пропанорма через 12 месяцев с начала приема практически равна показателям при применении Кордарона – 54,2 % и 52,9 % соответственно.
- При отсутствии постинфарктной кардиопатии (фракция выброса менее 40 %) Пропанорм® может применяться как антиаритмический препарат, в т. ч. в сочетании с бета-адреноблокаторами, если это необходимо.
- Пропанорм® обладает лучшим профилем безопасности, по сравнению с Кордароном.
Для удержания синусового ритма у пациентов с диагнозом «рецидивирующая фибрилляция предсердий» рекомендуемая суточная доза для постоянного приема Пропанорма составляет 450 мг (3 раза в сутки) или 600 мг (2 раза в сутки). При частых возникновениях пароксизмов возможно увеличение дозы до 900 мг (3 раза в сутки).
Эпидемиология пароксизмальной мерцательной аритмии
Фибрилляция и трепетание предсердий являются наиболее распространенными и опасными видами нарушений ритма сердца и встречаются в 0,4–1,0 % случаев в популяции [1, 2]. Частота возникновения фибрилляций/трепетания предсердий увеличивается с возрастом. Согласно Фремингемскому исследованию, частота встречаемости мерцательной аритмии (МА) удваивается через каждые 10 лет жизни: 0,55 % в возрасте 50–59 лет и 8,8 % среди пациентов в возрасте 81–90 лет [3]. За последние 20 лет прослеживается тенденция к увеличению частоты встречаемости ФП, особенно среди мужчин. Кроме того, наблюдается рост числа госпитализаций по поводу МА; в США, например, данный параметр вырос в 2,5 раза за период с 1985 по 1999 г. [4, 5].
Было также изучено негативное влияние фибрилляций/трепетания предсердий: риск тромбоэмболических осложнений вырос в 4–5, уровень смертности в 1,5–2,0 раза [6, 7]. Данная патология может привести к развитию и прогрессированию сердечной недостаточности и снижению качества жизни. Среди пациентов, госпитализированных по поводу нарушений ритма сердца, МА встречается в 34 %, трепетание предсердий – в 4 % случаев.
Как правило, в самом начале МА является пароксизмальной. Распространенность пароксизмов ФП варьируется, по различным данным, в диапазоне 22–65 %. Из них в 35–78 % случаев пароксизмальная форма аритмии переходит в персистирующую [8].
Определение, классификация пароксизмов мерцания
Термином “пароксизмальное мерцание предсердий” обозначают нарушение ритма, связанное с хаотичным сокращением отдельных групп мышечных волокон предсердий, давностью не более 7 суток с возможностью спонтанного купирования. Частота предсердных волн может достигать до 600 уд/мин. В связи с изменчивостью в этих условиях предсердно-желудочкового проведения, отчасти вследствие скрытого проведения части импульсов, желудочки сокращаются беспорядочно. В отсутствие дополнительного нарушения предсердно-желудочковой проводимости частота желудочкового ритма составляет около 100–150 ударов в минуту (тахисистолическое мерцание предсердий). Считают, что электрофизиологической основой мерцания предсердий являются множественные мелкие круги циркуляции импульсов в миокарде предсердий. Приступы мерцания предсердий, особенно нормо- и брадисистолической формы, нередко не вызывают выраженных гемодинамических расстройств, могут не сопровождаться заметным ухудшением состояния и самочувствия больного.
В плане назначения дифференцированной терапии заслуживает внимания выделение двух форм пароксизмальной МА: с преобладанием тонуса парасимпатической нервной системы (“вагусная” пароксизмальная МА) и с преобладанием тонуса симпатической нервной системы (“адренергическая”, “катехоламиновая” пароксизмальная аритмия) [9].
Определение, классификация пароксизмов трепетания
Трепетание предсердий – регулярное сокращение предсердий с частотой около 250–350 ударов в минуту. Желудочковый ритм при этом может быть регулярным или нерегулярным. Частота и регулярность желудочкового ритма при трепетании предсердий определяются предсердно-желудочковой проводимостью, которая может изменяться. Трепетание предсердий встречается в 10–20 раз реже, чем мерцание в виде пароксизмов. Иногда мерцание и трепетание предсердий чередуются у одного больного. Термин “мерцательная аритмия” был предложен Г.Ф. Лангом для обозначения мерцания и трепетания предсердий ввиду общности некоторых патогенетических и клинических черт, однако в диагнозе аритмия должна быть обозначена конкретно – мерцание или трепетание.
При пароксизмальной форме трепетания частота пароксизмов бывает весьма различной: от одного в год до нескольких раз в сутки. Пароксизмы могут провоцировать физические нагрузки, эмоциональный стресс, жаркая погода, обильное питье, алкоголь и даже расстройство кишечника. Проходят пароксизмы иногда сами, иногда же требуется медикаментозное лечение. Одни люди, страдающие МА, не ощущают ее, другие замечают легкую нерегулярность ритма своего сердца. Кроме того, возможны головокружение, давление и боль в груди.
Трепетание предсердий, являясь одной из форм МА, по клиническим проявлениям мало отличается от мерцания предсердий, однако характеризуется несколько большей стойкостью пароксизмов и большей резистентностью к антиаритмическим препаратам. Различают правильную (ритмичную) и неправильную формы данной аритмии. Последняя по клинике имеет большее сходство с мерцанием предсердий. Кроме того, выделяют два основных типа трепетания предсердий: 1 – классическое (типичное); 2 – очень быстрое (атипичное) [10].
Патогенез фибрилляции/ трепетания предсердий
Было установлено, что ФП – это преимущественно предсердная тахиаритмия, которая начинается и формируется в левом предсердии, где возникает несколько кругов microre-entry. Трепетание предсердий, напротив, обычно возникает в правом предсердии – в его нижней части. Круг macroreentry, лежащий в основе трепетания предсердий, располагается главным образом в участке (мостике) правого предсердия, соединяющего устье нижней полой вены и кольцо трехстворчатого клапана. Естественно, что в наше время методы лечения пароксизмов фибрилляции и трепетания предсердий – этих двух родственных, но все же различных предсердных тахиаритмий, следует рассматривать раздельно.
Диагностика фибрилляции/ трепетания предсердий
При ФП на электрокардиограмме (ЭКГ) зубец Р отсутствует, диастола заполнена беспорядочными по конфигурации и ритму мелкими волнами, более заметными в отведении VI. Их частота составляет 300–600 ударов в минуту (обычно ее не подсчитывают). Желудочковые комплексы следуют в неправильном ритме, обычно они не деформированы. При очень частом желудочковом ритме (более 150 уд./ мин) возможна блокада ножки, обычно правой, предсердно-желудочкового пучка. Под влиянием лечения, а также при наличии наряду с мерцанием предсердий нарушения предсердно-желудочковой проводимости частота желудочкового ритма может быть меньше. При частоте менее 60 уд./мин говорят о брадисистолической форме мерцания предсердий. Изредка мерцание предсердий сочетается с полной предсердно-желудочковой блокадой. При этом желудочковый ритм редкий и правильный. У лиц с пароксизмами мерцания предсердий при записи ЭКГ вне пароксизма, особенно вскоре после него, часто выявляют более или менее выраженную деформацию зубца Р.
При трепетании предсердий на ЭКГ обнаруживают регулярные предсердные волны без диастолических пауз, имеющие характерный пилообразный вид, более отчетливо выраженный в отведении AVF. Предсердные волны заполняют диастолу желудочков, они накладываются и на желудочковые комплексы, слегка деформируя их. Желудочковые комплексы могут следовать ритмично – после каждой второй (тогда желудочковый ритм составляет около 120–160 уд./мин), третьей и т. д. предсердной волны, или аритмично, если соотношение предсердных и желудочковых сокращений непостоянно. При частом желудочковом ритме возможно нарушение внутрижелудочковой проводимости, чаще – блокада правой ножки предсердно-желудочкового пучка. При частом и регулярном желудочковом ритме трепетание трудно отличить по ЭКГ от других наджелудочковых тахикардий. Если удается временно уменьшить предсердно-желудочковую проводимость (с помощью массажа каротидного синуса, введения дигоксина или 5 мг верапамила), ЭКГ-картина становится более характерной.
Лечение мерцательной аритмии
При лечении пациентов с мерцанием и трепетанием предсердий на догоспитальном этапе должна быть оценена целесообразность восстановления синусового ритма. Абсолютным показанием к восстановлению синусового ритма при развитии пароксизма МА является развитие отека легких или аритмогенного шока. В этом случае на догоспитальном этапе должна быть проведена экстренная кардиоверсия.
Противопоказаниями к восстановлению синусового ритма на догоспитальном этапе можно считать:
- длительность пароксизма мерцания предсердий более двух дней;
- доказанную дилатацию левого предсердия (передне-задний размер 4,5 см, по данным ЭхоКГ);
- наличие тромбов в предсердиях или тромбоэмболические осложнения в анамнезе;
- развитие пароксизма на фоне острого коронарного синдрома (при наличии стабильной гемодинамики);
- развитие пароксизма на фоне выраженных электролитных нарушений;
- декомпенсацию тиреотоксикоза;
- выраженные хронические расстройства гемодинамики и некоторые другие.
В таких случаях лечение должно быть направлено на стабилизацию гемодинамики, профилактику тромбоэмболий и контроль частоты сердечных сокращений в целях поддержания ее в пределах 60–90 уд./мин.
Средством выбора для контроля частоты сердечного ритма являются сердечные гликозиды, в частности дигоксин. Дальнейшая тактика определяется в стационаре. Постоянная нормосистолическая форма МА без признаков сердечной недостаточности вообще не нуждается в антиаритмической терапии [11].
Известно, что 50–60 % недавно развившихся (менее 48 часов) пароксизмов ФП прекращаются самостоятельно. S. Ogawa и соавт. [12] в ходе исследования J-RHYTHM выяснили, что такие параметры, как смертность и количество осложнений при купировании пароксизмов мерцания предсердий, не зависят от выбранной тактики лечения (урежения частоты сердечных сокращений или восстановления синусового ритма). Похожие результаты получили в своем исследовании и S.H. Hohnloser и соавт. [13].
Приступая к характеристике методов лекарственного лечения пароксизмов ФП, мы считаем нужным подчеркнуть, что пока еще не синтезирован антиаритмический препарат, способный устранить пароксизм мерцания предсердий у каждого больного. Врач должен располагать набором различных эффективных средств, чтобы иметь возможность производить адекватную замену одного препарата другим. Обычно лечение пароксизма ФП начинают с внутривенного вливания раствора калия хлорида, чаще вместе с дигоксином. Калий хлорид сам по себе нередко устраняет пароксизмы ФП после 3–5 вливаний. Кроме того, повышение плазменной концентрации калия на 0,5–1,5 мкм/л создает благоприятный фон для последующего действия других антиаритмических препаратов.
В случае неудачи с применением сердечного гликозида и хлорида калия или при наличии противопоказаний к применению сердечных гликозидов прибегают к введению прокаинамида. При необходимости это можно сделать и раньше, например после 1–2 вливаний раствора хлорида калия. По наблюдениям различных авторов, результаты лечения ФП прокаинамидом заметно улучшаются, если его вводят больным через 20–30 минут после внутривенного вливания раствора хлорида калия и сердечного гликозида. Таким способом синусовый ритм был восстановлен у 65 % больных, не отреагировавших на догоспитальном этапе на достаточно большую дозу прокаинамида (до 15 мл 10 %-ного раствора), введенного внутривенно [14].
Эффективными антиаритмическими средствами, которые рекомендуются для клинического использования с целью конверсии ФП предсердий, являются препараты IС-класса пропафенон и флекаинид. Они эффективны при внутривенном и пероральном применении. Синусовый ритм у больных с ФП восстанавливается через 2–6 часов после их перорального применения. По данным плацебо-контролируемого исследования Ю.А. Бунина и соавт. [15], эффективность пропафенона при ФП (однократном пероральном приеме в дозе 600 мг, наблюдение – 8 часов) составляет около 80 %. Однако в нескольких рандомизированных контролируемых исследованиях подчеркиваются не очень большие возможности внутривенно введенного пропафенона в конверсии трепетания предсердий (не более 40 %). Наши наблюдения также указывают на довольно низкую эффективность пропафенона и при пероральном купировании трепетания предсердий.
Применение антиаритмиков IС-класса противопоказано пациентам с острой ишемией миокарда (нестабильной стенокардией, инфарктом миокарда). Мета-анализ показал, что антиаритмики классов IС, IА и III класса имеют примерно одинаковую эффективность при купировании ФП. При этом не было обнаружено доказательств какого-либо влияния данных препаратов на выживаемость и качество жизни пациентов [16].
Если пароксизму ФП предшествует учащение синусового ритма, если пароксизм возникает в дневное время под влиянием стрессорных воздействий, физического или эмоционального напряжения, надо полагать, что в основе такого пароксизма лежит гиперсимпатикотонический механизм. Верапамил, дилтиазем и β-адреноблокаторы являются препаратами первой линии для экстренного внутривенного урежения частоты сердечных сокращений, т. к. эти антиаритмики высокоэффективны и быстро (в течение 5–10 минут) проявляют свое действие. При внутривенном введении дигоксина устойчивое замедление частоты желудочкового ритма достигается существенно позже (через 2–4 часа). Для больных с высоким риском системной эмболии (фибрилляция/трепетание предсердий продолжительностью более 2 суток) в целях уменьшения частоты сердечных сокращений резервным препаратом является амиодарон, после применения которого возможно восстановление синусового ритма и, следовательно, появление “нормализационных” тромбоэмболий [17].
В ряде международных рекомендаций [18, 19] отмечается, что купирование пароксизма фибрилляции/трепетания у пациентов с сердечной недостаточностью или фракцией выброса левого желудочка менее 40 % надо проводить амиодароном. Другие антиаритмики должны использоваться с осторожностью или не применяться из-за довольно высокого риска развития аритмогенных эффектов и отрицательного влияния на гемодинамику. Мета-анализ результатов плацебо-контролируемых исследований кардиоверсии ФП амиодароном показал позднее купирование им пароксизмов аритмии: достоверное различие в эффективности между амиодароном и плацебо отмечено не ранее чем через 6– часов после их внутривенного применения. С учетом этого после внутривенного введения “нагрузочной” дозы амиодарона затем целесообразно продолжить его внутривенную инфузию в течение 6–2 часов.
В исследовании Р.Д. Курбанова и соавт. [20] обнаружено, что курсовое лечение насыщающей дозой амиодарона способствует восстановлению синусового ритма у 30 % больных дилатационной кардиомиопатией, осложненной ФП. При этом длительное лечение амиодароном способствует сохранению синусового ритма в ближайшие 6 месяцев и компенсирует сердечную недостаточность. Проведенный метаанализ также показал, что лечение амиодароном облегчает процедуру восстановления синусового ритма и положительно влияет на выживаемость пациентов [21].
В исследовании С.А. Филенко [22] обнаружено, что у больных ишемической болезнью сердца пароксизмальная форма ФП протекает по симпатическому и смешанному типам. При исследовании препаратов, обладающих противорецидивным действием на пароксизмы мерцания, показано, что наиболее эффективным является амиодарон, а у больных пароксизмальной ФП симпатического типа также оказался эффективным метопролол.
С.А. Старичков и соавт. [23] исследовали больных артериальной гипертензией (АГ), cтрадающих ФП. Анализ результатов показал, что применение комбинации амиодарона и метопролола при АГ позволяет снижать дозы применяемых антиаритмических препаратов и способствует не только более эффективному контролю уровня артериального давления, но и предупреждению пароксизмов ФП у 71 % пациентов. Применение β-адреноблокаторов как в виде монотерапии, так и в сочетании с амиодароном приводит к нормализациипоказателей вариабельности ритма сердца, положительно влияет на процессы ремоделирования миокарда различных камер сердца.
Известно, что блокада рецепторов ангиотензина II первого типа кроме снижения артериального давления может приводить к уменьшению ремоделирования и гипертрофии миокарда, нормализации электролитного баланса, оказывает косвенное антиишемическое и антиадренергическое действия [24]. В исследовании Ю.Г. Шварц и соавт. [25] лечение лозартаном пациентов с сочетанием пароксизмов ФП и АГ сопровождалось достоверным уменьшением частоты пароксизмов аритмии в отличие от больных, леченных нифедипином и атенололом. Авторы считают, что вероятным механизмом положительного влияния лозартана на течение пароксизмов ФП является непосредственное действие на миокард. Еще J. Mayet [26] предполагал, что регресс гипертрофии левого желудочка связан с антиаритмическим эффектом антигипертензивной терапии.
Одним из многообещающих направлений лечения аритмий является использование омега-3-полиненасыщенных жирных кислот (ω-3-ПНЖК). В 2005 г. были опубликованы данные исследования, доказывающие, что потребление жирных сортов рыбы, богатых длинноцепочечными ω-3-ПНЖК, может снижать риск ФП [27]. Авторы объясняли такой антиаритмический эффект ω-3-ПНЖК снижением артериального давления и улучшением диастолической функции левого желудочка.
И.В. Антонченко и соавт. [28] обнаружили, что одним из возможных механизмов протекторного эффекта ω-3-ПНЖК у пациентов с пароксизмальной формой ФП является обратное электрическое ремоделирование миокарда предсердий. Добавление к купирующей терапии ω-3-ПНЖК уменьшает число эпизодов ФП и время их купирования. Однако электрофизиологические эффекты применения ω-3-ПНЖК в дозе 1 г/сут возникают не ранее 20-го дня приема.
Тактика лечения пароксизмов трепетания предсердий в значительной мере зависит от степени выраженности гемодинамических расстройств и самочувствия больного. Данная аритмия нередко не вызывает резких нарушений гемодинамики и мало ощущается пациентом даже при значительной тахисистолии желудочков. К тому же такие пароксизмы обычно трудно купируются внутривенным введением антиаритмиков, которые могут даже вызывать ухудшение состояния больного. Поэтому в этих случаях экстренной терапии, как правило, не требуется.
Говоря о медикаментозном лечении данной аритмии, следует иметь в виду, что, по данным авторов концепции “Сицилианского гамбита” [29], пароксизмы трепетания предсердий I типа лучше купируются препаратами класса IA (хинидином, прокаинамидом, дизопирамидом). Однако при использовании препаратов этого класса имеется риск парадоксального учащения ритма желудочков, поэтому лучше в первую очередь применять верапамил или β-адреноблокаторы. Пароксизмы трепетания предсердий II типа лучше купируются препаратами I3-го класса, в частности амиодароном. Отечественные авторы отмечают высокую эффективность нибентана при купировании пароксизмов фибрилляции и особенно трепетания предсердии [30].
В настоящее время доказано, что психические нарушения ухудшают течение аритмий, в частности ФП, за счет усложнения клинических проявлений, снижения качества жизни. Есть также мнение, что пациенты с депрессивными расстройствами имеют нарушение вегетативной регуляции ритма сердца (снижение парасимпатического и повышение симпатического тонуса), что увеличивает риск возникновения ФП.
В исследовании Б.А. Татарского и соавт. [31] добавление Афобазола сопровождалось выраженным анксиолитическим эффектом без резкой седации, эффективной коррекцией вегетативных нарушений, отсутствием лекарственной зависимости и синдрома отмены. Было выявлено, что лечение Афобазолом пациентов с пароксизмальной формой ФП без выраженных структурных изменений сердца сопровождалось уменьшением частоты пароксизмов, длительности эпизодов аритмии, более легкой переносимостью; имелась тенденция к трансформации в бессимптомную форму.
Эффективность нибентана в купировании пароксизмальных фибрилляций и трепетания предсердий составляет более 80 % [32]. Нибентан и ибутилид должны применяться только в специализированных отделениях под ЭКГ-контролем (противопоказаны пациентам с сердечной недостаточностью, удлиненным интервалом QT и при синдроме слабости синусового узла).
У больных синдромом Вольфа– Паркинсона–Уайта частота сокращений желудочков во время фибрилляции/ трепетания, как правило, бывает более высокой, чем у пациентов без синдрома предвозбуждения желудочков, и достигает 220–250 ударов в минуту и более, а на ЭКГ регистрируется тахикардия с неправильным ритмом и широкими комплексами QRS. Использование верапамила, дилтиазема, сердечных гликозидов противопоказано при синдроме Вольфа– Паркинсона–Уайта, т. к., уменьшая рефрактерность пучка Кента, они могут увеличивать частоту сердечных сокращений и даже вызывать фибрилляцию желудочков. Фибрилляцию/трепетание предсердий купируют препаратами, ухудшающими проведение по дополнительному пути предсердно-желудочкового проведения. Международные рекомендации по лечению больных ФП [19] предлагают с этой целью применять в первую очередь внутривенное введение прокаинамида или ибу-тилида.
Заключение
В заключение необходимо подчеркнуть, что целью антиаритмической терапии, как и любой другой, является не только устранение и предупреждение пароксизмальных аритмий, но и улучшение жизненного прогноза, а также снижение смертности пациентов, а для этого очень важно не допустить негативного гемодинамического и проаритмического действия применяемых препаратов. Разработка “антиаритмических препаратов будущего” для обеспечения контроля синусового ритма должна основываться на сочетании эффективности и безопасности терапии. Препараты, имеющие улучшенные электрические, структурные и триггерные свойства, вероятно, позволят в будущем сократить смертность и число осложнений пациентов с фибрилляцией/трепетанием предсердий.
Информация об авторах: Волков Виктор Евгеньевич – кандидат медицинских наук, научный сотрудник ФГУ РКНПК. E-mail; Доценко Юлия Владимировна – кандидат медицинских наук, научный сотрудник ФГУ РКНПК. Кирюшина Ирина Евгеньевна – врач генетик ФГУ РКНПК