В настоящее время острые нарушения мозгового кровообращения являются наиболее частым жизнеугрожающим заболеванием и одной из главных причин инвалидизации не только в России, но и в мире. По данным Всемирной федерации неврологических обществ, ежегодно в мире регистрируется около 15 млн инсультов. В России заболеваемость инсультом составляет 3,4 на 1000 человек в год, при этом около 30% инсультов приводят к летальному исходу в остром периоде [1, 2]. В течение последующего года умирают еще 10—15% больных. У 80% выживших после инсульта развивается та или иная степень ограничений в повседневной жизни [3]. В нашей стране инвалидизация вследствие инсульта (3,2 на 10 000 населения в год) опережает другие заболевания [4].
Существенный негативный вклад в инвалидизацию больных после инсульта вносят когнитивные нарушения, поскольку зачастую при отсутствии четкой очаговой симптоматики именно расстройства когнитивной сферы определяют тяжесть состояния больного и трудности в процессе его бытовой и профессиональной адаптации. В течение первого года после ишемического инсульта деменция развивается в 25—30% случаев [5]. Приблизительно в 1/3 случаев она является результатом декомпенсации или активизации предшествующего нейродегенеративного процесса, в остальных случаях постинсультная деменция обусловлена сосудистой мозговой недостаточностью [6—8]. У больных с постинсультной деменцией увеличивается риск развития повторного инсульта, что может быть связано с трудностями проведения вторичной профилактики у этой группы пациентов. Есть данные о том, что наличие выраженного когнитивного дефицита негативно влияет и на восстановление двигательных функций [9—12].
Особой формой когнитивных расстройств является афазия, которая представляет собой нарушение сформировавшейся речи, возникающее при очаговых поражениях коры и прилежащей подкорковой области доминантного полушария головного мозга и являющееся системным расстройством различных форм речевой деятельности при сохранности элементарных форм слуха и движений речевого аппарата [13]. Тотальная и сенсорная афазии в остром периоде отмечаются у 84% больных с кровоизлияниями и у 50% — с ишемическим инсультом в случае поражения доминантного полушария, спустя несколько месяцев сенсомоторная афазия сохраняется у 12—13% больных [6]. Любая форма когнитивных нарушений в целом и речи, в частности, ведет к изменению личности, к нарушению общей и вербальной коммуникации. Меняется поведение больного, его эмоциональное состояние, качество жизни.
Длительное время широко обсуждается вопрос о применении препаратов нейропротективного действия в остром периоде инсульта. Большинство исследователей склоняются к мнению, что раннее назначение нейропротекторов позволяет улучшить прогноз восстановления нарушенных функций, увеличить период «терапевтического окна», уменьшить размеры очага повреждения головного мозга [14—16]. В настоящее время активно ведется поиск эффективных лекарственных средств для первичной и вторичной нейропротекции, проводятся исследования, доказывающие необходимость назначения данных препаратов в остром периоде инсульта.
В настоящее время разработан новый оригинальный нейропротективный препарат для парентерального введения — целлекс (ЗАО «Фарм-Синтез», Россия). Он представляет собой белково-пептидный комплекс из эмбрионального головного мозга свиней, который способен обеспечивать регенерацию нервной ткани человека. Целлекс обладает прямым нейрорепаративным действием, что принципиально отличает его от нейротропных средств из других групп. Прямое репаративное действие целлекса на нейрональный и глиальный клеточные пулы нервной ткани доказано доклиническими исследованиями: в экспериментах с лабораторными животными на моделях острого ишемического повреждения мозга методом фотоиндуцированного тромбоза, на клеточных культурах нейронов мозжечка в модели глутаматной токсичности, а также на моделях глобальной преходящей и неполной гипоксиях мозга.
Полученные результаты явились основанием для проведения клинического исследования «Многоцентровое рандомизированное сравнительное открытое клиническое исследование эффективности и безопасности препарата целлекс в лечении больных с острым нарушением мозгового кровообращения», в котором было предусмотрено изучение влияния целекса на когнитивные и речевые нарушения.
Цель исследования — изучение действия целлекса на восстановление когнитивных и речевых функций в остром периоде инсульта.
Материал и методы
Многоцентровое сравнительное открытое клиническое исследование эффективности и безопасности препарата целлекс в лечении больных с острым инсультом проводилось на 6 клинических базах. В исследование были включены 180 пациентов с инсультом. Диагноз острого нарушения мозгового кровообращения, характер и локализация инсульта устанавливались согласно критериям регистра инсульта Национальной ассоциации по борьбе с инсультом (НАБИ) [5], на основании данных анамнеза (предшествующие заболевания сердечно-сосудистой системы, показатели артериального давления, характер развития неврологических симптомов), клинических данных (неврологический осмотр с оценкой выраженности общемозговых, оболочечных и очаговых симптомов) и данных дополнительных исследований (лабораторные исследования крови и цереброспинальной жидкости, осмотр глазного дна, компьютерная или магнитно-резонансная томография головного мозга, транскраниальная допплерография и дуплексное сканирование сосудов головного мозга с эмболодетекцией).
Критерии включения больных в настоящее исследование: мужчины в возрасте от 35 до 80 лет включительно; женщины в возрасте от 55 до 80 лет включительно, находящиеся в постменопаузальном периоде не менее 2 лет; больные, подписавшие письменное информированное согласие или их ближайшие родственники (при крайней тяжести пациента); больные с острым ишемическим или геморрагическим инсультом в соответствии с критериями МКБ-10, подтвержденными при рентгеновской компьютерной томографии (КТ) или магнитно-резонансной томографии (МРТ) головного мозга, госпитализированные в течение 1-х суток от развития заболевания.
Критериями исключения являлись: крайняя тяжесть пациента с уровнем сознания ниже 5 баллов по шкале комы Глазго (кома III cт. по отечественной классификации); регресс неврологической симптоматики в течение первых 24 ч от начала заболевания (транзиторная ишемическая атака); наличие у пациента заболеваний или состояний, указанных в противопоказаниях к назначению препарата целлекс: эпилепсия, маниакальный психоз, продуктивный бред, делирий; наличие в анамнезе анафилактических реакций на препараты белковой природы (альбумин, плазма крови, иммуноглобулины, сыворотки); наличие злокачественного новообразования; острые и/или хронические бактериальные и вирусные заболевания в стадии обострения; аутоиммунные заболевания в стадии декомпенсации, сопровождающиеся системным васкулитом; хроническая печеночная или почечная недостаточность в стадии обострения; выраженная или неконтролируемая патология сердца; предшествующая нейротропная метаболическая терапия в течение 14 дней перед госпитализацией пациента.
Среди включенных в исследование больных 147 (81,7%) перенесли ишемический инсульт и 33 (18,3%) — геморрагический инсульт.
К характеристике выборки можно также добавить, что у 148 (82%) больных были выявлены признаки атеросклероза. В 135 (75%) случаях отмечалось сочетание атеросклероза с артериальной гипертензией. В 158 (87,8%) наблюдениях имелась гипертоническая болезнь. Сахарный диабет, сочетающийся с атеросклерозом и артериальной гипертензией, выявлялся у 14 (7,8%) больных. В 78 (43,3%) наблюдениях определялись признаки ишемической болезни сердца, 15 (8,3%) больных ранее перенесли инфаркт миокарда. У 37 (20,5%) больных отмечалась постоянная форма мерцательной аритмии: на фоне коронарокардиосклероза — у 29, на фоне ревматизма — у 8; 8 (4,4%) пациентов ранее перенесли инсульт в том же сосудистом бассейне, из них у 3 этому предшествовали транзиторные ишемические атаки. Все больные были доставлены в стационар в течение первых суток заболевания.
Целлекс применялся на фоне стандартной базисной терапии в виде раствора для подкожного введения по 0,1 мг 1 раз в сутки первые 10 дней и с 21-х по 27-е сутки заболевания. Все препараты, не входящие в стандартную базисную терапию, обладающие нейротропным, антигипоксантным действием, были запрещены к применению на протяжении всего срока исследования. В случае, когда прием данных препаратов на фоне базисной терапии был неизбежен, пациент из исследования исключался.
В зависимости от особенностей терапии больные были разделены на две группы — основную и группу сравнения.
В основную группу из 180 вошли 90 (50%) больных, которым на фоне базисной терапии был назначен целлекс. Их средний возраст был 61,4±9,5 года. Группу сравнения также составили 90 (50%) пациентов, получавших только базисную терапию. Их средний возраст был 62,2±8,9 года.
Кроме того, в зависимости от тяжести состояния больные основной группы и группы сравнения были дополнительно разделены на три подгруппы. При определении тяжести состояния учитывались выраженность изменений сознания и других общемозговых симптомов, оболочечной симптоматики, вегетотрофических расстройств, очаговых неврологических нарушений на момент поступления в клинику. Разделение по тяжести состояния проводилось в соответствии со шкалой инсульта (NIHSS). Легкой степени соответствовали 0—6 баллов, средней — 7—14 баллов, тяжелой — 15 и выше баллов.
В основной группе легкая степень тяжести состояния была определена у 21 (23,3%) больного, средняя — у 49 (54,4%) пациентов и тяжелая — у 20 (22,2%). В группе сравнения легкая степень — в 36 (40%) случаях, средняя — в 44 (49%) и тяжелая — в 10 (11%).
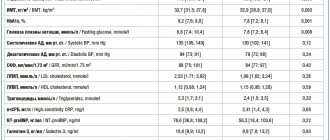
Распределение больных в выделенных группах и подгруппах по возрасту, полу, степени тяжести, характеру и бассейну поражения представлено в табл. 1 и 2.
Таблица 1. Распределение больных основной группы и группы сравнения по полу, типу инсульта, тяжести состояния и бассейну поражения в группе целлекс Примечание. ЛСМА — левая средняя мозговая артерия; ПСМА — правая средняя мозговая артерия; ВББ — вертебрально-базилярная система; ЛП — левое полушарие; ПП — правое полушарие; САК — субарахноидальное кровоизлияние.
Таблица 2. Распределение больных в изученных группах по показателям состояния высших психических функций
Всем больным проводился мониторинг основных физиологических показателей (артериальное давление, частота сердечных сокращений, электрокардиография, частота дыхания, температура тела, гликемия) в первые 48 ч от начала развития инсульта 4—6 раз в сутки в зависимости от тяжести состояния больного. Осуществлялись также коррекция и поддержание показателей гемодинамики, дыхания, водно-электролитного обмена и обмена глюкозы, коррекция отека мозга и повышенного внутричерепного давления, адекватная нутритивная поддержка, профилактика и борьба с осложнениями.
Оценка динамики нарушения высших корковых функций проводилась по тесту ТИПК (Информация—Память—Концентрация внимания) и ОР — опросник речи). Уровень сохранности сознания больных в остром периоде инсульта оценивали также в соответствии со шкалой комы Глазго: значения 8 баллов и ниже свидетельствовали о наличии комы, 9—12 баллов — от сопора до оглушения, 13—15 баллов — от легкой заторможенности до ясного сознания.
Статистическая обработка полученных результатов проводилась с использованием пакета программ Microsoft Exсel 2003 и Statistica 6.0 с использованием пакетов ANOVA и DENOVA. При нормальном распределении признака применялись t
-критерий Стьюдента и дисперсионный анализ с повторными измерениями, при распределении, признака, отличного от нормального, — ранговый дисперсионный анализ, критерии знаков и парных сравнений Вилкоксона, для тестирования зависимости — точный критерий Фишера. Различия считались статистически достоверными при
p
<0,05.
Полное 4-недельное исследование закончили 168 больных; 4 больных выведены по объективным причинам: выявление метастатического поражения мозга, развитие алкогольного делирия, перевод в нейрохирургическое отделение для оперативного лечения внутримозговой гематомы, перевод в стационар другой больницы по настоянию родственников. Из 3 умерших больных группы сравнения у 1 пациентки смерть наступила в результате тромбоэмболии легочной артерии, у 1 пациента развился острый инфаркт миокарда на фоне пароксизма мерцательной аритмии, у 1 пациентки к 3-м суткам отмечалось нарастание общемозговой и очаговой неврологической симптоматики с отеком мозга. Из 5 умерших больных, получавших целлекс, у 1 пациента поставлен патологоанатомический диагноз — опухоль головного мозга, у 1 пациента, поступившего в крайне тяжелом состоянии, отмечалось нарастание отека с вклинением ствола мозга к 3-м суткам, у 3 пациентов, поступивших в тяжелом состоянии, отмечалось прогрессивное нарастание очагового неврологического дефицита и общемозговой симптоматики с декомпенсацией сопутствующей патологии (у 1 пациентки — сахарного диабета 2-го типа и мерцательной аритмии, у 1 пациента — печеночной недостаточности на фоне хронического алкоголизма, у 1 пациента — выраженное прогрессирование сердечно-сосудистой недостаточности на фоне несостоятельности кардиостимулятора).
При анализе состояния высших психических функций по клиническим шкалам (средний балл NIHSS; средний балл расстройств сознания, средние значения по ОР) сравниваемые группы исходно достоверно различались: состояние этих функций у больных, лечившихся целлексом, изначально было достоверно тяжелее, чем в группе сравнения (см. табл. 2).
Оценка динамики неврологического дефицита по клиническим шкалам от 1-х суток к 3, 6, 10, 21-м и 28-м суткам проводилась методом сравнения средних изменений клинического балла в исследуемых группах с применением t-критерия Стьюдента для независимых выборок. Исследование значимости различий между показателями в контрольных точках проводилось методом дисперсионного анализа.
Целлекс® (Cellex)
Фирма-производитель: ФАРМ-СИНТЕЗ ЗАО (Россия)
р-р д/п/к введения 0.1 мг/1 мл: амп. 1 мл или 2 мл 1, 2, 4, 5 или 10 шт. Рег. №: ЛП-001393
Клинико-фармакологическая группа:
Ноотропный препарат
Форма выпуска, состав и упаковка
Раствор для п/к введения
прозрачный, бесцветный или светло-желтый, без запаха или со специфическим запахом; допускается опалесценция.
| 1 мл | |
| целлекс® субстанция-раствор (замороженный, в пересчете на белок*) | 0.1 мг |
Вспомогательные вещества:
глицин — 3.75 мг, натрия гидрофосфата дигидрат — 2.99 мг, натрия дигидрофосфата моногидрат — 0.47 мг, натрия хлорид — 5.85 мг, вода д/и — до 1 мл.
* Состав на 1 мл. Активное вещество:
полипептиды из головного мозга эмбрионов свиней активное вещество в пересчете на общий белок 0.9-2.4 мг (номинальное содержание общего белка 1.65 мг на 1 мл субстанции).
Вспомогательные вещества:
глицин — 3.75 мг, 0.1М раствора динатрия гидрофосфата — до pH 7.8 (около 0.8 мг сухого вещества), натрия хлорид — 5.85 мг, полисорбат 80 — 0.005 мг, вода очищенная — до 1 мл.
1 мл — ампулы темного стекла (1) — упаковки ячейковые контурные из пленки поливинилхлоридной (1) — пачки картонные. 1 мл — ампулы темного стекла (1) — упаковки ячейковые контурные из пленки поливинилхлоридной (2) — пачки картонные. 1 мл — ампулы темного стекла (2) — упаковки ячейковые контурные из пленки поливинилхлоридной (1) — пачки картонные 1 мл — ампулы темного стекла (2) — упаковки ячейковые контурные из пленки поливинилхлоридной (2) — пачки картонные. 1 мл — ампулы темного стекла (5) — упаковки ячейковые контурные из пленки поливинилхлоридной (1) — пачки картонные. 1 мл — ампулы темного стекла (5) — упаковки ячейковые контурные из пленки поливинилхлоридной (2) — пачки картонные. 2 мл — ампулы темного стекла (1) — упаковки ячейковые контурные из пленки поливинилхлоридной (1) — пачки картонные. 2 мл — ампулы темного стекла (1) — упаковки ячейковые контурные из пленки поливинилхлоридной (2) — пачки картонные. 2 мл — ампулы темного стекла (2) — упаковки ячейковые контурные из пленки поливинилхлоридной (1) — пачки картонные. 2 мл — ампулы темного стекла (2) — упаковки ячейковые контурные из пленки поливинилхлоридной (2) — пачки картонные. 2 мл — ампулы темного стекла (5) — упаковки ячейковые контурные из пленки поливинилхлоридной (1) — пачки картонные. 2 мл — ампулы темного стекла (5) — упаковки ячейковые контурные из пленки поливинилхлоридной (2) — пачки картонные.
Описание активных компонентов препарата «Целлекс®»
Фармакологическое действие
Ноотропный препарат. Наличие тканеспецифических сигнальных белков и полипептидов — факторов роста, факторов дифференцировки нервных клеток в препарате обуславливает его прямое нейрорепаративное действие, за счет регуляции концентраций пула нейротрансмиттеров, с торможением спиловера возбуждающих аминокислот.
Препарат активирует вторичную нейропротекцию за счет стимуляции процессов синаптогенеза, восстановления сигналов аутофагии, улучшения тканевой иммунорегуля ции с торможением иммуногенной цитотоксичности макрофагов. При этом отмечается тканеспецифическое и системное репаративное действие препарата с восстановлением регенеративного и репаративного потенциала клеток мозга, уменьшение числа поврежденных клеток и выраженности перифокального отека в зоне пенумбры (позволяет добиться значительного ограничения очага некроза мозговой ткани) с восстановлением микроциркуляции и общей перфузии.
Восстановление и регуляторная стимуляция различных компартментов ЦНС с системным воздействием факторов роста, дифференцировки и сигнальных молекул обеспечивает снижение сроков восстановления и реабилитации пациентов с повреждениями центральной и периферической нервной системы сосудистого генеза и восстановлением двигательной, чувствительной и когнитивной функций.
Терапевтический эффект обычно развивается через 3-5 дней после начала введения препарата.
Показания
Цереброваскулярные болезни:
—
острые нарушения мозгового кровообращения в остром и раннем реабилитационном периоде течения заболевания в составе комплексной терапии.
Режим дозирования
Взрослым
препарат назначают в дозе 0.1-0.2 мг 1 раз/сут п/к в течение 10 дней в зависимости от тяжести состояния больного. При необходимости проводят повторный курс через 10 дней.
Исследования по применению препарата у детей
не проводились.
Побочное действие
Возможно:
аллергические реакции в виде невыраженной гиперемии в месте введения, реакции гиперчувствительности (кожная сыпь, зуд, ангионевротический отек), субфебрилитет, нарушение сна, головная боль.
Противопоказания
— эпилепсия;
— маниакальный психоз;
— продуктивный бред;
— делирий;
— возраст до 18 лет (в связи с недостаточностью клинических данных).
С осторожностью
следует назначать препарат при наличии в анамнезе аллергических реакций на препараты белково-пептидной природы.
Беременность и лактация
При беременности действие препарата не изучено. Отсутствие соответствующих исследований не позволяет применять препарат у данного контингента больных.
Применение для детей
Исследования по применению препарата в детской практике не проводились.
Особые указания
С особой осторожностью следует назначать препарат при артериальной гипертензии злокачественного течения в стадии декомпенсации, симпато-адреналовых кризах по типу панических атак, выраженных тревожно-депрессивных расстройствах.
Препарат не содержит прионовых инфекций и вирусов.
Влияние на способность к вождению автотранспорта и управлению механизмами
В настоящее время не имеется данных о влиянии препарата Целлекс® на способность к управлению автомобилем и работе с механизмами, требующей повышенного внимания и скорости психических и двигательных реакций.
Передозировка
В настоящее время случаев передозировки препарата Целлекс® не отмечено.
Лекарственное взаимодействие
При совместном применении с психостимулирующими препаратами и алкоголем возможно психомоторное возбуждение, нарушения сна.
Возможно уменьшение активности средств для наркоза, транквилизаторов, нейролептиков.
Условия отпуска из аптек
Препарат отпускается по рецепту.
Условия и сроки хранения
Препарат следует хранить в защищенном от света, недоступном для детей месте при температуре от 2° до 8°С. Срок годности — 1 год.
Лекарственное взаимодействие
При совместном применении с психостимулирующими препаратами и алкоголем возможно психомоторное возбуждение, нарушения сна.
Возможно уменьшение активности средств для наркоза, транквилизаторов, нейролептиков.
Ишемический инсульт (ИИ) является наиболее распространенной формой острых нарушений мозгового кровообращения, его развитие ассоциировано с высокой летальностью, риском развития повторных сердечно-сосудистых событий, стойкой инвалидизацией. Вследствие широкой распространенности и тяжелых последствий ИИ представляет собой исключительно важную медико-социальную проблему. В Российской Федерации ежегодно регистрируется до полумиллиона первичных случаев инсульта, при этом заболеваемость составляет 3,36 случая на 1000 населения в год, стандартизованная заболеваемость – 2,39 на 1000 населения в год (у мужчин – 3,24 на 1000 населения, у женщин – 2,24 на 1000) [3]. Смертность от ИИ в России достигает 1,23 на 1000 населения, около трети выживших после ИИ остаются тяжелыми инвалидами, нуждаются в посторонней помощи в повседневном быту, а 20% лишены возможности к самообслуживанию и самостоятельному передвижению. Только пятая часть выживших после ИИ пациентов способны вернуться к прежней трудовой деятельности и в состоянии полностью обслуживать себя самостоятельно, при этом частота наступления летального исхода и формирования стойкого неврологического дефицита значительно выше у пациентов с обширной зоной инфаркта, в частности с атеротромботическим и кардиоэмболическим подтипами ИИ.
Наиболее значимыми факторами, обусловливающими инвалидизацию вследствие перенесенного ИИ, являются двигательные нарушения (моно- или гемипарез), а также расстройства высших мозговых функций (афазия, апраксия и пр.) и постинсультная деменция.
Эффективное восстановление нарушенных вследствие ИИ функций возможно при своевременном восстановлении нарушенного кровотока, интенсивном и систематическом проведении реабилитационных мероприятий, адекватном лекарственном обеспечении реабилитационного процесса.
Современные представления о патогенезе острого ИИ
ИИ – гетерогенный по своему патогенезу клинический синдром [9].
К основным причинам его возникновения относятся поражение артерий крупного калибра (атеротромботический подтип ИИ), артерий малого калибра (лакунарный инфаркт), а также кардиогенные эмболии (кардиоэмболический подтип ИИ) [10]. Зачастую сложно или невозможно установить основную причину развития ИИ, т.к. его возникновение обусловлено несколькими факторами; в данной ситуации патогенетический подтип ИИ расценивается как неуточненный. Вместе с тем именно точное установление причины первичного ИИ в значительной степени определяет эффективность мероприятий для предупреждения повторного инсульта. Определение патогенетического подтипа ИИ является надежным и ценным инструментом для проведения адекватной конкретным условиям вторичной профилактики.
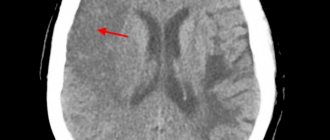
Установлено, что необратимое повреждение мозгового вещества наступает уже через 5–6 минут после полной остановки кровотока или его снижения до 10–15 мл/100 г/мин, вследствие чего эта область (т.н. центральная, или ядерная, зона инфаркта) погибает безвозвратно и не может рассматриваться в качестве перспективного объекта для терапевтического воздействия [16]. На периферии этой области на протяжении достаточно длительного периода времени (до 24–48 часов) располагается мозговая ткань с измененным функциональным состоянием, однако сохранившая свои основные структурные характеристики и жизнеспособность – пенумбра (син.: зона ишемической полутени).
К характерным отличиям этой области относятся низкий уровень энергетического и белкового метаболизма и следовательно, крайне низкий уровень генерации электрического сигнала при сохранной структуре клеточных мембран и мембран органелл [13]. Именно эта область может быть перспективной с точки зрения ограничения области поражения и функционального восстановления.
Длительность поддержания структурной целостности и потенциальной возможности восстановления функциональных свойств этой области обусловлена расположением очага ишемии в белом или сером веществе, состоянием кровотока и метаболизма, индивидуальной устойчивостью мозга к ишемии [12]. Возможность восстановления этой ткани в первую очередь определяется остаточным уровнем кровотока, а также скоростью его восстановления вследствие спонтанной или терапевтической реканализации пораженного сосуда. Расширение области инфаркта наблюдается в зонах минимального локального кровотока – менее 45–50% от нормального [17]. Максимально раннее его восстановление (в особенности в первые 3–6 часов от момента развития ишемии, т.н. терапевтическое окно) – наиболее перспективный способ минимизировать последствия перенесенной ишемии, в пределах которого лечебные мероприятия могут быть наиболее эффективными и безопасными. Эффективность и безопасность терапевтических воздействий, направленных на восстановление локального кровотока, связаны не только с сохранностью нейронов, но и с состоянием клеток глии и эндотелия сосудов, других клеток и тканей.
Полное прекращение или критическое снижение поступления крови к определенной зоне мозга (фокальная ишемия), не позволяющее обеспечить ткань должным количеством кислорода и глюкозы, инициирует сложную последовательность биохимических и патофизиологических изменений – «патобиохимический каскад» [2]. Угнетение аэробного гликолиза ведет к переключению метаболизма глюкозы на анаэробный путь, который характеризуется низкой продукцией энергии и накоплением в ткани молочной кислоты. Следствием служат локальное развитие лактат-ацидоза, внутриклеточное накопление ионов кальция, цитотоксический отек. Вследствие того что основное количество энергии, вырабатываемой тканью головного мозга, тратится на обеспечение работы ионных насосов, их деятельность в условиях ишемии и дефицита энергетических субстратов (в первую очередь глюкозы) грубо нарушается. Вследствие этого в клетки поступает масса ионов натрия и хлора, а вместе с ними – воды, что приводит к развитию цитотоксического отека.
В настоящее время в патогенезе острой фокальной церебральной ишемии важная роль отводится избыточному выбросу в синаптическую щель возбуждающих нейротрансмиттеров, в первую очередь глутамата и аспартата (т.н. глутаматная эксайтотоксичность). При развитии острой ишемии их концентрация в синаптическом пространстве в течение долей секунды возрастает в тысячи раз, что оказывает губительное действие на постсинаптический нейрон. Его избыточная стимуляция ведет к формированию патологической активности клетки, нерациональному расходованию энергетических ресурсов, инициации других патобиохимических реакций, в итоге ведущих к гибели клетки. При нарушении кислородного обмена и затруднении утилизации свободных радикалов развиваются оксидантный стресс, местная воспалительная реакция, активируются механизмы протеолиза и пр. [15]. Следствием совокупности указанных событий служит индукция процессов запрограммированной гибели нервных клеток (апоптоза) и дальнейшее расширение зоны повреждения [14]. По механизму апоптоза могут страдать клетки, получившие значительное ишемическое повреждение, жизнеспособность и способность к нормальному функционированию которых представляются сомнительными. В последующем включаются различные механизмы дегенеративного поражения нейронов – демиелинизация, валлеровское перерождение, сокращение дендритного поля, ограничение числа синапсов [2].
Помимо повреждающего воздействия ишемия нервной ткани инициирует ряд компенсаторных механизмов, обеспечивающих стимуляцию репаративного потенциала мозгового вещества. Многие биологически активные вещества, поступающие в ткани вследствие ишемии, способны оказывать стимулирующее действие на восстановительные процессы. Наряду с процессами острого и отсроченного повреждения мозгового вещества включаются механизмы образования нового сосудистого русла, формирования межклеточных связей, синаптогенез. Возможна активация противоположной пораженному полушарию коры, вследствие чего может быть реализована компенсация нарушенных функций, однако эффективность такого механизма была продемонстрирована не во всех экспериментальных исследованиях. В основе указанных механизмов лежит нейропластичность – основа компенсации нарушенных функций [4]. Важно, что эти процессы протекают, по сути дела, в условиях постоянного числа нейронов, т.к. вероятность появления недифференцированных клеток – предшественников нейронов в области ишемии зрелого мозга человека невелика, в связи с чем реализация собственных ресурсов мозгового вещества, их адекватная стимуляция представляются перспективным направлением. Немедикаментозная стимуляция восстановительных процессов, а также их активация с помощью лекарственных препаратов могут способствовать более полному восстановлению нарушенных функций.
Базовые принципы лечения больного ИИ
Результаты лечения пациента с ИИ зависит от правильной организации терапевтического процесса, основными принципами которого являются максимально быстрое начало лечения, направленного на восстановление кровотока в пораженной области мозга и защиту его от гипоксии и ишемии. Важно, что пациент с острым нарушением мозгового кровообращения должен быть госпитализирован в специализированный стационар, располагающий возможностями оказания реанимационной помощи, проведения адекватного состоянию больного лечения и обеспечения систематизированного последовательного реабилитационного процесса. Его полноценное функционирование возможно при наличии аппаратуры для оценки состояния мозгового кровотока, функционального состояния мозга, состояния сердечно-сосудистой системы. Отделение должно быть укомплектовано специалистами различного профиля (невролог, реаниматолог, кардиолог, терапевт, нейрохирург, сосудистый хирург).
Важнейшие направления лечения больного острым ИИ включают комплекс мероприятий, направленных на поддержание жизненно важных функций: коррекцию сердечно-сосудистой деятельности, уровня артериального давления, кислотно-ocновного и осмолярного гомеостаза, водно-электролитного баланса; профилактику и лечение внутричерепной гипертензии и других осложнений ИИ; предупреждение соматических осложнений; проведение ранних реабилитационных мероприятий.
Специфическим эффективным методом восстановления нарушенного кровотока является тромболитическая терапия. Максимальная эффективность и безопасность реперфузии сохраняются в пределах 3–6 часов от момента развития ишемии, тогда как проведение ее в более поздние сроки ассоциировано с высоким риском развития гиперперфузии, отека ткани и возникновением геморрагических осложнений. Реперфузионная терапия эффективна при тромбозе артерий среднего и крупного калибров [11]. При ранней реканализации окклюзированного сосуда в 75% случаев наступает значительное улучшение состояния больного в течение первых суток, при частичном восстановлении кровотока улучшение наступает у половины больных, в отсутствие ранней реканализации пораженного сосуда значимого клинического улучшения в течение первых 24 часов не происходит [18].
Раннее применение антиагрегантов снижает риск повторных ИИ, не влияя на частоту летальных исходов. Одним из наиболее широко применяемых антиагрегантов является ацетилсалициловая кислота (АСК). Наиболее высокая эффективность антиагрегантной терапии отмечена у пациентов с атеротромботическим подтипом ИИ, относительно меньшая – при лакунарном и кардиоэмболическом ИИ. Раннее применение АСК ассоциировано с повышенным риском геморрагических и гастроинтестинальных осложнений, однако потенциальная эффективность применения антиагрегантов у больных острым ИИ, обусловленная снижением риска повторного ИИ, превышает вероятность развития потенциальных осложнений. Для снижения риска развития ульцерогенного эффекта целесообразно одновременное применение гастропротекторов, в частности ингибиторов протонной помпы. Пациенты, перенесшие ИИ, нуждаются в пожизненном приеме антиагрегантов.
Исключительно привлекательным и перспективным направлением лечения пациента с острым ИИ является проведение нейропротективной и нейротрофической терапии. В соответствии с современными представлениями задачей нейропротекции в условиях острой ишемии (или другого острого повреждения центральной нервной системы) является повышение устойчивости клеток головного мозга к острой ишемии и гипоксии, вторичным повреждающим факторам, которые образуются в зоне повреждения, возможным токсическим влияниям. В зависимости от патофизиологических точек приложения выделяют первичную и вторичную нейропротекцию.
Первичная нейропротекция направлена на прерывание механизмов некротической смерти клеток и, чтобы быть эффективной, должна быть начата с первых минут развития ишемии. К вероятным точкам ее приложения относятся стабилизация клеточных мембран, восстановление работы ионных насосов с целью предупреждения цитотоксического отека, подавление избыточного образования свободных радикалов. В определенной степени в качестве нейротективного воздействия можно рассматривать восполнение дефицита энергетических субстратов или включение тех метаболических путей, которые в качестве источника энергии используют не глюкозу, а другие вещества. Возможности первичной нейропротекции ограничены исключительно быстрым формированием зоны инфаркта, в связи с чем интерес вызывает вторичная нейропротекция, направленная на уменьшение выраженности отдаленных последствий ишемии (блокаду провоспалительных цитокинов, молекул клеточной адгезии, торможение прооксидантных ферментов, торможение апоптоза), и начинается спустя 3–6 часов после развития ИИ. Объектом воздействия вторичной нейропротекции служит исключительно сохранная живая ткань головного мозга, расположенная в области пенумбры.
Результаты экспериментальных исследований, а также ряд клинических наблюдений дают основание полагать, что ранняя нейропротекция может способствовать уменьшению размеров зоны инфаркта, продлить период «терапевтического окна», расширив возможности применения методов восстановления кровотока, осуществлять защиту от реперфузионного повреждения. Клинически это может проявляться увеличением доли транзиторных ишемических атак и ИИ с обратимым неврологическим дефицитом при уменьшении количества тяжелых инсультов.
Нейротрофическая терапия направлена на стимуляцию собственных репаративных процессов в головном мозге, индукцию образования эндогенных нейротрофических факторов или возмещение их дефицита вследствие ишемии и гипоксии. Итогом таких воздействий может служить достижение достаточного уровня компенсации имеющегося неврологического дефицита. Важным ограничением применения нейропротекторов и нейротрофических препаратов является сложность или невозможность их доставки в область ишемии вследствие прекращения или резкого снижения кровотока. Вследствие этого достижение их эффективной концентрации в зоне ишемии не всегда возможно. Для преодоления этой проблемы предпринимались попытки использования вазодилататоров, гемодилюции, некоторых других направлений терапии, которые не всегда демонстрировали значимый терапевтический эффект. Отличительной особенностью нейротрофических препаратов в этой ситуации служит возможность реализации их эффектов за счет воздействия на отдалении – стимуляция синтеза собственных нейротрофинов в теле нейрона способна удовлетворить потребность в них всей клетки в целом. Перемещаясь по сохранным аксонам, лежащим в зоне пенумбры, нейротрофические факторы могут предупреждать формирование валлеровской дегенерации, а также оказывать воздействие на расположенные вблизи другие нейроны, подвергающиеся воздействию ишемии и гипоксии.
Эффективным представителем лекарственных средств, обладающих доказанным нейропротективным и нейротрофическим действиями, применение которого продемонстрировало свою эффективность в условиях как in vitro, так и in vivo, является Целлекс. Препарат представляет собой тканеспецифичный белково-пептидный комплекс, который получают из фетальной ткани сельскохозяйственных животных (свиней). В состав Целлекса входит ряд сигнальных белков и пептидов, включая факторы роста и дифференцировки нервных клеток. Основные клинические эффекты препарата обусловлены существенным уменьшением или полным устранением последствий перенесенного повреждения мозгового вещества, обусловленного, в частности, его ишемией – нормализацией белкового синтеза, восстановлением баланса нейротрансмиттеров, активацией процессов регенерации нервной ткани. В экспериментальных условиях было показано, что нейропротективные и нейротрофические функции Целлекса связаны с активацией процессов синаптогенеза сохранных нейронов, восстановления сигналов аутофагии, нормализации тканевой иммунорегуляции, угнетения иммуногенной цитотоксичности активированных макрофагов [7].
Целлекс оказывает первичное нейропротективное действие, стимулирует процессы регенерации и репарации. Так, в эксперименте, проведенном на крысах с двусторонней временной перевязкой общих сонных артерий (модель неполной глобальной ишемии головного мозга), препарат продемонстрировал способность повышать выживаемость животных в раннем послеоперационном периоде, уменьшать область инфаркта мозга, а также улучшать функциональный исход его поражения.
Нейротрофические свойства Целлекса обусловлены тем, что препарат является мощным индуктором процессов нейропластичности в поврежденной, но сохранившей свою жизнеспособность мозговой ткани. Результаты экспериментальных исследований продемонстрировали его способность уменьшать выраженность повреждения клеток в зоне пенумбры, ограничивая зону инфаркта [8].
Как свидетельствуют результаты другого экспериментального исследования, проведенного на крысах с моделью двустороннего фокального инфаркта префронтальной коры больших полушарий, введение Целлекса приводило к уменьшению зоны инфаркта, что проявлялось значительным улучшением функционального состояния животных [7]. Примечательно, что положительный эффект в результате применения Целлекса наблюдался как при его применении до формирования инфаркта, так и после развития необратимой ишемии головного мозга. Более выраженный эффект оказывало введение препарата не до развития экспериментальной ишемии, а после завершившегося тромбоза. Вероятно, в основе выявленных эффектов препарата лежит способность Целлекса оказывать прямые нейрорепаративное и нейротрофическое действия за счет влияния на сохранные в зоне пенумбры нейроны, снижать активацию провоспалительных реакций, вызванных ишемией, стимулировать синтез нейротрофинов и предотвращать гибель нейронов после фокального коркового инфаркта. Предполагаемый механизм действия препарата расширяет возможности для его терапевтического применения – время его назначения больному ИИ не ограничивается первыми часами или минутами с момента развития заболевания, что далеко не всегда возможно выполнить в условиях клинической практики, а пролонгируется на значительно бóльшие периоды времени.
Важно отметить, что разработчикам Целлекса удалось решить сложную проблему, создав препарат, включающий белки и полипептиды массой от 5 до 200 кДа, стабилизированные во взвеси, не выпадающие в осадок и сохраняющие при этом свои функциональные способности. Значительное удобство как для пациента, так и для медицинского персонала представляет возможность подкожного введения препарата.
Результаты экспериментальных исследований, продемонстрировавшие значительную эффективность препарата на моделях острой церебральной ишемии, стали основанием проведения клинических исследований препарата. Проведенные в последующем клинические исследования продемонстрировали эффективность Целлекса для пациентов с острым инсультом. Было установлено, что введение препарата в остром периоде ИИ сопровождалось выраженным уменьшением двигательных нарушений, достоверно лучшим восстановлением моторных и когнитивных функций [6]. Раннее его применение приводило к более полному восстановлению речевых функций, причем достоверное улучшение имело место у пациентов как с моторной, так и с сенсорной афазией [5]. Улучшение со стороны высших мозговых функций обеспечивало более высокий уровень социальной адаптации пациентов, перенесших ИИ. Предварительные исследования продемонстрировали хорошую переносимость препарата, хорошую сочетаемость с другими лекарственными препаратами.
Значительный интерес представляют результаты исследования, посвященного изучению влияния Целлекса на динамику речевых нарушений в остром периоде ИИ [1]. Результаты исследования продемонстрировали, что восстановление как экспрессивной, так и импрессивной речи носило достоверно более быстрый характер у пациентов, получавших Целлекс, по сравнению с пациентами, не получавшими его. У пациентов, получавших Целлекс, достоверно реже наблюдались выраженные явления мутизма, а их регресс наступал значительно раньше, чем в группе больных, не получавших препарат. В итоге проведенного исследования авторы сделали обоснованный вывод, согласно которому существенное улучшение речевых функций у пациентов с острым ИИ, получавших Целлекс, обеспечивало им значительно более полную социальную адаптацию после выписки из стационара.
С целью подтверждения результатов серий клинических наблюдений, показавших преимущества применения Целлекса больными ИИ, было проведено двойное слепое плацебо-контролируемое рандомизированное многоцентровое клиническое исследование эффективности препарата Целлекс в лечении пациентов с острым нарушением мозгового кровообращения по ишемическому типу (протокол TSEL-IV-2013). Целью работы стала оценка эффективности применения препарата Целлекс больными в остром периоде ИИ и изучение его влияния на динамику восстановления нарушенных функций по сравнению с плацебо на фоне стандартной терапии. Кроме того, задачей исследования стала оценка переносимости препарата в условиях клинического применения. Основную группу составили 240 пациентов с острым ИИ, верифицированным результатами нейровизуализационного исследования (136 мужчин и 104 женщины в возрасте 62,6±9,9 года). Начиная с первых суток ИИ больные получали по 1 мл (0,1 мг) Целлекса подкожно на протяжении 10 суток. Обследование включило комплекс формализованных тестов для оценки двигательных и сенсорных функций, речи, когнитивного статуса пациентов. Контрольную группу составили 240 больных острым ИИ, сопоставимых по возрасту, половому составу, исходной тяжести состояния. Все больные получали стандартизованную базисную терапию, включившую антиагреганты, антигипертензивные препараты, коронаролитики, препараты для улучшения состояния мозгового кровообращения. Кроме того, все больные получали немедикаментозное лечение, включая лечебную гимнастику, массаж, логопедические занятия. Исключался одновременный наряду с Целлексом прием препаратов нейротрофического и нейропротективного действий.
При оценке состояния наблюдавшихся больных по шкале тяжести инсульта Национальных институтов здоровья США (NIHSS – National Institutes of Health Stroke Scale) оказалось, что к 21-м суткам имело значительное улучшение в виде уменьшения средних значений как в основной, так и в контрольной группах (3,02±0,21 и 3,72±0,23 балла соответственно), отличия носили достоверный характер по сравнению с исходным уровнем (p<0,05). Более выраженная положительная динамика имела место в основной группе, различия на 21-е сутки носили достоверный характер и составили порядка 10,6%. При анализе динамики выраженности неврологического дефицита в зависимости от сроков начала лечения оказалось, что раннее начало введения Целлекса (в первые 12 часов от дебюта ИИ) сопровождалось трехкратным уменьшением значений по HINSS, при этом значения на 21-е сутки составили 3,03±0,31 и 4,51±0,42 балла соответственно (p<0,001), т.е. раннее начало лечения было ассоциировано со значительно более высокой эффективностью терапии (28%) по сравнению с контролем. Выраженность эффекта существенно не зависела от локализации очага поражения в каротидных или вертебрально-базилярной системах.
Сходная ситуация наблюдалась и при сравнении эффективности лечения в зависимости от исходной тяжести больных. Для пациентов с тяжелым ИИ (исходные значения по NIHSS – 18,35±2,54 балла) применение Целлекса сопровождалось более выраженной положительной динамикой по сравнению с контролем (7,81±2,23 и 12,47±2,49 балла соответственно; p<0,001), т.е. различия между группами к окончанию периода исследования превышали 35%. Наиболее выраженный положительный эффект наблюдался в отношении двигательных и речевых нарушений, относительно умеренный – в отношении сенсорных расстройств.
Выраженная положительная динамика в результате применения Целлекса была зарегистрирована и в отношении когнитивных функций. При оценке состояния пациентов без речевых нарушений по набору тестов «информация–концентрация внимания–память» оказалось, что улучшение на 21-е сутки по сравнению с исходным уровнем в основной группе составило 24,6%, в контрольной – только 14,8% (p<0,01). Еще более выраженная динамика была зарегистрирована при тестировании больных по Монреальской шкале когнитивных функций (МоСа – The Montreal Cognitive Assessment). При обследовании на 21-е сутки значения в основной и контрольной группах составили 26,99±1,3 и 25,69±0,51 балла (p<0,05). Эти результаты были подтверждены обследованием по Краткой шкале оценки психических функций (MMSE – Mini Mental State Examination). На 21-е сутки значения тестирования составили 26,38±0,81 и 28,01±0,49 балла (p<0,01).
При раздельной оценке влияния применения Целлекса на различные когнитивные функции не было выявлено существенных различий в отношении состояния памяти, пространственного гнозиса, праксиса. Также не было отмечено различий в эффективности терапии в зависимости от локализации очага ИИ – положительный эффект имел место у пациентов как с каротидными, так и с вертебрально-базилярными ИИ.
При применении Целлекса значимых побочных эффектов отмечено не было. Препарат хорошо переносился, отсутствовали как локальные, так и генерализованные существенные побочные эффекты. У отдельных пациентов имела место локальная гиперемия в области введения препарата, которая не потребовала прекращения лечения или изменения его режима. Целлекс не следует применять пациентам с эпилепсией, маниакальным психозом, продуктивным бредом, делирием.
Таким образом, результаты серии клинических наблюдений, а также законченного рандомизированного двойного слепого плацебо-контролируемого исследования применения Целлекса больными острым ИИ продемонстрировали его эффективность, которая заключалась в более полном восстановлении неврологических функций, нарушенных вследствие ИИ. Более выраженный эффект имел место при раннем применении препарата и у больных с исходно более выраженной тяжестью заболеваний. Подтверждены хорошая переносимость препарата, отсутствие на фоне его применения значимых побочных эффектов. Целлекс может применяться пациентами с острым ИИ начиная с первых часов заболевания наряду с другими лекарственными препаратами и немедикаментозным лечением.
С учетом данных о том, что на фоне применения Целлекса имела место выраженная положительная динамика со стороны когнитивных функций, несомненный интерес представляет изучение возможности его применения пациентами с различными формами деменции. Другим возможным направлением изучения клинической эффективности Целлекса является оценка эффективности его применения пациентами с травматическим поражением головного мозга, сопровождающимся моторными и когнитивными нарушениями. Результаты последующих исследований позволят более точно определить спектр заболеваний центральной нервной системы, при лечении которых препарат окажется эффективным, уточнить оптимальные дозировки и кратность повторных курсов введения препарата, установить комбинации лекарственных препаратов, оказывающих максимально выраженный положительный эффект.
Целлекс р-р п/к введ 0 ,1 мг/мл 1 мл амп N 5
Действующее вещество:
Полипептиды из головного мозга эмбрионов свиней
АТХ
N06BX Психостимуляторы и ноотропные препараты другие
Фармакологические группы
- Ноотропные средства, прочие средства, влияющие на нервную систему [Ноотропы]
- Ноотропные средства, прочие средства, влияющие на нервную систему [Другие нейротропные средства]
Состав
| Раствор для подкожного введения | 1 мл |
| активное вещество: | |
| Целлекс® субстанция-раствор (замороженный в пересчете на белок1) | 0,1 мг |
| вспомогательные вещества: глицин — 3,75 мг; натрия гидрофосфата дигидрат — 2,99 мг; натрия дигидрофосфата моногидрат — 0,47 мг; натрия хлорид — 5,85 мг; вода для инъекций — до 1 мл | |
| 1 состав на 1 мл: активное вещество — полипептиды из головного мозга эмбрионов свиней, в пересчете на общий белок — 0,9–2,4 мг (номинальное содержание общего белка — 1,65 мг на 1 мл субстанции); вспомогательные вещества — глицин — 3,75 мг, 0,1М раствор динатрия гидрофосфата — до рН 7,8 (около 0,8 мг сухого вещества), натрия хлорид — 5,85 мг, полисорбат 80 — 0,005 мг, вода очищенная — до 1 мл |
Описание лекарственной формы
Раствор: прозрачная бесцветная или светло-желтая жидкость, без запаха или со специфическим запахом. Допускается опалесценция. Допускается наличие отдельных нитей коагулята.
Фармакологическое действие
Фармакологическое действие — нейропротективное.
Фармакодинамика
Наличие тканеспецифических сигнальных белков и полипептидов — факторов роста, дифференцировки нервных клеток в препарате — обусловливает его прямое нейрорепаративное действие за счет регуляции концентраций пула нейротрансмиттеров с торможением спиловера возбуждающих аминокислот.
Препарат активирует вторичную нейропротекцию за счет стимуляции процессов синаптогенеза, восстановления сигналов аутофагии, улучшения тканевой иммунорегуляции с торможением иммуногенной цитотоксичности макрофагов. При этом отмечается тканеспецифическое и системное репаративное действие препарата с восстановлением регенеративного и репаративного потенциала клеток мозга, уменьшением числа поврежденных клеток и выраженности перифокального отека в зоне пенумбры (позволяет добиться значительного ограничения очага некроза мозговой ткани) с восстановлением микроциркуляции и общей перфузии.
Восстановление и регуляторная стимуляция различных компартментов ЦНС с системным воздействием факторов роста, дифференцировки и сигнальных молекул обеспечивает снижение сроков восстановления и реабилитации пациентов с повреждениями ЦНС и периферической нервной системы сосудистого генеза и восстановление двигательной, чувствительной и когнитивной функций. Терапевтический эффект обычно развивается через 3–5 дней после начала введения препарата.
Фармакокинетика
Сложный состав препарата Целлекс®, активная фракция которого состоит из сбалансированной и стабильной смеси биологически активных белков и полипептидов, обладающих суммарным полифункциональным действием, не позволяет провести обычный фармакокинетический анализ отдельных компонентов.
Показания препарата Целлекс®
Цереброваскулярные болезни — острые нарушения мозгового кровообращения в остром и раннем реабилитационном периоде течения заболевания, в составе комплексной терапии.
Противопоказания
эпилепсия;
маниакальный психоз;
продуктивный бред;
делирий;
возраст до 18 лет (в связи с недостаточностью клинических данных).
С осторожностью: аллергические реакции на препараты белково-пептидной природы в анамнезе.
Применение при беременности и кормлении грудью
Отсутствие соответствующих исследований не позволяет применять препарат у данного контингента больных.
Побочные действия
Могут отмечаться аллергические реакции в виде невыраженной гиперемии в месте введения, реакции гиперчувствительности (кожная сыпь, зуд, ангионевротический отек), субфебрилитет, нарушение сна, головная боль.
Взаимодействие
При совместном применении с психостимулирующими препаратами и алкоголем возможно психомоторное возбуждение, нарушения сна.
Возможно уменьшение активности средств для наркоза, транквилизаторов, нейролептиков.
Способ применения и дозы
П/к.
Взрослые: 0,1–0,2 мг 1 раз в сутки п/к в течение 10 дней, в зависимости от тяжести состояния больного. При необходимости проводят повторный курс через 10 дней. Исследования по применению препарата в детской практике не проводились.
Правила введения раствора
Препарат вводится п/к через стерильный шприцевый фильтр, входящий в комплект.
Для введения набирают необходимое количество препарата Целлекс® в шприц, снимают иглу, затем надевают на шприц стерильный шприцевый фильтр с диаметром пор 0,22 мкм. Берут новую иглу и надевают ее на стерильный шприцевый фильтр. Препарат готов к применению.
Передозировка
В настоящее время случаи передозировки препарата Целлекс® не отмечены.
Особые указания
С особой осторожностью назначается при артериальной гипертензии злокачественного течения в стадии декомпенсации, симпатоадреналовых кризах по типу панических атак, выраженных тревожно-депрессивных расстройствах.
При беременности действие препарата не изучено.
Препарат не содержит прионовые инфекции и вирусы.
Влияние на способность управлять транспортными средствами и работать с механизмами. В настоящее время не имеется данных о влиянии препарата Целлекс® на способность к управлению автомобилем и работу с механизмами, требующими повышенного внимания и скорости психических и двигательных реакций.
Форма выпуска
Раствор для подкожного введения, 0,1 мг/мл. В ампулах темного стекла вместимостью 1 или 2 мл импортных, имеющих кольцо натяжения для вскрытия, или ампулах, имеющих точку разлома, 1 или 2 мл. Допускается цветовая маркировка ампул в виде двух зеленых полосок. 1, 2, 5 амп. по 1 или 2 мл в контурной ячейковой упаковке из пленки ПВХ. 1 или 2 контурные ячейковые упаковки в пачке картонной. В каждой пачке стерильные шприцевые фильтры с диаметром пор 0,22 мкм в количестве, равном количеству ампул.
Условия отпуска из аптек
По рецепту.